GIST - Dr. Falk Pharma GmbH
Werbung
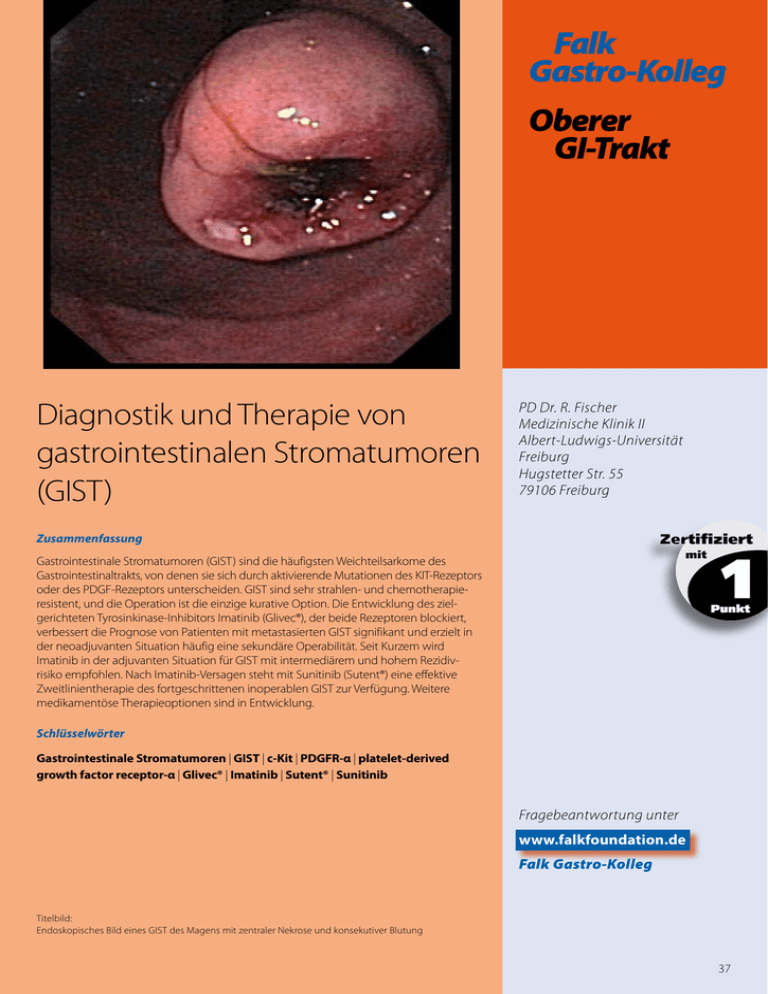
Falk Gastro-Kolleg Oberer GI-Trakt PD Dr. R. Fischer Diagnostik und Therapie von Medizinische Klinik II Albert-Ludwigs-Universität gastrointestinalen Stromatumoren Freiburg Str. 55 B CHugstetter 79106 Freiburg (GIST) Zusammenfassung Gastrointestinale Stromatumoren (GIST) sind die häufigsten Weichteilsarkome des Gastrointestinaltrakts, von denen sie sich durch aktivierende Mutationen des KIT-Rezeptors oder des PDGF-Rezeptors unterscheiden. GIST sind sehr strahlen- und chemotherapie­ resistent, und die Operation ist die einzige kurative Option. Die Entwicklung des ziel­ gerichteten Tyrosinkinase-Inhibitors Imatinib (Glivec®), der beide Rezeptoren blockiert, verbessert die Prognose von Patienten mit metastasierten GIST signifikant und erzielt in der neoadjuvanten Situation häufig eine sekundäre Operabilität. Seit Kurzem wird Imatinib in der adjuvanten Situation für GIST mit intermediärem und hohem Rezidivrisiko empfohlen. Nach Imatinib-Versagen steht mit Sunitinib (Sutent®) eine effektive Zweitlinien­therapie des fortgeschrittenen inoperablen GIST zur Verfügung. Weitere medikamentöse Therapieoptionen sind in Entwicklung. Schlüsselwörter Gastrointestinale Stromatumoren | GIST | c-Kit | PDGFR-α | platelet-derived growth factor receptor-α | Glivec® | Imatinib | Sutent® | Sunitinib Fragebeantwortung unter www.falkfoundation.de Falk Gastro-Kolleg Titelbild: Endoskopisches Bild eines GIST des Magens mit zentraler Nekrose und konsekutiver Blutung 37 Diagnostik und Therapie von gastrointestinalen Stromatumoren (GIST) 1. Historie und Definition von GIST Gastrointestinale Stromatumoren (GIST) wurden in der früheren Literatur den Leiomyomen, Leiomyoblastomen und Leiomyosarkomen zugeordnet. Elektronenmikroskopische Untersuchungen in den 60er-Jahren zeigten jedoch, dass typische Merkmale von glatten Muskelzellen in GIST häufig fehlten, wohingegen Strukturen, ähnlich ­denen von autonomen Nerven, zunehmend beschrieben wurden. Die immunhistochemischen Methoden in den frühen 80er-Jahren belegten eine eher neuroektodermale Differenzierung, und mit der Entdeckung der regelmäßigen Expression des Stammzellmarkers und Wachstumsrezeptors CD117 (c-Kit) 1998 konnte die Entität „GIST“ definiert werden. Weitere Arbeiten zeigten eine „gain-of-function“-Mutation im c-Kit-Gen bei etwa 90% der Patienten, welche zu einer Daueraktivierung des Rezeptors c-Kit führt. In etwa 70% der Fälle ist das Exon 11, in etwa 15% das Exon 9 betroffen, seltener Exon 13 und 17. Etwa 5% der GIST weisen keine aktivierende Mutation im c-Kit-Gen auf („Wildtyp-Gen“) und sind immunhistochemisch c-Kit-negativ; diese GIST haben in der Regel Mutationen des Wachstumsrezeptors PDGFR-α (platelet-derived growth factor receptor-α) im Exon 18 (selten Exon 12 oder 14) und sind in der Regel im Magen lokalisiert. P GIST weisen fast immer eine Aktivierung des Wachstumsrezeptors c-Kit auf. 2. Epidemiologie von GIST Während nur etwa 5% aller Sarkome GIST entsprechen, stellen GIST ca. 80% aller mesenchymalen Tumoren des Gastrointestinaltrakts dar. Die jährliche Inzidenz von GIST in Europa wird auf etwa 15/1 Mio. Einwohner geschätzt, mit einer Prävalenz von etwa 129/1 Mio. Einwohner. Eine objektive Zunahme der Erkrankungsinzidenz wird nicht beschrieben. Somit ist für Deutschland von ca. 1200 Neuerkrankungen/Jahr auszugehen. Das Erkrankungsalter ist typischerweise zwischen dem 55. und 65. Lebensjahr, extrem selten sind GIST bei Kindern. GIST sind fast immer sporadisch, und familiäre GIST-Syndrome (z. B. Neurofibromatose) selten. GIST können ubiquitär im Gastrointestinaltrakt einschließlich Harnblase und Mesenterium auftreten, jedoch sind die häufigsten Lokalisationen im Magen (60%), Dünndarm (25%), Dickdarm (10%) und Ösophagus (5%) zu finden. Magen-GIST haben eine signifikant bessere Prognose als extragastrische GIST. In der Regel wachsen GIST verdrängend und nicht lokal infiltrierend, jedoch liegt eine primäre Metastasierung in 15–47% der Fälle vor. Lymphknotenmetastasen sind selten, hingegen werden vor allem Lebermetastasen und Peritonealmetastasen beschrieben. Im Gegensatz zu anderen Sarkomen werden Lungenund Knochenmetastasen erst spät und selten im Erkrankungsverlauf manifest. Hirnmetastasen sind eine Rarität. P GIST sind seltene mesenchymale Sarkome des Gastrointestinaltrakts, die am häufigsten im Magen vor­kommen. Metastasen sind oft hepatisch oder peritoneal, selten lymphatisch oder pulmonal. Risikofaktoren sind nicht bekannt, weshalb weder Früherkennungsuntersuchungen noch vorbeugende Maßnahmen beschrieben sind. 3. Klinik Etwa ein Drittel aller GIST werden zufällig im Rahmen von Endoskopien, radiologischen Untersuchungen oder Operationen entdeckt. Die meisten GIST verursachen unspezifische abdominelle Beschwerden, Stuhlunregelmäßigkeiten und nicht selten (10–25%) gastrointestinale Blutungen. Fortgeschrittene Erkrankungen werden durch tastbare Tumoren und Allgemeinsymptome wie Müdigkeit, Appetitlosigkeit, Übelkeit und Anämie symptomatisch. P GIST sind oft asymptomatisch und werden daher häufig erst im Spätstadium diagnostiziert. 38 4. Diagnose Endoskopie und bildgebende Verfahren Die Diagnose wird histologisch gestellt, und die wichtigste nicht-invasive Methode zur Histologiegewinnung ist die endoskopische Untersuchung, verbunden mit der Endosonografie. Endoskopisch ist typischerweise eine submuköse Raumforderung darstellbar, häufig mit zentraler Einziehung und Ulzeration bei ansonsten unauffälliger Schleimhaut, die oft Ursache von Blutungen ist (Titelbild, Abb. 1). AAA BBB P Die Diagnose von GIST wird histologisch gestellt. Endoskopisch ist eine submuköse Raumforderung mit zentraler Nekrose typisch. Abb. 1 CCC Endoskopisches Bild eines GIST des Magens mit zentraler Nekrose (A) und GIST des Jejunums (B) mit dazugehöriger Röntgendurchleuchtung (C) © Dr. Schwacha, Universitätsklinik Freiburg Die Endosonografie zeigt häufig einen aus der 2. oder 4. echoarmen Schicht (Lamina muscularis mucosae bzw. muscularis propria) hervorgehenden Tumor bei erhaltener Wandschichtung mit guter Abgrenzbarkeit zu umliegenden Geweben und, im Gegensatz zu Karzinomen, selten infiltrativem Wachstum (Abb. 2). Abb. 2 P GIST wachsen nicht infiltrierend; submuköse Raumforderungen des Ösophagus < 2 cm können endo­ skopisch kontrolliert werden. Endosonografisches Bild eines GIST des Ösophagus, ausgehend von der Muscularis propria, ohne Infiltra­ tion oder Aufhebung der Wandschichtung © PD Dr. Spangenberg, Prof. Dr. Thimme, Universitätsklinik Freiburg Im Ösophagus sind mesenchymale Tumoren (submuköse Raumforderungen) in der Regel Leiomyome und nur selten GIST. Bei GIST < 2 cm ist eine erfolgreiche Biopsieentnahme endoskopisch häufig schwierig, und oft kann nur mittels Laparoskopie/ Laparotomie eine aussagekräftige Probe gewonnen werden. Viele dieser kleinen Tumoren sind jedoch „low-risk“-GIST oder andere nicht-maligne Entitäten (v. a. im Ösophagus), weshalb bei submukösen Raumforderungen < 2 cm engmaschige endoskopisch-endosonografische Verlaufskontrollen den Standard gemäß ESMO-Leitlinien (2008) darstellen. Eine Ausnahme hiervon stellen rektale Tumoren dar, deren zugrunde liegende Genese aufgrund höherer Aggressivität und chirurgischer Problematik diagnostiziert werden sollte. Bei endoskopisch nicht erreichbaren, z. B. peritonealen Raumforderungen ist die perkutane/endosonografische Nadelbiopsie indiziert. Zum Staging wird zusätzlich eine Schnittbildgebung empfohlen, hierfür eignet sich sowohl das Kontrastmittel-CT als auch -MRT. Ein GIST zeigt typischerweise eine definierte vaskularisierte Raumforderung, ggf. mit zentraler Nekrose oder Einblutung. Mittels FDG39 Positronenemissionstomografie (PET) lässt sich der Glukosemetabolismus von Ge­ weben darstellen. GIST sind im FDG-PET in der Regel stark positiv, weshalb sich das FDG-PET gut zur Erfolgskontrolle medikamentöser Therapien eignet. P GIST sind im FDG-PET positiv. Labordiagnostik und Histologie GIST werden histologisch in den Spindelzelltyp (70%), Epitheloidzelltyp (20%) oder gemischtzelligen Typ (10%) eingeteilt, wobei kein Zusammenhang zu c-Kit-Mutationen oder Therapieansprechen und Prognose bekannt ist. C-Kit ist in 95% der Fälle positiv (Abb. 3), CD34 in 60–70% und SMA (smooth muscle actin) in 30–40%. Abb. 3 B A P Wesentlich für die Malignitätsbeur­ teilung von GIST ist der Mitose-Index. Immunhistochemie eines GIST mit c-Kit (CD117), Epitheloidzelltyp (A); HE-Färbung eines GIST vom Spindelzelltyp (B) © Prof. Dr. Schmitt-Gräff, Universitätsklinik Freiburg Wesentlich für die Malignitätsbeurteilung ist neben der Tumorgröße der sog. Mitotische Index, der die Anzahl von Mitosen auf 50 HPF (high power fields) angibt. Die Mutationsanalyse von c-Kit und PDGFR-α wird empfohlen, da diese häufig von prognostischer und therapeutischer Relevanz ist. Klassifikation von GIST und Prognose Zur Beurteilung der Aggressivität werden GIST nach Größe, Mitotischem Index und Lokalisation in Risikogruppen von „sehr niedrig“ bis „hoch“ unterschieden (Tab. 1). Tab. 1 Risikostratifizierung von GIST Tumoreigenschaften Progressionsrisiko Mitotischer Index Tumorgröße (cm) Magen Dünndarm/andere Lokalisation < 5 auf 50 HPF ≤2 sehr niedrig sehr niedrig >2≤5 sehr niedrig niedrig > 5 ≤ 10 niedrig intermediär > 10 intermediär hoch ≤2 sehr niedrig intermediär >2≤5 intermediär hoch > 5 ≤ 10 hoch hoch > 10 hoch hoch ≥ 5 auf 50 HPF P GIST werden je nach Größe, Mitotischem Index und Lokalisation in unterschiedliche Malignitätsgruppen unterteilt. WHO 2002, modifiziert nach Hornick/Fletcher 2007 40 Während Tumoren mit „sehr niedrigem“ Progressionsrisiko praktisch nicht metastasieren und nach Tumorresektion nicht rezidivieren, ist bei Tumoren mit „hohem“ Progressionsrisiko eine Heilung durch alleinige Operation unwahrscheinlich. Im Durchschnitt liegt trotz kompletter (R0) Resektion das 5-Jahres-Überleben bei etwa 45%, bei etwa einem Drittel kommt es zu Lokalrezidiven, bei etwa 50% zu Fernmetastasen, meistens innerhalb der ersten 12 Monate postoperativ. Aktuelle Studien zeigen, dass der c-KitMutationsstatus gleichfalls prognostische Relevanz aufweist. Während Exon-11-Mutationen eine günstige Prognose aufweisen, sind Mutationen im Exon 9 oder bestimmte Deletionen im Exon 11 mit einer schlechteren Prognose vergesellschaftet. Das durchschnittliche Überleben von nicht therapierten Patienten mit rezidivierten oder metastasierten GIST liegt bei 6–20 Monaten. 5. Stadiengerechte Therapie gastrointestinaler Stromatumoren Lokalisierte Erkrankung Die einzige kurative Therapie von GIST ist die vollständige operative Resektion (R0) mit 2 cm Sicherheitsabstand ohne Verletzungen des Tumors. In seltenen Fällen, mit niedrigmalignen GIST, kann auch eine R1-Resektion sinnvoll sein. Bei kleinen GIST des ­Magens wird eine Wedge-Resektion empfohlen, während Segmentresektionen für ­lokalisierte intestinale GIST empfohlen werden. Aufgrund der sehr seltenen Lymphknotenmetastasierung wird generell auf eine Lymphadenektomie verzichtet. Ist eine primäre Operation nicht möglich, so ist eine neoadjuvante Therapie mit Imatinib ­indiziert. Ob auch primär operable Patienten von einer neoadjuvanten Therapie mit Imatinib profitieren, wird in aktuellen Studien geprüft. Zwar liegen die Ansprechraten der neoadjuvanten Imatinib-Therapie bei 80–90%, jedoch sollte aufgrund der unterschiedlichen Tumorresponse in Abhängigkeit vom c-Kit-Mutationsstatus, dieser vorher bestimmt werden. Die optimale Dauer der neoadjuvanten Therapie sollte etwa 6–12 Monate mit 400–800 mg Imatinib/Tag betragen, wobei sich die Dosierung und die Therapiedauer nach dem c-Kit-Mutationsstatus und der operativer Notwendigkeit richten sollten. Um möglichst frühzeitig Non-Responder identifizieren zu können, kann bereits ab 1 Monat nach Therapiebeginn eine FDG-PET-Untersuchung durchgeführt werden, die mit hoher Wahrscheinlichkeit ein Tumoransprechen vorhersagen kann. P Die Operation ist das einzige kurative Verfahren bei GIST. Inoperable GIST sollten mit Imatinib neoadjuvant behandelt werden. Trotz kompletter Resektion liegt das krankheitsfreie 5-Jahres-Überleben nur bei etwa 40–60%; das Risiko eines Rezidivs lässt sich nach der Tumorklassifikation (Tab. 1) abschätzen. Mehrere Studien bestätigen einen deutlichen Vorteil einer adjuvanten Therapie von GIST mit Imatinib (400 mg/Tag) über 12 Monate mit rückfallfreien 1-JahresÜberlebensraten von 97% vs. 83% in der Kontrollgruppe. Daher ist die Zulassung von Imatinib zur adjuvanten Therapie in Europa von der EMEA (European Medicines Agency) im März 2009 befürwortet worden. Die optimale Zeitdauer der adjuvanten Therapie wird in aktuellen Studien untersucht. Empfohlen wird die Therapie für intermediäre und Hochrisiko-GIST. P Intermediäre und Hochrisiko-GIST sollten 12 Monate adjuvant mit Imatinib behandelt werden. Fortgeschrittene Erkrankung GIST sind nicht sensibel auf Strahlen- oder Chemotherapie mit den klassischen Zytostatika, die zur Behandlung von Sarkomen eingesetzt werden. Bis vor wenigen Jahren waren nur operative Optionen verfügbar. Imatinib (Glivec®) ist ein Tyrosinkinase-Inhibitor, der die Rezeptor-Tyrosinkinasen c-Kit, PDGFR-α, Abl und Bcr-Abl kompetitiv hemmt und somit eine Wachstumsinhibition sowie Apoptoseinduktion in Tumor­ zellen mit entsprechender Überaktivierung bewirkt. Zugelassen ist Imatinib zur Erst­ linientherapie von GIST und der chronischen myeloischen Leukämie. In einer Dosierung von 400 mg/Tag führt Imatinib bei ca. 80% der Patienten zur Tumorstabilisierung und bei ca. 45% der Patienten zu einer messbaren Tumorregredienz. Das 2-JahresÜberleben unter Therapie beträgt ca. 75–80%; das Gesamtüberleben steht in vielen ­Studien noch aus und liegt in der Größenordnung von 3,5–5 Jahren (vs. 6–20 Monaten ohne Therapie). Das Ansprechen von GIST hängt dabei von der c-Kit-Mutation ab; während Patienten mit Exon-11-Mutationen eine objektive Ansprechrate von 84% P Definitiv inoperable GIST werden bis zur Progression mit Imatinib behandelt. Bei Tumorprogression wird die Dosis von Imatinib von 400 mg/Tag auf 800 mg/Tag erhöht. 41 P GIST mit einer c-Kit-Mutation im Exon 9 werden mit 800 mg Imatinib pro Tag behandelt. aufweisen, ist bei Patienten ohne c-Kit-Mutation keine objektive Tumorregredienz zu erwarten (wohl aber eine Tumorstabilisierung). Patienten mit Exon-9-Mutation haben eine etwa 45%ige Tumoransprechrate; eine Dosissteigerung von Imatinib auf 800 mg/ Tag führt bei dieser Mutation zu einer deutlich verbesserten Tumorkontrolle. Inoperable GIST sollten daher bis zur Tumorprogression eine Therapie mit Imatinib (400 mg/ Tag; bei bekannter Exon-9-Mutation 800 mg/Tag) erhalten. Die Therapie sollte kontinuierlich ohne Unterbrechung durchgeführt werden. Bei Tumorprogression sollte primär eine Dosiseskalation von Imatinib auf 800 mg/Tag durchgeführt werden. Wenn nur einzelne, lokalisierte Tumormanifestationen progredient sind, sollten diese nach Möglichkeit operiert und die Imatinib-Therapie fortgesetzt werden. Im Allgemeinen wird Imatinib gut vertragen, und die meisten Nebenwirkungen ­nehmen mit der Behandlungsdauer ab. Typische Nebenwirkungen sind Flüssigkeitsretention mit peripheren Ödemen/Augenlidödemen (74%), welche auf Diuretikagabe meist gut ansprechen, Diarrhö (44%) und Übelkeit (52%) sowie Asthenie, Myalgien (39%) und Unterleibsschmerzen. Transient auftretende Hautausschläge sind mit Antihistaminika und Steroiden gut behandelbar. Leuko- oder Thrombopenien sind bei Therapiepausierung rasch reversibel, können jedoch zu Dosisreduktionen zwingen. Eine Besonderheit bei der Verlaufskontrolle von GIST mit CT/MRT-morphologischer Bildgebung ist die bei Therapieansprechen häufige zystische Umwandlung (Nekrose) des Tumors, welche initial zu keiner objektiven Tumorverkleinerung nach RECIST­Kriterien führt, sondern zu einer veränderten Gewebedichte (Abb. 4). Abb. 4 A B C Kontrastmittel-CT eines GIST des Magens (A), 6 Monate nach Therapie mit Imatinib (400 mg/Tag) mit deutlichen liquiden Anteilen durch therapie­ bedingte Tumornekrose (B); maximales Tumor­ansprechen nach 12 Monaten Imatinib-Therapie (C) © Prof. Dr. Langer, PD Dr. Lohrmann, Universitätsklinik Freiburg Verlaufskontrollen alle 3–6 Monate sind daher ausreichend. Eine Messung der Tumoraktivität im FDG-PET ist wahrscheinlich deutlich sensitiver als das CT, stellt jedoch ­keinen Standard dar. Bei Imatinib-Unverträglichkeit oder Tumorprogress unter 800 mg Imatinib pro Tag sollte als zugelassene Zweitlinientherapie Sunitinib (Sutent®) eingesetzt werden. Sunitinib ist ein Multi-Tyrosinkinase-Inhibitor, der über eine Hemmung der Wachstums­ rezeptoren PDGFR-α und -β, VEGF-R1 und -R2, FLT3 und c-Kit antiproliferativ und antiangiogen wirkt. Sunitinib (37,5 mg) wird kontinuierlich 4-wöchentlich im Wechsel mit 2-wöchentlicher Pause verabreicht; wahrscheinlich ist eine kontinuierliche Therapie mit 25 mg/Tag genauso wirksam und besser verträglich. Nach Imatinib-Versagen führt Sunitinib zu einer Tumorkontrolle bei bis zu 65% der Patienten und zu einer etwa verdoppelten Überlebenszeit (74 vs. 36 Wochen). Ähnlich wie beim Imatinib hängt die Wirksamkeit von Sunitinib vom c-Kit-Mutationsstatus ab; bei Patienten mit Exon-9Mutation und c-Kit-Wildtyp sowie Mutationen des PDGFR-α ist die Wirksamkeit in der Zweitlinientherapie besonders hoch. P Bei Imatinib-Versagen oder -Unverträglichkeit ist Sunitinib zur Therapie von GIST zugelassen. 42 Das Nebenwirkungsprofil von Sunitinib umfasst häufig eine Mukositis mit Bildung von ­enoralen Aphthen, Asthenie und Nausea, teilweise Diarrhö, Unterleibsschmerzen und Hand-Fuß-Syndrom. Typisch für die antiangiogene Wirkung ist das häufige Auftreten einer arteriellen Hypertonie. Die hämatologischen Nebenwirkungen (Anämie und Neutropenie) sind ausgeprägter als bei Imatinib. In kleineren Phase-II-Studien wurde die Wirksamkeit von Dasatinib und Nilotinib sowie von Sorafenib (Nexavar®) und dem Chaperon-Inhibitor IPI-504 gezeigt; aktuell ­fehlen zu diesen Substanzen aber noch randomisierte Phase-III-Studien. Zusammenfassend hat die Identifizierung von GIST als eigenständige Tumorentität den Einsatz von zielgerichteten Medikamenten erlaubt, die zu einer deutlichen Prognoseverbesserung geführt haben. Eine weitere Verbesserung der aktuellen Therapieerfolge mit zusätzlichen Wirksubstanzen ist zu erwarten. Zu empfehlende Literatur Literatur 1 Casali PG, Jost L, Reichardt P, Schlemmer M, Blay JY; ESMO Guidelines Working Group. Gastrointestinal stromal tumors: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2008; 19: ii35–ii38. 2 Heger U, Weitz J, Lordick F. Indikationen zur prä- und postoperativen Therapie mit Imatinib bei gastrointestinalen Stromatumoren. Chirurg 2008; 79: 630–637. 3 Jiang Y, Ming L, Montero AJ, Kimchi E, Nikfarjam M, Staveley-O’Carroll KF. Optimizing imatinib mesylate treatment in gastrointestinal stromal tumors. Gastrointest Cancer Res 2008; 2: 245–250. 4 Judson IR. Prognosis, imatinib dose, and benefit of sunitinib in GIST: knowing the genotype. J Clin Oncol 2008; 26: 5322–5325. 5 Steigen SE, Eide TJ. Gastrointestinal stromal tumors (GISTs): a review. APMIS 2009; 117: 73–86. 6 Dematteo RP, Ballman KV, Antonescu CR, Maki RG, Pisters PW, Demetri GD, Blackstein ME, Blanke CD, von Mehren M, Brennan MF, Patel S, McCarter MD, Polikoff JA, Tan BR, Owzar K; American College of Surgeons Oncology Group (ACOSOG) Intergroup Adjuvant GIST Study Team. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet 2009; 28: 1097–1104. 43 Fragen zur Diagnostik und Therapie gastrointestinaler Stromatumoren (GIST) Falk Gastro-Kolleg Oberer GI-Trakt Frage 1: Welche Antwort ist richtig? w w w w w IST sind semimaligne Tumoren ohne Metastasierung G GIST sind maligne Tumoren, welche strahlensensibel sind GIST sind maligne Tumoren, welche chemotherapiesensibel sind GIST sind sowohl strahlen- als auch chemotherapiesensibel GIST sind maligne Tumoren, welche auf eine Therapie mit Tyrosinkinase-Inhibitoren gut ansprechen Frage 2: Welche Antwort ist richtig? w E ine erfolgreiche Behandlung von GIST mit Imatinib lässt sich mittels RECISTKriterien rasch im CT oder MRT nachweisen w Häufig führt eine Therapie von GIST mit Imatinib zu einer Tumornekrose, ohne dass sich die Tumorgröße (ausgemessen nach RECIST-Kriterien) signifikant verändert w GIST sind im FDG-PET häufig negativ w GIST zeigen in der Kontrastmittel-Sonografie ein pathognomonisches Gefäßmuster w GIST sind mittels Endosonografie von anderen submukösen Tumoren eindeutig unterscheidbar Bitte beachten Sie: Bei der Beantwortung der Fragen ist immer nur 1 Antwort möglich. Die Beantwortung der Fragen und Erlangung des Fortbildungszertifikats ist nur online möglich. Bitte gehen Sie dazu auf unsere Homepage www.falkfoundation.de. Unter dem Menüpunkt Falk Gastro-Kolleg können Sie sich anmelden und die Fragen beantworten. Bitte diesen Fragebogen nicht per Post oder Fax schicken! Frage 3: Welches ist die empfohlene Therapie des metastasierten GIST bei Imatinib-Versagen? w w w w w S trahlentherapie Chemotherapie Sunitinib (Sutent®) Cetuximab (Erbitux®) Bevacizumab (Avastin®) Frage 4: Welche Aussage trifft nicht zu? w w w w w ie Expression von c-Kit (CD117) ist für die Diagnose eines GIST nicht zwingend D Mutationen von c-Kit bestimmen das Ansprechen auf eine Imatinib-Therapie GIST metastasieren häufig in lokale Lymphknoten Die meisten GIST entstehen in Magen und Duodenum Der Mitotische Index bzw. der Proliferationsindex bestimmen wesentlich die Malignität von GIST Frage 5: Welche Aussage zur medikamentösen Therapie von GIST trifft nicht zu? Wichtig: Fragebeantwortung unter www.falkfoundation.de Falk Gastro-Kolleg w Im Falle eines Progresses unter 400 mg Imatinib pro Tag sollte die Dosis auf 800 mg/Tag erhöht werden w Ist bei mehreren GIST-Metastasen trotz Imatinib-Therapie eine Tumorlokalisation progredient, sollte eine primäre Operation und die Beibehaltung von Imatinib angestrebt werden w Bei allen GIST sollte eine adjuvante Therapie mit Imatinib durchgeführt werden w Bei großen GIST, die schlecht operabel sind, ist eine neoadjuvante Therapie mit Imatinib indiziert w Imatinib kann bei allen GIST unabhängig von der c-Kit-Mutation eingesetzt werden 44 Frage 6: Welche Aussage ist richtig? wDie Bestimmung der c-Kit-Mutation hat keine klinische Konsequenz und sollte daher nicht erfolgen wSunitinib sollte immer in Kombination mit Imatinib bei der Zweitlinientherapie des GIST eingesetzt werden wNilotinib und Sorafenib scheinen keine Wirkung beim GIST zu haben wBei Tumorwachstum trotz Imatinib-Therapie profitieren 30–40% der Patienten von einer Dosiseskalation wPatienten mit einer c-Kit-Genmutation im Exon 9 sprechen besonders gut auf Imatinib an und sollten primär mit 400 mg/Tag behandelt werden Falk Gastro-Kolleg Oberer GI-Trakt Frage 7: Welche Aussage zur adjuvanten Therapie von GIST ist richtig? wDie adjuvante Therapie kann mit Imatinib oder Sunitinib durchgeführt werden wDie Dauer der adjuvanten Therapie mit Imatinib sollte nicht länger als 2–3 Monate betragen wBei einer R0-Resektion eines 5 cm großen GIST des Duodenums mit einem Mitotischen Index > 10/50 HPF ohne Lymphknotenmetastasen ist eine adjuvante Therapie mit Imatinib wenig Erfolg versprechend wDie adjuvante Therapie mit Imatinib sollte für 12 Monate durchgeführt werden wDie adjuvante Therapie mit Imatinib sollte in jedem Fall mit 800 mg/Tag durch­ geführt werden Frage 8: Welche Aussage zur palliativen Therapie von GIST ist richtig? wAnalog zur OPTIMOX-Studie beim kolorektalen Karzinom führen regelmäßige Therapiepausen zu einem erhöhten Gesamtüberleben bei der Imatinib-Therapie von GIST wTypische und therapielimitierende Nebenwirkung von Imatinib ist das Hand-Fuß-Syndrom wDurch Imatinib auftretende periphere Ödeme sind medikamentös leicht behandelbar wDie Kombination von Capecitabin (Xeloda®) und Imatinib erhöht die Ansprech­rate deutlich wImatinib führt nur zu einer Tumorstabilisierung, jedoch nie zu einer in der radiologischen Bildgebung sichtbar messbaren Tumorregression Frage 9: Welche Aussage zur Diagnose von GIST ist nicht richtig? wGIST fallen klinisch häufig durch paraneoplastische Syndrome auf wHäufige Erstsymptome von GIST sind Dysphagie, Obstipation, gastrointestinale Blutungen oder abdominelle Schmerzen wZunehmend werden GIST als Zufallsbefund bei Endoskopien diagnostiziert wGIST werden in der Regel zwischen dem 55. und 65. Lebensjahr diagnostiziert wDie Mehrheit der GIST besitzen eine onkogene Mutation im c-Kit-Gen Frage 10: Welche Aussage zum Verhalten von GIST trifft zu? wBei gleicher Größe und Mitotischem Index sind GIST des Dünndarms mit einem höheren Progressionsrisiko assoziiert als GIST des Magens wBei einem GIST des Magens ist eine D2-Magenresektion onkologisch sinnvoll wFernmetastasen des GIST treten typischerweise in Lunge und Knochen auf wDer Mutationsstatus des c-Kit-Gens bestimmt das Ansprechen auf eine medikamentöse Therapie, jedoch nicht den Spontanverlauf der Erkrankung wEin R0-resezierter GIST mit ungünstigen Merkmalen (Größe und Mitotischer Index) führt häufig zu Lokalrezidiven, weshalb postoperativ eine lokale Nachbestrahlung indiziert ist 45











