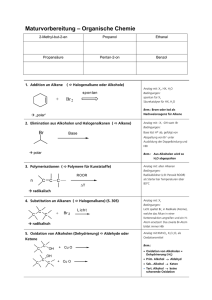
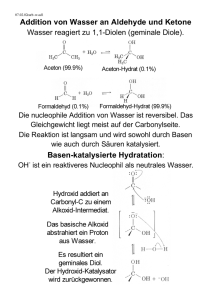
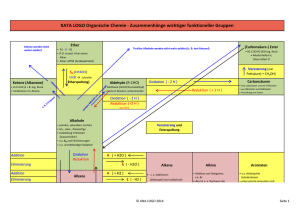
WILEY-VCH
Werbung

Hamid Hart, Leslie E. Craine, David J. Hart Organische Chemie Übersetzt von Nicole Kindler Zweite, vollständig überarbeitete und aktualisierte Auflage WILEY-VCH Inhalt Bildnachweis XIV Vorwort zur zehnten englischen Auflage XV An den Studenten XXV 1 Bindung und Isomerie 1.1 1.2 1.2.1 1.2.2 1.3 1.4 1.5 1.6 1.7 1.8 1.9 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17.1 1.17.2 1.17.3 1.18 Der Aufbau der Atome 1 Ionische und kovalente Bindung 4 Ionische Verbindungen 4 Die kovalente Bindung 7 Kohlenstoff und die kovalente Bindung 8 Kohlenstoff-Kohlenstoff-Einfachbindungen 10 Polare kovalente Bindungen 11 Kovalente Mehrfachbindungen A3 Wertigkeit J6 Isomerie 77 Formulierung von Strukturformeln 18 Vereinfachte Strukturformeln 20 Formale Ladung 22 Mesomerie 24 Pfeile 26 Orbitaltheorie der Bindung: Die a-Bindung 29 s/^-Hybridorbitale des Kohlenstoffatoms 30 Tetraedrischer Kohlenstoff: Bindungsverhältnisse in Methan 32 Klassifizierung der Moleküle nach ihrem Grundgerüst 34 Acyclische Verbindungen 34 Carbocyclische Verbindungen 35 Heterocyclische Verbindungen 36 Klassifizierung nach funktioneilen Gruppen 37 2 Alkane und Cycloalkane 2.1 2.2 2.3 Struktur der Alkane 46 Nomenklatur organischer Verbindungen 48 lUPAC-Regeln für die Benennung von Alkanen 49 1.17 1 45 VI Inhalt 2.4 2.5 2.6 2.7 2.8 2.9 2.10 2.11 2.12 2.12.1 2.12.2 2.13 Alkyl- und Halogensubstituenten 52 Anwendung der IUPAC-Regeln 53 Alkanquellen 55 Physikalische Eigenschaften von Alkanen und nichtbindende intermolekulare Wechselwirkungen 56 Konformation von Alkanen 58 Nomenklatur und Konformation der Cycloalkane 61 Cis-trans Isomerie bei Cycloalkanen 67 Zusammenfassung der Isomerieformen 68 Reaktionen der Alkane 69 Oxidation und Verbrennung: Alkane als Brennstoffe 69 Halogenierung 71 Der Radikalkettenmechanismus der Halogenierung 73 3 Alkene und Alkine 3.1 3.2 3.3 3.4 Definition und Einteilung 84 Nomenklatur 85 Eigenschaften der Doppelbindung 89 Das Orbitalmodell der Doppelbindung; die JT- Bindung 90 Cis-trans-lsomerie bei Alkenen 93 Vergleich von Addition und Substitution 95 Polare Addition 96 Addition von Halogenen 96 Addition von Wasser (Hydratisierung) 97 Addition von Säuren 97 Addition von unsymmetrischen Verbindungen an unsymmetrische Alkene: Die Markownikow-Regel .98 Mechanismus der elektrophilen Addition an Alkene 101 Zur Erläuterung der Markownikow-Regel 103 Das Reaktionsgleichgewicht 105 Reaktionsgeschwindigkeiten 107 Hydroborierung von Alkenen 110 Addition von Wasserstoff 112 Additionen an konjugierte Systeme 113 Elektrophile Additionen an konjugierte Diene 113 Cycloadditionen an konjugierte Diene: Die Diels-Alder-Reaktion 115 Addition freier Radikale; Polyethylene 116 Oxidation von Alkenen 118 Oxidation mit Permanganat als Nachweismethode 118 Ozonolyse von Alkenen 119 Weitere Oxidationen von Alkenen 122 Dreifachbindungen 122 3.5 3.6 3.7 3.7.1 3.7.2 3.7.3 3.8 3.9 3.10 3.11 3.12 3.13 3.14 3.15 3.15.1 3.15.2 3.16 3.17 3.17.1 3.17.2 3.17.3 3.18 83 Inhalt 3.19 3.20 3.21 Das Orbitalmodell der Dreifachbindung 123 Additionen an Alkine 124 Acidität von Alkinen 126 4 Aromatische Verbindungen 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8 4.9 Benzol 138 Die Kekulestruktur von Benzol 140 Das Resonanzmodell von Benzol 141 Das Orbitalmodell von Benzol 142 Symbole für Benzol 143 Nomenklatur aromatischer Verbindungen 144 Die Resonanzenergie von Benzol 147 Elektrophile Substitution 148 Der Mechanismus der elektrophilen aromatischen Substitution 149 Halogenierung 75/ Nitrierung 152 Sulfonierung 152 Alkylierung und Acylierung 153 Ringaktivierende und ringdesaktivierende Substituenten 154 Orf/io/para-dirigierende und mefa-dirigierende Gruppen 155 Orffao/para-dirigierende Gruppen 156 Mera-dirigierende Gruppen 159 Einflüsse von Substituenten auf die Reaktivität 160 Dirigierende Effekte in der Synthese 161 Polycyclische aromatische Kohlenwasserstoffe 162 4.9.1 4.9.2 4.9.3 4.9.4 4.10 4.11 4.11.1 4.11.2 4.11.3 4.12 4.13 137 5 Stereoisomerie 5.1 5.2 5.3 5.4 5.5 5.6 5.7 5.8 Chiralität und Enantiomere 176 Stereozentren; das asymmetrische Kohlenstoffatom 178 Konfiguration und R/S-Konvention 183 Die E/Z-Konvention für c/s-frarcs-Isomere 188 Polarisiertes Licht und optische Aktivität 189 Eigenschaften von Enantiomeren 195 Die Fischer-Projektion 197 Verbindungen rjiit mehr als einem Stereozentrum; Diastereomere 198 meso-Verbindungen; Stereoisomere von Weinsäure 201 Stereochemie: Wiederholung der Definitionen 203 Stereochemie und chemische Reaktionen 205 Racemattrennung 207 5.9 5.10 5.11 5.12 175 VII VIII Inhalt 6 Organische Halogenverbindungen; Substitution und Eliminierung 217 6.1 6.2 6.3 6.4 6.5 6.6 6.7 6.8 6.8.1 6.8.2 6.8.3 6.9 Nucleophile Substitution 218 Beispiele für nucleophile Substitutionen 219 Mechanismen der nucleophilen Substitution 223 Der SN2-Mechanismus 223 Der SN1-Mechanismus 227 SN1- und SN2-Mechanismus im Vergleich 230 Dehydrohalogenierung als Eliminierung; E2- und El-Mechanismus 232 Konkurrenz von Substitution und Eliminierung 234 Tertiäre Halogenide 234 Primäre Halogenide 235 Sekundäre Halogenide 236 Polyhalogenierte aliphatische Verbindungen 237 7 Alkohole, Phenole und Thiole 7.1 7.2 7.3 7.4 Nomenklatur der Alkohole 248 Klassifizierung von Alkoholen 249 Nomenklatur von Phenolen 24.9 Wasserstoffbrückenbindungen in Alkoholen und Phenolen 250 Acidität und Basizität: Ein Überblick 251 Acidität von Alkoholen und Phenolen 254 Basizität von Alkoholen und Phenolen 258 Dehydratisierung von Alkoholen zu Alkenen 258 Reaktion von Alkoholen mit Halogenwasserstoffen 260 Andere Synthesen von Alkylhalogeniden aus Alkoholen 262 Vergleich von Alkoholen und Phenolen 263 Oxidation von Alkoholen zu Aldehyden, Ketonen und Carbonsäuren 264 Alkohole mit mehr als einer Hydroxylgruppe 265 Aromatische Substitution von Phenolen 267 Oxidation von Phenolen 269 Thiole, die Schwefelanaloga von Alkoholen und Phenolen 272 7.5 7.6 7.7 7.8 7.9 7.10 7.11 1'.12 7.13 7.14 7.15 7.16 247 8 Ether und Epoxide 8.1 8.2 8.3 8.4 8.5 8.6 Nomenklatur von Ethern 282 Physikalische Eigenschaften von Ethern 283 Ether als Lösungsmittel 284 Grignard-Reagenzien: Organometallverbindungen 284 Darstellung von Ethern 287 Etherspaltung 289 281 Inhalt 8.7 8.8 8.9 Epoxide (Oxirane) 292 Reaktionen von Epoxiden 294 Cyclische Ether 296 9 Aldehyde und Ketone 9.1 9.2 9.3 9.4 9.5 9.6 9.16 9.17 9.18 9.19 Nomenklatur von Aldehyden und Ketonen 304 Einige weit verbreitete Aldehyde und Ketone 305 Synthese von Aldehyden und Ketonen 308 Aldehyde und Ketone in der Natur 309 Die Carbonylgruppe 310 Nucleophile Addition an Carbonylgruppen: eine Übersicht 312 Addition von Alkoholen: Hemiacetale und Acetale 314 Addition von Wasser; Hydratisierung von Aldehyden und Ketonen 318 Addition von Grignard-Verbindungen und Acetyliden 319 Addition von Cyanwasserstoff; Cyanhydrine 322 Addition von Stickstoffnucleophilen 323 Reduktion von Carbonylverbindungen 325 Oxidation von Carbonylverbindungen 326 Keto-Enol-Tautomerie 327 Acitdität von ri-Wasserstoffatomen; das Enolat-Anion 330 Deuteriumaustausch in Carbonylverbindungen 33/ Die Aldolkondensation 333 Gemischte Aldolkondensation 334 Kommerzielle Synthesen mit Aldolkondensation 335 10 Carbonsäuren und ihre Derivate 10.1 10.2 10.3 10.4 10.5 Nomenklatur von Carbonsäuren 346 Physikalische Eigenschaften von Carbonsäuren 349 Acidität und Säurekonstanten 350 Weshalb sind Carbonsäuren sauer? 352 Einfluss der Struktur auf die Säurestärke; induktiver Effekt 353 Überführung von Carbonsäuren in ihre Salze 355 Darstellung von Carbonsäuren 356 Oxidation von primären Alkoholen und Aldehyden 356 Oxidation von aromatischen Seitenketten 356' Reaktion von Grignard-Verbindungen mit Kohlendioxid 357 Hydrolyse von Cyaniden (Nitrilen) 358 Carbonsäurederivate 359 Ester 360 Darstellung von Estern; Fischer-Veresterung 361 9.7 9.8 9.9 9.10 9.11 9.12 9.13 9.14 9.15 10.6 10.7 10.7.1 10.7.2 10.7.3 10.7.4 10.8 10.9 10.10 303 345 IX Inhalt 10.11 10.12 10.13 10.14 10.15 10.16 10.17 10.18 10.19 10.20 10.21 10.22 Der Mechanismus der säurekatalysierten nucleophilen Acylsubstitution 362 Lactone 364 Verseifung von Estern 365 Ammonolyse von Estern 366 Reaktion von Estern mit Grignard-Verbindungen 366 Reduktion von Estern 367 Die Bedeutung aktivierter Acylgruppen 368 Säurehalogenide 369 Carbonsäureanhydride 371 Amide 375 Zusammenfassung der Carbonsäurederivate 378 Das «-Wasserstoffatom von Estern; Claisen Kondensation 380 11 Amine und verwandte Stickstoffverbindungen 11.1 11.2 11.3 11.9 11.10 11.11 11.12 11.13 Einteilung und Struktur von Aminen 3.92 Nomenklatur von Aminen 393 Physikalische Eigenschaften und zwischenmolekulare Wechselwirkungen von Aminen 3.95 Darstellung von Aminen: Alkylierung von Ammoniak und Aminen 396 Darstellung von Aminen; Reduktion von Nitroverbindungen 398 Basizität von Aminen 400 Vergleich der Basizität und Acidität von Aminen und Amiden 403 Reaktion von Aminen mit starken Säuren; Ammonium salze 405 Chirale Amine als Reagenzien zur Racemattrennung 408 Acylierung von Aminen mit Säurederivaten 409 Quartäre Ammoniumsalze 411 Aromatische Diazoverbindungen 412 Diazokupplung; Azofarbstoffe 416 12 Spektroskopie und Strukturaufklärung 12.1 12.2 12.2.1 12.2.2 12.2.3 12.3 12.4 12.5 12.6 Grundlagen der Spektroskopie 42.9 Kernresonanzspektroskopie (NMR) 431 Messung von NMR-Spektren 432 Chemische Verschiebungen und Signalflächen 433 Spin-Spin-Kopplung 438 13 C-NMR-Spektroskopie 443 Infrarotspektroskopie 447 UV-VIS-Spektroskopie 453 Massenspektrometrie 455 11.4 11.5 11.6 11.7 11.8 391 427 Inhalt 13 Heterocyclische Verbindungen 13.1 13.2 13.3 13.4 Pyridin: Bindung und Basizität 470 Substitutionen an Pyridin 472 Andere Sechsring-Heterocyclen 475 Fünfring-Heterocyclen: Furan, Pyrrol und Thiophen 478 Elektrophile Substitution an Furan, Pyrrol und Thiophen 481 Andere Fünfring-Heterocyclen: Azole 482 Kondensierte Fünfring-Heterocyclen: Indole und Purine 485 13.5 13.6 13.7 469 14 Synthetische Polymere 14.1 14.2 14.3 14.4 14.5 Einteilung von Polymeren 496 Radikalische Kettenpolymerisation 497 Kationische Kettenpolymerisation 503 Anionische Kettenpolymerisation 504 Stereoreguläre Polymere; Ziegler-NattaPolymerisation 505 Dienpolymere: Naturkautschuk und synthetischer Kautschuk 507 Copolymerc 509 Polykondensation: Dacron und Nylon 511 Polyurethane und andere Polykondensate 516 14.6 14.7 14.8 14.9 4.95 15 Lipide und Detergenzien 15.1 15.2 15.3 15.4 15.5 15.6 15.7 15.8 15.9 Fette und Öle; Glycerintriester 526 Hydrierung von Pflanzenölen 530 Verseifung von Fetten und Ölen; Seife 530 Wie wirken Seifen? 532 Synthetische Reinigungsmittel (Syndets) 533 Phospholipide 537 Prostaglandine, Leukotriene und Lipoxine 540 Wachse 541 Terpene und Steroide 541 16 Kohlenhydrate 16.1 16.2 16.3 Definitionen upd Einteilungen 554 Monosaccharide 555 Chiralität in Monosacchariden; Fischer-Projektionsformeln und D,i.-Zucker 556 Cyclische Hemiacetalstrukturen von Monosacchariden 560 Anomeriezentren; Mutarotation 563 Pyranosen und Furanosen 56'4 16.4 16.5 16.6 525 553 XI XII Inhalt 16.7 16.8 16.9 16.10 16.11 16.12 16.12.1 16.12.2 16.12.3 16.12.4 16.13 16.13.1 16.13.2 16.13.3 16.14 16.15 16.16 16.17 Konformationen von Pyranosen 566 Ester und Ether von Monosacchariden 567 Reduktion von Monosacchariden 568 Oxidation von Monosacchariden 569 Glycosidbildung aus Monosacchariden 570 Disaccharide 572 Maltose 572 Cellobiose 573 Lactose 574 Saccharose 574 Polysaccharide 577 Stärke und Glycogen 577 Cellulose 57.9 Sonstige Polysaccharide 582 Phosphatzucker 582 Desoxyzucker 583 Aminozucker 583 Ascorbinsäure (Vitamin C) 583 17 Aminosäuren, Peptide und Proteine 17.1 17.2 17.3 Natürlich vorkommende Aminosäuren 593 Säure-Base-Eigenschaften von Aminosäuren 594 Säure-Base-Eigenschaften von Aminosäuren mit mehr als einer sauren oder basischen funktionellen Gruppe 601 Elektrophorese 603 Reaktionen von Aminosäuren 604 Die Ninhydrin-Reaktion 604 Peptide 605 Die Disulfidbindung 607 Proteine 608 Primärstruktur von Proteinen 670 Aminosäureanalyse 610 Sequenzierung 611 Selektive Spaltung von Peptidbindungen 614 Logik der Sequenzbestimmung 615 Peptidsynthese 617 Sekundärstruktur von Proteinen 623 Die Geometrie der Peptidbindung 623 Wasserstoffbrückenbindungen 624 Die a-Helix und die ß-Faltblattstruktur 625 Tertiärstruktur: Faser- und Sphäroproteine 627 Quartärstruktur von Proteinen 630 17.4 17.5 17.6 17.7 17.8 17.9 17.10 17.10.1 17.10.2 17.10.3 17.11 17.12 17.13 17.13.1 17.13.2 17.13.3 17.14 17.15 593 Inhalt 18 Nucleotide und Nudeinsäuren 18.1 18.2 18.3 18.4 18.5 18.6 18.7 18.8 18.9 18.10 18.11 18.12 Allgemeine Struktur von Nudeinsäuren 640 Bausteine der Desoxyribonucleinsäure (DNA) 640 Nucleoside 64J Nucleotide 643 Primärstruktur der DNA 645 Nucleinsäuresequenzierung 646 Laborsynthese von Nudeinsäuren 648 Sekundärstruktur der DNA; die Doppel-Helix 649 DNA-Replikation 652 Ribonucleinsäuren (RNA) 654 Genetischer Code und Biosynthese der Proteine 656 Andere biologisch bedeutende Nucleotide 659 Anhang 639 67/ Tab. A: Bindungsdissoziationsenergien ausgewählter Bindungen: A-X—»A- + X- (in kcal/mol) 671 Tab. B: Bindungslängen ausgewählter Bindungen (in Ängstrom, Ä) 671 Tab. C: Typische Säurestärken funktioneller organischer Gruppen 672 Register 675 XIII