ZNS-Tumoren
Werbung

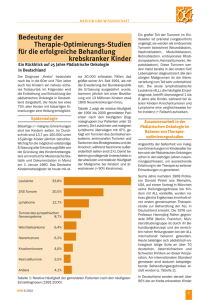
Pädiatrische Onkologie Dr. med. Toralf Bernig Oberarzt mit Schwerpunkt pädiatrische Hämatologie und Onkologie Universitätsklinik für Kinder- und Jugendmedizin Greifswald Teil 1 Allgemeine Grundlagen Inzidenzen von kindlichen Tumorerkrankungen in Deutschland Inzidenz = Anzahl der Neuerkrankungen an einer bestimmten Krankheit in einer Bevölkerungsgruppe (z.B. 100.000 Einwohner) während einer bestimmten Zeit (z.B. ein Jahr) Erwachsene • >90% Karzinome • 3% Leukämien/Lymphome • 2% ZNS Tumore • 1% Sarkome Kinder > 15 Jahre • 45% Leukämien/Lymphome • 20% ZNS Tumore • 30% Blastome/Sarkome • 1% Karzinome jährlich 13,9 Neuerkrankungen pro 100.000 Kindern unter 15 Jahren – ca. 1800 Neuerkrangungen/ Jahr – Diagnose einer bösartigen Erkrankung bei jedem 500. Kind bis zum 15. Geburtstag Altersstandardisierte Inzidenz kindlicher Krebserkrankungen in Deutschland nach Jahren 1981 – 2003, n=35367 (Quelle: Deutsches Kinderkrebsregister; www.kinderkrebsregister.de) Altersstandardisierte Inzidenzen kindlicher Krebserkrankungen nach dem Jahr der Diagnosestellung Westdeutschland ohne Berlin (Quelle: Deutsches Kinderkrebsregister; www.kinderkrebsregister.de) Krebs bei Kindern Häufigkeiten in den deutschen Bundesländern 15.1 13.5 14.2 13.8 14.1 13.7 14.3 15.6 14.0 13.2 12.6 13.4 12.0 12.2 12.8 13.3 Krebs bei Kindern Häufigkeiten - weltweit England 11-12 Deutschland 13-14 USA 12-13 Verteilung kindlicher Krebserkrankungen 1991-2000, n=17.641 (Quelle: Deutsches Kinderkrebsregister; www.kinderkrebsregister.de) Keimzelltumor 3.5% Andere 4.1% Knochentumor 4.6% Nephroblastom 6.2% Weichteil-Sarkom 6.4% Leukämie 33.8% Neuroblastom 8.7% ZNS-Tumor 20.0% Lymphom 12.7% Krebs bei Kindern- und Jugendlichen Beispiele für Altersabhängigkeiten (Quelle: Deutsches Kinderkrebsregister; www.kinderkrebsregister.de) Gesamterkrankungen Akute Lymphatische Leukämie Retinoblastom Hodgkin-Lymphom Spezifität kindlicher Krebserkrankungen – Im Gegesatz zu Krebserkrankungen Erwachsener sind kindliche Tumoren oft bereits vor der Geburt angelegt – Unkontrolliertes Zellwachstum führt zur Tumorentstehung Zellvermehrung natürlicher Zelltod – Mögliche Ursache für Fehlregulationen im Zellzyklus durch Defekte in den Erbanlagen (Mutationen), deren Produkte das innere Uhrwerk der Zelle steuern (z.B. Onkogene, Tumorsuppressorgene, Rezeptorgene, Reparaturgene) Prädispositionen - vererbbare Krebssyndrome Syndrom häufige Krebserkrankung kloniertes Gen Gruppe 1 Bloom-Syndrom Ataxia teleangiektatika Xeroderma pigmentosum Leukämien, solide Tumoren Lymphome Hautkrebs BLM ATM XPA-F Fanconi-Anämie Akute myeloische Leukämie FACC FACA Gruppe 2 WAGR-Syndrom Beckwith-Wiedemann-Syndrom Wilms-Tumor Wilms-Tumor, Hepatoblastom, Adrenokortikales, Karzinom, Rhabdomyosarkom Neurofibromatose Typ 1 Lymphome, Gehirntumoren Neurofibromatose Typ 2 Sarkome, Gliome, Meningiome, Akustikus-Neurinome, Ependymome Multiple endokrine Neoplasie Typ 1 Adenome, Karzinome endokriner Gewebe Multiple endokrine Neoplasie Typ 2 Medulläres Schilddrüsenkarzinom, Phäochromozytom Erbliches Retinoblastom Li-Fraumeni-Syndrom Retinoblastom Sarkome, Gehirntumoren, Leukämien, Adrenokortikales Karzinom chromosomale Lokalisation 15q26.1 11q22 9q34.1, 16p13, 19q13, 2q21, 13q32 - 33,3 p25, 11q12-13 9q22.3 16q24.3 WT1, WT2, andere? p57/KIP2 (?) 11p13 11p15 NF1 NF2 17q11.2 22q12.2 MEN1 RET 11q13 10q11.2 RB1 p53 13q14.3 17p13.1 Genetische Faktoren der Malignomentstehung Akute Leukämie (ALL) FISH-Analyse – Translokation t(12;21) – TEL-AML1 Fusionsgen in B-Vorläufer –ALL – Identisch in eineiigen Zwillingen mit zeitlich unterschiedlicher Manifestation einer TEL-AML1 positiven ALL Genetische Faktoren der Malignomentstehung Akute Leukämie (ALL) – TEL-AML1 Fusionsgen 100x häufiger im Blut gesunder Neugeborener als anhand der ALLInzidenz zu erwarten wäre – zusätzlich einwirkende Faktoren nach der Geburt, die Leukämieentstehung fördern → “two-hit” Modell Akute Leukämie (ALL) „two-hit“ Modell – Zusätzliche, noch unbekannte molekulare Ereignisse nach der Geburt erscheinen notwendig für die Leukämieentstehung bei Kindern – mögliche auslösende exogene Faktoren: • ionisierende Strahlung • Chemikalien • Infektionen • Ernährung • Arzneimittel Epidemiologische Studie zu Kinderkrebs in der Umgebung von Kernkraftwerken (KiKK-Studie) (Oktober 2207, Deutsches Kinderkrebsregister; www.kinderkrebsregister.de) Untersuchungszeitraum – 01.01.1980 – 31.12.2003 Untersuchungsregion – 16 Atomkraftwerke – 41 Landkreise , 1436 Gemeinden Studienpopulation – 1592 Fälle – 593 akute Leukämien (37.3 %) • 512 ALL (32,2 %) • 75 AML (4,7 %) – 242 Hirntumoren (15,2 %) – 486 embryonale Tumoren 30,6 %) Kontrollen (1:3) – 4735 Kontrollen Epidemiologische Studie zu Kinderkrebs in der Umgebung von Kernkraftwerken (KiKK-Studie) (Oktober 2207, Deutsches Kinderkrebsregister; www.kinderkrebsregister.de) Hypothese der Studie (im Sinne der statistischen Nullhypothese): „Es besteht kein Zusammenhang zwischen der Nähe der Wohnung zu einem Kernkraftwerk und dem Risiko, bis zum 5. Lebensjahr an Krebs zu erkranken.“ Ergebnisse für Kinder innerhalb der “< 5 km Zone”: – Risiko an Krebs zu erkranken bis zum 5. Lebensjahr OR = 1,62 (p<0,01) – “attributales” Risiko an allen Krebserkrankungen (77 von 13373): → 0,2%; d.h. 29 Fälle bzw. 1,2 Fälle pro Jahr – “attributales” Risiko an akuten Leukämien (37 von 5893): → 0,3%; d.h. 20 Fälle bzw. 0,8 Fälle pro Jahr Epidemiologische Studie zu Kinderkrebs in der Umgebung von Kernkraftwerken (KiKK-Studie) (Oktober 2207, Deutsches Kinderkrebsregister; www.kinderkrebsregister.de) Anhand des aktuellen strahlenbiologischen und -epidemiologischen Wissens können die von deutschen Kernkraftwerken im Normalbetrieb emittierte ionisierende Strahlung grundsätzlich nicht als Ursache interpretiert werden. Grenzwert für die Belastung von Personen in der „Umgebung“ von kerntechnischen Anlagen in Deutschland = 0,3 mSV/ Jahr Natürliche Strahlenbelastung = 1,4 mSV/ Jahr Exposition durch medizinische Untersuchungen = 1,8 mSV/ Jahr Mikrometastasierung von Malignomen Die bereits zum Zeitpunkt der Diagnosestellung vorhandene Mikrometastasierung erfordert ein multimodales Therapiekonzept. Multimodale Behandlungsstrategien Chemotherapiesensitivität kindlicher Malignome chemoresistent sensibler chemosensitiv chemosensitiv Adeno-CA Plattenepithel-CA Nieren-CA - Lunge - Niere Mamma-CA Hoden-CA Ovarial-CA kindliche Sarkome Leukämien Lymphome Resektion Bestrahlung Resektion Bestrahlung Resektion Bestrahlung Chemotherapie palliativ Chemotherapie + aggressive stratefizierte Chemotherapie aggressive stratifizierte Chemotherapie (Bestrahlung) Stammzelltransplantation Stammzelltransplantation Multimodale Anti-Tumortherapie in der paediatrischen Onkologie – Lokaltherapie (z.B. Resektion und Bestrahlung) für Primärtumor – Systemische Therapie gegen Tumoraussaat • Chemotherapie (Zytostatika) • Immuntherapie (monoklonale Antikörper) • Targettherapie (Thyrosinkinasehemmer) Lokaltherapie Resektion Chemotherapie Bestrahlung + Therapie Modalitäten Therapieansprechen Chemotherapie Operation Bestrahlung Fraglich niedrig maligne ZNS-Tumoren differenziertes SchilddrüsenKarzinom Niedrig Osteogenes Sarkom Hepatoblastom Intermediär Ewingsarkom Neuroblastom Hoch Leukämien/Lymphome Nephroblastom Embryonales Rhabdomyosarkom Adjuvante zytostatische Chemotherapie Neoadjuvante Chemotherapie = präoperative Chemotherapie zur Verminderung der Tumorlast vor lokaler operativer Tumorentfernung. Überlebenswahrscheinlichkeit in Abhängigkeit von der Therapieoption Ewing Sarkom Adjuvante Chemotherapie und Lokaltherapie 100 100 80 80 Survival [%] Survival [%] nur Lokaltherapie 60 40 Localized 60 40 Metastatic 20 20 0 0 0 20 40 60 80 100 120 140 160 Time [months] 0 2 4 6 Time [years] 8 10 Geschichte der pädiatrischen Onkologie und Hämatologie in Deutschland • 1966 - Deutsche Arbeitsgemeinschaft für Leukämie-Forschung und Behandlung im Kindesalter (DAL) • 1973 - Gesellschaft für Pädiatrische Onkologie (GPO) • 1991 - Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH) – in Deutschland werden derzeit über 90 % der an Krebs erkrankten Kinder und Jugendlichen in 24 aktiven Therapieoptimierungsstudien behandelt – Anteil von Studienpatienten je nach Diagnose zwischen 92 % und 100 % – Meldung von ca. 95 % aller Patienten zentral an das Deutsche Kinderkrebsregister Mainz Kompetenznetzwerk innerhalb GPOH – qualitativ hochwertige, einheitliche und optimale Diagnostik und Behandlung für jeden Patienten in Therapieoptimierungsstudien – Therapieoptimierung durch Modifikationen in Teilbereichen oder für bestimmte Risikogruppen – Auswertung von wissenschaftlichen Fragestellungen Strategie der künftigen Qualitätssicherung in der pädiatrischen Hämatologie und Onkologie Langzeitueberleben nach maligner Erkrankung im Kindes- oder Jugendalter in Deutschland 15-Jahres-Überlebenswahrscheinlichkeit für verschiedene Gruppen von Krebserkrankungen im Kindes- und Jugendalter bei Erkrankung im angegebenen Jahr (Grafik: Deutsches Kinderkrebsregister) Nachsorge paediatrischer Patienten mit einer malignen Erkrankung • Kumulation Überlebender einer Krebserkrankung im Kindes- und Jugendalter – 2010 ein Überlebender einer Krebserkrankung im Kindes- und Jugendalter pro 250 junger Erwachsenen zwischen 15 und 45 Jahren • Erfassung der Erkrankungs- und Therapienebenwirkungen als Langzeitfolgen auf den Gesundheitszustand und das Wohlbefinden der Patienten – eingeschränkten Funktion von Organsystemen Größenwachstum – Pubertätsentwicklung bzw. Fertilität – psychosoziale Probleme (z.B. durch Rezidivangst, Therapienebenwirkungen, verstümmelnde Operationen, Verlust an Freundschaften) – Entwicklung von Zweitmalignomen → seit Beginn der 90er Jahre Aufbau eines Late-effectsurveillance-Systems (LESS) in Deutschland (PD. Dr. Langer, Univ. Erlangen) Spätfolgen nach multimodaler Antitumortherapie Late Effect Treatment-related Risk Factors Diagnostic Approach • CNS RT, IT chemotherapy: Learning problems, neurocognitive dysfunction • Yearly educational assessment, neurocognitive testing • CNS RT: pituitary dysfunction • Yearly growth curves, TSH, LH/FSH • Alkylators: primary gonadal failure • LH/FSH, estradiol or testosterone, semen analysis • CNS RT: brain tumors • MRI for symptoms • Alkylators or epipodophyllotoxins: secondary AML • Yearly CBC Cardiac dysfunction • Anthracyclines: cardiomyopathy (risk related to cumulative dose, higher risk in AML) • EKG/echo every 3 years (cardiomyopathy can occur decades after treatment) Hepatic dysfunction • Methotrexate, 6-mercaptopurine, 6thioguanine: late hepatic fibrosis • Yearly LFT’s Cataracts • CNS RT • Yearly eye exam Abnormal dental development • CNS RT • Dental exam at age 5 CNS / psychosocial Endocrine / reproductive Secondary neoplasms Spätfolgen nach multimodaler Antitumortherapie Zweitmalignome Risiko auf Entwicklung eines Zweittumors im Rahmen der GPOHTherapieoptimierungsstudien insgesamt: 1,2% nach 10 Jahren 3,2% nach ALL (n=5006) nach Sarkom (n=5176) Spätfolgen nach multimodaler Antitumortherapie Zweitmalignome – Risiko nach Art des Sekundärtumors Leukämien/Lymphome solide Tumoren - Alkylantien - Epipodophylotoxine - Radiatio 4,7% 1,8% 2,0% 0,6% 45 (5-113) Monate 1,5% 0,2% Mediane Latenzzeit 82 (13-177) Monate → deutschlandweit standartisierte Therapie und Nachsorge für jeden Patienten mit einer malignen Erkrankung im Kindes- und Jugendalter → 75 % aller krebskranken Kinder und Jugendlichen können gegenwärtig geheilt werden Teil 2 Spezielle onkologische Erkrankungen Literaturhinweis: Akute Leukämien im Kindesalter Akute Lymphatische Leukämie, ALL Blässe Abgeschlagenheit Blutungsneigung Infektionszeichen (Fieber) Hepato- bzw. Splenomegalie vergrößerte Lymphknoten Knochen- bzw. Gelenkschmerzen Hodenschwellung Haut- bzw. Schleimhautinfiltrate Kopfschmerzen Hirnnervenlähmungen T-ALL obere Einflußstauung und Atemwegsobstruktion B-ALL Ileus-Symptomatik Akute Leukämie Symptomatik Akute lymphoblastische Leukämie Skelettbeschwerden als Initialsymptom im Kindesalter Monatsschr Kinderheilkd 1999; 147:116–121 • n=80 Kinder mit ALL (72 BFM, 8 SAKK) • 30 Patienten (37 %) mit Skelettbeschwerden n 7 8 10 23 f 0,23 0,27 0,33 0,77 statische Belastung ? Typische Knochenmarkbefunde bei ALL FAB-Klassifikation Normal L1 L2 L3 Akute Lymphatische Leukämie Beispiel für immunologische Typisierung pro-B-ALL (~5%) CD 19 und/oder CD22; CD10außerdem meist TdT+, HLA-DR+ Common cALL CD10+, cytoplasmatisches lgM- (~60%) prä-B-ALL (~15%) cytoplasmatisches lgM+, CD10 +/-, Oberflächen lgM- B-ALL zusätzlich Oberflächen lgM+ Akute Lymphatische Leukämie Knochenmarkbefunde während der Therapie Bei Diagnose Chemotherapie 2 Wochen 4 Wochen Remission Entwicklung der ALL-Therapie Event-free Survival (%) 100 Risk-adapted therapy (90’s) 80 Intensive therapy (80’s) CNS preventative therapy (70’s) 60 40 Combination chemotherapy (60’s) 20 Single-agent chemotherapy (50’s) 0 0 1 2 3 Years from diagnosis 4 5 6 Differentialdiagnose “Atypische Zellen” Hämatologie-Automaten können unreife bzw. pathologische Zellen identifizieren, aber nicht klassifizieren → Notwendigkeit der mikroskopischen Beurteilung reaktive Lymphozyten – Virusinfektion (z.B. EBV) Differentialdiagnose “Atypische Zellen” blastäre Zellen Differentialdiagnose “Atypische Zellen” diagnostisches Procedere Automaten-Blutbild • Atypische Zellen • Zytopenie suspekte Zellen Immunphaenotypisierung peripheres Blut Blasten ja Mikroskopische Beurteilung Blutausstrich Blasten ja Knochenmarkuntersuchung • mikroskopisch (nativ und gefaerbt) • Immunphaenotypisierung (FACS) Blasten nein Verlaufskontrolle Diagnose reaktive Lympho Fallbericht 2 Josy, 3 Jahre Symptome: • 4 Wochen vor Aufnahme rezidivierendes Fieber • cervikale Lymphknotenvergrößerungen • nachts starke Gliederschmerzen • antibiotisch behandelt mit wechselndem Erfolg • zunehmend blaue Flecken peripheres Blut Patient Labor: • Leukozyten 9.000/µl • Hämoglobin 5.3 mmol/L = 8.5 g/dl • Thrombozyten 30.000/µl peripheres Blut normal (aktivierte Lympho) Fallbericht 2 Josy, 3 Jahre Knochenmarkaspirat Patient → Diagnose: prä-B-ALL Knochenmarkaspirat gesunde Kontrolle Akute Myeloische Leukämie AML M1 AML M3 M1 - Akute myeloische Leukämie ohne Ausreifung M2 - Akute myeloische Leukämie mit Ausreifung M3 - Akute Promyelozyten-Leukämie AML M2 FAB M4 - Akute myelomonozytäre Leukämie FAB M5 - Akute Monozyten-Leukämie FAB M6 - Akute Erythroblasten-Leukämie FAB M7 - Akute MegakaryoblastenLeukämie AML M4 AML M6 AML M5 AML M7 Lymphome Differentialdiagnose Lymphadenitis durch Infektion? Malignes Lymphom? Lymphome Differentialdiagnose Morbus Hodgkin Pathologie einkernige Hodgkin- bzw. mehrkernige Reed-Sternberg-Zellen (HRS-Zellen) representieren < 1% des Tumorgewebes unterschiedliche Anzahl der HRS-Zellen (in zunehmender Reihenfolge: LR–NS– MC–LD) inflammatorisches Begleitinfiltrat (inflammatorische Zellen, Stroma) Klassisches Hodgkin Lymphom lymphozytenreiches klassisches Hodgkin-Lymphom (LRCHL, 1%) vorwiegend Lymphozyten, keine eosinophilen und neutrophilen Granulozyten, keine Fibrose noduläre Sklerose (NS, 68%) Kollagenfaserbuendel Mischtyp (MC, 21%) heterogene Mischung von HRS-Zellen, Lymphozyten, eosinophilen und neutrophilen Granulozyten, Histiozyten, Plasmazellen und Fibroblasten, keine bandförmigen Fibrosen lymphozytenarmer Subtyp (LD, 1%) wenig Lymphozyten im Begleitgewebe Morbus Hodgkin Pathologie Mb. Hodgkin – befallener Lymphknoten Mb. Hodgkin – Noduläre Sklerose Mb. Hodgkin – noduläre Sklerose (HRS-Zellen) Mb. Hodgkin – Mischtyp Mb. Hodgkin – Reed-Sternberg Zelle Morbus Hodgkin Epidemiologie Verteilung der Patienten nach Alter und Geschlecht in der Studie GPOHHD 95. Inzidenz des Morbus Hodgkin in Deutschland (1997–2001): 0,7 auf 100.000 Kinder unter 15 Jahren Morbus Hodgkin 18F-Fluordeoxyglukose Positronen Emissions Tomographie (18F-FDG-PET) CT FDG-PET Morbus Hodgkin Therapie → risikostratifizierte kombinierte Chemo-Radiotherapie Morbus Hodgkin Prognose Wahrscheinlichkeit für ereignisfreies Überleben (EFS) in den DAL/GPOHStudien HD 78 bis HD 95 (n=2.263) Wahrscheinlichkeit für Überleben (OS) in den DAL/GPOH-Studien HD 78 bis HD 95 Morbus Hodgkin Spätfolgen Schädigung der Gonaden Knaben: Mädchen: Beinträchtigung der Spermatogenese durch Zytostatika (Procarbacin) Strahlentherapie Kardiale Komplikationen Ursache: Antrazykline, Radiatio Lungenschäden Rezidivierende Infektionen Endokrine Störunge (Schilddrüse) Sekundäre maligne Neoplasien (SMN) Morbus Hodgkin Spätfolgen Kumulative Wahrscheinlichkeiten für SMN bis zu 20 Jahre nach Erkrankung an einem Morbus Hodgkin im Kindes- und Jugendalter Non-Hodgkin-Lymphome (NHL) Anamnese meist kurz, rasche Progredienz Symptomatik abhängig von Lokalisation Stridor - mediastinal Bauchschmerz - abdominell Oligo-/Anurie - retroperitoneal Krampfanfall, Hirndruck, Hirnnervenausfall - ZNS-Befall Mediastinal - meist T-Zell-Typ Abdominal - meist B-Zell-Typ Non-Hodgkin-Lymphome T-NHL – obere Einflusstauung Symptome • • • Hasten, Heiserkeit, Dyspnoe, thorakale Schmerzen Kopfschmerzen, Sehstörungen, Erbrechen Schwellung Kopf/ Hals, Plethora, Zyanose, Stridor Therapie • • • • • Vermeiden tiefer Sedierungen/ Anaesthesie Radiatio Steroide Chemotherapie kardio-respiratorischer Support bei Bedarf Fallbericht 2 Kai 17 Jahre Symptome: • • • • 15 % Gewichtsabnahme Nachtschweiß Schwellungen beidseits oberhalb der Schlüsselbeine (indolent, hart, nicht verschieblich) Labor: • LDH 63,1 katal/l (NB < 4,2) • HCG 29570 U/l (NB , 2,5) Fallbericht 2 Kai,17 Jahre → Diagnose: Hodenkarzinom mit diffuser Metastasierung (einschliesslich supraclaviculaer) Lokalisation kindlicher Tumoren Differentialdiagnose Mediastinaltumor Lymphome Neuroblastom L: N: Keimzelltumor T: Nephroblastom Charakteristika und biologische Besonderheiten malignaner embryonaler Tumor ausgehend von nephrogenen Blasten klassisch triphasisch Blasten, Stroma, Tubuli Histologische Subtypen low grade (10%) intermediate (75-80%) high grade (10-15%) • Assoziation zu urogenitalen Fehlbildungen • familiär gehäuft Nephroblastom Symptome oft - schmerzlose Schwellung selten - Schmerz, Hämaturie, Hypertonus Nephroblastom Therapiestrategie – neoadjuvante Chemotherapie 1. präoperative Chemotherapie ohne vorhergehende histologische Diagnosesicherung 2. Operation und Bestätigung der Diagnose und Stadieneinteilung durch Histologie 3. postoperative stratifizierte Chemotherapie 4. Bestrahlung ab Stadium II N+ und/oder Tumorruptur Nephroblastom Neoadjuvante/ adjuvante Chemotherapie bei pulmonalen Metastasen Therapieprotokoll S.I.O.P. (Vincristin, Actinomycin D ± Doxorubicin) bei Diagnose nach 2 Monaten → Remission unter Chemotherapie nach 4 Monaten Weichteilsarkome Klassifizierung nach Chemosensibilität und Histologie Heterogene Gruppe maligner Tumoren abstammend von mesenchymalen Stammzellen: – vielfältige Histologie mit unterschiedlichem biologischen Verhalten – ubiquitäres Vorkommen im Weichteilgewebe des menschlichen Körpers – unterschiedliches Ansprechen auf Chemo- bzw. Radiotherapie Weichteilsarkome Symptome in Abhängigkeit von Tumorlokalisation Allgemein Schwellung Schmerz Orbita Exophthalmus Chemosis Pharynx Epistaxis Dysphagia Arme/Beine Bewegungs Einschränkugen Retroperitoneal Obstipation, Durchfall, Ileus, Hämaturie Weichteilsarkome Rhabdomyosarkom hervorgehend aus embryonalem Mesenchym Histologie "kleine runde blaue Zellen" manchmal Spindeln positiv für Myosin und Vimentin RME: embryonales Rhabdomyosarkom Strukturen von embryonaler Muskulatur EFS lokalisiertes RME: 0,80 RMA: alveoläres Rhabdomyosarkom noch weniger differenziert EFS metastasiertes RME: 0,20 Solide Tumoren Differentialdiagnose → Histologie: "kleine runde blaue Zellen" Ewingsarkom (ES) Rhabdomyosarkom (RMS) Neuroblastom (NB) Medulloblastom PNET NHL Immunhistochemische Differenzierung "kleine runde blaue Zellen" Antigen NB NHL ES RMS PNET Neurofilament Synaptophysin Neuronenspezifische Enolase Beta2-mikroglobulin Leukozytenantigen Vimentin Myoglobin Myosin Aktin Desmin + + + - +/- - + - + +/- + - + + + + + + + - Neuroblastom Maligner embryonaler Tumor ausgehend von Sympathikoblasten Häufige Lokalisationen Nebenniere, Grenzstrang 50-70% intraabdominal 30-50% thorakal Histologie Brillenhaematom "kleine runde blaue Zellen" positiv für Neuronen-spezifische-Enolase und Synaptophysin höher differenziert: Ganglioneuroblastom, Ganglioneurom Metastasen häufiger Leber, Knochen, Knochenmark seltener Lunge, ZNS Abdominelle Schwellung Neuroblastom Symptome lokalisiert Zeichen der Raumforderung generalisiert Fieber, allgemeine Krankheitszeichen, Schmerzen Befall des Spinalkanals thorakal/apikal Sanduhrtumoren mit Querschnitt Horner Symptomatik (Ptosis, Miosis, Exophthalmus) Hirnmetastasen Hirnnervenausfälle, Hirndruck Neuroblastom Tumormarker spezifisch Katecholamine im Serum Katecholamin-Metaboliten im Urin (HMV, VMA) unspezifisch Laktatdehydrogenase mIBG*-Szintigraphie Prognostische Molekulare Marker N-MYC-Amplifikation 1p- Deletion (*meta-Jodo-Benzyl-Guanidin) Neuroblastom Altersabhängige Biologie Neuroblastom Therapiestrategie Chemotherapie abhängig von Stadium, Alter und biologischen Markern abwarten (Säuglinge 4S und komplett entfernte lokalisierter Tumoren) Standard-Chemotherapie und Operation (bei Tumoren mit erhöhtem Risiko) intensive Chemotherapie, Operation, Hochdosistherapie, autologe SZT und mIBG (Stadium 4, NMYC+) Prognose stadienabhängig 15-80% Neuroblastom Prognose Gute Prognose Säuglinge lokalisierter Tumor Ungünstig älter 12 Monate Stadium 4 nicht resezierbar hohe LDH Thrombozytopenie N-MYC Amplifikation 1p- Deletion Knochentumoren Knochen- und Gelenksymptome bei onkologischen Erkrankungen onkologische Erkrankungen a) primaere Manifestation am Knochen • solide Tumoren • Histiozytose • Lymphome Folgen der Antitumortherapie a) waehrend der Therapie • periphere Neuropathie • Knochenschmerzen b) Spaetfolgen der Therapie • aseptische Knochennekrosen b) Knochenmetastasen • Karcinome • Osteoporose • Nephroblastom • • Neuroblastom de Toni-Debré-Fanconi syndrome c) systemische Malignome • akute Leukaemien Solide Tumoren des Knochen bösartige Tumoren • • • • • • Osteosarkom Ewing Sarkom Chondrosarkom Fibrosarkoma Lymphome Knochenmetastasen (Brust-, Prostata-, Lungen-, Schilddruesen-CA, Nierentumoren, Neuroblastom) gutartige Tumoren • • • • Knochenzysten Osteochondrom Osteoidosteom Kallusbildung nach Frakturen Maligne Knochentumoren Symptomatik • Schmerzen – aktivitätsbezogen – nachts – kein therapeutisches Ansprechen auf NSAR • Bewegungseinschränkung • Weichteilschwellung betroffener Region • pathologische Frakturen (ca. 5% Ewing-Sarkom) • B-Symptomatik (seltener bei Osteosarkomen) Osteosarkom Ewing-Sarkom pathologische Fraktur Maligne Knochentumoren Epidemiologie Osteosarkom Ewing-Sarkom • Inzidenz: 2–3/106 Personen/Jahr • 2,1% aller Malignome • 2,3% aller Malignome • zweithäufigste primäre Knochentumor im Kindes- und Jugendalter • häufigste primäre Knochentumor im Kindes- und Jugendalter • meist im zweiten Lebensjahrzehnt, vornehmlich in der pubertären Wachstumsphase • Jungen häufiger betroffen als Mädchen • Inzidenz: 3/106 Personen < 15 Jahre/Jahr • Inzidenz: 2,4/106 Personen 15-25 Jahre/Jahr • mediane Alter 15 Jahre • Knabenwendigkeit 1,5:1 • Fast völliges Fehlen in Afrikanern und Chinesen Osteosarkom Häufigste Lokalisation des Primärtumors Metaphysen der langen Röhrenknochen (Knochen mit ausgeprägtesten pubertärem Wachstum): → distaler Femur → proximale Tibia → proximaler Humerus Ewing-Sarkom (klassisch) Häufigste Lokalisation des Primärtumors • knöchernes Becken (Os ilium), lange Röhrenknochen der (unteren) Extremitäten (Diaphyse), Rippen, Scapula und Wirbelsäule Maligne Knochentumoren Diagnostik – Nativroentgen (1) Osteosarkom • Osteosklerose • Osteolyse • Spikulae (“sunburst”) Maligne Knochentumoren Diagnostik – Nativroentgen (2) Ewing-Sarkom • Knochenlamellen • Osteolyse • Spikulae Osteosarkom Histologie sarkomatoeses Gewebe mit Bildung von Osteoid/ Knochen Ewing-Sarkom Histologie • wahrscheinlich pluripotente neuroektodermale Stammzelle • small blue round cells • postivity for surface antigen MIC2 (CD99) • Positive neuronale Marker S100, NSE, Synaptophysin • keine neuronalen Marker – klassisches ES • 1 neuronaler Marker – atypische ES • 2 neuronale Marker – PNET 95% with EWS-ETS-Genfusion Ewing-Tumor Familie • Ewing-Sarkom (klassisch) • Extraossäres Ewing-Sarkom • PNET Initiale Metastasierung maligner Knochentumoren Osteosarkom • 10 – 20% primäre Metastasen • ca. 80% okkulte Metastasen • Lokalisation: - Lunge - Skelett Ewing-Sarkom • ca. 25% primäre Metastasen • Lokalisation: - Lunge - Knochenmark/ Knochen in historischen Patientenkollektiven entwickelten mehr als 80% aller Fälle nach alleiniger chirurgischer Behandlung im weiteren Krankheitsverlauf Lungenmetastasen → Mikrometastasen zum Zeitpunkt der Diagnosestellung Therapiekonzept maligner Knochentumoren Osteosarkom Ewing-Sarkom → (neo)adjuvante Polychemotherapie Lokaltherapie Fallbericht 3 Jessica, 4 Jahre Neoadjuvante Chemotherapie bei Primitiv Neuroektodermalen Tumoren (PNET); Therapieprotokoll Euro E.W.I.N.G. 99: → präoperativ 6x VIDE (Vincristin, Ifosfamid, Doxorubicin, Etoposid) initial praeoperativ Fallbericht 4 Nicky, 15 Jahre Initialtumor → Diagnose: Lungenmetastase Osteosarkom rechter Humerus ZNS-Tumoren ZNS-Tumoren Allgemeine Zeichen des erhöhten Hirndrucks Kopfschmerz Vigilanzverminderung Übelkeit Erbrechen Verhaltensauffälligkeiten Hirnnervenlähmungen Doppelbilder Sehschwäche vorgewölbte Fontanelle Stauungspapille epileptischer Anfall Atemstillstand ZNS-Tumoren WHO Klassifikation der Astrozytome/Gliome WHO °I niedrig malignes Astrozytom bzw. Gliom (z.B. pilozytisches Astrozytom) WHO°II Astrozytom mit erhöhter Teilungsaktivität WHO°III z.B. anaplastisches Astrozytom WHO°IV z.B. Glioblastom (Erwachsene) ZNS-Tumoren Chemo- und Strahlen-Sensitivität Chemotherapie und Radiotherapie sensitiv • • • • AT/RT, PNET, Medulloblastom WHO °IV Ependymom WHO °III-IV Astrozytom WHO °III-IV Germinom Fraglich sensitiv für Chemotherapie und Radiotherapie • Ependymom WHO °II • Astrozytom WHO °II • Kraniopharingeom Nicht sensitiv für Chemotherapie und Radiotherapie • Ependymom WHO °I • Astrozytom WHO °I ZNS-Tumoren Niedrig maligne Gliome Astrozytome WHO °I und WHO°II 30-40% aller ZNS-Tumoren sehr langsames Wachstum nur selten aggressiv und disseminiert 20% der Neurofibromatosepatienten entwicklen Gliome Therapie Primär immer erst Resektion anstreben ab WHO°II Radio-Chemotherapie bei Progression supratentoriell • MRT-T1 hypointens • KM-Enhancement ZNS-Tumoren Niedrig malignes Gliom / pilozytisches Astrozytom WHO°I infratentoriell • MRT-T1 hypointens • KM-Enhancement • zystisch ZNS-Tumoren Niedrig malignes Gliom / pilozytisches Astrozytom WHO°I Sellaregion Chiasma → Sehschwäche Hypophyse Hypothalamus → Hormonausfälle - Minderwuchs - Diabetes insipidus - Adipositas ZNS-Tumoren Maligne Gliome → Hochmalignes anaplastisches Astrozytom WHO °III → Gliobastoma multiforme WHO °IV (Erwachsene) MRT/CT • • • • inhomogene Signal- Intensitäten inhomogenes KM-Enhancement perifokales Ödem Nekrosen Therapie • Resektion • Radio-Chemotherapie • EFS ~50% nach 3 Jahren ZNS-Tumoren Medulloblastom Charakteristika Histologie: "kleine runde blaue Zellen" Primitiv Neuroektodermaler Tumor (PNET) meist infratentoriell -> häufig Hydrozephalus häufig disseminiert supratentorielle Form stPNET meist 4. bis 8. L.J. doppelt so viele Jungen wie Mädchen MRT/CT: • variable Signalintensitäten • variables KM-Enhancement • perifokales Ödem ZNS-Tumoren Medulloblastom - intrakranielle Absiedlungen Tumorzellen im Liquor Supratentorielle, infratentorielle, spinale Absiedlungen • parenchymatoese Metastasen • Meningiosis ZNS-Tumoren Medulloblastom – therapeutisches Vorgehen 1. Hydrozephalus? Shunt oder Ventrikulostomie 2. vollstaendige Tumorresektion 3. Radiotherapie (Kinder älter als 4 Jahre) - Tumor 54 - 68 Gy - Neuroachse 36 Gy 4. Chemotherapie u.a. MTX, Cisplatin, Vincristin, Nitrosoharnstoff Prognose - ohne Metastasen - mit Metastasen 70-80% EFS 40% EFS Medulloblastom Therapieverlaufbeispiel initial nach Resektion + RadioChemotherapie