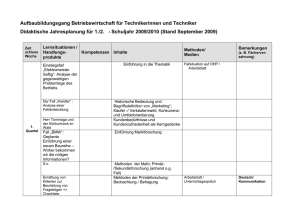
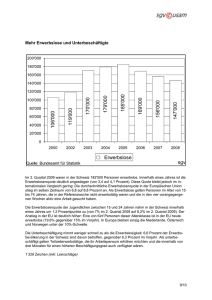
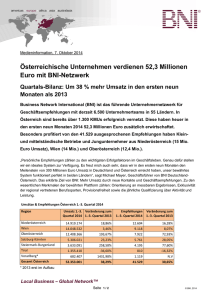
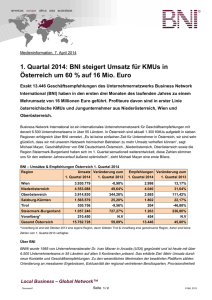
Fluorchinolon-Prophylaxe bei Patienten mit Neutropenie
Werbung

Aus der Medizinischen Universitätsklinik Abteilung Innere Medizin II der Albert-Ludwigs-Universität Freiburg im Breisgau Fluorchinolon-Prophylaxe bei Patienten mit Neutropenie INAUGURAL-DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg im Breisgau vorgelegt 2008 von Annette Pritzkow geboren in Freiburg im Breisgau Dekan: Prof. Dr. med. C. Peters 1. Gutachter: Prof. Dr. med. W. V. Kern 2. Gutachter: Prof. Dr. med. M. Dettenkofer Jahr der Promotion: 2009 INHALTSVERZEICHNIS 1 Einleitung und Zielsetzung............................................................................. 1 1.1 Einleitung .................................................................................................................... 1 1.1.1 Neutropenie und Infektrisiko ............................................................................. 1 1.1.2 Geschichte der Antibiotikaprophylaxe in der Onkologie................................... 3 1.1.3 Prophylaktische Fluorchinolone im Vergleich mit anderen Antibiotikaklassen 4 1.1.4 Levofloxacin - Eigenschaften und prophylaktische Anwendung....................... 4 1.1.5 Erkenntnisse aus bisherigen Studien mit Fluorchinolonprophylaxe .................. 6 1.2 Zielsetzung und Fragestellung .................................................................................... 7 1.2.1 Zielsetzung ......................................................................................................... 7 1.2.2 Fragestellung ...................................................................................................... 7 2 Patienten und Methoden ................................................................................ 8 2.1 Patienten (Studienpopulation) ..................................................................................... 8 2.1.1 Charakterisierung der Untersuchungszeiträume und Patientenkohorten ........... 8 2.1.2 Maligne Grunderkrankung ................................................................................. 8 2.1.3 Fluorchinolonprophylaxe ................................................................................... 9 2.1.4 Einschlusskriterien und Ausschlusskriterien.................................................... 10 2.2 2.1.4.1 Einschlusskriterien ....................................................................................... 10 2.1.4.2 Ausschlusskriterien ...................................................................................... 10 Methoden................................................................................................................... 12 2.2.1 Datenerfassung ................................................................................................. 12 2.2.2 Auswertungsparameter (Krankheitsparameter und erhobene Daten) .............. 12 2.2.2.1 Rekrutierungs- und Anamnesedaten ............................................................ 12 2.2.2.2 Nosokomiale Infektionen in der Neutropenie .............................................. 13 2.2.2.3 Antiinfektiva................................................................................................. 13 2.2.2.4 Clinical Outcome.......................................................................................... 14 2.2.2.5 Mikrobiologische Befunde ........................................................................... 14 2.2.3 Statistische Analyse.......................................................................................... 15 2.2.3.1 Endpunkte..................................................................................................... 15 2.2.3.2 Auswertung des Antibiotikaverbrauches ..................................................... 16 3 Ergebnisse ...................................................................................................... 18 3.1 Patientencharakteristika ............................................................................................ 18 3.1.1 Maligne Grunderkrankungen ........................................................................... 18 3.1.2 Autologe Blutstammzelltransplantation und Hochdosis-Chemotherapie ........ 21 3.1.3 Geschlechterverteilung..................................................................................... 23 3.2 Neutropenie: Dauer und Anzahl der Phasen ............................................................. 24 3.3 Granulopoese-stimulierende Therapie ...................................................................... 26 3.4 Antiinfektiva.............................................................................................................. 27 3.4.1 Fluorchinolonprophylaxe ................................................................................. 27 3.4.2 Antibiotikaverbrauch........................................................................................ 27 3.4.3 Antimykotika und Virustatika.......................................................................... 34 3.5 Infektionsdichte (-Rate)............................................................................................. 36 3.5.1 Prävalenz Fluorchinolon-resistenter Erreger in allen Isolaten ......................... 42 3.6 Fieberinzidenz ........................................................................................................... 43 3.7 Bakteriämierate ......................................................................................................... 45 3.7.1 3.8 Erregerspektrum- und prävalenzen .................................................................. 51 3.7.1.1 Spektrum und Resistenzprävalenzen - Gramnegative Erreger..................... 52 3.7.1.2 Resistenzprävalenzen - Grampositive Erreger ............................................. 55 Outcome .................................................................................................................... 57 3.8.1 Intensivstationspflichtigkeit und Todesfälle .................................................... 57 3.8.2 Liegedauer (Hospitalisierung).......................................................................... 58 3.9 4 Subgruppen-Analyse ................................................................................................. 60 Diskussion ...................................................................................................... 62 4.1 Einfluss der Fluorchinolon-Prophylaxe auf die Infektions- und Bakteriämierate .... 63 4.2 Veränderungen des therapeutischen Antibiotika-Verbrauches unter Fluorchinolonprophylaxe .......................................................................................... 66 4.3 Resistenzentwicklung unter Fluorchinolon-Prophylaxe ........................................... 67 4.4 Veränderungen des Erregerspektrums unter Fluorchinolonprophylaxe.................... 71 4.5 Unerwünschte Nebenwirkungen (Adverse Effects) .................................................. 73 4.6 Welche Patienten profitieren am meisten von einer Fluorchinolon-Prophylaxe ?.... 75 4.7 Welche Fluorchinolone eignen sich zur prophylaktischen Anwendung? ................. 75 4.8 Optimaler Zeitpunkt für den Beginn einer Fluorchinolon-Prophylaxe ..................... 77 4.9 Einfluss der Prophylaxe auf die Hospitalisierung (Liegedauer) ............................... 78 4.10 Antimykotika-Verbrauch .......................................................................................... 78 4.11 Einfluss der Prophylaxe auf die Mortalität ............................................................... 78 4.12 Limitationen der Studie ............................................................................................. 79 4.13 Schlussfolgerungen und Aussichten.......................................................................... 80 5 Zusammenfassung......................................................................................... 82 6 Literaturverzeichnis...................................................................................... 83 Anhang ......................................................................................................................... 95 Danksagung ............................................................................................................... 102 Lebenslauf.................................................................................................................. 103 ABKÜRZUNGSVERZEICHNIS µl € Abb. ADR AL ALL AML APL ATC BDK BK BSBL C. diff. CDAD CDC CI CLL CML CRP CSV D DDD E. coli EKG ESBL FQ FQPx FQR G-CSF GN GP HZL I Ig i.v. ID ISBL KBE Mikroliter Euro Abbildung Adverse Drug Reaction Akute Leukämie Akute lymphatische Leukämie Akute myeloische Leukämie Akute Promyelozyten-Leukämie Anatomical Therapeutical Clinical Blasendauerkatheter Blutkultur Breitspektrum-Betalaktam Clostridium difficile Clostridium difficile associated Diarrhea Centers for Disease Control and Prevention Confidence Intervall Chronische lymphatische Leukämie Chronische myeloische Leukämie C-Reaktives-Protein Character-, Comma- oder (Semi)colon-Sperated Values Tag Described Daily Doses Escherichia coli Elektrokardiogramm Extended-Spectrum-Beta-Laktamase Fluorchinolon Fluorchinolon-Prophylaxe Fluorchinolon-Resistenz Granulozyten-Kolonie-stimulierender-Faktor gramnegativ grampositiv Haarzell-Leukämie Intermediär Immunglobulin intravenös Infektionsdichte Intermediärspektrum-Betalaktam Kolonie bildende Einheit KMT KNS KZT MABUSE MAX MDS MEAN MeDoc® mg MNR MIN MM MRSA MZL NHL o.g. ORSA P. aeroginosa PBSZT PCP PDD PLL PT Q R RDD RR S S. S. aureus sog. spp. SPSS® SSBL tgl. TMP/STZ U/o v.a. VRE vs. ZVK Knochenmarktransplantation Koagulase-negative Staphylokokken Keimzelltumor Medical AntiBiotic Use, Surveillance and Evaluation Maximum Myelodysplastisches Syndrom Mittelwert Medizinisches Dokumentations- und Informationssystem ® Milligramm Magnetic Nuclear Resonance Minimum Multiples Myelom Methicillin-resistente- Staphylococcus aureus Mantelzell-Lymphom Non-Hodgkin-Lymphom oben genannte Oxacillin-resistenter-Staphylococcus aureus Pseudomonas aeroginosa Periphere Blutstammzelltransplantation Pnemocystis-carinii-Pneumonie Prescribed Daily Doses Prolymphozyten-Leukämie Pflegetage Quartal Resistent Recommended Daily Doses Relatives Risiko Sensibel Staphylokokkus Staphylococcus aureus Sogenannt Subspezies Statistical Package of the Social Sciences® Schmalspektrum-Betalaktam täglich Trimethoprim/Sulfamethoxazol und/oder vor allem Vancomycin resistenter Enterococcus versus Zentraler Venenkatheter 1 EINLEITUNG UND ZIELSETZUNG 1 1 EINLEITUNG UND ZIELSETZUNG 1.1 Einleitung 1.1.1 Neutropenie und Infektrisiko Bakterielle Infektionen und mit ihnen assoziierte Komplikationen stellen nach wie vor ein hohes Morbiditäts- und Mortalitätsrisiko bei onkologischen Patienten während der Neutropenie dar. Ein entscheidender Risikofaktor ist hierbei vor allem das Vorliegen einer protrahierten oder schweren Neutropenie mit Granulozytenzahlen (Leukozytenzahlen) < 500/µl (<1000/µl) für mindestens 10 Tage oder Granulozytenwerten (Leukozytenwerten) < 100/µl (< 500/µl). Zumeist handelt es sich hierbei um eine Folgeerscheinung einer vorangegangenen myelotoxischen (Hochdosis-) Chemotherapie mit oder ohne sich anschließender peripherer Stammzell- oder Knochenmarktransplantation (Schimpff et al. 1994, Hughes et al. 1997, Link et al. 2003, van de Wetering et al. 2005, Reuter et al. 2005, Gafter-Gvili et al. 2005, Elting et al. 1997). Weitere Ursachen und Risikofaktoren für Infektionen in der Neutropenie sind humorale oder zelluläre Immundefizite im Rahmen der malignen Grunderkrankung wie beispielsweise funktionelle Störungen der neutrophilen Granulozyten (Rossini et al. 2000). Zudem erleichtern Zytostatika- oder Neutropenie-bedingte Läsionen der Haut sowie der Pharynx- und Gastrointestinaltrakt-Mukosa durch Störung der physiologischen Barrierefunktion die Translokation der endogenen Flora in die Blutbahn und begünstigen dadurch die Entwicklung von Bakteriämien (Buchheidt et al. 2003 sowie 2000, Link et al. 2003, Schiel et al. 2003, Hughes et al. 2002). So beobachteten in diesem Zusammenhang Escande und Herbrecht (1998) bei neutropenen Patienten, die keine Antibiotikaprophylaxe erhielten, deutlich häufigere Bakteriämieraten mit oralen Streptokokken, Enterobacteriaceae-Spezies und Pseudomonas aeroginosa-Stämmen als bei Patienten mit einer Granulozytenzahl von > 500/µl. Die Dauer der Neutropenie nahm hierbei keinen Einfluss auf die Art der isolierten Pathogene. Insgesamt sind annähernd 80% der Infekte bei neutropenen Patienten endogenen Ursprungs (Bertz und Frank 2005). Ein weiteres hohes Risiko für die Entwicklung lokaler Infektionen oder Bakteriämien in der Neutropenie geht von intravasalen Kathetern (in Abhängigkeit von Pflege, Verweildauer und Typ des Katheters) aus, wobei Koagulase-negative Staphylokokken (KNS) unter den verantwortlichen Erreger-Spezies bezüglich der Prävalenz klar dominieren (Buchheidt et al. 2003, Link et al. 2003, Escande und Herbrecht 1998, Seifert et al. 2003). 1 EINLEITUNG UND ZIELSETZUNG 2 Ohne infektpräventive Maßnahmen beläuft sich die Infektionsrate bei neutropenen Patienten mit Fieber auf 48% bis 60% (Gafter-Gvili et al 2005, Hughes et al. 1997), bei bis zu 40% der neutropenen Patienten kommt es zur Entwicklung einer Bakteriämie (Schiel et al. 2003, Buchheidt et al. 2000). Eine Studie von Schimpff (1986) ergab bei Vorliegen einer febrilen und ausgeprägten Neutropenie (Neutrophilenzahl < 100/µl ) und bei Abwesenheit einer Antibiotikaprophylaxe eine Rate an gramnegativen Bakteriämien von 20%. In den überwiegenden bisherigen Untersuchungen bei Patienten mit hämatologischen Neoplasien oder soliden Tumoren waren KNS (17 bis 48,9% der Bakteriämien) die dominierende Spezies unter den Bakteriämie verursachenden Erregern. Escherichia coli (E. coli) erreichte als Vertreter der (aeroben) gramnegativen Enterobakterien in der Regel die höchsten Prävalenzraten unter den gramnegativen Bakteriämien (11,5% bis 16% der Bakteriämien in Arbeiten von Rolston et al. 2006, Escande und Herbrecht 1998 sowie Cherif et al. 2003). Die Gründe für das Überwiegen grampositiver Isolate, hierbei v.a. die Gruppe der KNS, liegen einerseits in der bei onkologischen Patienten häufigen und zumeist länger andauernden Lage zentralvenöser Katheter (Hughes et al. 2002), als auch in der zunehmenden Änderung des Wirkspektrums der therapeutisch eingesetzten Betalaktame in Richtung gramnegative Organismen (Escande und Herbrecht 1998). Im Verlauf der letzten zwei Jahrzehnte hat somit allmählich ein Wechsel von gramnegativen zu grampositiven Organismen als häufigste Erreger von Bakteriämien stattgefunden (Elting et al. 1997, Oppenheim 1998, Zinner 1999, Martin et al. 2003, Cherif et al. 2003). Eine Studie von Wisplinghoff et al. aus dem Jahr 2003 zeigte unter den Bakteriämien neutropener Patienten einen Anteil an grampositiven Pathogenen von 61%, während der Anteil gramnegativer Pathogene bei 24,9% lag. In der Neutropenie können oftmals eindeutige klinische Hinweise auf eine Infektion wie beispielsweise Entzündungsreaktionen und dadurch bedingt auch radiologische Zeichen wie pneumonische Lungeninfiltrate fehlen (Sickles et al. 1975, Rossini et al. 2000). Letztere demaskieren sich unter Umständen erst bei einer Normalisierung der Granulozytenzahlen. So gelingt nur etwa bei 50% der Neutropeniepatienten mit Fieber tatsächlich der klinische oder mikrobiologische Nachweis einer Infektion (Hughes et al. 2002, Link et al. 2003, Buchheidt et al. 2003). Das Auftreten von Fieber bleibt teilweise der einzige Hinweis auf eine mögliche Infektion (Link et al. 2003, Sickles et al. 1975), kann jedoch trotz eines vorliegenden Infektes auch gänzlich ausbleiben, insbesondere bei der Therapie mit Kortikosteroiden. Insgesamt sind daher die rechtzeitige Diagnostik und Therapie von Infekten in der Neutropenie sowie infektpräventive Vorkehrungen von großer Bedeutung für ein gutes klinisches Outcome neutropener Patienten. Baden (2005) definiert als allgemeine Ziele einer 1 EINLEITUNG UND ZIELSETZUNG 3 Antibiotikaprophylaxe in der Neutropenie die Verzögerung des Auftretens infektiöser Komplikationen bei gleichzeitiger Verringerung der Infektionsrate. Dies soll insbesondere durch eine Prophylaxe während der vulnerablen Phase der Neutropenie, wie beispielsweise bei Gegenwart einer Mukositis, gewährleistet werden. 1.1.2 Geschichte der Antibiotikaprophylaxe in der Onkologie Angesichts des oben beschriebenen hohen Infektionsrisikos, welchem Patienten in der Neutropenie ausgesetzt sind, sowie der zusätzlich bestehenden Gefahr einer schnellen Infektprogression (Hughes et al. 2002), wurden bereits in den 70er Jahren erste antibiotische Infektprophylaxen bei Neutropeniepatienten eingeführt (van de Wetering 2005). Bei den meisten Prophylaxen, die bislang in der Onkologie angewandt wurden, handelte es sich um antibiotische Präparate mit erweitertem Wirkspektrum im gramnegativen Bereich (Celkan et al 2002), da durch gramnegative Erreger verursachte Infektionen bzw. Bakteriämien (trotz ihrer inzwischen geringeren Prävalenz s.o.) im Vergleich zu grampositiven Infektionen eine deutlich höhere Mortalitätsrate aufweisen (Schimpff 1986). Eine in der pädiatrischen HämatoOnkologie durchgeführte Studie von Celkan et al. (2002) ergab in diesem Zusammenhang eine Mortalitätsrate von nur 8% bei grampositiven Septikämien gegenüber einer Mortalitätsrate von 20% bei gramnegativen Septikämien. Insgesamt lag in bisherigen Arbeiten die infektassoziierte Mortalitätsrate bei erwachsenen Neutropeniepatienten ohne Antibiotikaprophylaxe bei annähernd 4-7% (van de Wetering et al. 2005 sowie Bucaneve et al. 2005, Kern et al. 2005), bei Vorliegen einer Bakteriämie bei 10-15% (Buchheidt et al. 2003). Die anfänglichen Prophylaxe-Strategien der siebziger Jahre bestanden zunächst in einer Prophylaxe mit oral nicht- oder nur partiell absorbierbaren Antibiotika wie z.B. das Polypeptid-Antibiotikum Polymyxin (Colistin), Aminoglycoside und/oder Glycopeptide wie etwa Vancomycin (Schimpff et al. 1975, Hahn et. al 1978, Hughes et al. 2002). Ziel war die selektive Dekontamination der fakultativ pathogenen aeroben Flora des Gastrointestinaltraktes ohne hierbei die nicht-pathogene anaerobe Flora zu beeinträchtigen (van de Wetering et al. 2005, van der Waaij et al. 1986, Hahn et al 1978). Hiervon wurde jedoch nicht zuletzt wegen unerwünschter Nebenwirkungen und mangelnder Compliance wieder Abstand genommen (Kerr 1999, Gomez-Martin et al. 2000). 1 EINLEITUNG UND ZIELSETZUNG 1.1.3 4 Prophylaktische Fluorchinolone im Vergleich mit anderen Antibiotikaklassen Unter allen bislang angewendeten Antibiotikaprophylaxen bei Neutropeniepatienten erwies sich die Gruppe der Fluorchinolone bezüglich der Infektprävention im gramnegativen Bereich als eine der erfolgversprechensten, nicht zuletzt aufgrund ihres breiten Wirkspektrums in diesem Bereich (Gafter-Gvili et al. 2005, van de Wetering et al. 2005, Engels et al. 1998, Cruciani et al. 1996). Studien mit Fluorchinolonprophylaxen lösten im Laufe der achtziger Jahre (Kerr 1999) und zu Beginn der neunziger Jahre zunehmend Prophylaxen mit Vertretern anderer Antibiotikaklassen wie beispielsweise Trimethoprim-Sulfamethoxazol (Cotrimoxazol) ab, welches vorwiegend in den Achtzigern zum Einsatz kam (Gafter-Gvili et al. 2005, Martino et al. 1984, Kauffmann et al. 1983). Trimethoprim-Sulfamethoxazol war (verglichen mit Chinolonen) sowohl aufgrund seines geringeren grampositiven und gramnegativen Wirkspektrums (z.B. keine Wirksamkeit gegen P. aeroginosa) als auch wegen seiner potentiellen Myelotoxizität (Hughes et al. 2002, Pascoe und Cullen 2006) und einem erhöhten Hypersensibilitäts-Risiko den Chinolonen an Effektivität und Verträglichkeit unterlegen (Rubinstein et al. 1994, Kerr 1999, van de Wetering et al. 2005, Leibovici et al. 2006). 1.1.4 Levofloxacin - Eigenschaften und prophylaktische Anwendung In den jüngsten Studien mit Fluorchinolonprophylaxe erhielt immer mehr das DrittGenerations-Fluorchinolon Levofloxacin den Vorzug vor anderen Fluorchinolonen wie z.B. Ciprofloxacin (Reuter et al. 2005, Bucaneve et al. 2005, Cullen et al. 2005), welches wie Ofloxacin der Gruppe der Zweit-Generations-Fluorchinolone angehört (Naber und Adam 1998). Gründe hierfür sind u.a. das breitere Wirkspektrum von Levofloxacin gegenüber älteren Chinolonen mit einer signifikanten Reduktion klinisch dokumentierter Infektionen, der Fieberinzidenz und daraus resultierend auch der Liegedauer, bei einer verhältnismäßig geringen Rate an unerwünschten Nebenwirkungen (Cullen et al. 2005). Als aktives L-Isomer von Ofloxacin verfügt es gegenüber älteren Fluorchinolonen sowohl über ein breiteres Wirksamkeitsspektrum im gramnegativen als auch im grampositiven Bereich (Hughes et al. 2005, Bucaneve et al. 2005) und deckt zudem atypische und intrazelluläre Erreger wie Legionella pneumophilia, Chlamydia und Mycoplasma pneumoniae ab (Lanzafame et al. 2005). Laut Lanzafame und Kollegen (2005) zeichnet sich Levofloxacin außerdem durch eine exzellente und gesteigerte in-vitro Aktivität gegen Anaerobier (z.B. Bacteroides fragilis) sowie gegen multiresistente, (nosokomiale) gramnegative Pathogene (inklusive Extended- 1 EINLEITUNG UND ZIELSETZUNG 5 Spectrum-Beta-Lactamase (ESBL)-Stämme) aus, darunter Erreger wie E. coli, EnterobacterSpezies sowie Klebsiella pneumoniae, von denen 90% bereits bei (in-vitro-) Konzentrationen von 0,5 mg/l gehemmt werden. Daneben zeigte Levofloxacin auch im Vergleich zu Ciprofloxacin eine höhere Wirksamkeit gegen Stenotrophomonas maltophilia sowie gegen grampositive Erreger wie beispielsweise Streptokokken (hierunter insbesondere Streptococcus pneumoniae-Stämme unabhängig ihrer Resistenz oder Sensibilität gegenüber Penicillin und Makroliden) oder Staphylokokken (hierunter v.a. Oxacillin-resistente S. epidermidis- und S. aureus-Stämme) (Lanzafame et al 2005, Gesu et al. 2003, Zhanel et al. 2002). Im Rahmen von in-vivo Experimenten von Fu et al. (1992) erreichte Levofloxacin höhere Gewebs- und Serumkonzentrationen in Mäusen als Ciprofloxacin und zeigte sich, wie bei Lanzafame et al., in-vitro effektiver in seiner Aktivität gegen S. aureus und Pneumokokken. Insgesamt wurden auch hier von Levofloxacin in-vitro bis zu 90%ige Hemmraten von Streptokokken (einschließlich Vertretern der Viridansgruppe) erreicht. Vergleicht man darüber hinaus die unerwünschten Nebenwirkungen mit denen anderer Fluorchinolone, so gehört Levofloxacin mit einer in Untersuchungen beschriebenen Nebenwirkungsrate von 1,8 bis 2% zu denjenigen Vertretern der Chinolone, die eine besonders hohe Verträglichkeit aufweisen. Im Vergleich dazu erreichen andere Fluorchinolone ADR-Raten (Adverse Drug Reaction) von bis zu 10% (Carbon 2001, Croom und Goa 2003, Kahn 2001). Bei Verabreichung einer Levofloxacinprophylaxe konnte eine signifikant bessere subjektive Verträglichkeit gegenüber einer prophylaktischen Einnahme von Ciprofloxacin (plus Phenethicillin) beobachtet werden (Timmers et al. 2007). Als überwiegender Anteil unerwünschter Nebenwirkungen waren bei der Anwendung von Levofloxacin gastrointestinale Störungen zu verzeichnen (Cullen et al. 2005). Diese lassen sich vor allem durch die signifikant stärkere Wirksamkeit von einigen der neueren Chinolone gegen die physiologische anaerobe Darmflora und die dadurch bedingte Abnahme der Kolonisations-Resistenz des Darmes erklären (Kerr et al. 1999, Piddock 1994, Samonis et al. 2005, Baden 2005, Clasener et al. 1987, van der Waaj et al. 1971). Levofloxacin verfügt zudem über ein günstiges pharmakokinetisches Profil mit hoher Bioverfügbarkeit und geringer Proteinbindung, was die lediglich einmal tägliche intravenöse wie auch orale Verabreichung ermöglicht (Croom und Goa 2003, Norrby 1999, Gasink et al. 2006, Zhanel et al. 2002) und somit im Vergleich zu anderen Substanzen gute Voraussetzungen für eine suffiziente Compliance bei prophylaktischer Einnahme schafft. Darüberhinaus wurde bisher nur von wenigen Wechselwirkungen mit anderen Medikamenten berichtet. 1 EINLEITUNG UND ZIELSETZUNG 1.1.5 6 Erkenntnisse aus bisherigen Studien mit Fluorchinolonprophylaxe In mehreren Studien konnte bei der Anwendung einer Fluorchinolonprophylaxe bei neutropenen onkologischen Patienten bereits eine signifikante Reduktion der Inzidenz gramnegativer Bakteriämien und Infektionen sowie der Hospitalisierungsdauer nachgewiesen werden (van de Wetering et al. 2005, Bucaneve et al. 2005, Cullen et al. 2005, Gafter-Gvili et al. 2005, Delarive 2000, Engels et al. 1998, Cruciani et al. 1996). Eine durch Studien von Bucaneve et al. und Cullen et al. (jeweils aus dem Jahr 2005) ergänzte Meta-Analyse von 16 randomisierten und kontrollierten Studien konnte zudem eine effektive Reduktion (RR, 0.37; 95% CI, 0.30-0.46) von grampositiven Infektionen in der Gruppe der Patienten mit Fluorchinolonprophylaxe zeigen (Leibovici et al. 2006). Diese war in erster Linie durch die Abnahme von Infektionen mit Streptokokken und Methicillin-sensiblen Staphyloccocus aureus (MRSA)-Stämmen bedingt. Im Gegensatz zu Meta-Analysen von Cruciani et al. (1996) sowie Engels et al. (1998), in denen kein Nachweis einer Senkung der infektassoziierten Mortalität bei Antibiotikaprophylaxe gelang (kein Überlebens-Vorteil durch Antibiotikaprophylaxe), konnten Gafter-Gvili et al. in einer im Jahr 2005 veröffentlichten Meta-Analyse durch die Auswertung von 55 Studien mit Fluorchinolonprophylaxe (Fluorchinolonprophylaxe vs. keine Prophylaxe bzw. Placebo) neben einer reduzierten Fieberund Infektionsinzidenz eine signifikante Verminderung der infektassoziierten Mortalität um 62% (RR, 0.58; 95% CI, 0.55 – 0.81) zeigen. Dennoch ist und bleibt die routinemäßige Anwendung einer Fluorchinolonprophylaxe, wie sie in einigen klinischen Zentren in Europa (bei 71% von 167 untersuchten hämato-onkologischen Abteilungen in Großbritannien) und den USA bereits seit mehreren Jahren angewendet wird (Ziglam et al. 2005, Reuter et al. 2005, Cullen et al. 2005, Bucaneve et al. 2005, Razonable et al. 2002), nach wie vor umstritten (Hughes et al. 2002, Baden 2005, Freifeld et al 2006, Delarive et al. 2000). Als ein Gegenargument wird von einigen Autoren immer wieder das Risiko der mit dem erhöhten Fluorchinolonverbrauch einhergehenden Zunahme Fluorchinolon-resistenter grampositiver wie gramnegativer Erreger angeführt und damit auch die Zunahme der durch diese verursachten Kolonisationen und Infektionen (Prabhu et al. 2005, Razonable et al. 2002, Pena et al. 1995, Kern et al. 1994, Carratala et al. 1995, Leibovici et al. 2006). Andere Studien wiederum sahen keinen Anhalt für einen schlechten Einfluss auf das klinische Outcome bei einem Anstieg von Fluorchinolon-resistenten Erregern bei Neutropeniepatienten (Pascoe und Cullen 2006, Bucaneve et al. 2005, Gafter-Gvili et al. 2007, Leibovici et al. 2006) bzw. schätzten das vermehrte Auftreten Chinolon-resistenter Stämme, wie beispielsweise 1 EINLEITUNG UND ZIELSETZUNG 7 Streptokokken der Viridansgruppe, als ein durchaus kontrollierbares Problem ein (Timmers GJ et al. 2007). 1.2 Zielsetzung und Fragestellung 1.2.1 Zielsetzung Das Ziel der vorgelegten Arbeit ist die Überprüfung der Effektivität und der Auswirkungen einer Fluorchinolonprophylaxe (mit Levofloxacin, alternativ Ciprofloxacin) auf das klinische Outcome von Neutropeniepatienten in der Hämato-Onkologie des Universitätsklinikums Freiburg sowie ihres potentiellen Einflusses auf eine Resistenzentwicklung. Hierzu wurden prospektiv erfasste Daten von neutropenen Patienten mit Chinolonprophylaxe mit Patientendaten von prophylaxefreien Aufenthalten verglichen. 1.2.2 Fragestellung Die zugrundeliegende Fragestellung ist hierbei, ob auch in dieser Untersuchung in der Kohorte mit Fluorchinolonprophylaxe die bereits in mehreren Studien nachgewiesene Reduktion der Inzidenz von Fieber sowie von gramnegativen Bakteriämien und Infektionen, einschließlich ihrer assoziierten Komplikationen, nachzuweisen ist (van de Wetering et al. 2005, Bucaneve et al. 2005, Cullen et al. 2005, Gafter-Gvili et al. 2005). Des weiteren stellt sich die Frage, ob damit einhergehend auch ein verbessertes klinisches Outcome im Sinne von kürzeren Hospitalisierungszeiten und einer geringeren Rate infektassoziierter Todesfälle zu erzielen ist. Somit wird ein weiteres Augenmerk dieser Arbeit sein, ob durch die Reduktion oben beschriebener Ereignisse ein geringerer Einsatz therapeutischer Antibiotika erreicht werden kann, was folglich einen ökonomischen Vorteil versprechen könnte (Bucaneve et al. 2005). Zudem soll überprüft werden, ob die Einführung der Fluorchinolon-Prophylaxe in der Interventionsphase mit einer Zunahme der Inzidenz Fluorchinolon-resistenter (oder multiresistenter) Erreger einhergeht, ähnlich wie es in zwei diskontinuierlichen Fluorchinolon-Prophylaxe-Studien von Reuter et al. (2005) sowie Kern et al. (2005) zu beobachteten war und damit auf längere Sicht hin eine eventuelle Minderung oder gar Aufhebung des infektpräventiven Effekts zu erwarten wäre (Bucaneve et al. 2005). Die zentrale Fragestellung dieser Arbeit soll folglich sein, ob auch in der Freiburger HämatoOnkologie bei Neutropeniepatienten die Etablierung einer neuen antibiotischen Standardprophylaxe mit Levofloxacin in Anbetracht der Studienergebnisse in Erwägung zu ziehen ist. 2 PATIENTEN UND METHODEN 8 2 PATIENTEN UND METHODEN 2.1 Patienten (Studienpopulation) 2.1.1 Charakterisierung der Untersuchungszeiträume und Patientenkohorten Die vorliegende (beobachtende) Kohortenstudie basiert auf der Erfassung und Auswertung prospektiver Daten von neutropenen Patienten der hämato-onkologischen Abteilung (Medizin I) der Universitätsklinik Freiburg, welche in den beiden Untersuchungszeiträumen 1. Oktober 2004 bis 30. Juni 2005 (Vorphase / 1. Untersuchungsphase) sowie 1. Oktober 2005 bis einschließlich 30. Juni 2006 (Interventionsphase / 2. Untersuchungsphase) eingeschlossen werden konnten. Gemeinsames Merkmal und Haupt-Einschlusskriterium war das Vorliegen einer Neutropenie mit einer Leukozytenzahl von ≤ 1000/µl über einen Mindestzeitraum von zwei Tagen, wobei das Datum des ersten Neutropenietages innerhalb des vorgegebenen Studienzeitraumes liegen musste. Die im Rahmen der neunmonatigen Vorphase eingeschlossenen stationären Aufenthalte waren durch die Abwesenheit einer Fluorchinolonprophylaxe gekennzeichnet. Nach dreimonatiger Erhebungspause schloss sich die Interventionsphase an, welche die Neueinführung einer täglichen Fluorchinolonprophylaxe [1 (2) x 500 mg/d Levofloxacin bzw. in wenigen Fällen alternativ 2 x 500 mg/d Ciprofloxacin] bei neutropenen Patienten der hämato-onkologischen Abteilung beinhaltete. Da in der Interventionsphase, neben der Erfassung von Patientendaten mit Fluorchinolonprophylaxe, weiterhin stationäre Aufenthalte ohne eine solche eingeschlossen und erhoben wurden, lag folglich in diesem Untersuchungszeitraumes bezüglich der An- oder der Abwesenheit einer Fluorchinolonprophylaxe eine Mischkohorte vor. Die Zuordnung der Patientenaufenthalte zur Interventionsphase richtete sich wie in der Vorphase nach dem Zeitpunkt des Neutropeniebeginns. Dieser war in beiden Untersuchungsperioden auch ausschlaggebend für die weitere Zuordnung der stationären Aufenthalte zu dem zu diesem Zeitpunkt vorliegenden Jahresquartal, wodurch zusätzlich eine quartalsbezogene Auswertung der Daten (in aggregierter Form) durchgeführt werden konnte. (s. auch Tabelle 3.1). Zudem garantierte die Einteilung in zwei Aufenthaltskohorten (Fluorchinolonprophylaxe vs. keine Fluorchinolonprophylaxe) eine vom Quartal und Untersuchungszeitraum unabhängige Analyse der Daten (vgl. Tabelle 3.2). 2.1.2 Maligne Grunderkrankung Die Studienpopulation umfasste neben Patienten mit akuten und chronischen Leukämien ebenso Patienten mit Lymphomen oder sonstigen hämatologischen und nicht- 2 PATIENTEN UND METHODEN 9 hämatologischen Neoplasien, zumeist nach unmittelbar vorangegangener Chemotherapie mit oder ohne einer sich anschließenden autologen Peripheren Blutstammzelltransplantation (PBSZT) (s. Tabelle 3.1 und Tabelle 3.2). Das dominierende hämato-onkologische Erkrankungsbild war in jeder Untersuchungskohorte die Akute Leukämie (AL). 2.1.3 Fluorchinolonprophylaxe Um den Kriterien einer möglichst standardisierten Fluorchinolonprophylaxe in der Neutropenie gerecht zu werden, erhielten die Patienten idealerweise bereits zu Beginn ihres stationären Aufenthaltes oder am letzten Tag der Chemotherapie, spätestens aber am ersten Tag ihrer Neutropenie eine tägliche Prophylaxe mit 1(2) x 500 mg/d Levofloxacin (Tavanic®). Neutropene Patienten, welche eine alternative Prophylaxe mit Ciprofloxacin (Ciprobay®) 2x 500 mg/d erhielten, wurden ebenso unter dem Gesichtspunkt der Fluorchinolonprophylaxe eingeschlossen. Das gewünschte Ziel war somit, die Prophylaxe rechtzeitig bei bzw. unmittelbar vor dem erwarteten Eintreten einer Neutropenie zu verabreichen. Bei Auftreten von Fieber (> 38°C) oder anderen ersten klinischen oder laborchemischen Hinweisen für das wahrscheinliche Vorliegen einer Infektkonstellation, erfolgte gemäß der zu diesem Zeitpunkt aktuellen Freiburger hämato-onkologischen Therapierichtlinien das Ansetzen einer empirischen Antibiotikatherapie. In der Regel handelte es sich hierbei initial um das Breitspektrumbetalaktam (BSBL) Piperacillin/Tazobactam (Tazobac®) oder alternativ eine Monotherapie mit Ceftazidim (Fortum®). Ab diesem Zeitpunkt erfolgte eine Pausierung der Fluorchinolonprophylaxe bis eine allmähliche Deeskalation oder Oralisierung der Antibiotikatherapie möglich wurde. Im Rahmen der Suche nach einem verursachenden Infektfokus wurde noch vor der Verabreichung der empirischen Antibiotikatherapie die Abnahme von Blutkulturen (peripher sowie zentralvenös über ZVK oder Port) durchgeführt und nach Ermessen des behandelnden Arztes weitere mikrobiologische Proben bzw. Abstriche gewonnen. Da die studienerprobte Fluorchinolonprophylaxe aus klinischen Erwägungen eingeführt und im Rahmen dieser Arbeit untersucht wurde, war keine spezifische Einwilligung der Patienten erforderlich. Die in der hämato-onkologischen Abteilung übliche Einwilligung der Patienten zur Datenverarbeitung lag vor. 2 PATIENTEN UND METHODEN 2.1.4 10 Einschlusskriterien und Ausschlusskriterien Die Ein- und Ausschlusskriterien wurden in Anlehnung an das Studienprotokoll der Abteilung für medizinische Mikrobiologe und Hygiene der Ulmer Universitätsklinik erstellt. 2.1.4.1 Einschlusskriterien Voraussetzung für die Erfüllung der Einschlusskriterien waren eine Neutropeniedauer des Patienten von mindestens zwei Tagen mit einer absoluten Leukozytenzahl von ≤ 1000 /µl bzw. einer neutrophilen Granulozytenzahl von ≤ 500/µl. Die Definition der Neutropenie orientierte sich hierbei an den Guidelines from the Infectious Diseases Society of America von 1997 (2002). Ebenso war der Aufenthalt auf einer der (hämato-) onkologischen Stationen der Abteilung (Medizin I) der Universitätsklinik Freiburg Voraussetzung für einen Einschluss. Zudem musste eine der in Tabelle 3.1 aufgeführten malignen Grunderkrankungen vorliegen. Eine Neutropeniephase wurde als beendet betrachtet, sobald für mindestens drei Tage eine Leukozytenzahl von > 1000/µl eingetreten war. Jeder erneute Abfall der Leukozyten unter 1000/µl (über eine Mindestdauer von zwei Tagen) wurde, insofern er innerhalb des gleichen Aufenthaltes eintrat, als eine weitere Neutropeniephase auf demselben Datenbogen dokumentiert. Kam es innerhalb der hämato-onkologischen Abteilung aus organisatorischen oder sonstigen Gründen zu einer Verlegung von eingeschlossenen Patienten auf eine andere Station, wurde dies als ein und derselbe stationäre Aufenthalt und Beobachtungszeitraum betrachtet und ausgewertet. Ausnahme stellte die Verlegung des Patienten auf die Knochenmarktransplantation- (KMT-) Station mit der Intention einer allogenen PBSZT dar, welche einem Ausschlusskriterium entsprach. Der stationäre Aufenthalt wurde bei nicht mehr vorhandener Neutropenie mit dem Zeitpunkt der Verlegung als beendet betrachtet und alle Patientendaten nur bis zu diesem Moment erfasst. Das Verlegungsdatum entsprach somit dem Enddatum des stationären Aufenthaltes. War der Patient zum Zeitpunkt der Verlegung auf die KMT-Station neutropen, so wurde er nur dann weiterhin beobachtet, wenn die Neutropenie vor Durchführung der allogenen PBSZT bereits beendet war. 2.1.4.2 Ausschlusskriterien Betrug die Dauer der Neutropenie nur einen Tag, so konnte der Patient nicht eingeschlossen werden. Ebenso entsprachen die Durchführung einer allogenen PBSZT bzw. allogenen KMT während eines aktuellen oder im Rahmen eines vorangegangenen stationären Aufenthaltes einem Ausschlusskriterium. Neutropene Patienten, die nicht auf einer der genannten hämatoonkologischen Stationen lagen, waren von der Studie ausgeschlossen. Hiervon ausgenommen 2 PATIENTEN UND METHODEN 11 waren Patienten, die im Rahmen eines septischen Geschehens oder anderer Komplikationen auf die Intensivstation verlegt werden mussten. Im Falle einer Rückverlegung auf die hämatoonkologische Tagesstation verblieb der Patient in der Studienkohorte. Seine Auswertungsparameter wurden weiterhin auf dem gleichen Datenbogen dokumentiert und als ein Aufenthalt gewertet. Bei Vorliegen einer Autoimmunerkrankung, welche nicht als unmittelbares Sekundärgeschehen im Rahmen der malignen Grunderkrankung zu sehen war, musste ebenfalls ein Ausschluss des Patienten aus der Studienkohorte erfolgen. Aufenthalte, die Ausschlusskriterien erfüllten, wurden in der Auswertung nicht berücksichtigt. 2 PATIENTEN UND METHODEN 12 2.2 Methoden 2.2.1 Datenerfassung Die Datenerfassung erfolgte prospektiv und in standardisierter Form mittels Aktendurchsicht sowie mit Hilfe des im Intranet des Uniklinikums Freiburg verfügbaren Medizinischen Dokumentations- und Informationssystem MeDoc (© 1996-2005 Universitätsklinikum Freiburg), in welchem die aktuellen Patientenbefunde der Diagnostik abrufbar waren. Die erhobenen Daten wurden auf einem Erfassungsbogen dokumentiert, dessen Grundgerüst in Zusammenarbeit mit der Abteilung für medizinische Mikrobiologe und Hygiene der Ulmer Universitätsklinik entworfen wurde und welcher an die Freiburger Rahmenbedingungen adaptiert wurde. Zur Gewährleistung einer datengeschützten Identifizierung und gleichzeitig einer patientenbezogenen Auswertung erhielt jeder Patient bei Einschluss eine ausschließlich ihm zugeordnete Patientennummer, kombiniert mit der aktuellen Aufenthaltsnummer. Letztere begann mit der Ziffer eins und wurde bei jedem weiteren stationären Aufenthalt desselben Patienten in chronologischer Reihenfolge fortgesetzt, insofern es zu einem erneuten Einschluss kam. Die erfassten Patientendaten der eingeschlossenen Aufenthalte wurden mit ihrem aufenthaltsbezogenen Code in eine Datenbank eingegeben, welche ebenso in Zusammenarbeit mit der Ulmer Universitätsklinik konzipiert wurde. Aufgrund des zeitlich früheren Beginns der Datenerhebung und -eingabe im Universitätsklinikum Ulm war die Datenbank zum Zeitpunkt der Freiburger Dateneingabe bereits erprobt. Durch den betreuenden Informatiker, wurden nachträglich einige zusätzliche Freiburg-spezifische Modifikationen an der Datenbank vorgenommen. 2.2.2 Auswertungsparameter (Krankheitsparameter und erhobene Daten) Bei Einschluss eines Patienten wurden folgende Daten im Verlauf des stationären Aufenthaltes dokumentiert: 2.2.2.1 Rekrutierungs- und Anamnesedaten Diese beinhalteten das Patientenalter, die zugrundeliegende maligne Erkrankung mit Erstdiagnose und, falls zutreffend, die Anzahl der Rezidive. Des weiteren wurden die Art der Zytostatikatherapie, wesentliche Begleiterkrankungen sowie die Dauer der Neutropeniephase(n), des stationären Aufenthaltes und der ZVK- wie BDK-Anlagen dokumentiert. Bei Durchführung einer autologen PBSZT wurde diese unter Angabe des Zeitpunktes vermerkt. 2 PATIENTEN UND METHODEN 2.2.2.2 13 Nosokomiale Infektionen in der Neutropenie Die Erfassung nosokomialer Infektionen orientierte sich an den allgemein anerkannten Definitionen der Centers for Disease Control and Prevention (CDC), Atlanta, USA (s. Anhang). Diesen Kriterien sowie vergleichbaren Studien zufolge lag dann eine nosokomiale Infektion vor, wenn diese weder bereits bei Aufnahme des Patienten vorhanden war, noch sich zu diesem Zeitpunkt in der Inkubationsphase befand und daher nicht vor Ablauf der ersten 48 Stunden nach Aufnahme in Erscheinung trat (Escande et Herbrecht 1998). Eine Infektion galt ab dem Datum als evident, an dem alle, gemäß den CDC-Definitionen erforderlichen Kriterien einer Infektion vorlagen. Eine Kolonisation, d.h. die Anwesenheit von Erregern auf Haut, Schleimhaut, offenen Wunden, in Ex- oder Sekreten, ohne das Vorhandensein klinischer Symptome, wurde hierbei nicht als Infektion betrachtet (www.nrzhygiene.de). Ebenso wurden erhöhte bzw. auffällige Infektparameter mit Angabe des zugehörigen Datums erfasst. Bei einem Anstieg des C-Reaktiven-Protein (CRP)-Wertes über 5 mg/l wurde das Datum des Erstanstiegs vermerkt. Die Dokumentation des Fiebers in der Neutropenie erfolgte bei einem Anstieg über 38°C unter Angabe der Maximaltemperatur und der Dauer in Form der Eckdaten. Lag im Sinne der CDC-Definitionen der dringende Verdacht auf das Vorliegen einer nosokomialen Infektion oder auf eine mikrobiologisch gesicherte oder rein klinische Sepsis bzw. Bakteriämie vor, so wurden diese ab dem zweiten Tag der Neutropenie bis einschließlich dem zweiten Tag nach Ende der Neutropeniephase erfasst. Fieber und andere Infektionsparameter wurden im gleichen Zeitfenster dokumentiert, ausgenommen das Datum des CRP-Anstiegs über einen Wert von 5 mg/l, welches auch außerhalb der Neutropenie dokumentiert wurde. 2.2.2.3 Antiinfektiva Daten zur antibiotischen, antiviralen und antimykotischen Prophylaxe und Therapie wurden über den gesamten stationären Aufenthalt hinweg, also auch außerhalb der Neutropeniephasen, dokumentiert. Dies erfolgte jeweils unter Angabe der Tagesdosen in mg und des Verabreichungszeitraumes. Neben der antibiotischen Prophylaxe mit Fluorchinolonen wurden ebenso die Verbrauchsdaten anderer antibiotischer Prophylaxeformen, wie die Pneumocystis carinii-Pneumonie (PCP-Prophylaxe mit Cotrimoxazol (alternativ Daraprim/Dapson) sowie die antituberkulöse (Reaktivierungs-)Prophylaxe mit Isoniazid (300 mg/d), dokumentiert. Darüber hinaus erfolgte in gleicher Vorgehensweise die Erfassung der 2 PATIENTEN UND METHODEN 14 Therapiedaten mit Granulozyten-Kolonie-stimulierendem-Faktor (G-CSF), wobei es sich in erster Linie um Neupogen® handelte. 2.2.2.4 Clinical Outcome Unter dem Gesichtspunkt Clinical Outcome wurden folgende Daten, wenn zutreffend, erfasst: • Gramnegative Sepsis/Bakteriämie mit Datum • Verlegung unter Angabe des Datums, Ortes, und Verlegungsgrundes und, ob der Patient zum Zeitpunkt der Verlegung neutropen war • Liegedauer in Form der Eckdaten des stationären Aufenthaltes mit der Information, ob der Patient zu diesem Zeitpunkt per Definition (s.o.) noch neutropen war • Falls eingetreten, Angabe des Todeszeitpunkts sowie der Todesart (infektassoziiert oder als Folge der malignen Grund- oder einer anderen zugrunde liegenden Erkrankung) 2.2.2.5 Mikrobiologische Befunde Hierunter wurden alle in der Neutropenie gewonnen positiven Proben mit potentiell pathologischer Flora/Erregertyp erfasst. Dies erfolgte unter Angabe der Materialnummer, der Lokalisation sowie des Datums der Probengewinnung. Zusätzlich wurde das zugehörige Antibiogramm dokumentiert, falls ein solches durchgeführt wurde. Mikrobiologische Befunde wurden, wie Infektionen, lediglich innerhalb der Neutropeniephase erfasst. Bei der Beurteilung für das Vorliegen einer Bakteriämie bzw. Sepsis wurden die CDCDefinitionen für Sepsis (B1 - Durch Labor bestätigte Sepsis, s. Anhang) nur eingeschränkt angewandt. Das Nebenkriterium „gewöhnlicher Hautkeim wurde in Blutkultur bei einem Patienten mit intravaskulärem Fremdkörper isoliert, und Arzt beginnt entsprechende antimikrobielle Therapie“ wurde in dieser Untersuchung als nicht hinreichend für das Vorliegen einer Sepsis bzw. Bakteriämie bewertet, ausgenommen es lag neben einem positiv getesteten Blutkulturen-Set noch zusätzlich ein positiver Nachweis von >15 Kolonien im Bereich der ZVK-Spitze im Sinne einer Katheter-assoziierten Sepsis vor. Hierbei musste es sich jedoch um denselben Erreger mit identischem Resistenzmuster handeln. Andernfalls musste ein sogenannter „Hautkeim“ [KNS oder Saprophyten, wie Corynebakterien, Proprionibakterien (Buchheidt et al. 2003 und 2000, Link et al. 2003) sowie Bazillus-Spezies (Weinstein 2003)] in mindestens zwei Blutkulturen-Sets mit gleichem Resistenzmuster nachzuweisen sein, um von einer signifikanten Bakteriämie ausgehen zu können (Cherif et al. 2003 sowie erstes Nebenkriterium der zweiten CDC-Definition für Sepsis, s. Anhang). Ein 2 PATIENTEN UND METHODEN 15 Blutkulturen-Set bestand in der Regel aus zwei aeroben und einem anaeroben BlutkulturRöhrchen, deren Blut aus ein und derselben Entnahmestelle gewonnen wurde. Bei Nachweis eines oben genannten „Hautkeims“ in lediglich einem Blutkultur-Set, wurde von einer Kontamination der Blutkultur mit einem grampositiven Erreger ausgegangen (Cherif et al. 2003, Link et al. 2003). Diese potentiell kontaminierten Blutkulturen wurden separat vermerkt und ausgewertet. Die Isolation von gramnegativen Erregern sowie von allen übrigen grampositiven Erreger-Spezies (z.B. Enterokokken) in nur einem Blutkulturen-Set war hingegen hinreichend für die Wertung als signifikante Bakteriämie (gemäß Punkt eins der CDC-Definition einer Sepsis sowie Cherif et al. 2003). Im Gegensatz zu den Kriterien der CDC wurde in dieser Studie auf eine Differenzierung zwischen primärer und sekundärer Sepsis verzichtet. 2.2.3 Statistische Analyse Als Grundlage für die Datenerfassung und die statistische Auswertung diente eine Datenbank, welche in Zusammenarbeit mit der Abteilung Mikrobiologie der Universität Ulm konzipiert und programmiert wurde. Nach Export der Daten im CSV-Dateiformat erfolgte zunächst die Basis-Auswertung mit Hilfe des Tabellenkalkulationsprogrammes Excel (Microsoft®). Die weiterführende Datenverarbeitung und Analyse fand unter Anwendung des Statistikprogrammes SPSS® (Version 13.0) statt. Da in dieser Arbeit oftmals nur geringe Absolutwerte bzw. Fallzahlen vorlagen, wurde einer rein deskriptiven Datendarstellung der Vorzug gegeben. 2.2.3.1 Endpunkte Die Auswertung der Patientendaten aus beiden Untersuchungsphasen (Vor- und Interventionsphase) erfolgte zum einen quartalsweise, d.h. in Form aggregierter Datensätze. Hierbei war das Datum des Neutropeniebeginns ausschlaggebend für die Zugehörigkeit des Aufenthaltes zur entsprechenden Dreimonatsperiode (Jahres-Quartal). Zum anderen wurde durch eine zusätzliche Unterteilung aller in der Vor- und Interventionsphase erfassten Aufenthalte (n= 375) in zwei Kohorten (Aufenthalte mit vs. ohne Fluorchinolonprophylaxe) ein von den Quartalen- und der Untersuchungsphase unabhängiger Datenvergleich gewährleistet. Diese alternative Art der Datendarstellung und -analyse wurde nicht zuletzt aufgrund der in der initialen Interventionsphase eher zurückhaltenden Anwendung der Fluorchinolon-Prophylaxe gewählt. Die Kohorte mit Fluorchinolonprophylaxe umfasste hierbei 103, ausschließlich in der Interventionsphase eingeschlossene, stationäre Aufenthalte. 2 PATIENTEN UND METHODEN Die diesbezüglich prophylaxefreie 16 Kohorte beinhaltete 254, aus der Vor- und Interventionsphase stammende, stationäre Aufenthalte. Primäre Endpunkte der statistischen Datenanalyse waren neben den Inzidenzraten von Bakteriämien sowie von mikrobiologisch dokumentierten Infektionen (insbesondere solche gramnegativen Ursprungs) ebenso die Inzidenz fiebriger Neutropeniephasen. Weitere Endpunkte der Auswertung stellten Infektkomplikationen, wie etwa schwere septische Konstellationen mit erforderlicher Verlegung auf die Intensivstation sowie die Rate infektassoziierter Todesfälle dar. Zudem erfolgte die Analyse der Prävalenzraten Fluorchinolon-resistenter Erreger sowie die Anwendungsdichten therapeutischer und prophylaktischer Antibiotika in beiden Untersuchungsperioden. 2.2.3.2 Auswertung des Antibiotikaverbrauches Die Berechnung der Antibiotika-Anwendungsdichten (Therapie und Prophylaxe) erfolgte in den Einheiten Defined Daily Doses (DDD), Recommended Daily Doses (RDD) sowie Prescribed Daily Doses (PDD), wobei sich diese jeweils auf 100 Pflegetage (PT) beziehen. Die Einheit DDD basiert auf den Guidelines for Anatomical Therapeutical Clinical (ATC) classification and DDD assignment of the WHO Collaboration Centre for Drug Statistics Methodology (WHO 2007). Die DDD werden als angenommene mittlere TagesErhaltungsdosis für die Hauptindikation eines Arzneimittels beim Erwachsenen definiert und in einem jährlich gegengeprüften ATC-Index der WHO (www.whocc.no) für jeden antibiotischen Wirkstoff festgelegt. Da es sich bei diesen Werten um rein rechnerische Größen handelt, entsprechen diese nicht zwangsläufig der empfohlenen Dosierung (RDD) oder den tatsächlich angewendeten bzw. verschriebenen Tagesdosen eines Arzneimittels (PDD). Dadurch kann die Anwendung der Einheit DDD zu einer Überschätzung des tatsächlichen Antibiotikaverbrauches führen (Kern et al. 2004, de With 2005). Dennoch ermöglicht gerade die Einheit DDD/100 PT eine regionale wie auch internationale Vergleichbarkeit des Antibiotikaverbrauches (www.whocc.no, de With 2005). Diese Arbeit beschränkte sich bei der vergleichenden Darstellung und Analyse des Antibiotikaverbrauches vor allem auf die Darstellung der Anwendungsdichten in Form von RDD pro 100 PT. Die RDD entsprechen den empfolenden Tagesdosen und werden durch den sog. MABUSE (Medical AntiBiotic Use, Surveillance and Evaluation)-Index festgelegt. Dieser basiert auf den „Leitlinien Antimikrobielle Therapie und Prophylaxe“ der Arzneimittelkommission des Universitätsklinikums Ulm (6. Auflage, 1999) und orientiert sich 2 PATIENTEN UND METHODEN 17 an den lokalen Verschreibungsgewohnheiten und -leitlinien von Universitätskliniken (de With 2005, Kern et al. 2004). Zu beachten ist hierbei jedoch die Tatsache, dass in den bislang zu diesem Thema publizierten Arbeiten noch die Bezeichnung PDD anstelle der bei uns eingesetzten RDD verwendet wurde. Da bei der in dieser Arbeit bevorzugten Auswertungsform RDD/100 PT die tatsächlich verschriebenen Tagesdosen (PDD) in ein rechnerisches Verhältnis mit den empfohlenen (MABUSE-) RDD gesetzt werden, lassen die Ergebnisse insgesamt auch eine ökonomische Analyse des Antibiotikaeinsatzes zu. Die Verbrauchsanalyse in Form von PDD/100 Pflegetage ist im Gegensatz zu den beiden anderen Rechengrößen in der Lage eine Patienten- bzw. eine aufenthaltsbezogene Auswertung der antibiotischen Anwendungsdichten zu ermöglichen, da - unabhängig von der Höhe der verabreichten Dosis - lediglich die Verabreichungsdauer des Antibiotikums in die Berechnung der Anwendungsdichte einfließt. Die PDD entspricht der tatsächlich verabreichten Tagesdosis eines Patienten und somit derjenigen Größe, die im Rahmen unserer Datenerhebung dokumentiert wurde. Bei der Auswertung und Darstellung der Antibiotika-Wirkstoffklassen wurde die in einer Arbeit von de With (2005) dargelegte indikations- und wirkspektrumgerechte Einteilung der antimikrobiellen Substanzen nach Antibiotikaklassen, -subklassen und -gruppen (sog. MABUSE-Klassifikation) übernommen. 3 ERGEBNISSE 18 3 ERGEBNISSE 3.1 Patientencharakteristika 3.1.1 Maligne Grunderkrankungen Im Rahmen der Vorphase wurden insgesamt 69 (37%) stationäre Aufenthalte mit einer zugrundeliegenden akuten Leukämie (AL) eingeschlossen. Diese umfasste neben dem Erkrankungsbild der Akuten Myeloischen Leukämie (AML) und der Akuten Lymphatischen Leukämie (ALL) ebenso die Prolymphozyten-Leukämie (PLL) sowie die (Akute) Promyelozyten-Leukämie (APL, auch PML genannt). Bei quartalsbezogener Auswertung dieses prophylaxefreien Untersuchungszeitraumes reichte der Anteil akuter Leukämien in den Kohorten der einzelnen Dreimonatszeiträumen von 34 bis einschließlich 43% (Tabelle 3.1 sowie Abb. 3-2). UNTERSUCHUNGSPHASE 1 (U1) UNTERSUCHUNGSPHASE 2 (U2) VORPHASE / BASELINE INTERVENTIONSPHASE/ Quartal 4 / 2004 Quartal 1 / 2005 Quartal 2 / 2005 Quartal 4 / 2005 Quartal / 2006 Quartal 2 / 2006 Stationäre Aufenthalte Akute Leukämien AML ALL PLL, APL (=PML) MDS Chron. Leukämien CLL CML Plasmozytom/ MM Morbus Hodgkin NHL (total) NHL (ohne MZL) MZL Haarzell-Leukämie Sonstige Neoplasien KZT Hochdosis-Chemotherapie Autologe PBSZT N (%) N (%) N (%) N (%) N (%) N (%) 49 (100) 21 (43) 17 4 0 3 (6) 1 0 1 8 (16) 0 10 (20) 8 2 0 5(10) 1 19 (39) 16 (33) 68 (100) 23 (34) 18 5 0 0 1 0 1 15 (22) 4(6) 22 (32) 20 2 0 1 (1) 2 30 (44) 16 (24) 68 (100) 25 (37) 19 6 0 2 (3) 3 2 1 11 (16) 3 (4) 20 (30) 18 2 0 4 (6) 0 28 (41) 16 (24) 66 (100) 23 (35) 16 6 1 0 0 0 0 19 (29) 0 17 (26) 14 3 0 5(8) 2 40 (61) 26 (40) 58 (100) 23 (40) 16 4 3 0 1 0 1 10 (17) 0 11 (19) 11 0 2 4(7) 7 35 (62) 14 (24) 48 (100) 22(46) 18 4 0 1 (2) 0 0 0 7 (15) 1 (9) 14 (29) 12 2 0 2 (4) 1 25 (52) 18 (38) Tabelle 3.1: Patientencharakteristika der Vor- und Interventionsphase. Darstellung in Form aggregierter Daten (quartalsweise). Anmerkung: Keine Datenerfassung Untersuchungszeiträumen. im Quartal 3/2005 als Übergangsphase zwischen beiden Abkürzungen: AML= Akute myeloische Leukämie; ALL=Akute lymphatische Leukämie; APL= Akute Promyelozyten-Leukämie(=PML), PLL= Prolymphozyten-Leukämie; MDS= Myelodysplastisches Syndrom; CLL= Chronische lymphatische Leukämie; CML= Chronische myeloische Leukämie; HZL= HaarzellLeukämie; NHL= Non-Hodgkin-Lymphom; MM= Multiples Myelom; MZL= Mantelzell-Lymphom; KZT= Keimzelltumor(en); PBSZT= Periphere Blutstammzelltransplantation. 3 ERGEBNISSE 19 In der sich nach dreimonatiger Erhebungspause anschließenden Interventionsphase lagen bei 68 (40%) der insgesamt 172 Aufenthalte eine AL vor. Nach Dreimonatsphasen aufgeschlüsselt wurde in den Quartalen 4/2005, 1/2006 sowie 2/2006 bei 35, 40, sowie 46% der Aufenthalte eine AL als zugrundeliegende Erkrankung registriert (s. Tabelle 3.1). Abb. 3-3 sowie Tabelle 3.2 geben zudem einen quartalsunabhängigen Überblick über die Häufigkeitsverteilung maligner Grunderkrankungen im gesamten Studienzeitraum, indem sie die Fluorchinolonprophylaxe erhaltenden Aufenthalte (n=103) der Interventionsphase und die prophylaxefreien Aufenthalte (n=254) aus Vor- und Interventionsperiode einander gegenüber stellen. Bei dieser Art des Datenvergleiches zeigte sich unter anderem, dass die ProphylaxeKohorte mit 49 (48%) von 103 Aufenthalten den größeren Anteil an AL aufzuweisen hatte. In der Aufenthaltskohorte ohne prophylaktische Chinolone lag im Vergleich hierzu in 35% (88 von 254 Aufenthalten) der Fälle eine AL als hämato-onkologische Grunderkrankung vor (Abb. 3-1 sowie Tabelle 3.1). Fluorchinolon-Prophylaxe Keine Fluorchinolon-Prophylaxe Interventionsphase n (%) Interventions- und Vorphase n (%) 103 (100) 254 (100) Levofloxacin-Prophylaxe 92 (89) 0 Ciprofloxacin-Prophylaxe 11 (11) 0 Akute Leukämien Stationäre Aufenthalte 49 (48) 88 (35) AML 35 69 ALL 12 17 PLL, APL(=PML) 2 2 0 6(2) 0 6(2) 0 2 MDS Chron. Leukämien CLL CML Plasmozytom/ MM 0 4 11 (11) 59 (23) 1 (1) 7 (3) 27 (26) 67 (26) NHL (ohne MZL) 23 60 MZL 4 7 Morbus Hodgkin NHL (total) Haarzell-Leukämie 1 (1) 1 (0) Sonstige Neoplasien 4 (4) 17 (7) KZT 10 (10) 3 (1) Hochdosis-Chemotherapie 66 (64) 111 (44) autologe PBSZT 33 (32) 70 (28) Tabelle 3.2: Patientencharakteristika aus Vor- und Interventionsphase im quartalsunabhängigen Zweikohorten-Vergleich. Ein Non-Hodgkin-Lymphom (ohne Miteinbeziehung des Multiplen Myeloms) war in der Fluorchinolonprophylaxe erhaltenden Aufenthaltskohorte mit 26% ebenso häufig vertreten wie unter den Aufenthalten ohne eine Prophylaxe dieser Art (Abb. 3-3 sowie Tabelle 3.2). 3 ERGEBNISSE 20 Morbus Hodgkin-Erkrankungen traten innerhalb der prophylaxefreien Vorphase lediglich bei zwei der drei Dreimonatskohorten in Erscheinung. Im Quartal 1/2005 machte diese Erkrankung 6% (4 von 68) der Aufenthalte aus, im Quartal 2/2005 lag diese 3 (4%) von 68 Aufenthalten zugrunde. Das erste Quartal der Vorphase (4/2004) und die ersten beiden Quartale der Interventionsphase wiesen keine Patienten mit einer Morbus Hodgkin- A k u te L e u k ä m ie n (A L L , A M L , P L L , P M L ) 60 F Q -P r o p h y la x e n 1 0 3 50 K e in e F Q -P r o p h y la x e n254 40 % 30 20 10 0 Abb. 3-1: Inzidenzrate (%) der Akuten Leukämie im Zwei-Kohortenvergleich Erkrankung auf. In der Interventionsperiode wurde lediglich 1(2%) Aufenthalt von 49 mit einem Morbus Hodgkin als maligne Grunderkrankung eingeschlossen, wobei dieser der Aufenthaltskohorte des letzten Dreimonatszeitraums (Quartal 2/2006) angehörte. Die relative Häufigkeit des Plasmozytoms (gleichbedeutend dem Multiplen Myelom) schwankte in den Dreimonatsphasen der Vorphase zwischen 16 und 22%, bezogen auf die Gesamtzahl der pro Quartal beobachteten Aufenthalte. Im Vergleich hierzu ergab sich für die A k u te L e u k ä m ie n (A M L , A L L , P L L , P M L ) Anteil der Aufenthalte 5 0 % 4 0 % 3 0 % 2 0 % 1 0 % Q 4 /0 4 Q 1 /0 5 Q 2 /0 5 Q 4 /0 5 Q 1 /0 6 Q 2 /0 6 Abb. 3-2: Anteil der Aufenthalte (%) mit Akuter Leukämie (AL) im quartalsabhängigen Vergleich; Schraffierte Säulen entsprechen den AL-Raten in den Quartalen der Interventionsphase 3 ERGEBNISSE 21 Quartale der Interventionsphase eine von 15 bis maximal 29% reichende PlasmozytomInzidenz (Tabelle 3.1). In der Aufenthaltskohorte mit prophylaktischer FluorchinolonAnwendung war diese mit 11% nur halb so hoch wie in der prophylaxefreien Kohorte (Tabelle 3.2, Abb. 3-3). Insgesamt lagen 10 (10%) der 103 Chinolon-prophylaktisch behandelten Aufenthalte ein maligner Keimzelltumor zugrunde. In der interventionsfreien Kohorte erreichte die Inzidenz dieser Erkrankung mit 3 von 254 Aufenthalten hingegen lediglich einen Prozent. Die Häufigkeitsverteilung weiterer maligner Grunderkrankungen sind Tabelle 3.1, Abb. 3-3 sowie Tabelle 3.2 zu entnehmen. 3.1.2 Autologe Blutstammzelltransplantation und Hochdosis-Chemotherapie In der Fluorchinolonprophylaxe-Kohorte wurden 32% der Aufenthalte (33 von 103) bei diesem oder einem der vorangegangen Aufenthalte einer autologen peripheren Stammzelltransplantation unterzogen. Die prophylaxefreie Aufenthaltskohorte lag mit 70 (28%) von 254 betroffenen Aufenthalten diesbezüglich nur geringfügig darunter. Bei 66 (64%) der 103 Prophylaxe erhaltenden Aufenthalte wurde eine Hochdosis-Chemotherapie durchgeführt. Mit 44% erwies sich der Anteil an Aufenthalten mit hochdosierter Chemotherapie im prophylaxefreien Aufenthalts-Kollektiv (n=254) als (deutlich) kleiner (Tabelle 3.2). Entsprechend lag auch in den Quartalen der Interventionsphase (d.h. mit Einführung der Fluorchinolonprophylaxe) die Rate an Aufenthalten mit HochdosisChemotherapie über jener der Vorphasen-Quartale (Tabelle 3.1). Maligne Grunderkrankungen HZL relative Häufigkeitsverteilung KZT 100% 10% 7% Sonstige Neoplasien Anteil der Aufenthalte 4% 80% MDS 26% 26% MHOD 60% CL (total) 35% 40% 48% NHL (inklusive MZL) AL (total) 20% 23% PLAM (MM) 11% 0% FQ-Prophylaxe n103 keine FQ-Prophylaxe n254 Abb. 3-3: Häufigkeitsverteilung der malignen Grunderkrankungen Altersverteilung 3 ERGEBNISSE 22 Über die Quartale beider Untersuchungsphasen verteilt schwankte der Altersdurchschnitt der den Aufenthalten zugehörigen Patienten zwischen 51 und 57 Jahren (vgl. Tabelle 3.3), wobei das erste Quartal der Vorphase sowie die letzten beiden Quartale nach Prophylaxeeinführung (Interventionsphase) mit 51 Jahren den geringsten Altersdurchschnitt zeigten. Auffallend war das mit 75 bzw. 73 Jahren geringere Höchstalter der im vorletzten bzw. letzten Dreimonatszeitraum der Interventionsperiode eingeschlossenen Patienten. Dieses rangierte in den übrigen Quartalen der Vor- und Interventionsphase zwischen einschließlich 81 und 83 Jahren. Wie Tabelle 3.4 zeigt, lag der Altersdurchschnitt der Fluorchinolonprophylaxe erhaltenden Kohorte mit 49 Jahren (deutlich) unter dem der prophylaxefreien Aufenthaltskohorte (56 Jahre). Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 Quartal 2/06 n49 n68 N68 n66 n58 n48 Männlich 29 (59) 42 (62) 38 (56) 39 (59) 32 (55) 34 (71) Weiblich 20 (41) 26 (38) 30 (44) 27 (41) 26 (45) 14 (29) MEAN 51 54 56 57 51 51 MIN 19 19 18 20 20 20 MAX 81 82 83 83 75 73 Geschlecht n (%) Alter (Jahre) Tabelle 3.3: Geschlechter- und Altersverteilung (quartalsweise analysiert) Geschlecht n (%) FQ-Prophylaxe n103 Keine FQPx n254 Interventionsphase Interventions- und Vorphase Männlich 63 (61) 151 (60) Weiblich 40 (39) 103 (41) 49 56 Alter (Jahre) MEAN MIN 20 18 MAX 79 83 Tabelle 3.4: Geschlechter- und Altersverteilung im quartalsunabhängigen Vergleich Abkürzungen: FQ= Fluorchinolon, MIN= Minimum, MAX= Maximum, MEAN= Mittelwert. Bezüglich des Mindestalters unterschieden sich beide Gruppen lediglich um 2 Jahre (20 versus 18 Jahre), das maximale Alter belief sich in der Prophylaxegruppe auf 79, in der interventionsfreien Kohorte auf 83 Jahre (Tabelle 3.4). 3 ERGEBNISSE 23 100 80 83 79 60 M IN M EAN M AX 56 40 49 20 0 18 20 FQ-Prophylaxe n103 Keine FQ-Prophylaxe n254 Abb. 3-4: Aufenthaltsbezogenes Alter im quartalsunabhängigen Vergleich. 3.1.3 Geschlechterverteilung Das gerundete Verhältnis von Aufenthalten männlicher Patienten zu jenen weiblicher Patienten lag in den einzelnen Quartalen beider Untersuchungsphasen nahezu konstant bei etwa Geschlechterverteilung Lediglich im letzten Quartal der 80 (02/2006) nahm 60 Aufenthalten mit männlichen Patienten 40 gegenüber weiblichen (29%) um etwa 20 10% 100 Aufenthhalte (%) 1,5:1. auf 71% Interventionsphase der zu. quartalsunabhängigem 0 Q4/04 Q1/05 Q2/05 Männlich Q4/05 Q1/06 Anteil Auch an im Vergleich Q2/06 Weiblich zeigte sich sowohl bei der Prophylaxeals auch bei der prophylaxefreien Abb. 3-5: Verhältnis der Aufenthalte männlicher zu Aufenthalten weiblicher Patienten in der quartalsbezogenen Darstellung. Kohorte ein fast identisches Verhältnis Interventionsphasen-Quartale schraffiert. Geschlecht von ca. 1,5:1 (Abb. 3-6). von männlichem zum weiblichen 3 ERGEBNISSE 24 3.2 Neutropenie: Dauer und Anzahl der Phasen In der prophylaxefreien ersten Untersuchungsphase verteilten sich insgesamt 200 Neutropeniephasen auf 185 Aufenthalte, wobei sich bei 13 stationären Aufenthalten mehr als eine Neutropeniephase im Rahmen ein und desselben stationären Aufenthaltes G e s c h le c h t e r v e r t e ilu n g 1 20 W e ib lic h Aufenthalte ( %) ereignete. M ä n n lic h 1 00 39 80 41 60 In der nachfolgenden Interventionsphase wurden Aufenthalten Neutropeniephasen 184 bei 172 registriert. 40 61 60 20 Abb. 3-6: Quartalsunabhängiger Vergleich der Geschlechterverteilung 0 F Q - P r o p h y la x e n 103 K e in e F Q P r o p h y la x e n 2 5 4 Hierbei war es in der Summe in 11 Fällen zu mehreren Neutropeniephasen während ein und desselben Liegezeitraums gekommen. In den Quartalen der Vorphase ereignete sich bei durchschnittlich 7,3% der stationären Aufenthalte mehr als eine Neutropenieepisode, in den Dreimonatszeiträumen der Interventionsphase im Mittel bei 6,2% (Tabelle 3.6). In beiden Untersuchungszeiträumen war im jeweils ersten Quartal (4/2004 sowie 4/2005) die höchste Rate an Aufenthalten mit mehr als einer Neutropeniephase zu beobachten (10,2% versus 9,1%). Neutropeniephase(n)/ Aufenthalt : Keine FQPx n254 Interventionsphase Interventions- und Vorphase 1 n (%) 95 (92) 238 (90) 2 7 14 3 ∑ FQ-Prophylaxe n103 >1 n (%)* 1 2 8 (7,8) 16 (6,3) 12 10 Neutropeniedauer/Aufenthalt (d): MEAN MIN 2 2 MAX 43 51 G-CSF-Therapie n (%) 83 (81) 203 (80) Tabelle 3.5: Quartalsunabhängiger Vergleich der Aufenthaltskohorten mit und ohne Fluorchinolonprophylaxe bezüglich Anzahl der Neutropeniephasen, Neutropeniedauer sowie Häufigkeit der Therapie mit Granulozyten-Koloniestimulierender-Faktor (G-CSF) Anmerkung: (*) entspricht der Summe der Aufenthalte mit >1 Neutropeniephase pro Aufenthalt 3 ERGEBNISSE 25 Auch hinsichtlich der minimalen und maximalen Neutropeniedauer unterschieden sich die einzelnen Quartale von Vor- und Interventionsphase nur geringfügig voneinander (Tabelle 3.6 sowie Abb. 3-7). Im quartalsunabhängigen Vergleich von Fluorchinolonprophylaxe- und prophylaxefreier Kohorte lagen in ersterer bei 7,8%, in letzterer bei 6,3% der Aufenthalte mehrfach neutropene Episoden vor (Tabelle 3.5). Neutropeniephase Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 Quartal 2/06 (n) / Aufenthalt: n49 n68 n68 n66 n58 n48 1 n (%) 44 (90) 64 (94) 64 (94) 60 (91) 55 (95) 46 (96) 2 4 4 3 6 2 2 3 ∑ >1 n (%) 1 0 1 0 1 0 5 (10,2) 4 (5,9) 4 (5,9) 6 (9,1) 3 (5,2) 2( 4,2) 7,3% MEAN 6,2% Neutropeniedauer/ Aufenthalt (d): 11 MEAN 8 9 12 11 11 MIN 3 2 2 2 2 3 MAX 38 37 34 51 41 32 G-CSF-Therapie 41 (84) 57 (84) 48 (71) 57 (86) 48 (83) 35 (73) Tabelle 3.6: Anzahl der Neutropeniephasen, Neutropeniedauer sowie Häufigkeit der Therapie mit Granulozyten-Kolonie-stimulierender-Faktor (G-CSF) in der quartalsabhängigen Auswertung. Die maximal während eines prophylaxefreien Aufenthaltes erreichte Neutropeniedauer lag bei 51 Tagen und somit 8 Tage über der Neutropenie-Höchstdauer, welche im Rahmen von Aufenthalten mit prophylaktischer Fluorchinolongabe dokumentiert wurde (Abb. 3-8, Tabelle 3.5). Bei quartalsbezogener Betrachtung der maximalen Neutropeniedauer hob sich insbesondere das erste Quartal der Interventionsphase (Quartal 4/2005) (aufgrund der 51 Neutropenietage des bereits erwähnten prophylaxefreien Aufenthaltes) von den übrigen Quartalen beider Untersuchungszeiträume ab (Abb. 3-7), bei welchen die Spannbreite der höchsten Neutropeniedauer zwischen 32 und 41 Tagen lag. Die minimale Neutropeniedauer betrug in den Dreimonatszeiträumen beider Untersuchungsphasen 2 bis 3 Tage. Aufgrund der geltenden Einschlusskriterien war eine Mindest-Neutropeniedauer (aufeinanderfolgenden) Tagen erforderlich und somit kein kleinerer Wert möglich. von 2 3 ERGEBNISSE 26 60 MEAN 6 0 50 MAX 40 30 20 51 Neutropeniedauer [d] Neutropeniedauer [d] MIN 50 F Q - P r o p h y l a x e N °1 0 3 43 4 0 k e ine FQ- P r ophy la x e N °2 5 4 3 0 2 0 12 10 10 10 2 0 2 0 Q4/04 Q1/05 Q2/05 Q4/05 Q1/06 Q2/06 Abb. 3-7: Neutropeniedauer pro Aufenthalt [d], quartalsweise dargestellt M E AN M IN M AX Abb. 3-8: Neutropeniedauer pro Aufenthalt [d], quartalsunabhängiger Vergleich. 3.3 Granulopoese-stimulierende Therapie Der Anteil der stationären Aufenthalte, bei welchen eine Therapie mit G-CSF durchgeführt wurde, lag in den Quartalen der Vorphase bei durchschnittlich 79,4%, in denen der Interventionsphase bei 80,6%. Wie Tabelle 3.5 zeigt, war auch bei unmittelbarem Vergleich der beiden Kohorten (Fluorchinolonprophylaxe versus keine Intervention) bezüglich der GCSF Therapie kein wesentlicher Unterschied feststellbar (81 versus 80% der Aufenthalte mit G-CSF). 3 ERGEBNISSE 27 3.4 Antiinfektiva 3.4.1 Fluorchinolonprophylaxe Im Rahmen der Interventionsphase erhielten insgesamt 103 (60%) der 172 Aufenthalte eine Fluorchinolonprophylaxe. Bei 11 dieser 103 Fluorchinolonprophylaxe 100 % Fälle wurde anstelle von Levofloxacin Q4 / 0 5 Ciprofloxacin (2x500 mg/d) als Prophylaxe Q 1/ 0 6 75 % verabreicht (Tabelle 3.11). Lag im ersten Q2 / 0 6 50 % Quartal (4/2005) der Interventionsphase der 77% 64% 25 % 44% Anteil an stationären Aufenthalten mit einer Fluorchinolonprophylaxe bei lediglich 44% (29 0% Quar t al e der I nt er v ent i onspha se Abb. 3-9: Vergleich der Interventionsphasenquartale bezüglich dem Anteil der Aufenthalte [%] mit Fluorchinolonprophylaxe von 66), so stieg dieser mit 64% (37 von 58) im Folgequartal (1/2006) und 77% (37 von 48) im letzten Quartal (2/2006) kontinuierlich im Verlauf der Interventionsphase an (Abb. 3-9). Der therapeutische und prophylaktische Fluorchinolon-Verbrauch betrug in der Prophylaxekohorte insgesamt 50,2 RDD/100 PT, in der Aufenthalts-Kohorte ohne prophylaktische Fluorchinolone 6,8 (Tabelle 3.11). 3.4.2 Antibiotikaverbrauch Q1/2005 Q2/2005 Q4/2005 Q1/2006 Q2/2006 Q4/2004 [RDD/100 PT] [RDD/100 PT] [RDD/100 PT] [RDD/100 PT] [RDD/100 PT] [RDD/100 PT] Antibiotika gesamt 143,3 118,4 134,4 159,4 142,8 157,0 Betalaktame gesamt BSBL ISBL SSBL Fluorchinolone Glykopeptide Aminoglykoside Sonstige Antibiotika Makrolide und Linkosamide Cotrimoxazol Andere Linezolid Metronidazol Diverse Antibiotika (Colistin, Tetrazykline, Pyrimenthamin) 61,6 56,5 3,5 1,6 9,6 17,5 5,4 49,2 15,0 10,0 24,1 3,4 18,4 52,5 46,3 4,7 1,5 6,2 9,2 4,9 45,6 4,1 12,6 28,9 2,8 11,8 54,5 49,4 2,9 2,2 5,3 17,2 5,6 51,9 9,4 18,8 23,8 1,9 8,3 64,5 62,4 0,7 1,5 21,0 22,4 9,1 42,4 9,2 16,1 17,1 0,8 10,3 54,8 54,3 0,5 0,0 36,2 18,2 5,0 28,5 11,1 7,7 9,7 0,4 8,6 60,4 59,1 1,0 0,2 51,1 18,3 2,0 25,3 6,5 5,2 13,6 0,0 6,0 2,3 14,2 13,5 6,0 0,7 7,6 Tabelle 3.7: Anwendungsdichte therapeutischer und prophylaktischer Antibiotika in den Quartalen der Vor- und Interventionsphase. Ausgewertet und dargestellt in der Einheit Recommended Daily Doses (RDD) pro 100 Pflegetage (PT) 3 ERGEBNISSE 28 Der Gesamt-Antibiotikaverbrauch, gemessen in RDD pro 100 Pflegetage (PT), unterlag in beiden Untersuchungsperioden quartalsabhängigen Schwankungen (Tabelle 3.7, Abb. 3-10 und 3-12), wobei sowohl in der Vorphase als auch in der Interventionsphase im jeweils zweiten Quartal (Quartal 1/2005 sowie 1/2006) der geringste antibiotische Gesamtverbrauch vorlag (118,4 sowie 142,8 RDD/100 PT). Antibiotikaverbrauchsdichte Differenzbeträge im Antibiotika-Verbrauch (FQPx-Kohorte - no FQPx-Kohorte) 175 Antibiotika gesamt Sonstige Antibiotika 150 Fluorchinolone 125 Aminoglykoside 40,0 100 RDD/100 PT RDD/100 PT 60,0 Glykopeptide 75 Fluorchinolone 50 Betalaktam e gesamt 25 Sonstige Antibiotika 20,0 0,0 -20,0 0 -40,0 Q4/2004 Q1/2005 Q2/2005 Q4/2005 Q1/2006 Q2/2006 Abb. 3-10: Antibiotikaverbrauchsdichte in RDD/100 Abb. 3-11: Darstellung des Differenzbetrages zwischen Pflegetage. Fluorchinolonprophylaxe-Kohorte und der prophylaxefreien Vergleichsgruppe. Zunahme des Abkürzungen: RDD= Recommended Daily Doses, gesamten Antibiotika- sowie des FluorchinolonPT= Pflegetage, Q= Quartal Verbrauchs. Abnahme des Einsatzes sonstiger Antibiotika. Abkürzungen: FQPx= Fluorchinolonprophylaxe, RDD= Recommended Daily Doses Das mittlere Quartal (1/2005) der prophylaxefreien Vorphase konnte somit auch den geringsten Antibiotikaeinsatz insgesamt vorweisen, während der erste Dreimonatszeitraum (Quartal 4/05) nach Prophylaxeeinführung (Interventionsphase) diesbezüglich die höchste Anwendungsdichte erreichte (159,4 RDD/100 PT). Ein unmittelbarer Vergleich der sich jahreszeitlich entsprechenden Vor- und Interventionsphasen-Quartale (Abb. 3-15) ergab einen höheren Antibiotikaverbrauch in den Dreimonatsphasen der Interventionsphase. Neben dem durch die Neueinführung der Fluorchinolonprophylaxe gestiegenen Verbrauch von Fluorchinolon-Präparaten (s. Tabelle 3.7) war in der Interventionsphase ebenso eine Zunahme der Anwendungsdichte von Glykopeptid-Antibiotika zu beobachten. Beide Wirkstoffklassen erreichten in jedem Quartal der Interventionsphase höhere Verbrauchsdichten als dies in den Dreimonatsperioden der Vorphase der Fall war, auch wenn es sich im Falle der Glykopeptide phasenweise nur um äußerst geringe Differenz-Beträge handelte (vgl. Tabelle 3.7). Der Zweikohorten-Vergleich (Fluorchinolon- vs. interventionsfreie Kohorte) ergab hierbei eine um 2,8 RDD/100 PT höhere Verbrauchsdichte von Glykopeptiden bei Aufenthalten mit Chinolonprophylaxe (19,1 vs. 16,3 RDD/100 PT, vgl. Tabelle 3.9). Im zweiten Quartal der Vorphase (Quartal 1/2005) vollzog im Bezug auf 3 ERGEBNISSE 29 den Quartals-Verbrauch von Glykopeptiden eine vorübergehende (annähernde) Halbierung der in den übrigen Quartalen üblichen Anwendungsdichte auf 9,2 RDD/100 PT. 175 150 RDD/100 PT 125 Antibiotika gesamt 100 S onstige Antibiotika 75 50 25 0 Q 4/04 Q1/05 Q 2/05 Q4/05 Q1/06 Q 2/06 Abb. 3-12: Verbrauch der Antibiotikaklasse Sonstige sowie der Antibiotika- Gesamtverbrauch im Vergleich. Aminoglykosid-Antibiotika kamen in den Dreimonatszeiträumen der Vorphase in nahezu konstant bleibenden Mengen zum Einsatz und erreichten Anwendungsdichten von 5,4 (Quartal 4/04), 4,9 (Quartal 1/05) sowie 5,6 (Quartal 2/05) RDD/100 PT. Die Interventionsphase zeigte neben einer größeren Spanne seiner Verbrauchsdichten (9,1 RDD/100 PT, 5,0 RDD/100 PT sowie 2,0 RDD/100 PT in den Quartalen 04/05, 01/06 sowie 02/06) einen quartalsweise deutlich abnehmenden Verbrauch an Aminoglykosiden. Insgesamt war jedoch nur eine geringe Differenz im Aminoglykosidverbrauch zwischen der Fluorchinoloprophylaxe-Gruppe und der interventionsfreien Kohorte festzustellen (6,1 vs. 5,3 RDD/100 PT, s. Tabelle 3.9). Bei einem Vergleich der sich entsprechenden beiden letzten Quartale der Vor- und Interventionsphase blieb der Anstieg des gesamten Antibiotikaverbrauchs hinter dem Betrag, um welchen der Verbrauch von Fluorchinolonen gestiegen war, zurück (Abb. 3-15). Hierbei kam (unter anderem) der nicht unerhebliche Rückgang in der Verschreibung von Antibiotikapräparaten aus der Wirkstoffklasse „Sonstige Antibiotika“ zum tragen (vgl. Abb. 3-12, Tabelle 3.7). Zu letzterer zählten die Antibiotikagruppen der Makrolide und Linkosamide, der Folsäure-Antagonisten (Cotrimoxazol) sowie die Gruppe der „anderen“ Antibiotika, wiederum bestehend aus den Wirkstoffen Metronidazol, Linezolid, sowie anderen diversen Antibiotika-Wirkstoffen [Polypeptide (Colistin), Tetrazykline, Pyrimenthamin], die infolge geringer Anwendungsdichten unter zuletzt genannter Subgruppe zusammengefasst wurden. In jedem Dreimonatszeitraum der Interventionsphase waren weniger Antibiotika der Klasse Sonstige zum Einsatz gekommen als in der Dreimonatsphasen der Vorphase. Auch die 3 ERGEBNISSE 30 quartalsunabhängige Gegenüberstellung von Chinolonprophylaxe- und interventionsfreier Kohorte (Abb. 3-11 sowie Tabelle 3.9) ergab, dass der Gesamt-Antibiotikaverbrauch in der Prophylaxegruppe um 27,2 RDD/100 PT RDD/100 Pflegetage Betalaktamverbrauch 75 über dem der interventionsfreien Kohorte 60 lag, jedoch insbesondere aufgrund des um 45 20 RDD/100 PT gesunkenen Einsatzes der BSBL 30 Wirkstoffklasse ISBL „Sonstige Antibiotika“ SSBL 15 hinter der Zunahme des Fluorchinolon- 0 Q4/04 Q1/05 Q2/05 Q4/05 Abb. 3-13: Quartalsweiser Betalaktam-Antibiotika. Q1/06 Verbrauchs Q2/06 Verbrauch von zurückblieb. (43,3 RDD/100 Während PT) die Verschreibungsdichte von Cotrimoxazol (Trimethoprim-Sulfamethoxazol) im Verlauf der Vorphase angestiegen war (10,0 RDD/100 PT im Quartal 4/2004; 12,6 RDD/100 PT im Quartal 1/2005 sowie 18,8 RDD/100 PT im Quartal 2/2005), nahm diese in der anschließenden Interventionsphase quartalsweise wieder kontinuierlich ab und lag im letzten Dreimonatszeitraum (Quartal 2/2006) bei 5,2 RDD/100 PT. Cotrimoxazol wurde in erster Linie als Prophylaxe gegen Pneumocystis cariniiPneumonie eingesetzt. Während bei den 254 Aufenthalten ohne prophylaktische Chinolone noch 14,7 RDD/100 Pflegetage Cotrimoxazol angewendet wurden, erhielten die Gruppe mit Fluorchinolon-Prophylaxe nur noch insgesamt 6,2 RDD/100 PT (s. Tabelle 3.9). Die Anwendung von Linezolid-, Makrolid- (Erythromycin und Clarithromycin) und LincosamidAntibiotika nahm sowohl in Verlauf der Vor- als auch in der Interventionsphase quartalsweise ab und erreichte folglich im Quartal 2/2005 sowie 2/2006 die jeweils niedrigsten Verbrauchdichten innerhalb des zugehörigen neunmonatigen Untersuchungszeitraums (Vor- bzw. Interventionsphase). Im Quartal 2/2006 wurde keinem der 48 stationären Aufenthalte ein Linezolid-Präparat (Zyvoxid®) verschrieben (s. Tabelle 3.7). Insgesamt war der Linezolidverbrauch in jedem der Vorphasen-Quartale um mehr als 1,1 RDD/100 PT höher als in den Dreimonatsepisoden der Interventionsphase und lag bei Aufenthalten mit vs. ohne Chinolonprophylaxe bei 0,2 vs. 2,2 RDD/100 PT . Die Anwendungsdichte von Metronidazol belief sich in der Prophylaxekohorte auf annähernd 8 RDD/100 PT und war damit geringer als in der prophylaxefreien Kohorte (11,9 RDD/100 PT) (s. Tabelle 3.9). Wie bereits im Falle des Antibiotika-Gesamtverbrauchs zu beobachten war, lag im jeweils zweiten Dreimonatszeitraum (Quartal 1/2005 sowie 1/2006) der Vor- und Interventionsphase die geringste Anwendungsdichte von Betalaktam-Antibiotika (BL) vor 3 ERGEBNISSE 31 (vgl. Tabelle 3.7). Letztere unterteilten sich in die Subklassen Breitspektrum- (BSBL), Intermediärspektrum-(ISBL) sowie Schmalspektrum-Betalaktame (SSBL). Der Verbrauch von Breitspektrum-Betalaktamen (BSBL), wiederum bestehend aus den Wirkstoffgruppen der Breitspektrumpenicilline, Carbapeneme und 3.-Generations-Cephalosporine, erreichte hierbei im zweiten Quartal der Vorphase mit 46,3 RDD/100 PT den niedrigsten Wert im gesamten Studienzeitraum (Vor- und Interventionsphase) (Abb. 3-13 sowie Tabelle 3.7). In den Quartalen der Vorphase wurden durchschnittlich geringere Mengen an Betalaktamen verschrieben, bedingt durch eine geringere Anwendungsdichte von BSBL in diesem Zeitraum. Im Zweikohorten-Vergleich (Fluorchinolonprophylaxe vs. keine Prophylaxe) war der Betalaktam-Gesamtverbrauch mit 61,9 versus 61,7 RDD/100 PT jedoch annähernd identisch (Tabelle 3.9). Der BSBL-Mehrverbrauch von 4,3 RDD/100 PT in der Chinolonprophylaxe-Gruppe (61,3 RDD/100 PT mit vs. 57,0 RDD/100 PT ohne Fluorchinolon-Prophylaxe) wurde hierbei durch die entsprechend geringeren Anwendungsdichten von ISBL (0,5 vs. 3,0 RDD/100 PT) und SSBL (0,1 vs. 1,7 RDD/100 PT) in dieser Gruppe wieder ausgeglichen ( vgl. Abb. 3-13). Antibiotika der Subklasse ISBL (in diesem Fall ausschließlich 2.-Generations-Cephalosporine in Form von Cefuroxim bzw. Cefuroximaxetil) und SSBL (mit den Wirkstoffen Flucloxacillin, Penicillin, Ampicillin sowie Amoxicillin) kamen folglich in den Quartalen der Interventionsperiode in geringerem Umfang zum Einsatz (Tabelle 3.7) als es in der Vorphase noch der Fall war. So wurde beispielsweise keinem der 58 Aufenthalte, welche im Quartal 1/06 (Interventionsphase) eingeschlossenen wurden, ein Antibiotikum der Subklasse SSBL verabreicht. Veränderungen des Antibiotikaverbrauchs [RDD/100 Pflegetage] Betalaktamverbrauch (Zweikohorten-Vergleich) 60 80 Antibiotika (insgesamt) RDD/100 PT 61,3 60 57,0 FQ-Prophylaxe 45 Keine FQ-Prophylaxe 30 Fluorchinolone (therapeutisch und prophylaktisch) 45,8 40 30,0 15 20 0,5 3,0 0,1 1,7 0 BSBL ISBL 24,4 16,1 SSBL Abb. 3-14: Betalaktam-Verbrauch FQ-ProphylaxeKohorte vs. prophylaxefreie Kontrollgruppe. 22,6 11,4 0 Differenz Verbrauch (Q4/05-Q4/04) Differenz Verbrauch (Q1/06-Q1/05) Differenz Verbrauch (Q2/06-Q2/05) Abb. 3-15: Zunahme des gesamten Antibiotika sowie des Fluorchinolon-Verbrauchs in den Quartalen der Interventionsphase 3 ERGEBNISSE 32 SUBGRUPPE: Aufenthalte ohne Fieber n(%) mit FQPx n=47 ohne FQPx n=127 41 (87%) 102 (80%) Bakteriämien 0 6 (5,9%) grampositiv 0 2 gramnegativ 0 4 1 (2,4%) 6 (5,9%) grampositiv 1 3 gramnegativ 0 3 1 (2,4%) 11 (10,8%) 1 2 Empirische Antibiotikatherapie Piperacillin/Combactam, Ceftazidim, Imipenem, Vancomycin(1)) Davon: Infektionen (abzüglich CDAD) Klinisch dokumentierte Infektion (ohne Erregernachweis) BK-Kontaminationen (grampositiv) Tabelle 3.8: Zweikohortenvergleich der fieberfreien Aufenthalte bezüglich der relativen Häufigkeit einer empirischen Antibiotikatherapie. Anmerkung: (1)Empirische Vancomycin (Monotherapie) insgesamt nur bei drei afebrilen Aufenthalten (alle ohne FQPx). Abkürzungen: FQPx= Fluorchinolon-Prophylaxe, BK= Blutkultur, CDAD= Clostridium difficile assoziierte Diarrhoe In den Untersuchungsgruppen (mit vs. ohne Fluorchinolon-Prophylaxe) lag der Anteil der fieberfreien Aufenthalte, welche eine empirische Antibiotikatherapie erhalten hatten, bei 87% vs. 80%. Die Anzahl bakteriell- sowie rein klinischer Infektions-Ereignisse (Bakteriämien und/oder Infektion) lag in den afebrilen Subgruppen bei 2 (4,9%) vs. 23 (22,5%), die der potentiell kontaminierten Blutkultur-Isolate bei 1 von 42 versus 2 von 102 Aufenthalten ohne Fieber und mit empirischer Antibiotika-Therapie (s. Tabelle 3.8). A n t ib io t ik a v e r b r a u c h s d ic h t e n in R D D / 1 0 0 P T A n tib io tika (g e s a m t) 175 F lu o r c h i n o lo n e (th e ra p e u tis c h u n d p r o p h y la k t i s c h ) 150 125 100 1 4 3 ,3 1 1 8 ,4 1 3 4 ,4 6 ,2 5 ,3 1 5 9 ,4 1 4 2 ,8 1 5 7 ,0 75 50 25 5 1 ,1 9 ,6 3 6 ,2 2 1 ,0 0 Q 4 /0 4 Abb. 3-16: Q 1 /0 5 Q 2 /0 5 Q 4 /0 5 Anwendungsdichte von Fluorchinolonen Antibiotikaverbrauch in RDD/100PT Q 1 /0 6 im Q 2 /0 6 Verhältnis zum gesamten 3 ERGEBNISSE 33 Antibiotika gesamt 200 Fluorchinolone 158,6 RDD/100 PT 150 131,4 100 50,2 50 6,8 0 FQ-Prophylaxe Keine FQ-Prophylaxe Abb. 3-17: Quartalsunabhängige Gegenüberstellung der Antibiotika-Verbrauchsdichten (Fluorchinolone sowie Gesamt-Antibiotika) in RDD/100 Pflegetage (PT) FQ-Prophylaxe keine FQ-Prophylaxe (n°103 Aufenthalte) (n°254 Aufenthalte) DDD/100 PT RDD/100 PT PDD/100 PT DDD/100 PT RDD/100 PT PDD/100 PT Antibiotika gesamt 166,19 158,59 164,10 148,82 131,38 145,10 62,09 61,93 60,46 68,52 61,70 61,67 BSBL 60,65 61,32 59,41 56,91 57,04 56,17 ISBL 0,89 0,47 0,91 5,72 3,00 3,39 SSBL 0,56 0,14 0,14 5,90 1,67 2,12 Fluorchinolone 51,72 50,17 45,00 8,87 6,82 8,26 Glykopeptide 19,10 19,10 25,89 16,25 16,25 19,93 Betalaktame gesamt Aminoglykoside 8,12 6,09 8,43 7,05 5,29 7,39 Sonstige Antibiotika 25,16 21,30 24,32 48,13 41,33 47,85 Makrolide + Linkosamide 10,28 6,42 8,08 16,74 10,44 11,43 Cotrimoxazol 6,19 6,19 6,19 14,67 14,67 14,84 Andere 8,69 8,69 10,04 16,73 16,22 21,57 Linezolid 0,24 0,24 0,24 2,18 2,18 2,18 Metronidazol 8,00 8,00 8,22 11,88 11,88 11,95 0,45 0,45 1,57 2,67 2,17 7,45 0,56 0,56 0,56 9,99 9,23 9,46 Diverse Antibiotika (Colistin, Tetrazykline, Pyrimenthamin) Tuberkulostatika Tabelle 3.9: Vergleich der Antibiotika-Anwendungsdichten in RDD, DDD sowie PDD, jeweils pro 100 Pflegetage. Fluorchinolon -Prophylaxe-Kohorte vs. prophylaxefreie Kohorte Anmerkung: (1) ohne Tuberkulostatika. 3 ERGEBNISSE 34 Antibiotikaverbrauch Zweikohorten-Vergleich Sonstige Antibiotika Aminoglykoside Glykopeptide 200 Fluorchinolone Betalaktame gesamt RDD/100 PT 100 0 FQ-Prophylaxe Keine FQ-Prophylaxe Abb. 3-18: Antibiotika-Verbrauchsdichten im quartalsunabhängigen Vergleich U1 Quartal 4 Stationäre Aufenthalte n (%) Quartal 1 U2 Quartal 2 Quartal 4 Quartal 1 Quartal 2 2004 2005 2005 2005 2006 2006 49 (100) 68 (100) 68 (100) 66 (100) 58 (100) 48 (100) 0 0 0 29 (44) 37 (64) 37 (77) 0 0 0 26 29 37 Fluorchinolon-Prophylaxe n Aufenthalte (%) Levofloxacin 0 0 0 3 8 0 143,3 118,4 134,4 159,4 142,8 157,0 9,6 6,2 5,3 21,0 36,2 51,1 Antimykotika-Prophylaxe n Aufenthalte (%) 39 (80) 56 (82) 55 (81) 59 (89) 44 (76) 43 (90) Antimykotika-Therapie n Aufenthalte (%) 27 (55) 25 (37) 32 (47) 28 (42) 28(48) 20 (42) Antivirale Therapie/Prophylaxe n Aufenthalte (%) 16 (33) 31 (46) 39 (57) 48 (73) 35 (60) 29 (60) Ciprofloxacin Antibiotikaverbrauch (gesamt) [RDD/100 PT] Fluorchinolonverbrauch [RDD/100 PT] (therapeutisch und prophylaktisch) Tabelle 3.10: Anwendungsdichte der Fluorchinolonprophylaxe sowie sonstiger Antiinfektiva im quartalsbezogenen Vergleich. Abkürzungen: PT= Pflegetage, RDD= Recommended Daily Doses 3.4.3 Antimykotika und Virustatika In der Vorphase wurde, bei Mittelung aller drei Quartale, bei durchschnittlich 81% der Aufenthalte (pro Quartal) eine antimykotische Prophylaxe eingesetzt und zeigte mit 80% (Quartal 4/04), 82% (Quartal 1/05) sowie 81% (Quartal 2/05) betroffenen Aufenthalten eine relativ konstante Anwendungsdichte (Tabelle 3.10). In den Quartalen der Interventionsphase 3 ERGEBNISSE 35 unterlag der Anteil an Aufenthalten mit prophylaktisch verabreichten Antimykotika größeren Schwankungen und erreichte Werte von einschließlich 79 bis 90% (Abb. 3-19). Antiinfektiva ohne Antibiotika Aufenthalte (%) 100 AntimykotikaProphylaxe 80 AntimykotikaTherapie 60 Antivirale Therapie/Prophy laxe 40 20 Q4/04 Q1/05 Q2/05 Q4/05 Q1/06 Q2/06 Abb. 3-19: Antimykotische Prophylaxe und Therapie sowie Antivirale Therapie im quartalsabhängigen Vergleich In der Fluorchinolonprophylaxe-Kohorte erhielten 91% (94 von 103) der Aufenthalte eine antimykotische Prophylaxe, während im Vergleich hierzu nur bei 80% der Aufenthalte (202 von 254) ohne Fluorchinolonprophylaxe eine Antimykotika-Prophylaxe verabreicht worden FQ-Prophylaxe Interventionsphase 103 (100) Keine FQPx Interventions- und Vorphase 254 (100) -Levofloxacin 92 0 -Ciprofloxacin 11 0 158,6 131,4 50,2 6,8 94 (91) 202 (80) 38 (37) 122 (48) 66 (64) 132 (52) Stationäre Aufenthalte n (%) FQ-Prophylaxe mit: Antibiotika-Verbrauch (total) RDD/100 PT FQ-Verbrauch [RDD/100 PT] (therapeutisch und prophylaktisch) Antimykotika Prophylaxe n Aufenthalte (%) Antimykotika Therapie n Aufenthalte (%) Antivirale Therapie/Prophylaxe n Aufenthalte (%) Tabelle 3.11: Quartalsunabhängige Darstellung des Verbrauchs bzw. der Häufigkeit angewendeter antiinfektiöser Prophylaxe sowie Therapie war (Tabelle 3.11). Zu einer antimykotischen Therapie kam es hingegen häufiger in der Gruppe der stationären Aufenthalte ohne Fluorchinolonprophylaxe [122 (48%) von 254 vs. 38 (37%) von 103]. Wie bei der antimykotische Therapie ergab somit auch in diesem Fall der Vergleich beider Gruppen einen Differenzbetrag von 11%. Abb. 3-19 verdeutlicht das in den einzelnen Quartalen beider Zeiträume nahezu spiegelbildliche Verhalten der Anwendungshäufigkeit antimykotischer Therapie und antimykotischer Prophylaxe. Wie 3 ERGEBNISSE 36 Tabelle 3.10 und Abb. 3-19 zur Darstellung bringen, stieg der Einsatz von Virustatika im Verlauf der Vorphase mit jedem Quartal an, und lag in der Interventionsphase in jedem ihrer drei Zeiträume höher als dies in der Vorphase der Fall war. Im Quartal 4/2005 der Interventionsphase unterliefen 73% der stationären Aufenthalte eine antivirale Therapie oder Prophylaxe, was dem höchsten Anteil im gesamten Studienzeitraum entsprach. Im Vergleich dazu wies die erste Dreimonatsepisode der Vorphase (Quartal 4/2004) die geringste Rate an virustatisch therapierten stationären Aufenthalten [16 (33%) von 49 Aufenthalte] auf. Die Quartale 1/2006 sowie 2/2006 (Interventionsphase) zeigten hinsichtlich des Anteils antiviral behandelter Aufenthalte mit jeweils 60% keinen Unterschied. 3.5 Infektionsdichte (-Rate) Q4/2004 Q1/05 Q2/05 Q4/05 Q1/06 Q2/06 n (ID/100PT) n (ID/100PT) n (ID/100PT) n (ID/100PT) n (ID/100PT) n (ID/100PT) Mikrobiologisch dokumentierte Infektionen (gesamt) Grampositive Infektionen (inkl. C. diff.-Infektionen) Gramnegative Infektionen Mischinfektionen (grampositiv/gramnegativ) Mykosen Virale Infektionen (inkl. HSV-Reaktivierung) Infektion mit atypischen Erregern (z.B. Chlamydien, Mykoplasmen) Klinisch dokumentierte Infektionen (ohne Erregernachweis) Clostridium difficile-Infektion (-assoziierte Enterokolitis) 12 (0,82) 16 (1,01) 17 (1,13) 24 (1,33) 14 (0,86) 10 (0,83) 5 (0,34) 7 (0,42) 5 (0,33) 10 (0,55) 7 (0,43) 3 (0,25) 6 (0,41) 5 (0,30) 2 (0,13) 2 (0,11) 0 (0) 0 (0) 0 (0) 0 (0) 1 (0,07) 0 (0) 0 (0) 0 (0) 0 (0) 1 (0,06) 3 (0,20) 5 (0,28) 1 (0,06) 1 (0,08) 0 (0) 3 (0,18) 6 (0,40) 7 (0,39) 6 (0,37) 6 (0,50) 1 (0,07) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 8 (0,54) 9 (0,54) 3 (0,20) 4 (0,22) 6 (0,37) 2 (0,17) 3 (0,20) 3 (0,18) 1 (0,07) 8 (0,44) 5 (0,31) 1 (0,08) Tabelle 3.12: Infektionsdichte (ID) pro 100 Pflegetage (PT) im quartalsabhängigen Vergleich Anmerkung: ª isolierte Darstellung der Clostridium-difficile-assoziierten Enterokolitiden. Ab dem ersten Dreimonatszeitraum der Vorphase bis zur Vollendung des ersten Interventionsphasen-Quartals nahmen die Anzahl und Dichte mikrobiologisch dokumentierter Infektionen sukzessive zu (Tabelle 3.12). Das Quartal 4/2005 wies demnach mit 24 Infektionen und einer Dichte von 1,33/100 Pflegetage die höchste Inzidenz an Infektionen mit (positivem) Erregernachweis auf. Die beiden Folgequartale der Interventionsphase boten neben dem ersten Quartal der Vorphase (4/2004) die niedrigsten Infektionsdichten im gesamten Studienzeitraum (Vor- und Interventionsphase). Das Quartal 3 ERGEBNISSE 37 2/2006 zeigte hierbei mit einer Anzahl von 10 mikrobiologisch dokumentierten Infektionen auch insgesamt den geringsten Absolutwert. Im Verlauf der prophylaxefreien Vorphase vollzog sich in der chronologischen Abfolge der drei Quartale ein kontinuierlicher Rückgang der Infektionsdichte mit gramnegativen Erregern pro 100 Pflegetage (Tabelle 3.12, Abb. 320). Innerhalb der nachfolgenden Interventionsphase wiesen lediglich 2 Aufenthalte des ersten Quartals (4/2005) eine gramnegative Infektion auf, wobei keinem der beiden betroffenen Patienten eine Fluorchinolonprophylaxe im Rahmen seines stationären Aufenthaltes verabreicht worden war. A ty p is c h e E r re g e r ( z . B . C h la m y d i e n , M y k o p la s m e n ) 1 ,4 V i r a l ( i n k lu s i v e HSVR e a k tiv ie r u n g ) Infektionsdichte/100 Pflegetage 0 ,3 9 0 ,4 0 M ykose 0 ,1 8 0 ,2 8 0 ,0 7 0 ,0 6 0 ,7 0 ,3 7 0 ,2 0 0 ,4 1 0 ,1 1 0 ,5 0 0 ,3 0 G e m is c h t ( g r a m p o s it iv /g r a m n e g a tiv ) 0 ,0 7 0 ,0 6 0 ,1 3 G r a m n e g a t iv 0 ,0 8 0 ,5 5 0 ,3 4 0 ,4 2 0 ,4 3 0 ,3 3 0 ,2 5 0 ,0 Q 4 /0 4 Q 1 /0 5 Q 2 /0 5 Q 4 /0 5 Q 1 /0 6 G r a m p o s i t i v ( i n k l. C lo s t r i d i u m d i f f i c i le ) Q 2 /0 6 Abb. 3-20 : Infektionsdichte/100 PT in den Quartalen der Vor und Interventionsphase Somit war es bei keinem der Prophylaxe erhaltenden stationären Aufenthalte (n=103) zu einer nosokomialen Infektion mit gramnegativen Erregern gekommen (Tabelle 3.13). In den übrigen Dreimonatszeiträumen gramnegativen Infektionen der Interventionsphase konnten keine Fälle von mehr nachgewiesen werden. Auf 254 prophylaxefreie Aufenthalte, welche im Rahmen der Vor- und Interventionsphase eingeschlossen wurden, verteilten sich 15 (0,44/100 PT) durch gramnegativen Erreger verursachte Infektionen, wovon sich wiederum 2 Infektionen innerhalb ein und desselben stationären Aufenthaltes ereigneten. Das erste Quartal nach Einführung einer Fluorchinolon-Prophylaxe 3 ERGEBNISSE 38 (Interventionsphase) bot die höchste Anzahl (10) und Dichte (0,55/100 PT) an Infektionen mit grampositiven Erregern. Gleichzeitig wies dieser Zeitraum auch die insgesamt höchste Fallzahl C lo s tr id iu m d if fic ile - a s s o z iie r t e D ia r r h o e B e z o g e n a u f d ie G e s a m tz a h l d e r A u f e n t h a lte und Inzidenz (8 Aufenthalte; 0,44 Infektionen/100 16 % PT) bzw. 12,1% der Aufenthalte) 1 2 ,1 % an Anteil der Aufenthalte 12 % Clostridium difficile- assoziierten Enterokolitiden bzw. 8 ,6 % 8 % Diarrhoen (CDAD) auf, welche 6 ,1 % 4 ,4 % 4 % 2 ,1 % sowohl in diesem als auch im 1 ,5 % zweiten 0 % Q 4 /0 4 Q 1 /0 5 Q 2 /0 5 Q 4 /0 5 Q 1 /0 6 Q 2 /0 6 Abb. 3-21: Inzidenz der Clostridium difficile-assoziierte Diarrhoe (CDAD) in den Quartalen der Vor und Interventionsphase. Quartal der Interventionsphase mehr als 2/3 der grampositiven Infektionen ausmachten (Tabelle 3.12). Dennoch vollzog sich im weiteren Verlauf der Interventionsphase wieder ein Rückgang der Anzahl und Dichte an grampositiven Infektionen bei gleichzeitigem Sinken der CDAD-Inzidenz (s. Abb. 3-21). Sowohl in der Vorphase als auch in der Interventionsphase war lediglich in der jeweils letzten Dreimonatsperiode ein einziger stationärer Aufenthalt von einer Clostridium difficileassoziierten Enterokolitis betroffen. Mit insgesamt 3 grampositiven Infektionen wies das letzte Interventionsphasen-Quartal (Quartal 2/06) die geringste Anzahl sowie, bezogen auf 100 Pflegetage, auch die geringste Dichte (0,25) grampositiver Infektionen im gesamten Studienzeitraum (Vor- und Interventionsphase) auf. Aus der quartalsunabhängigen Datenauswertung (Tabelle 3.13) geht hervor, dass die Inzidenz der Clostridium difficileassoziierten Enterokolitiden in der Prophylaxe-erhaltenden Kohorte und der Aufenthaltskohorte ohne Fluorchinolonprophylaxe nahezu identisch waren (0,21/100 PT vs. 0,23/100 PT bzw. 5,8% versus 5,9% der Aufenthalte). Im Verlauf der 254 Aufenthalte ohne Chinolonprophylaxe ereigneten sich (inklusive CDAD) 28 grampositive Infektionen (0,44/100 PT). In der Fluorchinolonprophylaxe erhaltenden Kohorte traten hingegen 0,31 grampositive Infektionen pro 100 Pflegetage auf (9 von 103 ). Eine gemischt grampositive/gramnegative Infektion ereignete sich lediglich bei einem Aufenthalt der prophylaxefreien Vorphase. Dieser wurde im Rahmen des letzten Dreimonatszeitraums (Quartal 2/05) Fluorchinolonprophylaxe unterzogen. der Vorphase erfasst und folglich keiner 3 ERGEBNISSE 39 FQ-Prophylaxe N°103 Keine FQ-Prophylaxe N°254 n (Infektionen/100 PT) % n (Infektionen/100 PT) % Mikrobiologisch dokumentierte Infektionen (gesamt) Grampositive Infektionen (inklusive Clostridium difficile-Infektionen) Gramnegative Infektionen Mischinfektionen (grampositiv/gramnegativ ) Mykosen Virale Infektionen (inkl. HSV-Reaktivierung) Infektion mit atypischen Erregern (z.B. Chlamydien, Mykoplasmen) Klinisch dokumentierte Infektionen (ohne Erregernachweis) 26(0,91) 25,2% 67(1,04) 26,4% 9(0,31) 8,7% 28(0,44) 11,0% 0(0) 15(0,23) 5,9% 0(0) 1(0,02) 4(0,14) 3,9% 7(0,11) 2,8% 13(0,45) 12,6% 15(0,23) 5,9% 0(0) 1(0,02) 0,4% 4(0,14) 3,9% 28(0,44) 11,0% 6(0,21) 5,8% 15(0,23) 5,9% Clostridium difficile- Infektion ( a) (-assoziierte Enterokolitis) Tabelle 3.13: Infektionsdichte/100 Pflegetage im quartalsunabhängigen Zweikohorten-Vergleich (a) isolierte Darstellung der Clostridium-difficile- assoziierten Enterokolitiden (Diarrhoe) Insgesamt konnte in der Interventionsphase eine höhere Inzidenz an viralen Infektionen beobacht werden, welche in beiden Untersuchungsphasen zu einem überwiegenden Anteil aus einer Reaktivierung von Herpes-Viren (Herpes simplex 1 ,2 A ty p is ch e E rre g er (z . B . C h la m y d ie n , M y k op la s m en ) Typ 1 und 2, Varizella Zoster 1 ,0 v ira le In fe k tion (in k l. H S V R ea k tiv ie ru n g ) Infektionsdichte/100 PT 0 ,2 3 Virus) hervorgingen (Tabelle 0 ,8 0 ,1 1 3.12). M yk os e 0 ,4 5 0 ,6 0 ,2 3 0 ,4 M is c h in fe k tion e n (g ra m p os itiv /g ra m n e g ativ ) Der erste Dreimonatszeitraum der Vorphase 0 ,1 4 war frei von G ra m n e g ativ Infektionen viraler Genese. Im 0 ,4 4 0 ,2 0 ,3 1 G ra m p o sitiv (in k l. C los trid iu m d iffic ile In fek tio n ) 0 ,0 F lu o rc h in o lo n - P ro p h y la x e n 1 0 3 Abb. 3-22: 100 dieses neunmonatigen Untersuchungszeitraumes konnte k e in e F lu o rc h in o lo n p ro p h yla x e n254 Infektionsdichte pro quartalsunabhängigen Laufe Pflegetage im Zweikohorten- bei 9 (4,8%) von insgesamt 185 Aufenthalten eine Virusinfektion nachgewiesen werden. In der nachfolgenden Interventionsphase waren hingegen 19 (11,0%) der insgesamt 172 stationären Aufenthalte von einer viralen Infektion bzw. Reaktivierung betroffen. In der Aufenthaltskohorte mit Fluorchinolonprophylaxe lag die Dichte viraler Infektionen mit 0,45/100 Pflegetage (12 von 103 Aufenthalten) in etwa doppelt so hoch wie bei der Aufenthaltskohorte ohne prophylaktische Fluorchinolone 0,23/100 PT (15 von 254 stationären Aufenthalten). Der wesentliche Anteil der nachgewiesenen mykotischen Infektionen beruhte auf Candida albicans Infektionen, hierbei insbesondere SoorStomatitiden und/oder Oesophagitiden. Für die Aufenthaltskohorte mit 3 ERGEBNISSE 40 Fluorchinolonprophylaxe (n=103) ergab sich diesbezüglich bei 4 Mykosen eine Infektionsdichte von 0,14/100 PT (3,9%), für die interventionsfreie Kohorte (ohne Fluorchinolonprophylaxe) errechnete sich ein Wert von 0,11 Mykosen/100 PT (2,8%). Lediglich bei den im Quartal 4/2004 (Vorphase) eingeschlossenen Aufenthalten ereigneten sich keine Mykosen. Eine Infektion durch einen atypischen Erreger, in diesem Fall eine serologisch gesicherte frische Chlamydia pneumoniae-Pneumonie, ließ sich lediglich im Quartal 4/2004 bei einem der 48 Aufenthalte nachweisen. Da dieser Aufenthalt im Rahmen der Vorphase eingeschlossen wurde, war dem zugehörigen Patienten keine Fluorchinolonprophylaxe verabreicht worden. In den ersten beiden Dreimonatsphasen der prophylaxefreien Vorphase gehörte E. coli mit 3 von 6 bzw. 3 von 5 verursachten gramnegativen Infektionen zu der dominierenden ErregerSpezies (Tabelle 3.14). Auch im letzten Quartal war eine der 2 dokumentierten gramnegativen Infektionen durch E. coli bedingt. Weitere, im Rahmen von Infektionen isolierte Erreger, waren Klebsiella spp. (Harnwegsinfekte oder Pneumonien), Enterobacter cloacae (Abszessformationen), sowie Bacteroides spp. (Aspirations-Pneumonie). Im ersten Interventionsphasenquartal handelte es sich wiederum bei einer der 2 gramnegativen Infektionen (welche bei prophylaxefreien Aufenthalten aufgetretenen waren) um eine E. coliInfektion (Harnwegsinfekt), die andere (Haut-)Infektion war durch ein Bakterium der Gruppe „Sonstige gramnegative Erreger“ verursacht worden. Bei letzterem wurde auf ein Antibiogramm verzichtet. Dabei erwies sich der isolierte E. coli-Stamm als Fluorchinolonsensibel sowie Cotrimoxazol-resistent. Von 13 gramnegativen (Mono-) Infektions-Erregern der Chinolon-Prophylaxefreien Vorphase wurden 12 bezüglich ihres Resistenzverhaltens gegenüber Fluorchinolonen (hier ausschließlich auf den Wirkstoff Ciprofloxacin) sowie Cotrimoxazol getestet (Tabelle 3.14): 11 von 12 waren hierbei Fluorchinolon-sensibel, ein Erreger (E. coli) von 12 erwies sich als Fluorchinolon-resistent. Resistent gegenüber Cotrimoxazol wurden 4 der 12 analysierten Erreger getestet, die übrigen 8 waren Cotrimoxazol-sensibel. Unter denjenigen grampositiven Erregern, welche in der Vorphase zu Infektionen geführt hatten, waren alle 8 (100%) auf Cotrimoxazol getesteten Erreger sensibel (Tabelle 3.15). Bei insgesamt zwei, bezüglich ihrer Fluorchinolon-Resistenz (wiederum ausschließlich Ciprofloxacin) getesteten, grampositiven Erregern verhielt sich einer Fluorchinolon-sensibel der andere -intermediär. Wie Tabelle 3.14 verdeutlicht, beruhte der Rückgang grampositiver Infektionen in den Quartalen der Interventionsphase vor allem auf einer deutlichen Abnahme an durch Enterokokken spp. verursachte Infekte. Dieser Trend spiegelte sich dementsprechend auch in der Bakteriämierate mit dieser Erreger-Spezies 3 ERGEBNISSE 41 wieder (Tabelle 3.21 sowie Tabelle 3.23). Bei quartalsunabhängiger Analyse der InfektionsErreger (Fluorchinolon-Prophylaxe vs. keine Fluorchinolon-Prophylaxe) zeigte sich, dass, wie bei den Bakteriämien, das Erreger- und damit auch das Infektions-Spektrum bei Aufenthalten mit prophylaktischer Chinolon-Verabreichung weniger breit gefächert war und sich zugunsten von KNS (–assoziierten Infektionen) verschob bzw. sich ganz auf diese Erreger-Gruppe beschränkte: Die einzigen 3 grampositiven Infektionen bei Aufenthalten mit Fluorchinolon-Prophylaxe (hierbei abzüglich der 6 Fälle von C. difficile-assoziierter Enterokolitis) waren durch KNS verursacht worden. In allen Fällen handelte es sich um eine Infektion der ZVK-Einstichstelle. Hierbei fand bei keinem der Isolate eine FluorchinolonResistenztestung statt. In der Vorphase (Quartal 4/05) war lediglich ein grampositiver Erreger (KNS) (bei insgesamt 3 Fluorchinolon-getesteten Isolaten) Fluorchinolon-resistent. Der betroffene Aufenthalt hatte zuvor keine Chinolonprophylaxe erhalten. Die einzige rein grampositive Mischinfektion (S. aureus und E. faecalis) ereignete sich, wie die gramnegativgrampositive Mischinfektion, im Rahmen eines prophylaxefreien Aufenthaltes der Vorphase (hier Quartal 1/05). Der daran beteiligte E. faecalis stellte einen der 2 Infektions-Erreger (ausgenommen Bakteriämie-Erreger) dar, die in der Vorphase überhaupt bezüglich ihrer Fluorchinolon-Resistenz getestet wurden und erwies sich hierbei als Fluorchinolon-sensibel. Im Gegensatz zur Vorphase, in der alle getesteten Infektionserreger Cotrimoxazol-sensibel (8 von 8) waren, verhielt sich in der Interventionsphase jeder der 3 [(KNS (n= 2), S. aureus (n= 1)] getesteten grampositiven Bakterien-Stämme Cotrimoxazol-resistent. Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 6 5 2 2 0 0 E.coli 3 3 1 1 (1) ---- ---- Enterobacter 2 ---- ---- ---- ---- ---- Klebsiella spp. 1 2 ---- ---- ---- ---- 1(1) Cotrimoxazolresistent (nur E. coli getestet) ---- ---- ---- ---- ---- Gramnegative-Infektionen 1 Bacteroides spp. Sonstiger gramnegativ Erreger ---- Antibiogramm: (12 von13 GN-Infektions-Erreger getestet) GP/GN-Mischinfektion mit (polymikrobiell) E. coli / Enterococcus Quartal 2/06 ---FQS 11/12 FQR 1/12 (E. coli) CotrimS 4/12 CotrimR 8/12 1 ---- ---- FQR, CotrimR FQS, VancoS Tabelle 3.14: Spektrum und Resistenzprävalenz der gramnegativen Infektionserreger (unabhängig von Bakteriämien) Abkürzungen: FQR= Fluorchinolon-resistent, FQS= Fluorchinolon-sensibel, GN= gramnegativ, GP= grampositiv, CotrimR= Cotrimoxazo-resistent, VancoS= Vancomycin-sensibel, STX-TMP= Cotrimoxazol Anmerkung: (*) nicht mehr unter den Erregern grampositiver Monoinfektionen (Tabelle 3.15) aufgelistet; (**) nicht mehr unter gramnegative Monoinfektionen aufgeführt. (1) Aufenthalte ohne Fluorchinolonprophylaxe 3 ERGEBNISSE 42 Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 Quartal 2/06 Grampositive Infektionen 2 4 4 2 2 2 (ohne CDAD) (4) (1) KNS 1 1 2 1 2 1(1) S. aureus 0 1 0 0 0 1(3) (2) Enterococcus spp. 1 3 1 1 0 0 Sonstige 0 0 1 0 0 0 Resistenzverhalten [Anzahl/ Gesamtzahl der auf den jeweiligen Wirkstoff getesteten Erreger im vorliegenden Quartal] Vancomycin-R 0 1/5(5) 0 0 0 1/2(3) Vancomycin-S 2/2 4/5 2/2 2/2 2/2 1/2 Oxacillin-R 2/2 4/5 0 2/2 1/2 2/2 Oxacillin-S 0 1/5 2/2 0 0 0 Oxacillin-I 0 0 0 0 1/2 0 Cotrimoxazol-R 0 0 0 2/2 1/1 0 Cotrimoxazol-S 1/1 5/5 2/2 0 0 0 (4) Fluorchinolon-R 0 0 0 1/1 0 0 Fluorchinolon-S 0 1/1 0 0 0 0 Fluorchinolon-I 0 0 1/1 0 0 0 Tabelle 3.15: Spektrum und Resistenzprävalenz der grampositiven Infektionserreger (unabhängig von Bakteriämien); Die Quartale 4/04 bis 2/05 entsprechen der prophylaxefreien Vorphase. Abkürzungen: I=intermediär, S= sensibel, R= resistent, FQPx= Fluorchinolonprophylaxe) Anmerkung: (1) (einzigen) Aufenthalte mit Fluorchinolonprophylaxe ( insgesamt 3, Erreger: KNS) (2) darunter eine Mischinfektion mit S. aureus und E. faecalis (3) Oxacillin- und Vancomycin-resistenter S. aureus (Aufenthalt ohne Prophylaxe) (4) Cotrim-resistener und einziger Fluorchinolon-resistenter grampositiver Erreger in der Vor-und Interventionsphase von insgesamt 3 Fluorchinolon-getesteten Erregern. Der betroffene Aufenthalt hat keine Fluorchinolon-Prophylaxe erhalten. (5) Vancomycin-Resistenter-E. faecium (VRE) 3.5.1 Prävalenz Fluorchinolon-resistenter Erreger in allen Isolaten Sowohl in der prophylaxefreien Vorphasen- als auch in der anschließenden Interventionsphasen-Kohorte (Aufenthalte mit und ohne Fluorchinolon-Prophylaxe) wurde bei 27% aller mikrobiologischen Erreger-Befunde (54 von 203 vs. 36 von 134) eine Resistenztestung mit Fluorchinolonen durchgeführt. Diese schloss Erreger in Proben, welche nicht von pathologischer Bedeutung oder klinischer Relevanz waren, mit ein. Hierbei erwiesen sich 11 (20%) der 54 getesteten Isolate der Vorphase als Fluorchinolon-resistent. In der Interventionsphase war der Anteil Chinolon-resistenter Erreger hingegen auf 64% angestiegen (23 der 36 Fluorchinolon-getesteten Isolate). 42 (78%) von 54, in der Vorphase getesteten, Bakterien Interventionsphase verhielten wiesen 12 sich (33%) Fluorchinolon-sensibel, von 36 im Chinolon-getesteten Rahmen Proben der einen Fluorchinolon-resistenen Erreger auf. In beiden Untersuchungsphasen verhielt sich je ein Erreger intermediär gegenüber Fluorchinolon-Wirkstoffen [1 (2%) von 54 (Vorphase) vs. 1 (3%) von 36 (Interventionsphase)]. 3 ERGEBNISSE 43 3.6 Fieberinzidenz UNTERSUCHUNGSPHASE 1 UNTERSUCHUNGSPHASE 2 Vorphase / Baseline Interventionsphase Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 Quartal 2/06 n49 n68 n68 n66 n58 n48 n (%) n (%) n (%) n (%) n (%) n (%) Fieberdauer/Aufenthalt [d] MEAN MIN MAX Fieber >38°C n (%) 6 1 24 22 (45) 3 1 14 35 (51) 5 1 17 37 (54) 4 1 11 33 (50) 4 1 19 26 (45) 3 1 14 30 (63) davon FUO n (%) 14 (64) 16 (46) 16 (43) 13 (39) 15 (58) 20 (67) Tabelle 3.16: Fieberinzidenz und- dauer im quartalsabhängigen Vergleich. Abkürzung(en): FUO= Fieber unklarer Genese In den Dreimonatsphasen der Vorphase schwankte der Anteil an Aufenthalten mit fiebriger Neutropenie zwischen 45 und 54% und betraf pro Quartal im durchschnittlich 50% der stationären Aufenthalte. In der anschließenden Interventionsphase reichte die Fieberinzidenz von 45 bis einschließlich 63% (Tabelle 3.16). Bei Mittelung der Fieberinzidenz in den Interventions-Quartalen lag der mittlere Anteil an Aufenthalten mit Fieber bei 53% und somit im Schnitt nur geringfügig über der Fieberinzidenz in den Quartalen der Vorphase. FQ-Prophylaxe No.103 Interventionsphase Keine FQ-Prophylaxe No.254 Interventions- und Vorphase 3 1 14 56 (54) 5 1 24 127 (50) Fieberdauer/Aufenthalt [d] MEAN MIN MAX Fieber >38°C n (%) 36 (64) davon FUO n (% Aufenthalte mit Fieber) Tabelle 3.17: Fieberinzidenz undFluorchinolonprophylaxe dauer in den Kohorten 58 (46) mit versus ohne Die mittlere Fieberdauer unterschied sich in den Quartalen beider Untersuchungszeiträume nur unwesentlich, lag jedoch in zwei Quartalen der Vorphase um einen bzw. zwei Tag(e) über dem Interventionsphasen-Quartal mit der höchsten mittleren Fieberdauer (Tabelle 3.16). In der Chinolonprophylaxe erhaltenden Kohorte lag die maximale Fieberdauer bei 14 Tagen, die prophylaxefreien Aufenthalte aus Vor-und Interventionsphase wiesen im Vergleich hierzu eine Fieberhöchstdauer von 24 Tagen auf. Wie Tabelle 3.17 und Abb. 3-24 zur Darstellung bringen, betrug der Anteil an stationären Aufenthalten mit fiebriger Neutropenie in der Fluorchinolonprophylaxe-Kohorte 54% (56 von 103) und lag damit über der Fieberinzidenz in der interventionsfreien Kohorte (50% der Aufenthalte). Bezüglich der minimalen Fieberdauer zeigte sich sowohl im quartalsabhängigen wie auch -unabhängigen Vergleich 3 ERGEBNISSE 44 kein Unterschied. Diese entsprach in jeder Kohorte der zur positiven Fieberdokumentation erforderlichen Mindestdauer von einem Tag. F ie b e r in z id e n z (> 3 8 ° C ) Fieberinzidenz (>38°C) 60% Anteil der Aufenthalte Anteil der Aufenthalte 80% 60% 40% 50% 54% 50% 20% 0% 40% Q4/04 Q1/05 Q2/05 Q4/05 Q1/06 F Q -P r o p h y la x e n 1 0 3 Q2/06 k e in e F Q -P r o p h y la x e n 2 5 4 Abb. 3-24: Fieberinzidenz im quartalsunabhängigen Zweikohorten-Vergleich Abb. 3-23: Fieberinzidenz in den Quartalen der Vor-und Interventionsphase Anmerkung: Quartale der Interventionsphase schraffiert dargestellt Der Anteil der Fieberepisoden unklarer Genese erreichte in der Gruppe der Prophylaxe erhaltenden Aufenthalte einen höheren Wert als in der prophylaxefreien Kontrollgruppe F ie b e r u n k la r e r G e n e s e ( F U O ) b e i A u f e n t h a lt e n m it F ie b e r (64% versus 46% der Fieberepisoden). Die quartalsabhängige Schwankung Anteil der Aufenthalte 7 0 % der 6 0 % Rate an Fieberepisoden mit unklarem Ursprung kommt in Abb. 3- 5 0 % 25 zur Darstellung: Im Verlauf beider 4 0 % Untersuchungszeiträume zeigte sich 3 0 % Q 4 /0 4 n 2 2 Q 1 /0 5 n 3 5 Q 2 /0 5 n 3 7 Q 4 /0 5 n 3 3 Q 1 /0 6 n 2 6 Q 2 /0 6 n 3 0 ein annähernd U-förmiger Verlauf der Inzidenz von Fieber unklarer Genese Abb. 3-25: Inzidenz von Fieber unklarer Genese (FUO) unter Aufenthalten mit Fieber (FUO), wobei das Quartal 4/2004 sowie das Quartal 2/2006 mit 64 bzw. 67% die jeweils höchste Rate in ihrem Untersuchungszeitraum bildeten. Subgruppe Akute Leukämien (AL) FQ-Prophylaxe n (%) keine FQ-Prophylaxe n(%) AL-Aufenthalte 49 (100%) 88 (100%) Fieber 33 (67%) 49 (56%) 19 (39%) 17 (19%) FUO (1) Tabelle 3.18: Fieber- und FUO-Inzidenz unter den Aufenthalten mit Akuter Leukämie. Vergleich von Fluorchinolonprophylaxe- versus prophylaxefreie Kontroll-Gruppe. Anmerkung: (1) Bezogen auf die Gesamtzahl der Kohorten-Aufenthalte 3 ERGEBNISSE 45 Innerhalb des Patientenkollektivs mit AL erreichte sowohl die Fieber- als auch die FUOInzidenz unter den Chinolonprophylaxe erhaltenden Aufenthalten deutlich höhere Werte als in der prophylaxefreien Kontrollgruppe (Tabelle 3.18). 3.7 Bakteriämierate BAKTERIÄMIEN gesamt * Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 Quartal 1/06 13 12 13 10 2 3 0 3 Grampositive Erreger 1 8 6 6 4 (9 mit GN/GP) (8 mit GN/GP) (8 mit GN/GP) (5 mit GP/GN) KNS 4 (5 mit GN/GP) 3 3 (5 mit GN/GP) 3 0 1 (2 mit GP/GP) FQ resistent 0 0 2 0 0 0 FQ sensibel 0 0 0 0 0 0 Enterokokken 3 2 (3mit GN/GP) 2 1 0 1 FQ resistent 0 0 0 1 0 1 FQ sensibel 0 0 1 0 0 0 S. aureus 1 0 0 0 0 1 FQ resistent 0 0 0 0 0 1 FQ sensibel 0 0 0 0 0 0 Streptokokken 0 1 (2 mit GN/GP) 0 0 (1 mit GN/GP) 0 0 FQ resistent 0 0 0 0 0 0 FQ sensibel 0 0 0 0 0 0 Sonstige grampositive Erreger 0 0 1 0 0 0 FQ resistent 0 0 0 0 0 FQ sensibel 0 0 0 0 0 0 3 4 2 3 2 3 Kontaminierte Blutkultur Isolate (nur GP) 1 FQ resistent 0 0 0 0 0 0 FQ sensibel 0 0 0 0 0 0 Gramnegative Bakteriämien 2 5 6 ** 6 6 1 0 FQ resistent 0 1 0 3 0 0 FQ sensibel 5 4 6 3 1 0 Polymikrobielle Bakteriämien 1 2 4 1 0 1 Grampositiv/Gramnegativ 1 E. coli/KNS 2 2 1 E. coli/Strep. 0 0 Grampositiv/Grampositiv 0 0 2 0 0 1 KNS/S. aureus Candidämie 0 0 1 0 1 0 Tabelle 3.19: Bakteriämie-Fallzahlen und Erreger-Resistenzen im quartalsabhängigen Vergleich Anmerkung: 1 ohne 2 mit gramnegativen/grampositiven (=polymikrobielle) Misch-Bakteriämien ** nur 5 von 6 bezüglich Fluorchinolon-Resistenz getestet * inklusive Candidämien Abkürzungen: KNS= Koagulase-negative Staphylokokken, S. aureus= Staphylococcus aureus 3 ERGEBNISSE 46 Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 Quartal 1/06 BAKTERIÄMIEN gesamt * 13 12 13 10 2 3 Escherichia coli 2 3 4 4 0 0 FQ resistent FQ sensibel 0 2 1 2 0 4 2 2 0 0 0 0 Gramnegative Bakteriämien (Non-Escherichia coli) FQ resistent 3 3 2 2 1 0 0 0 0 1 0 0 FQ sensibel 3 2 2 1 1 0 Enterobacter 2 0 0 2 1 0 FQ resistent FQ sensibel 0 2 0 0 0 0 1 1 0 1 0 0 Klebsiella pneumoniae 0 2 0 0 0 0 FQ resistent 0 0 0 0 0 0 FQ sensibel 0 2 0 0 0 0 Stenotrophomonas /Pseudomonas 0 0 2 0 0 0 FQ resistent 0 0 0 0 0 0 FQ sensibel 0 0 2 0 0 0 Proteus mirabilis 1 0 0 0 0 0 FQ resistent 0 0 0 0 0 0 FQ sensibel 1 0 0 0 0 0 Sonstige gramnegative Erreger 0 1 0 0 0 0 FQ resistent 0 0 0 0 0 0 FQ sensibel 0 0 0 0 0 0 Tabelle 3.20: Bakteriämien mit gramnegativen Erregern sowie deren Resistenzverhalten. Quartalsgebundener Vergleich. Anmerkung: * inklusive Candidämien Die Gesamtzahl dokumentierter Bakteriämien ergab sich aus der Anzahl grampositiver und gramnegativer Bakteriämien sowie aus der Anzahl an sich ereignenden Fungämien. Letztere waren ausschließlich durch Pilze der Gattung Candida bedingt. Die einzelnen Dreimonatszeiträume der prophylaxefreien Vorphase unterschieden sich nur geringfügig bezüglich ihrer Absolutzahl und Gesamt-Dichte an nachgewiesenen Bakteriämien pro 100 Pflegetage. Sowohl im ersten als auch im letzten Quartal der Vorphase ereigneten sich 13 Bakteriämien, was einer Dichte von 0,88 (27%) (Quartal 4/2004) sowie 0,87 (19%) (Quartal 2/2005) pro 100 Pflegetage entsprach. Das Quartal 1/2005 lag mit 12 (18%) Bakteriämien und einer Dichte von 0,72 pro 100 Pflegetage nur geringfügig darunter. 5 (10% bei n=49 Aufenthalten) der 13 Bakteriämien, welche im Quartal 4/2004 nachgewiesenen wurden, waren gramnegativer Genese, hierunter eine polymikrobielle Bakteriämie (E. coli und KNS) mit einem grampositiven Erreger innerhalb desselben Blutkulturen-Sets. Die restlichen 8 (16%) waren ausschließlich durch grampositive Erreger bedingt. Misch-Isolate, welche sowohl grampositive als auch gramnegative Pathogene enthielten, wurden im Rahmen der Datenauswertung und -darstellung generell unter der 3 ERGEBNISSE 47 Gruppe der gramnegativen Bakteriämien aufgeführt. Die betreffenden grampositiven Bakterien sind lediglich in der Tabelle 3.24 der Resistenzprävalenzen vorzufinden (vorausgesetzt eine Resistenztestung wurde vorgenommen). Quartal Quartal Quartal Quartal Quartal Quartal 4/04 1/05 2/05 4/05 1/06 2/06 0,88(13) 0,72(12) 0,87(13) 0,55(10) 0,12(2) 0,25(3) 0,54(8) 0,36(6) 0,40(6) 0,22(4) 0(0) 0,25(3) KNS 0,27(4) 0,18(3) 0,20(3) 0,17(3) 0(0) 0,08(1) Enterokokken 0,20(3) 0,12(2) 0,13(2) 0,06(1) 0(0) 0,08(1) S. aureus BAKTERIÄMIEN insgesamt Grampositive Erreger (insgesamt) 1 0,07(1) 0(0) 0(0) 0(0) 0(0) 0,08(1) Streptokokken 0(0) 0,06(1) 0(0) 0(0) 0(0) 0(0) Sonstige grampositive Erreger 0(0) 0(0) 0,07(1) 0(0) 0(0) 0(0) Kontaminierte Blutkultur Isolate (nur GP) 0,20(3) 0,24(4) 0,13(2) 0,17(3) 0,12(2) 0,25(3) Gramnegative Bakteriämien 2 (insgesamt) 0,34(5) 0,36(6) 0,40(6) 0,33(6) 0,06(1) 0(0) E. coli 0,14(2) 0,18(3) 0,27(4) 0,22(4) 0(0) 0(0) Enterobacter 0,14(2) 0(0) 0(0) 0,11(2) 0,06(1) 0(0) 0(0) 0,12(2) 0(0) 0(0) 0(0) 0(0) Klebsiella pneumoniae Stenotrophomonas/ Pseudomonas 0(0) 0(0) 0,13(2) 0(0) 0(0) 0(0) 0,07(1) 0(0) 0(0) 0(0) 0(0) 0(0) Sonstige gramnegative Erreger 0(0) 0,06(1) 0(0) 0(0) 0(0) 0(0) Polymikrobielle Bakteriämien 0,07(1) 0,12(2) 0,27(4) 0,06(1) 0(0) 0,08(1) Candidämie (insgesamt) 0,00(0) 0(0) 0,07(1) 0(0) 0,06(1) 0(0) Proteus mirabilis Tabelle 3.21: Bakteriämiedichte/100 Pflegetage(PT) in quartalsabhängiger Darstellung. Abkürzungen: KNS= Koagulase-negative Staphylokokken, S. aureus= Staphylococcus aureus, E. coli= Escherichia coli, GN= gramnegativ, GP= grampositiv. Im Quartal 1 sowie 2/2005 lag mit einer Anzahl von jeweils 6 ein ausgeglichenes Verhältnis (1:1) von grampositiven zu gramnegativen Bakteriämien vor (Tabelle 3.19 bis Tabelle 3.21). Innerhalb der Vorphase ereignete sich lediglich im Laufe eines Aufenthaltes eine Candidämie, bei gleichzeitigem Vorliegen einer mikrobiologisch gesicherten Candida albicans-Infektion. Der Einschluss des betroffenen Patienten (-Aufenthaltes), welcher zuvor einer antimykotischen Prophylaxe unterzogen worden war, erfolgte im Quartal 2/2005. In den Quartalen der Interventionsphase war hingegen eine geringere Anzahl und Dichte der Gesamt-Bakteriämierate zu beobachten, was sowohl auf einem Rückgang grampositiver als auch gramnegativer Bakteriämie-Ereignisse beruhte. Hierbei war bezüglich der Inzidenz an gramnegativen Bakteriämien ein ähnliches Verhalten zu beobachten wie bei der Infektionsrate mit gramnegativen Erregern (vgl. Tabelle 3.21 mit Tabelle 3.12). So boten auch in diesem Fall die beiden letzten Quartale (Quartal 1/06 sowie 2/06) mit einem (0,06/100 Pflegetage) sowie keinem betroffenen Aufenthalt die geringste gramnegative sowie Gesamt-Bakteriämiedichte und –anzahl, die in beiden Untersuchungsphasen erreicht wurde (Vor- und Interventionsphase). Die Anzahl (Dichte) bakteriämischer Episoden betrug in den beiden genannten Quartalen insgesamt 2 (0,12/100 Pflegetage) sowie 3 (0,25/100 3 ERGEBNISSE 48 Pflegetage). Der erste Dreimonatszeitraum (Quartal 04/05) nach Einführung der Chinolonprophylaxe wies mit einer Anzahl von 6 (60%) gramnegativen von insgesamt 10 Bakteriämien (0,33/100 Pflegetage) hingegen noch keinen Unterschied zu der (gramnegativen) Bakteriämierate, welche in den prophylaxefreien Vorphase-Quartalen nachzuweisen war, auf (Tabelle 3.21). Eine der 6 gramnegativen Bakteriämien war polymikrobiell, da neben E. coli zudem der Nachweis von Streptokokken (Streptococcus mitis) innerhalb ein und desselben Blutkulturen-Sets gelang. Insgesamt war lediglich bei 2 (1,9%) der 103 Aufenthalte mit Fluorchinolonprophylaxe die Isolation von gramnegativen Erregern aus der Blutbahn gelungen. Im ersten Dreimonatszeitraum nach Einführung der Fluorchinolonprophylaxe (Quartal 4/05) ereigneten sich bei 10 Gesamt-Bakteriämien lediglich 4(40%) bakteriämische Episoden mit grampositiven Erregern (ohne Miteinbeziehung des oben genannten polymikrobiellen E. coli/ Streptokokken Isolates), was einer Dichte von 0,22 pro 100 Pflegetage entsprach. In den zwei Folgequartalen (1/2006 und 2/2006) waren keine sowie 3 Bakteriämiedichte/100 PT 0,75 (0,25/100 Grampositive Erreger (insgesamt) 0,60 0,45 Gramnegative Bakteriämien (insgesamt) 0,30 Anteil der Aufenthalte mit FQ-Prophylaxe (%) 0,15 0,00 Quartal Quartal Quartal Quartal Quartal Quartal 4/04 1/05 2/05 4/05 1/06 2/06 Pflegetage) grampositive Bakteriämien nachweisbar. Dabei entsprachen die grampositiven Isolate des auch der Quartals 2/06 Gesamtzahl 3 an bakteriämischen Episoden in diesem Dreimonatszeitraum. Abb. 3-26: Dichte der grampositiven und gramnegativen Bakteriämien (pro 100 Pflegetage) im quartalsbezogenen Vergleich sowie Darstellung der Fluorchinolonprophylaxe-Compliance. Abkürzungen: PT= Pflegetage, FQ = Fluorchinolon Eine Candidämie (Spezies Candida krusei) trat innerhalb der gesamten Interventionsphase ebenfalls nur bei einem einzigen Aufenthalt (Quartal 1/06) auf. Diesem war eine antimykotische Prophylaxe, jedoch keine Fluorchinolonprophylaxe verabreicht worden. Folglich war es in der Kohorte der Fluorchinolonprophylaxe erhaltenden Aufenthalte (n=103) zu keiner Candidämie bzw. Fungämie gekommen. Die Anzahl an Blutkultur-Isolate, bei welchen man mit hoher Wahrscheinlichkeit von einer Kontamination mit grampositiven Erregern (vorwiegend KNS) und folglich keiner echten Bakteriämie ausgehen musste, hielt sich in den Dreimonatsphasen beider Untersuchungszeiträume mit 2 bis 4 kontaminierten Blutkulturen pro Quartal auf einem relativ konstanten Niveau (Tabelle 3.19 und Tabelle 3 ERGEBNISSE 49 3.21). Auf die 103 Aufenthalte mit Chinolonprophylaxe verteilten sich 6 (0,21/100 Pflegetage) kontaminierte Isolate (5 KNS-Isolate, 1 Isolat mit einem „sonstigen“ grampositiven Erreger), unter den Aufenthalten ohne prophylaktische Fluorchinolongabe (n=254) wurden insgesamt 11 (0,17/100 PT) Blutkultur-Isolate gewonnen (8 KNS-, 1 Streptokokken-, 2 „sonstige“ grampositiven Isolate), welche keiner echten Bakteriämie entsprachen. In beiden Untersuchungsgruppen stellten zu einem überwiegenden Anteil KNS die Kontaminanten der Blutkulturen dar (5 von 6 kontaminierten Isolaten in der Prophylaxekohorte sowie 8 von 11 betroffenen Isolaten in der prophylaxefreien Aufenthaltskohorte). Antibiogramme wurden in der Gruppe der stationären Aufenthalte mit Fluorchinolonprophylaxe (n=103) bei 10 von 11 Kontaminanten durchgeführt. In der Gruppe ohne prophylaktische Chinolone (n=254) wurden 4 der insgesamt 6 kontaminierenden Erreger einer Resistenztestung unterzogen. In beiden Kohorten verhielt sich je ein kontaminiertes Isolat intermediär gegenüber Oxacillin. Sowohl in der Prophylaxegruppe als auch in der prophylaxefreien Aufenthaltskohorte waren jeweils die Hälfte der getesteten Kontaminanten Oxacillin-resistent (2 von 4 vs. 5 von 10). Die Prävalenz Oxacillin-sensibler Erreger unter den kontaminierenden Erreger-Isolaten belief sich auf 1 von 4 in der Prophylaxekohorte sowie 4 von 10 in der interventionsfreien Kohorte. Alle getesteten Kontaminanten waren sensibel gegenüber dem Glykopeptid Vancomycin. Eine Testung auf Fluorchinolon-Resistenz bzw. –Sensibilität war nicht durchgeführt worden. Bakteriämiedichte/100 PT 0,60 Gramnegative Bakteriämien (insgesamt) 0,50 Grampositive Erreger (insgesamt) 0,40 0,30 Candidämie (insgesamt) 0,20 0,10 0,00 Quartal Quartal Quartal Quartal Quartal Quartal 4/04 1/05 2/05 4/05 1/06 2/06 Abb. 3-27: Bakteriämiedichte pro quartalsbezogenen Vergleich 100 Pflegetage (PT) im 3 ERGEBNISSE 50 Aufenthalte mit FQ- Prophylaxe n103 (U2) [n (Dichte/100 PT)] 6 (0,21) 6% Aufenthalte ohne FQ Prophylaxe n 254 (U1+U2) [n (Dichte/100 PT)] 47 (0,73) 19% 4 (0,14) 4% 23 (0,36) 9% 3 (0,10) 1 (0,03) 0 0 0 11 (0,17) 8 (0,12) 2 (0,03) 1 (0,02) 1 (0,02) Gramnegative Bakteriämien (2) 2 (0,07) 2% 22 (0,34) 9% Kontaminierte Blutkultur-Isolate (GP) 6 (0,21) 6% 11 (0,17) 4% KNS Streptokokken Sonstige grampositive Erreger Polymikrobielle Isolate/ Bakteriämien GP / GN GP / GP 5 0 1 0 0 0 8 1 2 8 (0,12) 3% 6 (0,09) 2 (0,03) Pilz-Bakteriämie 0 2 (0,03) E. coli Bakteriämien FQ-resistent FQ-sensibel TMP/STX-resistent TMP/STX-sensibel 0 13 (davon 6 GP/GN) (0,20) 0 0 0 0 3 10 13 0 Gramnegative Bakteriämien (außer E. coli) 2 (0,07) 9 (davon 1 GP/GN) (0,14) Enterobacter Klebsiella pneumoniae Stenotrophomonas/ Pseudomonas Proteus mirabilis Sonstige gramnegative Erreger Gramnegative Bakteriämien (außer E. coli) FQ-resistent FQ-sensibel TMP/STX-resistent TMP/STX-sensibel 2 (0,07) 0 0 0 0 2 (0,07) 1 1 2 0 3 (davon 1 GP/GN) (0,05) 2 (0,03) 2 (0,03) 1 (0,02) 1 (0,02) 9 (davon 1 GP/GN) (0,14) 0 8 (1 nicht getestet) 3 3 Bakteriämien (total) Grampositive Bakteriämien (1) KNS Enterokokken Staphylokokkus aureus Streptokokken Sonstige grampositive Erreger Tabelle 3.22: Quartalsabhängige Darstellung der bakteriämischen Episoden und Erregerprävalenz in n(%) sowie in Form von Dichte/100 Pflegetage (PT). Abkürzungen: KNS= Koagulase-negative Staphylokokken, GN= gramnegativ, GP= grampositiv, FQ= Fluorchinolon, TMP/STX= Cotrimoxazol Anmerkung: (1) ohne, (2) einschließlich GN/GP Mischbakteriämien (polymikrobiell) 0,60 Gram positive Erreger (insgesam t) Bakteriämien/100 PT 0,50 Gram negative Bakteriäm ien (insgesam t) 0,40 0,30 0,20 0,10 0,00 Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 Quartal 2/06 Abb. 3-28: Gramnegative (GN) sowie grampositive (GP) Bakteriämiedichten pro 100 Pflegetage (PT) im quartalsgebundenen Vergleich. 3 ERGEBNISSE 51 Quartal 4/04 Quartal 1/05 Quartal 2/05 Quartal 4/05 Quartal 1/06 Quartal 2/06 (n) (n) (n) (n) (n) (n) 13 12 13 10 2 3 Koagulase-negative Staphylokokken Enterokokken Staphylococcus aureus Streptokokken Sonstige grampositive Erreger (4) 31% (3) 23% (1) 8% 0% 0% (3) 25% (2) 17% 0% (1) 8% 0% (3) 23% (2) 15% 0% 0% (1 )8% (3) 30% (1) 10% 0% 0% 0% 0% 0% 0% 0% 0% (1) 33% (1) 33% (1) 33% 0% 0% Escherichia coli Enterobacter Klebsiella pneumoniae Stenotrophomonas/ Pseudomonas Proteus mirabilis Sonstige gramnegative Erreger (2) 15% (2) 15% 0% 0% (1) 8% 0% (3) 25% 0% (2) 17% 0% 0% (1) 8% (4) 31% 0% 0% (2) 15% 0% 0% (4) 40% (2) 20% 0% 0% 0% 0% 0% (1) 50% 0% 0% 0% 0% 0% 0% 0% 0% 0% 0% BAKTERIÄMIEN (insgesamt) Tabelle 3.23: Häufigkeitsverteilung (Prävalenzraten) der isolierten Bakteriämie-Erreger bezogen auf die Gesamtzahl an Bakteriämien pro Quartal. 3.7.1 Erregerspektrum- und prävalenzen Unter den Erregern, welche im Rahmen von grampositiven Bakteriämien isoliert wurden, dominierte zumeist die Gruppe der KNS (Tabelle 3.23). Dies war sowohl in jedem der drei Dreimonatszeiträume innerhalb der Vorphase als auch im ersten Quartal der Interventionsphase der Fall. Erstere wiesen KNS-Prävalenzraten von 23 bis 31% auf, in letzterem führten die KNS als Verursacher von 30% der Bakteriämien ebenso die PrävalenzRangliste vor allen übrigen grampositiven Pathogenen an. In den genannten Quartalen folgten Enterokokken-Spezies als die Gruppe der zweithäufigsten Erreger von grampositiven Bakteriämien. Ihr Anteil an der Gesamtzahl an Bakteriämien schwankte zwischen 10 und 23% (Tabelle 3.23). Im Quartal 1/2006 wurde keine grampositive Bakteriämie registriert. Im letzten Dreimonatszeitraum der Interventionsphase (Quartal 2/2006) verteilten sich die 3 insgesamt dokumentierten Bakteriämien hingegen ausschließlich auf grampositive Erreger [KNS (33,3%), Enterokokken (33,3%) sowie S. aureus (33,3%) mit je einer Bakteriämie]. Lediglich im Quartal 4/2004 (Vorphase) trat noch eine weitere S. aureus-Bakteriämie [1(8%) von insgesamt 13 Bakteriämien] auf. In beiden Fällen war zuvor keine FluorchinolonProphylaxe verabreicht worden. In den übrigen Dreimonatszeiträumen der Vor- und Interventionsphase konnte kein weiterer Fall von S. aureus-Bakteriämie nachgewiesen werden. Im zweiten Vorphasen-Quartal (1/2005) ereignete sich die einzige Bakteriämie des gesamten Studienzeitraums, welche ausschließlich (monomikrobiell) durch StreptokokkenSpezies verursacht wurde und in diesem Quartal 8% (1 von 12) aller dokumentierten Bakteriämien ausmachte. Zwei weitere Streptokokken-Spezies (Streptokokkus mitis sowie bovis) wurden im Rahmen von polymikrobiellen Bakteriämien mit E. coli isoliert. In beiden Fällen handelte es sich um Aufenthalte ohne Chinolonprophylaxe (Quartal 1/05, Vorphase, 3 ERGEBNISSE 52 Quartal 4/05, Interventionsphase). Eine Blutstrominfektion durch einen Erreger der Gruppe „Sonstige grampositive Erreger“ konnte lediglich im Quartal 2/2005 nachgewiesen werden. Bei einer Gesamtzahl von 13 Bakteriämien in diesem Quartal entsprach dies einem Anteil von ebenfalls 8%. Auch bei diesem Aufenthalt war zuvor keine Fluorchinolonprophylaxe mit Levofloxacin oder Ciprofloxacin verabreicht worden. Folglich wurde in der gesamten Interventionsphase (und somit auch in der Fluorchinolonprophylaxe-Kohorte) keine grampositive Bakteriämie durch Streptokokken oder Pathogene der Gruppe „Sonstige grampositive Erreger“ verursacht. Insgesamt waren sowohl in der Fluorchinolon-Gruppe (n=103) als auch in der prophylaxefreien Gruppe (n=254) KNS die am häufigsten isolierte Erreger-Gruppe im Rahmen einer Bakteriämie (3 von 4 vs. 11 von 22 grampositiven Bakteriämien). 3.7.1.1 Spektrum und Resistenzprävalenzen - Gramnegative Erreger Das Spektrum an isolierten gramnegativen Erregern war in der Interventionsphase erheblich geringer als dies in der Vorphase noch der Fall war. So waren die in der Interventionsphase verursachten gramnegativen Bakteriämien ausschließlich E. coli und Enterobacter-Spezies zu verdanken. Im letzten Interventionsphasen-Quartal (2/2006) traten keine Fälle von gramnegativen Bakteriämien auf. In drei (Quartal 1/2005, 2/2005 sowie 4/2005) der insgesamt 6 Dreimonatsepisoden wurde der überwiegende Anteil gramnegativer Bakteriämien durch E. coli-Stämme verursacht. Im ersten Dreimonatszeitraum der Vorphase (Quartal 4/05) waren jeweils 2 (15%) der 13 Bakteriämien durch E. coli- sowie durch Enterobacter-Erreger bedingt. Die Anzahl der durch E. coli verursachten Bakteriämien blieb mit 3 von 12 (Quartal 1/2005), 4 von 13 (Quartal 2/2005) sowie mit 4 von 10 (Quartal 4/2005) Gesamt-Bakteriämien auch in den nachfolgenden Quartalen relativ konstant. Aufenthalte, welche in der letzten und vorletzten Dreimonatsphase der Interventionsperiode eingeschlossen wurden wiesen keine bakteriämische Episode mit E. coli auf. In den Quartalen 4/2005 sowie 1/2006 (jeweils Interventionsphase) lagen bei 2 (20%) von insgesamt 10 sowie bei einer von insgesamt 2 Bakteriämien Enterobacter-Erreger vor. Im Rahmen der Dreimonatszeiträume der Vorphase wurden neben E. coli und Enterobacter spp., weitere Erreger wie Klebsiella pneumoniae (Quartal 1/2005), Pseudomonas bzw. Stenotrophomonas (Quartal 2/2005), Proteus mirabilis (Quartal 4/2004) sowie Vertreter der Gruppe „ Sonstige gramnegative Erreger“ (Quartal 1/2005) während bakteriämischen Episoden isoliert (Tabelle 3.23). Hierbei lagen maximal 2 Bakteriämien pro Erreger und Quartal vor. Bei lediglich 2 gramnegativem bakteriämischen Episoden hatten die betroffenen Aufenthalte zuvor eine Fluorchinolonprophylaxe erhalten. In beiden Fällen wurden Enterobacter als verantwortliche 3 ERGEBNISSE 53 Erreger isoliert, wobei beide Enterobacter-Isolate resistent gegenüber dem Wirkstoff Cotrimoxazol waren. Fluorchinolon-Wirkstoffen gegenüber verhielt sich eines der Isolate resistent, das andere sensibel. Insgesamt waren daher alle übrigen gramnegativen Bakteriämien ausschließlich bei Aufenthalten ohne prophylaktische Fluorchinolon-Einnahme in Erscheinung getreten, d.h. es ereignete sich auch keine E. coli-Bakteriämie im Rahmen der 103 Aufenthalte mit prophylaktischer Chinolon-Behandlung. Bei Aufenthalten ohne prophylaktisches Levofloxacin oder Ciprofloxacin (n=254) traten insgesamt 13 E. coliBakteriämien (0,20/100 PT) auf. Daneben wurden insgesamt 9 (0,14/100 PT) weitere Bakteriämien mit Enterobacter (n= 3), Klebsiella pneumoniae (n= 2), Stenotrophomonas bzw. Pseudomonas (n= 2), Proteus mirabilis (n= 1), sowie „sonstigen gramnegativen Erregern“ (n= 1) nachgewiesen. Unter den 13 E. coli-Isolaten waren 100% resistent bezüglich Cotrimoxazol getestet worden. 10 (77%) von 13 waren sensibel sowie 3 von 13 resistent gegenüber Fluorchinolonen. Von den 9 restlichen bakteriämischen Episoden mit gramnegativen (Non-E. coli-) Erregern wurden nur 8 auf ihr Verhalten gegenüber Fluorchinolon-Antibiotika getestet, wobei sich wiederum 100% als sensibel erwiesen. 6 der 9 isolierten gramnegativen Blutkultur-Isolate wurden auf Cotrimoxazol getestet, wovon sich je 3 (50%) sensibel sowie resistent verhielten. Zusammenfassend war daher in der Fluorchinolon-Prophylaxekohorte sowohl bei den grampositiven als auch bei den gramnegativen Bakteriämien ein kleineres Erregerspektrum als in der prophylaxefreien Kohorte vorhanden. In der Aufenthalts-Kohorte ohne prophylaktische Chinolone waren 18 von insgesamt 21 getesteten gramnegativen Bakteriämien Fluorchinolon-sensibel, die restlichen 3 erwiesen sich als resistent. In der gleichen Gruppe waren insgesamt 19 von 22 gramnegativen Erreger bezüglich dem Wirkstoff Trimethoprim-Sulfamethoxazol (Cotrimoxazol) getestet worden, wobei sich 16 (84%) von 19 als Cotrimoxazol-resistent, die anderen 3 (15,7%) als Cotrimoxazol-sensibel erwiesen. Bei den Aufenthalten ohne Fluorchinolonprophylaxe (n=254) waren 8 (17%) der insgesamt 47 registrierten Bakteriämien polymikrobiell (rein grampositive Isolate oder grampositive und gramnegative Misch-Isolate), wohingegen bei keinem der 103 Aufenthalte mit Fluorchinolonprophylaxe eine polymikrobielle Bakteriämie aufgetreten war. Die genannten 8 polymikrobiellen Isolate setzten sich zu ¾ aus Mischbakteriämien mit grampositiven und gramnegativen Erregern und zu ¼ aus rein grampositiven, polymikrobiellen Bakteriämien zusammen. 3 ERGEBNISSE 54 Aufenthalte mit FQ- Prophylaxe N°103 Aufenthalte ohne FQ Prophylaxe N°254 KNS- Bakteriämien Oxacillin-sensibel Oxacillin-resistent Vancomycin-sensibel Vancomycin-resistent STX/TMP-sensibel STX/TMP-resistent FQ-sensibel FQ-resistent Enterococcus- Bakteriämie Oxacillin-sensibel Oxacillin-resistent Vancomycin-sensibel Vanco-resistent (VRE) STX/TMP-sensibel STX/TMP-resistent FQ-sensibel FQ-resistent Staphylococcus aureus- Bakteriämie Oxacillin-sensibel Oxacillin-resistent Vancomycin-sensibel Vancomycin-resistent STX/TMP-sensibel STX/TMP-resistent FQ-sensibel FQ-resistent Streptococcus- Bakteriämie keine Probe getestet 3 1 2 3 0 0 1 0 0 1 0 0 1 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 15 (1) 6 9 15 0 2 5 0 2 9 (inklusive 1 polym GP/GN) 0 8 5 4 1 5 1 1 2 (davon nur 1 getestet) 0 1 1 0 0 0 0 1 3 (inklusive polymikrobielle Isolate) 3 Getestete GP-Bakteriämien (insgesamt) 4 25 FQ-sensibel (FQ-getestet) FQ-resistent (FQ-getestet) 0(1) 1(1) 1(5) 4(5) Kontaminierte Blutkulturen getestet/insgesamt 4/6 10/11 1 2 1 4 0 0 1 0 0 4 5 1 10 0 2 3 0 0 Oxacillin-sensibel Oxacillin-resistent Oxacillin-intermediär Vancomycin-sensibel Vancomycin-resistent STX/TMP-sensibel STX/TMP-resistent FQ-sensibel FQ-resistent Tabelle 3.24: Prävalenzen und Spektrum grampositiver Erreger im Zweikohorten-Vergleich Anmerkung: Resistenzen auch bei jenen polymikrobiellen Isolaten (gramnegativ/grampositiv bzw. grampositiv/grampositiv) angegeben, welche unter den Bakteriämien nicht aufgelistet sind (da keine eigenständige Bakteriämie) (1) inklusive der GP/GP-Mischbakteriämien (z.B. S. aureus/KNS). Abkürzungen: s. Tabelle 3.22 3 ERGEBNISSE 3.7.1.2 55 Resistenzprävalenzen - Grampositive Erreger 2 (67%) der 3 KNS-Isolate, welche in der Prophylaxekohorte im Rahmen einer bakteriämischen Episode gewonnen wurden, waren Oxacillin resistent (Tabelle 3.24). In der Aufenthaltskohorte ohne Fluorchinolonprophylaxe verhielten sich 9 (60%) der insgesamt 15 isolierten KNS-Pathogene resistent gegenüber Oxacillin. Die übrigen KNS-Stämme wurden in beiden Kohorten sensibel bezüglich Oxacillin getestet. Alle KNS waren sensibel gegenüber Vancomycin. Keiner der insgesamt 3 KNS-Stämme, der bei Fluorchinolon-Prophylaxe erhaltenden Aufenthalten (n=103) isoliert werden konnte, wurde bezüglich seines ResistenzVerhaltens gegenüber Fluorchinolonen getestet. In der prophylaxefreien Kohorte wurde bei 2 der 15 isolierten KNS Fluorchinolone in die Resistenztestung miteingeschlossen, wobei sich in beiden Fällen die Erreger als Fluorchinolon-resistent erwiesen. In der ChinolonprophylaxeGruppe erwies sich die einzige dokumentierte Enterokokken-Bakteriämie als sensibel gegenüber Vancomycin sowie resistent bezüglich Fluorchinolonen. Das Antibiogramm schloss in diesem Fall eine Testung auf Oxacillin- und Cotrimoxazol-Resistenz nicht mit ein. Bei 4 der 9 Enterokokken-Isolate (einschließlich eines polymikrobiellen Isolates mit E. coli), welche sich auf die 254 prophylaxefreien Aufenthalte verteilten, handelte es sich um Vancomycin Resistente Enterokokken (VRE) der Spezies Enterococcus faecium, die übrigen 5 ergaben in der Resistenztestung eine Vancomycin-Sensibilität. In der gleichen Untersuchungskohorte schloss die Testung bei 8 isolierten Enterokokken-Bakteriämien Oxacillin mit ein, wobei sich alle Isolate resistent verhielten. Einer der 2 EnterokokkenStämme, die bezüglich ihres Verhaltens gegenüber Fluorchinolon-Antibiotika getestet wurden, war resistent (ebenfalls in der prophylaxefreien Kohorte n=254), der andere sensibel. Zudem erwies sich ein Enterokokken-Isolat (von 6 auf Cotrimoxazol getesteten) als sensibel, die restlichen 5 als resistent gegenüber Cotrimoxazol. Lediglich im Rahmen von stationären Aufenthalten ohne Fluorchinolonprophylaxe war es zu S. aureus-Bakteriämien (n=2) gekommen, wobei jedoch nur ein Isolat getestet wurde. Bei diesem ergab sich eine Resistenz gegenüber Oxacillin und Fluorchinolon-Wirkstoffen sowie eine Vancomycin-Sensibilität. Cotrimoxazol war in diesem Fall nicht Teil der Resistenztestung. Insgesamt wurde in der Fluorchinolonprophylaxe-Kohorte nur ein grampositives BlutkulturIsolat auf Fluorchinolon-Resistenz getestet und erwies sich dabei als Fluorchinolon-resistent. In der Vergleichskohorte ohne prophylaktische Chinolon-Antibiotika waren 4 der 5 Fluorchinolon-getesteten, grampositiven Erreger Fluorchinolon-resistent. Betrachtet man die Resistenzprävalenzen von Infektionen und Bakteriämien gemeinsam, so ergab sich in der Fluorchinolon-Prophylaxekohorte, dass eines der lediglich zwei 3 ERGEBNISSE 56 Fluorchinolon-getesteten gramnegativen Isolate Fluorchinolon-resistent war, verglichen mit 4 Fluorchinolon-resistenten von 34 getesteten Pathogenen (inklusive Mischinfektionen) in der interventionsfreien Kohorte (vgl. Tabelle 3.14 bis Tabelle 3.15, Tabelle 3.22 sowie Tabelle 3.24). Bei grampositiven Erregern wies die Prophylaxegruppe 1 Fluorchinolon-resistenten Erreger in der einzigen, bezüglich Fluorchinolone getesteten Probe auf, wohingegen die prophylaxefreie Gruppe insgesamt bei 5 von 8 getesteten grampositiven Proben Fluorchinolon-resistente Erreger von Infektionen und Bakteriämien aufweisen konnte (1/8 Fluorchinolon-intermediär, 2/8 Fluorchinolon-sensibel). 3 ERGEBNISSE 57 3.8 Outcome 3.8.1 Intensivstationspflichtigkeit und Todesfälle Verlegung(en) auf ITS wg. Sepsis n (%) Anzahl Todesfälle insgesamt n (%) Infektassoziierte Todesfälle n (%)* Q4/2004 N°49 2 (4,1) Q1/05 N°68 2 (2,9) Q2/05 N°68 2 (2,9) Q4/05 N°66 3 (4,5) Q1/06 N°58 2 (3,4) Q2/06 N°48 1 (2,1) 0 2 (2,9) 6 (8,8) 3 (4,5) 4 (6,9) 3 (6,3) 0 1 (1,5) 4 (5,9) 2 (3,0) 2 (3,4) 2 (4,2) Tabelle 3.25: Anzahl (relative Häufigkeit) der Verlegungen und Todesfälle im quartalsbezogenen Vergleich Anmerkung: * bezogen auf die Gesamtzahl der Aufenthalte im jeweiligen Quartal Abkürzungen: ITS= Intensivstation In jedem Quartal der Vorphase war bei genau zwei Aufenthalten aufgrund des Vorliegens einer Sepsis eine Verlegung auf eine Intensivstation erforderlich. Gemessen an der Anzahl der Aufenthalte lag die Verlegungsrate folglich bei 3% (Quartal 1 und 2/2005) bzw. 4% (Quartal 4/2004). Im Verlauf der Interventionsphase nahm die Verlegungsanzahl und –rate von Quartal zu Quartal ab (Tabelle 3.25). Im Rahmen des ersten Dreimonatszeitraums der Vorphase (Quartal 4/2004) war es zu keinem Todesfall gekommen, wohingegen das letzte Vorphasen-Quartal mit 6 Todesfällen die höchste Gesamtmortalität beider Untersuchungsphasen aufwies (6 Todesfälle bei 68 stationären Aufenthalten). Hiervon wurden wiederum 4 (66,7%) als infektassoziiert gewertet. FQ-Prophylaxe No.103 Keine FQ-Prophylaxe No.254 Interventionsphase Interventions- und Vorphase Verlegung(en) auf ITS wg. Sepsis; n (%) 3 (2,9) 9 (3,5) Anzahl Todesfälle n (%) 3 (2,9) 15 (5,9) 2 (1,9) 9 (3,5) Infektassoziierte Todesfälle n (%) (*) Tabelle 3.26: Anzahl (relative Häufigkeit) der Verlegungen und Todesfälle. Vergleich der Kohorten mit versus ohne Fluorchinolonprophylaxe. Anmerkung: (*) bezogen auf die Anzahl aller Aufenthalte je Kohorte. Abkürzungen: ITS= Intensivstation, FQ= Fluorchinolon 3 ERGEBNISSE 58 In der Prophylaxekohorte wurden insgesamt 3 (2,9%) der 103 Aufenthalte aufgrund einer fulminanten Sepsis intensivpflichtig, in der interventionsfreien Kohorte war dies bei 9 (3,5%) von 254 Aufenthalten der Fall T o d e s f ä l l e Anzahl der Todesfälle 7 , 5 (Tabelle 3.26). Im Rahmen von 2 A n z a h l d e r T o d e s f ä l l e ( g e s a m t ) T i n f e k t - a s s o z i i e r t e o d e s f ä l l e 5 (1,9%) Aufenthalten mit Fluorchinolon-Prophylaxe kam es zu einem infektassoziierten Versterben 2 , 5 der 0 Q 4 / 0 4 Q 1 / 0 5 Q 2 / 0 5 Q 4 / 0 5 Q 1 / 0 6 Q 2 / 0 6 Patienten. Unter prophylaxefreien den 254 Aufenthalten ereigneten sich 4 Todesfälle (3,5%), Abb. 3-29: Anzahl der gesamten infektassoziierten Todesfälle je Quartal sowie der deren Genese auf einen vorliegenden eines Infektes zurückgeführt wurde (Tabelle 3.26). In beiden Untersuchungskohorten war bei jedem der infektassoziiert verstorbenen Patienten im Laufe seines Aufenthaltes eine sepsisbedingte, intensivmedizinische Behandlung erforderlich gewesen. G e s a m t m o r t a lit ä t ( % ) 6 ,3 % Q 2 /0 6 6 ,9 % Q 1 /0 6 4 ,5 % Q 4 /0 5 8 ,8 % Q 2 /0 5 2 ,9 % Q 1 /0 5 Q 4 /0 4 0 ,0 % 0 ,0 % 2 ,0 % 4 ,0 % 6 ,0 % 8 ,0 % 1 0 ,0 % A n t e il d e r A u f e n t h a lt e ( % ) Abb. 3-30: Anzahl der Todesfälle in den einzelnen Quartalskohorten. Interventionsphase schraffiert 3.8.2 Liegedauer (Hospitalisierung) Bezüglich der mittleren Liegedauer unterschieden sich die Quartale der Vor- und Interventionsphase nur unerheblich voneinander (Tabelle 3.27). Beide Untersuchungsphasen boten jeweils in ihrem letzten Dreimonatszeitraum (Quartal 2/2005 sowie 2/2006) den niedrigsten Mittelwert der Liegedauer. 3 ERGEBNISSE 59 Q4/2004 N°49 Q1/05 N°68 Q2/05 N°68 Q4/05 N°66 Q1/06 N°58 Q2/06 N°48 30 8 120 1470 25 6 88 1678 22 4 48 1502 27 4 72 1804 28 9 95 1623 25 6 53 1210 Liegedauer [Tage] [=Pflegetage] MEAN MIN MAX Summe Tabelle 3.27: Liegedauer in Tagen. Quartalsweise dargestellt Die mittlere Liegedauer der Chinolonprophylaxe erhaltenden Aufenthalte betrug 28 Tage und übertraf damit die durchschnittliche Hospitalisierungsdauer der prophylaxefreien Studienkohorte um lediglich 3 Tage. FQ-Prophylaxe No.103 Interventionsphase Keine FQ-Prophylaxe No.254 Interventions- und Vorphase 28 6 95 2858 25 4 120 6429 Liegedauer [Tage] [=Pflegetage] MEAN MIN MAX Summe 2000 70 1800 65 1600 60 1400 55 1200 L ie g e d a u e r [T a g e ] PT 50 1000 A n z a h l d e r Au fe n th a lte 45 80 0 Anzahl der Aufenthalte Liegedauer in Tagen Tabelle 3.28: Liegedauer in Tagen. Vergleich der Kohorte mit vs. ohne Fluorchinolon-Prophylaxe 40 Q 4/04 Q 1 /05 Q 2/05 Q 4/05 Q 1/06 Q 2 /06 Abb. 3-31: Anzahl der Aufenthalte sowie Summe der Liegedauer aller Aufenthalte in den Quartalen der Vor- und Interventionsphase 3 ERGEBNISSE 60 3.9 Subgruppen-Analyse Hochdosis-Chemotherapie n (%) Mittlere Neutropeniedauer [d] >1 Neutropeniephase/ Aufenthalt n (%) Keine AL n=220 AL n=137 (+/-FQPx) (+/-FQPx) 127 (57,7) 50 (36,5) 7,1 15,6 5 (2,3) 19 (13,9) Fieber n (%) 101 (45,9) 82 (59,9) FUO (1) n (%) 58 (26,4) 36 (26,3) Tabelle 3.29: Vergleich der Kohorten mit vs. ohne zugrunde liegender Akuter Leukämie (AL) Anmerkung: (1) bezogen auf die Gesamtzahl der Aufenthalte Unabhängig vom Erhalt einer Fluorchinolonprophylaxe wurden in der Subgruppe mit der Grunderkrankung AL zum einen eine längere mittlere Neutropeniedauer (15,6 vs. 7,1 Tage) und zum anderen auch bei einem größeren Anteil an Aufenthalten (13,9% vs. 2,3%) mehr als eine Neutropenie-Episode während ein und desselben Aufenthaltes dokumentiert (Tabelle 3.29 und Tabelle 3.30). Hochdosis-Chemotherapie Mittlere Neutropeniedauer [d] Keine AL n=220 keine FQPx FQPx n=166 n=54 45 (83,3) 82 (49,4) AL n=137 FQPx n=49 21 (42,9) keine FQPx n=88 29 (33,0) 7,9 6,8 16,0 15,4 1 (1,9) 4 (2,4) 7 (14,3) 12 (13,6) Fieber n (%) 23 (42,6) 78 (47,0) 33 (67,3) 49 (55,7) FUO (1) n (%) 17 (31,5) 41 (24,7) 19 (38,8) 17 (19,3) >1 Neutropeniephase/Aufenthalt n (%) Tabelle 3.30: Vergleich der Kohorten mit vs. ohne zugrunde liegender Akuter Leukämie (AL) bei An- oder Abwesenheit einer Fluorchinolonprophylaxe; Anmerkung: (1) bezogen auf die Gesamtzahl der Aufenthalte Wie Tabelle 3.29 zeigt, nahm die Fieberinzidenz in der AL-Aufenthaltsgruppe höhere Werte an als in der Subgruppe mit andersartigen hämato-onkologischen Erkrankungsbildern (59,9% vs. 45,9%). Die Rate an FUO-Episoden war, bezogen auf die Gesamtzahl der KohortenAufenthalten, in beiden Untergruppen nahezu identisch (26,4% vs. 26,3%). Die Aufenthaltskohorte ohne Fluorchinolon-Prophylaxe, bei denen gleichzeitig eine AL zugrundelag (19,3%), wies insgesamt eine geringerer Rate mit Fieberepisoden unklaren Ursprungs auf als ihre Vergleichsgruppe ohne AL Erkrankung (24,7%). Ein umgekehrtes Verhältnis ergab sich in der Subgruppe der Aufenthalte mit Fluorchinolon-Prophylaxe: Hier war die Inzidenz an FUO-Episoden in der AL-Gruppe höher (38,8% vs. 31,5%). In der Subgruppe mit Nicht-AL-Erkrankungen hatte ein deutlich größerer Anteil der Aufenthalte (sowohl mit als auch ohne Fluorchinolon-Prophylaxe) eine HochdosisChemotherapie erhalten (Tabelle 3.29). 3 ERGEBNISSE 61 KEINE AL n=220 keine FQPx FQPx n54 n166 48 (88,9) 127 (76,5) FQPx n49 46 (93,9) keine FQPx n88 75 (85,2) Antimykotika-Therapie n (%) 12 (22,2) 67 (40,4) 26 (53,1) 55 (62,5) Antivirale Prophylaxe/Therapie n (%) 32 (59,3) 86 (51,8) 34 (69,4) 46 (52,3) Antimykotika-Prophylaxe n (%) Antimykotika-Prophylaxe n (%) AL n=137 KEINE AL n=220 +/- FQPx AL n=137 +/- FQPx 175 (79,5) 121 (88,3) Antimykotika-Therapie n (%) 79 (35,9) 81 (59,1) Antivirale Prophylaxe/Therapie n (%) 118 (53,6) 80 (58,4) Tabelle 3.31: Vergleich der Subgruppen (Akute Leukämie vs. keine Akute Leukämie) bezüglich der Anwendungshäufigkeit (Anteil der Aufenthalte in %) einer antimykotischen sowie antiviralen Prophylaxe oder Therapie Sowohl in der Fluorchinolon-Prophylaxekohorte (n=103) als auch in der prophylaxefreien Kontrollgruppe (n=254) war bei der Subgruppe mit zugrundeliegender AL insgesamt häufiger eine antimykotische Prophylaxe oder Therapie angewendet worden als bei Aufenthalten mit einer andersartigen malignen Grunderkrankung. Die Abweichungen zwischen den Anwendungsraten fiel bei der antimykotischen Therapie deutlicher aus als dies bei der Antimykotika-Prophylaxe der Fall war (Tabelle 3.31). Subgruppe Keine Hochdosis-Chemotherapie Mittlere Neutropeniedauer [d] >1 Neutropeniephase/Aufenthalt n (%) Subgruppe Hochdosis-Chemotherapie keine FQPx N°143 10,6 FQPx N°37 14,8 keine FQPx N°111 8,8 FQPx N°66 10,0 13 (9,1) 6 (16,2) 3 (2,7) 2 (3,0) Tabelle 3.32: Vergleich der Aufenthaltskohorten mit vs. ohne Hochdosis-Chemotherapie in Abhängigkeit von der An- oder Abwesenheit einer Fluorchinolonprophylaxe Hochdosis-Chemotherapie +/- FQPx N°177 Mittlere Neutropeniedauer [d] >1 Neutropeniephase/Aufenthalt n (%) keine Hochdosis-Chemotherapie +/- FQPx N°180 9,3 11,5 5 (2,8) 19 (10,6) Tabelle 3.33: Vergleich der Aufenthaltskohorten mit vs. ohne Hochdosis-Chemotherapie 4 DISKUSSION 62 4 DISKUSSION Das Ziel dieser prospektiven Studie war die Untersuchung der Auswirkungen einer neu eingeführten Antibiotika-Prophylaxe mit Levofloxacin (alternativ Ciprofloxacin) auf das Outcome neutropener Patienten, welche in der hämato-onkologischen Abteilung des Universitätsklinikums Freiburg behandelt wurden. Noch im ersten Quartal (4/05) nach Einführung der Fluorchinolon-Prophylaxe (Interventionsphase) waren weniger als die Hälfte (44%) der Aufenthalte einer solchen unterzogen worden. Der Anteil dieser Prophylaxe-Aufenthalte konnte sich erst im letzten Interventionsphasen-Quartal (2/06) auf über 70% steigern. Aufgrund dieser initial moderaten Prophylaxe-Compliance wurde neben einer quartalsbezogenen Auswertung der Patientendaten zusätzlich ein quartalsunabhängiger Zweikohorten-Vergleich (FluorchinolonProphylaxe- versus prophylaxefreie Aufenthaltskohorte) der Patientendaten aus der Vor- und Interventionsphase vorgenommen. Bezüglich der Altersverteilung sowie des Verhältnisses von männlichem zu weiblichem Geschlecht ergaben sich im quartalsbezogenen (aggregierten) sowie im ZweikohortenVergleich keine wesentlichen Unterschiede. Auch die Rate an Aufenthalten, bei welchen GCSF zum Einsatz kam, war in beiden Untersuchungskohorten nahezu identisch. Die mittlere Neutropeniedauer (12 vs. 10 Tage) sowie der Anteil an Aufenthalten mit mehr als einer Neutropeniephase (7,8% vs. 6,3%), erreichte in der Kohorte mit Fluorchinolon-Prophylaxe geringfügig höhere Werte als in der interventionsfreien Kohorte (ohne Prophylaxe). Vermutlich spielten hierbei die im Mittel längeren und verhältnismäßig häufigeren Neutropeniephasen des Patientenkollektivs mit AL eine entscheidende Rolle (Tabelle 3.29 sowie Tabelle 3.30), da dieses Erkrankungsbild in der Chinolon-Prophylaxegruppe zu einem größeren Anteil vertreten war als in der prophylaxefreien Kontrollgruppe (Tabelle 3.2). Auch in einer Studie von Bucaneve et al. (2005) dauerten die Neutropeniephasen in der ALSubgruppe im Mittel länger als in der Patientengruppe mit Lymphom- oder soliden TumorErkrankungen, unabhängig davon, ob eine Levofloxacin-Prophylaxe verabreicht worden war oder nicht. Ungeachtet der Ab- oder Anwesenheit einer Prophylaxe wies auch in unserer Untersuchung die Gruppe der stationären Aufenthalte mit AL insgesamt eine höhere Fieberinzidenz auf als die Aufenthaltskohorte mit andersartigen malignen Grunderkrankungen (Tabelle 3.29 und Tabelle 3.30). Folglich ist anzunehmen, dass sich die (um 13%) höhere ALPrävalenz in der Fluorchinolon-Prophylaxegruppe auch in ihrer (um 4%) höheren Fieberinzidenz wiederspiegelte. Untermauert wird diese Annahme durch die Ergebnisse des letzten Interventionsphasen-Quartals 2/2006, welches mit dem höchsten AL-Anteil 4 DISKUSSION gleichzeitig 63 auch die höchste Fieberinzidenzrate bot. Da dennoch in beiden Untersuchungskohorten (mit vs. ohne Fluorchinolon-Prophylaxe) das Krankheitsbild AL seltener vertreten war als in anderen Prophylaxestudien (Bucaneve et al. 2005, Delarive et al. 2000 Gafter-Gvili et al. 2005), könnte dies auch die vergleichsweise geringere Fieberinzidenz in beiden Gruppen erklären. So ereignete sich (bei einem AL-Anteil von 35%) lediglich bei 50% (127 von 254) der prophylaxefreien Aufenthalte Fieber in der Neutropenie, während in ähnlichen Studien, bei deutlich höheren AL-Raten, insgesamt 85% bis 96% der prophylaxefreien Neutropenie-Episoden Fieber aufwiesen (Bucaneve et al. 2005, Kern et al. 2005, Buchheidt et al. 2003, Delarive et al. 2000). Unter den gegebenen Umständen konnten wir, im Gegensatz zu anderen Prophylaxestudien (van de Wetering et al. 2005, Bucaneve et al. 2005, Cullen et al. 2005, Gafter-Gvili et al. 2005), keine Reduktion der Fieberinzidenz unter prophylaktischer Levofloxacin- bzw. Ciprofloxacin-Einnahme beobachten. Bezogen auf die Gesamtzahl der Aufenthalte mit Chinolon-Prophylaxe stimmte die in unserer Studie beobachtete Inzidenzrate von Fieber unklaren Ursprungs (FUO) mit der von Bucaneve et al. (2005) beschriebenen Inzidenz überein (34% in der Fluorchinolon-Prophylaxekohorte). Laut Link et al. sowie Buchheidt et al. (2003) bleibt bei etwa der Hälfte aller Fieberepisoden in der Neutropenie die Genese unklar. Auch in unserer Untersuchung waren nahezu die Hälfte (49%) aller Fieberepisoden, welche in der prophylaxefreien Gruppe registriert wurden, unbekannten Ursprungs. In der Prophylaxekohorte war ihr Anteil hingegen um 15% höher (Tabelle 3.17). Die höhere FUO-Rate in zuletzt genannter Gruppe lässt sich jedoch nicht durch die höhere AL-Prävalenz in dieser Gruppe erklären, da zwischen der AL-Subgruppe und andersartigen Grunderkrankungen kein wesentlicher Unterschied bezüglich der FUOInzidenzrate festzustellen war (Tabelle 3.29). 4.1 Einfluss der Fluorchinolon-Prophylaxe auf die Infektions- und Bakteriämierate Auch in dieser Arbeit war die in einigen Studien bereits nachgewiesene Reduktion gramnegativer Infektionen und Bakteriämien bei Verabreichung einer täglichen Fluorchinolonprophylaxe zu beobachten (van de Wetering et al. 2005, Bucaneve et al. 2005, Cullen et al. 2005, Gafter-Gvili et al. 2005, Leibovici et al. 2006, Delarive 2000, Engels et al. 1998, Cruciani et al. 1996). In den letzten beiden Quartalen der Interventionsphase (Quartal 1 und 2/2006) zeigte sich, bei inzwischen gewachsenem Anteil an Aufenthalten mit Fluorchinolonprophylaxe, eine deutlich geringere Gesamt-Bakteriämierate als in den vorangehenden Quartalen. Hierbei war sowohl ein Rückgang gramnegativer als auch 4 DISKUSSION 64 grampositiver Bakteriämien zu verzeichnen (vgl. Abb. 3-26 sowie Tabelle 3.19). Im letzten Dreimonatszeitraum der Interventionsphase (Quartal 2/06) ereignete sich im Rahmen der 49 eingeschlossenen Aufenthalte keine einzige Bakteriämie mit gramnegativen Erregern mehr. Gleichzeitig handelte es sich hierbei auch um das Quartal mit dem höchsten Anteil an Aufenthalten mit prophylaktischer Fluorchinolongabe (77%). Auch im Zwei-KohortenVergleich zeigten sich geringere Raten der gesamten, grampositiven (4% vs. 9%) wie auch gramnegativen (2% vs. 9%) bakteriämischen Ereignisse (Tabelle 3.22). Wie bei der Levofloxacin-Prophylaxestudie von Bucaneve et al. (2005) war der Rückgang gramnegativer Bakteriämien im Wesentlichen einer Abnahme von E. coli-Isolaten (0 E. coli-Bakteriämien unter Fluorchinolon-Prophylaxe vs. 13 E. coli-Bakteriämien ohne Intervention) zu verdanken. Der Vergleich von Fluorchinolon-Prophylaxe- (n=103) und interventionsfreier Kohorte (n=254) zeigte, dass auch in unserem Fall von einem bakteriämie- bzw. infektpräventiven Effekt der Chinolonprophylaxe ausgegangen werden kann: Erstere wies eine um 2,3% geringere Inzidenzrate an grampositiven Infektionen (ohne primäre Bakteriämien) auf. Gramnegative Infektionen (ebenfalls primäre Bakteriämien) traten in der Gruppe mit Fluorchinolon-Prophylaxe im Gegensatz zur prophylaxefreien Kontrollgruppe überhaupt nicht auf (Tabelle 3.13). Vor allem bedingt durch die höhere Inzidenz viraler Infektionen in der Fluorchinolon-Prophylaxekohorte war der Unterschied zwischen beiden Kohorten bezüglich der Gesamt-Rate mikrobiologisch dokumentierter Infektionen nur minimal. Eine Meta-Analyse von Gafter-Gvili et al. 2005 ergab bei Auswertung von 14 Studien (Chinolon-Prophylaxe vs. Placebo oder keine Prophylaxe), dass die Verabreichung einer Fluorchinolon-Prophylaxe auch zu einer Senkung des Risikos für klinische Infektionen führte (RR 0,53; 95% CI 0,36-0,80). In der Summe der analysierten Studien war es hierbei bei 137 (24,4%) von 561 Patienten in der Chinolon-Prophylaxegruppe und bei 234 (41,9%) der 558 prophylaxefreien Patienten zu einer klinischen Infektion gekommen. Auch in unseren Untersuchungen ereigneten sich in der Aufenthaltskohorte mit Fluorchinolon-Prophylaxe deutlich weniger klinische Infektionen, im Rahmen derer kein Erregernachweis gelingen konnte (Tabelle 3.13). Verglichen mit Erregerprävalenzdaten anderer Studien lagen in dieser Untersuchung bereits unter den Aufenthalten ohne Fluorchinolon-Prophylaxe relativ niedrige gramnegative sowie grampositive Bakteriämieraten vor: So wiesen in unserer Untersuchung lediglich 22 (9%) der prophylaxefreien Aufenthalte (n=254) bakteriämische Episoden mit gramnegativen Pathogenen auf, während sich in vergleichbaren Neutropenie-Studien bei etwa 16 bis 20% der prophylaxefreien Aufenthalte gramnegative Bakteriämien ereigneten (Kern et al. 2005, 4 DISKUSSION 65 Bucaneve et al. 2005, Delarive et al. 2000, Schimpf et al. 1986). Auch die grampositive Bakteriämierate lag in der prophylaxefreien Kohorte (ohne Miteinbeziehung grampositivgramnegativer Misch-Isolate) bei vergleichsweise niedrigen 9%, während andere Autoren bei diesem Patientenkollektiv grampositive Bakteriämieraten von 16 sowie 18% beobachteten [Kern et al. 2005, Bucaneve et al. 2005 (18% einschließlich rein grampositiver polymikrobieller Bakteriämien)]. Das Vorliegen dieser relativ niedrigen Ausgangs-Bakteriämieraten (wie auch Infektionsraten) könnte sich zu einem gewissen Anteil durch die therapeutische Vorgehensweise der Freiburger Hämato-Onkologie bei vermuteter Infektkonstellation erklären lassen. In beiden Patientenkohorten war, verglichen mit anderen Prophylaxestudien (Reuter et al. 2005, Bucaneve et al. 2005, von Baum et al. 2007), eine zumeist großzügigere Indikationsstellung für den Beginn einer empirischen Antibiotikatherapie zu beobachten. Im Gegensatz zu den drei o.g. Studien wurde in dieser Arbeit in beiden Untersuchungskohorten (mit vs. ohne Fluorchinolon-Prophylaxe) auch bei einem relativ hohen Anteil afebriler Neutropeniepatienten eine Therapie mit einem (Breitband)-Antibiotikum eingeleitet (87% vs. 80% der fieberfreien Aufenthalte). In einigen Fällen waren jedoch zu diesem Zeitpunkt, abgesehen von einem CRP-Anstieg über Norm (und gegebenenfalls einer Mukositis), keine weiteren laborchemischen oder klinischen Anzeichen einer möglichen Infektion vorhanden. Bei lediglich 2 (bzw. 3 unter Einbeziehung einer kontaminierten Blutkultur) der 41 afebrilen Fluorchinolonprophylaxe-Aufenthalte, bei denen eine empirische Antibiotika-Therapie begonnen wurde, war das Vorhandensein einer mikrobiologischen oder rein klinischen Infektkonstellation der Anlass für die Einleitung der Antibiose (und somit für eine Pausierung der Fluorchinolon-Prophylaxe) (Tabelle 3.8). In Folge dessen wurde auch gehäuft eine zuvor begonnene Fluorchinolon-Prophylaxe bereits zu einem relativ frühen Zeitpunkt (d.h. unter Umständen auch schon nach einer Prophylaxedauer von 2 Tagen) wieder abgesetzt. Mikrobiologische Proben wurden somit auch vermehrt unter bereits laufender empirischer Antibiotikatherapie gewonnen, was die Fallzahlen positiver Befunde auch im Sinne einer Dezimierung beeinflusst haben dürfte. Trotz ihrer höheren Rate an potentiellen (kontaminierte Blutkulturen und rein klinische Infektionen) und tatsächlichen (mikrobiologisch belegten) Infektionsereignissen, war der Anteil fieberfreier Aufenthalte, die eine empirischen Antibiotikagabe erhielten, in der Kontrollgruppe ohne Fluorchinolon-Prophylaxe um 7% kleiner (102 (80%) von 127 Aufenthalten) als in der fieberfreien FluorchinolonProphylaxekohorte (41 von 47 Aufenthalte). 4 DISKUSSION 66 Einen eher untergeordneten Effekt auf die relativ niedrigen (Ausgangs-) Bakteriämieraten dürfte die PCP-Prophylaxe gespielt haben: Die verabreichte Dosis von maximal 549 mg/d Cotrimoxazol dürfte zu gering sein, um eine über die PCP hinausreichende, effektive Prävention von gramnegativen Infektionen bewirken zu können. Die in den meisten Studien bislang angewandte Dosierung zur effektiven (gramnegativen) Infektprophylaxe lag in der Regel bei 1920 mg/d (Donelly et al. 1992, Gafter-Gvili et al. 2005). Da trotz des Vorherrschens relativ niedriger Bakteriämie-Prävalenzen und einer teilweise nur kurzdauernden Prophylaxe-Anwendung dennoch eine sichtbare Reduktion in der Infektionsund Bakteriämierate gelingen konnte, ist die enorme Effektivität einer Fluorchinolonprophylaxe mit Levofloxacin nicht von der Hand zu weisen. 4.2 Veränderungen des therapeutischen Antibiotika-Verbrauches unter Fluorchinolonprophylaxe Der häufigere Einsatz einer empirischen Antibiotikatherapie bei den fieberfreien ChinolonProphylaxe-Aufenthalten der Interventionsphase (Tabelle 3.8) spiegelte sich auch in den Daten der antibiotischen Anwendungsdichten wieder: In den Dreimonatszeiträumen der Interventionsphase (nach Einführung der Fluorchinolon-Prophylaxe) kamen, bei Mittelung der 3 Quartals-Verbrauchsdichten, sogar größere Mengen an BSBL in RDD/100 PT zur Anwendung als in der prophylaxefreien Vorphase (vgl. Abb. 3-13 sowie Tabelle 3.7), ohne dass eine um 4% höherer Fieberinzidenz bzw. gesunkene Infekt- und Bakteriämieraten dies erklären würde. Auch in der quartalsunabhängigen Analyse zeigte sich, dass bei der Fluorchinolon-Prophylaxegruppe 4,3 RDD pro 100 PT mehr BSBL-Wirkstoffe angewendet wurden als in der prophylaxefreien Kontrollgruppe, auch wenn unter dem Einsatz der Chinolon-Prophylaxe deutliche Rückgange des Verbrauchs von ISBL, SSBL sowie Antibiotikapräparaten aus der Wirkstoff-Klasse „Sonstige“ zu verzeichnen waren. Gegenüber der prophylaxefreien Kohorte war die Anwendungsdichte von Wirkstoffen aus zuletzt genannter Antibiotikaklasse sogar um insgesamt 20 RDD/100 PT gesunken, was auch das relativ teure Reserve-Antibiotikum Linezolid (Zyvoxid®) mit einem Minderverbrauch von 2 RDD/100 PT miteinschloss. Die Tageskosten für eine intravenösen Therapie mit 2 x 600 mg/d Linezolid beliefen sich im Jahr 2007 auf 183 €. Im vergleich dazu lagen die Tagestherapiekosten für Vancomycin (2000 mg/d) bei 63,60 € sowie für Flucloxacillin (i.v.) bei 15,90 € (Schneider und Richling 2007). Es ist anzunehmen, dass dieser (ökonomisch wertvolle) Rückgang der Anwendungsdichte von Linezolid-Präparaten in der Prophylaxekohorte u.a. in unmittelbarem Zusammenhang mit ihrer geringeren Inzidenz an 4 DISKUSSION 67 Vancomycin-resistenten Staphylokokken-Infektionen (S. aureus oder KNS) sowie VREBakteriämien steht (Tabelle 3.15 sowie Tabelle 3.24). Da der Gesamtverbrauch an Betalaktamen (BSBL, ISBL, SSBL) in beiden Untersuchungs-Gruppen jedoch nahezu übereinstimmte, war die von uns beobachtete Verbrauchs-Reduktion von bestimmten therapeutischen Antibiotika (und der damit einhergehenden Kosten) unter Einsatz der Fluorchinolonprophylaxe (Bow et al. 1995, Kern et al. 2005) weitaus geringer ausgefallen als beispielsweise bei Bucaneve et al. (2005). Letztere sahen in der signifikanten Abnahme febriler Neutropenie-Episoden in der Levofloxacinprophylaxe-Gruppe (Absolute RisikoDifferenz -0,20; 95% CI, –0,26 bis -0,14; p= 0,001) die Hauptursache für den geringeren und damit ökonomischeren Bedarf an therapeutischen Antibiotika in dieser Kohorte: Die mittleren Antibiotikakosten pro Patient betrugen hierbei 1,953 € in der Levofloxacin-Gruppe während die Placebogruppe auf 2,841 € pro Patient kam (p < 0,001). Eine weitere, nicht zu missachtende Konsequenz dieses vergleichsweise großzügigeren Einsatzes von empirischen Antibiotika könnte auf lange Sicht hin das erhöhte Risiko einer Resistenzentwicklung von Erregern gegen diese Wirkstoffe sein (Leibovici et al. 2006). Sinkt ihr Bedarf unter Anwendung einer Fluorchinolonprophylaxe, so könnte diese Gefahr eingedämmt werden und den Fluorchinolon-bedingten Selektionsdruck weitestgehend ausgleichen (Bucaneve et al. 2005, Cullen et al. 2005). Angesichts des erhöhten Bedarfs an empirischen Antibiotika bei Hochrisiko-Patienten, wie beispielsweise Neutropeniepatienten, dürfte ein Anstieg der Erreger-Resistenz gegen Breitbandantibiosen einen weitaus negativeren Einfluss auf ihr klinisches Outcome ausüben, als bei einer erhöhten Prävalenz Fluorchinolonresistener Isolate anzunehmen wäre. 4.3 Resistenzentwicklung unter Fluorchinolon-Prophylaxe Erwartungsgemäß bewegte sich in der prophylaxefreien Vorphase die FluorchinolonResistenz-Prävalenzrate grampositiver wie auch -negativer Erreger auf relativ geringem Level (Tabelle 3.14 und Tabelle 3.15): Insgesamt erwiesen sich lediglich 2 gramnegative (und kein grampositiver) Infektions-Erreger von insgesamt 16 getesteten als Fluorchinolon-resistent. In der Interventionsphase trat lediglich bei einem prophylaxefreien Aufenthalt die einzige grampositive Infektion mit einem Fluorchinolon-resistenten Erreger auf (Bakteriämien hierbei nicht berücksichtigt). Die drei grampositiven Infektionen bei Prophylaxe-Aufenthalten waren nicht bezüglich einer Chinolon-Resistenz getestet worden. Aus Mangel an Fallzahlen und Fluorchinolon-Resistenztestungen (vgl. Cullen et al. 2005), kombiniert mit der initial schlechten, und z.T. nur kurzwährenden Prophylaxe-Compliance (Interventionsphase), ist in 4 DISKUSSION 68 der vorliegenden Arbeit die Beurteilung eines Einflusses der Prophylaxe auf die Rate an Infektionen durch Fluorchinolon-resistente Erreger nur eingeschränkt möglich. Auch die isolierte Betrachtung der Bakteriämien ergab niedrige Inzidenzraten mit Chinolon-resistenten Erregern in der interventionsfreien Kontrollgruppe, in diesem Fall jedoch nur unter den gramnegativen Erregern (Tabelle 3.22 und Tabelle 3.24). Wiederum waren in der Prophylaxegruppe bei lediglich 2 gramnegativen (Enterobacter spp.) und 4 grampositiven Bakteriämien die Absolutwerte und die Anzahl an Resistenztestungen äußerst gering. Daher dürfte auch dem Unterschied in der Inzidenz von Fluorchinolon-resistenten, grampositiven Bakteriämie-Erregern (Prophylaxegruppe: 1 von 1 vs. Kontrollgruppe: 4 von 5 getesteten Isolaten) nur eine geringe statistische Aussagekraft beigemessen werden. Gleiches trifft für den Inzidenz-Vergleich der gramnegativen, Fluorchinolon-resistenten Bakteriämien zu (1 von 2 vs. 3 von 21 Fluorchinolon-getesteten Isolaten Chinolon-resistent). Die Analyse aller mikrobiologischen Proben (inklusive pathologisch nicht-relevanter Befunde) fiel bezüglich der Resistenzprävalenz etwas deutlicher aus (vgl. Kapitel 3.5.1). Wiederum zeigte sich die zu erwartende niedrige Prävalenz Chinolon-resistenter Erreger in der prophylaxefreien Vorphase (20%) gegenüber einer (um 44%) deutlich gestiegenen Rate Fluorchinolon-resistener Organismen in der Interventionsphase (d.h. ab dem Zeitpunkt der Einführung einer Levofloxacin- bzw. Ciprofloxacinprophylaxe). Die Aussagekraft dieses Ergebnisses wird hierbei jedoch durch die Tatsache limitiert, dass die Proben der Interventionsphase auch von Aufenthalten ohne Fluorchinolon-Prophylaxe stammten. Dennoch lässt sich zusammenfassend feststellen, dass die Interventionsphase trotz ihrer gestiegenen Prävalenz Fluorchinolon-resistenter Erreger in allen gewonnenen Proben (vgl. Kapitel 3.5.1) keinen erkennbaren Anstieg einer Infektionsrate durch solche zu verzeichnen hatte. Hierbei gehen die Ergebnisse konform mit Beobachtungen von mehreren Autoren (Bucaneve et al. 2005, Leibovici et al. 2006, Gafter-Gvili et al 2005 und 2007, Pascoe and Cullen 2006). Auch Ugarte-Torres et al. (2006) beobachteten in ihrer ChinolonprophylaxeStudie trotz einer hohen Chinolon-Resistenzprävalenz keinen Anstieg der Infektionsrate mit resistenten Erregern. Zudem ergab eine Meta-Analyse von 8 Chinolonprophylaxe-Studien mit insgesamt 2713 Patienten (Leibovici et al. 2006), dass Patienten mit prophylaktischer Chinolon-Einnahme nicht mehr Infektionen mit Fluorchinolon-resistenten Organismen erlitten, als jene ohne Prophylaxe- bzw. mit Placebo-Anwendung (RR 1.04; 95% CI 0,72 1,50; s.a. Abb. 4-1). Darüber hinaus war in der älteren Version dieser Meta-Analyse (GafterGvili et al. 2005) lediglich ein nicht-signifikanter Anstieg Chinolon-resistenter, kolonisierender Erreger innerhalb der Prophylaxegruppe festgestellt worden (RR 1,69; 95% 4 DISKUSSION 69 CI 0,73 – 3,92). Zwar beobachteten Bucaneve et al. (2005) unter Patienten mit Levofloxacinprophylaxe einen nicht signifikanten Anstieg der Bakteriämierate mit Fluorchinolon-resistenten Erregern. Dieser blieb jedoch ohne Folgen für das Outcome wie die infekt-assoziierte Mortalität oder Morbidität. Abb. 4-1: Quelle Leibovici et al. 2006. Darstellung des Relativen Risikos (RR) mit 95% ConfidenceIntervall (95% CI) für eine Infektion mit Erregern, welche gegen das verwendete Chinolon resistent sind. Die Auflistung der Studien erfolgt nach Erstautoren mit Erscheinungsjahr. Abkürzungen: Chi2 = Chi-Square Test; df= degrees of freedom. Mehrfach wurde von Autoren ein gehäuftes Auftreten von bakteriämischen Episoden und Kolonisationen mit Fluorchinolon-resistenten Streptokokken bei neutropenen (zumeist PBSZT-) Patienten mit Chinolon-Prophylaxe beschrieben. Dieses Phänomen konnte sowohl bei prophylaktischer Anwendung von älteren Chinolonen wie Norfloxacin, Ofloxacin oder Ciprofloxacin (Cruciani et al. 1996, Bochud et al. 1997, Bow et al. 1996, Classen et al. 1990, Menichetti et al. 1989) als auch im Zusammenhang mit neueren prophylaktisch eingesetzten Fluorchinolonen mit erweitertem grampositivem Spektrum (Levofloxacin, Gatifloxacin sowie Moxifloxacin) beobachten werden. Hierbei wurde überwiegend die Gruppe der ViridansStreptokokken (orale Streptokokken) genannt (Razonable et al. 2002, Prabhu et al. 2005, Timmers et al. 2004). In unserer wie auch in einer Arbeit von Kern et al.(2005) wurden hingegen keine Fälle von Streptokokken-Bakteriämien (der Lancefield-Gruppe A-C) bei Patienten mit Levofloxacin-Prophylaxe nachgewiesen, womit auch keine zunehmende Fluorchinolon-Resistenzentwicklung unter Streptokokken beurteilt und bestätigt werden kann. Die einzige Enterokokken-Bakteriämie (Lancefield-Gruppe D), die sich in unseren Untersuchungen bei Aufenthalten mit Fluorchinolon-Prophylaxe ereignet hatte, erwies sich als Chinolon-resistent (sowie Vancomycin-sensibel). Die insgesamt 3 KNS-Bakteriämien, welche sich der Fluorchinolon-Prophylaxegruppe ereigneten, wurden nicht auf FluorchinolonWirkstoffe getestet. Studien von Kern et al. (2004), Oppenheim et al. (1989) sowie Siegrist et 4 DISKUSSION 70 al. (1999) beobachteten in diesem Zusammenhang eine rapide ansteigende Resistenzprävalenz unter aus Kolonisations- oder Infektionsproben isolierten KNS-Stämmen in Abteilungen mit erhöhtem Fluorchinolon-Verbrauch. Dieser Trend erwies sich jedoch bei Oppenheim et al. nach Auslassen von Ciprofloxacin als reversibel. Kern et al. (2004) konnten allerdings keine Korrelation zwischen Abteilungsweitem Fluorchinolon-Verbrauch und Resistenzentwicklung bei KNS, P. aeroginosa sowie S. aureus feststellen, ganz im Gegensatz zu den isolierten E. coli-Stämmen, deren in-vitro Resistenz deutlich mit der Höhe der FluorchinolonAnwendungsdichte korrelierte. Dennoch ergaben sich auch in einer FluorchinolonProphylaxe-Diskontinuitätsstudie von Kern et al. (2005) Hinweise für die Reversibilität der Entwicklung Fluorchinolon-resistenter E. coli-Stämme bei passagerem Aussetzen der Fluorchinolon-Anwendung: Die (in-vitro-) Raten Fluorchinolon-resistenter E. coli- (Bakteriämien) waren in den Jahren vor und nach einer sechsmonatigen Prophylaxepause signifikant höher (Abb. 4-2). Ähnliches beschrieben zudem Martino et al. (1998), die bei Abbruch einer Norfloxacinprophylaxe einen sofortigen Wiederanstieg Norfloxacin-sensibler Enterobakterien feststellen konnten. Da sich in der Prophylaxekohorte unserer Studie keine E. coli-Bakteriämie und lediglich eine E. coli-Infektion (ohne Fluorchinolon-Testung) ereignete, ist keine Aussage zur Resistenzentwicklung unter E. coli-Erregern möglich. In Anbetracht der in o.g. Studien beobachteten Reversibilität, sollte die Sorge über eine zunehmende Resistenzentwicklung unter Fluorchinolon-Prophylaxe nicht zwangsläufig zur Ablehnung einer solchen führen (Bucaneve et al. 2005). Darüber hinaus liefern weitere Arbeiten Hinweise, dass es sich beim Auftreten Fluorchinolon-resistenter E. coli-Stämme offenbar um ein multiklonales Phänomen handelt. Im Rahmen der unten genannten Untersuchungen war es zu keiner Ausbreitung Fluorchinolon-resistenter oder -sensibler E. coli-Stämme unter Neutropeniepatienten gekommen, d.h. es waren keine bzw. selten gemeinsame Genotypen bei verschiedenen Patienten aufgetreten (Oethinger et al. 1996, Tascini et al. 1999, Kern et al. 2005). Anhand einer Follow-up-Studie mit einer erneuten Untersuchungsphase ohne Fluorchinolon-Prophylaxe ließe sich eventuell auch in der vorliegenden Studie ein Trend in der Resistenzentwicklung abschätzen, auch wenn die geringen Fallzahlen der Interventionsphase die Aussagekraft limitieren würden. 4 DISKUSSION 71 Abb. 4-2: Jährliche Anzahl der hämato-onkologischen Patienten mit einer oder mehreren Bakteriämien mit Fluorchinolon-resistentem E. coli (FQREC). Anmerkung: Pfeil markiert den 6-monatigen Untersuchungszeitraum ohne Chinolonprophylaxe. Quelle: Kern et al. (2005) 4.4 Veränderungen des Erregerspektrums unter Fluorchinolonprophylaxe In der Aufenthaltskohorte ohne Chinolon-Prophylaxe war das Spektrum der Erreger, welche im Rahmen von bakteriämischen Episoden isoliert wurden, breiter gefächert und erstreckte sich auf jeweils 5 verschiedene Spezies im gramnegativen wie auch grampositiven Bereich. Bakteriämien, die in der Gruppe der Aufenthalte mit Fluorchinolonprophylaxe registriert wurden, waren hingegen lediglich durch 2 verschiedene grampositive und eine gramnegative Erreger-Spezies verursacht worden (Tabelle 3.22). Im Rahmen von Infektionen (unabhängig von rein primären Bakteriämien) stellten KNS sogar die einzige Erreger-Spezies dar, die isoliert werden konnte. Wie bei Bucaneve et al. (2005) war in der Gruppe der Aufenthalte mit Levofloxacin-Prophylaxe keine einzige S. aureus-Bakteriämie aufgetreten. Es ist davon auszugehen, dass die beobachtete Abnahme der Erregervielfalt unter FluorchinolonProphylaxe (Tabelle 3.22) durch das breite Wirkspektrum von Levofloxacin im gramnegativen wie auch grampositiven Bereich bedingt ist (Hughes et al. 2005, Bucaneve et al. 2005). In einer Meta-Analyse von Leibovici et al. (2006) war die effektive Reduktion grampositiver Bakteriämien in der Gruppe mit Fluorchinolon-Prophylaxe [FluorchinolonProphylaxe- (n=1655) vs. prophylaxefreie Kontrollgruppe (n=1653): RR, 0,37; 95% CI, 0,30 - 0,46] hauptsächlich ihrem reduzierenden Effekt auf Streptokokken- und MRSABakteriämien zu verdanken. In unseren Untersuchungen war der Rückgang grampositiver Infektionen in den Quartalen der Interventionsphase vor allem die Folge einer deutlichen Abnahme von Enterokokken-Infektionen. Diese Veränderung vollzog sich auch in Form sinkender Bakteriämieraten mit Enterokokken (einschließlich der VRE-Bakteriämierate) im gleichen Untersuchungszeitraum (vgl. Tabelle 3.21 sowie Tabelle 3.23). Der Zweikohortenvergleich (mit vs. ohne Ciprofloxacin-/Levofloxacin-Prophylaxe) machte diesen Trend noch deutlicher: 0 vs. 6 Enterokokken-Infektionen (davon 0 vs. 1 VRE-Infektion) bzw. 4 DISKUSSION 72 1 vs. 8 Enterokokken-Bakteriämien (davon 0 vs. 4 mit VRE). Überlappungen durch sekundäre Bakteriämien im Rahmen von Infektionen sind hierbei miteingeschlossen. Donskey et al. (2004) beobachteten in Mausexperimenten bei der Langzeitanwendung von neueren Fluorchinolonen wie Gatifloxacin oder Moxifloxacin eine dosisabhängige Zunahme von Kolonisationen und somit Überwucherungen mit VRE im Gastrointestinaltrakt der Maus. Bei der länger anhaltenden Gabe von Ciprofloxacin oder Levofloxacin (deren Wirksamkeit gegen die anaerobe physiologische Darmflora weniger stark ausgeprägt ist) wurde hingegen mit einem signifikanten Unterschied (p < 0.001) kein derartiger Anstieg einer VRE-Besiedlung beobachtet. Auch bei von Baum et al. (2006) kam es bei einem Prophylaxe-Wechsel von Levofloxacin zu Moxifloxacin zu einem Anstieg der Enterokokken-Bakteriämierate (um 3%) und bei einem Wechsel zurück zu Levofloxacin wiederum zu einem Abfall der Enterokokken–Inzidenzrate um 5% auf 0 Isolate. Da unsere sowie die oben beschriebenen Studien-Ergebnisse gerade auch hinsichtlich der Abnahme der Enterokokken-Rate unter Levofloxacin- oder Ciprofloxacin-Prophylaxe zu einem gewissen Grad Übereinstimmungen aufweisen, dürfte dies ein Argument für die Wahl einer dieser beiden Substanzen zu ungunsten der C8-Methoxy-Fluorchinolone Gatifloxacin oder Moxifloxacin darstellen. Bei Betrachtung der VRE-Inzidenz darf jedoch die Tatsache nicht außer Acht gelassen werden, dass ihr Rückgang sich etwa innerhalb desselben Zeitraumes vollzog, in dem auch eine zunehmend erfolgreichere Eindämmung und Kontrolle der in der Vorphase vorherrschenden VRE-Problematik (hohe Prävalenz an intestinalen VRE-Besiedlungen) gelang. Eine anlässlich des VRE-Ausbruches gebildete klinikinterne Task-Force konnte durch die Einführung gezielter Infektions-Kontrollmaßnahmen eine signifikante Abnahme der VREInfektionen und -Besiedlungen in der hämato-onkologischen Abteilung erreichen. Die diesbezüglich durchgeführten Untersuchungen von Mlangeni et al. (2006) ergaben, dass die Zahl der Infektionen mit VRE von 6 (Oktober 2004) auf 2 (Januar 2005) gesunken war. Auch die Anzahl der mit VRE kolonisierten Patienten nahm im Verlauf um mehr als die Hälfte ab (n=23 im Dezember 2004 gegenüber n=10 im Januar 2005). Wie in anderen Untersuchungen mit neutropenen Patienten stellten KNS die dominierenden Pathogene unter den grampositiven Bakteriämien dar (Bucaneve et al. 2005, Escande und Herbrecht 1998, Kern et al. 2005 [Prä- und Postinterventions-Periode], Wisplinghoff et al. 2003). Diese Tatsache lässt sich anhand ihres physiologischen Vorkommens auf Schleimhäuten und Haut erklären (Oppenheim et al. 1998). Über Eintrittspforten wie etwa Läsionen der oralen bzw. gastro-intestinalen Schleimhautbarriere (z.B. im Rahmen einer 4 DISKUSSION 73 Zytostatika- oder Neutropenie-induzierten Mukositis) oder aber via intravasale Fremdkörper (z.B. ZVK) kann eine erleichterte Translokation dieser Erreger in die Blutbahn stattfinden und diese folglich systemisch wirksam werden. Hinzu kommt der zunehmende Einsatz von Betalaktam-Antibiotika mit erweitertem Spektrum im gramnegativen Bereich, wodurch sich das Erregerspektrum in den letzten 20 Jahren zugunsten grampositiver Bakterien verschoben hat (Seifert et al. 2003, Escande und Herbrecht 1998, Elting et al. 1997, Oppenheim 1998, Zinner 1999, Martin et al. 2003, Cherif et al. 2003). Auch in dieser Arbeit zeigte sich eine Abnahme von polymikrobiellen Bakteriämien (rein grampositiv oder grampositiv/gramnegativ) unter dem Einsatz einer FluorchinolonProphylaxe. Diese Abnahme erreichte bei Bucaneve et al. (2005) Signifikanzniveau. So konnte in unserem Fall unter den Aufenthalten mit Prophylaxe keine einzige polymikrobielle Bakteriämie mehr nachgewiesen werden, ganz im Gegensatz zu den 8 (3%) beobachteten polymikrobiellen Bakteriämien unter den 254 prophylaxefreien Aufenthalten der Kontrollgruppe. Wie bei Bucaneve et al. (2005) waren hierbei die grampositiv-gramnegativen Misch-Isolate den rein grampositiven polymikrobiellen Bakteriämien zahlenmäßig überlegen. Zwei Prophylaxe-Diskontinuitäts-Studien von Reuter et al (2005) sowie Kern et al. (2005) beobachteten ebenfalls eine Zunahme polymikrobieller Isolate in der Gruppe ohne ChinolonProphylaxe. In letzterer lagen bei 8% der Neutropeniephasen polymikrobielle Bakteriämien vor, verglichen mit 3% bzw. 1% in den Kohorten mit prophylaktischen Fluorchinolonen. Bei Cherif et al. (2003) sowie Escande und Herbrecht (1998) lag die Rate polymikrobieller Bakteriämien bei Neutropenie-Patienten ohne antibiotische Prophylaxe bei 10% bzw. 13%. Da in Anbetracht der Studienlage eine Reduktion polymikrobieller Bakteriämie-Episoden durch eine Fluorchinolon-Prophylaxe mit hoher Wahrscheinlichkeit anzunehmen ist, ließe sich durch ihre routinemäßige Anwendung auch die Rate schwerwiegenderer Krankheitsverläufe reduzieren (Reuter et al. 2005), welche laut Buchheidt et al. (2003) gehäuft bei Vorliegen polymikrobieller Bakteriämien auftreten können. 4.5 Unerwünschte Nebenwirkungen (Adverse Effects) Die in mehreren Studien (von Baum et al. 2006, Gaynes et al. 2004, Biller et al. 2007, McCusker et al. 2003, Pepin et al 2005, Muto et al. 2005) beschriebene Zunahme von Fällen mit Clostridium difficile-assoziierter-Diarrhoe (CDAD) bzw. -Enterokolitis bei einer länger anhaltenden Einnahme von Fluorchinolonen (insbesondere Moxifloxacin oder Gatifloxacin), bestätigte sich in dieser Arbeit nicht. In zwei der o.g. Studien (von Baum et al. 2006, Gaynes et al. 2004) wurde sogar ein Rückgang der CDAD-Rate bei einem Wechsel zurück zu einer 4 DISKUSSION 74 Prophylaxe mit Levofloxacin beobachtet. Da Moxifloxacin wie auch Gatifloxacin als C8Methoxy-Fluorchinolone gegenüber Levofloxacin und Ciprofloxacin eine höhere Aktivität im anaeroben Bereich aufweisen, führt eine Anwendung erst genannter neben einer Abnahme der aeroben auch zu einer stärkeren Dezimierung der anaeroben autochthonen Mikroflora des Darms (Beeinträchtigung der intestinalen Kolonisations-Resistenz). Einige Autoren sehen darin eine mögliche Ursache für das übermäßige Wachstum bzw. die steigende Rate an Superinfektionen mit Fluorchinolon-resistenten, potentiell pathogenen Aeroberiern, wie etwa (Chinolon-resistenten) Enterokokken spp. oder E. coli sowie mit Anaerobiern, wie z.B. C. difficile (von Baum et al. 2006, Clasener et al. 1987, Stein und Goldstein 2006, Vollhaard et al. 1990, van der Waaij 1979). Diese Kombination von Reduktion der Kolonisations- und gleichzeitig steigender Fluorchinolon-Resistenz unter C. difficile–Stämmen (McCusker et al. 2003, Gaynes et a. 2004, McDonald et al. 2005, Pépin et al. 2005) könnte eine plausible Erklärung für den Anstieg der CDAD-Rate bei (Langzeit-) Anwendung der genannten C8Methoxy-Fluorchinolone darstellen. In unserer Prophylaxe-Studie erreichte die Rate an Clostridium difficile-assoziierter Diarrhoe bzw. Enterokolitis in der Gruppe mit Levo- bzw. Ciprofloxacin-Prophylaxe mit gerundeten 6% eine identische Inzidenzrate wie in der interventionsfreien Kontrollgruppe (Tabelle 3.13). Von Baum et al. (2006) kamen, die CDAD-Rate betreffend, bei einer der beiden Levofloxacin-Prophylaxekohorten zu einem übereinstimmenden Ergebnis (3 (6,3%) von 48 Neutropeniepatienten). Somit ergibt sich ein weiteres Argument für eine Prophylaxe mit Ciprofloxacin oder Levofloxacin und gegen die Verwendung der Substanzen Moxifloxacin oder Gatifloxacin. Zudem war es in unserer Untersuchung im Rahmen der Chinolonprophylaxe mit Levofloxacin oder Ciprofloxacin sogar zu einer Abnahme von Bakteriämien mit Anaerobiern wie E. coli und Enterococcus spp. gekommen. Weiss et al. (2006) vermuten als Primär-Ursache der in einigen klinischen Zentren gestiegenen CDAD-Raten (McDonald et al. 2005, Muto et al. 2005) ohnehin vielmehr unzureichende Infektionskontrollmaßnahmen und nicht in erster Linie einen vermehrten Fluorchinolon-Verbrauch. Samonis et al. 2005 beobachteten darüber hinaus bei Anwendung von Levofloxacin und insbesondere Moxifloxacin eine signifikant erhöhte Kolonisation des menschlichen Gastrointestinaltraktes mit der Spezies der Gattung Candida. Auch dieses Phänomen sehen die Autoren im unmittelbaren Zusammenhang mit der erweiterten (in-vitro) Aktivität der neueren Fluorchinolone gegen die physiologische anaerobe Darmflora. Wingard et al. (1991) sowie Bow et al. (1996) beschrieben ebenfalls eine Zunahme von Candida-Besiedlungen und –Infektionen bei der Langzeit-Anwendung oraler Chinolone wie Norfloxacin oder Ofloxacin. 4 DISKUSSION 75 Auch wenn die Analyse der mykotischen Besiedlungsdichte von Stuhl- und Speichelproben keinen Endpunkt dieser Arbeit darstellte, konnte zumindest keine wesentliche Erhöhung der Pilz-Infektionsdichte in der Fluorchinolon-Prophylaxe erhaltenden Kohorte beobachtet werden. Diese lag nur geringfügig über der Dichte bzw. Inzidenz an mykotischen Infektionen, die in der prophylaxefreien Vergleichskohorte dokumentiert wurden. Systemische Mykosen im Sinne einer Candidämie waren lediglich bei Aufenthalten ohne Fluorchinolonprophylaxe in Erscheinung getreten. Auch Pultz et al. (2005) beobachteten keine Zunahme der Besiedlungsdichte des Gastrointestinaltraktes von Mäusen mit der Spezies Candida glabrata unter subkutaner Langzeit-Applikation von Levofloxacin. 4.6 Welche Patienten profitieren am meisten von einer FluorchinolonProphylaxe ? Das von uns ausgewählte Patientenkollektiv, welches eine Fluorchinolon-Prophylaxe erhielt, umfasste sowohl Hoch-Risiko-Patienten (Patienten mit AL oder autologer Stammzelltransplantation) als auch Patienten mit potentiell niedrigerem Risiko (solide Tumor- oder Lymphom-Patienten mit Chemotherapie). Einige Autoren schlugen in Anbetracht aktueller Studienergebnisse vor, eine FluorchinolonProphylaxe nur selektiv bei bestimmten (Hochrisiko-) Patientengruppen anzuwenden, um durch kontrollierten und rationalen Fluorchinolon-Einsatz den Selektionsdruck in Richtung Fluorchinolon-resistenter Erreger möglichst gering zu halten (Baden et al. 2005, Freifeld und Sepkowitz 2006, van de Wetering et al 2005, Kern et al. 2005, Uriburu und Rovira 2005, Lo and Cullen 2006, Micozzi und Bucaneve 2005). Pascoe und Cullen (2006) zufolge sollten folgende Patientengruppen Empfänger einer Fluorchinolon-Prophylaxe sein: Patienten mit AL und zytotoxischer Chemotherapie sowie Patienten mit soliden Tumoren oder Lymphomen, welche eine Hochdosis-Chemotherapie oder den ersten Zyklus einer myelosuppressiven Standard-Chemotherapie erhalten, da v.a. im ersten Zytostatika-Zyklus eine signifikante Reduktion des (erhöhten) Risikos für Fieber und Infektionen belegt werden konnte (Cullen et al. 2005). Leibovici et al. 2006 erweitern den Kreis der Empfänger, indem sie den Einschluss von Neutropeniepatienten unmittelbar vor oder nach Erhalt einer autologen Stammzelltransplantation empfehlen. 4.7 Welche Fluorchinolone eignen sich zur prophylaktischen Anwendung? In unserer Untersuchung wurde bei 11 der 103 Prophylaxe-Aufenthalte das Fluorchinolon Ciprofloxacin anstelle von Levofloxacin eingesetzt. In den Auswertungen wurde jedoch 4 DISKUSSION 76 aufgrund dieser geringen Anzahl darauf verzichtet, diese Fälle gesondert bezüglich des Effektes auf das Patienten-Outcome auszuwerten. Leibovici et al. (2006) analysierte in diesem Zusammenhang 6 kleinere Studien (n=521) mit Ciprofloxacinprophylaxe (vs. Placebo oder „no Treatment“) sowie zwei umfangreichere Levofloxacinprophylaxe-Studien (n=2301) von Cullen et al. und Bucaneve et al. (beide aus dem Jahr 2005) bezüglich ihres Effektes auf die Gesamt-Mortalität. Diese Meta-Analysen ergaben sowohl für Cipro- als auch für Levofloxacin eine deutliche Reduktion der Gesamtmortalität (Abb. 4-3) Abb. 4-3: Darstellung des Relativen Risikos (RR) mit 95% Konfidenz-Intervall (95% CI) für das Versterben (Gesamtmortalität) von neutropenen Patienten, welche entweder eine Ciprofloxacin- oder eine Levofloxacin-Prophylaxe erhalten haben. Die Auflistung der Studien erfolgt nach Erstautoren mit Erscheinungsjahr. Abkürzungen: Chi2 = Chi-Square Test; df= degrees of freedom. I²= Test for heterogenity Anmerkung: Die hier gezeigte Darstellung entspricht einem Ausschnitt der Abbildung (Figure 4) aus Leibovici et al. 2006. Pascoe and Cullen sowie Leibovici et al. (2006) empfehlen daher bei der Auswahl eines geeigneten Fluorchinolons sich zwischen Levofloxacin oder Ciprofloxacin zu entscheiden. Den Autoren zufolge spricht das weitere grampositive Wirkspektrum für Levofloxacin, die bessere Anti-Pseudomonaden-Wirkung von Ciprofloxacin hingegen für die prophylaktische Verwendung von letzterem. Die Entscheidung für Levofloxacin oder Ciprofloxacin sollte in Abhängigkeit von den Erregerspektren und Resistenzmustern erfolgen, welche in der lokalen Patientenpopulation des Krankenhaus-Einzugsgebietes überwiegen. Dennoch könnte sich 4 DISKUSSION 77 Levofloxacin letztlich von Vorteil erweisen, da sein Applikationsweise (1 x tgl. 500mg) für eine zufriedenstellendere Compliance sorgen dürfte als Ciprofloxacin (2 x tgl. 500 mg). Gafter-Gvili und Kollegen (2005) berechneten in ihrer Meta-Analyse zwar mehr unerwünschte Nebenwirkungen in der Chinolonprophylaxe-Kohorte als in der Placebo- oder „no Treatment“- Gruppe (RR 1.41; CI 1.09-1.83), diese Nebenwirkungen wurden von den Autoren jedoch als geringradig eingestuft und beeinflussten in einer LevofloxacinProphylaxe-Studie von Cullen et al. (2005) offenbar nicht die Patienten-Compliance. Anhand der im Kapitel 4.5 geschilderten Nebenwirkungen, welche gehäuft bei der prophylaktischen Anwendung von neueren C8-Methoxy-Fluorchinolonen wie Moxifloxacin oder Gatifloxacin auftraten (von Baum et al. 2006, Gaynes et al. 2004, Biller et al. 2007, McCusker et al. 2003, Pepin et al 2005, Muto et al. 2005), scheint eine Standardprophylaxe mit den Substanzen dieser Generation nicht erstrebenswert. 4.8 Optimaler Zeitpunkt für den Beginn einer Fluorchinolon-Prophylaxe In der vorliegenden Arbeit wurde als spätester Zeitpunkt des Prophylaxe-Starts der Beginn der Neutropenie festgelegt. Ein erstmaliges Ansetzen der Prophylaxe war jedoch auch unmittelbar zu Beginn der Chemotherapie möglich. Leibovici et al. (2006) analysierten diesbezüglich mehrere Studien, welche entweder den Start der Antibiotikaprophylaxe zu Beginn der Chemotherapie wählten oder erst bei Auftreten der Neutropenie mit einer solchen begannen. Hierbei konnten keine Unterschiede bezüglich der Reduktion des Fieber- oder Mortalitäts-Risikos festgestellt werden. In Anbetracht der mehrfach beschriebenen Korrelationen zwischen Fluorchinolon-Anwendung und Resistenzentwicklung (Kern et al. 2004, Carratala 1996, Cruciani et al. 1996, Gomez et al. 2003, Bochud et al. 1997, Bow et al. 1996, Classen et al. 1990, Menichetti et al. 1989, Razonable et al. 2002, Prabhu et al. 2005, Timmers et al. 2004, Martino et al. 1998, Richard et al. 1994 und 2001), würde sich eine Verabreichung der Fluorchinolonprophylaxe erst 24 bis 48 Stunden nach Vollendung der Chemotherapie empfehlen (Bucaneve et al. 2005, 1st European Conference on Infection in Leukemia, Juan-les-Pins 2005), um eine Fluorchinolon-Exposition und somit auch den Selektionsdruck möglichst gering zu halten (vgl. Gafter-Gvili et al. 2005). Zudem könnte dadurch die von mehreren Autoren beschriebene Interaktion von Hochdosis- Cyclophosphamid und einer zeitgleich oder vorausgehend applizierten CiprofloxacinProphylaxe umgangen werden, da diese Wechselwirkung laut Autoren zu einer negativen Beeinflussung des Outcomes führen kann (Carlens et al. 1998, Xie et al. 2003, Afsharian et al. 2005). 4 DISKUSSION 78 4.9 Einfluss der Prophylaxe auf die Hospitalisierung (Liegedauer) Eine Arbeit von Cullen et al. (2005) mit 1565 Patienten (solide Tumoren oder Lymphome) ergab, dass durch eine Chinolon-Prophylaxe (vs. Placebo), in allen Chemotherapiezyklen eine Senkung der Hospitalisierungszeit um 27% (95% CI, 10-41%) erreicht werden kann. In der vorliegenden Arbeit konnte sich dieser Effekt nicht bestätigen, da die mittlere Liegedauer in der Prophylaxegruppe drei Tage über jener innerhalb der prophylaxefreien Kontrollgruppe lag (Tabelle 3.28). Es ist anzunehmen, dass dieser Umstand v.a. der um 20% höheren Rate an Hochdosis-Chemotherapie in der Fluorchinolonprophylaxe-Kohorte zu verdanken ist, deren Verabreichung längere Hospitalisierungszeiten bewirken kann. 4.10 Antimykotika-Verbrauch In der Gruppe mit Chinolon-Prophylaxe wurde im Gegensatz zur prophylaxefreien Aufenthaltsgruppe bei einem größeren Anteil an stationären Aufenthalten eine antimykotische Prophylaxe (Amphomoronal-Suspension®, Sempera®, Diflucan®) und insbesondere Therapie eingesetzt. Auch diese Phänomen kann in engem Zusammenhang mit der höheren AL-Prävalenz in erstgenannter Gruppe gesehen werden, da insgesamt mehr Aufenthalte, bei welchen eine AL (Hochrisiko-Patienten) vorlag, prophylaktische und therapeutische Antimykotika erhalten hatten. Auch in einer Studie von Bucaneve et al. (2005) zeigte sich, dass bei Fluorchinolon-Prophylaxe erhaltenden Aufenthalten mit zugrundeliegender Leukämie zu einem größeren Anteil eine antimykotische Prophylaxe angewendet wurde als bei Prophylaxe-Aufenthalten mit soliden Tumorerkrankungen (93 vs. 85%). 4.11 Einfluss der Prophylaxe auf die Mortalität Ähnlich den Prophylaxe-Studien von Bucaneve et al. (2005) (mit Levofloxacin) sowie Talbot et al. (1993) (mit Enoxacin), lag auch in dieser Untersuchung die Rate an infektassoziierten Todesfällen bei etwa 2% vs. 4% (Chinolonprophylaxe vs. keine Prophylaxe). Dennoch waren wie in unserer Untersuchung die Fallzahlen zu gering, um Signifikanzniveau erreichen zu können. Im Gegensatz zu zwei Meta-Analysen von Engels et al. (1998) sowie Cruciani et al. (1996), in welchen kein Effekt der Chinolon-Prophylaxe auf die infektassoziierte Mortalität nachgewiesen werden konnte, ergab eine spätere Meta-Analyse (Gafter-Gvili et al. 2005) von 10 Studien mit Chinolon-Prophylaxe (vs. Placebo), dass die Verabreichung einer solchen das Risiko für ein infektassoziiertes Versterben um 62% (95% CI, 31%-79%) senken kann (vgl. Abb. 4-4). In der Summe waren im Rahmen der ausgewerteten Studien 14 (3%) von insgesamt 542 Patienten mit Chinolon-Prophylaxe, in der Placebogruppe hingegen 33 (7%) 4 DISKUSSION 79 von 480 untersuchten Patienten infektbedingt verstorben. Bezüglich der Gesamtmortalität (alle Todesursachen) zeigte ein Update dieser Meta-Analyse (mittels eine Ergänzung durch die Arbeiten von Cullen et al. 2005 sowie Bucaneve et al. 2005) beim Vergleich von Chinolon-Prophylaxe-Patienten (n=1753) mit Patienten ohne Prophylaxe (n= 1687, Placebo oder „no Treatment“) ebenfalls eine Risiko-Reduzierung bei Anwendung einer Prophylaxe [RR 0,62 (95% CI 0,45-0,86]. Auch Reuter et al. (2005) konnten in ihrer LevofloxacinProphylaxe-Diskontinuitätsstudie, trotz gestiegener Fluorchinolon-Resistenzraten, einen Überlebensvorteil bei Patienten mit Levofloxacin-Prophylaxe gegenüber prophylaxefreien Patienten feststellen. Abb. 4-4: Darstellung des Relativen Risikos (RR) mit 95% Konfidenz-Intervall (95% CI) für die Infektassoziierte Mortalität: Fluorchinolon versus Placebo oder „no intervention“. Anmerkung: Abbildung entnommen aus Gafter-Gvili et al. 2005. In einer Meta-Analyse von van de Wetering und Mitarbeitern (2005) gelang ebenfalls der Nachweis, dass eine Chinolon-Prophylaxe zu einer Reduktion der infektassoziierten Mortalität führen kann, wenngleich der beobachtete Effekt bei vergleichsweise kleinem Patientenkollektiv (4 von 282 Fluorchinolonprophylaxe-Gruppe vs. 10 von 279 prophylaxefreie Gruppe) kein Signifikanzniveau erreichen konnte [RR 0,43 ( 95%CI, 0,151,27)]. 4.12 Limitationen der Studie Insgesamt erwiesen sich die Fallzahlen der in der Prophylaxe-Kohorte isolierten (gramnegativen) Infektions- und Bakteriämie-Erreger als zu gering um eine eindeutige 4 DISKUSSION 80 Aussage bezüglich der Auswirkungen einer Fluorchinolon-Prophylaxe auf eine zunehmende Infektionsrate mit Fluorchinolon-resistenen Pathogenen treffen zu können. Zwar zeigte sich in der Prophylaxekohorte eine geringere Rate infektassoziierter Todesfälle (s.o.), jedoch waren auch hier die Fall- und Kohortenzahlen nicht umfangreich genug, um einen statistisch signifikanten Unterschied zu erreichen. Aufgrund des o.g. relativ großzügigen Einsatzes empirischer Antibiotika bei afebrilen Patienten wurde in diesen Fällen eine zuvor angesetzte Fluorchinolon-Prophylaxe bereits zu einem sehr frühen Zeitpunkt unterbrochen. Hierdurch wurde die Compliance teilweise deutlich reduziert und somit die Wirkungszeit der Prophylaxe stark verkürzt. Mikrobiologische Proben wurden aufgrund dessen vermehrt unter bereits laufender Antibiotikatherapie gewonnen. Ohnehin war der Einsatz einer Fluorchinolon-Prophylaxe zu Beginn der Interventionsphase eher zurückhaltend und konnte sich erst in ihrem Verlauf steigern (70% der Aufenthalte im letzten Interventionsphasenquartal). In beiden Untersuchungskohorten war die Hochrisiko-Gruppe mit AL zu einem deutlich kleineren Anteil vertreten als in vergleichbaren Prophylaxestudien (s.o.), wodurch sich nicht zuletzt auch die verhältnismäßig niedrigeren Fieberraten beider Gruppen erklären ließen. Zudem bewirkte der höhere AL-Anteil in der Fluorchinolon-Prophylaxegruppe aller Wahrscheinlichkeit nach auch die in dieser Gruppe vorherrschende höhere Fieberinzidenz, wodurch in unserer Studie kein Nachweis einer Fieberinzidenz-Senkung unter dem Einfluss einer Chinolon-Prophylaxe gelingen konnte. 4.13 Schlussfolgerungen und Aussichten Die Ergebnisse der vorliegenden Arbeit zeigen, dass die Einführung einer FluorchinolonProphylaxe auch in der Freiburger Hämato-Onkologie durchaus zu einer Verbesserung des klinischen Outcomes führen kann und somit grundsätzlich als sinnvoll zu erachten ist. Bei Einsatz einer Prophylaxe mit Fluorchinolonen oder Vertretern anderer Antibiotikagruppen sollte jedoch stets die mögliche Gefahr einer induzierten Resistenzentwicklung bedacht werden und folglich eine aufmerksame Überwachung und Dokumentation der Resistenzmuster aller isolierten Erreger sowie im Speziellen der Infektionsraten mit resistenten Erregern vollzogen werden. Somit ließe sich frühzeitig ein drohender Effektivitätsverlust einer Prophylaxe bei wachsenden Resistenzraten feststellen (Bucaneve et al. 2005 und Cullen et al. 2005, Reuter et al. 2005, Baden et al 2005). In Gebieten mit hohen Fluorchinolon-Resistenzprävalenzen könnte eine alternative Antibiotikaprophylaxe (eventuell mit neueren Wirkstoffen) in Erwägung gezogen werden, 4 DISKUSSION 81 was die Durchführung weiterer randomisierter, kontrollierter Studien erforderlich machen würde (Leibovici et al. 2006). Gafter-Gvili und Kollegen (2005) konnten bei einer MetaAnalyse von 37 Studien (Prophylaxe n=1486 vs. Placebo n=1451), welche unterschiedliche Antibiotika-Prophylaxen verwendeten, nicht nur alleine für Fluorchinolone (s.o.) eine Reduktion der infektassoziierten Mortalitätsrate nachweisen, sondern auch insgesamt bei Anwendung einer Antibiotikaprophylaxe in der Neutropenie [ RR 0,58; 95% CI (0,45-0,74)]. 5 ZUSAMMENFASSUNG 82 5 ZUSAMMENFASSUNG Die vorliegende Arbeit untersucht anhand prospektiv erfasster Patientendaten in der HämatoOnkologie (Universitätsklinikum Freiburg) die Auswirkungen einer Fluorchinolon- Prophylaxe (FQPx) mit Levofloxacin auf das Outcome neutropener Patienten. In der Vorphase (10/04 bis 06/05) eingeschlossene Patienten erhielten keine FQPx. In der anschließenden Interventionsphase (10/05 bis 06/06), welche die Einführung einer FQPx beinhaltete, ergab sich ein Kollektiv aus FQPx-erhaltenden (n=103) sowie weiterhin prophylaxefreien Aufenthalten. Letztere bildeten zusammen mit den prophylaxefreien Aufenthalten der Vorphase die interventionsfreie Kontrollgruppe (n=254). Die Datenauswertung erfolgte sowohl quartalsweise als auch quartalsunabhängig in Form eines Zweikohortenvergleichs (FQPx vs. keine FQPx). Endpunkte der Auswertung stellten primär die Fieberinzidenz, Infektions- und Bakteriämie-Raten, der Antibiotikaverbrauch sowie FQResistenzprävalenzen dar. Wie in vergleichbaren FQPx-Studien ergab der Zweikohortenvergleich eine geringere Rate an grampositiven sowie gramnegativen Infektionen und Bakteriämien in der FQPx-Kohorte. Letztere zeichnete sich durch die Abwesenheit gramnegativer Infektionen (ausgenommen Bakteriämien) aus. Dementsprechend ergab sich auch in der Abfolge der Interventionsphasen-Quartale eine Minderung o.g. Inzidenzraten, die in den letzten beiden Interventions-Quartalen am deutlichsten ausfiel. In diesen war gleichzeitig auch der Anteil der Aufenthalte mit FQPx auf 64% (Quartal 1/06) bzw. 77% (Quartal 2/06) angestiegen. Vergleichbar mit den Ergebnissen anderer Arbeiten, war auch in unserem Fall der Rückgang gramnegativer Infektionen bzw. Bakteriämien in der FQPx-Kohorte wesentlich einer Abnahme von E. coli-Isolaten zu verdanken und das Sinken der grampositiven Infektions- und Bakteriämie-Raten v.a. die Folge einer abnehmenden Enterococcus spp.- (einschließlich VRE-) Inzidenz. Entgegen anderer Studien wies unsere Prophylaxekohorte vor dem Hintergrund einer um 13% höheren AL-Rate eine (um 4%) höhere Fieberinzidenz auf. Der Antibiotika-Gesamtverbrauch lag in der Prophylaxegruppe bei erhöhtem FQ-Verbrauch zwar um 27,2 RDD/100 PT über dem der prophylaxefreien Kohorte, blieb jedoch v.a. aufgrund des um 20 RDD/100 PT geringeren Verbrauchs „sonstiger Antibiotika“ (Makrolide, Linkosamide, u.a.) hinter dem Betrag des FQ-Anstiegs zurück. In der FQPx-Kohorte erwies sich das einzige grampositive Pathogen (Bakteriämie-Erreger), dessen Antibiogramm die FQ-Testung miteinschloss, als FQ-resistent (FQR). In der Kohorte ohne FQPx waren 5 der 8 getesteten grampositiven Erreger einer Infektion u/o Bakteriämie FQR. Unter den gramnegativen Bakteriämie- und Infektions-Erregern wiesen 1 von 2 (FQPxKohorte) vs. 4 von 34 (keine FQPx) der getesteten Isolate eine FQR auf. 6 LITERATURVERZEICHNIS 83 6 LITERATURVERZEICHNIS 1. Afsharian P, Möllgård L, Hassan Z, Xie H, Kimby E, Hassan M (2005) The effect of ciprofloxacin on cyclophosphamide pharmacokinetics in patients with non-Hodgkin lymphoma. Eur J Haematol. 75: 206-11 2. Arzneimittelkommission des Universitätsklinikums Ulm (1999) Leitlinien Antimikrobielle Therapie und Prophylaxe. 6. Auflage 1999. Ulm. 3. Baden LR (2005) Prophylactic antimicrobial agents and the importance of fitness. N Engl J Med 353: 1052-1054. 4. Ball P (2001) Future of the quinolones. Semin Respir Infect 16: 215-224. 5. Bertz und Frank (2005) Antibiotische Therapie – Fieber in der Neutropenie. In: Engelhardt M, Mertelsmann R, Berger P, Behringer D, Henss H (Hrsg.): Das Blaue Buch – gcp-m@nual (CD-ROM) Onkologie und Hämatologie Version 5.1. Abteilung Medizin I, Hämatologie und Onkologie, Universitätsklinikum Freiburg. 6. Biller P, Shank B, Lind L, Brennan M, Tkatch L, Killgore G, Thompson A, McDonald LC (2007) Moxifloxacin therapy as a risk factor for Clostridium difficile-associated disease during an outbreak: attempts to control a new epidemic strain. Infect Control Hosp Epidemiol 28: 198-201. 7. Bochud PY, Calandra T, Francioli P (1994) Bacteremia due to viridans streptococci in neutropenic patients: a review. Am J Med 97: 256-64. 8. Bow EJ, Ronald AR (1993) Antibacteriel chemoprophylaxis in neutropenic patients where do we go from here? Clin Inf Dis 17: 333-337. 9. Bow EJ, Loewen R, Vaughan D (1995) Reduced riquirement for antibiotic therapy targeting gram-negative organisms in febrile, neutropenic patients with cancer who are receiving antibacterial chemoprophylaxis with oral quinolones. Clin Infect Dis 20: 907-912. 10. Bow EJ, Mandell LA, Louie TJ, Feld R, Palmer M, Zee B, Pater J (1996) Quinolonebased antibacterial chemoprophylaxis in neutropenic patients: effect of augmented grampositive activity on infectious morbidity. Ann Intern Med 125: 183-190. 11. Bucaneve G, Castagnola E, Leibovici L, Menichetti F, Viscoli C (2005) Fluorchinolone prophylaxis in neutropenic patients. 1st European Conference on Infection in Leukemia, Juan-les-Pins 2005. 12. Bucaneve G, Micozzi A, Menichetti F, Martino P, Dionisi MS, Martinelli G, Allione B, D’Antionio D, Buelli M, Nosari AM, Cilloni D, Zuffa E, Cantaffa R, Specchia G, 6 LITERATURVERZEICHNIS 84 Amadori S, Fabbiano F, Deliliers GL, Lauria F, Foà R, Del Favero A (2005) Levofloxacin to prevent bacterial infection in patients with cancer and neutropenia. N Eng J Med 353: 977-987. 13. Buchheidt D, Böhme A, Cornely O, Fätkenheuer G, Fuhe HG, Heussel G, Junghanss C, Karthaus M, Kellner O, Kern WV, Schiel X, Sezer O, Südhoff T, Szelenyi H (2000) Dokumentierte Infektionen bei hämatologischen und onkologischen PatientenEmpfehlungen zur Diagnostik und Therapie. Fachgruppe der Deutschen Gesellschaft für Hämatologie und Onkologie-Arbeitsgruppe „Dokumentierte Infektionen“. 14. Buchheidt D, Böhme A, Cornely OA, Fätkenheuer G, Fuhr HG, Heussel G, Junghanss C, Karthaus M, Kellner O, Kern WV, Schiel X, Sezer O, Südhoff T, Szelenyi H (2003) Diagnosis and treatment of documented infections in neutropenic patients. Ann Hematol 82: 127-132. 15. Carbon C (2001) Comparison of side effects of levofloxacin versus other fluoroquinolones. Chemotherapy 47: 9-14. 16. Carlens S, Ringdén O, Aschan J, Hägglund H, Ljungman P, Mattsson J, Remberger M (1998) Risk factors in bone marrow transplant recipients with leukaemia. Increased relapse risk in patients treated with ciprofloxacin for gut decontamination. Clin Transplant 12: 84-92. 17. Carratala J, Fernandez-Sevilla A, Tubau F (1995) Emergence of quinoloneresistant Escherichia coli in neutropenic patients with cancer who have received prophylactic norfloxacin. Clin Infect Dis 20: 557-560. 18. Carratala J, Fernandez-Sevilla A, Tubau F, Dominguez MA, Gudiol F (1996) Emergence of fluoroquinolone-resistant escherichia coli in fecal flora of cancer patients receiving norfloxacin prophylaxis. Antimicrob Agents Chemother 40: 503– 505. 19. Celkan T, Oskan A, Apak H, Diren Suküfe, Can Günay, Yuksel L, Yildiz I (2002) Bacteriemia in childhood cancer. J Trop Pediatrics 48: 373-377. 20. Cherif H, Kronvall G, Björkholm M, Kalin M (2003) Bacteraemia in hospitalised patients with malignant blood disorders: a retrospective study of causative agents and their resistance profiles during a 14-year period without antibacterial prophylaxis. The Hematoloy Journal 4: 420-426. 21. Claasen DC, Burke JP, Ford CD, Evershed S, Aloia MR, Wilfahrt JK, Elliott JA (1990) Streptococcus mitis sepsis in bone marrow transplant patients receiving oral antimicrobial prophylaxis. Am J Med 89: 441-446. 6 LITERATURVERZEICHNIS 22. 85 Clasener HA, Vollhaard EJ, van Saene HK (1987) Long-term prophylaxis of infection by selective decontamination in leukopenia and in mechanical ventilation. Rev Infect Dis 9: 295-328. 23. Cometta A, Calandra T, Bille J, Glauser MP (1994) Escherichia coli resistant to fluoroquinolones in patients with cancer and neutropenia. N Engl J Med 330: 12401241, (letter). 24. Croom KF, Goa KL (2003) Levofloxacin: a review of its use in the treatment of bacterial infections in the United States. Drugs 63: 2769-2802. 25. Cruciani M , Bassetti D (1994) The fluoroquinolones as treatment for infections caused by gram-positive bacteria. J Antimicrob Chemother 33: 103-417. 26. Cruciani M , Malena M, Bosco O, Nardi S, Serpelloni G, Mengoli C (2003) Reappraisal with meta-analysis of the addition of gram-positive prophylaxis to fluoroquinolone in neutropenic patients. J Clin Oncol 21: 4127-4137. 27. Cruciani M, Rampazzo R, Malena M, Lazzarini L, Todeschini G, Messori A, Concia E (1996) Prophylaxis with fluoroquinolones for bacterial infections in neutropenic patients: a meta-analysis. Clin Infect Dis 23: 795-805. 28. Cullen M, Steven N, Billingham L, Gaunt C, Hastings M, Simmonds P, Stuart M, Rea D, Bower M, Fernando I, Huddart R, Gollins S, Stanley A (2005) Antibacterial prophylab´xis after chemotherapy for solid tumors and lymohomas. N Eng J Med 353: 988-998. 29. Delarive P, Baumgartner JD, Glauser MP, Cometta A (2000) Evaluation de la prophylaxie antibiotique chez les patients neutropéniques avec hémopathie maligne. Schweiz Med Wochenschrift 130: 1837-1844. 30. De With K (2005) Antibiotikaanwendung an acht Universitätskliniken in Deutschland (Projekt INTERUNI-II). Med. Dissertation, Universität Freiburg. 31. Donelly JP, Maschmeyer G, Daenen S (1992) Selective oral antimcrobial prophylaxis for the prevention of infevtion in acute leukaemia-ciprofloxacin versus co-trimocacole plus colistin. The EORTC-Gnotobiotic Project Group. Eur J Cancer. 28 A: 873-878. 32. Donskey CJ, Helfand MS, Pultz NJ, Rice LB (2004) Effect of parenteral fluoroquinolone administration on persistence of vancomycin-resistant enterococcus faecium in the mouse gastrointestinal tract. Antimicrob Agents Chemother 48: 326328. 6 LITERATURVERZEICHNIS 33. 86 Elting LS, Rubenstein EB, Rolston KVI, Bodey GP (1997) Outcomes of bacteriemia in patients with cancer and neutropenia: observations from two decades of epidemiological and clinical trials. Clin Infect Dis 25: 247-259 34. Engels EA, LauJ, Barza M (1998) Efficacy of chinolone prophylaxis in neutropenic cancer patients: a meta analysis. J Clin Oncol 16: 1179-1187. 35. Escande MC, Herbrecht R (1998) Propspective study of bacteriaemia in cancer patients. Rresults of a french multicenter study. Support Care Cancer 6: 273-280. 36. Foleno B, Fu KP (1992) In vitro activity of l-ofloxacin against norfloxacin-resistant coagulase-negative staphylococci. Diagn Microbiol Infect Dis 15: 557-559. 37. Foleno B, Lafredo SC, Fu KP (1993) In vitro activity of levofloxacin, ofloxacin, and other quinolones against coagulase-negative staphylococci. Chemotherapy 39: 120123. 38. Ford CD, Reilly W, Wood J, Classen DC, Burke PB (1998) Oral antimicrobial prophylaxis in bone marrow transplant recipients: randomized trial of ciprofloxacin versus ciprofloxacin-vancomycin. Antimicrob Agents Chemother 42: 1402-1405. 39. Fu KP, Lafredo SC, Foleno B, Isaacson DM, Barret JF, Tobia AJ, Rosenthale ME (1992) In vitro and in vivo antibacterial activities of levofloxacin (l-ofloxacin), an optically active ofloxacin. Antimicrob Agents Chemother 36: 860-866. 40. Freifeld AG, Sepkowitz KA, Martino P, Steven N, Billingham L, Cullen M, Baden LR (2006) Antibacterial prophylaxis in patients with cancer and neutropenia. N Engl J Med 354: 90-94; author reply 90-94. 41. Gafter-Gvili A, Fraser A, Paul M, Leibovici L (2005) Meta-analysis: antiobiotic prophylaxis reduces mortality in neutropenic patients. Ann Intern Med 142: 979-95 42. Gasink LB, Fishman NO, Weiner MG, Nachamkin I, Bilker WB, Lautenbach E (2006) Fluoroquinolone-resistant pseudomonas aeroginosa: assessment o risk factors and clinical impact. Am J Med 119: 526.e19-526.e25. 43. Gaynes R, Rimland D, Killum E, Lowery HK, Johnson TM, Killgore G, Tenover FC (2004) Outbreak of clostridium difficile infection in a long-term care facility: association with gatifloxacin use. Clin Infect Dis 38: 640–645. 44. Gesu GP, Marchetti F, Piccoli L, Cavallero A (2003) Levofloxacin and ciprofloxacin. Invitro activities against 4.003 clinical bacterial isolates collected in Italian laboratories. Antimicrob Agents Chemother 47: 816-819. 45. Gomez-Martin C, Solá M, Hornedo J, Perea J, Lumbreras C, Valentì V, Arcediano A, Rodriguez M, Salazar, R, Cortés-Funes H, Hidalgo M (2000) Rifampicin does not 6 LITERATURVERZEICHNIS 87 improve the efficacy of quinolone antibacterial prophylaxis in neutropenic cancer patients: Results of a randomized clinical trial. J Clin Oncol 18: 2126-2134. 46. Hahn DM, Schimpff SC, Fortner CL, Smyth AC, Young VM, Wiernik PH (1978) Infection in acute leukemia patients receiving oral nonabsorable antibiotics. Antimicrob Agents Chemother 13: 958-64 47. Hurst M, Lamb HM, Scott LJ, Figgitt DP (2002) Levofloxacin: an updated review of its use in the treatment of bacterial infections. J Urol 170: 337-338. 48. Hughes WT, Armstrong D, Bodey GP, Bow EJ, Brown AE, Calandra T, Feld R, Pizzo PA, Rolston KV, Shenep JL, Young LS (2002) Guidelinesfor the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis 34: 730-751. 49. Hughes WT, Chairman, Armstrong D, Bodey GP, Brown AE, Edwards JE, Feld R, Pizzo P, Rolston VI, Shenep JL, Young LS (1997) 1997 Guidelines fot the use of antimicrobial agents in neutropenic patients with unexplained fever. Clin Infect Dis 25: 551-573. 50. Kahn JB (2001) Latest industry information on the safety profile of levofloxacin in the US. Chemother 47: 32-37; discussion 44-48. 51. Kauffmann CA, Liepman, MK, Bergman AG, Mioduszewski J (1983), Trimethoprim/Sulfamethoxacol prophylaxis in neutropenic patients. Reduction of infections and effect on bacterialand fungal flora. Am J Med 74: 599-607. 52. Kern WV, Andriof E, Oethinger M, Kern P, Hacker J, Marre R (1994) Emergence of fluoroquinolone-resistant Escherichia coli at a cancer center. Antimicrob Agents Chemother 38: 681-687. 53. Kern WV, Hay B, Kern P, MarreR, Arnold A (1994) A randomized trial of roxithromycin in patients with acute leucaemia and bone marrow transplant recipients receiving fluorochinolone prophylaxis. Antimicrob Agents Chemother 38: 465-472. 54. Kern WV, Klose K, Jellen-Ritter AS, Oethinger M, Bohnert J, Kern P, Reuter S, von Baum H, Marre R (2005) Fluoroquinolone resistance of Escherichia coli at a cancer center: epidemiologic evolution and effects of discontinuing prophylactic fluoroquinolone use in neutropenic patients with leukaemia. Eur J Clin Microbiol Inf Dis 24: 111-118. 55. Kern WV, Steib-Bauert M, de With K, Reuter S, Bertz H, Frank U, von Baum H (2004) Fluoroquinolone consumption and resistance in haematology-oncology patients: ecological analysis in two university hospitals: 1999-2002. J Antimicrob Chemother 55: 57-60. 6 LITERATURVERZEICHNIS 56. 88 Kerr KG (1999) The prophylaxis of bacterial infections in neutropenic patients. J Antimicrob Chemother 44, 587-591. 57. Kerr KG, Armitage HAT, McWhinney PHM (1999) Activity of quinolones against viridans group streptococci isolated from blood ciltures of patients with haematological malignancy. Support Care Cancer 7: 28-30. 58. Lanzafame A, Bonfiglio G, Santini L, Mattina R (2005) In vitro-activity of levofloxacin against recent gram-negative nosocomial pathogens. Chemotherapy 51: 44-50. 59. Leibovici L, Mical P, Cullen M, Bucaneve G, Gafter-Gvili A, Fraser A, Kern WV (2006) Antibiotic prophylaxis in neutropenic patients. New Evidence, Practical Decisions. Cancer 107: 1743-1751. 60. Link H, Böhme A, Cornely OA, Höffken K, Kellner O, Kern WV, Mahlberg R, Maschmeyer G, Nowrusian MR, Ostermann H, Ruhnke M, Sezer O, Schiel X, Wilhelm M, Auner HW (2003) Antimicrobial therapy of unexplained fever in neutropenic patients. Ann Hematol 82: 105-117. 61. Lo N, Cullen M (2006) Antibiotic prophylaxis in chemotherapy-induced neutropenia: time to reconsider. Haematol Oncol 24: 120-5. 62. Martin GS, Mannino DM, Eaton S, Moss M (2003) The epidemiology of sepsis in the United States from 1997 through 2000. N Engl J Med 348: 1546-1554. 63. Martino P, Venditti M, Petti MC, Mandelli F, Serra P (1984) Cotrimoxazole prophylaxis in patients with leukaemia and prologed granulocyopenia. Am J Med Sci 287: 7-9. 64. Martino R, Subira M, Altés A, López R, Sureda A, Domingo-Albós A, Pericas R, Brunet S (1998) Effect of discontinuing prophylaxis with norfloxacin in patients with hematologic malignancies and severe neutropenia. A matched case-control study of the effect on infectious morbidity. Acta Haematol. 99: 206-11. 65. Maschmeyer G, Beinert T, Buchheidt D, Einsele H, Heussel CP, Kiehl M, Lorenz J (2003) Diagnosis and antimicrobial therapy of pulmonary infiltrates in febrile neutropenic patients. Guidelines of he infectious diseases working party (AGIHO) of the German society of hematology and oncology (DGHO). Ann Hematol 82: 118-126. 66. McCusker ME, Harris AD, Perencevich E, Rughmann MC (2003) Fluoroquinolone use and Clostridium difficile-associated diarrhea. Emerg Infect Dis 9: 730-733. 67. McDonald LC, Killgore GE, Thompson A, Owens RC, Kazakova SV, Sambol SP, Johnson S, Gerding DN (2005) An epidemic, toxin gene-variant strain of clostridium difficile. N Engl J Med 353: 2433-2441. 6 LITERATURVERZEICHNIS 68. 89 Menichetti F, Felicini R, Bucaneve G, Aversa F, Greco M, Pasquarella C, Moretti MV, Del Favero A, Martelli MF (1989) Norfloxacin prophylaxis for neutropenic patients undergoing bone marrow transplantation. Bone Marrow Transplant 4: 489-492. 69. Micozzi A, Bucaneve G (2005) Prophylaxis and treatment of bacterial infections: do we need new strategies. Rev Clin Exp Hematol 9: E4 70. Mlangeni D, Bertz H, Bussmann M, Conrad A, Huebner J, Jonas D, Kist M, Serr A, Dettenkofer M (2006) Management of an outbreak of vancomycin-resistant enterococci in a German university hospital hemato-oncology department. Clin Microbiol Infect 12: 1470-9465. 71. Muto CA, Pokrywka M, Shutt K, Mendelsohn AB, Nouri K, Posey K, Roberts T, Croyle K, Krystofiak S, Patel-Brown S, Pasculle AW, Paterson DL, Saul M, Harrison LH (2005) A large outbreak of clostridium difficile–associated disease with an unexpected proportion of deaths and colectomies at a teaching hospital following increased fluoroquinolone use. Infect Control Hosp Epidemiol 26: 273-280. 72. Naber K, Adam D unter Mitwirkung einer Expertengruppe der Paul-EhrlichGesellschaft e.V. (Halle, E) (1998) Einteilung der Fluorchinolone. Münch. Med. Wschr 140: 248-250. 73. Norrby SR (1999) Levofloxacin. Expert opinion on pharmacotherapy 1: 109-119 74. Oethinger M, Conrad S, Kaifel K, Cometta A, Bille J, Klotz G, Glauser MP, Marre R, Kern WV (1996) Molecular epidemiology of fluoroquinolone-resistant Escherichia coli bloodstream isolates from patients admitted to European cancer centers. Antimicrob Agents Chemother. 40: 387-92. 75. Oppenheim BA (1998) The changing pattern of infection in neutropenic patients. J Antimicrob Chemother 41: 7-11. 76. Oppenheim BA, Hartley JW, Lee W, Burnie JP (1989) Outbreak of coagulase-negativestaphylococcus highly resistant to ciprofloxacin in a leukaemia unit. Br Med J 299: 294-297. 77. Pascoe J, Cullen M (2006) The prevention of febrile neutropenia. Curr Opin Oncol 18: 325-329. 78. Pépin J, Saheb N, Coulombe MA, Alary ME, Corriveau MP, Authier S, Leblanc M, Rivard G, Bettez M, Primeau V, Nguyen M, Jacob CE, Lanthier L (2005) Emergence of fluoroquinolones as the predominant risk factor for clostridium difficile–associated diarrhea: a cohort study during an epidemic in quebec. Clin Infect Dis 41: 1252-1260. 6 LITERATURVERZEICHNIS 79. 90 Pena C, Albareda JM, Pallares R, Pujol M, Tubau FE, Ariza J (1995) Relationship between quinolone use and emergence of ciprofloxacin-resistant escherichia coli in bloodstream infections. Antimicrob Agents Chemother 39: 520-524. 80. Piddock LJV (1994) New quinolones and grampositive bacteria. Antimicrob Agents Chemother 32: 163-169. 81. Prabhu RM, Piper KE, Litzow MR, Steckelberg JM, Patel R (2005) Emergence of qinolone resistance among viridans isolated from the oropharynx of neutropenic peripheral blood stem cell transplant patients receiving quinolone antimicrobial prophylaxis. Eur J Clin Microbiol Infect Dis 24: 832-8. 82. Pultz NJ, Stifel U, Ghannoum M, Helfand MA, Donskey D (2005) Efffect of parenteral antibiotic administration on esthablishment of intestinal colonization by candida glabrata in adult mice. Antimicrob Agents Chemother 49: 438-440. 83. Razonable RR, Litzow MR, Khaliq Y, Piper KE, Rouse MS, Patel R (2002) Bacteremia due to viridans streptococci with diminished suspectibility to levofloxacin among neutropenic patients receiving levofloxacin prophylaxis. Clin Infect Dis 34: 14691474. 84. Reuter S, Kern WV, Sigge A, Döhner H, Marre R, Kern P, von Baum H (2005) Impact of fluoroquinolone prophylaxis on reduced infection-related mortality among patients with neutropenia and haematologic malignancies. Clin Infect Dis 40: 1087-1093. 85. Richard P, Delangle MH, Merrien D, Barillé S, Reynaud A, Minozzi C, Richet H (1994) Fluoroquinolone use and fluoroquinolone resistance: is there an association? Clin Infect Dis 19: 54-9. 86. Richard, Marie Hélène Delangle, François Raffi, Eric Espaze, and Hervé Richet (2001) Impact of fluoroquinolone administration on the emergence of fluoroquinoloneresistant gram-negative bacilli from gastrointestinal flora pascale. Clin Infect Dis 32: 162–166. 87. Rossini F, Verga M, Piotelli P, Giltri G, Sancassani V, Pogliani E M, Corneo G (2000) Incidence and outcome of pneumonia in patients with acute leukemia receiving first induction therapy with anthracycline-containing regimens. Haematologica 85: 12551260. 88. Rolston KV, Yadegarynia D, Kontoyiannis DP, Raad II, Ho DH (2006) The spectrum of gram-positive bloodstream infections in patients with hematologic malignancies, and the in vitro activity of Vrious quinolones against gram-positive bacteria isolated from cancer patients. Int J Infect Dis 10: 223-230 6 LITERATURVERZEICHNIS 89. 91 Rotstein C, Mandell LA, Goldberg N (1997) Fluoroquinolone prophylaxis for profoundly neutropenic cancer patients: a meta-analysis. Curr Oncol 4: 2–7. 90. Rubinstein E, Potgieter P, Davey P, Norrby SR (1994) The use of fluoroquinolones in neutropenic patients-analysis of adverse effects. J Antimicrob Chemother 34: 7-19. 91. Samonis G, Kofteridis DP, Maraki S, Alegakis D, Mantadakis E, Papadakis J, Gikas AH (2005) Levofloxacin and moxifloxacin increase human gut colonization by candida species. Antimicrob Agents Chemother 49: 5189 letter. 92. Schiel X, Hebart H, Kern WV, Kiehl MG, Sölch JP, Wilhelm S, Ostermnann H (2003) Sepsis in Neutropenia. Ann Haematol 82: 158-166. 93. Schimpff SC, Greene WH, Young VM, Fortner CL, Cusack N, Block JB, Wiernik PH (1975) Infection prevention in acute nonlymphocytic leukemia. Laminar air flow room reverse isolation with oral, nonabsorbable antibiotic prophylaxis. Ann Intern Med 82: 351-358. 94. Schimpff SC (1986) Empiric antibiotic therapy for granulocytopenic cancer patients. Am J Med 80: 13-20. 95. Schimpff SC, Scott DA, Wade JC (1994) Infections in cancer patients: some controversial issues. Support Care Center 2: 94-104. 96. Schneider D, Richling (2007) Fakten. Arzneimittel 2007. Thieme, Stuttgart New York, 37-67. 97. Seifert H, Cornely O, Seggewiss K. Decker M, Stefanik D, Wisplinghoff H, Fätkenheuer G (2003) Bloodstream infectioon in neutropenic cancer patients related to short-term nontunneled catheters determined by quantitative blood cultures, differential time to positivity, and molecular epidemiological typing with pulsed-field gel electrophoresis. J Clin Microbiol 41: 118-123. 98. Sickles EA, Greene WH, Wiernik PH (1975) Clinical presentation of infection in granulocytopenic patients. Arch Intern Med 135: 715-719. 99. Stein GE, Goldstein EJC (2006) Fluoroquinolones and Anaerobes. Clin Infec Dis 42: 1598–1607. 100. Talbot GH, Cassileth PA, Paradiso L, Correa-Coronas R, Bond L (1993) Oral enoxacin for infection prevention in adults with acute non-lymphocytic leukemia. The Enoxacin Prophylaxis Study Group. Antimicrob Agents Chemother. 37: 474-482. 101. Tascini C, Menichetti F, Bozza S, Fedele M, Preziosi R, Allegrucci M, Del Favero A, Micozzi A, Martino P, Bistoni F (1999) Molecular typing of fluoroquinolone-resistant 6 LITERATURVERZEICHNIS 92 and fluoroquinolone-susceptible Escherichia coli isolated from blood of neutropenic cancer patients in a single center. Clin Microbiol Infect. 5: 457-461. 102. Timmers GJ, Simoons-Smit AM, Leidekker ME, Janssen JJ, Vandenbroucke-Grauls CM, Huijgens PC (2007) Levofloxacin vs. ciprofloxacin plus phenethicillin for the prevention of bacterial infections in patients with haematological malignancies. Clin Microbiol Infect. 13: 497-503. 103. Timmers GJ, Dijstelbloem Y, Simoons-Smit AM, van Winkelhoff AJ, Touw DJ, Vandenbroucke-Grauls CM, Huijgens PC (2004) Pharamcokinetics and effects on bowel and throat microflora of oral levofloxacin as antibacterial prophylaxis in neutropenic patients with haematological malignancies. Bone Marrow Transplant 33: 847-853. 104. Ugarte-Torres A, Villasis-Keever A, Hernandez-Bribiesca ME, Crespo-Solis E, RuizPalacios GM, Sifuentes-Osornio J, Ponce-de-Leon-Garduno A (2006) Fluoroquinolone prophylaxis utility during chemotherapy-induced severe neutropenia in patients with acute leukaemia, with fluoroquinolone resistance high prevalence, in a reference hospital in Mexico. Rev Invest Clin 58: 547-554. 105. Universitätsklinikum Tübingen Hygieneplan (2005) Infektionserfassung Institut für Medizinische Mikrobiologie und Hygiene (Hrsg.) Ausgabe 1, Seite 1 – 11. 106. Uriburu C, Rovira M (2005) Prophylaxis against infections in neutropenic patients. Enferm Infecc Microbiol Clin 23: 14-18. 107. Van de Wetering MD, de Witte MA., Kremer LC., Offringa M, Scholten RJ, Caron HN (2005) Efficacy of oral prophylactic antibiotics in neutropenic afebrile patients: A systematic review of randomised controlled trials. Eur J Cancer 41: 1372-1382. 108. Van der Waaij, D (1979) The colonization resistance of digestive tract in man and animals. Zentralbl Bakteriol [Suppl] 7:155 161. In: Fliedner TM, Heit H, Niethammer D, Pflieger H. (Hrsg): Clinical and experimental gnotobiotics. Fischer, Stuttgart, New York. 109. Van der Waaij D, Berghuis-Devries JM, van der Lekkerkerk-Wees JEC (1971) Colonization resistance of the digestive tract in conventional and antibiotic-treated mice. J Hyg 69: 405-411. 110. Van der Waaij D, Gaus W, Krieger D, Linzenmeier G, Rozenberg-Arska M, de VriesHospers HG (1986) Bacteriological data on a propspective multicenter study of the effect of two different regimens for selective decontamination in patients with acute leukaemia. Infection 14: 268-274. 6 LITERATURVERZEICHNIS 93 111. Vollaard EJ, Clasener HA, van Saene HK, Muller NF (1990) Effect on colonization resistance: an important criterion in selecting antibiotics. DICP 24: 60-66. 112. Von Baum H, Sigge A, Bommer M, Kern WV, Marre R, Döhner H, Kern P, Reuter S (2006) Moxifloxacin prophylaxis in neutropenic patients. J Antimicrob Chemother 58: 891-894. 113. Weinstein MP (2003) Blood Culture Contamination: Persisting Problems and Partial Progress. J Clin Microbiol 41: 2275-2278. 114. Weiss K (2006) Poor infection control, not fluoroquinolones, likely to be primary cause of clostridium difficile-associated diarrhea outbreaks in Quebec. Clin Infect Dis. 42: 725-727; author reply 727-729. 115. WHO (2007) Guidelines for ATC classification and DDD assignment des World Health Organization Collaborating Centre for. Drug Statistics Methodology. 10th edition, Oslo, Norway. 116. Wingard JR, Merz WG, Rinaldi MG, Johnson TR, Karp JE, Saral R (1991) Increase in Candida krusei infection among patients with bone marrow transplantation and neutropenia treated prophylactically with fluconalzole. N Engl J Med 325: 1274-1277. 117. Wisplinghoff H, Seifert H, Wenzel RP, Edmond MB (2003) Current trends in epidemiology of nosocomial bloodstream infections in patients with hematological malignancies and solid neoplasms in hospitals in the United States. Clin Infect Dis 36: 1103-1110. 118. Wu CJ, Lee HC, Lee NY, Shih HI, Ko NY, Wang LR, Ko CW (2006) Predominance of Gram-negative bacilli and increasing antimicrobial resistance in nosocomial bloodstream infections at a university hospital in southern Taiwan, 1996-2003. J Microbiol Immunol Infect 39: 135-143. 119. Xie HJ, Broberg U, Griskevicius L, Lundgren S, Carlens S, Meurling L, Paul C, Rane A, Hassan M (2003) Alteration of pharmacokinetics of cyclophosphamide and suppression of the cytochrome p450 genes by ciprofloxacin. Bone Marrow Transplant 31: 197-203. 120. Zhanel GG, Ennis K, Vercaigne L. Walkty A, Gin AS, Embil J, Smith H, Hoban DJ (2002) A critical review of the fluorochinolones: Focus on respiratory infections. Drugs 62: 13-59. 121. Ziglam HM, Gelly KJ, Olver WV (2005) A survey of the antibiotic treatment in febrile neutropenia in haematology units in the United Kingdom. Clin Lab Haematol 27: 374378. 6 LITERATURVERZEICHNIS 94 122. Zinner SH (1999) Changing epidemiology of infections in patients with neutropenia and cancer: emphasis on gram-positive and resistant bacteria. Clin Infect Dis 29: 490-494. ANHANG CDC-Kriterien Sepsis B1 Durch Labor bestätigte Sepsis muss eines der folgenden Hauptkriterien erfüllen: 1. Krankheitserreger aus Blutkultur isoliert und Mikroorganismus nicht mit Infektion an anderer Stelle verwandt* 2. eines der folgenden: Fieber (> 38°C), Schüttelfrost oder Hypotonie und eines der folgenden Nebenkriterien: • gewöhnlicher Hautkeim wurde aus zwei zu verschiedenen Zeiten entnommenen Blutkulturen isoliert und ist nicht mit einer Infektion an anderer Stelle verwandt* • gewöhnlicher Hautkeim wurde in Blutkultur bei einem Patienten mit intravaskulärem Fremdkörper isoliert, und Arzt beginnt entsprechende antimikrobielle Therapie • Positiver Antigen-Bluttest und Krankheitserreger ist mit Infektion ananderer Stelle nicht verwandt B2 Klinische Sepsis muss eines der folgenden Kriterien erfüllen: • Fieber (>38°) oder Hypotonie (systolischer Druck < 90 mmHg) oder Oligurie (< 20 ml/h) ohne sonstige erkennbare Ursache und sämtliche der folgenden Anzeichen: • keine Blutkultur durchgeführt oder keine Mikroorganismen oder Antigene im Blut entdeckt • keine offensichtliche Infektion an anderer Stelle • Arzt leitet eine Therapie wegen Sepsis ein * Passt der aus der Blutkultur isolierte Mikroorganismus mit einer nosokomialen Infektion an anderer Stelle zusammen, wird die Sepsis als sekundäre Sepsis klassifiziert. Eine Ausnahme besteht bei der katheterassoziierten Sepsis, die als primäre klassifiziert wird, unabhängig davon, ob an der Insertionsstelle Infektionszeichen bestehen. BX Sekundäre Sepsis ist eine durch eine Blutkultur bestätigte Sepsis, die mit einer nosokomialen Infektion an anderer Stelle in Verbindung steht. Bei einer sekundären Sepsis muss der nachgewiesene Erreger und sein Antibiogramm mit dem primären Infektionsherd übereinstimmen. Beispielsweise hat ein Patient mit einer nosokomialen Harnweginfektion eine positive Blutkultur und sind die Erreger und das Antibiogramm der Blut- und Urinkultur identisch, wird die Infektion als Harnweginfektion mit sekundärer Sepsis gemeldet. Eine sekundäre Sepsis wird nicht einzeln gemeldet. Pneumonie C1 Pneumonie muss eines der folgenden Hauptkriterien erfüllen: 1. Rasselgeräusche bei der Auskultation oder Dämpfung bei Perkussion während der Untersuchung des Thorax und eines der folgenden Anzeichen (Nebenkriterien): • neues Auftreten von eitrigem Sputum oder Veränderung der Charakteristika (z. B. Aussehen, Konsistenz, Geruch) des Sputums • Mikroorganismus aus Blutkultur isoliert • Krankheitserreger aus Bronchoalveolärer Lavage, Bronchialabstrich (geschützte Bürste), transtrachealem Aspirat oder Biopsieprobe isoliert 2. Röntgenuntersuchung des Thorax zeigt neues oder progressives Infiltrat, Verdichtung, Kavitation oder pleuralen Erguss und eines der folgenden Anzeichen: • neues Auftreten von eitrigem Sputum oder Veränderung der Charakteristika des Sputums • Mikroorganismus aus Blutkultur isoliert • Krankheitserreger aus Bronchoalveolärer Lavage, Bronchialabstrich, transtrachealem Aspirat oder Biopsieprobe isoliert • Isolierung eines Virus oder Ermittlung von viralem Antigen in Atemwegssekreten • diagnostischer Einzelantikörper-Titer (IgM) oder vierfacher Titeranstieg (IgG) für den betreffenden Krankheitserreger in wiederholten Serumproben • histopathologische Anzeichen einer Pneumonie Harnweginfektion D1 Symptomatische Harnweginfektion muss eines der folgenden Kriterien erfüllen: Eines der folgenden: 1. Fieber (> 38°C), Harndrang, Häufigkeit, Dysurie oder suprapubische Missempfindungen und eine Urinkultur von > 105 Kolonien/ml Urin mit nicht mehr als zwei Arten von Mikroorganismen 2. Zwei der folgenden: Fieber (> 38°C), Harndrang, Häufigkeit, Dysurie oder suprapubische Missempfindungen und eines der folgenden Anzeichen: • Harnteststreifen für Leukozytenesterase und/ oder Nitrat positiv • Pyurie (> 10 Leukozyten/ml oder > 3 Leukozyten/Gesichtsfeld bei 1000-facher Vergrößerung im nicht-zentrifugierten Urin) • Bei Gram-Färbung einer nicht-zentrifugierten Urinprobe Nachweis von Mikroorganismen zwei Urinkulturen mit wiederholter Isolierung des gleichen Uropathogens mit > 10² KBE/ml Urin im Katheterurin Urinkulturmit < 105 KBE/ml Urin einzelner Uropathogene bei Patienten, die mit der entsprechenden antimikrobiellen Therapie behandelt werden • Diagnose des Arztes • Arzt beginnt entsprechende antimikrobielle Therapie D2 Asymptomatische Bakteriurie muss eines der folgenden Kriterien erfüllen: 1. Blasenkatheter innerhalb von 7 Tagen vor der Urinkultur, kein Fieber (> 38°C) oder andere Symptome der ableitenden Harnwege, > 105 KBE/ml Urin mit max. 2 Arten von Mikroorganismen 2. In den letzten 7 Tagen vor Entnahme der ersten von 2 Urinkulturen kein Blasenkatheter, > 105 KBE/ml Urin, gleiche Keime in mindestens 2 Urinkulturen, max. 2 Arten, keine Infektionszeichen D3 Sonstige Infektionen der Harnwege (Nieren, Ureter, Blase, Urethra,) müssen eines der folgenden Kriterien erfüllen: 1. Mikroorganismus aus Flüssigkeits- (nicht Wundabstrich) der betroffenen Region isoliert Urin) oder Gewebekultur (bzw. 2. Ein Abszess oder sonstiges Anzeichen einer Infektion während der Direktuntersuchung, der Operation oder durch histopathologische Untersuchung festgestellt 3. Zwei der folgenden Anzeichen: Fieber (> 38°C), lokalisierter Schmerz oder Empfindlichkeit der betreffenden Stelle und eines der folgenden: • eitrige Sekretion von der betroffenen Stelle • aus Blutkultur isolierter Mikroorganismus • röntgenologischer Infektionsnachweis • Diagnose des Arztes • Arzt beginnt entsprechende antimikrobielle Therapie Knochen- und Gelenkinfektionen E1 Osteomyelitis muss eines der folgenden Kriterien erfüllen: 1. Mikroorganismus aus dem Knochen in der Kultur anzüchtbar Während der Operation oder bei der histopathologischen Untersuchung festgestellte Osteomyelitis 2. Zwei der folgenden Anzeichen, ohne andere festgestellte Ursache: Fieber (>38°), lokalisierte Schwellung, Empfindlichkeit, Überwärmung oder Sekretion an der Infektionsstelle und eines der folgenden: • Mikroorganismus aus der Blutkultur isoliert • Positiver Antigentest im Blut • Röntgenologischer Anhalt für eine Infektion E2 Gelenk- oder Schleimbeutelinfektion muss eines der folgenden Kriterien erfüllen: 1. Aus Gelenkflüssigkeit oder Synovialbiopsie isolierter Mikroorganismus 2. Während der Operation oder bei der histopathologischen Untersuchung ersichtliche Gelenk- oder Schleimbeutelinfektion 3. Zwei der folgenden Anzeichen, ohne sonstige Ursache: Gelenkschmerz Schwellung, Empfindlichkeit, Überwärmung, Anzeichen von Erguss oder Bewegungseinschränkung und eines der folgenden: • Bei Gram-Färbung der Gelenkflüssigkeit wurden Mikroorganismen und Leukozyten nachgewiesen • Positiver Antigentest in Blut, Urin- oder Gelenkflüssigkeitsproben • Zytologische und chemische Befunde aus der Gelenkflüssigkeit sind mit einer Infektion vereinbar • Röntgenologischer Anhalt für eine Infektion E3 Infektion im Bereich der Bandscheibe muss eines der folgenden Kriterien erfüllen: 1. Mikroorganismus aus einer Kultur des Gewebes der betroffenen Region isoliert, das während einer Operation oder einer Punktion entnommen wurde 2. Infektion der betroffenen Region während der Operation sichtbar oder durch den 3Nachweis in der histopathologischen Untersuchung 3. Fieber (> 38°C) ohne sonstige erkennbare Ursache, oder Schmerzen an der betroffenen Region und ein röntgenologischer Anhalt für eine Infektion 5. Fieber (> 38°C) ohne sonstige erkennbare Ursache und Schmerzen an der betroffenen Region und positiven Antigen-Test im Blut oder Urin Infektionen des Kardiovaskulären Systems F1 Arterien- oder Veneninfektion muss eines der folgenden Kriterien erfüllen: 1. Isolierung eines Mikroorganismus aus der Kultur von intraoperativ entnommenen Arterien- oder Venen, und eine Blutkultur wurde nicht durchgeführt, oder es konnte kein Mikroorganismus aus der Blutkultur isoliert werden 2, Infektion der betroffenen Gefäßstelle während der Operation sichtbar oder durch den Nachweis in der histopathologischen Untersuchung 3. Eines der folgenden Zeichen: Fieber (>38°C), Schmerzen, Rötung oder Überwärmung an der betroffenen Gefäßstelle und beide folgenden: • Semiquantitativer kultureller Nachweis von > 15 Kolonien einer intravasal gelegenen Katheterspitze • keine Blutkultur durchgeführt oder kein Mikroorganismus aus der Blutkultur isoliert 4. Eitrige Sekretion an der betroffenen Gefäßstelle, und es wurde keine Blutkultur durchgeführt oder kein Mikroorganismus aus der Blutkultur isoliert F2 Endokarditis der natürlichen oder künstlichen Herzklappen muss eines der folgenden Kriterien erfüllen: 1. Isolierung eines Mikroorganismus aus der Kultur von Herzklappen oder Vegetationen. 2. Zwei der folgenden Anzeichen, ohne andere festgestellte Ursache: Fieber (> 38°C), neues oder verändertes Geräusch, Hinweise auf arterielle Embolien (z. B. Hautmanifestationen), Zeichen der kardialen Dekompensation oder Herzrhythmusstörungen, und Arzt beginnt entsprechende Therapie und eines der folgenden: • Mikroorganismus aus zwei Blutkulturen isoliert • im Gram-Präparat mikroskopischer Nachweis eines Mikroorganismus von der Herzklappe, wenn die Kultur negativ ist oder nicht angelegt wurde • Herzklappenvegetationen während einer Operation oder Autopsie festgestellt • Positiver Antigentest im Blut oder Urin • Nachweis neuer Vegetationen im Echokardiogramm F3 Myokarditis oder Perikarditis muss eines der folgenden Kriterien erfüllen: 1. Isolierung eines Mikroorganismus aus der Gewebekultur des Perikards oder aus Flüssigkeit, die durch eine Punktion oder eine Operation gewonnen wurde 2. Zwei der folgenden Anzeichen, ohne andere erkennbare Ursache: Fieber (> 38°C), Schmerzen im Brustkorb, paradoxer Puls oder Zunahme der Herzgröße und eines der folgenden: • auf eine Myokarditis oder Perikarditis hinweisende Befunde im EKG • Antigen-Bluttest positiv • Nachweis einer Myokarditis oder Perikarditis durch die histologische Untersuchung des Herzgewebes • vierfacher Anstieg eines typen-spezifischen Antikörpers mit oder ohne Virusisolierung aus Pharynx oder Fäkalien • Perikardialer Erguss, Computertomographie-Scan, gesichert MNR, röntgenologischer Anhalt für eine Infektion durch Angiographie Echokardiogramm, oder sonstiger F4 Mediastinitis muss eines der folgenden Kriterien erfüllen: 1. Isolierung eines Mikroorganismus aus der Gewebekultur des Mediastinum oder aus Flüssigkeit, die während einer Operation oder einer Punktion gewonnen wurde 2. während einer Operation oder durch histopathologische Untersuchung nachgewiesene Mediastinitis 3. eines der folgenden Anzeichen: Fieber (>38°C), Schmerzen im Brustkorb und eines der folgenden: • eitrige Sekretion aus dem mediastinalen Bereich • kultureller Nachweis eines Mikroorganismus aus der Blutkultur oder dem Sekret des mediastinalen Bereichs • bei radiologischer Untersuchung festgestellte Erweiterung des Mediastinums DANKSAGUNG Mein besonderer Dank gilt Herrn Prof. Dr. W. V. Kern für die Überlassung des ebenso interessanten wie aktuellen Themas meiner Doktorarbeit sowie für die gute Betreuung, die ich genießen durfte. Des Weiteren möchte ich mich bei Herrn Prof. Dr. M. Dettenkofer herzlich dafür bedanken, dass er ohne zu zögern bereit war, das Zweitgutachten meiner Arbeit zu übernehmen. Herrn Prof. Dr. H. Bertz möchte ich dafür danken, dass er durch die Einführung der Fluorchinolonprophylaxe in der hämato-onkologischen Abteilung einen wesentlichen Grundstein für diese Arbeit gelegt hat. Ebenso danke ich der Abteilung für Medizinische Mikrobiologie und Hygiene der Uniklinik Ulm für die freundliche Bereitstellung der Datenbank und des Studienprotokolls sowie Torsten Illmann für die Anpassung dieser Datenbank an unsere Studienziele. Zudem danke im Einzelnen: • Michaela Steib-Bauert für ein stets und in jeder Hinsicht offenes Ohr und ihrem wesentlichen Beitrag zur statistischen Auswertung der Daten • Gabriele Peyerl-Hoffmann und Matthias Bussmann für die Unterstützung bei der Datenerhebung und -eingabe sowie im Speziellen Gabi Peyerl-Hoffmann für die Erleichterung meines Arbeitens durch ihre tatkräftige Unterstützung bei organisatorischen und formellen Angelegenheiten sowie für die Ermöglichung eines immer sehr angenehmen Arbeitsplatzes • Dr. Katja de With für ihre wertvollen Tipps bei medizinischen Fragen • Christina und Stephan für das ebenso geduldige wie kritische Korrekturlesen meiner Arbeit - letzterem insbesondere auch für die Hilfe und Geduld, die eine oder andere Widerspenstigkeit des Wordformats in den Griff zu bekommen Abschließend danke ich meinen Eltern ich für ihre vielseitige Unterstützung, ohne die weder mein Studium noch diese Arbeit möglich gewesen wären. LEBENSLAUF Angaben zur Person Name: Geburtsdatum: Geburtsort: Staatsangehörigkeit: Familienstand: Annette Pritzkow 16/05/81 Freiburg i. Breisgau deutsch ledig Schulbildung 1991 – 2000 1987 - 1991 Faust-Gymnasium Staufen, Abschluss: Abitur Grundschule Bollschweil Studium 10/2001 – 06/2008 06/2008 Studium der Humanmedizin, Albert-Ludwigs-Universität Freiburg Staatsexamen (2. Abschnitt der ärztlichen Prüfung) 09/2003 Physikum (Ärztliche Vorprüfung) Famulaturen 2004-2006 Anästhesie und Intensivmedizin, St. Hedwig Krankenhaus Berlin Medizinische Notaufnahme, Uniklinik Freiburg; Ambulanz des Departments Orthopädie und Traumatologie, Uniklinik Freiburg; Pulmologie und Kardiologie, Sozialmedizinischen Zentrum Ost, Wien; Allgemein-, Viszeral- und Unfall-chirurgie, Kreiskrankenhaus Emmendingen; Praktisches Jahr 2007 Medizinische Universitätsklinik Freiburg, Abteilung Kardiologie sowie Gastroenterologie Anästhesiologische Universitätsklinik Freiburg sowie University Hospital of Wales, Cardiff (UK) Department of Anaesthetics and Intensive Care 2006 Spital Zofingen (CH), Abteilung Viszeral-, Unfall- und Gefäßchirurgie Sonstige Praktische Tätigkeiten 2000 - 2001 Freiwilliges Soziales Jahr in der Allgemein- und Viszeralchirurgie des Uniklinik Freiburg