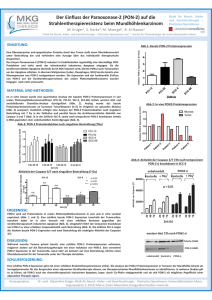
ZIP - FreiDok - Albert-Ludwigs
Werbung

Aus dem Anatomischen Institut der Albert-Ludwigs-Universität Freiburg i. Br. (Prof.Dr.med Bodo Christ, Lehrstuhl Anatomie II) Untersuchungen zum dynamischen Expressionsverhalten von lunatic fringe in der Embryonalentwicklung von Vertebraten INAUGURAL – DISSERTATION zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg i. Br. vorgelegt 1999 von Alexander Josef Herbert Aulehla geboren in Freiburg i. Br. Dekan: Prof. Dr. M. Schumacher 1. Gutachter Prof. Dr. Beate Brand-Saberi 2. Gutachter Prof. Randy L. Johnson Jahr der Promotion 2002 dedicata ai miei genitori Inhaltsverzeichnis 1 Einleitung .................................................................................................................................1 2 Material und Methoden.........................................................................................................12 2.1 Tiere .......................................................................................................................................12 2.2 Mikrochirurgische Manipulationen ....................................................................................13 2.2.1 Material und Instrumente .................................................................................................13 2.2.2 Isolierung der Embryonen ................................................................................................14 2.2.3 Somitennomenklatur .........................................................................................................15 2.2.4 Versuchsreihen...................................................................................................................16 2.2.4.1 Manipulationen an Hühnerembryonen ........................................................................16 2.2.4.2 Manipulationen an Mausembryonen............................................................................19 2.2.5 In vitro Kultivierung der Embryonen...............................................................................20 2.2.5.1 Material und Medien ......................................................................................................20 2.2.5.2 Kultivierung von Hühnerembryonen ...........................................................................21 2.2.5.3 Kultivierung von Mausembryonen ...............................................................................22 2.3 Molekularbiologische Methoden.........................................................................................22 2.3.1 Transformation kompetenter Bakterienzellen.................................................................22 2.3.2 Präparation von Plasmid-DNA ........................................................................................23 2.3.3 Konzentrations- und Reinheitsbestimmung der DNA...................................................25 2.3.4 Spaltung von DNA mit Restriktionsenzymen.................................................................26 2.3.5 Agarosegel-Elektrophorese von DNA und RNA ...........................................................26 2.3.6 Isolierung von DNA–Fragmenten aus Agarosegelen.....................................................27 2.3.7 Reinigung von DNA..........................................................................................................27 2.3.8 Veränderung der DNA-Sequenz mittels Polymerasekettenreaktion ............................28 2.3.9 Klonierung und Produktion eines retroviralen RCAS-Vektors.....................................30 2.3.10 Injektion des Retrovirus in Hühnerembryonen ............................................................35 2.4 Methoden zur Auswertung der Embryonen......................................................................35 2.4.1 Whole-mount in situ Hybridisierung ...............................................................................35 2.4.2 Anfertigung von Gefrierschnitten ....................................................................................39 2.4.3 Alcianblau Knorpelfärbung ..............................................................................................40 2.4.4 Fotografieren der Embryonen...........................................................................................40 3 Ergebnisse................................................................................................................................41 3.1 Übersicht der mRNA-Expression von lunatic fringe im Hühnerembryo .........................41 3.2 Charakterisierung der Dynamik der lunatic fringe Expression .......................................43 3.3 Kontrolle der zyklischen Expression von lunatic fringe ...................................................46 3.3.1 Transversale Durchtrennung der Segmentplatte............................................................46 3.3.2 Isolierung der Segmentplatte von allen umliegenden Geweben...................................47 3.4 Transplantation einer Segmentplatte in ein neues Umfeld ..............................................47 3.5 Retrovirale Überexpression von lunatic fringe in der Segmentplatte................................49 3.6 Vergleich zweier zyklischer Gene: lunatic fringe und c-hairy1 ..........................................50 3.7 Kultivierung von Mausembryonen.....................................................................................51 4 Diskussion...............................................................................................................................52 4.1 Diskussion der Ergebnisse ...................................................................................................52 4.2 Über Oszillationen und Zyklen ...........................................................................................57 4.3 Theoretische Überlegungen zur Funktion von lunatic fringe in der Somitogenese.........58 4.4 Ausblick .................................................................................................................................61 5 Zusammenfassung..................................................................................................................62 6 Literaturverzeichnis................................................................................................................63 7 Anhang.....................................................................................................................................69 7.1 Liste der Abkürzungen ........................................................................................................69 7.2 Standardlösungen.................................................................................................................70 7.3 Lösungen und Medien für mikrochirugische Manipulationen ........................................71 7.4 Lösungen/ Reagenzien für die Whole-mount in situ Hybridisierung.............................71 8 Abbildungen ...........................................................................................................................75 9 Danksagung.............................................................................................................................93 10 Lebenslauf .............................................................................................................................95 11 Verzeichnis eigener Publikationen ....................................................................................96 11.1 Originalarbeiten ..................................................................................................................96 11.2 Gedruckte Abstracts von Kongreßbeiträgen ....................................................................96 12 Erklärung ...............................................................................................................................97 1 1 Einleitung Die segmentale Organisation des Körperbauplans ist ein Charakteristikum vieler Tierspezies. Man findet metamere Baupläne sowohl in Vertebraten, in denen die Metamerie am Aufbau der Wirbelsäule sichtbar wird, als auch in Invertebraten. Bei Vertebraten ist die bleibende Segmentierung auf die Bildung der Somiten zurückzuführen. Somiten stellen epitheliale kugelige Strukturen dar, die paarweise auf beiden Seiten des Neuralrohrs angelegt werden. Sie wurden bereits 1689 von Malpighi zum ersten Mal beschrieben und nehmen in der frühen Embryonalentwicklung eine besondere Stellung ein (Malpighi 1689). Zum einen sind sie das erste sichtbare Zeichen einer Segmentierung des Embryos und stellen die Vorläufer der Wirbelkörper dar, die namensgebend für die Klasse der Vertebraten sind. Sie sind darüber hinaus Ursprung der Rippen und der Wirbelbögen und der gesamten quergestreiften Muskulatur der Extremitäten und des Rumpfes (BrandSaberi et al. 1996). Auch tragen Somiten zur Bildung von Endothelien der Blutgefäße und Angioblasten bei (Wilting et al. 1995). Die Somiten bedingen durch ihre metamere Anordnung die segmentale Organisation weiterer Strukturen, wie z.B dem peripheren Nervensystem und dem primären Blutkreislauf (Christ et al. 1979; Rickmann et al. 1985). Dieser Vorgang wird in der Literatur als sekundäre Segmentierung bezeichnet und damit der primären Segmentierung der Somiten gegenübergestellt (Christ et al. 1998). Neben primärer und sekundärer Segmentierung wurde auch eine tertiäre Segmentierung beschrieben. So bewirken die Spinalganglien, die ihrerseits sekundäre Segmente darstellen, die metamere Anordnung der Wirbelbögen, die somit als tertiäre Segmente bezeichnet werden können (Strudel 1955). Eine weiterer wichtiger Vorgang während der Segmentierung in Vertebraten ist die sogenannte Neugliederung, die 1850 von Remak beschrieben worden ist (Remak 1850). Remak beobachtete, daß die Somitengrenzen nicht den endgültigen Wirbelkörpergrenzen entsprechen, so daß im Zuge der Differenzierung der Somiten eine Neugliederung stattgefunden haben muß. Durch neuere embryologische Untersuchungen, v.a. durch die mikrochirurgische Transplantation von Somiten, konnte der Prozeß der Neugliederung experimentell gesichert werden (Brand-Saberi und Christ 1999; Huang et al. 1996). Ein Somit bildet dabei die kraniale bzw. kaudale Hälfte zweier 2 Einleitung benachbarter Wirbelkörper, das gleiche trifft für den distalen Teil zweier benachbarter Rippen zu (Huang et al. 1996). Durch die Neugliederung wird auch erreicht, daß die Intervertebral-und Interkostalmuskeln, die aus einem Somiten stammen, ebenfalls zwei definitive Segmente überbrücken und miteinander verbinden. Damit stellt die Neugliederung die Grundlage der Funktionsweise einer Bewegungseinheit dar. Trotz dieser großen Bedeutung der Somitenbildung für die regelrechte Entwicklung des Embryos und zahlreicher Untersuchungen auf morphologischer, zellulärer, molekularer und genetischer Ebene bleibt bis heute der Mechanismus der Somitenbildung enigmatisch. Um in die aktuellen Fragestellungen und das Thema dieser Arbeit einzuführen, sollen zunächst die wichtigsten frühembryonalen Prozesse, in die die Somitogenese eingebettet ist, erläutert werden. Die Gastrulation stellt den entscheidenden Umbauvorgang in der frühen Embryonalentwicklung dar. Ein bekanntes Zitat spiegelt die Bedeutung dieses Vorganges wieder: „It is not birth, marriage, or death, but gastrulation, which is truly the most important time in your life“ (Lewis Wolpert, 1986). Dieser Prozeß, der zur Ausbildung der dreiblättrigen Keimscheibe, bestehend aus Ektoderm, Mesoderm und Entoderm führt, beginnt in der Maus am Tag 6,5 dpc (dies post coitum), in Hühnerembryonen nach einer Bebrütungszeit von 12-13 Stunden (entspricht dem Hamburger und Hamilton Stadium HH3, siehe Material und Methoden) (Hamburger und Hamilton 1992; Tam 1981). Epiblastzellen wandern dabei durch den Primitivstreifen, der eine mediale Zellverdichtung des Epiblasten darstellt, in die Tiefe und bilden durch diese Immigration das Mesoderm und das Entoderm. Die verbleibenden Epiblastzellen bilden die Ektodermschicht. Das Mesoderm läßt sich in verschiedene Kompartimente unterteilen: axiales, paraxiales, intermediäres und Seitenplattenmesoderm (Christ und Ordahl 1995). Aus dem axialen Mesoderm entsteht früh die Rückensaite (Chorda dorsalis), die wichtige induktive Funktionen, wie z.B die Induktion des Neuroektoderms übernimmt. Das intermediäre Mesoderm stellt das Zellmaterial für die Ausbildung der Urogenitalanlage, während das Seitenplattenmesoderm sich zu zahlreichen Geweben, wie z.B der glatten Muskulatur der Blutgefäße und des Verdauungstraktes sowie zum Herzmuskelgewebe entwickelt (Christ und Ordahl 1995). Nur das paraxiale Mesoderm hat das Potential, Somiten zu bilden. 3 Einleitung Im paraxialen Mesoderm unterscheidet man die bereits gebildeten Somiten vom noch unsegmentierten Bereich. Dieser mesenchymale, lockere Zellverband wird in Mausembryonen als präsomitisches Mesoderm (PSM) bezeichnet, in Hühnerembryonen nennt man diesen Bereich Segmentplatte (SP). Diese Begriffe werden im Verlauf dieser Arbeit synonym verwendet. Die Zellen, die die SP und damit die Somiten konstituieren, stammen zunächst direkt aus dem Gastrulationsprozeß. Nach Abschluß der Gastrulation liefert eine mesenchymale Proliferationszone, die Schwanzkospe, das Zellmaterial für die Segmentplatten. Die Schwanzknospe (tail bud) ist ein Rudiment des Primitivstreifens und bildet sich am posterioren Ende des Embryos (Schoenwolf 1979). Sie besteht aus undifferenzierten mesenchymalen Zellen, die die Fähigkeit besitzen, sich zu zahlreichen Geweben, unter anderem den Somiten, aber auch dem posterioren Anteil des Neuralrohrs differenzieren zu können (Griffith et al. 1992). Aus dieser Proliferationszone treten Zellen in die SP ein. Dadurch wird der Zellverlust, der durch die Somitenbildung am kranialen SP-Ende entsteht, ausgeglichen, so daß die Länge der SP über einen gewissen Zeitraum konstant gehalten werden kann (Tam 1981). In Hühnerembryonen wurde gezeigt, daß eine SP das Zellmaterial für 10-12 prospektive Somiten enthält, während das präsomitische Mesoderm von Mausembryonen nur 4-5 prospektive Somiten enthält (Packard 1976; Tam 1981). Der Vorgang, der zur Somitenbildung führt, ist komplex und setzt sich aus mehreren Teilprozessen zusammen, die in ihrer Gesamtheit als Somitogenese bezeichnet werden (Gossler und Hrabe de Angelis 1998). Dieser Begriff beinhaltet folgende Aspekte: (a) die Regionalisierung des Mesoderms (Gliederung in paraxiales, intermediäres und Seitenplattenmesoderm) (b) die Vorsegmentierungsperiode, die die Vorgänge der regionalen Spezifizierung (z.B Spezifizierung thorakaler Somiten, die später die Rippenanlage bilden, in Abgrenzung zu zervikalen Somiten, die diese Fähigkeit nicht besitzen) und der Polarisierung der Somiten in eine anteriore und eine posteriore Hälfte, sowie die Definierung der Somitengröße beinhaltet. Diese Vorgänge finden vor der Bildung der Somiten statt (Stern et al. 1988). 4 Einleitung (c) die Somitenbildung: dieser Vorgang umfaßt die Segmentierung sowie die Epithelialisierung des paraxialen Mesoderms (d) die Somitenreifung: sie setzt mit der Spezifizierung unterschiedlicher Zellgruppen ein, wodurch der Somit in verschiedene Kompartimente unterteilt wird (Brand-Saberi et al. 1996). Anschließend findet die Differenzierung auf morphologischer Ebene statt. Alle diese Teilprozesse sind Gegenstand intensiver Untersuchungen, womit die Komplexität der Somitenforschung deutlich wird. Die vorliegende Arbeit konzentriert sich auf die Vorsegmentierungsperiode und die Somitenbildung, weshalb auf diese Aspekte detaillierter eingegangen werden soll. Die Bildung der Somiten vollzieht sich achsensymmetrisch auf beiden Seiten des Neuralrohrs in einer kranial-kaudalen Sequenz. Der Vorgang beginnt am kranialen Ende der Segmentplatte, indem Zellen eine koordinierte mesenchymale–epitheliale Transformation durchführen und sich von der Segmentplatte abschnüren. Durch diese Epithelialisierung und Segmentierung entsteht ein neuer Somit (Christ et al. 1998; Keynes und Stern 1988; Tam und Trainor 1994; Yamaguchi 1997). Dieser Prozeß wiederholt sich periodisch und setzt sich nach kaudal fort, bis die Gesamtzahl der Somiten, etwa 50 bei Hühnerembryonen und 65 bei Mausembryonen, gebildet wurden. Bei Hühnerembryonen bilden sich Somiten mit einer Frequenz von 90-95 Minuten. Somiten sind entlang der anterior-posterioren Achse polarisiert, d.h. sie besitzen eine anteriore und eine posteriore Hälfte. Diese Polarisierung ist Voraussetzung für die Aufrechterhaltung der Somitengrenzen. Bringt man experimentell zwei anteriore Somitenhälften in Kontakt, so mischen sich die Zellen beider Hälften. Bei der Konfrontation einer posterioren mit einer anterioren Hälfte entsteht jedoch eine Grenze und die Zellen beider Hälften mischen sich nicht (Stern und Keynes 1987). Die Polarisierung stellt darüber hinaus eine Grundlage für die sekundäre Segmentierung dar. Motoneurone, die aus dem Neuralrohr auswachsen, migrieren nur durch das jeweilige anteriore Somitenkompartiment. Ebenso verhält es sich mit Neuralleistenzellen, die aus dem Neuralrohr auswandern. Sie wandern ebenfalls nur durch den anterioren Somiten, so 5 Einleitung daß auch die Spinalganglien, zu denen die Neuralleistenzellen sich im Laufe der Entwicklung differenzieren, regelmäßig segmental angeordnet werden (Keynes et al. 1991). Die Somitenbildung umfaßt die Prozesse der Epithelialisierung und der Segmentierung. Diese Unterscheidung ist auch deshalb sinnvoll, weil die Regulation dieser Teilprozesse nicht identisch zu sein scheint. So zeigten rekombinante Mutationsexperimente in der Maus, daß zumindest eine Segmentierung auch ohne Epithelialisierung stattfinden kann (Burgess et al. 1996). In Mausembryonen, die kein funktionelles Paraxis produzieren, findet keine Epithelialisierung des paraxialen Mesoderms statt und es bilden sich daher keine Somiten. Trotzdem zeigt das paraxiale Mesoderm eine Segmentierung in metamere Einheiten. Auch Experimente in Hühnerembryonen unterstützen diese Trennung in zwei eigenständige Prozesse. Entfernt man alle umliegenden Gewebe von der Segmentplatte, so kann nur der unmittelbar an die Somiten angrenzende Teil der Segmentplatte einen Somiten bilden, d.h. es findet hier sowohl eine Segmentierung als auch eine Epithelialisierung statt. Weiter posterior lokalisierte Bereiche der Segmentplatte können in Abwesenheit der umliegenden Gewebe keine Epitheliarisierung durchführen, führen jedoch eine Segmentieung durch (Palmeirim et al. 1998). Die Information für die Segmentierung muß daher zu einem sehr frühen Zeitpunkt an die Segmentplattenzellen vermittelt worden sein, wohingegen die Epitheliarisierung auf permissive Signale aus umliegenden Geweben angewiesen ist (Sosic et al. 1997). Weitere Ergebnisse sprechen für eine solche frühe Determination der Segmentierung. Wird die SP eines Hühnerembryos mikrochirugisch in kranial-kaudaler Richtung rotiert, so entstehen die Somiten ebenfalls in umgekehrter Richtung, also von kaudal nach kranial (Christ et al. 1974). Die Segmentierungsrichtung ist damit mit der Bildung der Segmentplatte bereits festgelegt. Bei transversaler Durchtrennung des Embryos bilden sich Somiten zeitgerecht, so daß auch die Intaktheit der Segmentplatte keine Bedingung für den zeitgerechten Ablauf der Segmentierung darstellt. Diese Ergebnisse führten zu der Ansicht, daß die Segmentierung eine intrinsische und autonome Kapazität der Segmentplatte darstellt (Christ et al. 1974; Gossler und Hrabe de Angelis 1998). Eine weitere Eigenschaft der Somitenbildung ist die große Konstanz der Somitenzahl innerhalb einer Spezies. Unabhängig von der Größe der Embryonen wird eine konstante 6 Einleitung Somitenzahl gebildet. Die Embryonengröße läßt sich z.B. in Amphibienembryonen experimentell dadurch manipulieren, daß eine große Anzahl an Blastulazellen entfernt wird. Daraufhin entwickeln sich kleinere aber regelrecht proportionierte Embryonen mit einer normalen Anzahl an Somiten, die jedoch weniger Zellen pro Somit enthalten (Cooke 1975; Waddington und Deucher 1953). Auch in Mausembryonen kann die Regulation der Somitenzahl beobachtet werden. So besitzt die Mausmutante amputated eine geringere Körperlänge, doch ist die Anzahl der Somiten am Tag 9,5 dpc normal. Wiederum wird die Anzahl der Somiten konstant gehalten, indem die Zellzahl pro Somit reduziert wurde (Flint et al. 1978; Tam 1981). Es muß angemerkt werden, daß auch Zweifel bestehen, ob es sich bei dieser Regulation der Somitenzahl um ein repräsentatives Prinzip handelt, da es in mehreren Spezies, Reptilen, Amphibien,Vögel und Säugetieren auch Beispiele für ein Fehlen einer solchen Regulation gibt (Fowler 1970; Gossler und Hrabe de Angelis 1998; Keynes und Stern 1988). Bis heute bleibt die Frage unbeantwortet, wie eine derart systemische Regulation erreicht werden könnte. Wie kann ein Embryo schon zu Beginn seiner Entwicklung die Reduktion seiner Körpergröße in die Bildung der Somiten integrieren? Das „Clock and the wavefront“ Modell von Cooke und Zeemann aus dem Jahre 1976 macht den Versuch, sowohl eine solche globale Regulation als auch die Periodizität der Somitenbildung mit Hilfe eines theoretischen Modells zu erklären (Cooke und Zeeman 1976). Das Modell postuliert die Existenz einer Wellenfront („the wavefront“), die den Embryo von anterior nach posterior durchläuft. Werden Zellen von dieser kontinuierlich fortschreitenden Wellenfront durchlaufen, so erhalten sie die Fähigkeit zur Somitenbildung. Gleichzeitig besitzen alle Zellen der Segmentplatte eine intrinsische Uhr oder Oszillator („the clock“). Diese Uhr kontrolliert die Oszillation aller Segmentplattenzellen zwischen zwei Zuständen: -permissiv für die Somitenbildung -refraktär für die Somitenbildung Wenn nun die Wellenfront Zellen passiert während sie durch den Oszillator in einem refraktären Zustand gehalten werden, so kann die vermittelte Kompetenz zur Somitenbildung nicht ausgeführt werden. Diese Zellen werden dadurch als eine Einheit definiert, die die Fähigkeit zur Somitenbildung hat. Zur Ausführung dieses Potentials kommt es allerdings erst dann, wenn die Uhr in den permissiven Zustand wechselt. In 7 Einleitung diesem Fall werden diese Zellen synchron in einen Somiten integriert. Durch das Zusammenspiel des Oszillators mit der kontinuierlich fortschreitenden Wellenfront wird die Somitenbildung zu einem periodischen Vorgang. Zusätzlich wird postuliert, daß sowohl die Zeit, die die Wellenfront braucht, um den Embryo von anterior nach posterior zu durchlaufen als auch die Periodizität der Uhr, speziesspezifisch konstant ist. Diese Forderung resultiert direkt aus der Beobachtung, daß Embryonen, die synchron mit der Segmentierung beginnen, diese, unabhängig von der Embryonengröße, auch zum gleichen Zeitpunkt abschließen. Wenn die Zeit für die gesamte Passage des Embryos konstant ist, dann folgt daraus, daß die Wellenfront große Embryonen mit einer höheren Geschwindigkeit durchlaufen muß. Damit werden in größeren Embryonen pro Oszillation mehr Zellen durchlaufen und damit in einen Somiten integriert. Die Angleichung der Somitengröße an die Gesamtgröße des Embryos ließe sich demnach durch die Regulation der Geschwindigkeit der Wellenfront erklären. Ein anderes Modell aus dem Jahre 1982 von Hans Meinhardt basiert auf der Idee eines diffusiblen Morphogengradienten innerhalb der Segmentplatte. Dieser Gradient, der seine maximale Konzentration am posterioren Ende des Embryos aufweist, verursacht die Oszillation der Segmentplattenzellen zwischen zwei Zuständen, zum Beispiel A und P. Die Konfrontation dieser verschiedenen Zustände führt schließlich zur Bildung einer Grenze und damit zur Segmentierung (Meinhardt 1986). Eine Zelle in der Segmentplatte muß, um die Oszillationen zwischen A und P fortsetzen zu können, einen gewissen Schwellenwert an Morphogenkonzentration erreichen. Dieser Schwellenwert nimmt mit jeder Oszillation einen höheren Wert an. Daraus folgt, daß Zellen am anterioren Ende der Segmentplatte, die die geringste Morphogenkonzentration aufweisen, als erste den Schwellenwert nicht mehr erreichen und damit einen definitiven Zustand annehmen (zum Beispiel A). Weiter posterior lokalisierte Zellen oszillieren unter dem Einfluß der höheren Morphogenkonzentration zurück zum P Zustand, womit die erste Grenze zwischen A und P gebildet wird. Durch die unterschiedliche Morphogenverteilung in verschieden großen Embryonen kann auch die Regulation der Somitengröße erklärt werden: in großen Embryonen steigt die Morphogenkonzentration langsamer an, so daß bei Anstieg des Schwellenwertes eine größere Anzahl an Zellen unter diesen Grenzwert fallen und damit einen größeren Somiten bilden. 8 Einleitung Auch dieses Modell führt die Periodizität der Segmentierung auf einen zellulären, intrinsischen Oszillator zurück. Ein drittes Modell, welches eine Verbindung des Zellzyklus mit der Bildung der Somiten herstellt, soll kurz erläutert werden: Ergebnisse aus Hitzeschockexperimenten bei Hühnerembryonen zeigten, daß als Folge der Exposition der Embryonen mit hohen Temperaturen Somitendefekte entstehen (Primmett et al. 1988). Diese Defekte treten in bestimmten regelmäßigen Abständen auf, wobei zwischen den Defekten jeweils ein Abstand von 6-7 Somiten liegt. Es fanden bis zu vier Wiederholungen dieser Defekte statt, so daß auch Zellen, die zum Zeitpunkt der Exposition noch nicht in der Segmentplatte eingewandert waren, später eine defekte Somitenbildung aufwiesen. Aufgrund dieser Beobachtungen wurde davon ausgegangen, daß der Hitzeschock ein periodisches Ereignis beeinflußt, welches sich ebenfalls alle 6-7 Somiten wiederholt. Nur Zellen, die sich in dieser vulnerablen Phase befinden, werden vom Hitzeschock beeinflußt. Ein Zellzyklus entspricht in Hühnerembryonen der Zeit von 9 Stunden oder der Bildung von 6-7 Somiten (Primmett et al. 1989). Darüber hinaus zeigen Zellen, die zusammen einen Somiten bilden, einen gewissen Grad an Zellzyklussynchronität (Stern und Bellairs 1984). Auf diesen Beobachtungen basierend, versucht das Zellzyklusmodell den Vorgang der Segmentierung mit dem Zellzyklus zu verbinden. Demnach gibt es innerhalb der SP eine sogenannte Determinationsperiode, in der Zellen, die sich im gleichen Abschnitt des Zellzyklus befinden, gruppiert werden und später zusammen einen Somiten bilden. Diese Determinationsperiode findet genau einen Zellzyklus vor der Bildung des Somiten statt und soll die Dauer von 100 Minuten, gemäß der Somitenbildungsrate, besitzen. Der vulnerablen Phase für die Hitzeschockexposition entspricht daher einer bestimmte Phase im Zellzyklus, womit die Wiederholung der Defekte im Abstand eines Zellzyklus erklärbar wären. Dieses Modell propagiert im Gegensatz zu den vorherigen Modellen keine systemische Regulation der Somitogenese, sondern sieht die Somitenbildung als Summe lokaler, zellautonomer Ereignisse . Gemeinsam ist den vorgestellten theoretischen Modellen, daß sie das Vorhandensein eines intrinsischen, zellulären Oszillators propagieren. Einen ersten experimentellen Hinweis auf die Existenz einer solchen molekularen Uhr lieferte die faszinierende Entdeckung der 9 Einleitung Expressionseigenschaften von c-hairy1 in Hühnerembryonen (Palmeirim et al. 1997). Die mRNA-Expression v o n c-hairy1 oszilliert mit einer Periodizität, die der Somitenbildungsrate entspricht, wobei die Expression eine intrinsische Eigenschaft der Segmentplattenzellen darstellt. Die Entdeckung dieser molekularen Uhr regte intensive Diskussionen über ihre Bedeutung für die Somitogenese an und führte zur Wiederbelebung der vorgestellten theoretischen Modelle (Cooke 1998; Stern und Vasiliauskas 1998). Eine wichtige Frage hierbei ist, ob es sich bei c-hairy1 um eine seltene Ausnahme handelt oder ob es weitere zyklisch exprimierte Gene gibt. Da bisher die funktionelle Bedeutung von c-hairy1 für die Somitogenese nicht nachgewiesen werden konnte, wäre es dabei von besonderem Interesse, Gene zu identifizieren, die sowohl eine oszillatorische Expressionseigenschaft als auch eine nachgewiesene Funktion in der Somitogenese besitzen. Der molekularbiologische Ansatz der vergangenen Jahre hat zur Identifizierung einer Vielzahl an Genen geführt, die an der Somitogenese beteiligt sind. Ein entscheidender Signalweg für die Somitenbildung ist der Notch-Signalweg. Notch wurde zunächst in der Fruchtfliege beschrieben und ist ein Transmembranprotein, welches als Rezeptor für die Liganden Delta und Serrate dient, die ebenfalls Transmembranproteine sind (ArtavanisTsakonas et al. 1995). Dieser Signalweg ist an vielen zellvermittelten Prozessen beteiligt, die zu Zelldifferenzierung führen. Klassisches Beispiel für die Funktionsweise von Notch ist seine Rolle bei der Neurogenese in Drosophila. Die Notch-Aktivität führt dazu, daß nur bestimmte Zellen eines ehemals homogenen, pluripotenten Zellverbandes aussortiert werden und zu neurogenen Zellen differenzieren, während die verbleibenden Zellen die Epidermis bilden (Simpson 1990). Dieser Zell-Zell vermittelte Vorgang wird in der Literatur als laterale Inhibierung bzw. laterale Spezifizierung bezeichnet und beruht auf negativen und positiven Rückkopplungsmechanismen innerhalb des Notch-Signalweges (Greenwald 1998). In Vertebraten wurden zahlreiche Homologe der Komponenten dieses Signalweges gefunden (Greenwald 1998; Weinmaster 1997). Expressionsanalysen zeigten, daß diese Homologe in weiten Bereichen des präsomitischen Mesoderm transkribiert werden. Die funktionelle Bedeutung dieses Signalweges für die Somitogenese wurde durch rekombinante Mutationsexperimente deutlich: Mutationen in einzelnen Komponenten des Notch-Signalweges, darunter Notch1, Delta-like 1 (Dll-1), Delta-like 3 (Dll-3) und dem 10 Einleitung Transkriptionsfaktor RBPJ-kappa resultieren in einer defekten Somitenbildung (Conlon et al. 1995; Hrabe de Angelis et al. 1997; Kusumi et al. 1998; Oka et al. 1995; Swiatek et al. 1994). Weiterhin sind mehrere Genprodukte bekannt, die modulierend in den Notch-Signalweg eingreifen können (Greenwald 1998). Dazu zählt auch das Protein Fringe. In Drosophila wurde das Zusammenspiel von Fringe mit dem Notch-Signalweg am Prozeß der Kompartimentierung des Flügels experimentell gesichert (Irvine und Wieschaus 1994). Die Flügelanlage der Fruchtfliege kann in ein ventrales und ein dorsales Kompartiment unterteilt werden. Der Notch-Ligand Serrate wird ausschließlich in dorsalen Zellen exprimiert, der Ligand Delta wird zunächst in allen Zellen dieser Flügelanlage exprimiert (Panin et al. 1997). Fringe wird wie Serrate ebenfalls nur in dorsalen Zellen exprimiert. Grundsätzlich besteht ein positiver Rückkopplungsmechanismus zwischen den Liganden Serrate und Delta, d.h eine Aktivierung des Rezeptors Notch durch Delta führt zu einer Hochregulation des Liganden Serrate, und vice versa. Die Wirkung von Fringe besteht darin, die Notch-Rezeptoraktivierung durch Serrate zu inhibieren und die durch Delta zu fördern. Dadurch können dorsale Serrate-exprimierende Zellen nur Notch-Rezeptoren aktivieren, die ventral liegen. Die Folge dieser Aktivierung ist eine Hochregulation des Delta-Liganden in ventralen Zellen. Diese Delta-exprimierenden, ventralen Zellen wiederum aktivieren Notch bevorzugt in dorsalen Zellen, da diese Aktivierung durch Fringe zusätzlich gefördert wird (Irvine und Wieschaus 1994; Panin et al. 1997). Durch diese Wirkung von Fringe wird der Notch-Rezeptor ausschließlich entlang der dorsoventralen Grenze aktiviert. Diese lokalisierte Notch-Aktivität führt zur Ausbildung spezifischer Grenzzellen, die für das Auswachsen der Flügelanlage entscheidend sind und die letztlich die Grenze zwischen dem dorsalen und ventralen Kompartiment bilden (Panin et al. 1997). Ein weiteres Beispiel für die Modulation des Notch-Signalweges durch Fringe finden sich beim Vorgang der Kompartimentierung des Auges in Drosophila (Cho und Choi 1998; Dominguez und de Celis 1998). Die Ausbildung einer dorso-ventralen Polarität im Auge von Drosophila verläuft dabei analog zum beschriebenen Mechanismus in der Flügelanlage (Irvine 1999). In Vertebraten sind drei Homologe von Drosophila fringe entdeckt worden: manic, radical und lunatic fringe (Cohen et al. 1997). Von diesen drei Homologen wird nur lunatic fringe 11 Einleitung im präsomitischen Mesoderm exprimiert (Johnston et al. 1997). Die Verbindung zwischen Fringe und dem Notch-Signalweg wurde auch in Vertebraten experimentell gesichert. In Mausembryonen, die kein funktionelles Notch1, bzw. Dll-1 oder RBPJ-kappa produzieren, ist keine lunatic fringe Expression nachweisbar (Barrantes et al. 1999). Lunatic fringe cDNA kodiert für ein Prä-Pro-Protein, welches auf posttranskriptioneller Ebene durch autokatalytische Prozessierung reguliert werden kann (Johnston et al. 1997). Das prozessierte Protein hat ein Molekulargewicht von 32,9 kDa und kann von der Zelle sezerniert werden (Johnston et al. 1997; Wu et al. 1996). Die Analyse der cDNA zeigt Sequenzähnlichkeiten mit Glykosyltransferasen, doch ist bisher die genaue Funktionsweise von Lunatic Fringe unbekannt (Yuan et al. 1997). Auf mRNA Ebene ist lunatic fringe vor allem im Zentralnervensystem und im präsomitischen Mesoderm exprimiert (Johnston et al. 1997). Im kranialen präsomitischen Mesoderm zeigt lunatic fringe eine auf mehreren Streifen lokalisierte Expression, zusätzlich findet sich eine breitere Expressionsdomäne im kaudalen Teil des präsomitischen Mesoderms. Auffällig war, daß die Expression große individuelle Unterschiede zeigte, so daß die Möglichkeit einer dynamischen Regulation der Transkription bestand (Evrard et al. 1998). Durch rekombinante Mutationsexperimente wurde die Bedeutung von Lunatic Fringe in der Embryogenese bestimmt. Mausembryonen, die kein funktionelles Lunatic Fringe produzieren, zeigen schwerwiegende Defekte in der Somitenbildung (Evrard et al. 1998; Zhang und Gridley 1998). Die Ausbildung einer Intersomitengrenze ist in diesen Embryonen fehlerhaft, was zu unregelmäßig geformten Somiten führt. Darüber hinaus fehlt in diesen unregelmäßigen Somiten die anterior -posteriore Polarität. In Hühnerembryonen ist lunatic fringe ebenfalls beschrieben worden (Sakamoto et al. 1997). Auch in Hühnerembryonen wurde lunatic fringe mRNA in den Ohrplakoden, im zentralen Nervensystem und in den Segmentplatten nachgewiesen. Ziel der vorliegenden Arbeit war es, eine detaillierte Analyse des Expressionsverhalten von lunatic fringe im unsegmentierten Mesoderm von Hühnerembryonen durchzuführen. Es sollte geklärt werden, ob die große Variabilität der lunatic fringe Expression auch in Hühnerembryonen existiert und es sollte untersucht werden, wie diese zu erklären ist. Die Experimente zu den Expressionseigenschaften von lunatic fringe sollten dazu beitragen, Aufschluß über die Rolle von lunatic fringe während der Somitogenese zu gewinnen. 12 2 Material und Methoden 2.1 Tiere Hühnerembryonen Befruchtete Hühnereier (Weiße Leghorn, Gallus domesticus) wurden von der Firma Spafas in Conneticut bezogen und bis zur Verwendung bei 4°C aufbewahrt. Die Hühnereier wurden auf der Seite liegend in einem Inkubator (Kuhl, New Jersey) bei 37°C und 60-80% Luftfeuchtigkeit bebrütet, bis sie das gewünschte Entwicklungsstadium erreicht hatten. Die Stadieneinteilung erfolgte gemäß der Nomenklatur von Hamburger und Hamilton (Hamburger und Hamilton 1992). Als Kriterium für diese Stadieneinteilung wird dabei unter anderem die Anzahl der Somiten herangezogen. Mausembryonen Embryonen wurden aus zeitlich definierten Paarungen gewonnen. Mäuse der Gattung Swiss wurden von Jackson Laboratory in Bar Harbor, Maine bezogen. Am Tag des Erscheinens eines vaginalen Pfropf wurde 12 Uhr als 0,5 dpc (dies post coitum) festgesetzt. 13 Material und Methoden 2.2 Mikrochirurgische Manipulationen 2.2.1 Material und Instrumente Wolframdrahtnadeln: Für die mikrochirugischen Manipulationen wurden feine Nadeln aus Wolframdraht zum Schneiden von Gewebe verwendet. Dazu wurde Wolframdraht so in eine Glaspasteurpipette eingeschmolzen, daß der Draht ca. 1,5cm herausragte. Anschließend wurde der Wolframdraht entweder durch Elektrolyse oder durch Abflammen geschärft. Bei der Methode der Elektrolyse wurde der Wolframdraht wiederholt in 10N Natronlauge eingetaucht und diente als Anode. Als Kathode diente eine Metallklammer, die in der Natronlauge eingetaucht war. Zwischen Anode und Kathode wurde eine Spannung von ca. 7,5 Volt angelegt. Durch diese Elektrolyse wurde der Wolframdraht geschärft, bis der Nadeldurchmesser wenige µm betrug. Abflammen geschärft werden. Alternativ kann der Wolframdraht durch Dazu wurde der Draht in die Flamme eines Bunsenbrenners gehalten, bis durch Abflammen/Abglühen der Draht geschärft war. Diese Methode war weniger aufwendig und schneller als die Methode der Elektrolyse, lieferte allerdings qualitativ etwas weniger hochwertige Nadeln. Färbestifte: Glasstifte wurden über einer Flamme fein ausgezogen und die Spitze wurde zu einem kleinen Glasball geformt. Dieser wurde mit einem Gemisch aus Agar und dem Vitalfarbstoff Nilblau überzogen (0,25g Agar-Noble in 10ml H2O aufkochen, dazu 0,1g Nilblausulfat hinzugeben und gut mischen). Die Färbestifte dienten zur Markierung von Gewebe während des Operierens. 14 Material und Methoden Operations-Agarschalen: Plastik Petrischalen (60x15 mm) wurden mit einer 1%igen Agarose/PBS Lösung bis auf ca. 0,4cm aufgefüllt. Auf dieser Agaroseschicht wurden die (Hühner-)Embryonen während der mikrochirurgischen Manipulation gelegt und damit stabilisiert. Mehrere feine Dumont Pinzetten, eine Iridektomieschere und ein Sieblöffel wurden zum Isolieren und zum Übertragen der Embryonen verwendet. 2.2.2 Isolierung der Embryonen Isolierung der Hühnerembryonen aus dem Ei Das inkubierte Hühnerei wurde vorsichtig eröffnet und in eine Glasschale überführt. Die Glasschale war mit einer isotonischer Lösung (Locke–Lösung) gefüllt, so daß das Eigelb in der Locke-Lösung schwamm. Mit Hilfe einer Iridektomieschere wurde um das Blastoderm herum die Eigelbmembran durchtrennt. Dazu wurden zunächst zwei parallele Schnitte entlang der Längsachse des Embryos im Bereich der area opaca angelegt. Durch einen dieser Schnitte wurde ein Sieblöffel eingeführt und unter das Blastoderm gebracht. Danach wurde das Blastoderm vollständig von der Eigelbmembran abgetrennt und in eine Petrischale mit Locke-Lösung überführt. Mit Hilfe feiner Pinzetten wurde die Vitellinmembran, die dem Blastoderm direkt aufliegt, entfernt. Gewinnung der Mausembryonen Am Entwicklungstag 9,5 dpc wurden die schwangeren Mäuse durch zervikale Dislokation getötet und die Embryonen aus dem Uterus gewonnen. Dazu wurden die Uteri chirurgisch aus dem Bauchsitus entfernt und in eisgekühltem Dissektionspuffer gereinigt. Anschließend wurden die Uteri auf der dem embryonalen Pol entgegengesetzten Seite mit 15 Material und Methoden Hilfe feiner Pinzetten geöffnet. Die Embryonen wurden vorsichtig von Dottersack und Amnion entfernt. 2.2.3 Somitennomenklatur Somiten wurden gemäß der Nomenklatur von Christ und Ordahl (1995) beschriftet (Christ und Ordahl 1995). Diese Nomenklatur beinhaltet zwei Beschriftungsysteme. Zunächst werden die Somiten in der Reihenfolge ihrer Bildung mit fortlaufenden arabischen Nummern versehen. Der zuerst gebildete Somit erhält die arabische Ziffer 1 (Somit 1), der zehnte Somit, der während der Embryonalentwicklung entsteht, erhält die Ziffer 10 (Somit 10) usw.. Zusätzlich wird jeder Somit gemäß seines individuellen Enwicklungsalters mit römischen Nummern beschriftet. Der zuletzt gebildete Somit, also der jüngste Somit wird immer als Somit I bezeichnet, der zuvor gebildetete Somit als Somit II und diese Beschriftung wird von posterior nach anterior fortgesetzt. In dieser Arbeit wurde diese Nomenklatur auf den noch unsegmentierten Bereich der Segmentplatten übertragen. Dabei wurde der nächste zu bildende Somit als Somit –I, der übernächste zu bildende Somit als Somit –II bezeichnet. Diese Beschriftung wurde von anterior nach posterior weitergeführt (Abb. 1A). 16 Material und Methoden 2.2.4 Versuchsreihen Um das dynamische mRNA-Expressionsverhalten von lunatic fringe zu untersuchen, wurden verschiedene mikrochirurgische Manipulationen an Hühner- und Mausembryonen durchgeführt. 2.2.4.1 Manipulationen an Hühnerembryonen Herstellung zweier Hälften eines Embryos Ziel dieser Manipulation war es, einen Embryo entlang seiner Längsachse in zwei nahezu identische Hälften zu trennen. Dazu wurde der Hühnerembryo wie in Abschnitt 2.2.2 beschrieben aus dem Ei isoliert und anschließend auf eine Operations-Agarschale übertragen. Der Embryo wurde so ausgerichtet, daß der Betrachter auf die dorsale Seite blickte. Mit einer Wolframnadel wurde zunächst das Neuralrohr von posterior nach anterior, bis etwa auf die Höhe des Somiten V, eröffnet. Dazu wurde zunächst die Nadelspitze in das Gewebe hineingeführt und anschließend wurde mit einer schnellen aber kontrollierten Aufwärtsbewegung das Gewebe durchtrennt. Nachdem das Neuralrohr eröffnet worden war, wurden auch die darunter liegenden Schichten, das Mesoderm und das Entoderm, exakt in der Medianlinie durchtrennt. Die median liegende Rückensaite blieb an einer der beiden Seiten haften, die Verteilung geschah willkürlich in Abhängigkeit der vorliegenden Operationsbedingungen. Anschließend wurde auf einer Seite des Embryos mit einer Federschere ein Schnitt von lateral bis zur durchtrennten Mittellinie geführt. Die dadurch entstandenen Hälften sind bezüglich der Segmentplatte und der umliegenden Gewebe nahezu identisch. 17 Material und Methoden Transversale Durchtrennung einer Hälfte Die Embryonenhälften wurden wie oben beschrieben hergestellt. Anschließend wurde zusätzlich auf einer Hälfe der posteriore Teil entfernt, indem ungefähr in der Mitte der Segmentplatte mit einer Federschere ein transversaler Schnitt durchgeführt wurde. Isolieren der Segmentplatte Die Isolierung der Segmentplatte erforderte mehrere Teilschritte und dauerte ungefähr 20 Minuten. Zunächst mußte das Ektoderm über dem paraxialen Mesoderm entfernt werden. Dazu wurden zwei unterschiedliche Strategien gewählt. Der Embryo wurde wie in Abschnitt 2.2.2 beschrieben gewonnen und auf einer Agarschale stabilisiert. Auf einer Seite des Embryos wurde mit Hilfe einer Wolframnadel das Ektoderm zwischen dem Neuralrohr und dem paraxialen Mesoderm eröffnet und anschließend nach lateral abgezogen. Alternativ wurde dieser Schritt nicht auf eine Agarschale durchgeführt, sondern direkt in ovo. Dazu wurde das befruchtete Ei durchleuchtet und die Lage des Embryos mit Bleistift auf der Schale markiert. An dieser Stelle wurde mit einer feinen Säge ein ca 1cm 2 großes Fenster gesägt. Die Kalkschale wurde entfernt, ohne die darunterliegende Schalenmembran zu öffnen. Nun wurde mit einer Pinzette am stumpfen Eipol eingestochen und somit das dort befindliche Luftkissen eröffnet. Die Eimembran wurde mit Locke-Lösung benetzt und vorsichtig eröffnet. Der Embryo, der durch das Entweichen der Luft abgesunken war, wurde durch vorsichtiges Einträufeln von LockeLösung direkt unter die Eischale angehoben. Die Vitellinmembran wurde mit einem Färbestift markiert und anschließend über dem paraxialen Mesoderm eröffnet. Das Ektoderm wurde ebenfalls mit einem Färbestift markiert und in der gleichen Art und Weise, wie zuvor beschrieben, entfernt. Diesen Schritt in ovo durchzuführen war aufwendiger und zeitintensiver im Vergleich zur Entfernung des Ektoderms auf einer Agarschale. Allerdings hat sich gezeigt, daß in ovo das Ektoderm deutlich einfacher und schonender vom Mesoderm zu entfernen ist. Eine mögliche Erklärung könnte in der 18 Material und Methoden größeren Spannung liegen, die in ovo im Gewebe vorliegt und es somit vor Verletzung schützt. Nachdem das Ektoderm entfernt worden war, wurde der Embryo auf der Agarschale derart gedreht, daß der Betrachter auf die ventrale Seite blickt. Das Entoderm wurde vorsichtig mit Hilfe einer Wolframnadel vom Mesoderm entfernt. Anschließend wurde zwischen dem paraxialen und dem intermediären Mesoderm ein Schnitt von posterior nach anterior durchgeführt. Um eine saubere Trennung dieser Mesodermkompartimente, die kontinuierlich ineinander übergehen, zu erreichen, war es entscheidend, diesen Schnitt von der ventralen Seite aus durchzuführen. Abschließend wurde das paraxiale Mesoderm vom Neuralrohr abgetrennt. Dazu wurde von der dorsalen Seite im Extrazellularraum, der sich zwischen Neuralrohr und paraxialen Mesoderm befindet, entlanggeschnitten. Damit war das paraxiale Mesoderm von allen umliegenden Geweben wie Ekto- und Entoderm, dem intermediären Mesoderm und dem Neuralrohr befreit. Transplantation einer Spendersegmentplatte in einen Wirtembryo (Abb. 1B) Ziel dieser Manipulationen war es, die SP eines Wirtembryos durch die SP eines Spenderembryos zu ersetzen. Anschließend wurden sowohl der Spender, als auch der Empfänger bei 37,8°C für einen Zeitraum von 5 Stunden reinkubiert. Als Spender und Empfänger wurden Hühnerembryonen im Stadium HH11-12 gewählt. Die Segmentplatte auf der rechten Seite des Donors wurde wie in oben beschrieben isoliert und in 2%iger Rinderserumalbumin/Locke-Lösung aufbewahrt. Der Empfängerembryo wurde wie folgt vorbereitet: auf einer Operations-Agarschale wurde das Ektoderm zwischen Neuralrohr und paraxialen Mesoderm eröffnet. Um die Isolierung der SP zu erleichtern, wurden wenige Tropfen einer 25%igen Trypsinlösung in Locke-Lösung auf den Embryo gegeben. Nach ca. 30 Sekunden wurde begonnen, das Neuralrohr vorsichtig vom paraxialen Mesoderm abzutrennen, indem am Neuralrohr vorsichtig mit einer Wolframnadel entlang gefahren wurde. Die Enzymreaktion wurde mit einer 20%igen BSA-Lösung gestoppt. Der Embryo wurde anschließend mehrmals mit frischer LockeLösung gewaschen. 19 Material und Methoden Das Ektoderm ließ sich nun leicht zur Seite schieben. An der Grenze zwischen dem paraxialen und intermediären Mesoderm wurde wiederum mit einer Wolframnadel ein Schnitt gesetzt, der das Mesoderm jedoch nicht das Entoderm durchtrennt. Das paraxiale Mesoderm wurde anschließend vorsichtig von Neuralrohr und vom darunterliegenden Entoderm abgetrennt. Um Mesodermreste vom Entoderm zu entfernen, wurde eine Glaspasteurpipette über einer Flamme fein ausgezogen. Mit dieser feinen Pipette wurden die Mesodermreste abgesaugt. Wenn die SP korrekt entfernt wurde, war das darunterliegende glänzende Entoderm zu sehen. Die isolierte SP des Spenders wurde nun auf den Empfängerembryo übertragen und korrekt ausgerichtet. Es wurde darauf geachtet, daß die ursprüngliche anterior-posteriore Orientierung der Spender-SP beibehalten wurde. Die eingesetzte SP wurde abschließend mit Ektoderm überdeckt. Sowohl beim Spender als auch bei dem chimären Empfänger wurde der Schwanzknospenbereich entfernt, bevor die Kultivierung (siehe 2.2.5) erfolgte. 2.2.4.2 Manipulationen an Mausembryonen Mausembryonen im Stadium 9,5 dpc wurden wie in 2.2.2 beschrieben gewonnen und in eiskalten Dissektionspuffer gelegt. Mit einer feinen Dumontpinzette wurde der Embryo so ausgerichtet, daß von dorsal auf den Embryo gesehen wurde. Mit einer Wolframnadel wurde das Neuralrohr von posterior nach anterior in der Mittellinie bis etwa auf die Höhe des Somiten V eröffnet. Anschließend wurden die restlichen Gewebsschichten in der Medianebene mit einer Wolframnadel oder alternativ mit einer feinen Iridektomieschere durchschnitten. Dadurch entstanden im posterioren Bereich des Embryos zwei nahezu identische Hälften. 20 Material und Methoden 2.2.5 In vitro Kultivierung der Embryonen 2.2.5.1 Material und Medien Kulturmedium für Hühnerembryonen Als Kulturmedium wurde DMEM (GibcoBRL, Life Technologies) mit 10% fetalem Rinderserum (FBS) und 2% Hühnerserum verwendet. Zusätzlich wurden 50 IU/ml Penicillin und 50µg/ml Streptomycin hinzugefügt. Kulturmedium für Mausembryonen: Das Kulturmedium bestand aus DMEM (GibcoBRL, Life Technologies) und Ham’s F12 im Verhältnis 1:1 und 10% fetalem Rinderserum (FBS). Agar/Eigelb-Kulturschalen: Die Kulturschalen wurden nach einem Protokoll von Packard und Johnson (Packard 1976) hergestellt. Dazu wurde ein Teil 6%iger Agar (Bacto-agar, Difco, Detroit, Michigan) und 3 Teile Eiüberstand miteinander vermischt. Der Eiüberstand wurde gewonnen, indem man den Inhalt mehrerer nichtinkubierter Eier vermischt und 30 Minuten bei 15900xg (g=Erdbeschleunigung) zentrifugiert. Die 6%ige Agarlösung wurde erst bis zum Kochen erhitzt und anschließend ebenso wie der Eiüberstand auf ca. 48°C abgekühlt. Nach dem Vermischen der Agarlösung mit dem Eiüberstand, wurden ca. 3ml in eine Petrischale gegossen und gewartet, bis dieses nutritive Substrat fest geworden war. 21 Material und Methoden 2.2.5.2 Kultivierung von Hühnerembryonen Kultivierung von Hühnerembryonen auf Polykarbonatfiltern Hühnerembryonen wurden nach einem Protokoll von Palmeirim et al. kultiviert (Palmeirim et al. 1997). Die Embryonenhälften oder die isolierten Segmentplatten wurden mit der ventralen Seite nach unten auf einen Polykarbonatfilter (0,8µm Porengröße, Millipore, Bedford, Massachusetts) gelegt. Der Filter wurde vorsichtig in eine Petrischale mit Kulturmedium gelegt, so daß der Filter auf dem Medium flottierte. Die Inkubation erfolgte bei 37°C. Nach Ablauf der Inkubationszeit, die zwischen 20 und 150 Minuten variierte, wurde der Filter mit einem Sieblöffel in eine 4%ige Paraformaldehydlösung (PFA) überführt, und der Embryo wurde darin über Nacht bei 4°C fixiert. Kultivierung von Hühnerembryonen auf Agar/Eigelb-Petrischalen Die Kultivierung der Embryonen auf einer Agar/Eigelb-Petrischale wurde in der Versuchsreihe durchgeführt, in der chimäre Hühnerembryonen hergestellt wurden. Das Protokoll wurde von Packard und Johnson übernommen (Packard 1976). Sowohl der Spender, als auch der Empfänger wurden nach Austausch der Segmentplatte mit Hilfe eines Sieblöffels auf Agar/Eigelb-Petrischalen überführt. Die Inkubation erfolgte bei 37,8°C und 5% CO2 für eine Dauer von 5 Stunden. Anschließend wurden die Embryonen in 4% PFA über Nacht bei 4°C fixiert. 22 Material und Methoden 2.2.5.3 Kultivierung von Mausembryonen Mausembryonenhälften wurden nach der Methode des hängenden Tropfens kultiviert. Das Protokoll wurde freundlicherweise von Kristen Correia und Ron Conlon zur Verfügung gestellt. Die Embryonenhälften wurden in einen Tropfen Kulturmedium übertragen, der zuvor auf den Boden einer Petrischale pipettiert wurde. Die Petrischale wurde zusammen mit dem Tropfen und dem darin enthaltenen Embryo vorsichtig invertiert, so daß ein hängender Tropfen entstand. Die Inkubation erfolgte bei 37°C und 5% CO2. Anschließend wurden die Embryonen in 4% PFA über Nacht bei 4°C fixiert. 2.3 Molekularbiologische Methoden 2.3.1 Transformation kompetenter Bakterienzellen Kompetente Zellen Transformationskompetente Zellen wurden einem Laborvorrat entnommen. Transformation Die bei –80°C eingefrorenen Zellen wurden auf Eis aufgetaut. Zu 100µl Zellen wurden bis zu 100ng Plasmid gegeben und der Ansatz wurde 30 Minuten auf Eis inkubiert. Nach einem Hitzepuls (30 Sekunden bei 42°C) wurden die Zellen sofort für 3-5 Minuten auf Eis gekühlt. Anschließend wurden 400µl antibiotikumfreies Medium (LB-Medium: 5g Hefeextrakt, 10g NaCl,10g Trypton, 1000ml H2O) hinzugegeben und 30 Minuten bei 37°C inkubiert. Von diesem Ansatz wurden 100µl auf einer LB/Ampicillin-Platte ausplattiert. Die restlichen 400µl wurden 20 Sekunden in einer Tischzentrifuge bei 14000upm 23 Material und Methoden zentrifugiert. Daraufhin wurden 300µl des Überstandes verworfen und das Pellet in den verbleibenden 100µl gelöst. Diese 100µl wurden auf einer zweiten LB/Ampicillin-Platte ausplattiert. Beide Platten wurden über Nacht bei 37°C inkubiert. 2.3.2 Präparation von Plasmid-DNA Kleinansatz Plasmid-DNA Präparation Das Protokoll zur Präparation von Plasmid- DNA wurde aus Maniatis übernommen (Sambrock et al. 1989). Fünf Milliliter LB-Medium (mit 100µg/ml Ampicillin) wurden mit einer einzelnen Bakterienkolonie angeimpft und im Erlenmeyerkolben bei 37°C und 250upm über Nacht inkubiert (mindestens für 7 Stunden). Nach dieser Inkubation wurden 1,7ml der Kultur in ein Eppendorf-Röhrchen (Eppendorf, Hamburg) gegeben und 30 Sekunden bei 12000upm zentrifugiert. Der Überstand wurde verworfen. Das Bakterienpellet wurde in 100µl eisgekühlter Lösung I (50mM Glukose, 25mM Tris-HCl pH 8,0, 10mM EDTA pH 8,0) vollständig gelöst. Die Lyse der Zellen erfolgte durch die Zugabe von 200µl Lösung II (0,2N NaOH (frisch verdünnt von einer 10N Stammlösung), 1% SDS). Anschließend wurden 150µl der Lösung III hinzugefügt (3M Kaliumacetat, 5M Eisessig) und durchmischt. Dieser Ansatz wurde 5 Minuten bei 4°C und 12000upm zentrifugiert. Der Überstand wurde in ein neues Röhrchen übertragen und die DNA gefällt. Dazu wurden 2 Volumenanteile Ethanol hinzugegeben und 2 Minuten bei Raumtemperatur stehengelassen. Dieser Ansatz wurde 5 Minuten bei 12000upm und 4°C zentrifugiert. Der Überstand wurde verworfen, und das Pellet wurde getrocknet. Abschließend wurde das Pellet mit 70% Ethanol gewaschen und nach Entfernung des Überstandes erneut luftgetrocknet. Die DNA wurde in 50µl TE-8 gelöst und der DNAGehalt wurde photometrisch bestimmt. 24 Material und Methoden Großansatz Plasmid-DNA Präparation Fünf Milliliter LB-Medium (mit 100µg/ml Ampicillin) wurden mit einer einzelnen Bakterienkolonie angeimpft und bei 37°C und 250upm über Nacht inkubiert (mindestens für 7 Stunden). Diese Bakterienkultur wurde in einen zwei Liter Erlenmeyerkolben mit 500ml LB-Medium (mit 100µg/ml Ampicillin) gegeben, und ebenfalls bei 37°C und 250upm inkubiert. Nach 8-16 Stunden Inkubation wurde das Kulturmedium auf zwei 250ml Behälter verteilt und in einem GSA Rotor bei 5000upm zentrifugiert (Sorvall Instruments, RC5C, Du Pont). Der Überstand wurde verworfen, und die Bakterienpellets wurden in je 15ml STE (100mM NaCl, 10mM Tris-HCl pH 8,0, 1mM EDTA pH 8,0) aufgelöst. Die Bakterien beider Flaschen wurden kombiniert, anschliesßend wurden erneut 50ml STE hinzugefügt und die Bakterien 10 Minuten bei 6000upm zentrifugiert. Der Überstand wurde verworfen und das Pellet in 18ml Lösung I (50mM Glukose, 25mM Tris-HCl pH 8,0, 10mM EDTA pH 8,0) gelöst. Danach wurden 2ml Lysozym-Lösung (10mg/ml in TE-8) hinzugegeben und 5 Minuten bei RT inkubiert. Die Lyse der Zellen erfolgte nach Zugabe von 40ml Lösung II (0,2M NaOH, 1% SDS). Nach gründlichem Mischen wurde der Ansatz 5 Minuten bei RT inkubiert. Nach dieser Inkubationszeit wurde zur Neutralisierung des Ansatzes 30ml Lösung III (3M Kaliumazetat, 5M Eisessig) hinzugefügt und vorsichtig vermischt. Nachdem der Ansatz 5 Minuten auf Eis gelagert wurde, wurde 10 Minuten bei 6000upm zentrifugiert. Der Überstand wurde durch Gaze in einen neuen 250ml Behälter filtriert. Um die DNA zu fällen, wurden 85ml Isopropanol hinzugefügt, gut durchmischt und 10 Minuten bei RT inkubiert. Anschließend wurde die DNA 10 Minuten bei 6000upm abzentrifugiert. Das Pellet wurde mit 50ml 70 % Ethanol gewaschen und erneut 5 Minuten bei 6000upm abzentrifugiert. Der Überstand wurde verworfen, und das Pellet wurde 10 Minuten bei 37°C getrocknet. Die DNA wurde in 4,5ml TE-8 gelöst. Um die Plasmid-DNA in möglichst reiner Form zu erhalten, wurde die DNA über einen Cäsiumchloridgradienten gereinigt. Dazu wurde die DNA-Lösung in ein 12ml-Röhrchen übertragen und 5,25g CsCl wurden hinzugefügt und gelöst. Dazu wurden 0,3ml einer Ethidiumbromidstammlösung (10mg Ethidiumbromid/ml H2O) hinzugefügt. Der Ansatz wurde 5 Minuten bei 6000upm in einem SS-34 Rotor zentrifugiert (Sorvall Instruments, RC5C, Du Pont). Der Überstand wurde in ein „quick-seal“ Röhrchen (5,2ml, Beckman Instruments) übertragen und dieses verschweißt. Anschließend wurde dieser Ansatz mindestens 12 Stunden bei 55000upm in einem vTi65.2 Rotor zentrifugiert (XL-70 25 Material und Methoden Ultracentrifuge, Beckman Instruments). In der Mitte des Röhrchens bildete sich eine rote Bande, die der reinen Plasmid-DNA mit interkaliertem Ethidiumbromid entsprach. Über dieser Bande bildete die genomische bakterielle DNA eine zweite Bande. Um die PlasmidDNA zu isolieren, wurde zunächst mit einer Nadel ein Loch in den oberen Teil des Röhrchens gestochen, um so eine Luftzufuhr herzustellen. Anschließend wurde mit einer zweiten Nadel, die mit einer 1ml–Spritze verbunden war, kurz unterhalb der PlasmidDNA Bande eingestochen und die Bande abgesaugt. Dieser Inhalt wurde in ein Eppendorf- Röhrchen übertragen. Um die DNA von dem Ethidiumbromid zu reinigen, wurde der Inhalt mit einem gleichen Volumen Isoamylalkohol extrahiert. Nach einer einminütigen Zentrifugation in einer Tischzentrifuge (14000upm) wurde die obere Phase verworfen. Dieser Schritt wurde mehrmals wiederholt, bis die wässrige Phase nicht mehr rötlich gefärbt war. Um die Plasmid-DNA auszufällen, wurde zur wässrigen Phase das dreifache Volumen 70%igen Ethanols hinzugefügt. Dieser Ansatz wurde gemischt und 10 Minuten auf Trockeneis gelegt. Daraufhin wurde der Ansatz erwärmt, bis das Cäsiumchlorid wieder gelöst war und anschließend in einer Tischzentrifuge bei 4°C und 14000upm zentrifugiert. Der Überstand wurde verworfen, und das DNA-Pellet wurde mit 70%igen Ethanol bei Raumtemperatur gewaschen und anschließend luftgetrocknet. Das DNA-Pellet wurde in 100-500µl H2O gelöst, und die DNA-Konzentration wurde photometrisch bestimmt. 2.3.3 Konzentrations- und Reinheitsbestimmung der DNA Die DNA-Konzentration wurde im Spektralphotometer durch Messung der optischen Dichte bei 260, 280 und 320nm bestimmt. Die Messung bei 320nm diente zur Streulichtkorrektur, der hierbei erhaltene Messwert wurde von den bei 260nm und 280nm ermittelten Werten subtrahiert. Die DNA–Konzentrationen wurden wie folgt bestimmt: DNA: OD260 1= 50ug/ml Die Proteinkontamination der DNA wurde aus dem Quotienten der bei 260nm und 280nm ermittelten Extinktionswerten erhalten. Eine reine Nukleinsäure zeichnet sich durch ein 26 Material und Methoden 260/280 Verhältnis von 1,9 aus. Ein Quotient weit über oder weit unter diesem Wert spricht für eine Proteinkontamination. 2.3.4 Spaltung von DNA mit Restriktionsenzymen Restriktionsendonukleasen erkennen und hydrolysieren kurze, definierte Nukleotidsequenzen der DNA. Die Plasmid-DNA wurde in den jeweils mitgelieferten Reaktionspuffern inkubiert. Die Reaktion wurde bei der empfohlenen Temperatur für eine Stunde durchgeführt. Gespaltene DNA-Fragmente wurden elektrophoretisch analysiert und gegebenenfalls isoliert. 2.3.5 Agarosegel-Elektrophorese von DNA und RNA Agarosegele erlauben die Auftrennung von DNA-Fragmenten im Bereich von 100-100000 Basenpaaren. Es wurde ausschließlich mit einer Agarose-Konzentration von 1% gearbeitet. Zur Herstellung des Gels wurde 1g Agarose in 100ml Puffer unter Kochen gelöst. Zur Auftrennung von DNA-Fragmenten wurde TAE als Puffer verwendet, für RNA wurde TBE verwendet. Zu diesen 100ml Agarose-Lösung Ethidiumbromidstammlösung (10mg/ml) hinzugegeben. wurden 5µl einer Dieser Ansatz wurde in vorgefertigte Gelwannen gegossen. Zur Ausbildung von Probentaschen wurde ein entsprechender Probenkamm in die Kammer eingehängt. Nach Erstarren der Agarose wurde der Kamm entfernt und die Gelkammer mit Puffer gefüllt. Die Proben wurden mit einem Ladepuffer gemischt, der gleichzeitig einen Farbmarker enthielt. Zur Größenbestimmung wurden Standards definierter Größe verwendet, wie z.B. 1 kbDNAMarker (GibcoBRL, Life Technologies). Die Elektrophorese wurde bei 60-100 V durchgeführt. Ethidiumbromid interkaliert in die DNA bzw. RNA, wodurch diese bei UVLicht (366nm) sichtbar wird. Nach der Elektrophorese wurden die Gele unter UV-Licht fotografiert. 27 Material und Methoden 2.3.6 Isolierung von DNA–Fragmenten aus Agarosegelen Zur Isolierung der DNA-Fragmente aus Agarosegelen wurde das Isolierungskit Geneclean II (ISC Bioexpress, Utah) verwendet. Das Prinzip dieser Reinigung beruht auf einer spezifischen Bindung von DNA an ein Silicagel (Glasmilch). Die Isolierung der DNA aus diesem Agarosestück erfolgte nach den Angaben des Herstellers, die hier kurz zusammengefaßt werden: Die DNA-Fragmente wurden aus einem Agarosegel unter schwachem UV-Licht ausgeschnitten. Das Agarosestückchen wurde in 3,5fachen Volumen einer 6mM NaI–Lösung bei 50°C gelöst. Anschließend wurde die Lösung für 10-20 Minuten bei Raumtemperatur mit 5µl Glasmilch inkubiert. NaI wurde durch mehrmaliges Waschen mit der mitgelieferten Waschlösung wieder entfernt. Durch Inkubation der Glasmilch in 0,1fachen TE-8 für 5 Minuten bei 50°C wurde die DNA schließlich eluiert. 2.3.7 Reinigung von DNA Zur Reinigung von DNA wurden folgende Methoden angewendet: Präzipitation von DNA DNA wurde durch Zugabe von 0,1 Volumenanteilen einer 3M Natriumazetatlösung (pH 5,2) und 2,5 Volumenanteilen Ethanol bei –20°C für 30 Minuten präzipitiert. Die präzipitierte DNA wurde durch Zentrifugation (Eppendorf- Tischzentrifuge 14000upm für 5 Min, bei 4°C) sedimentiert, mit 70 % Ethanol gewaschen und in TE-8 oder H2O gelöst. Phenolchloroformextraktion DNA-Lösungen wurden mit einem Volumentanteil Phenol/Chloroform(1:1) extrahiert und anschließend bei 14000upm in einer Tischzentrifuge für 5 Minuten zentrifugiert. Die wässrige Phase wurde abgetrennt und in ein neues Eppendorfröhrchen gegeben. Die 28 Material und Methoden verbleibende Lösung wurde mit TE-8 verdünnt und mit einem Volumenanteil Phenol/Chloroform (1:1) extrahiert. Nach erneuter Zentrifugation wurden die wässrigen Phasen miteinander vereint. Die darin enthaltene DNA wurde abschließend präzipitiert (siehe oben). 2.3.8 Veränderung der DNA-Sequenz mittels Polymerasekettenreaktion Die Polymerasekettenreaktion dient der in vitro Amplifikation einer spezifischen Nukleinsäuresequenz. Als Vorlage dafür dient meist ein doppelsträngiges DNA-Stück, welches die gesuchte Sequenz enthält. Die PCR ist mittlerweile eine vollautomatisierte Methode und wurde in einem Perkin Elmer Cetus–DNA Thermal Cycler durchgeführt. Der Arbeitszyklus beginnt mit der Denaturierung der doppelsträngigen DNA. Die dadurch entstehenden DNA-Einzelstränge werden mit kurzen Oligunukleotiden-Paaren, den Primern, hybridisiert. Diese Primer erkennen eine bestimmte Sequenz auf der DNA und dienen als Start für die anschließende Kettenverlängerung. Dabei ist der sogenannte 5‘-Primer komplementär zum Minusstrang, der 3´-Primer ist komplementär zum Plusstrang. Im nächsten Arbeitsschritt verlängert eine hitzestabile DNA-Polymerase aus Thermus aquaticus die Primer, wobei als Vorlage der jeweils komplementäre DNA–Strang dient. Somit werden zwei neue DNA-Stränge synthetisiert, die erneut als Vorlage dienen können. Dieser Zyklus, Denaturierung, Hybridisierung und Kettenverlängerung wird zwischen 20 und 30 mal wiederholt, wobei jeder Zyklus die Anzahl der DNA-Moleküle verdoppelt. Die Polymerasekettenreaktion kann in modifizierter Form auch dazu verwendet werden, die DNA-Sequenz an einigen wenigen Basen zu verändern. Dazu wird ein Primer ausgesucht, der nicht vollständig komplementär zur Vorlage ist und der die gewünschten Veränderungen enthält. Der neu synthetisierte DNA-Strang ist somit ebenfalls im Vergleich zu seiner Vorlage verändert und dient als Matrize für nachfolgende Zyklen. Nach Fertigstellung aller Zyklen besitzt daher fast die komplette DNA-Population eine veränderte DNA-Sequenz. 29 Material und Methoden In dieser Arbeit wurde diese Strategie angewendet, um die lunatic fringe cDNA kompatibel für die Klonierung in einen retroviralen Vektor zu machen. Zwei verschiedene cDNAs wurden dabei hergestellt: PCR-Produkt 1: lunatic fringe cDNA mit modifiziertem 5' und 3‘ Ende für die Klonierung in den Vektor pSlax-13 PCR-Produkt 2: lunatic fringe cDNA mit modifiziertem 5' und 3‘ Ende für die Klonierung in den Vektor pSlax Flu2.1 Die PCR wurde wie folgt durchgeführt: 10µl (entsprachen 200ng) Plasmid-DNA (lunatic fringe cDNA) wurden mit jeweils 4µl der beiden Primer (Sequenz siehe unten), 10µl Desoxynukleotidlösung (dATP, dCTP, dGTP, dTTP in einer Konzentration von je 2mM), 10µl 10facher Polymerasepuffer, 10µl DMSO und H2O (52µl) in einemVolumen von 100µl gemischt. Dazu wurde 0,5µl „high fidelity“- Polymerase (Boehringer, Mannheim) gegeben und abschließend dieser Reaktionsansatz mit einem Tropfen Mineralöl überdeckt. Nach 2 Minuten Denaturierung bei 94°C wurde die DNA über 22 Zyklen wie folgt amplifiziert: 1) Denaturierung: 94°C, 30 Sekunden 2) Annealing: 50°C, 36 Sekunden 3) DNA-Synthese (Elongation): 72°C, 75 Sekunden Im Anschluß an diese 22 Zyklen wurde eine terminale Elongationsphase von 3 Minuten bei 72°C durchgeführt und damit die PCR-Reaktion abgeschlossen. 5µl der PCR wurde auf einem 1% igen Agarosegel getestet . Primersequenz für die PCR Die Primer wurden von der Firma GibcoBRL, Life Technologies erhalten. Die Sequenz lautete wie folgt: Für PCR-Produkt 1 : 5‘-Primer: AAAGAAGACACCATGCTCCAGCGGTG 3‘-Primer: ACAGAATTCCAACCACGACTGCTAGAAG (Amplifiziertes PCR-Produkt hat eine Größe von 1153 Basenpaaren) 30 Material und Methoden Für PCR-Produkt 2 : 5‘-Primer: AAAGAAGACACCATGCTCCAGCGGTG 3‘-Primer: AAAGAATTCAAGATGGCGGAGCGAGGA (Amplifiziertes PCR-Produkt hat eine Größe von 1169 Basenpaaren) 2.3.9 Klonierung und Produktion eines retroviralen RCAS-Vektors Subklonierung der lunatic fringe cDNA in einen Hilfsvektor Der RCAS–Vektor (RC=Replikationskompetent: A= avian leukemia virus LTR; S= SpliceAkzeptor) kodiert für einen vogelspezifischen Retrovirus, welcher zur Überexpression von Genen eingesetzt werden kann (Hughes et al. 1987; Morgan und Fekete 1996). Hier wurde die lunatic fringe cDNA in einen RCAS–Vektor kloniert. Dazu mußte die cDNA zunächst in einen Hilfsvektor eingebaut werden. Es wurden zwei verschiedenen Hilfsvektoren eingesetzt : pSlax 13 (für PCR-Produkt 1) pSlax Flu 2.1 (für PCR-Produkt 2) Der Klonierungsschritt wurde wie folgt durchgeführt: 1) Mit der PCR wurden neue Restriktionsstellen in der lunatic fringe cDNA erzeugt PCR-Produkt 1: BbsI (5') und EcoRI (3') PCR-Produkt 2: BsaI (5') und EcoRI (3') 2) 50µl des PCR-Reaktionsgemisches wurden durch Phenolchloroformextraktion gereinigt. 3) die PCR-Produkte und die Hilfsvektoren wurden mit geeigneten Restriktionsenzymen geschnitten PCR-Produkt 1: BbsI (5‘) und EcoRI (3‘) 31 Material und Methoden PCR-Produkt 2: BsaI (5') und EcoRI (3‘) Vektor: NcoI (5‘) und EcoRI (3‘) 4) Phosphatasebehandlung des Vektors: Um die Selbstligation des Vektors zu minimieren, wurde am 5‘ Ende die Phosphatgruppen entfernt. Hierzu wurden CIAP (calf intestinal alkaline phosphatase, 2,5U/5µg Vektor-DNA, Boehringer Mannheim) und der mitgelieferte Puffer (100mM Tris-HCl pH 8,3, 10mM MgCl2) direkt zum Reaktionsgemisch gegeben und dieser Ansatz 30 Minuten bei 37°C inkubiert. 5) die geschnittenen DNA-Fragmente wurden gelelektrophoretisch aufgetrennt und anschließend aus dem Gel isoliert. 6) die Ligation der Fragmente erfolgte mit Hilfe des Takara DNA Ligation Kit (Takara Shuzo Co.,Ltd.) nach den Angaben des Herstellers. 7) Transformation des Ligationsansatzes und der Ligations-Kontrolle in kompetente Bakterien. Einzelne Bakterienkolonien dieser Transformation wurden einer DNA-Präparation zugeführt. Durch Schneiden mit geeigneten Restriktionsenzymen wurde die korrekte Orientierung der klonierten Fragmente überprüft. Klonierung der cDNA in den RCAS-Vektor Die cDNA wurde aus diesem Hilfsvektor heraus in den endgültigen retroviralen Vektor RCAS(A) hineinkloniert. Dazu wurde der Hilfsvektor und der RCAS-Vektor mit dem Enzym ClaI geschnitten. Dieser Verdau setzte das gewünschte cDNA-Fragment aus dem Hilfsvektor frei und schafft kompatible Enden für die Klonierung in den RCAS–Vektor. Nach dem Verdau wurden die Fragmente gelelektrophoretisch aufgetrennt und anschließend aus dem Gel isoliert. 32 Material und Methoden Die Ligation und Transformation erfolgte wie oben beschrieben. Um die Klonierung des gewünschten Fragmentes sicher zu überprüfen, wurden die Vektoren RCAS-MFR und RCAS-MFR-Tag von der Sequenziereinheit des MD Anderson Cancer Centers ansequenziert. Die ermittelte Sequenz bestätigte die erfolgreiche Klonierung beider Fragmente in den retroviralen Vektor, so daß zwei neue Konstrukte entstanden 1) RCAS (A)-MFR 2) RCAS (A)-MFR-Tag Produktion des Retrovirus in Zellkultur Die Produktion eines Retrovirus in Zellkultur ist eine etablierte Methode, die ungefähr zwei Wochen beansprucht: a) Herstellung primärer Hühnerfibroblasten Primäre Hühnerfibroblasten für diese Arbeit wurden einem Laborvorrat entnommen. b) Transfektion der Fibroblasten mit dem RCAS-Vektor Die Transfektion der primären Hühnerfibroblasten erfolgte mit der Methode der Calciumphospatpräzipitation. Dazu wurden zunächst 20µg des zu transfizierenden Plasmids mit Natriumacetatlösung und Ethanol präzipitiert und anschließend in 100µl sterilem Wasser gelöst (siehe 2.3.7). Davon wurden 30µl entnommen und auf 450µl mit Wasser verdünnt. Dazu wurden 50µl einer 2,5M CaCl2 Lösung gegeben. Dieses Gemisch wurde tropfenweise zu einer 2- fachen HBS –Lösung (137mM NaCl, 5mM KCl, 0,7mM Na2HPO4, 6mM Dextrose, 21mM Hepes pH 7,05) zugegeben. Es sollte zu einem feinen Präzipitat kommen. Auf Zellkulturplatten mit einem zu 60% konfluenten Zellwachstum wurden 1ml Medium (DMEM, GibcoBRL, Life Technologies) gegeben. Anschließend wurde das DNA-Präzipitatgemisch unter ständigem vorsichtigen Mischen tröpfchenweise hinzugegeben. Die Kulturplatten wurden 10 Minuten in einem Zellinkubator bei 37°C und 5% CO2-Atmosphäre inkubiert. Anschließend wurden 10ml Medium zugegeben. Nach 4 33 Material und Methoden Stunden Inkubation bei 37°C wurde das Medium entfernt und 2ml 15%iges Glycerol hinzugegeben. Nach 90 Sekunden Inkubation wurde mehrfach mit PBS gewaschen und anschließend Medium hinzugegeben. c) Zellkultur der transfizierten primären Hühnerfibroblasten Die Zellkultur erfolgte bei 38°C und 5% CO2, als Medium wurde DMEM (GibcoBRL, Life Technologies) mit 10% fetalem Rinderseum (FBS, GibcoBRL, Life Technologies) und 2% Hühnerserum (CS) und Penicillin/Streptomycin (50IU/ml, 50µg/ml) verwendet. Die Zellen wurden zunächst bis zur vollständigen Konfluenz kultiviert und anschließend auf größere Platten übertragen. Dazu wurde zunächst das Medium entfernt und mehrfach mit sterilem PBS gewaschen. Anschließend wurden die Zellen für wenige Minuten in Trypsin (GibcoBRL, Life Technologies) inkubiert, bis sich die Zellen von der Plastikoberfläche ablösen ließen. Diese Trypsinierung wurde durch Zugabe von Medium gestoppt, und die Zellen wurden dann auf die größeren Platten übertragen. Die Zellen wurden nach Erreichen vollständiger Konfluenz einmal passagiert und anschließend wurde gewartet, bis die Zellen überkonfluent gewachsen waren. d) Gewinnung des Retrovirus Sobald die Zellen überkonfluent waren, wurde an drei aufeinanderfolgenden Tagen das Medium entfernt und bei –80°C aufbewahrt. In diesem Überstand befinden sich Retroviren, die von den infizierten Zellen in das Medium freigesetzt wurden. e) Konzentrierung der Retroviren Das gesammelte Medium wurde durch einen Filter mit der Porengröße 0,45µm filtriert, um Zellreste zu entfernen. Anschließend wurde das Medium in einem Ausschwingrotor bei 21000upm bei 4°C für 3 Stunden zentrifugiert. Die Viren befanden sich im Pellet, der Überstand wurde vorsichtig dekantiert. Das Virus wurde in einem sehr geringen Restvolumen gelöst. Das gelöste Retrovirus wurde aliquotiert und bis zur Injektion bei –80°C aufbewahrt. 34 Material und Methoden f) Western-Blot mit lysierten, transfizierten Fibroblasten Um die erfolgreiche Transfektion und auch die Produktion des gewünschten Proteins zu überprüfen, kann mit lysierten Fibroblastenzellen, die nach Beendigung der Kultivierungsphase gewonnen wurden, ein Western-Blot durchgeführt werden. Da Konstrukt 2 mit einer Epitopmarkierung (Flu) ausgestattet ist, konnte ein Antikörper (HA11), der diese Markierung erkennt, verwendet werden, um das gebildete Protein nachzuweisen. Die Zellen wurden durch Zugabe von Puffer (50mM Tris-HCl pH 6,8 , 2% SDS, 10% Glyzerol, 0,1% Bromophenolblau, 100mM DTT) lysiert. Dieses Zelllysat wurde 2 Minuten bei 100°C denaturiert und anschließend auf einem 8% igen linearen SDS-PolyacrylamidGel aufgetrennt. Sammelgel und Trenngel hatten folgende Zusammensetzung: Trenngel (4ml) Sammelgel (2ml) 1,067ml einer 30%igen Acrylamid- 0,266ml ABA bisacrylamid-Lösung (ABA) 0,5ml Puffer (0,5M Tris, 0,4% SDS pH 6,8) 1ml Puffer (1,5M Tris, 0.4% SDS, pH 8,8) 20µl Ammoniumperoxodisulfat 40µl Ammoniumperoxodisulfat 2µl TEMED 4µl TEMED 1,234ml H20 1,933ml H2O Als Größenstandard wurde ein vorgefärbter Standard von 14 kDa bis 200 kDA (GibcoBRL, Life Technologies) verwendet. Die Gelelektrophorese wurde bei 200 V in 50 Minuten durchgeführt. Anschließend wurden die Proteine auf eine Nitrozellulosemembran übertragen. Dazu wurde zunächst das Sammelgel abgetrennt und das Trenngel wurde 10 Minuten in Transferpuffer (25mM Tris, 192mM Glyzin, 20% Methanol, pH 8,3) gewaschen. Die Sandwich-Methode hatte folgenden Aufbau: Kathode, Scotch-brite Papier, WhatmanPapier, Trenngel, Nitrocellulosemembran (Schleicher und Schuell), Whatman-Papier, Scotch-brite Papier, Anode. Der Elektrotransfer erfolgte im Transfertank bei 100 V und dauerte 45-60 Minuten. 35 Material und Methoden 2.3.10 Injektion des Retrovirus in Hühnerembryonen Das konzentrierte Virus wurde in eine fein ausgezogene Kapillare aufgezogen. Dabei wurde das Virus (5µl) mit einer Farblösung (0,5µl einer 1%igen Fast Green-Lösung) vemischt, um die Injektion leichter überprüfen zu können. Die Kapillare war über ein kleines Kunststoffröhrchen an eine Hamiltonspritze verbunden. Sowohl Hamiltonspritze als auch die Kapillare sind vor Aufziehen der Viruslösung mit Mineralöl aufgefüllt worden. Die Eier wurden auf ihrer Längsseite stabilisiert und nach Aufstechen des Luftsackes am stumpfen Eipol wurde die Schale über dem Embryo eröffnet. Anschließend wurde der Embryo orientiert. Die Injektionen wurden mit einem Handmanipulator durchgeführt. Es wurden pro Embryo 6-8 Injektionen durchgeführt. Abschließend wurde das Ei mit Pflaster verschlossen und in den Inkubator gelegt. 2.4 Methoden zur Auswertung der Embryonen 2.4.1 Whole-mount in situ Hybridisierung Zur Darstellung der mRNA–Expression wurde die Methode der in situ Hybridisierung angewendet, die von Pardue und Gall eingeführt wurde (Pardue und Gall 1970). Dazu wurden zunächst RNA-Sonden hergestellt, die in das Gewebe eingebracht wurden und an die zu untersuchende mRNA durch Hybridbildung binden. Eine Sonde stellt dabei das Transkript des Antisense–Stranges der cDNA dar, welches somit zur endogenen mRNA–Sequenz, die ihrerseits das Transkript des Sense-Stranges darstellt, komplementär ist. 36 Material und Methoden Herstellung der RNA-Sonde a) Linearisierung des Plasmids 10µg des Transkriptionsplasmids wurden mit dem passenden Restriktionsenzym geschnitten (siehe Tabelle Transkriptionsplasmide). Nach einer Phenolchloroform- extraktion mit anschließender DNA-Präzipitation wurde die DNA in 50µl 0,1 fachen TE-8 gelöst. b) Transkription Digoxygenin markierte Antisense-RNA als Sonde für in situ Hybridisierung wurde im wesentlichen gemäß den Angaben des Herstellers (Boehringer, Mannheim) produziert. Der Ansatz lautete wie folgt: 10µl linearisierte DNA(1µg) 4µl Transkriptionspuffer (5 fach, Promega,Madison, WI) 2µl DTT 0,1M (Promega, Madison,WI) 2µl Nukleotidmix (Boehringer, Mannheim) 0,5µl RNAse Inhibitor (Promega,Madison, WI) 1,5µl RNA Polymerase (Promega,Madison, WI) 20µl Nach einer Inkubation von zwei Stunden bei 37°C wurde die Transkription durch Auftrennung eines 1µl Aliquots auf einem 1% TBE – Gel überprüft. Zum Transkriptionsansatz wurde 1µl DNAse (Boehringer, Mannheim) hinzugegeben und 15 Minuten bei 37°C inkubiert. Anschließend wurde die RNA durch Zugabe 0,1 Volumenanteile 4M Lithiumchlorid und 3 Volumenanteile Ethanol bei –20°C (für mindestens 60 Minuten) ausgefällt. Nach der Zentrifugation der präzipitierten RNA bei 14000upm und 4°C wurde das RNA-Pellet mit 70%igen Ethanol gewaschen. Abschließend wurde die RNA in 50µl TE-8 und 50µl Hybridisierungspuffer gelöst und bei –20°C aufbewahrt. 37 Material und Methoden c) Transkriptionsplasmide Gen lunatic fringe lunatic fringe c-hairy1 Pax-3 Organismus Huhn Maus Huhn Huhn HinDIII HinDIII BamHI Restriktionsenzym für ClaI Antisense Linearisierung RNA-Polymerase T3 T3 T7 T3 Quelle Ed RL Olivier RL Laufer Johnson Pourquie Johnson Vorbereitung der Embryonen für die Hybridisierung Die Embryonen wurden nach der Fixierung (4% Paraformaldehyd über Nacht bei 4°C) in einer aufsteigenden Methanolreihe (25%, 50%, 75%, 100%, 100%) dehydriert und mindestens eine Nacht in –20°C aufbewahrt. Daraufhin wurden die Embryonen in einer absteigenden Methanolreihe rehydriert und in PBT gewaschen. Nach einer einstündigen Inkubation in 6%igem Wasserstoffperoxid wurden die Embryonen 10 Minuten mit ProteinaseK behandelt. Die Konzentration der ProteinaseK richtete sich nach dem Alter der Embryonen. Für Hühnerembryonen im Stadium HH12, sowie für 8,5 dpc alte Mausembryonen betrug die ProteinaseK-Konzentration 0,5µg/ml, für Hühnerembryonen HH19 und Mausembryonen 9,5 dpc wurde eine Konzentration von 1µg/ml gewählt. Im Anschluß an die ProteinaseK Behandlung wurden die Embryonen gewaschen (PBT) und nachfixiert (4% Paraformaldehyd und 0,05% Glutaraldehyd in PBT, 20 Minuten bei RT). Die Embryonen wurden in screw-cap Röhrchen mit Hybridisierungspuffer überführt und zunächst bei RT inkubiert. Nachdem die Embryonen zu Boden gesunken waren, wurde dieser Hybridisierungspuffer erneut ausgetauscht. Dieser Ansatz wurde in ein Wasserbad bei 70°C für mindestens eine Stunde inkubiert. 38 Material und Methoden Hybridisierung 10-12µl RNA-Sonde aus der in vitro Transkription wurde in 1ml Hybridisierungspuffer gegeben, so daß die ungefähre RNA-Konzentration 1µg/ml betrug. Die vorbehandelten Embryonen wurden in dieser Hybridisierungslösung bei 70°C im Wasserbad inkubiert. Die Hybridisierungszeit betrug 12-24 Stunden. Posthybridisierungswaschgänge Die Embryonen wurden nach der Hybridisierung zunächst drei Mal in Lösung I gewaschen (bei 65°C, jeweils 30 Minuten), anschließend wurden drei Waschgänge in Lösung III durchgeführt (bei 65°C, jeweils 30 Minuten pro Waschgang). Danach wurden die Embryonen in TBST überführt. Antikörperinkubation Die Embryonen wurden in TBST mit 10% Schafserum für mindestens 2,5 Stunden inkubiert. Der Antikörper (Dig-Antikörper, Boehringer Mannheim) wurde mit Embryopulver, welches in TBST gelöst worden ist, geblockt (1µl Antikörper in 500µl TBST/Embryopulver). Anschließend wurde der Antikörper bis auf eine Konzentration von 1:2000 mit TBST/1% Schafserum verdünnt. Die Embryonen wurden in dieser Antikörperlösung bei 4°C für 12-18 Stunden inkubiert. Farbreaktion Die Embryonen wurden ausgiebig in TBST gewaschen und anschließend in NTMT überführt. Nach dreimaligem Waschen in NTMT wurde zu den Embryonen die Färbelösung gegeben. Die Farbreaktion muß im Dunkeln erfolgen, die Färbelösung sollte dabei nach gewisser Zeit erneuert werden. Die Hintergrundfärbung kann deutlich 39 Material und Methoden reduziert werden, indem man die Embryonen während des Färbens auf einem Schüttler bewegt. Die Farbreaktion wurde gestoppt, indem die Embryonen in PBT überführt und mehrmals gewaschen wurden. Abschließend wurden die Embryonen in 4%igen Paraformaldehyd und 0.05% igen Glutaraldehyd eine Stunde lang bei RT fixiert und dann in PBT aufbewahrt. Alternatives Whole-mount in situ Hybridisierungsprotokoll für schwache Sonden Die Arbeitsschritte wurden zunächst wie oben ausgeführt. Wenn nach der Farbreaktion die Signalintensität unbefriedigend war, wurden die Embryonen fixiert und anschließend erneut mit Dig-Antikörper inkubiert. Daran schloß sich die Farbreaktion und die Postfixierung an. Durch die beiden Färbesschritte konnte das Signal verstärkt werden, ohne das Hintergrundsignal zu stark zu erhöhen. 2.4.2 Anfertigung von Gefrierschnitten Embryonen, die im Schnittpräparat analysiert werden sollten, wurden nach Beendigung der Whole-mount in situ Hybridisierung in einer aufsteigenden Sucrosereihe (5%, 15%, 30%) dehydriert. Daraufhin wurden die Embryonen in einem Gemisch von 30%iger Sucrose/O.C.T im Verhältnis 1:1 für mindestens eine Stunde inkubiert (Sechrist und Marcelle 1996). Die Embryonen wurden abschließend ca. 30 Minuten in O.C.T. (Miles Inc.,Elkhart, IN) gelegt und auf Flüssigstickstoff eingefroren. Mit Hilfe eines Kryostats (Leitz Cryomicrotom) wurden 25µm-30µm dicke Schnitte angefertigt und auf Objektträger (Superfrost plus, Menzel-Gläser) übertragen. Die Schnitte wurden über Nacht getrocknet, kurz mit PBS rehydriert und mit Aquamount eingedeckelt. 40 Material und Methoden 2.4.3 Alcianblau Knorpelfärbung Um Knorpelstrukturen zu analysieren, wurden die Embryonen zunächst in 4% Paraformaldehyd über Nacht bei 4°C fixiert. Anschließend wurden sie mehrmals in PBS gewaschen und in Alcianblau–Lösung (0,02%Alcianblau 8GX gelöst in einem Gemisch von 70% Ethanol und 30% Eisessig) für 6-8 Stunden gefärbt (Capdevila et al. 1998). Die Embryonen wurden anschließend in einer Ethanolreihe (100, 95, 70, 40, 15%, jeweils für eine Stunde) gespült und in H2O gewaschen. Daraufhin wurden die Embryonen durch eine 0,5% Kaliumhydroxid/Glyzerol–Serie (3:1, 1:1, 1:3) geführt (für jeweils zwei Stunden) und in 100% Glyzerol aufbewahrt. 2.4.4 Fotografieren der Embryonen Totalpräparate wurden unter einem Nikon SMZ-U Mikroskop, welches mit einem Nikon UFX-DX mit der Kamera verbunden war, fotografiert. Als Film wurde entweder Kodak 64T oder Kodak 100 Ektachrome verwendet. Die Embryonen wurden zum Fotografieren entweder in eine mit PBS gefüllte Petrischale (schwarzer Hintergrund) oder aber in eine Agar-Operationsschale gelegt (blauer Hintergrund). Gefrierschnitte wurden mit einem Zeiss Axiophot Mikroskop fotografiert. 41 3 Ergebnisse 3.1 Übersicht der mRNA- Expression von lunatic fringe im Hühnerembryo Grundlage der vorliegenden Arbeit war die detaillierte Charakterisierung der lunatic fringe mRNA-Expression während der frühen Embryonalentwicklung des Hühnerembryos. Diese Analyse konzentrierte sich dabei vor allem auf die Expression in der Segmentplatte (SP) und in der Schwanzknospe, sowie auf die lunatic fringe Expression während und kurz nach der Gastrulation. Die Expression im Neuralrohr und in der Ohrplakode sind in der Literatur bereits präzise beschrieben und werden daher in der folgenden Übersicht nicht berücksichtigt (Sakamoto et al. 1997). Um die mRNA-Expression zu analysieren, wurde an Hühnerembryonen vom Gastrulationsstadium (HH4) bis zum Extremitätenknospenstadium (HH22) eine Wholemount in situ Hybridisierung durchgeführt, wobei eine lunatic fringe Antisense-Sonde verwendet wurde. Die Expression wurde anschließend sowohl am Totalpräparat, als auch an Gefrierschnitten analysiert. Im definitiven Primitivstreifenstadium (HH4) findet sich die lunatic fringe mRNAExpression in zwei diffusen Epiblastregionen (Abb. 2A). Diese Expression ist kaudal des Hensenschen Knotens lokalisiert und achsensymmetrisch um die Mittellinie angeordnet. Wie frühere Zellmarkierungsexperimente gezeigt haben, sind diese Epiblastzellen prospektive paraxiale Mesodermzellen und stellen damit Vorläufer der Somitenzellen dar (Psychoyos und Stern 1996). Die Lokalisation der Expression in Epiblastzellen läßt sich im transversalen Gefrierschnitt bestätigen (Abb. 3A). Außerdem können im Transversalschnitt gastrulierende Zellen identifiziert werden, die ihre lunatic fringe mRNA-Expression beibehalten haben. Kurz vor der Bildung des ersten Somiten (HH6) kann lunatic fringe mRNA in zwei Regionen detektiert werden. Eine kranial des Hensenschen Knotens lokalisierte umschriebene Expressionsdomäne und eine kaudal des Hensenschen Knotens gelegene, etwas diffusere und breitere Expression (Abb. 2B). Die kraniale Expression entspricht dem neu gebildeten paraxialen Mesoderm (Abb. 3B). Das paraxiale Mesoderm erstreckt sich kranial vom Hensenschen Knoten achsensymmetrisch auf beiden Seiten des Neuralrohrs 42 Ergebnisse und beinhaltet die somitogenen Zellen des Embryos. Die kaudale Expressionsdomäne läßt sich im Gefrierschnitt jungen mesodermalen Zellen zuordnen, die die Gastrulationsphase noch nicht oder eben gerade abgeschlossen haben (Abb. 3B). Diese Zellen befinden sich unmittelbar kaudal des Hensenschen Knotens und stellen junges prospektives paraxiales Mesoderm dar. Nach der Bildung des ersten Somiten (HH7) und anschließend bis zum Extremitätenknospenstadium (HH22) findet sich die lunatic fringe mRNA in hoher Konzentration in der kranialen Segmentplatte (Abb. 2C-2F). Diese Ergebnisse stimmen auch mit den Angaben aus der Literatur überein (Sakamoto et al. 1997). Um diese intensive Expression innerhalb der Segmentplatte und in Bezug auf den zuletzt gebildeten Somiten präziser zu lokalisieren, wurden transversale und sagittale Gefrierschnitte durch repräsentative Embryonen angefertigt (Abb. 3C, 3D). Im Transversalschnitt sieht man, daß die Expression streng auf die Segmentplatte begrenzt ist und nicht das intermediäre Mesoderm oder das Seitenplattenmesoderm umfaßt (Abb. 3C). Im Sagittalschnitt ist erkennbar, daß die stärkste mRNA-Expression von lunatic fringe interessanterweise im Somiten -II lokalisiert ist (Abb. 3D). Zusätzlich kann in Embryonen ab dem Stadium HH19 die mRNA-Expression in neugebildeten Somiten nachgewiesen werden, wobei diese auf die Region des prospektiven Dermomyotoms beschränkt ist. Bei der Auswertung der lunatic fringe Expression in der Segmentplatte von Hühnerembryonen im Stadium HH11 bis HH16 (n= 41) fällt auf, daß das Expressionsmuster sehr variabel ist (Abb. 4A-C). Auch in Embryonen ähnlicher Entwicklungsstadien zeigen sich deutliche Variationen der lunatic fringe Expression in der Segmentplatte. Um diese Variationen zu ordnen, werden drei verschiedene Expressionsklassen definiert. Grundlage dieser Einteilung ist dabei die Expression von lunatic fringe in der kranialen und kaudalen Segmentplatte. Die Mehrheit der Embryonen (Klasse 1; n= 19/41; 46%) zeigt eine starke Expression nur in der kranialen Segmentplatte. Diese Expression entspricht in Ausdehnung und in Lokalisation dem Somiten -II (Abb. 4A). Embryonen mit einer Expression der Klasse 2 (n=10/41; 25%) zeigen zusätzlich zu dieser Expression in Somit -II eine schwächere lunatic fringe Expression in der kaudalen Segmentplatte (Abb. 4B). Schließlich zeigen Embryonen der Expressionsklasse 3 (n=12/41; 29%) zwei Expressionsdomänen in der kranialen Segmentplatte, die nur durch eine schmale expressionsfreie Region getrennt werden (Abb. 4C). Die schwächere kraniale 43 Ergebnisse Expression entspricht einem Teil des Somiten -II. Die intensivere kaudale Expression ist auf Höhe des Somiten -IV lokalisiert, wobei jedoch die Ausdehnung dieser kaudalen Expression von Embryo zu Embryo unterschiedlich ist. Zusätzlich zeigen Embryonen aller drei Klassen gelegentlich eine lunatic fringe Expression in der Schwanzknospe, die jedoch besonders konstant in Embryonen der Klasse 3 zu sehen ist. 3.2 Charakterisierung der Dynamik der lunatic fringe Expression Wie ist die oben beschriebene Variabilität der lunatic fringe Expression in der Segmentplatte zu erklären? Eine Möglichkeit ist, daß jeder Embryo sein individuelles und konstantes Expressionsmuster besitzt. Jeder Embryo würde damit immer derselben Expressionsklasse angehören, pro Embyro wäre damit nur eine Expressionsklasse repräsentiert. Eine alternative Erklärung ist, daß die lunatic fringe Expression sich sehr dynamisch verhält und sich in sehr kurzer Zeit verändert. Die unterschiedlichen Expressionsmuster wären in diesem Fall Ausdruck geringer Altersunterschiede zwischen den untersuchten Embryonen. Von jedem Embryo würden alle drei Expressionsklassen durchlaufen, die dann als Expressionsphasen bezeichnet werden könnten. Der Zeitpunkt der Fixierung würde darüber entscheiden, welche Expressionsphase durch die in situ Hybridisierung sichtbar wird. Um zwischen diesen beiden Möglichkeiten unterscheiden zu können, wurde ein Embryonenkulturexperiment durchgeführt. Die Methodik wurde dabei im wesentlichen von Palmeirim et al. übernommen (Palmeirim et al. 1997). Dazu wurden die Hühnerembryonen nach der Isolierung aus dem Ei in zwei identische Hälften getrennt. Während eine Hälfte sofort fixiert wurde, konnte die zweite Hälfte für einen definierten Zeitraum auf einem Polykarbonatfilter, der auf einem Nährmedium flottiert, bei 37°C inkubiert werden. Nach Abschluß dieser Inkubation wurden beide Hälften der Whole-mount in situ Hybridisierung zugeführt. Mit diesem Experiment ist es möglich, die Expression in zwei Segmentplatten zu vergleichen, die aus einem Embryo stammen und sich nur durch die Dauer der Inkubation in ihrem Entwicklungsalter unterscheiden. 44 Ergebnisse Um zu überprüfen, ob unter diesen Kulturbedingungen eine normale Entwicklung gewährleistet ist, wurden zunächst Kontrollexperimente durchgeführt. Dazu wurden nach der Halbierung des Embryos beide Hälften für eine Dauer von 120 Minuten inkubiert. In allen Fällen (n=3) zeigen beide Hälften eine identische Expression von lunatic fringe mRNA, und während der Inkubation hat sich ein weiterer Somit gebildet. Dies zeigt, daß unter diesen Kulturbedingungen die Somitenentwicklung ungestört weiterläuft. Es wurde anschließend eine Versuchsreihe durchgeführt (n=42), in der wie oben beschrieben, nur eine Hälfte der Embryonen für eine Dauer von 20 bis 130 Minuten inkubiert wurde. Durch den Vergleich der lunatic fringe Expression in der inkubierten mit der entsprechenden nichtinkubierten Embryonenhälfte kann gezeigt werden, daß sich die lunatic fringe Expression dynamisch verhält und sich schon während kurzer Inkubationszeiten verändert (Abb. 5A,B,C,E,F,G). Die beschriebene Variabilität der Expression in der Segmentplatte ist Folge dieser hohen Dynamik. Darüber hinaus konnten die drei Expressionsklassen, die nun als Expressionsphasen bezeichnet werden, zeitlich in Beziehung gesetzt werden. So zeigen die Ergebnisse, daß Phase I in Phase II umgewandelt wird (Abb. 5A) und Phase II in Phase III konvertiert wird (Abb. 5B). Da die Expressionsphase III erneut in eine Phase I übergeht (Abb. 5C), konstituieren diese drei Expressionsphasen einen Kreislauf, der mit dem Erreichen der Phase I erneut beginnt. Diese Ergebnisse zeigen, daß lunatic fringe oszillierend und zyklisch exprimiert wird. Wieviel Zeit benötigt ein Kreislauf oder Zyklus bis zu seiner Vollendung? Wenn man eine Inkubationszeit von 95- 100 Minuten wählt (Abb. 5D), befinden sich sowohl die inkubierte als auch die nichtinkubierte Hälfte in der gleichen Expressionsphase. Dies zeigt, daß die inkubierte Hälfte einen kompletten Zyklus durchschritten hat und sich im wesentlichen nur durch die Bildung eines zusätzlichen Somiten von der nichtinkubierten Hälfte unterscheidet. Die Zyklusdauer beträgt 95-100 Minuten und entspricht damit der Zeit, die für die Bildung eines Somiten erforderlich ist (90 Minuten in vivo, 95 -100 Minuten unter Kulturbedingungen). Die Expression in der Schwanzknospe ist schwierig zu den Expressionsphasen in Beziehung zu setzen. So ist in der frühen Phase I eine deutliche Expression in der Schwanzknospe nachzuweisen (Abb. 5E linke, nichtinkubierte Hälfte). Diese Expression verschwindet aber während einer kurzen Inkubation von 36 Minuten, wobei sich die 45 Ergebnisse inkubierte Hälfte immer noch in Phase I befindet (Abb. 5E, rechte Hälfte). Zu Beginn der Phase II ist in der Schwanzknospe keine Expression nachweisbar (Abb. 4B, 5A), erst im Zuge der Umwandlung der Phase II in Phase III (Abb. 5B) erscheint lunatic fringe mRNAExpression in der Schwanzknospe, und diese Expression wird während Phase III beibehalten (Abb. 4C). Das komplexe Expressionsverhalten in der Segmentplatte und der Schwanzknospe wird in einem schematischen Modell zusammengefaßt (Abb. 6). Die Dynamik der lunatic fringe Expression konnte besonders gut beurteilt werden, wenn sehr kurze Inkubationszeiten gewählt wurden (Abb. 5F). Die Expression, die in der kaudalen SP zu sehen ist und hier ihren Ursprung nimmt, wird als initiale Segmentplattenexpression bezeichnet (iSPE). Diese breitet sich während der kurzen Inkubationszeit von 21 Minuten nach kranial aus und nimmt gleichzeitig an Intensität zu (Abb. 5F). Der Zeitpunkt der Somitenbildung läßt sich durch Embryonenkulturexperimente klar zu den Expressionsphasen in Beziehung setzen (Abb. 5G-K). Beide Hälften des Embryos in Abb. 5G befinden sich in Phase III. Die Expression ist während der Inkubationszeit (23 Minuten) nur gering nach kranial fortgeschritten. Während dieser geringfügigen Progression hat sich ein neuer Somit gebildet. Dies läßt sich sowohl am Whole-mount Präparat (Abb. 5G) beurteilen, als auch an Sagittalschnitten durch beide Hälften (Abb. 5HK) bestätigen. Damit ist gezeigt, daß die Somitenbildung während der Expressionsphase III stattfindet. Diese Phase III gliedert sich demnach in einen Abschnitt vor Somitenbildung und einen Abschnitt nach Somitenbildung. Die Dauer der einzelnen Phasen läßt sich aus ihren relativen Häufigkeiten bestimmen. So zeigen 46% aller ausgewerteten Embryonen (n= 83, 38/83) eine Expressionsphase I. Da die Dauer eines gesamten Zyklus 95 Minuten beträgt, errechnet sich für Phase I ein Anteil von 45 Minuten. Die Dauer der Phasen II und III scheinen jeweils 25 Minuten zu betragen, da ihre relative Häufigkeit gleich groß ist. Unsere Daten aus den Embryokulturexperimenten stehen in Einklang mit diesen berechneten Werten. 46 Ergebnisse 3.3 Kontrolle der zyklischen Expression von lunatic fringe 3.3.1 Transversale Durchtrennung der Segmentplatte Die kraniale Progression der lunatic fringe mRNA-Expression könnte auf verschiedenen Mechanismen beruhen. Prinzipiell könnte die Progression auf Zell-Zell Kommunikation zurückzuführen sein. Die Expression, die in der kaudalen SP initiiert wird, würde zellvermittelt sequentiell nach kranial weitergeleitet werden. Im Falle von c-hairy1, welches eine sehr ähnliche Progression der Expression aufweist, ist jedoch eine intakte Segmentplatte, die Bedingung für einen zellvermittelten Mechanismus ist, für diese Progression nicht notwendig (Palmeirim et al. 1997). Dies wies auf die Möglichkeit hin, daß eine solche dynamische Veränderung der Expression eine autonome Eigenschaft der SP darstellen könnte. Um zu überprüfen, ob es sich bei lunatic fringe um eine zellvermittelte oder eine autonome Progression handelt, wurden mehrere Versuchsreihen durchgeführt. Zunächst wurde eine Modifikation des Embryonenkulturexperiments durchgeführt. Dazu wurden die Embryonen halbiert und anschließend wurde die SP der rechten Embryonenhälfte zusätzlich transversal durchtrennt. Die linke Embryonenhälfte sowie die kraniale rechte Hälfte wurden für 80 bis 150 Minuten inkubiert, und anschließend wurde die lunatic fringe Expression in beiden Hälften verglichen. In allen Fällen (n=8) zeigen beide Hälften eine sehr ähnliche Expression von lunatic fringe (Abb. 7A,B). Dies deutet darauf hin, daß die kaudale SP sowie die Schwanzknospe für das zyklische Expressionsverhalten nicht notwendig sind, was für einen autonomen Mechanismus spricht. Wichtig ist hierbei, daß die Expression auch in den Segmentplatten identisch ist, die während der Inkubation einen Somiten gebildet haben. Dies zeigt, daß nicht nur die Progression der Expression, sondern auch der Neustart eines Zyklus unabhängig von der Integrität der SP ist. 47 Ergebnisse 3.3.2 Isolierung der Segmentplatte von allen umliegenden Geweben Um zu überprüfen, ob benachbarte Strukturen, wie z.B. das Neuralrohr oder die Chorda dorsalis einen Einfluß auf die lunatic fringe Expression haben, wurde die SP einer Embryonenhälfte von allen umliegenden Geweben isoliert. Diese SP und die entsprechende intakte Kontrollhälfte wurden für 40 bis 150 Minuten inkubiert (n=18). In fast allen Fällen (n=16/18) ist das Expressionsmuster in der intakten Embryonenhälfte und in der isolierten SP identisch oder sehr ähnlich (Abb. 7C-E). Dies trifft auch zu, wenn sich während einer langen Inkubation ein zusätzlicher Somit bildet und damit ein neuer Zyklus gestartet worden ist (Abb. 7D). Sowohl die dynamische Progression, als auch das zyklische Verhalten der lunatic fringe Expression sind damit unabhängig vom fortdauernden Kontakt zu den umliegenden Geweben. 3.4 Transplantation einer Segmentplatte in ein neues Umfeld Die aufgeführten Ergebnisse zeigen, daß auch ohne äußere Signale die lunatic fringe Expression den Expressionszyklus unverändert fortsetzen kann. Sie machen jedoch keine Aussage darüber, ob äußere EInflüsse diesen Expressionszyklus verändern können. In diesem Zusammenhang ist es interessant zu erwähnen, daß in der Literatur ein Einfluß des Umfelds auf die Somitogenese beschrieben wird. So bilden sich aus Segmentplatten, die aus Wachtelembryonen isoliert und in Hühnerembryonen implantiert wurden, Somiten, die von der Größe eher Hühnersomiten gleichen (Packard et al. 1993). Damit sollte gezeigt werden, daß die Somitenbildung durch ein verändertes Umfeld beeinflußt werden kann. Die Methodik dieser Arbeit wurde übernommen, um zu prüfen, ob ein solcher Umwelteinfluß auf die lunatic fringe Expression nachgewiesen werden kann. Aus Wirtembryonen wurde eine SP entfernt und durch die SP eines Spenderembryos ersetzt. Sowohl Spender, als auch Empfänger wurden auf einer Eigelb-Agar-Kulturschale für fünf 48 Ergebnisse Stunden inkubiert. Anschließend wurde die lunatic fringe Expression in Spender und Empfänger bestimmt. Paßt sich die implantierte SP an das neue Umfeld an und nimmt die Expressionsphase des Empfängers an, oder verbleibt die implantierte SP auch im neuen Umfeld weiterhin in einem Zyklus, der dem des Ursprungsembyros entspricht? Mehrere Einschränkungen der Auswertbarkeit dieses Experiments sind zu erwähnen. Zunächst läßt sich prinzipiell nur dann eine Aussage treffen, wenn Empfänger und Spender zum Zeitpunkt der Operation sich deutlich in der Expressionsphase unterscheiden. Dies kann man indirekt an der lunatic fringe Expression in der jeweils nicht manipulierten SP in Spender und Empfänger überprüfen. Es wurden daher nur Embryonen ausgewertet, die erstens das oben aufgeführte Kriterium erfüllten und zweitens den operativen Eingriff ohne erkennbare Folgen überlebten. In diesen Fällen zeigt sich, daß die implantierte SP, die während der Inkubationszeit mehrere Somiten gebildet hat, sich in einer Expressionsphase befindet, die der Expressionsphase des Spenderembryos entspricht (n=2). In Abb. 7F ist ein solcher Embryo gezeigt. Entscheidend für die Beurteilung der Expressionsphase ist der Abstand zwischen kranialer und kaudaler Expressionsdomäne. Der Empfängerembryo zeigt dabei auf seiner nicht manipulierten linken Hälfte einen Abstand, der mehrere Somitendurchmesser umfaßt. Dies entspricht der Phase II. Jedoch zeigt sowohl die endogene SP des Spenderembryos, als auch die transplantierte SP des Spenderembryos, die sich im neuen Umfeld des Empfängerembryos befindet, eine Expression der Phase III. Der Abstand zwischen kranialer und kaudaler Expressionsdomäne beträgt hier ungefähr einen Somitendurchmesser und unterscheidet sich somit klar von der Expression in der SP des Empfängers. Damit kann gezeigt werden, daß äußere Einflüsse, die auf eine SP über einen Zeitraum von fünf Stunden einwirken, nicht in der Lage sind, das zyklische Expressionsverhalten von lunatic fringe zu beeinflussen oder zu respezifizieren. 49 Ergebnisse 3.5 Retrovirale Überexpression von lunatic fringe in der Segmentplatte Die Expression von lunatic fringe in der SP hat mehrere interessante Eigenschaften, von denen vor allem das zyklische Expressionsverhalten hervorzuheben ist. Bemerkenswert ist jedoch auch die räumlich klar begrenzte Expression auf Höhe des Somiten –II. Es stellt sich die Frage, ob diese Beschränkung auf Somit- II eine funktionelle Bedeutung hat. Wie verhält sich die Somitenbildung, wenn durch Überexpression von lunatic fringe in der gesamten SP, also einem „gain of function“ Experiment, die Lokalisierung der Expression auf Somit –II aufgehoben wird? Um eine Überexpression gewünschter Genprodukte in Hühnerembryonen zu erreichen, wurde ein retrovirales System verwendet (Hughes et al. 1987; Morgan und Fekete 1996). Ein replikationskompetenter Retrovirus (RCAS), der zusätzlich die cDNA des gewünschten Genes enthält, welches überexprimiert werden soll, wird in Zellkultur produziert und anschließend in den zwei Tage alten Embryo injiziert. Durch die Wahl des Injektionsortes läßt sich dabei eine lokalisierte Überexpression erzielen. Da Retroviren in das Genom der infizierten Zellen integrieren, erzielt man durch diese Infektion eine stabile Transfektion. 12-18 Stunden nach der Injektion läßt sich sowohl die Produktion viraler Proteine als auch die des ektopischen Proteins nachweisen. In der vorliegenden Arbeit wurden zwei Retroviren kloniert, die als zusätzliches Gen die lunatic fringe cDNA der Maus (MFR) oder die lunatic fringe cDNA der Maus mit einer daran angehängten Flu-Epitopmarkierung (MFR-Tag) enthalten. Da ein Antikörper vorliegt, der gegen die Flu-Epitopmarkierung gerichtet ist, kann im Falle des RCAS-MFR-Tag-Virus die Produktion des markierten Lunatic Fringe Proteins in einem Western-Blot mit lysierten, transfizierten primären Hühnerfibroblasten nachgewiesen werden (Abb.8A). Es wurde ein Infektionsschema erarbeitet, welches eine ektopische Expression in der gesamten SP bewirkt (Abb. 8B). Die erfolgreiche Infektion wird mit Hilfe der Wholemount in situ Hybridisierung nachgewiesen, indem als Sonde die lunatic fringe cDNA der Maus verwendet wird (Abb. 8C). Diese Sonde erkennt nur die ektopische lunatic fringe mRNA, nicht jedoch die endogene lunatic fringe Expression. Es wurden mit beiden Viren große Versuchreihen durchgeführt (n= jeweils größer 60). Die Infektionen erfolgten im Stadium HH10-12, anschließend wurden die Embryonen mehrere Tage (2-7) reinkubiert. Sowohl bei der Beurteilung der Somiten anhand der Expression bekannter Gene am Tag 2 50 Ergebnisse nach Infektion, als auch bei Beurteilung der Skelettbildung mit Hilfe einer Knorpelfärbung am Tag 5-7 nach Infektion, werden keinerlei Abweichungen von der Normalentwicklung beobachtet (Abb. 8D,E). In diesen Versuchsreihen konnte damit kein Effekt der lunatic fringe Überexpression auf die Somitenentwicklung nachgewiesen werden. 3.6 Vergleich zweier zyklischer Gene: lunatic fringe und c-hairy1 Wie in der Einleitung beschrieben, ist c-hairy1 das erste Gen, für welches ein zyklisches Expressionsmuster nachgewiesen wurde (Palmeirim et al. 1997). Die vorliegende Arbeit zeigt, daß lunatic fringe ein sehr ähnliches Expressionsverhalten besitzt. Es war deshalb interessant, diese zwei zyklisch exprimierten Gene direkt miteinander bezüglich ihrer zeitlichen und räumlichen Expression zu vergleichen. Hühnerembryonen wurden aus dem Ei isoliert und halbiert. Jede Hälfte wurde anschließend getrennt entweder mit einer lunatic fringe oder mit einer c-hairy1 Sonde hybridisiert. Die Ergebnisse zeigen, daß während des gesamten Expressionszyklus die mRNA beider Gene nahezu identisch exprimiert wird (Abb. 9A-C). Wenn lunatic fringe eine Phase I Expression zeigt, ist auch chairy1 nur in einer Bande exprimiert, die im Gegensatz zu lunatic fringe in den Somiten –I hineinreicht. Auch während der Phase II und III zeigen beide Gene überschneidende Expressionmuster. In neugebildeten Somiten zeigt c-hairy1 eine schwache Expression in der kaudalen Somitenhälfte (Abb. 9A,B), wohingegen lunatic fringe eine schwache Expression in der kranialen Somitenhälfte zeigt (Abb. 9C, siehe auch Abb. 5A;E). Außerdem scheint c-hairy1 insgesamt in viel schwächerer Intensität exprimiert zu sein, da die Färbezeiten zur Visualisierung für c-hairy1 um ein vielfaches länger waren als für die Visualisierung von lunatic fringe (siehe auch Material 2.4.1). Diese Ergebnisse zeigen, daß lunatic fringe und c-hairy1 während eines Expressionszyklus synchron exprimiert werden und sehr ähnliche Expressionsdomänen aufweisen. 51 Ergebnisse 3.7 Kultivierung von Mausembryonen Lunatic fringe zeigt auch in Mausembryonen sehr variable Expressionsmuster (Cohen et al., 1997; Johnston et al., 1997; Evrard et al., 1998). Um zu klären, ob auch in diesem Fall die Variabilität Folge einer sehr dynamischen Veränderung der Expressionsmuster von lunatic fringe ist, wurde an Mausembryonen ein Embryonenkulturexperiment durchgeführt. Dieses wurde analog zu den Versuchsreihen an Hühnerembryonen gestaltet: 9,5 dpc alte Mausembryonen (n= 16) wurden in der kaudalen Mittellinie getrennt. Eine Hälfte wurde sofort fixiert, die andere Hälfte wurde in einem hängenden Tropfen eines Nährmediums inkubiert (30 -135 Minuten) und anschließend ebenfalls fixiert. Die inkubierte und die entsprechende Kontrollseite zeigen meist eine unterschiedliche Expression von lunatic fringe. So zeigt etwa die linke Hälfte des Embryos in Abb. 10A zwei Expressionsbanden im kranialen präsomitischen Mesoderm. Während der Inkubation von 65 Minuten entwickelt die rechte Hälfte dieses Embryos eine breite lunatic fringe Expression im kaudalen Bereich des präsomitischen Mesoderms. Dies deutet auf die dynamische Veränderung der Expression innerhalb eines Embryos hin. Auch die kraniale Progression der zunächst kaudal lokalisierten Expressionsdomäne kann in dieser Versuchsreihe gezeigt werden (Abb. 10B). Schließlich zeigen Embryonenhälften, die sich durch eine Inkubationszeit von 125 Minuten unterscheiden, sehr ähnliche Expressionsmuster (Abb. 10C). Dies weist darauf hin, daß auch in Mausembryonen verschiedene Expressionsphasen anzutreffen sind, die sich dynamisch ineinander umwandeln und nach gewisser Zeit erneut wiederholen. Damit konstituieren sie einen Expressionszyklus, der dem Expressionsverhalten von lunatic fringe in Hühnerembryonen entspricht. 52 4 Diskussion 4.1 Diskussion der Ergebnisse In der vorliegenden Arbeit wurde zunächst das Expressionsverhalten von lunatic fringe in der Segmentplatte von Hühnerembryonen detailliert analysiert, um so einen Hinweis auf eine mögliche Funktion von lunatic fringe in der Somitogenese zu erhalten. Embryonenkulturexperimente ermöglichten darüber hinaus die beobachteten Expressionsmuster zeitlich in Beziehung zu setzen und identifizierten lunatic fringe als ein zyklisch exprimiertes Gen. Die zyklische Expression von lunatic fringe kann in eine stabile und in eine dynamische Komponente unterteilt werden. Die dynamische Expressionskomponente wird am posterioren Ende der Segmentplatte initiiert. Diese Expressionsdomäne, die als initiale Segmentplattenexpression (iSPE) bezeichnet wird, breitet sich dynamisch nach kranial aus und nähert sich so der zweiten, stabilen Komponente. In Anlehnung an das „clock and wavefront“– Modell (siehe Einleitung) kann man diese Ausdehnung als Wellenfront, oder Expressionsfront bezeichnen, die den Embryo von kaudal nach kranial durchläuft. Zum Zeitpunkt der Somitenbildung ersetzt die dynamische Komponente die stabile Expression und ein neuer Zyklus beginnt. Dieser Expressionszyklus wurde in einem Modell schematisch zusammengefaßt (Abb. 6). Was ist die Natur der raschen kranialen Progression der Expressionsfront? Aus Zellmarkierungsexperimenten ist bekannt, daß die in der SP vorhandene Zellmotilität nicht ausreicht, um die beobachtete dynamische Ausbreitung der Expression zu erklären (Palmeirim et al. 1997). Eine wahrscheinlichere Möglichkeit ist, daß diese Progression die Folge einer koordinierten, sequentiellen Aktivierung der lunatic fringe Expression in den Zellen der SP ist. Danach würde nach dem Prinzip einer Lichterkette, bei der ein Licht nach dem anderen aufleuchtet, der Eindruck einer sich bewegenden Welle entstehen, ohne daß dazu tatsächliche Bewegung notwendig ist. 53 Diskussion Eine wichtige Frage ist, wie eine derart koordinierte, sequentielle Expressionsaktivierung erreicht werden kann. Wie erhält eine Zelle in der Segmentplatte die Information, die lunatic fringe Expression zu starten? Wie die Ergebnisse dieser Arbeit zeigen, ist weder eine intakte Segmentplatte, noch andauernde äußere Signale für die Progression der Expressionsfront und auch für den Neustart eines Zyklus notwendig. Zusätzlich läßt sich der Expressionszyklus einer SP auch durch Implantation in ein neues Umfeld nicht respezifizieren. Spätestens mit der Bildung der SP ist dieser Expressionszyklus determiniert, zumindest sind die Signale des neuen Umfeldes nicht in der Lage, die Expression zu respezifizieren. Die sequentielle Aktivierung ist demnach nicht die Folge einer zellvermittelten Fortleitung im Sinne eines Relais–Mechanismus. Vielmehr scheinen die Zellen spätestens mit Eintritt in die SP die Information für ein oszillatorisches Expressionsverhalten erhalten zu haben. Die Zellen in der SP sind in der Lage, die lunatic fringe Expression zu einem genauen Zeitpunkt zu starten, ohne daß fortbestehende äußere Signale zur Aktivierung notwendig sind. Die Ergebnisse lassen weiterhin den Schluß zu, daß die Aktivierung der lunatic fringe Expression eine intrinsische Eigenschaft der Segmentplatte darstellt, daß jedoch Signale der umliegenden Gewebe zur Aufrechterhaltung bzw. Unterstützung der Expression notwendig sind. So sieht man nach Isolierung einer Segmentplatte mit anschließender langer Inkubation einen deutlichen Abfall der Expressionsintensität im Vergleich zur intakten Kontrollhälfte (Abb. 7E). Wird jedoch die Segmentplatte isoliert und anschließend in einen Empfängerembryo so implantiert, daß Kontakt zu allen umliegenden Geweben besteht, zeigt sich auch nach relativ langer Inkubation kein Abfall der Expressionsintensität (Abb. 7F). Diese Ergebnisse sprechen dafür, daß äußere Signale der Aufrechterhaltung der lunatic fringe Expression dienen, die primäre Aktivierung und Fortleitung der Expression jedoch eine intrinsische Fähigkeit der Segmentplattenzellen darstellt. Damit besitzt die lunatic fringe Expression eine Gemeinsamkeit mit dem Vorgang der Segmentierung, welcher ebenfalls eine intrinsische Fähigkeit der Segmentplatte darstellt (siehe Einleitung). Ungeachtet dessen, ob es sich dabei um zwei voneinander unabhängige oder zwei sich gegenseitig bedingende Fähigkeiten handelt, müssen diese bereits früh an prospektive Segmentplattenzellen vermittelt worden sein. Lunatic fringe ist zum Zeitpunkt der Gastrulation in Epiblastzellen exprimiert. Zellmarkierungsexperimente haben gezeigt, daß Epiblastzellen in Bezug auf ihre spätere Differenzierung topisch angeordnet sind. Entsprechend diesen Ergebnissen wird lunatic 54 Diskussion fringe in Zellen exprimiert, die den prospektiven paraxialen Mesodermzellen entsprechen (Psychoyos und Stern 1996). Daher ist es möglich, daß lunatic fringe in diesem frühen Stadium an der Vermittlung wichtiger Informationen für die Somitogenese beteiligt ist. Ein der Segmentplatte innewohnendes Signal, welches mit Lunatic Fringe in funktioneller Wechselbeziehung steht, könnte in Form des Transkriptionsfaktors c-Hairy1 vorliegen. Wie in der Einleitung beschrieben, war c-hairy1 das erste Gen, für welches ein zyklisches Expressionsverhalten gezeigt weden konnte. Die Ergebnisse der vorliegenden Arbeit zeigen, daß lunatic fringe und c-hairy1 in Lokalisation und Dynamik ein sehr ähnliches Expressionsverhalten aufweisen. Während der drei Expressionsphasen zeigen ihre Expressionsdomänen bemerkenswerte Überschneidungen. Beide Gene zeigen darüber hinaus einen sehr ähnlichen zeitlichen Ablauf des Expressionszyklus. Sowohl die Gesamtdauer, die in beiden Fällen der Dauer einer Somitenbildung entspricht, als auch die individuelle Phasendauer sind in beiden Fällen nahezu identisch. Aufgrund dieser Synchronität ist ein funktionelles Zusammenspiel dieser beiden Genprodukte vorstellbar. C-hairy1 kodiert für einen Transkriptionsfaktor der bHLH–Familie und kommt daher als Regulator der lunatic fringe Expression theoretisch in Betracht. Dabei ist zu bemerken, daß c-hairy1 Sequenzelemente aufweist, die charakteristisch für eine aktive Repressorfunktion sind (Palmeirim et al. 1997). Diese Sequenzinformationen sprechen dafür, daß es sich bei einer möglichen Aktivierung der lunatic fringe Expression durch c-Hairy1 um eine indirekte Regulation handelt. Anderseits ist ebenfalls vorstellbar, daß Lunatic Fringe die c-hairy1 Aktivität reguliert. Da Lunatic Fringe Sequenzähnlichkeiten mit Glykosyltransferasen besitzt ist auch hier eine direkte Aktivierung unwahrscheinlich (Yuan et al. 1997). Über den Notch-Signalweg besteht jedoch eine mögliche Verbindung zwischen Lunatic Fringe und c-Hairy1. Lunatic Fringe ist ein bekannter Modulator des Notch- Signalweges (Barrantes et al. 1999; Cohen et al. 1997; Evrard et al. 1998; Johnston et al. 1997; Panin et al. 1997). Von Ergebnissen in Invertebraten ist bekannt, daß Mitglieder der Familie der hairy/enhancer of split bHLH Transkriptionsfaktoren Zielgene dieses Signalweges darstellen (Greenwald 1998; Gridley 1997; Jennings et al. 1994). In Vertebraten stellen Hes Gene Homologe zu der Familie der hairy/enhancer of split Transkriptionsfaktoren dar (Kageyama und Nakanishi 1997). Ihre Regulation durch den Notch-Signalweg wurde durch rekombinanten 55 Diskussion Mutationsexperimenten in der Maus belegt (de la Pompa et al. 1997). So ist sowohl in Mausmutanten, die kein Notch1 oder RBP-J-kappa produzieren, als auch in Lunatic Fringe-Mutanten, die Expression von H e s 5 im präsomitischen Mesoderm stark abgeschwächt oder fehlt vollständig (Barrantes et al. 1999; Evrard et al. 1998). Auch CHairy1 gehört zu der Familie der hairy/enhancer of split Transkriptionsfaktoren, so daß diese Ergebnisse für eine indirekte Regulation der c-hairy1 Expression durch Lunatic Fringe und den Notch-Signalweg sprechen. Hervorzuheben sind nicht nur die Gemeinsamkeiten der Expression von lunatic fringe und c-hairy1 in Hühnerembryonen, sondern auch ihre Unterschiede. So ist der Startpunkt der dynamischen Komponente der Expression beider Gene nicht identisch beschrieben worden. Die Expression von c-hairy1 nimmt ihren Ursprung im am weitesten kaudal gelegenen Abschnitt der SP, einschließlich des Schwanzknospenbereichs (Palmeirim et al. 1997). Die Ergebnisse der vorliegenden Arbeit zeigen jedoch, daß die dynamische Komponente der lunatic fringe Expression ihren Ursprung nicht in der Schwanzknospe nimmt. Vielmehr beginnt die kaudale Expression mit der iSPE und breitet sich nach kranial aus. Die Schwanzknospenexpression wird erst zu einem späteren Zeitpunkt innerhalb des Expressionszyklus aktiviert. Damit stellt sich die Frage, wie die Expressionen in der SP und der Schwanzknospe zusammenhängen. So könnte die Expression in der Schwanzknospe eine Folge einer auch kaudalen Ausbreitung der iSPE sein. Eine andere attraktivere Möglichkeit ist, daß Segmentplattenexpression und Schwanzknospenexpression unabhängig voneinander reguliert werden. Für diese Möglichkeit sprechen zum einen die Expressionsergebnisse dieser Arbeit. Sowohl Beginn der Expression in der Schwanzknospe als auch die Beendigung dieser Expression lassen sich nur schwer in den Expressionszyklus der Segmentplatte einordnen. Zum anderen stellen Segmentplatte und Schwanzkospe entwicklungsgeschichtlich keine identische Strukturen dar. Während die Segmentplatte bereits spezifiziertes Mesoderm repräsentiert, stellt die Schwanzknospe ein Rudiment des Primitivstreifens dar (Schoenwolf 1979). Die Zellen in der Schwanzknospe haben das Potential, sich in viele verschiedene Zellen und Gewebe zu differenzieren. Dazu zählen die Segmentplattenzellen, aber auch Zellen des posterioren Neuralrohrs und der kaudalen Gefäße. Weitere Experimente, die speziell die Expressionsdynamik im 56 Diskussion Schwanzknospenbereich untersuchen, sind notwendig, um Aufschluß über die Beziehung der Segmentplattenexpression zur Schwanzknospenexpression zu gewinnen. Ein weiterer bemerkenswerter Unterschied zwischen der Expression von lunatic fringe und c-hairy1 betrifft die Lokalisation in Somit -I bzw. in den bereits gebildeten Somiten. Während für c-hairy1 eine Expression in der posterioren Hälfte des Somiten -I und der gebildeten Somiten beschrieben wurde, zeigen die Ergebnisse dieser Arbeit, daß lunatic fringe in der anterioren Hälfte exprimiert wird (Palmeirim et al. 1997). Diese lokalisierte Expression in einer Somitenhälfte spricht für eine Beteiligung dieser zyklischen Gene am Vorgang der Polarisierung der Somiten in eine anteriore und eine posteriore Hälfte. Darüber hinaus sprechen die Ergebnisse dafür, daß diese Polarisierung auf Höhe der Somiten -II bzw. Somit -I stattfindet, denn erst im Bereich von Somit -I zeigen lunatic fringe und c-hairy1 eine gegensätzliche und auf eine Somitenhälfte lokalisierte Expression. In Einklang damit stehen Ergebnisse aus Zellmarkierungsexperimenten, die zeigten, daß die Polarisierung der Somiten entlang der anterior-posterioren Achse in der kranialen Segmentplatte, also vor Somitenbildung stattfindet (Stern et al. 1988). Für Lunatic Fringe liegen Ergebnisse aus Untersuchungen in der Maus vor, die eine Beteiligung an der Polarisierung nachgewiesen haben. Mausembryonen, die kein Lunatic Fringe produzieren, zeigen unregelmäßig geformte Somiten, die keine Polarisierung in eine anteriore und eine posteriore Hälfte besitzen (Evrard et al. 1998). Um auch in Hühnerembryonen die Funktion von Lunatic Fringe zu untersuchen, wurde in der vorliegenden Arbeit eine retrovirale Überexpression von lunatic fringe durchgeführt. Mit Hilfe des retroviralen Vektors wurde die SP so infiziert, daß die gesamte SP dauerhaft lunatic fringe exprimiert. Damit war sowohl die lokalisierte Expression im Somit -II, als auch der Expressionzyklus aufgehoben. Es konnte jedoch kein Effekt der Überexpression auf die Somitogenese nachgewiesen werden. Abgesehen von methodischen Überlegungen kann die Ursache für die negativen Ergebnisse im Wirkmechanismus von Lunatic Fringe begründet sein. Ein Überschuß an Lunatic Fringe hat unter Umständen keinen negativen Einfluß auf die Somitenentstehung, wohingegen ein Mangel an diesem Protein die normale Somitenentstehung erheblich beeinträchtigt (Evrard et al. 1998; Zhang und Gridley 1998). In einem solchen Falle würde auch ein methodisch einwandfreier Überexpressionsansatz keine Effekte auf die Somitogenese erzielen. 57 Diskussion Da die funktionelle Bedeutung von Lunatic Fringe für die Somitogenese nur in Mausembryonen experimentell belegt ist, war es von Bedeutung zu überprüfen, ob ein zyklisches Expressionsverhalten von lunatic fringe nicht nur im Hühnerembryo, sondern auch in Mausembryonen nachzuweisen ist. Aus vorausgegangenen Arbeiten war bekannt, daß auch in Mausembryonen sehr unterschiedliche lunatic fringe Expressionsmuster anzutreffen sind, was ein Hinweis auf eine dynamische Expression ist. In der vorliegenden Arbeit konnte gezeigt werden, daß lunatic fringe im präsomitischen Mesoderm von 9,5 dpc Mausembryonen tatsächlich ein zyklisches Expressionsverhalten aufweist. Damit ist lunatic fringe das erste Gen mit zyklischem Expressionsverhalten, dessen Produkt eine nachgewiesene funktionelle Bedeutung in der Somitogenese besitzt. 4.2 Über Oszillationen und Zyklen Die Ergebnisse der Embryonenkulturexperimente zeigen, daß lunatic fringe oszillatorisch und zyklisch in der Segmentplatte exprimiert wird. Die unterschiedliche Bedeutung der Begriffe „oszillatorisch“ und „zyklisch“ soll kurz erläutert werden. Oszillatorisch ist eine Beschreibung des Expressionsverhalten auf dem Einzelzellniveau. Damit ist in diesem Zusammenhang gemeint, daß jede Zelle in der SP zwischen zwei Zuständen hin und herschwingt (lat. oscillare; schaukeln, schwingen), nämlich zwischen dem lunatic fringe exprimierenden und dem nicht-exprimierenden Zustand. Nur dadurch, daß diese Oszillationen koordiniert ablaufen, entstehen Expressionsmuster oder Expressionsphasen, die sich ineinander umwandeln und sich periodisch, also zyklisch wiederholen. Der Begriff „zyklisch“ bezieht sich daher auf die Boebachtung, daß die Expressionsmuster einen Kreislauf oder Zyklus konstituieren. Er beschreibt daher weniger die Situation auf Einzelzellniveau als vielmehr den Ablauf der Expression bezogen auf die gesamte SP. Die Koordination der Oszillationen stellt damit die Grundlage für das zyklische Expressionverhalten dar. In diesem Zusammenhang ist es wichtig festzuhalten, daß die Ergebnisse zum Expressionszyklus sich jedoch nicht auf die Oszillationseigenschaften der Einzelzelle übertragen lassen. So beträgt die Zyklusdauer 95 Minuten in Hühnerembryonen, es wäre jedoch sicherlich falsch, daraus direkt auf die 58 Oszillationsdauer schließen zu wollen. Diskussion Die Abbildung 11 soll diese Überlegungen verdeutlichen. Daraus folgt, daß weitere Experimente auf Einzelzellniveau nötig wären, um genauere Aussagen über die Eigenschaften der lunatic fringe Oszillationen machen zu können. Besonders interessant wäre es, das zeitliche Verhältnis des Expressionszustandes zum Nicht-Expressionszustand zu bestimmen. Informationen über die Oszillationseigenschaften würden damit auch einen direkteren Hinweis auf die Natur einer molekluaren Uhr liefern. 4.3 Theoretische Überlegungen zur Funktion von lunatic fringe in der Somitogenese Die aktuelle Somitenforschung steht vor der interessanten Herausforderung, die in den letzten Jahrzehnten erworbenen Daten und entwickelten theoretische Modelle, mit neueren meist molekularbiologischen Ergebnissen in Verbindung zu setzen. Die Ergebnisse der vorliegenden Arbeit eignen sich in besonderer Weise, diesem Anliegen nachzukommen. In theoretischen Modellen zur Somitenentstehung, von denen mehrere in der Einleitung kurz beschrieben wurden, wird ein zellautonomes oszillatorisches Element postuliert, welches das Grundelement des Somitogenesemechanismus darstellen soll. Eine Publikation aus dem Jahre 1986, in der das Modelll nach Meinhardt vorgestellt wurde, beschreibt die Eigenschaften dieses, zum damaligen Zeitpunkt rein theoretischen Oszillators: “The model described above is an attempt to find a feasible molecular mechanism compatible with available data. This model would obtain strong support if the postulated oscillations in the mesoderm before somite formation could be detected. One full cycle of this oscillation should take precisely the same time as that required for the formation of one somite (about 2 h in Xenopus)" (Meinhardt 1986). Der Nachweis, daß lunatic fringe im unsegmentierten Mesoderm von Hühner- und Mausembryonen zyklisch exprimiert ist, wobei die Oszillationsdauer in Hühnerembryonen im Bereich der Zeit einer Somitenentstehung liegt, unterstützt die Vorstellung eines molekularen Oszillators. Den 59 Diskussion ersten experimentellen Hinweis auf das Vorliegen einer solchen molekularen Uhr lieferten die Expressionsergebnisse von c-hairy1. Isabelle Palmeirim gelang es als erster, das dynamische Expressionsverhalten von c-hairy1 richtig zu interpretieren und damit das erste zyklisch exprimierte Gen zu identifizieren (Palmeirim et al. 1997). Die Ergebnisse der vorliegenden Arbeit zeigen, daß es sich bei c-hairy1 nicht um eine seltene Ausnahme handelt, sondern bestärken die Idee einer molekularen Uhr als generelles Prinzip für die Somitogenese. Da lunatic fringe ein zyklisches Gen mit bekannter funktioneller Bedeutung in der Somitenbildung ist, stellen die Ergebnisse eine solche molekulare Uhr in direkten Zusammenhang mit der Somitogenese. Zusätzlich zu den hier beschriebenen Eigenschaften ist Lunatic Fringe ein wichtiger Modulator des Notch-Signalweges (siehe Einleitung, Barrantes et al. 1999). Lunatic fringe stellt damit eine Verbindung zwischen dem Notch-Signalweg, der eine entscheidende Bedeutung für die Somitogenese besitzt, und einem autonomen zellulären Oszillator her (Irvine 1999). Wie könnte man sich eine solche Integration funktionell vorstellen? Hier sollen zwei Möglichkeiten diskutiert werden. (a) lunatic fringe lokalisiert die Notch-Aktivität auf die Somitenhöhe -I/-II Der entscheidende Vorgang, der zur unmittelbaren Somitenentstehung führt, ist die Bildung einer Grenze zwischen Somit -I und Somit -II. Ein Signalweg, der für diesen Vorgang verantwortlich sein könnte, ist der Notch-Signalweg. Dieser Signalweg ist, wie schon häufiger erwähnt, an vielen Vorgängen beteiligt, die zu Kompartimentierung führen (siehe Einleitung) (Cho und Choi 1998; de Celis et al. 1998; Rauskolb und Irvine 1999). Komponenten des Notch-Signalweges, wie etwa Notch-1, Notch-2, Delta-like 1(Dll-1), Deltalike-3 (Dll-3) und Jagged 1 (Homolog zu Drosophola serrate) zeigen jedoch im Gegensatz zu lunatic fringe in der SP keine streng lokalisierte Expression auf den Bereich -I/-II, sondern sind vielmehr in einem großen Bereich in der SP exprimiert (Barrantes et al. 1999). Da lunatic fringe an der Grenze von -I zu -II exprimiert wird, könnte die Funktion darin bestehen, die Notch-Aktivität ebenfalls auf den Bereich -I/-II zu lokalisieren. Wenn das Vorhandensein von lunatic fringe Voraussetzung für eine Aktivierung des NotchSignalweges ist, dann würde die lokalisierte Expression von lunatic fringe ausreichen, auch die Eingrenzung der Notch-Aktivität auf den Bereich -I/-II zu bewirken. Unterstützt wird 60 Diskussion diese Hypothese durch vorausgegangene Untersuchungen, die zeigten, daß die Modulation des Notch-Signalweges durch Fringe-Proteine darin besteht, die NotchAktivität zu lokalisieren (Cho und Choi 1998; Panin et al. 1997). Das zyklische Expressionverhalten könnte in diesem Falle die Funktion haben, die genaue Lokalisierung der lunatic fringe Expression auf Somitenhöhe -II sicherzustellen . (b) Die zyklische lunatic fringe Expression als Ausdruck einer periodisch ablaufenden Vorbereitung der Somitenbildung Der periodisch-sequentielle Charakter der Somitenentwicklung bei Vertebraten wirft einige interessante Fragen auf. Wieso beträgt die Periodizität (im Falle des Hühnerembryos) 90 Minuten? Warum vergehen vom Eintritt einer Zelle in die SP bis zu ihrer Integration in einen Somiten 18 Stunden? Haben diese 18 Stunden „Verzögerung“ funktionelle Relevanz? Während ihres Aufenthaltes in der SP exprimiert jede Zelle lunatic fringe in einem Abstand von ungefähr 95-100 Minuten. Bis zur Integration in einen Somiten vollzieht jede Zelle demnach 10-12 Expressionszyklen. Palmeirm et al. schlugen in Anlehnung an das Modell von Hans Meinhardt vor, daß die Zellen die c-hairy1 Expressionspulse registrieren und zählen können (Palmeirim et al. 1997). Die Zellen würden demnach die Anzahl der Expressionen zählen und nach 12 Expressionszyklen einen Somiten bilden. Bezieht man die Ergebnisse der vorliegenden Arbeit in diese Überlegungen mit ein, könnte dies bedeuten, daß bei jeder lunatic fringe Expression Notchprotein in eine aktive Form überführt und als Folge davon ein weiterer Faktor (oder Notch selbst) akkumuliert wird. Jede erneute Expression führt zu einer Akkummulation dieses Faktors, bis nach 10-12 Zyklen eine ausreichende Menge vorliegt und die Somitenbildung stattfinden kann. Mehrere Aspekte der Somitogenese können während dieses Reifeprozesses vorbereitet werden. Prinzipiell muß die Somitengröße definiert, der Somit in ein anteriores und ein posteriores Segment unterteilt und die mesenchymale-epitheliale Transformation ermöglicht werden. Die lunatic fringe Expression wäre damit Zeichen eines ablaufenden Reifeprozesses der Zellen in der SP. Dieser Prozeß findet periodisch statt, d.h mit jeder Expression erlangt die Zelle oder vielmehr die Zellpopulation die nächst höhere Kompetenzstufe. Dieser 61 Diskussion periodische Reifungsprozeß wäre somit sowohl die Ursache für die periodische Somitenbildung, als auch der Grund für die lange Verweildauer der Zellen in der SP. 4.4 Ausblick Eine grundsätzliche Einschränkung zu den Ergebnissen dieser Arbeit, wie auch zu anderen Arbeiten über zyklisch exprimierte Gene, ist, daß alle Untersuchungen ausschließlich auf dem Niveau der mRNA durchgeführt wurden. Es gibt zum aktuellen Zeitpunkt keine Informationen über die Proteinexpression und Verteilung von Lunatic Fringe. Ein Ziel muß es also sein, in zukünftigen Untersuchungen zu klären, ob Lunatic Fringe auch auf dem Niveau der Proteinexpression zyklisch und lokalisiert exprimiert wird. Die beschriebenen Charakteristika der lunatic fringe Expression haben wesentliche Gemeinsamkeiten mit den Eigenschaften der Somitogenese: beide Ereignisse sind periodischer, zyklischer Natur, sie sind eine intrinsische Fähigkeit des unsegmentierten paraxialen Mesoderms und werden beide sehr früh determiniert. Damit scheint der Mechanismus, der für diese Eigenschaften der lunatic fringe Expression verantwortlich ist, unmittelbar mit dem Mechanismus verbunden oder gar übereinstimmend zu sein, der der Somitogenese zugrunde liegt. Die Entdeckung des Kontrollmechanismus der lunatic fringe Expression würde daher einen entscheidender Schritt zum Verständnis der Somitogenese darstellen. Ein langfristiges Ziel besteht darin, die molekulare Uhr zu identifizieren, die der Somitogenese zu Grunde liegt. 62 5 Zusammenfassung In der vorliegenden Arbeit wurde das dynamische Expressionverhalten von lunatic fringe im unsegmentierten paraxialen Mesoderm in Hühner- und Mausembryonen untersucht. Die Ergebnisse bei Hühnerembryonen zeigen, daß lunatic fringe schon während der Gastrulation in Epiblastzellen exprimiert wird, in einem Bereich, der den prospektiven paraxialen Mesodermzellen entspricht. Im weiteren Verlauf der Entwicklung wird lunatic fringe in der SP exprimiert, wobei eine stabile Expressionsbande auf Höhe des Somiten –II lokalisiert ist. Embryonenkulturexperimente zeigen, daß lunatic fringe zyklisch exprimiert wird und es konnten drei Expressionsphasen bestimmt werden. Der Expressionszyklus wird in einem Modell zusammenfassend dargestellt. Die Dauer eines gesamten Expressionszyklus beträgt 95 Minuten und entspricht damit der Dauer einer Somitenbildung. Die zyklische Expression von lunatic fringe ist dabei unabhängig sowohl von der Intakheit der SP als auch von Signalen von umliegenden Geweben. Darüber hinaus kann auch die Transplantation einer SP in ein neues Umfeld diesen Zyklus nicht respezifizieren. Der Expressionszyklus ist damit eine intrinsische Eigenschaft der SP. Überexpressionexperimente, die zur ektopen Expression von lunatic fringe in der gesamten SP führten, zeigen keinen Effekt auf die regelrechte Somitenbildung. Daher bleibt die funktionelle Bedeutung der zyklischen Expression noch zu klären. Der Expressionsvergleich mit c-hairy1 zeigt, daß beide Gene zeitlich synchron und räumlich überlappend exprimiert werden, was die Möglichkeit einer funktionellen Interaktion oder eines gemeinsamen Kontrollmechanismus eröffnet. Abschließend konnte in Experimenten an Mausembryonen gezeigt werden, daß lunatic fringe auch in Säugetieren zyklisch exprimiert wird. Die Ergebnisse der vorliegenden Arbeit identifizieren lunatic fringe als erstes Gen, welches eine zyklische Expression mit gleichzeitig bekannter Funktion in der Somitogenese aufweist. Da lunatic fringe ein Modulator des Notch-Signalweges ist, stellen die Ergebnisse dieser Arbeit darüber hinaus eine Verbindung des Notch-Signalweges mit der Vorstellung eines molekularen Oszillators her. Langfristiges Ziel ist es, diese molekulare Uhr zu identifizieren. 63 6 Literaturverzeichnis Artavanis-Tsakonas S, Matsuno K, Fortini ME (1995) Notch signaling. Science 268: 225-232. Barrantes IB, Elia AJ, Wunsch K, De Angelis MH, Mak TW, Rossant J, Conlon RA, Gossler A, de la Pompa JL (1999) Interaction between notch signalling and lunatic fringe during somite boundary formation in the mouse [In Process Citation]. Curr Biol 9: 470-480. Brand-Saberi B, Christ B. (1999). Evolution and Development of Distinct Cell Lineages Derived from Somites. In: Current Topics in Developmental Biology (Ordahl C, Ed.), Vol. 47, pp. 255-296. Brand-Saberi B, Wilting J, Ebensperger C, Christ B (1996) The formation of somite compartments in the avian embryo. Int J Dev Biol 40: 411-420. Burgess R, Rawls A, Brown D, Bradley A, Olson EN (1996) Requirement of the paraxis gene for somite formation and musculoskeletal patterning. Nature 384: 570-573. Capdevila J, Tabin C, Johnson RL (1998) Control of dorsoventral somite patterning by Wnt-1 and beta-catenin. Dev Biol 193: 182-194. Cho KO, Choi KW (1998) Fringe is essential for mirror symmetry and morphogenesis in the Drosophila eye. Nature 396: 272-276. Christ B, Jacob HJ, Jacob M (1974) [Somitogenesis in the chick embryo. Determination of the segmentation direction]. Verhandlungen der Anatomischen Gesellschaft 68: 573-579. Christ B, Jacob HJ, Jacob M (1979) Über die Gestaltungsfunktion der Somiten bei der Entwicklung der Körperwand von Hühnerembryonen. Verh Anat Ges. 73: 537-549. Christ B, Ordahl CP (1995) Early stages of chick somite development. Anat Embryol 191: 381-396. Christ B, Schmidt C, Huang R, Wilting J, Brand-Saberi B (1998) Segmentation of the vertebrate body. Anat Embryol 197: 1-8. Cohen B, Bashirullah A, Dagnino L, Campbell C, Fisher WW, Leow CC, Whiting E, Ryan D, Zinyk D, Boulianne G, Hui CC, Gallie B, Phillips RA, Lipshitz HD, Egan SE (1997) Fringe boundaries coincide with Notch-dependent patterning centres in 64 Literaturverzeichnis mammals and alter Notch-dependent development in Drosophila. Nat Genet 16: 283-288. Conlon RA, Reaume AG, Rossant J (1995) Notch1 is required for the coordinate segmentation of somites. Development 121: 1533-1545. Cooke J (1975) Control of somite number during morphogenesis of a vertebrate, Xenopus laevis. Nature 254: 196-199. Cooke J (1998) A gene that resuscitates a theory--somitogenesis and a molecular oscillator. Trends Genet 14: 85-88. Cooke J, Zeeman EC (1976) A clock and wavefront model for control of the number of repeated structures during animal morphogenesis. Journal of Theoretical Biology 58: 455-476. de Celis JF, Tyler DM, de Celis J, Bray SJ (1998) Notch signalling mediates segmentation of the Drosophila leg. Development 125: 4617-4626. de la Pompa JL, Wakeham A, Correia KM, Samper E, Brown S, Aguilera RJ, Nakano T, Honjo T, Mak TW, Rossant J, Conlon RA (1997) Conservation of the Notch signalling pathway in mammalian neurogenesis. Development 124: 1139-1148. Dominguez M, de Celis JF (1998) A dorsal/ventral boundary established by Notch controls growth and polarity in the Drosophila eye. Nature 396: 276-278. Evrard YA, Lun Y, Aulehla A, Gan L, Johnson RL (1998) lunatic fringe is an essential mediator of somite segmentation and patterning. Nature 394: 377-381. Flint OP, Ede DA, Wilby OK, Proctor J (1978) Control of somite number in normal and amputated mutant mouse embryos: an experimental and a theoretical analysis. J Embryol Exp Morphol 45: 189-202. Fowler J (1970) Control of vertebrate numbers in teleosts- an embryological problem. Q.Rev.Biol. 45: 148-167. Gossler A, Hrabe de Angelis M (1998) Somitogenesis. Current Topics in Developmental Biology 38: 225-287. Greenwald I (1998) LIN-12/Notch signaling: lessons from worms and flies. Genes Dev 12: 1751-1762. Gridley T (1997) Notch signaling in vertebrate development and disease. Mol Cell Neurosci 9: 103-108. Griffith CM, Wiley MJ, Sanders EJ (1992) The vertebrate tail bud: three germ layers from one tissue. Anat Embryol 185: 101-113. 65 Literaturverzeichnis Hamburger V, Hamilton HL (1992) A series of normal stages in the development of the chick embryo. Dev Dyn 195: 231-272. Hrabe de Angelis M, McIntyre Jn, Gossler A (1997) Maintenance of somite borders in mice requires the Delta homologue DII1. Nature 386: 717-721. Huang R, Zhi Q, Neubuser A, Muller TS, Brand-Saberi B, Christ B, Wilting J (1996) Function of somite and somitocoele cells in the formation of the vertebral motion segment in avian embryos. Acta Anat 155: 231-241. Hughes SH, Greenhouse JJ, Petropoulos CJ, Sutrave P (1987) Adaptor plasmids simplify the insertion of foreign DNA into helper- independent retroviral vectors. J Virol 61: 3004-3012. Irvine KD (1999) Fringe, notch, and making developmental boundaries [In Process Citation]. Curr Opin Genet Dev 9: 434-441. Irvine KD, Wieschaus E (1994) fringe, a Boundary-specific signaling molecule, mediates interactions between dorsal and ventral cells during Drosophila wing development. Cell 79: 595-606. Jennings B, Preiss A, Delidakis C, Bray S (1994) The Notch signalling pathway is required for Enhancer of split bHLH protein expression during neurogenesis in the Drosophila embryo. Development 120: 3537-3548. Johnston SH, Rauskolb C, Wilson R, Prabhakaran B, Irvine KD, Vogt TF (1997) A family of mammalian Fringe genes implicated in boundary determination and the Notch pathway. Development 124: 2245-2254. Kageyama R, Nakanishi S (1997) Helix-loop-helix factors in growth and differentiation of the vertebrate nervous system. Curr Opin Genet Dev 7: 659-665. Keynes RJ, Jaques KF, Cook GM (1991) Axon repulsion during peripheral nerve segmentation. Development Suppl 2: 131-139. Keynes RJ, Stern CD (1988) Mechanisms of vertebrate segmentation. Development 103: 413-429. Kusumi K, Sun ES, Kerrebrock AW, Bronson RT, Chi DC, Bulotsky MS, Spencer JB, Birren BW, Frankel WN, Lander ES (1998) The mouse pudgy mutation disrupts Delta homologue Dll3 and initiation of early somite boundaries. Nat Genet 19: 274-278. Malpighi M (1689) "Opera omnia". Lugduni, Batav. Meinhardt H. (1986). Models of Segmentation. In: Somites in Developing Embryos (Bellairs RE, Donald A; Lash James W, Ed.), Plenum Press, New York, pp. 179-189. 66 Literaturverzeichnis Morgan BA, Fekete DM (1996) Manipulating gene expression with replication-competent retroviruses. Methods Cell Biol 51: 185-218. Oka C, Nakano T, Wakeham A, de la Pompa JL, Mori C, Sakai T, Okazaki S, Kawaichi M, Shiota K, Mak TW, Honjo T (1995) Disruption of the mouse RBP-J kappa gene results in early embryonic death. Development 121: 3291-3301. Packard DS, Jr. (1976) The influence of axial structures on chick somite formation. Dev Biol 53: 36-48. Packard DS, Jr., Zheng RZ, Turner DC (1993) Somite pattern regulation in the avian segmental plate mesoderm. Development 117: 779-791. Palmeirim I, Dubrulle J, Henrique D, Ish-Horowicz D, Pourquie O (1998) Uncoupling segmentation and somitogenesis in the chick presomitic mesoderm. Dev Genet 23: 77-85. Palmeirim I, Henrique D, Ish-Horowicz D, Pourquie O (1997) Avian hairy gene expression identifies a molecular clock linked to vertebrate segmentation and somitogenesis. Cell 91: 639-648. Panin VM, Papayannopoulos V, Wilson R, Irvine KD (1997) Fringe modulates Notchligand interactions. Nature 387: 908-912. Pardue ML, Gall JG (1970) Chromosomal localization of mouse satellite DNA. Science 168: 1356-1358. Primmett DR, Norris WE, Carlson GJ, Keynes RJ, Stern CD (1989) Periodic segmental anomalies induced by heat shock in the chick embryo are associated with the cell cycle. Development 105: 119-130. Primmett DR, Stern CD, Keynes RJ (1988) Heat shock causes repeated segmental anomalies in the chick embryo. Development 104: 331-339. Psychoyos D, Stern CD (1996) Fates and migratory routes of primitive streak cells in the chick embryo. Development 122: 1523-1534. Rauskolb C, Irvine KD (1999) Notch-mediated segmentation and growth control of the drosophila Leg [In Process Citation]. Dev Biol 210: 339-350. Remak R (1850) Untersuchungen über die Entwicklung der Wirbeltiere. Reimer, Berlin Rickmann M, Fawcett JW, Keynes RJ (1985) The migration of neural crest cells and the growth of motor axons through the rostral half of the chick somite. J Embryol Exp Morphol 90: 437-455. 67 Literaturverzeichnis Sakamoto K, Yan L, Imai H, Takagi M, Nabeshima Y, Takeda S, Katsube K (1997) Identification of a chick homologue of Fringe and C-Fringe 1: involvement in the neurogenesis and the somitogenesis. Biochemical & Biophysical Research Communications 234: 754-759. Sambrock J, Fritsch EF, Maniatis T. (1989). “Molecular Cloning.” Cold Spring Harbour Laboratory Press Schoenwolf GC (1979) Histological and ultrastructural observations of tail bud formation in the chick embryo. Anat Rec 193: 131-147. Sechrist J, Marcelle C (1996) Cell division and differentiation in avian embryos: techniques for study of early neurogenesis and myogenesis. Methods Cell Biol 51: 301-329. Simpson P (1990) Lateral inhibition and the development of the sensory bristles of the adult peripheral nervous system of Drosophila. Development 109: 509-519. Sosic D, Brand-Saberi B, Schmidt C, Christ B, Olson EN (1997) Regulation of paraxis expression and somite formation by ectoderm- and neural tube-derived signals. Dev Biol 185: 229-243. Stern CD, Bellairs R (1984) Mitotic activity during somite segmentation in the early chick embryo. Anat Embryol 169: 97-102. Stern CD, Fraser SE, Keynes RJ, Primmett DR (1988) A cell lineage analysis of segmentation in the chick embryo. Development 104: 231-244. Stern CD, Keynes RJ (1987) Interactions between somite cells: the formation and maintenance of segment boundaries in the chick embryo. Development 99: 261-272. Stern CD, Vasiliauskas D (1998) Clocked gene expression in somite formation. Bioessays 20: 528-531. Strudel G (1955) L'action morphogène du tube nerveux et la chorde sur la différenciation des vertèbres et des muscles vertébraux chez l'embryon de poulet. Arch.Anat.Microsc.Morphol.Exp. 44: 209-235. Swiatek PJ, Lindsell CE, del Amo FF, Weinmaster G, Gridley T (1994) Notch1 is essential for postimplantation development in mice. Genes Dev 8: 707-719. Tam PP (1981) The control of somitogenesis in mouse embryos. J Embryol Exp Morphol 65 Suppl: 103-128. Tam PP, Trainor PA (1994) Specification and segmentation of the paraxial mesoderm. Anat Embryol 189: 275-305. 68 Literaturverzeichnis Waddington C, Deucher E (1953) Studies on the mechanism of meristic segmentation I. J Embryol. exp. Morph. 1: 349-361. Weinmaster G (1997) The ins and outs of notch signaling. Mol Cell Neurosci 9: 91-102. Wilting J, Brand-Saberi B, Huang R, Zhi Q, Kontges G, Ordahl CP, Christ B (1995) Angiogenic potential of the avian somite. Dev Dyn 202: 165-171. Wu JY, Wen L, Zhang WJ, Rao Y (1996) The secreted product of Xenopus gene lunatic Fringe, a vertebrate signaling molecule [published erratum appears in Science 1996 Oct 25;274(5287):485]. Science 273: 355-358. Yamaguchi TP (1997) New insights into segmentation and patterning during vertebrate somitogenesis. Curr Opin Genet Dev 7: 513-518. Yuan YP, Schultz J, Mlodzik M, Bork P (1997) Secreted fringe-like signaling molecules may be glycosyltransferases. Cell 88: 9-11. Zhang N, Gridley T (1998) Defects in somite formation in lunatic fringe-deficient mice. Nature 394: 374-377. 69 7 Anhang 7.1 Liste der Abkürzungen cDNA komplementäre Desoxyribonukleinsäure dpc dies post coitum DTT Dimethylsulfoxid iSPE initiale Segmentplattenexpression kDa Kilodalton mRNA Messenger Ribonukleinsäure ODX optische Dichte bei x nm Pax paired-box Transkriptionsfaktor PCR Polymerasekettenreaktion PSM präsomitisches Mesoderm RT Raumtemperatur SP Segmentplatte tb Tail bud (Schwanzknospe) Tris Tris-(hydroxymethyl)-aminomethan Tween 20 Polyoxyenthylensorbitanmonolaurat upm Umdrehungen pro Minute 70 7.2 Standardlösungen TE-8 10mM Tris-HCl, pH 8 1mM EDTA pH 8 10 X PBS 80g NaCl 2g KCl 11,5g Na2HPO4 *7 H2O 2g KH2PO4 per 1000ml aqua bidest. TBS 0,14M NaCl 2,7mM KCl 5mM Tris-HCl pH 7,5 5X TBE 450mM Tris-HCl, pH 8 450mM Borsäure 10mM EDTA 50 X TAE 2M Tris-HCl, pH 8 1M Essigsäure 50mM EDTA Anhang 71 Anhang 7.3 Lösungen und Medien für mikrochirugische Manipulationen Locke-Lösung 2,2mM CaCl2 5,4mM KCl 154mM NaCl in aqua bidest Dissektionspuffer für Mausembryonen 5,8g/l NaCl 0,186g/l KCl 0,05g/l KH2PO4 0,05g/l MgSO4* 7H2O 0,004g/l Na2EDTA*2 H2O 0,336g/l NaHCO3 0,25g/l CaCl2 4,76g/l HEPES pH 7,1 10% fetales Rinderserum 7.4 Lösungen/Reagenzien für die Whole-mount in situ Hybridisierung Filtersystem Alle Lösungen wurden vor Gebrauch filtriert (0,22µm, Corning, NY) DEPC H2O 0,1% DEPC (Sigma, St.Louis, MO) in H2 O, bei 37°C über Nacht inkubieren und anschließend autoklavieren. 72 PBT PBS –DEPC mit 0,1% Tween-20 10 X PBS- DEPC 80g NaCl 2g KCl 11.5g Na2HPO4 . 7 H2O 2g KH2PO4 per 1000ml H2O-DEPC. 4% iges Paraformaldehyd 4g Paraformaldehyd (Sigma, St.Louis, MO) 90ml H2O 20µl 10N NaOH 5 Minuten bei 65°C erhitzen anschließend abkühlen lassen und 10ml 10x PBS hinzugeben Glutaraldehyd 25%ig (Sigma, St.Louis, MO) 20XSSC 175.3g NaCl 88.2g Natriumcitrat 1000ml Aqua bidest pH 4,5 (mit Zitronensäure eingestellt) Hybridisierungspuffer 50% Formamid 5X SSC pH 4,5 50µg/ml Hefe-RNA (Boehringer, Mannheim) 1% SDS 50µg Heparin DEPC-H2O Anhang 73 Lösung I: Lösung III: 50% Formamid 50% Formamid 5XSSC pH 4,5 2XSSC pH 4,5 1% SDS H2O H2O TBST 0,14M NaCl 2,7mM KCl 25mM Tris-HCl pH 7,5 0,1% Tween-20 2mM Levimasole H2O Antikörper Anti-Dig-AP, Fab –Fragmente (Boehringer, Mannheim) Stammlösung NBT (Nitro Blue Tetrazolium) 0,075gNBT(Sigma, St.Louis, MO) in 1ml 70% igen Dimethylformamid Stammlösung BCIP (5-Bromo-4-Chloro-3-Indolyl Phosphat) 0,05g BCIP-Dinatriumsalz(Sigma, St.Louis, MO) in 1ml H2O NTMT Färbelösung 100mM NaCl 2ml NTMT 100mM Tris-HCl pH 9,5 6,75µl 50mm MgCl2 NBT(Stamml.)/70%DMF 0,1 Tween-20 5,25µl BCIP(Stamml.)/H2O 2mM Levimasole Anhang 74 Anhang Embryopulver Hühnerembryonen bzw. Mausembryonen im Stadium HH30 bzw. 10,5 dpc wurden in eiskaltem PBS homogenisiert. Vier Volumenanteile eiskaltes Aceton wurden hinzugegeben und dieser Ansatz wurde 30 Minuten auf Eis inkubiert. Nach einer Zentrifugation bei 10000upm bei 4°C wurde der Überstand verworfen und das Pellet mit Azeton gewaschen und anschließend über Nacht luftgetrocknet. Mit einem Mörser wurde das Pellet zu feinem Embryopulver zermahlen. 75 8 Abbildungen 76 Abbildungen Abb.1 A) Somitennomenklatur. Somiten werden in der Reihenfolge ihrer Bildung mit fortlaufenden arabischen Ziffern beschriftet. Diese Beschriftung schreitet von anterior (a) nach posterior (p) fort. Das Schema zeigt Somiten 18, 19 und 20 eines Hühnerembryos im Stadium HH14. Darüber hinaus werden Somiten entsprechend ihres Entwicklungsalters mit römischen Zifferns beschriftet. Der zuletzt gebildete Somit, also der jüngste Somit, wird als Somit I bezeichnet, der zuvor gebildete Somit ist Somit II. Dieses Beschriftungssystem wurde auf den noch unsegmentierten Bereich übertragen. Der nächste zu bildende Somit ist Somit -I, der übernächste zu bildende Somit ist Somit -II usw.. B) Schematisches Operationsschema der Segmentplattentransplantation. Zunächst wird bei Spender (rechts) und Empfänger (links) der Schwanzknospenbereich (tail bud, tb) entfernt. Anschließend wird sowohl beim Spender, als auch beim Empfänger die Segmentplatte (sp) auf der rechten Seite isoliert (beim Spender bleibt zusätzlich ein Somit an der Segmentplatte angeheftet). Die Segmentplatte des Spenders wird anschließend in den Empfängerembryo eingesetzt. 78 Abbildungen Abb. 2 Übersicht der lunatic fringe Expression Whole-mount in situ Hybridisierung an Hühnerembryonen im Stadium HH4 bis HH20 mit einer lunatic fringe Antisense-Sonde. Alle Embryonen sind von der dorsalen Seite gezeigt. (A) Embryo im Stadium HH4, der lunatic fringe Expression in zwei diffusen, achsensymmetrisch um die Mittellinie angelegten Domänen kaudal des Hensenschen Knotens (Pfeil) zeigt. (B) Dieser Embryo im Stadium HH6 zeigt die Expression in einer kleinen Domäne in der Segmentplatte (kranial des Hensenschen Knotens) und in neugebildeten Mesodermzellen, die sich noch kaudal des Hensenschen Knotens befinden. (C) Embryo im Stadium HH7, die Expression ist im unsegmentierten Mesoderm nachweisbar. (D,E) Die Expression befindet sich in der kranialen Segmentplatte (F). Im Stadium HH20 wird lunatic fringe mRNA in der kranialen SP und in neugebildeten Somiten nachgewiesen. 80 Abbildungen Abb. 3 Schnittpräparate verdeutlichen die Lokalisation der lunatic fringe mRNA (A) Transversaler Gefrierschnitt durch einen Embryo im Stadium HH4. Die Schnittebene befindet sich im kranialen Teil des Primitivstreifens, kaudal des Hensenschen Knotens. Die Expression ist im Epiblasten lokalisiert, wohingegen Mesoderm und Entoderm keine Expression zeigen. Zusätzlich ist eine schwache Expression in gastrulierenden, prospektiv mesodermalen Zellen zu sehen. (ep) Epiblast, (mes) Mesoderm, (en) Entoderm (B) Parasagittaler Schnitt durch den Embryo in Abb. 2B. Die Expression kranial des Hensenschen Knotens ist auf die Mesodermschicht begrenzt, kaudal vom Hensenschen Knoten befindet sich die Expression in jungen Mesodermzellen, die die Invagination durch den kranialen Primitivstreifen abgeschlossen haben oder sie eben durchführen. (hn) Hensenscher Knoten (C) Transversalschnitt durch einen Embryo im Stadium HH14 auf der Höhe der lunatic fringe Expressionsdomäne in der Segmentplatte. Die Expression ist streng auf das paraxiale Mesoderm begrenzt. (sp) Segmentplatte. (D) Parasagittalschnitt durch das paraxiale Mesoderms eines Embryos im Stadium HH14. Lunatic fringe ist vornehmlich auf Somitenhöhe –II exprimiert. Die Grenze zwischen dem zuletzt gebildeteten Somiten (I) und dem unsegmentierten Bereich (-I,-II,-III) ist mit einem schwarzen Pfeil markiert. Abb. 4 Variabilität der lunatic fringe Expression in der Segmentplatte und Einteilung in drei Expressionsklassen Gezeigt sind Whole-mount in situ Hybridisierungen an Hühnerembryonen im Stadium HH14-15. Die schwarzen Pfeile deuten auf den Übergang vom segmentierten in den unsegmentierten Bereich des paraxialen Mesodems hin. (A) Klasse 1: Lunatic fringe ist im Somit –II exprimiert, keine Expression ist im kaudalen Bereich der SP sichtbar. (B) Klasse 2: Zusätzlich zur Expression in Somit -II ist eine schwächere Expressionsdomäne in der kaudalen SP zu sehen. (C) Klasse 3: Zwei Expressionsdomänen, durch einen kleinen, etwa einem Somiten entsprechenden Bereich getrennt, sind in der kranialen SP sichtbar. Zusätzlich ist lunatic fringe in der Schwanzknospe (tb) exprimiert. 82 Abbildungen Abb. 5 Embryonenkulturexperimente mit anschließender Whole-mount in situ Hybridisierung Nach der Halbierung des Hühnerembryos wurde die linke Hälfte sofort fixiert, während die rechte Hälfte für die angegebene Dauer inkubiert wurde. Repräsentative Embryonenkulturexperimente zeigen die Interkonversion der drei Expressionsphasen (AC) und die Vollendung eines kompletten Zyklus (D). (A) Umwandlung der Phase I in Phase II. Während der Inkubationszeit von 40 Minuten entwickelt sich eine Expressionsdomäne (iSPE) in der kaudalen SP der inkubierten Hälfte (Phase II). (B) Die iSPE führt während der Inkubationszeit eine kraniale Progression durch, dabei nimmt die Expressionsdomäne sowohl an Umfang als auch an Intensität zu. Dadurch geht Phase II in Phase III über. Zusätzlich wird während der Inkubation auch die Expression in der Schwanzknospe initiiert. (C) Phase III wandelt sich in Phase I um. (D) Sowohl inkubierte Hälfte als auch Kontrollhälfte befinden sich in Phase III, unterscheiden sich jedoch in der Bildung eines zusätzlichen Somiten auf der inkubierten Hälfte (schwarzer Pfeil weist auf die Grenze zwischen Somit I und Somit -I zum Zeitpunkt der Fixierung hin, weißer Pfeil weist auf die neu gebildete Grenze hin, die während der Inkubation entstanden ist). Die Wiederholung der Expressionsmuster zeigt, daß während der Inkubationszeit von 95 Minuten ein kompletter Zyklus durchlaufen worden ist. Um die einzelnen Phasen genauer zu charakterisieren, wurden kürzere Inkubationszeiten gewählt (E-K). (E) Beide Hälften sind in Phase I. Die Expression in der Schwanzknospe, die auf der Kontrollseite zu sehen ist, wird im Verlauf der Phase I herunterreguliert (F) Beide Hälften sind in Phase II. Während der kurzen Inkubation von 21 Minuten wandert die iSPE nach kranial und nimmt an Intensität zu. (G-K) Gezeigt ist die lunatic fringe Expression im Totalpräparat und in sagittalen Gefrierschnitten durch die linke (H,I) und rechte (J,K) Hälfte des gleichen Embryos. Schwarze (G,I) und weiße Pfeile (G,K) weisen auf korrespondierende Expressionsdomänen im Totalpräparat und in den Gefrierschnitten hin. (G) Beide Hälften sind in Phase III. Während der Kultivierungsperiode schreitet die mehr kaudal gelegene Expression geringfügig nach kranial fort. (H,I) Direkt anterior der kranialen Expressionsdomäne (schwarzer Pfeil) ist auf der nichtinkubierten Hälfte kein Somit zu sehen. (I) Vergrößerung des eingerahmten Bereichs aus (H). (J,K) Ein neuer Somit hat sich während der kurzen Inkubationszeit gebildet und ist anterior der kranialen Expressionsdomäne (weißer Pfeil) zu sehen. (K) Vergrößerung des eingerahmten Bereichs aus (J). 84 Abbildungen Abb. 6 Modell der dynamischen lunatic fringe Expression in der Segmentplatte von Hühnerembryonen Während Phase I ist lunatic fringe in der Segmentplatte nur in Somit -II exprimiert. Diese Expression hält für 45-45 Minuten an. Daraufhin wird in der kaudalen Segmentplatte eine neue, zunächst schwache Expressionsdomäne initiiert (iSPE), während die Expression in Somit -II weiter bestehen bleibt (Phase II). Diese neue Expressionsdomäne breitet sich schnell nach kranial aus und nähert sich damit dem kranialen Ende der Segmentplatte. Während die Expressionsintensität am kranialen Ende zunimmt, nimmt diese am kaudalen Segmentplattenende progressiv ab. Damit geht Phase II in Phase III über. Darüber hinaus wird während dieses Überganges auch die Expression in der Schwanzknospe initiiert. Wenn sich die Expressionsdomäne auf Höhe der Somiten -II und -IV befinden (Phase III vor Somitenbildung), findet die Somitenbildung statt. Die kraniale Expression wird dadurch auf Somitenhöhe -I lokalisiert, die kaudale Expression wandert weiter nach kranial und wird damit bald die neue Expression auf Somitenhöhe -II konstituieren (Phase III nach Somitenbildung). Kurz nachdem eine neue Expression im Somit -II entstanden ist (frühe Phase I), geht die Expression in der Schwanzknospe verloren. Damit ist das charakteristische Expressionsmuster der Phase I erneut erreicht. Somiten II I -I -II I -I -II Segmentplatte Schwanzknospe Phase I Phase II Phase III Phase III vor nach Somitenbildung Somitenbildung 86 Abbildungen Abb. 7 Kontrolle der zyklischen Expression von lunatic fringe (A,B) Embryonenkulturexperiment: nach der Halbierung wurde auf der rechten Seite der kaudale Anteil der SP entfernt, anschließend wurden beide Hälften inkubiert. (A) Inkubation für eine Dauer von 85 Minuten. Beide Hälften zeigen Expression in Somit -II. Dies zeigt, daß der kaudale Teil der SP nicht für die Aktivierung von lunatic fringe am kranialen Segmentplattenende notwendig ist. (B) 150 Minuten Inkubation. Beide Hälften zeigen eine Expression der Phase III. (C-E) Isolierung der Segmentplatten von allen umliegenden Geweben und anschließende Inkubation sowohl der Kontrollseite als auch der SP. (C) Nach 60minütiger Inkubation zeigen Kontrollhälfte und isolierte SP sehr ähnliche Expressionsmuster. (D) Die SP wurde zusammen mit den zwei zuletzt gebildeten Somiten isoliert, während der Inkubation von 130 Mintuen bildete sich ein neuer Somit (weißer Pfeil). Die Expression ist ähnlich in Kontrollhälfte und isolierter SP. (E) Nach einer Kultivierungsperiode von 150 Minuten zeigt die isolierte SP eine kraniale und eine kaudale (schwarzer Pfeil) Expressionsdomäne, die durch eine kleine nichtexprimierende Region getrennt sind. Damit befindet sich die SP und die Kontrollhälfte in Phase III. (F) Segmentplattentransplantation. Der Spenderembryo ist in der Abbildung rechts zu sehen, der Empfängerembryo befindet sich in der linken Bildhälfte. Die rechte SP des Empfängers wurde durch die SP des Spenders ersetzt (siehe Operationsschema Abb. 1B). Der schwarze Pfeil zeigt die Stelle der Insertion. Während der Inkubationszeit von fünf Stunden haben sich mehrere Somiten gebildet. Nach der Inkubation wurde eine Wholemount in situ Hybridisierung durchgeführt. Die endogene und die implantierte SP des Empfängerembryos unterscheiden sich deutlich in der lunatic fringe Expression. Während die endogene SP sich in Phase II befindet, zeigt die implantierte SP eine Expression der Phase III. Damit gleicht die implantierte SP in ihrer Expression der SP des Spenderembryos (Phase III). Als Kriterium für den Vergleich der Expressionen eignet sich vor allem der Abstand der kranialen und der kaudalen Expressionsdomäne. Dieser beträgt in der SP des Empfängerembryos vier Somiten, während er in der implantierten SP und in der SP des Spenderembryos nur die Breite eines Somiten besitzt (charakteristisch für Phase III). Außerdem zeigt die kaudale Expressionsdomäne der implantierten SP eine stärkere Intensität, was ebenfalls der Phase III entspricht. 88 Abbildungen Abb.8 Überexpressionsexperiment A) Western-Blot mit lysierten Hühnerfibroblasten. Die Hühnerfibroblasten waren zuvor mit dem retroviralen Konstrukt MFR-TAG transfiziert worden. Als Antikörper wurde HA11, der gegen die Flu-Epitopmarkierung gerichtet ist, eingesetzt. Zu sehen sind zwei intensive Proteinbanden, denen Lunatic Fringe in nativer Form und Lunatic Fringe nach autokatalytischer Proteolyse entsprechen. B) Infektionsprotokoll. Gezeigt ist ein Embryo im Stadium HH12. Die roten Sterne markieren die Injektionsorte in der posterioren Segmentplatte und im Bereich des verbleibenden Primitivstreifens. Der Injektionsbereich endet auf Höhe des prospektiven Somiten 25. C) Whole-mount in situ Hybridisierung mit einer lunatic fringe Antisense-Sonde der Maus (MFR) zeigt die erfolgreiche Infektion. Nach der Injektion wurde dieser Embryo 18 Stunden inkubiert. Der Pfeil weist auf Somit 25 hin, damit entspricht die kraniale Ausdehnung der Infektion der kranialen Grenze des Injektionsbereiches. D) Nach einer Inkubationszeit von 2 Tagen im Anschluß an die Injektion des Retrovirus wurde eine Whole-mount in situ Hybridisierung mit einer Pax3 Antisense-Sonde durchgeführt. Die Expression in den Somiten zeigt keine Unregelmäßigkeiten. E) Alcianblau-Knorpelfärbung. Nach einer Inkubationszeit von 6 Tagen nach der Injektion des Retrovirus wurde eine Knorpelfärbung durchgeführt. Die Wirbelsäulenanlage und die Rippenanlage sind regelrecht und zeigen keine Effekte der Überexpression. 90 Abbildungen Abb.9 Vergleich der Expression von lunatic fringe mit c-hairy1 Die Embryonenhälften wurden separat mit einer Antisense-Sonde von lunatic fringe (linke Hälfte) und c-hairy1 (rechte Hälfte) hybridisiert. Die schwarzen Pfeile deuten auf den Übergang von Somit I und SP hin. (A-C) Die Expression beider Gene ist in allen Phasen zeitlich synchron und zeigt sehr ähnliche Expressionsdomänen. (A) Phase I (B) Phase II. Die Expression von c-hairy1 reicht im Vergleich zu lunatic fringe weiter nach kranial, bis in den posterioren Bereich von Somit -I. (C) Phase III Abb. 10 Whole-mount in situ Hybridisierung an Mausembryonenhälften Mausembryonenhälften wurden direkt fixiert (linke Hälfte) oder zunächst für die angegebene Dauer inkubiert. (A) Während der Inkubation von 65 Minuten entwickelte die rechte Hälfte im Vergleich zur linken Kontrollhälfte eine zusätzliche, kaudale Expressionsdomäne im präsomitischen Mesoderm. (B) Die linke Embryonenhälfte zeigt am kranialen Ende des PSM zwei lokalisierte Expressionsbanden und zusätzlich eine diffusere, breitere Expression im kaudalen Bereich des PSM. Nach der Kultivierungsperiode von 70 Minuten wird diese kaudale Expressionsdomäne von einer mehr kranial gelegenen, lokalisierteren Expression abgelöst. (C) Nach einer Inkubation von 125 Minuten zeigen beide Hälften sehr ähnliche Expressionsmuster: die mRNA ist in einer Domäne im kranialen PSM nachweisbar. 92 Abbildungen Abb. 11 Modell zur Differenzierung der Zyklusdauer von der Oszillationsdauer Zum Zeitpunkt 0' des Expressionszyklus findet sich in der Segmentplatte eine Phase I Expression. Die markierte Zelle im posterioren Anteil der SP zeigt keine Expression von lunatic fringe. Nach 45 Minuten sieht man in der kaudalen Segmentplatte die iSPE, damit befindet sich der Expressionszyklus in Phase II. Die Einzelzelle exprimiert lunatic fringe. Zum Zeitpunkt 140' ist diese Phase II innerhalb des zweiten Expressionszyklus erreicht, die iSPE ist erneut zu sehen. Damit entspricht die Zeit von 95 Minuten der Zyklusdauer. Die Zyklusdauer entspricht der Zeit, die zur Wiederholung einer Expressionsphase in der SP notwendig ist. Zum Zeitpunkt 140' liegt die markierte Zelle außerhalb der iSPE, da durch die Somitenbildung am kranialen SP-Ende und die neu eingewanderten Zellen am kaudalen SP-Ende sich die relative Position der Zelle verändert hat. Erst zu einem späteren Zeitpunkt (140'+x) exprimiert die Zelle lunatic fringe und nimmt an der Bildung der nach kranial ausgebreiteten Expressionsdomäne teil. Das identische Expressionsmuster (Phase II zum Zeitpunkt 45' und 140') wird daher von unterschiedlichen Zellen konstituiert (siehe markierte Zelle zum Zeitpunkt 45' und 140'). Die Oszillationsdauer entspricht der Zeit, die zur Wiederholung der Expressionsaktivierungen inerhalb einer Zelle notwendig ist. Aufgrund der relativen Positionsveränderung der Einzelzelle entlang der kranio-kaudalen Achse beträgt diese 95'+x, wobei x z.B. von der Ausbreitungsgeschwindigkeit der iSPE abhängig ist. Daher kann von der Zyklusdauer nicht auf die Oszillationsdauer abgeleitet werden. Zyklusdauer 95’ Expressionsphasen in der Segmentplatte I II I II 95’ 140’ II - II - II 0’ 45’ Expression in einer individuellen Zelle Oszillationsdauer 95’+ x 140’+x 93 9 Danksagung Ich bin Frau Prof. Dr. Beate Brand-Saberi zu tiefstem Dank verpflichtet. Über die letzten Jahre hinweg hat sie mir ihre Unterstützung zukommen lassen, und sie gab mir durch ihr Vertrauen in meine Arbeit als wissenschaftliche Hilfskraft die Möglichkeit, die Embryologie als begeisterndes Fach zu entdecken. Darüber hinaus ermöglichte Sie den einjährigen Laboraufenthalt am MD Anderson Cancer Center in Houston, in dessen Rahmen der experimentelle Teil dieser Doktorarbeit fertiggestellt werden konnte. Besonders danke ich Frau Prof. Dr. B. Brand-Saberi auch für die außerordentlich gute Betreuung und die kompetente Hilfe bei der Ausarbeitung dieser Doktorarbeit. Ich danke Prof. Randy L. Johnson am MD Anderson Cancer Center in Houston/U.S.A für die Möglichkeit, in der Zeit von Oktober 1997 bis Oktober 1998 in seinem Labor arbeiten zu dürfen. Während dieser intensiven Laborerfahrung konnten durch seine große Unterstützung mehrere Projekte, darunter der experimentelle Teil meiner Doktorarbeit fertiggestellt werden. Herzlich bedanken möchte ich mich bei Prof. R.L. Johnson auch für die Möglichkeit der Teilnahme am Spring Retreat 1998 des Genes and Development Programms des MD Anderson Cancer Center in Corpus Christi, Texas, sowie am 57. Kongreß der Society for Developmental Biology 1998 in Stanford, Kalifornien. Ich danke Herrn Prof. Dr. Bodo Christ für die Möglichkeit der Anfertigung meiner Doktorarbeit am Lehrstuhl II des Anatomischen Institutes Freiburg. Herr Prof. Dr. B. Christ hat mit seiner Kompetenz und Professionalität mein Interesse an embryologischen Fragestellungen entscheidend gefördert, wofür ich ihm herzlich danken möchte. Ein besonderer Dank gilt Herrn Prof. Dr. Davor Solter am Max-Planck-Institut für Immunbiologie in Freiburg für die großzügige Hilfe bei der Fertigstellung der Doktorarbeit. 94 Danksagung Im Labor von Prof. Johnson danke ich vor allem Haixu Chen und Yi Lun für die geduldige und kompetente Einführung in molekulare Methoden, vor allem jedoch für die freundschaftliche Atmosphäre im Labor. Am MD Anderson Cancer Center in Houston danke ich Dr. Maki Wakamiya für die Hilfe bei den Versuchen an Mausembryonen, Dr. Claire Jaques für das Erlernen molekularbiologischer Techniken und Dmitry Ovchinnikov für die unermüdliche Diskussionbereitschaft. Frau Dr. F. Pröls, Herrn PD Dr. H. Kurz und Herrn PD Dr. J. Wilting am Anatomischen Institut Freiburg danke ich für ihre Hilfe bei der wissenschaftlichen Arbeit. Allen Mitarbeitern des Anatomischen Institutes in Freiburg danke ich für ihre Hilfsbereitschaft. Vor allem danke ich Ellen Gimbel für das Erlernen histologischer und immunzytochemischer Methoden und für Korrekturen am Manuskript, in erster Linie aber für die angenehme Zusammenarbeit und freundliche Arbeitsatmosphäre. Ich danke meinem Vertrauensdozenten Herrn Prof. Dr. Otto Stärk für seine sehr persönliche Unterstützung und Förderung während der letzten Jahre. Der Aufenthalt in Houston wurde unterstützt durch die Studienstiftung des deutschen Volkes, wofür ich mich sehr herzlich bedanken möchte. Meinen Freunden danke ich für die Unterstützung und die schöne gemeinsame Zeit. Ich danke Sebastian Arnold dafür, mich als erster in die Thematik der experimentellen Embryologie eingeführt zu haben. Besonders möchte ich mich bei meinen Eltern und meinen Schwestern für die Aufmunterung, den Zuspruch und den familiären Rückhalt danken. Grazie. 95 10 Lebenslauf Name: Alexander Josef Herbert Aulehla Geburtsdatum: 8. Juni 1973 Geburtsort: Freiburg im Breisgau Eltern: Rolf Aulehla Gabriella Aulehla geb. Hausler Geschwister: Vanessa (1969), Fiorenza (1980) Ausbildung 1980-1984 Grundschule Eisingen 1984-1993 Schiller-Gymnasium Pforzheim Juli 1993 Abitur am Schiller-Gymnasium Pforzheim Aug. 93-Sept. 94 Zivildienst im St. Trudpert Krankenhaus Pforzheim Oktober 1994 Beginn des Studiums der Humanmedizin an der Universität Freiburg September 1996 Physikum März 1997 Aufnahme in die Studienstiftung des deutschen Volkes September 1997 1. Staatsexamen Okt. 97-Okt. 98 Laboraufenthalt am MD Anderson Cancer Center in Houston/Texas/U.S.A Okt.1998 Fortführung des Medizinstudiums an der Universität Freiburg Februar 99 -März 99 Famulatur in der Kardiologie der Universitätsklinik Freiburg März 99- April 99 Famulatur in der Notaufnahme des Hôpital Gaston Bourret, Nouméa, Neukaledonien Wissenschaftliche Ausbildung März 1996 Praktikum am Lehrstuhl II des Anatomischen Institutes Freiburg Juni 96- Juli 97 wissenschaftliche Hilfskraft bei PD Dr. B. Brand-Saberi am Anatomischen Institut, Lehrstuhl II Prof. Dr. B. Christ Okt. 97-Okt. 98 Laboraufenthalt in Houston bei Prof. R.L. Johnson 96 11 Verzeichnis eigener Publikationen 11.1 Originalarbeiten Chen H, Ovchinnikov D, Pressman CL, Aulehla A, Lun Y, Johnson RL (1998) Multiple calvarial defects in lmx1b mutant mice. Dev Genet 22(4):314-320 Evrard YA, Lun Y, Aulehla A, Gan L, Johnson RL (1998) lunatic fringe is an essential mediator of somite segmentation and patterning. Nature 394:377-381 *Aulehla A, Johnson RL (1999) Dynamic expression of lunatic fringe suggests a link between notch signaling and an autonomous cellular oscillator driving somite segmentation. Dev Biol 207(1):49-61 11.2 Gedruckte Abstracts von Kongreßbeiträgen Brand-Saberi B, Aulehla A, Schmidt C, Birchmeier C, Patel K, Christ B (1997) Epitheliomesenchymal transitions in somite development. Somite Development Meeting, Les Embiez, 5.-9. Oktober 1997 Brand-Saberi B, Aulehla A, Schmidt C, Füchtbauer EM, Birchmeier C, Christ B (1998) Cell adhesion in somite development. Verh Anat Ges 93 Füchtbauer EM, Engist T, Christ B, Schmidt C, Aulehla A, Brand-Saberi B (1998) Expression and function of twist during differentiation of somites. Verh Anat Ges 93 *Aulehla A, Johnson RL (1998) Dynamic lunatic fringe expression in the avian segmental plate. Dev Biol 198: 170 (Die mit * gekennzeichnete Arbeit enthält Ergebnisse dieser Dissertation) 97 12 Erklärung Hiermit erkläre ich, daß ich die vorliegende Dissertation selbständig angefertigt und in dieser oder ähnlicher Form noch nicht anderweitig eingereicht habe. Freiburg, den 20. September 1999