Abklärung des Verdachts einer transfusionsbedingten viralen Infektion
Werbung
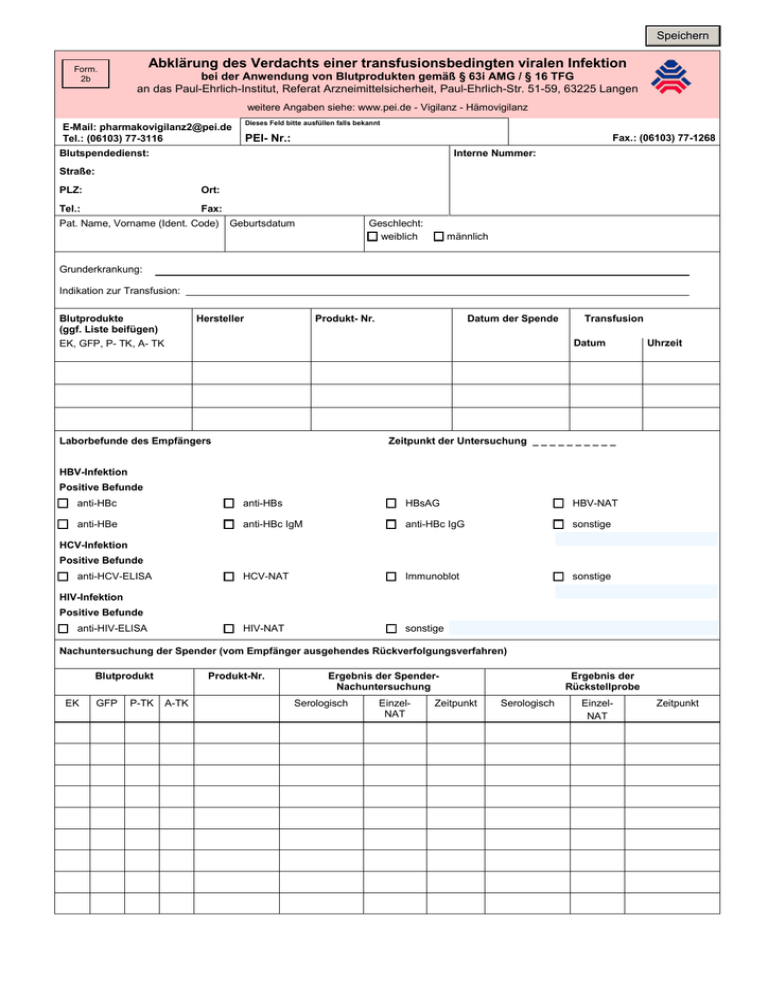
Speichern Form. 2b Abklärung des Verdachts einer transfusionsbedingten viralen Infektion bei der Anwendung von Blutprodukten gemäß § 63i AMG / § 16 TFG an das Paul-Ehrlich-Institut, Referat Arzneimittelsicherheit, Paul-Ehrlich-Str. 51-59, 63225 Langen weitere Angaben siehe: www.pei.de - Vigilanz - Hämovigilanz E-Mail: [email protected] Tel.: (06103) 77-3116 Dieses Feld bitte ausfüllen falls bekannt PEI- Nr.: Fax.: (06103) 77-1268 Blutspendedienst: Interne Nummer: Straße: PLZ: Ort: Tel.: Fax: Pat. Name, Vorname (Ident. Code) Geburtsdatum Geschlecht: weiblich männlich Grunderkrankung: Indikation zur Transfusion: Blutprodukte (ggf. Liste beifügen) EK, GFP, P- TK, A- TK Hersteller Produkt- Nr. Datum der Spende Transfusion Datum Laborbefunde des Empfängers Uhrzeit Zeitpunkt der Untersuchung _ _ _ _ _ _ _ _ _ _ HBV-Infektion Positive Befunde anti-HBc anti-HBs HBsAG HBV-NAT anti-HBe anti-HBc IgM anti-HBc IgG sonstige HCV-NAT Immunoblot sonstige HIV-NAT sonstige HCV-Infektion Positive Befunde anti-HCV-ELISA HIV-Infektion Positive Befunde anti-HIV-ELISA Nachuntersuchung der Spender (vom Empfänger ausgehendes Rückverfolgungsverfahren) Blutprodukt EK GFP P-TK Produkt-Nr. A-TK Ergebnis der SpenderNachuntersuchung Serologisch EinzelNAT Zeitpunkt Ergebnis der Rückstellprobe Serologisch EinzelNAT Zeitpunkt Form. 2b Abklärung des Verdacht einer transfusionsbedingten viralen Infektion bei der Anwendung von Blutprodukten gemäß § 63i AMG / § 16 TFG vom Empfänger ausgehendes Rückverfolgungsverfahren (Fortsetzung) Patient erhielt auch Produkte anderer Hersteller, die mit der aufgetretenen unerwünschte Wirkung assoziiert werden können □ □ ja □ nein Wenn ja, welche: Zeitpunkt der Verabreichung: □ Bezeichnung des Arzneimittels: nicht bekannt □ Plasmaprodukte zelluläre Blutprodukte Präparatnamen: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ □ nicht bekannt Pharmazeutischer Unternehmer: Serologische Befunde des Empfängers, vor der Verabreichung der involvierten Arzneimittel □ □ ja □ nein nicht bekannt Wenn ja, welche: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ Datum: Befunde liegen schriftlich vor: □ ja □ nein Vom Empfänger sind noch Blutproben aus der Zeit vor Verabreichung der involvierten Arzneimittel vorhanden □ □ ja □ nein nicht bekannt Wenn ja, aus welcher Zeit Aus der Blutprobe wurden serologische Nachuntersuchungen durchgeführt □ □ ja □ nein nicht bekannt Ergebnisse _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ Bei sorgfältiger Überprüfung der Anamnese vor Transfusion wurden Hinweise gefunden, die bei der Bewertung der gemeldeten unerwünschten Arzneimittelwirkung von Bedeutung sein könnten □ □ ja □ nein nicht bekannt Wenn ja, welche: Ergebnisse liegen schriftlich vor: □ ja □ nein Phylogenetische Sequenzhomologie (Empfänger / Spender) □ □ ja □ nein nicht durchgeführt Beurteilung des Kausalzusammenhanges (AK Blut Votum 34 Anhang D1) □ gesichert □ □ nicht zu beurteilen □ Initialbericht wahrscheinlich □ □ möglich Folgebericht □ unwahrscheinlich □ PEI- Nr.: Name des Transfusionsverantwortlichen/ Stufenplanbeauftragten Klinik/ Praxis: PLZ: E-Mail: Datum: Version 01.2013 Tel.-Nr: Ort: Fax.-Nr: ausgeschlossen