Endokrinpharmakol. 1 - Institut für Pharmakologie und Toxikologie
Werbung

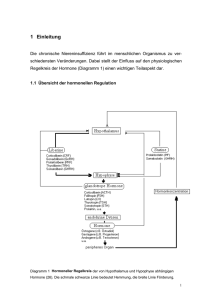
Endokrinpharmakologie 1: Steroidhormone Prof. Dr. Ralf Stumm Institut für Pharmakologie und Toxikologie Drackendorfer Straße 1 07747 Jena 03641 – 93 25651 [email protected] 1. Hormone Klassische Definition: Hormone sind Botenstoffe, die von spezialisierten Organen (Drüsen) synthetisiert werden. Sie werden in das Blut abgegeben und erreichen dadurch ihr Zielorgan. Hormonähnliche Mediatoren (z.B. Prostaglandine, Wachstumsfaktoren) wirken nur lokal, wo sie produziert werden. Hormonrezeptor Hormon-produzierende Zelle Zielzelle Blut endokrin parakrin autokrine 1.1 Hormonproduzierende Organe Die wichtigsten hormonproduzierenden Organe: Hirn(Hypothalamus) Hypophyse Nebennierenrinde Nebennierenmark Gonaden Schilddrüse Nebenschilddrüse Pankreasinseln Gastrointestinaltrakt Herz Wichtige Hormonklassen: Glykoproteine Steroide Peptide Aminosäurederivate 1.2 Regulating der Hormon-Sekretion durch Feedback-Mechanismen in Hypothalamus und Hypophyse Hypothalamische Hormone Hypothalamus Corticotrophin-releasing Hormone (CRH, diagnostische Relevanz) Synthese und Freisetzung des Releasing-Hormons (z.B. CRH) Synthese und Freisetzung des Tropins (z.B. ACTH) Thyrotrophin-releasing Hormone (TRH, diagnostische Relevanz) vordere Hypoph. Zielorgan periphere Hormone vermitteln negatives Feedback spezialisierte Zellen: - Korticotrophe - Laktotrophe - Somatotrophe - Thyrotrophe - Gonadotrophe Synthese and Freisetzung peripherer Effektorhormone (z.B. Glucocorticoide) Growth Hormone-releasing Hormone (GHRH, diagnostische Relevanz) Growth Hormone-release-inhibiting Hormone (Somatostatin, das Derivat Octreotid hat therapeutische Relevanz) Gonadotrophin-releasing Hormone (GnRH, diagnostisch und therapeutisch) Prolactin-release-inhibiting Faktor (Dopamin, therapeutische Relevanz) Prolactin-releasing Hormone (PRH) Melanocyte-stimulating Hormone (MSH)releasing Hormone MSH release-inhibiting Hormone 2. CRH, ACTH und die Nebennierenrindenhormone CRH Hypoth. Hypoph. CRH and ACTH sind Peptidhormone. ACTH und andere Hormone werden aus Pro-Opiomelanokortin (POMC) herausgeschnitten. CRH ADH Korticotrophe: Adrenocorticotrophes Hormon (ACTH, = Korticotrophin) ACTH Biochemie von CRH und ACTH Steroide Steroide Prä-POMC: Signalpeptid γ-MSH β-Endorphin α-MSH β-MSH ACTH β-lipotropin NNRinde Stimulation eines GPCR, cAMP-Anstieg, erhöhte Produktion der Steroidhormone Vertikale Linien zeigen Schnittstellen für Endoproteasen an (die Erkennungssequenz trägt 2 basische Aminosäuren) ACTH-Sekretion ist früh morgens maximal und minimal am Abend (circadianer Rhythmus). Stress stört den ACTH-Rhythmus ebenso wie schwere Infektionen, Trauma, Geburt und Wehen, Kälte sowie psychologischer Stress (-> ACTH steigt an). 2.1 Hormone der Nebennierenrinde (Corticosteroide) Querschnitt der Nebenniere (NN) Querschnitt Mikroskopisch Z. glomerulosa: Mineralcorticoide (Aldosteron) Z. fasciculata: Glucocorticoide (Hydrocortison/ Cortisol) Z. reticularis: Androgene (Testosteron) Pregnenolon Cholesterol Sexsteroide ACTH (Geschwindigkeitsbestimmender Schritt) Mineralcorticoide Glucocorticoide 2.2 Corticosteroid-Rezeptoren Struktur der Mineralcorticoid (MC)- und Glucocorticoid (GC)-Rezeptoren MC-Rezeptoren und GC-Rezeptoren werden von unterschiedlichen Genen kodiert und zeigen hohe Strukturhomologie (94% Identität auf Proteinebene). AF1 (activator function 1)-Domäne: Liganden-abhängige Modulation von Transkriptionsfaktoren Core domain: DNA-Bindung über Zinkfinger (2 Schleifen mit 4 Cysteinen, welche Zinkionen binden und eine fingerartige Struktur bilden, die an hormone response elements von corticosteroid-sensiblen Genen binden). Hinge region: macht den Rezeptor flexibel und ermöglicht Dimerisierung. AF2-Domäne: Liganden-abhängige Modulation von Transkriptionsfaktoren. 2.3 Molekularer Wirkungsmechanismus der Corticosteroid-Rezeptoren 1. Die Rezeptoren liegen zytosolisch inaktiv im Komplex mit heatshock-Proteinen vor. 2. Nach Ligandenbindung (AF2-Domäne) löst sich der Komplex auf und der Rezeptor gelangt in den Kern. 3a. Wirkung in Abhängigkeit von DNA-Bindung: die Rezeptoren bilden Homodimere und binden an die hormone (z.B. glucocorticoid) response elements spezifischer Gene. Über ihre AF-Domänen und Koaktivatorproteine stellen sie Kontakt zur Transkriptionsmaschinerie her. Die Transkription der Zielgens wird dadurch zumeist aktiviert (Transaktivierung). 3b. Wirkung unabhängig von DNA-Bindung: die Rezeptoren binden als Monomere an andere Transkriptionsfaktoren (z.B. NFκB beim GC-Rezeptor) und hemmen deren Effekt auf Zielgene. Dadurch wird insbesondere die Expression von Entzündungsgenen unterdrückt (Transrepression). 2.4 Wirkung von Cortisol an GC- und MC-Rezeptoren Cortisol Kd = 10nM Aldosteron Kd = 1nM Progesteron Kd = 1nM Kd = 60nM GC-Rezeptor (alle Gewebe) MC-Rezeptor (Niere, Colon, Schweißund Speicheldrüsen) Glucocorticoideffekte durch erhöhte oder reduzierte Genexpression Erhöhte Expression von Na+-Kanälen Na+-Retention (z.B. in den distalen Tubuli der Niere) In Aldosteron-responsiven Geweben wird die Mineralcorticoid- Aktivitiät von Cortisol durch das Enzym 11β-Hydroxysteroid-Dehydrogenase unterdrückt: Das Enzym überführt Cortisol (aktiv) in Cortison (inaktiv). (umgangssprachlich wird das aktive Cortisonacetat fälschlich als Cortison bezeichnet) 2.5 Effekte der endogenen Glucocorticoide Metabolische Effekte - Erhöhte Gluconeogenese aus Aminosäuren, - Reduzierte Insulinsensitivität (-> Diabetes mellitus) - Weniger Proteinsynthese, mehr Proteinabbau (-> Ausdünnung der Haut; Muskelschwund, schlechte Wundheilung, Osteoporose) - Lipolytischer Effekt der Katecholamine wird gesteigert (Fett wird von den Extremitäten auf den Nacken und den Torso umverteilt; Fettleibigkeit) Immunsuppression Natrium- und Wasserretention, Exkretion von K+ (mineralcorticoider Effekt) (erhöhter Blutdruck) ZNS-Effekte - Abruf von Gedächtnisinhalten gestört - mentale Effekte Endokrine Effekte - Inhibition der CRH- und ACTH-Produktion und -Freisetzung Exogene Glucocorticoide unterdrücken die Produktion der endogenen Hormone. Am Ende einer Glucocorticoidtherapie müssen die Glucocorticoide ausgeschlichen werden! 2.6 Struktur-Aktivitäts-Beziehung synthetischer Glucocorticoide Doppelbindung an C1/C2 verstärkt selektiv die Glucocorticoidaktivität R1: Methylierung steigert selektiv die Glucocorticoidaktivität (in Methylprednisolon) 2 1 R2: Halogenreste verstärken die Glucocorticoidaktivität und die Mineralcorticoidaktivität Cortisol Prednisolon R3: Methyl- oder Hydroxylgruppen eliminieren die Mineralcorticoidaktivität R1 R2 R3 Wirkstoff H 6α-methyl H H H H H 9α-fluor 9α-fluor 9α-fluor H H 16α-hydroxy 16β-methyl 16α-methyl Prednisolon Methylprednisolon Triamcinolon Betamethason Dexamethason 2.7 Synthetische Glucocorticoide Synthetische Glucocorticoide werden häufig zur Entzündungshemmung eingesetzt. Der optimalen Substanz fehlen 1. Metabolische Effekte 2. Mineralcorticoide Effekte 1: Glucocorticoide ohne metabolische Wirkung konnten nicht entwicklet werden. 2: Starke, hochselektive synthetische Glucocorticoide sind verfügbar. Corticosteroid relative glucocorticoid Stärke Cortisol 9α-Fluorcortisol Prednisolon Methylprednisolon Dexamethason 1 10 4 5 30 Pharmakokinetische Aspekte: Glucocorticoid Cortisol Prednisolon Dexamethason Budesonid Bioverfügbarkeit 96% 85% 80% 11% relative mineralcorticoid Stärke 1 125 0,8 0,5 0 anti-inflammatorische Dosis 20 nicht anti-inflammatorisch 5 4 0,75 (mg/Tag) Budesonid ist optimal für nicht-systemischen Einsatz (z.B. dermal or inhalativ). Prednisolon oder Dexamethason sind für den systemischen Einsatz oral verfügbar. 2.8 Anwendungsgebiete der Glucocorticoide Systemisch/ orale Anwenung (z.B. Prednisolon, Dexamethason): Rheumatische Erkrankungen, Kollagenosen (z.B. Lupus erythematodes) Allergische Erkrankungen (z.B. anaph. Schock) Lungenerkrankungen (Asthma) Tumore (akute lymphatische Leukämie, ausgeprägte Metastasierung) Gastrointestinale Erkrankungen Multiple Sklerose Hauterkrankungen speziell Dexamethason: drohende Frühgeburt, Hirnödem, zytostatikainduziertes Erbrechen Lokale Anwendung: Hauterkrankungen: spezielle Zubereitungen – oftmals Esterderivate (Lipophilie) Atemwegserkrankungen (Asthma): Budesonid, Beclametason-diproprionat, Ciclesonid (wird in der Lunge durch Esterasen aktiviert) Augenerkrankungen Gelenkerkrankungen: spezielle Kristallsuspensionen Darmerkrankungen: Budesonid 2.9 Nebenwirkungen der Glucocorticoidtherapie intrakranialer Druck gesteigert (gutartig) Büffelnacken Bluthochdruck dünne Haut dünne Extremitäten/ Muskelschwund Weitere Symptome: -Thromboserisiko -Osteoporose -Hyperglykäme -Appetitzunahme -Infektanfäligkeit/ Pilzanfälligkeit -Übergewicht -Verhaltensänderungen -Magen-Darmulzera -NN-Rindeninsuffizienz Katarakt (grauer Star) Mondgesicht Zuwachs von Abdominalfett avaskuläre Nekrose des Femurkopfes Hochdosierter systemischer Einsatz synthetischer Glucocorticoide verursacht das iatrogene Cushing´s Syndrom Glucocorticoid-Entzugssyndrom: Fieber, Muskel- und Gelenkschmerz; allgemeines Krankheitsgefühl Bei inhalativer Anwenung: Heiserkeit und Pilzinfektionen im Mund/Rachenraum Verletzbarkeit schlechte Wundheilung Bei lokaler Anwendung an der Haut: Pilz- und bakterielle Infektionen, Akne, Atrophie der Haut 3. GnRH, FSH, LH und die Sexualhormone Hypothalamus GnRH pulsatile Freisetzung Hypophyse Gonadotrophe Zelle: FSH,LH Sexualhormone Gonaden (Testosteron, Estrogene, Progesteron) 3.1 Männlicher Organismus Testosteron Synthetisiert in Leydig-Zellen, NN-Rinde, Ovarien GnRH Wird in Dihydrotestosteron überführt (= potenterer Metabolit, aktive Form in den meisten Organen) FSH LH Effekt von Testosteron-Applikation/ endogenem T. Vor der Pubertät: verfrühter Schluss der Epiphysenfuge Leydigzellen Sertolizellen (unterstützen Spermatozoen) In der Pubertät: sekundäre Sexualmerkmale, Reifung der Reproduktionsorgane, Muskelwachstum, Körperwachstum, Aktivität der Talgdrüsen (Akne) Nach der Pubertät: Spermatogenese Testosteron In der Frau: Virilisierung Einsatz von T. und Androgenen macht negatives Feedback zu GnRH und FSH/LH, reduziert Synthese der Sexsteroide, und verursacht Infertilität in beiden Geschlechtern. Effekte sind u.U. nicht voll reversibel. 3.2.1 Testosteron: Pharmakokinetik Metabolismus in der Leber 3.2.2 Anwendung von Testosteron und seinen Derivaten Ersatztherapie mit Testosteron - bei primärem (testikulär bedingtem) und sekundärem (durch Hypothalamus/ Hypophyse bedingtem) männlichem Hypogonadismus (bis zu 120 mg/ Tag) - Bei Hyposexualität der Frau nach Ovariektomie (0.3 mg/ Tag) Wegen geringer Bioaverfügbarkeit wird Testosteron oft als Pflaster oder intramuskuläres Depot verabreicht. Testosteronester: 1. Testosteronheptanoat: Langwirksames intramuskuläres Präparat (2 Wochen) 2. Testosteronundecanoat: 1. 2. Oral bioverfügbar. Die hoch lipophile Substanz geht von der Darmschleimhaut in Lymphkapillaren über, von wo sie über den Ductus thoracicus die Vena subclavia erreicht (Umgehung der Leber). 3.3 Der 5α-Reduktase-Inhibitor Finasterid Finasterid inhibiert die Produktion von Dihydrotestosteron Finasterid wird bei benigner Prostatahyperplasie gegeben. Einsatz besonders bei starker Hyperplasie; in moderaten Fällen wird der, α1a-Antagonist Tamsulosin bevorzugt. Nebenwirkungen auf Muskel, Knochen, Hypothalamus/ Hypophysen/Gonaden-Achse, Virilität und Libido sind gering. Finasterid Finasterid auch zur Behandlung von Haarausfall cave: systemische Manipulation des Hormonsystems für kosmetische Zwecke! 3.4 Der CYP17A1-Inhibitor Abirateron 17α-Hydroxy-Pregnenolon und 17α-Hydroxy-Progesteron sind Testosteronvorläufer. Die 17α-Hydroxy-Gruppe wird durch CYP17A1 angehängt. Der CYP17A1-Hemmstoff Abirateron hemmt die Androgensynthese in Hoden und Nebenniere. Abirateron wird zur Behandlung von kastrationsresistentem Prostatakrebs eingesetzt. Hintergrund: manchmal genügen geringe Androgenmengen aus dem Tumor oder der Nebenniere, um das Krebswachstum auch nach der Entfernung der Hoden bzw. nach Behandlung mit GnRH-Superagonisten zu stimulieren. 3.5 Antiandrogene: Cyproteron Cyproteronacetat - Androgenrezeptorantagonist (rot im Bild) - gestagene Aktivität (blau im Bild) Wirkungsmechanismus Einsatz: -ausgeprägte Androgenisierung bei der Frau -schwere Formen der Akne -schwerer Hirsutismus -beim Mann Triebdämpfung bei Hypersexualität -palliative Therapie des hormonsensitiven Prostatacarcinoms -im Gefolge einer Behandlung mit GnRHSuperagonisten -in Kombination mit Estrogen zur Hormonersatztherapie bei Frauen nach der Menopause NW: - Ovulationshemmung und Ammenorhö - Hemmung der Spermatogenese, verminderte Libido, erektile Dysfunktion, - Antriebslosigkeit, Gewichtszunahme - hepatotoxische Effekte 3.6 Weiblicher Organismus Hypothalamus Hormonschwankungen während des Menstruationszyklus Adenohypophyse Ovar Wirkung auf Reproduktionstrakt und andere Organe Mittelwerte +/- Standardabw. (n = 40); schattierte Bereiche zeigen die beobachtete Schwankungsbreite 3.7 Produktion der Estrogene Estrogene werden in Ovar und Plazenta gebildet (auch NN-Rinde, Hoden) Wesentliche Schritte der Estrogenbiosynthese: Cholesterol -> Pregnenolon -> Progesteron ->…-> Testosteron Estradiol Androgene (Testosteron) sind obligate Estrogenvorläufer, Konversion erfolgt durch Aromatase (CYP19). Estron Regulation der Hormonproduktion im Ovar: LH Thekazellen FSH Estriol Granulosazellen LH-Rez FSH-Rez GS GS cAMP cAMP Cholesterol -> Androgene Androgene Estron/Estradiol LH erhöht Androgenproduktion FSH erhöht Aromateseaktivität 3.8 Endogene Estrogene, Pharmakokinetik Estradiol Sekretionsrate: Frauen der Östrogene Schwangere Postmenopause Männer Estradiol: aktivstes endogenes Östrogen 25 - 100 µg/d 30 mg/d ! 5 - 10 µg/d 2 - 25 µg/d Estron: 1/3 der Aktivität von Östradiol Estron Estriol: 1/10 der Aktivität von Östradiol Östriol entwickelt nur in der Schwangerschaft pharmakologische Effekte (große Mengen fallen an) Transport der Estrogene im Blut: 69% gebunden an sexhormon binding protein, 30% an Albumin, 1% frei Estriol Estrogene werden in der Leber schnell matabolisiert: Produktion von Estriol, Glucuronidierung oder Sulfatierung -> geringe oral Bioverfügbarkeit 3.9 Synthetische Estrogene Mestranol 17 Mestranol und Ethinylestradiol: Substitution mit Ethinyl-Gruppe an der 17α Position erhöht metabolische Stabilität in der Leber (-> gute orale Bioverfügbarkeit). Mestranol wird in Ethinylestradiol umgewandelt. 3 Ethinylestradiol Mestranol und Ethinylestradiol: die Estrogene in oralen Kontrazeptiva. 17 Estradiolvalerat: Verfügbar als Tablette und zur i.m. Injektion als Langzeitdepot (alle 4 Wochen): Für Hormonersatztherapie nach der Menopause. Außerdem: Konjugierte Estrogene (heute seltener) es sind oft sulfatierte Estrogene (aus dem Harn trächtiger Stuten). Hohe orale Dosen, für Hormonersatztherapie nach der Menopause. Estradiolvalerat 3.10 Estrogenrezeptoren (ER) Die Estrogenrezeptoren gehören zur gleichen Familie wie die Corticosteroidrezeptoren. ER (Erα, ERβ) sind nukleäre Rezeptoren. Starke Expression in weibl. Geschlechtsorganen, Brustdrüse, Knochen, Erα: glatte Muskulatur der Blutgefäße, Hypothalamus Vermittelt die Östrogeneffekte in den Geschlechtsorganen, Brust, Knochen, im kardiovaskulären System, Hypothalamus/Hypophysen-Achse Erβ: Es fehlt die AF1-Domäne. Scheint an der Regulation der Ovulation beteiligt zu sein 3.11 Estrogenrezeptoren: Koaktivatorproteine Genomeffekte der Estrogene: 1. 2. 3. 4. 5. Estrogen/ER-Komplexe binden an estrogen-response-elements (EREs) Konformationsänderung der AF-2 Domäne Rekrutierung von Koaktivatorproteinen (e.g. SRC-1) an die AF-2-Domäne Rekrutierung von Histoneacetylasen (HATs) and TRAP220 TRAP220 kontaktiert den generellen Transkriptionsapparat (GTA) welcher die RNA-Polymerase II (RNPII) rekrutiert. Alternative Mechanismen: Antagonist/ER-Komplexe rekrutieren Korepressorproteine und Histondeacetylasen. Deacetylierung induziert geschlossene DNA-Konformation und schaltet Transkription ab. Korepressor ERDimer SRC-1 HAT Estrogen GTA ERE HDAC Transkription keine Transkription Antagonist RNPII DNA ERE DNA 3.12 Effekte der Estrogene (1) Sexualspezifische Effekte Induktion der Progesteronrezeptoren (kein Gestageneffekt ohne vorherigen Östrogeneffekt) Anabole Effekte in den Geschlechtsorganen Präparation des Uterus für Nidation des befruchteten Eis Aufrechterhaltung der Schwangerschaft Sexualunspezifische Effekte Proteinanabole Effekte Inhibition der Osteoklasten Longitudinales Wachstum von Knochen und Verschlus der Epiphysenfugen Induktion von Koagulationsfaktoren in der Leber Verstärkte fibrinolytische Aktivität Dilatation kleiner Blutgefäße Wasserretention Reduziertes LDL, erhöhtes HDL Hemmung der Talgdrüsen Psychische Effekte 3.13 Einsatz der Estrogene (1) 1. Hormonersatztherapie in der Postmenopause mit Estradiol und Estradiolvalerat (oral oder transdermal). Estrogene müssen mit Gestagenen kombiniert werden (sonst 5-15x erhöhtes Risiko für Endometriumcarcinom). Selten: Konjugierte equine Estrogene. Ziel: - Osteoporose vorbeugen/ aufhalten - Kardiovaskulären Erkrankungen vorbeugen (?!) - Wechseljahresbeschwerden verbessern World Health Initiative-Study (2002 abgebrochen!) zeigte: - weniger Knochenfrakturen, - weniger Wechseljahresbeschwerden - weniger kolorektale Carcinome Aber: - 41% erhöhtes Risiko für Schlaganfall - 29% erhöhtes Risiko für koronare Herzkrankheit - 100% Erhöhung der Lungenembolien - 26% Erhöhung der Mammacarcinome Keine Langzeit-Estrogentherapie in der Postmenopause! 3.13 Einsatz der Estrogene (2) 2. Vorübergehende Therapie von Wechseljahresbeschwerden: oral oder transdermal, meist Estradiol und Estradiolvalerat (am besten in Kombination mit Gestagenen). 3. Behandlung von vaginalen Östrogenmangelsymptomen nach der Menopause (Trockenheit, Juckreiz, Kohabitationsbeschwerden) durch lokale Estrogengabe (als Crème oder Zäpfchen). 4. Orale Kontrazeptiva (Mestranol, Ethinylestradiol) siehe gesondertes Kapitel. 5. Behandlung von Großwuchs (wenn dies von Kind und Eltern gewünscht wird; z.B. bei Mädchen > 1,85 m). 3.14 Tibolon Tibolon ist ein 19-Nortestosteron-Derivat. Die Substanz entfaltet estrogene, gestagene und androgene Wirkungen. Einsatz zur Osteoporoseprophylaxe und zur Behandlung von Wechseljahresbeschwerden. Wg. erhöhtem Brustkrebsrisiko und erhöhtem Endometriumkarzinomrisiko erfolgt der Einsatz nur nach sorgfältiger Abwägung. 3.15 Selektive Östrogenrezeptor Modulatoren (SERM) SERM haben je nach Gewebe agonistische oder antagonistische Effekte. Wirkungsmechanismus: SERM binden an ER und induzieren Konformationsänderung des Rezeptors SERM/ER-Komplexe binden Koaktivator- oder Korepressorproteine. Da das Vorkommen von Koaktivatoren und Korepressoren vom Gewebetyp abhängt, können SERMs je nach Gewebe agonistische oder antagonistische Effekte ausüben. Effekt Vasomotorische Effekte Enodmetriumcarcinom Antiresorptiver Effekt am Knochen Brustkrebsrisiko Kardiovaskuläres Risiko Östradiol Tamoxifen Raloxifen +++ ++ +++ ++ +++ + + + -++ + kein Einfluss ++ -++ (+: Steigerung; -: Senkung) Tamoxifen wird zur Behandlung des estrogensensitiven Mammacarcinoms eingesetzt. Es erhöht aber die Proliferation am Endometrium (-> Carcinomrisiko). Raloxifen wird zur Osteoporoseprophylaxe in der Postmenopause eingesetzt. Es erhöht jedoch das Thromboserisiko. 3.16 Selektive Estrogenrezeptor Modulatoren: Clomifen Clomifen zeigt antiestrogene Effekte. Es dominiert die antiöstrogene Wirkung im Hypothalamus/Hypophysen-System: die negative Rückkopplung von Estrogen auf die GnRH-produzierenden Zellen im Hypothalamus wird unterdrückt. Dadurch steigt die GnRH- und Gonadotropin (FSH und LH) -Ausschüttung an. Es kommt zur Auslösung des Eisprungs. Clomifen wird bei unerfülltem Kinderwunsch eingesetzt (auch im Vorfeld künstlicher Befruchtung) – das Risiko einer Mehrlingsschwangerschaft steigt. NW: sehr häufig: vergrößerte Ovarien Wechseljahresbeschwerden Unterbauch- und Regelbeschwerden Kopfschmerzen, Sehstörungen, Übelkeit, Erbrechen 3.17 Aromataseinhibitoren Beispiele: Exemestan, Anastrozol, Letrozol Testosteron Wirkungsmechanismus: Estradiol Aromatase Aromataseinhibitor Vor Menopause: FSH stimuliert Aromataseexpression im Follikel. Aromataseinhibitoren sind nicht effektiv, weil ihr Effekt durch FSH/ Aromatse-Anstieg kompensiert wird. Postmenopause: Estrogene werden vor allem im Fettgewebe produziert. Aromatseinhibitoren sind effektiv. Einsatz der Aromataseinhibitoren: Behandlung fortgeschrittener estrogensensitiver Mammacarcinome nach der Menopause. Im fortpflanzungsfähigen Alter werden Aromataseinhibitoren nur nach Ovariektomie eingesetzt. Aromataseinhibitoren erhöhen das Risiko von Knochenfrakturen und Hitzewallugen. 3.18 Gestagene Progesteron: - Wird von Corpus luteum und Plazenta gebildet. - Induziert Sekretionsphase im Endometrium (wenn estrogeninduzierte Proliferation vorangegangen ist). Bereitet Nidation vor. - plötzlicher Abfall induziert Menstruation; Aufrechterhaltung hoher Progesteronspiegel unterhält Schwangerschaft. - Macht Zervixschleim unpassierbar für Spermien - negativer Feedback underdrückt Gonadotropinfreisetzung Einsatz der Gestagene in oralen Kontrazeptiva Gestagene vermitteln ihre Effekte über den Gestagenrezeptor (GR), der dem ER nahe verwandt ist. Das GR-Gen wird von Estrogenen stimulatiert. Wegen geringer oraler Bioverfügbarkeit des Progesterons (Leberstoffwechsel) wurden synthetische Gestagene entwickelt. 3.19 Synthetische Gestagene Effekte unterscheiden sich von denen des Progesterons und hängen vom Vorläufermolekül, das zur Synthese verwendet, wurde ab. Vorläufermoleküle sind u.A. Androgene (Ethinyltestosteron = Ethisteron), Norgestrel, Progesteron, Spironolacton (ein Mineralkortikoid Rezeptor Antagonist). Androgenderivate: - Norethisterone Norgestrelderivate: - Levonorgestrel - Norgestimat - Gestoden - Desogestrel 1. Generation 2. Generation 3. Generation Derivate des Progesterons und 17α-Hydroxyprogesterons: - Chlormadinonacetat - Cyproteronacetat Spironolactonderivat: - Drospirenone 3.20 Effekte unterschiedlicher Gestagene Zusätzlich zu den typischen Gestageneffekten können synthetische Gestagene estrogene oder anti-estrogene androgene oder anti-androgene glucocorticoide und anti-mineralcorticoide Effekte auftreten. Estrogeneffekt Androgeneffekt Glucocorticoideffekt Anti-Mineralkortikoideffekt (+) + Progesteron: anti (anti) Norethisteron: Norgestrel: Desogestrel (pro) anti anti pro pro pro - - Chlormadinon anti anti + - Drospirenon anti anti - + Drospirenon imitiert das pharmakologische Profil von Progesteron 3.21 Einsatz der Gestagene -zusammen mit Estrogenen bei Hormonersatztherapie nach der Menopause (als Tablette) -Endometriosebehandlung, Regelbeschwerden, Brutbeschwerden (als Tablette) -Unterstützung der Lutealphase bei assistierter Reproduktion (als Vaginalgel) -in Kontrazeptiva die Wahl des Gestagens beeinflusst Begleiteffekte der Pille: Androgene Wirkung in 1. Generation kann sich positiv auf Blutungen auswirken Antiandrogene Wirkung wird für Besserung von Akne verantwortlich gemacht Antimeneralkortikoide Wirkung reduziert Wassereinlagerung und bewirkt geringfügigen Gewichtsverlust. -> „Kosmetische Wirkung“ wird von der Werbung ausgenutzt! Gestagene der 3. Generation stehen im Verdacht, das Thromboserisiko stärker zu erhöhen als solche der 2. Generation. Gleiches gilt für Drospirenon, Chlormadinon und Cyproteron. Bis hier 90 min 3.22 Orale Kontrazeptiva 1. Kombinationspräparate aus Estrogen und Gestagen 2. Minipille (gestagen-only-pill) Estrogen: Gestagen: zumeist Ethinylestradiol; zahlreiche Wirkstoffe 3.23 Kombinierte Pille Wirkung beruht auf Hemmung der Gonadotropinsekretion Keine Follikelreifung und keine Ovulation. Estrogenkomponente stabilisiert das Endometrium (verhindert Blutungen) und induziert Progesteronrezeptoren. Pillengeneration: Ethinylestradiolgehalt 1 50 µg 2 30 µg 3 20 – 30 µg Es wird empfohlen, Pillen mit einem Estrogengehalt < 50 µg zu verwenden. Einnahme: über 21 oder 22 Tage mit 7 oder 6 Tage Pause, in denen es zur Abbruchblutung kommt. Kontinuierliche Einnahme ohne Pause ist möglich. Therapeutische Anwendungen: verlängerte Monatsblutungen, Regelbeschwerden, Endometriose, Ovarialzysten, Hyperandrogenämie 3.23 Nebenwirkungen der kombinierten Pille Übelkeit, Brustbeschwerden, Gewichtszunahme, Depression, Libidoverlust Myokardinfarkt Datenlage nicht eindeutig. Rauchen + Pille ist besonderer Risikofaktor. Schlaganfall Präparate mit geringem Estrogengehalt scheinen sicherer zu sein Bluthochdruck, Rauchen und Migräne sind Risikofaktoren. Migräne mit Aura ist eine absolute Kontraindikation. Krebsrisiko Ovarialkarzinomrisiko wird gesenkt Zervixkarzinomrisiko steigt bei HPV-positiven Frauen Brustkrebsrisiko wird vermutlich nicht beeinflusst Rauchen, Bluthochdruck, Bewegungsmangel, Übergewicht und Alter sind zusätzliche Risikofaktoren für die kardiovaskulären Risiken der Pille. 3.24 Minipille und weitere Kontrazeptiva Minipille (0,03 mg Levonorgestrel) Macht den Zervixschleim undurchlässig für Spermien Ovulation nur bei 30% der Frauen gehemmt Vorteil: Pille mit geringster Hormondosis Nachteil: kontrazeptive Sicherheit nicht ausreichend häufige Zwischenblutungen Minipille nur empfohlen, wenn Estrogene nicht gegeben werden können. Weitere Kontrazeptiva: - Gestagenimplantat: subdermaless Implantat mit Etonogestrel (ähnelt Desogestrel) - Dreimonatsspritze (Depotgestagene) intramuskulär - Gestagenhaltiges Intrauterinpessar - Postkoitale Kontrazeption durch 1,5 mg Levonorgestrel (= Pille danach) 3.25 1. Orale Kontrazeptiva: pharmakokinetische Aspekte Estrogene und Gestagene der oralen Kontrazeptiva werden durch Cxytochromp P450-Enzyme metabolisiert. Enzyminduzierende Wirkstoffe wie Carbamazepin, Phenytoin, Rifampicin, und Griseofulvin reduzieren die kontrazeptive Sicherheit. 2. Estrogene besitzen enterohepatischen Kreislauf, der die Biovefügbarkeit erhöht. Breitbandantibiotika stören die gastrointestinale Flora und den Enterohepatischen Kreislauf -> Schwangerschaftsrisiko 3.26 Selektive Progesteronerezeptor Modulatoren (SPRM) RU486/ Mifepriston: In vivo ein Gestagenantagonist (in vitro SPRM-Aktivität nachgewiesen). Wird zum Schwangerschaftsabbruch und als Notfallkontrazeptivum eingesetzt. Ulipristal Als Notfallkontrazeptivum. Hormonhaltige Präparate: Alternativen zur “Pille” - Transdermales System (z.B. Ethinylestradiol + Norelgestromin) 3x 7 Tage - Vaginalring (Ethinylestradiol + Etonogestrel) für 21 days - Intamuskuläres Depot (z.B. 200 mg Norethisteron-enantate) für 3 Monate (3 Monatsspritze) - Intrauterines Pessar (Levonorgestrel) nicht empfehlenswert wg. Komplikationen, kein Vorteil bzgl. thromboembol. Risiken! -Postcoitale kontrazeptive Pille (1.5 mg Levonorgestrel) 72h post couitum; je früher je besser, nach oder zusammen mit Mahlzeit -Ulipristal (SPRM) als postcoitale kontrazeptive Pille