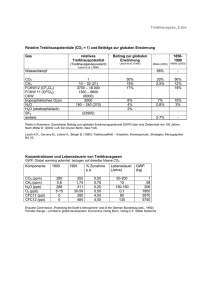
(7%) CH4 (0,3 %) - Bristol ChemLabS
Werbung

Prof. Dudley Shallcross, ACRG Tim Harrison, Bristol ChemLabS 2008 Die Geschichte eines Schadstoffs German translation: Feb. 23, 2015 2 Übersicht des Vortrags • Vergleich der Erde mit anderen Planeten • Stickstoff und Sauerstoff • Verlauf der Temperatur • Troposphärische Schadstoffe 3 Die 3 häufigsten Gase in der Atmosphäre der Planeten Jupiter H2 (93%) He (7%) CH4 (0,3 %) Saturn H2 (96%) He (3%) CH4 (0,45 %) Uranus H2 (82%) He (15%) CH4 (2,3 %) Neptun H2 (80%) He (19%) CH4 (1-2 %) Venus CO2 (96%) N2 (3,5%) SO2 (0,015 %) Mars CO2 (95%) N2 (2,7%) Ar (1,6 %) Erde N2 (78%) O2 (21%) Ar (0,93 %) Stickstoff (N2) 4 NN Bindungsenergie = 944 kJ/mol 78% unserer Atmosphäre sind inert Gasförmig bei 25 OC, flüssig bei – 196 OC Farb- und geruchlos TGH 5 Bakterienhaufen Foto: Dr. Hazel Mottram Sauerstoff (O2) 6 O=O Bindungsenergie = 496 kJ/mol 21% der Atmosphäre Gasförmig bei 25 OC, flüssig bei -183 OC Farb- und geruchlos Photosynthese ist die Hauptquelle für O2: 6CO2 + 6H2O + Sonnenlicht C6H12O6 + 6O2 2H2O2 2H2O + O2 TGH 7 “Spirale des Lebens” Foto: Dr. Adrian Mulholland 8 (Thermosphäre) Höhe (Mesosphäre) (Stratosphäre) (Ozon Maximum) (Troposphäre) Temperatur 9 Chemie der Luft in der Stadt 10 km Die Tropopause Die Grenzschicht 1 km NO, NO2, VOC VOC ? 0 km Stoffe biogenen und menschlichen Ursprungs 10 Was passiert mit den flüchtigen Kohlenwassertstoffen (VOC, volatile organic compounds)? • Pflanzen, darunter Bäume, emittieren eine breite Palette an organischen Stoffen: Alkene, Alkohole, Carbonyle (Aldehyde, Ketone), Säuren • Fahrzeuge emittieren Kohlenwasserstoffe und aromatische Spezies Viele dieser Stoffe sind wasserunlöslich und werden nicht ausgeregnet; Wie werden sie aus der Atmosphäre entfernt? TGH 11 Verbrennung bei hoher Temperatur VOC können in Luft oxidiert (verbrannt) werden nach folgender Reaktionsgleichung (Beispiel): CaC2 + 2H2O Ca(OH)2 + C2H2 C2H2 + (5/2)O2 2CO2 + H2O CH3OH + (3/2)O2 CO2 + 2H2O Die Atmosphäre oxidiert VOC mithilfe freier Radikale 12 VOC werden vom OH Radikal abgebaut, welches sich aus Sonnenlicht bildet O3 + Sonnenlicht O * + O2 O* + H2O OH + OH OH + R-H R + H2O < ~ 330 nm Messung von Stickoxiden in der Luft von Bristol Bristol 20th January 2001 Messung vonNONO am 20.01.2001 in Bristol 450 400 350 300 NO (ppb) NO ppb 13 250 200 150 100 50 0 0 3 6 9 12 15 18 21 24 Hour Stunde Verbrennung ist die Hauptquelle von NO2 (NO wird in der Luft zu NO2 oxidiert) TGH 14 Photochemischer Smog NO2 + Sonnenlicht O * + NO O* + O2 < ~ 400 nm O3 TGH Photochemischer Smog in Bristol: 27/07/2001 Ozone episode 27th July 2001 Bristol area 80 1 0.9 70 0.8 60 50 40 0.5 CO ppm 0.6 CO (ppm) 0.7 O O3 (ppb) NO und NO and 3 ppb 15 0.4 30 0.3 20 0.2 10 0.1 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 hour of day Stunde 14 15 16 17 18 19 20 21 22 23 NO O3 CO 16 CO2 Messungen in Bristol CO2 wurde über mehrere Jahre im Old Park Hill gemessen. 17 CO2 Messungen in Bristol CO2 Minima (Stundenwerte) Datum 18 Langzeitmessungen von CO2 CO2 Gehalt der Luft bei Mauna Loa (ppm) CO2 Messungen wurden bei Mauna Loa (Hawaii) für einige Jahre durchgeführt. Man erkennt einen stetigen Anstieg. 19 Der verstärkte Treibhauseffekt Der Treibhauseffekt Sonnenstrahlung passiert die klare Atmosphäre Ein Teil der Strahlung wird von der Erde und der Atmosphäre reflektiert Ein Großteil der Strahlung wird von der Erdoberfläche absorbiert und erwärmt diese Ein Teil der Infrarotstrahlung passiert die Atmosphäre, und ein Teil wird von Treibhausgasen absorbiert und in alle Richtungen reemittiert. In der Folge erwärmen sich die Erdoberfläche und die untere Atmosphäre Infrarotstrahlung wird von der Erdoberfläche emittiert 20 Geheimnisse im Eis Secrets in the Ice • Schnee “vergräbt” und archiviert Nachweise für Zustände der Umwelt. • Er wird zu Eis verdichtet und koserviert die Daten. • Man kann nach Eiskernen und Daten bohren. CO2 Niveau der letzten 1000 Jahre CO2 Gehalt (ppm) 21 Südpol Jahr Gase werden aus eingeschlossenen Blasen extrahiert (diese sind in den Eiskernen “gefangen”). Sie geben Aufschluss über die frühere Zusammensetzung der Atmosphäre. 22 Froschchor Foto: Dr. Simon Hall CH4 (ppb) Global (errechnet) Jahr Jahr Jahr Strahlungsantrieb (W/m²) N2O (ppb) Strahlungsantrieb (W/m²) 23 Methan (CH4) and Lachgas (N2O) Anstieg der globalen Temperatur Mittlere Oberflächentemperatur der Luft (Jahresmittel), relativ zum Ende des 19. Jahrhunderts Temperaturänderung (°C) 24 Auswirkungen der globalen Erwärmung 25 • Änderungen – – – Niederschläge Meeresniveau Extrema im Wetter 1941 2004 26 Simulation (Modell) Messungen Nur natürliche Treiber (Variabilität von Sonne, Vulkanen, etc.) The Met Office Temperaturanomalie (°C) Temperaturanomalie (°C) Modellrechnungen des jüngeren Klimas Simulation (Modell) Messungen Nur anthropogene Treiber (Änderungen, die durch menschliches Handeln bedingt sind) Berechnete globale Erwärmung von 1860-2000: Natürliche und menschenbedingte Faktoren 1,0 Temperaturanstieg Temperature rise o C (°C) 27 Gemessen Simulation (Modell) 0,5 0,0 Hadley Centre 1850 1900 1950 2000 28 Impacts of Climate on the world: Temperature Einfluss des Klimas auf die Welt: Temperatur Änderungen der mittleren Oberflächenlufttemperaturen DezemberJänner-Februar von 1960-1990 auf 2070-2011 (HadCM2, IS92a) Einheit: °C Mittelwert: 3,3; Minimum: -0,3; Maximum: 17,7 29 Impacts of Climate the World:auf Rainfall Einfluss desonKlimas die Welt: Niederschläge Änderungen der mittleren Niederschläge Dezember-Jänner-Februar von 1960-1990 auf 2070-2011 (HadCM2, IS92a) Einheit: mm pro Tag Mittelwert: 0,2; Minimum: -6,0; Maximum: 8,5 Szenario 2: Stabilisierung bei 500 ppm CO2 in der Atmosphäre Emissionen von fossilen Treibstoffen (GtC/Jahr) Szenario 1: 1,5% pro Jahr exponentielles Wachstum 50 Jahre Jahr Emissionen von fossilen Treibstoffen (GtC/Jahr) wedge = Keil 1 GtC/Jahr StabilisierungsKeile Szenario 2 Stabilisierungsdreieck Weitere CO2 Emissionen von fossilen Treibstoffen Jahr GtC = Gigatonnen Kohlenstoff = 109 Tonnen C Die Stabilisierungskeile – 2 Szenarien Emissionen Kohlenstoff in Milliarden Tonnen pro Jahr 14 7 Historische Emissionen 0 1955 2005 2055 2105 Die Stabilisierungskeile – 2 Szenarien Emissionen Kohlenstoff in Milliarden Tonnen pro Jahr 14 7 Historische Emissionen 0 1955 2005 2055 2105 Emissionen Kohlenstoff in Milliarden Tonnen pro Jahr 14 7 Historische Emissionen Flacher Pfad 0 1955 2005 2055 2105 Emissionen Kohlenstoff in Milliarden Tonnen pro Jahr Einfaches CO2 Ziel ~850 ppm 14 Stabilisierungsdreieck 7 Historische Emissionen Flacher Pfad 0 1955 2005 2055 2105 Emissionen Kohlenstoff in Milliarden Tonnen pro Jahr 14 14 GtC/Jahr Sieben “Keile” 7 7 GtC/Jahr Historische Emissionen Flacher Pfad 0 1955 2005 2055 2105 Heute verfügbare Technologien für die Keile • • • • • • • • • • • Verbesserung der Treibstoffeffizienz Reduktion der Abhängigkeit von PKW Energieeffizientere Gebäude Effizientere Kraftwerke Weniger Kohlenstoff für Strom und Treibstoffe (“Dekarbonisierung”) Ersatz von Kohle durch Erdgas Kernspaltung Windstrom Photovoltaik Biotreibstoffe Carbon capture and storage (CCS, KohlenstoffAbscheidung und –Speicherung) 37 Die 3 häufigsten Gase in der Atmosphäre der Planeten Jupiter H2 (93%) He (7%) CH4 (0,3 %) Saturn H2 (96%) He (3%) CH4 (0,45 %) Uranus H2 (82%) He (15%) CH4 (2,3 %) Neptun H2 (80%) He (19%) CH4 (1-2 %) Venus CO2 (96%) N2 (3,5%) SO2 (0,015 %) Mars CO2 (95%) N2 (2,7%) Ar (1,6 %) Erde N2 (78%) O2 (21%) Ar (0,93 %) TGH 38 Danksagung Bristol ChemLabS British Council Sci Fest Africa 2008 [email protected] [email protected] http://www.chemlabs.bris.ac.uk/outreach