Nomenklatur von Koordinationsverbindungen
Werbung

Vorlesung
Koordinationschemie
Gliederung:
1.
2.
3.
4.
5.
Grundbegriffe
Nomenklatur
Koordinationszahl und Geometrie
Isomerie
Komplexbildungsgleichgewichte, Chelateffekt
und Stabilität von Metallkomplexen
6. Chemische Bindung
Literatur:
• E. Riedel, C. Janiak, T. M. Klapötke, H.-J. Meyer
Moderne Anorganische Chemie
Verlag: Walter de Grytner, 2003
• A. F. Hollemann, E. und N. Wiberg
Lehrbuch der Anorganischen Chemie
Verlag: Walter de Grytner, 2007
• J. R. Gispert
Coordination Chemistry
Verlag: Wiley-VCH, 2008
• L. H. Gade
Koordinationschemie
Verlag: Wiley-VCH, 1998
1. Grundbegriffe
Alfred Werner, Begründer der modernen Koordinationschemie
Z. Anorg. Allg. Chem. 1893, 3, 267-330.
Nobelpreis 1913
1. Grundbegriffe
Verbindungen einfacher Ordnung sind aus Atomen aufgebaut.
NH3
H2O
CO2
1. Grundbegriffe
Verbindungen höherer Ordnung (Komplexe) entstehen durch
Vereinigung von Molekülen.
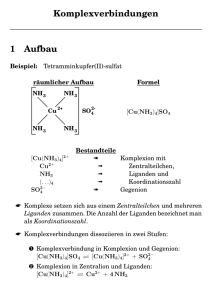
CuSO4
farblos
+
[Cu(H2O)m]2+
hellblau
Aquakomplex
(m + n)H2O
+
[SO4(H2O)n]2-
2+
n+
OH22
OH
H22O
O
OH2
Cu
M
OH2
OH
H22O
O
OH22
OH
1. Grundbegriffe
Ein Komplex besteht aus dem Koordinationszentrum und
der Ligandenhülle.
Das Koordinationszentrum (Zentralteilchen)
Zentralatom oder ein Zentralion sein .
kann
ein
Die Liganden sind Ionen oder Moleküle.
Die Zahl der an das Zentrum gebundenen Liganden heißt
Koordinationszahl (Abkürzung: KOZ, CN).
Aus ihr ergeben sich eine oder mehrere (meist möglichst
hochsymmetrische) Varianten zur geometrischen Anordnung
der Liganden (Koordinationspolyeder).
1
OH
OH222
H22O
O
H
2
6
H
H22O
O
5
II
Cu
Cu
M
2+
n+ Koordinationszentrum: Cu2+
OH
OH22
2
OH
OH22
OH
OH22
4
3
Ligand: H2O
O6-Koordinationssphäre
Koordinationszahl: 6
Oxidationsstufe: + 2
Koordinationspolyeder:
4 Liganden in äquatorialer Umgebung
2 Liganden in axialer Stellung
Oktaeder
1. Grundbegriffe
Homoleptische Komplexe: -nur ein Ligandtyp
[Ni(CN)4]2-
[Fe(CO)5]
[Co(NH3)6]3+
[Cu(en)2]2+
1. Grundbegriffe
Heteroleptische Komplexe: -mehr als ein Ligandtyp
[CrCl2(NH3)4]+
[RhCl3(H2O)3]
1. Grundbegriffe
Koordinationsverbindung:
Bei Metallkomplexen tritt ein neuer Bindungstyp auf: die koordinative
Bindung.
- zur Bildung einer koordinativen
Bindung werden die Elektronen
von einem Bindungspartner
geliefert
- NH3 besitzt ein freies, nicht
bindendes Elektronenpaar (LewisBase)
- BF3 weist eine „Elektronenlücke“
auf (Lewis-Säure)
1. Grundbegriffe
BF3
+
NMe3
[Me3NBF3]
F
F
F
F
B
B
F
+
F
N
Me
Me
N
Me
Me
Lewis-Säure
Akzeptor
Lewis-Base
Donor
Me
Me
Lewis-Säure-Base-Reaktion
-
F
BF3
+
F-
[BF4-]
B
F
F
F
2. Nomenklatur von
Koordinationsverbindungen
a Aufstellung von Komplexformeln
Regel 1: Das Kation steht in der Formel immer vor dem Anion.
Komplexe werden in eckigen Klammern geschrieben.
z.B. K4[Fe(CN)6]
Kaliumhexacyanoferrat(II)
[NBu4][BPh4]
Tetrabutylammoniumtetraphenylborat
2. Nomenklatur von
Koordinationsverbindungen
Regel 2: Das Zentralatom steht in der Formel an erster Stelle.
z.B. [Fe(CN)6]4-, [PF6-]
Regel 3: Anionische vor neutralen Liganden.
Regel 4: Alphabetische Reihenfolge innerhalb der Ligandklassen.
Regel 5: Molekulare Komplexliganden sowie Abkürzungen in
runde Klammern.
Regel 6: Oxidationszahl als Exponent hinter Zentralatom.
z.B. [FeII(CN)6]4-, [CoIII(NO2)3(NH3)3], [CoIIBrCl(en)2]
2. Nomenklatur von
Koordinationsverbindungen
b Name von Komplexverbindungen
Regel 1: Liganden in alphabetischer Reihenfolge vor dem Namen
des Zentralatoms mit di, tri,.. als Präfix.
z.B. [Co(H2O)6]3+ Hexaaquacobalt(III)
[Cu(NH3)4]2+ Tetraamminkupfer(II)
Regel 2: a) Angabe der Oxidationszahl des Zentralatoms als
römische Ziffern (z.B. I, II)
z.B. [PtCl4]2- Tetrachloridoplatinat(II)
[PtCl6]2- Hexachloridoplatinat(IV)
2. Nomenklatur von
Koordinationsverbindungen
Regel 2: b) Angabe der Ladungszahl der Koordinationseinheit
als arabische Ziffer + Ladung (z.B. +3).
z.B. [Ni(CN)5]3- Pentacyanonickelat(3-)
Beachte: Anionische Komplexe enden auf -at.
z.B. Cu: Cuprat
Au: Aurat
Cd: Cadmat
Fe: Ferrat
Sn: Stannat
Hg: Mercurat
Pb: Plumbat
Ag: Argentat
Re: Rhenat
2. Nomenklatur von
Koordinationsverbindungen
Regel 3: Namen anionischer Liganden enden auf -o, neutrale
und formal kationische ohne Zusatz.
NH3: ammin
CO: carbonyl
H2O: aqua
NO: nitrosyl
Cl-:
chlorido
O2-: oxido, (oxo)
S2-:
sulfido, (thio)
C2O42-: oxalato
2. Nomenklatur von
Koordinationsverbindungen
c Liganden
Die Zahl der koordinativen Bindungen, die ein Ligand in einem
Komplex betätigt, wird als die Zähnigkeit des Liganden bezeichnet.
Monodentate Liganden
P
O
O
N
THF
Pyridin
H
N
H
Ammin
H
P
S
ambident
dmso
Triphenylphosphan
Trimethylphosphan Dimethylsulphoxid
Bidentate Liganden
N
N
phen
1,10-Phenanthrolin
N
N
bipy, bpy
2,2‘-Bipyridin
N
dap
1,12-Diazaperylen
a, a‘-Diimin
[Ni(dap)3]2+
N
Eur. J. Inorg. Chem. 2006, 1547-1551.
Supramolecular Assemblies with Honeycomb Structures by π-π
Stacking of Octahedral Metal Complexes of 1,12-Diazaperylene
(Eur. J. Inorg. Chem. 8/2006)
The cover picture shows the honeycomb structure
formed by π-π stacking of homoleptic octahedral
NiII complexes of the “large-surface” ligand 1,12diazaperylene (dap), [Ni(dap)3](BF4)2 (Ni red, N
green, C dark yellow, B blue, F light yellow). The
[Ni(dap)3]2+ cation and one of the BF4− counterions
form parallel nanosized channels (ca. 9.60 A° in
diameter), which run along the crystallographic c
axis and are filled with the other disordered BF4−
counterion (omitted for clarity). The C3 symmetry
of [Ni(dap)3]2+ is a prerequisite for forming the
highly symmetrical supramolecular assembly.
Details are discussed in the article by H.-J. Holdt et
al. on p. 1547 ff.
Bidentate Liganden
CH3
Ph
Ph
N
P
O
P
O
CH3
Ph
acac
O
O
O
N
O
Ph
dppe
tmeda
Oxalato
Tridentate Liganden
H3C
N
N
N CH3
tacn
N
N
H3C
N
O
O
terpy
S
O
O
Sulfato
EDTA
Ethylendiamintetraacetat
Hexadentater Ligand
Mn+
O
N
C
Mn+ = Ca2+, Mg2+, Fe2+, Fe3+.....
Analytische Verwendung:
-Schwermetall-Bestimmung
-Bestimmung der Wasserhärte
Entwicklung von Molekülen mit strukturspezifischer
Wechselwirkung von hoher Selektivität, Nobelpreis 1987
+
18-Krone-6, Charles J. Pedersen
n+
O
+
M+
N
O
O
[2,2,2]-Kryptand, Jean-Marie Lehn
O
O
O
N
K+
N
Rb+
N
OR
OR RO
OR
RO
OR
Li+ > Na+ >> K+
Spherand, Donald J. Cram
Li+
2. Nomenklatur von
Koordinationsverbindungen
d Formel und Namen für Komplexe mit
mehrzähnigen Liganden
Dithiooxalat:
Dithiooxalato-O,O
Dithiooxalato-O,S
Dithiooxalato-S,S
k-Symbolik:
Nitrito, NO2- :
monodentat, ambident
hn
[Co(NO2)(NH3)5]2+
Pentaammin(nitrito-k-N)-cobalt(III)
D
[Co(ONO)(NH3)5]2+
Pentaammin(nitrito-k-O)-cobalt(III)
12
8
1
4
Triiodido(1,4,8,12-tetrathiocyclopentadecan-k3-S1,4,8)molybdän(III)
2. Nomenklatur von
Koordinationsverbindungen
e Mehrkernige Komplexe
[Fe3(CO)12]
Dodecacarbonyltrieisen
[{RuCl3}2(µ-OH)3]3Tri-µ2-hydroxo-bis(trichloridoruthenat)