KLP Q Säuren und Basen
Werbung
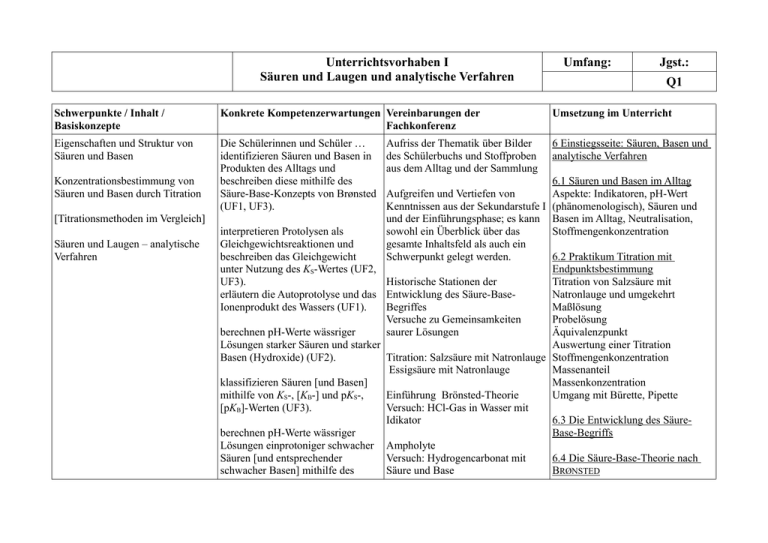
Unterrichtsvorhaben I Säuren und Laugen und analytische Verfahren Umfang: Jgst.: Q1 Schwerpunkte / Inhalt / Basiskonzepte Konkrete Kompetenzerwartungen Vereinbarungen der Fachkonferenz Umsetzung im Unterricht Eigenschaften und Struktur von Säuren und Basen Die Schülerinnen und Schüler … identifizieren Säuren und Basen in Produkten des Alltags und beschreiben diese mithilfe des Säure-Base-Konzepts von Brønsted (UF1, UF3). 6 Einstiegsseite: Säuren, Basen und analytische Verfahren Konzentrationsbestimmung von Säuren und Basen durch Titration [Titrationsmethoden im Vergleich] Säuren und Laugen – analytische Verfahren Aufriss der Thematik über Bilder des Schülerbuchs und Stoffproben aus dem Alltag und der Sammlung 6.1 Säuren und Basen im Alltag Aufgreifen und Vertiefen von Aspekte: Indikatoren, pH-Wert Kenntnissen aus der Sekundarstufe I (phänomenologisch), Säuren und und der Einführungsphase; es kann Basen im Alltag, Neutralisation, interpretieren Protolysen als sowohl ein Überblick über das Stoffmengenkonzentration Gleichgewichtsreaktionen und gesamte Inhaltsfeld als auch ein beschreiben das Gleichgewicht Schwerpunkt gelegt werden. 6.2 Praktikum Titration mit unter Nutzung des KS-Wertes (UF2, Endpunktsbestimmung UF3). Historische Stationen der Titration von Salzsäure mit erläutern die Autoprotolyse und das Entwicklung des Säure-BaseNatronlauge und umgekehrt Ionenprodukt des Wassers (UF1). Begriffes Maßlösung Versuche zu Gemeinsamkeiten Probelösung berechnen pH-Werte wässriger saurer Lösungen Äquivalenzpunkt Lösungen starker Säuren und starker Auswertung einer Titration Basen (Hydroxide) (UF2). Titration: Salzsäure mit Natronlauge Stoffmengenkonzentration Essigsäure mit Natronlauge Massenanteil klassifizieren Säuren [und Basen] Massenkonzentration mithilfe von KS-, [KB-] und pKS-, Einführung Brönsted-Theorie Umgang mit Bürette, Pipette [pKB]-Werten (UF3). Versuch: HCl-Gas in Wasser mit Idikator 6.3 Die Entwicklung des Säureberechnen pH-Werte wässriger Base-Begriffs Lösungen einprotoniger schwacher Ampholyte Säuren [und entsprechender Versuch: Hydrogencarbonat mit 6.4 Die Säure-Base-Theorie nach schwacher Basen] mithilfe des Säure und Base BRØNSTED Massenwirkungsgesetzes (UF2) Versuch zur starken bzw. schwachen Säuren: Salzsäure und Essigsäure mit Indikatoren Versuch: diverse Salze mit Indikatoren testen BRØNSTEDsäuren/Protonendonatore n zeigen an Protolysereaktionen auf, BRØNSTEDbasen/Protonenakzeptore wie sich der Säure-Base-Begriff n durch das Konzept von Brønsted Protolysen verändert hat (E6, E7). Säure-Base-Paare Versuche zu Puffer: Säure bzw. Funktionsschema für Säure-Baseplanen Experimente zur Basenzugabe zu Wasser oder Puffer Reaktionen Bestimmung der Konzentration von Ampholyte Säuren und Basen in Versuch: ph-metrische Titration von Schrittweise Protonenabgabe Alltagsprodukten bzw. Proben aus Cola (mehrprotonige Säuren) der Umwelt angeleitet und selbstständig (E1, E3). Versuche zur Leitfähigkeitstitration [6.5 Die Neutralisationswärme Überprüfung des Essigsäureanteils Reaktionswärme erläutern das Verfahren einer Säure- in Essigessenz mit einer Neutralisationswärme] Base-Titration mit Leitfähigkeitstitration Endpunktsbestimmung über einen Titration Bariumhydroxid mit 6.6 Autoprotolyse des Wassers und Indikator, führen diese zielgerichtet Schwefelsäure pH-Wert durch und werten sie aus (E3, E4, Bestimmung von Säuren im Autoprotolyse des Wassers E5). Weisswein Ionenprodukt des Wassers Def. des pH-Wertes [beschreiben eine pH-metrische weitere Versuche: Zusammenhänge zwischen KW, Titration, interpretieren Bestimmung von Hydroxidionen c(H3O+), c(OH-) bzw. pKW, pH, pOH charakteristische Punkte der aus festen Rohrreinigern Titrationskurve (u.a. 6.7 Die Stärke von Säuren und Äquivalenzpunkt, Basen Halbäquivalenzpunkt) und erklären Protolysegleichgewicht den Verlauf mithilfe des Säure- und [Basenkonstante] Protolysekonzepts (E5).] KS-Wert, pKS-Wert [KB-Wert, pKB-Wert] erklären das Phänomen der elektrischen Leitfähigkeit in 6.8 Salze und Protolysen wässrigen Lösungen mit dem Kationen als Säuren [Basen] Vorliegen frei beweglicher Ionen Anionen als Säuren [Basen] (E6). [erläutern die unterschiedlichen Leitfähigkeiten von sauren und alkalischen Lösungen sowie von Salzlösungen gleicher Stoffmengenkonzentration (E6).] beschreiben das Verfahren der Leitfähigkeitstitration (als Messgröße genügt die Stromstärke) zur Konzentrationsbestimmung von Säuren bzw. Basen in Proben aus Alltagsprodukten oder der Umwelt und werten vorhandene Messdaten aus (E2, E4, E5). machen Vorhersagen zu Säure-BaseReaktionen anhand von KS-[und KB-]Werten und von pKS-[und pKB-]-Werten (E3). bewerten durch eigene Experimente gewonnene Analyseergebnisse zu Säure-Base-Reaktionen im Hinblick auf ihre Aussagekraft (u.a. Nennen und Gewichten von Fehlerquellen) (E4, E5). [vergleichen unterschiedliche Titrationsmethoden (u.a. SäureBase-Titration mit einem Indikator, Leitfähigkeitstitration, pH-metrische Titration) hinsichtlich ihrer Neutrale Salzlösungen Inhaltsstoffe von Lebensmitteln und Reinigern 6.9 pH-Werte von Säurelösungen pH-Werte starker Säuren pH-Werte schwacher Säuren 6.10 pH-Werte von Basenlösungen pH-Werte der wässrigen Lösung starker Basen (Hydroxide) [und schwacher Basen] [optional auch für LK 6.10 Exkurs Puffersysteme Wirkungsweise eines Puffersystems Henderson-Hasselbalch-Gleichung Kohlensäure-HydrogencarbonatPuffersystem Essigsäure-Acetat-Puffersystem] 6.11 Titration mit Endpunktsbestimmung Bestimmung von Essigsäure im Essig Titration Maßlösung Probelösung Äquivalenzpunkt Auswertung einer Titration Stoffmengenkonzentration Massenanteil Massenkonzentration Umgang mit Bürette, Pipette Aussagekraft für ausgewählte Fragestellungen (E1, E4).] [erklären die Reaktionswärme bei Neutralisationen mit der zugrundeliegenden Protolyse (E3, E6).] stellen eine Säure-Base-Reaktion in einem Funktionsschema dar und erklären daran das DonatorAkzeptor-Prinzip (K1, K3). dokumentieren die Ergebnisse einer Leitfähigkeitstitration [und einer pH-metrischen Titration] mithilfe graphischer Darstellungen (K1). erklären fachsprachlich angemessen und mithilfe von Reaktionsgleichungen den Unterschied zwischen einer schwachen und einer starken Säure [bzw. einer schwachen und einer starken Base] unter Einbeziehung des Gleichgewichtskonzepts (K3) recherchieren zu Alltagsprodukten, in denen Säuren und Basen enthalten sind, und diskutieren unterschiedliche Aussagen zu deren Verwendung adressatengerecht (K2, K4), [6.12 pH-metrische Titration Titration einer starken Säure Titration einer schwachen Säure Titration einer mehrprotonigen Säure Äquivalenzpunkt Wendepunkt Neutralpunkt] pH-Sprung [6.13 Halbtitration Halbäquivalenzpunkt Bestimmung des KS-Wertes über die Ermittlung des Halbäquivalenzpunktes] [6.14 Titration und Indikator Indikatorwahl und Titration] 6.15 Leitfähigkeitstitration Leitfähigkeit von Ionenlösung Unterschiedliche Ionenleitfähigkeiten (Ionenäquivalentleitfähigkeit) Durchführung einer Leitfähigkeitstitration Dokumentation der Ergebnisse einer Leitfähigkeitstitration mithilfe graphischer Darstellungen [beschreiben und erläutern Titrationskurven starker und schwacher Säuren (K3).] [nutzen chemiespezifische Tabellen und Nachschlagewerke zur Auswahl eines geeigneten Indikators für eine Titration mit Endpunktsbestimmung (K2).] beurteilen den Einsatz, die Wirksamkeit und das Gefahrenpotenzial von Säuren und Basen in Alltagsprodukten (B1, B2). bewerten die Qualität von Produkten und Umweltparametern auf der Grundlage von Analyseergebnissen zu Säure-BaseReaktionen (B1). [bewerten durch eigene Experimente gewonnene oder recherchierte Analyseergebnisse zu Säure-Base-Reaktionen auf der Grundlage von Kriterien der Produktqualität oder des Umweltschutzes (B4).] [beschreiben den Einfluss von Säuren und Basen auf die Umwelt an Beispielen und bewerten mögliche Folgen (B3).] 6.16 Titrationen im Vergleich Vergleich der Titrationsverfahren im Hinblick auf die Bestimmung des Äquivalenzpunktes einer SäureBase-Titration Lehrmittel, Material: Chemie heute SII - Ausgabe 2014 für Nordrhein-Westfalen Überprüfungen: ein bis max. zwei schriftliche Übungen Anmerkungen: Ausschließlich für den Leistungskurs relevante Inhalte werden in eckigen Klammern angegeben.