Ein wenig Quantenphysik
Werbung

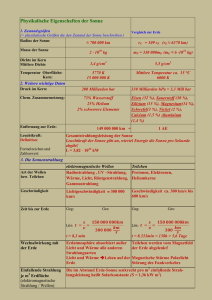
Ein wenig Quantenphysik: Leitfaden, um sich zurechtzufinden. Buchbezug zu Sexl, Band 2: Der Weg zur modernen Physik Entstehung (Emission), Ausbreitung und "Tod" (Absorption) von Strahlung Emissionsspektrum der Atome: S 313; Laserlicht S 274,275 Absorptionsspektren: S 313; Himmelsblau S 74, Körperfarben, addititive/subtraktive Farbmischung S71,72 Strahlung ist in diesem Sinn die Gesamtheit elektromagnetischer Strahlung. Nicht dazu gehören: die radioaktiven Strahlen (schnelle Heliumkerne) und (schnelle Elektronen oder Positronen), hingegen -Strahlung. Die Physik elektromagnetischer Strahlungen ist nicht mit Mitteln der Mechanik zu erklären. Auch die Elektrizitätslehre einschliesslich Wellenlehre reicht nicht aus, um alle Phänomene verstehen zu können. Wann entsteht Strahlung? Strahlung entsteht immer, wenn elektrische Ladungen beschleunigt werden. Ihre Abstrahlrichtung ist vorwiegend senkrecht zur Beschleunigung. Das ist schon eine Voraussage von J. C. Maxwell (1856) als Folge seiner 2 Maxwell'schen Gesetze: Siehe Lehrbuch Seite 202. Alle elektromagnetischen Wellen sind Transversalwellen. Es gibt keine elektromagnetischen Longitudinalwellen. E, B sind gleichphasig, stehen aber aufeinander senkrecht. Siehe Skizze Seite 204 oben. Das Spektrum der elektromagnetischen Wellen reicht von der niederfrequenten Übertragung elektrischer Energie über den Eisenkern von Transformatoren (50 Hz) bis zu höchstfrequenten Strahlen, die von Atomkernen stammen. Siehe Tabelle Seite 205. Alle elektromagnetischen Wellen breiten sich unabhängig vom Bezugssystem des Betrachters oder vom Bezugssystem der Strahlungsquelle im Vakuum mit 1 Lichtgeschwindigkeit aus. Dabei ist c . (S 205). Prüfe nach mit der o 0 Formelsammlung. Die Formel ist eine Folge der Maxwell'schen Gleichungen. Max Planck: 1900 fand aus Überlegungen in Analogie zur statistischen Wärme das Planck' sche Strahlungsgesetz. Es bezieht sich auf die Energie, die ein "schwarzer Körper" in Abhängigkeit von seiner Temperatur in den einzelnen Wellenlängenbereichen der abgestrahlten Temperaturstrahlung emittiert. Begriffe: Temperaturstrahlung (Seite 208), schwarzer Körper (Seite 208), Emissionsvermögen (S 209), Absorptionsvermögen (Seite 208) Planck musste (nicht freiwillig, hat sich gesträubt!) eine kleinste Lichtenergie einführen. Dies führt zum Ausdruck "Quantelung". E = hf. h = 6.63·10-34 Ws. f = Frequenz der Strahlung. Damit ist klar: Hochfrequente Strahlung hat hohe Quantenenergie. (Jedes Quant hat dann hohe Energie, blaue Lichtquanten sind energiereicher als rote, UV ist wiederum energiereicher, Röntgenstrahlen noch mehr etc.) Die Planck'sche Strahlungsformel steht in der Formelsammlung. Ihr Graph: siehe Planck.xls Seite -1- Niels Bohr erklärt kurz darauf in seinem Atommodell (das heute überholt ist), dass die Energiequanten hf die Differenz der möglichen potenziellen Energien von Elektronenbahnen in den "Schalen" angeregter möglicher Zustände darstellen. Siehe Lehrbuch Seite 81: Lymann-Serie, Balmer-Serie, Paschen-Serie zum WasserstoffAtom. E1 - E2 = hf. Die Bohr'sche Theorie zeigt das feine Gefühl Bohr's für das physikalische Verhalten der Natur im Mikrokosmos, jedoch fehlt der Theorie ein Fundament. Er konnte aber die Wasserstoffspektren ausrechnen! Seine Theorie versagt bei allen anderen (komplizierteren) Atomen. Sie war ein wegweisender Anfang. Bohr konnte nicht schlüssig erklären, warum Atome stabil sind. Albert Einstein erkläre 1905 den von früher her bekannten aber mit klassischen Mitteln nicht erklärbaren äusseren Photoeffekt. Bestrahlt man eine negativ geladene Metallplatte (Elektronen an der Oberfläche) mit Licht, so kommt es darauf an, ob jedes einzelne Quant des Lichts genügend Quantenenergie besitzt, um die nötige Austrittsarbeit für die zu emittierenden Elektronen aufzubringen, sodass sich die Platte wegen der dann austretenden Elektronen entlädt. Er schloss, dass je 1 Lichtquant genau 1 Elektron aus dem Metall herausschlage. Ist die Austrittsarbeit kleiner als die Energie hf, so reicht diese für den Effekt. Für Zink zum Beispiel eignet sich das Licht einer Glühlampe auch dann nicht, wenn man enorme Intensitäten verwendet. Die Platte bleibt negativ geladen. Nach der klassischen Physik würden die Elektronen dadurch so stark geschüttelt, dass sie schliesslich genügend Energie zum Austreten hätten. Hingegen beobachtet man den Effekt recht gut, wenn UVLicht aus einer Quecksilberdampflampe verwendet wird (auch wenn sie schwach ist). Die Elektronen haben nach dem Herausschleudern die kinetische Energie E = hf - A Graph siehe: Lehrer an der Tafel. Für diese Arbeit erhielt A. Einstein den Nobelpreis (nicht für die Entwicklung der Relativitätstheorie). Diese Erklärung zeigt deutlich den Teilchencharakter von Strahlung. Wir machen das Experiment. Auch die Untersuchung von Röntgenspektren zeigt deutlich die Energiequantelung. Röntgenstrahlung entsteht durch abruptes Abbremsen sehr schneller Elektronen an einem Metalltarget. Die Beschleunigungsenergie wird auf das Quant übertragen. hc hc 1 1.25 106 Vm eU hf , min e U U Streuungsexperimente zeigen, dass die Quanten des Lichts, man nennt sie fortan Photonen, Impuls besitzen, d. h. sie weisen Trägheit auf wie ein sich bewegendes Teilchen. Wenn sie aufprallen übertragen sie auf die Aufprallmaterie Impuls. Dieser h Photonenimpuls hat den Betrag: p , seine Richtung entspricht der Ausbreitungsrichtung des Photons. Streuungsexperimente führten übrigens Ernest Rutherford zur Entdeckung des Atomkerns. Beim Compton-Effekt, benannt nach dem Physiker, der ihn erklärte, wird die Streuung hochenergetischer Strahlung (Röntgen- oder -Strahlen) an den Elektronen von Materie (meist Metalle) untersucht. Dabei sind die Erhaltungssätze für Energie und Impuls mit den genannten Ansätzen anzuwenden und ausserdem ist die Rechnung wegen der hohen Geschwindigkeiten herausgeschleuderter Elektronen relativistisch zu führen. Die Ansätze erinnern an die klassischen Ansätze für Stossversuche. Auch hier ist es nötig, die Strahlung als Teilchenstrom zu betrachten. Die sorgfältigen Untersuchungen und die klare Interpretation trug auch Compton den Nobelpreis ein. Seite -2- De Broglie hatte die kühne Idee, den Spiess umzudrehen (siehe Impulsformel der Strahlung, oben) und stellte als 24-jähriger in seiner Doktorarbeit die Hypothese auf, h dass jede bewegte Materie von einer Welle begleitet sei, deren Wellenlänge . p Setzt man für p = mv, E = oder: mv 2 p2 h2 , so ergibt sich die Energieformel E 2 2m 2m 2 h 2mE Diese Wellen nannte De Broglie Materiewellen. Das heisst, de Broglie postulierte, dass beliebige bewegte Teilchen (Materie) Welleneigenschaften besitze. Für die Leistungen, die sich hinter dieser Doktorarbeit verbergen, erhielt auch De Broglie den Nobelpreis. Seine Behauptungen wurden durch die Voraussage von Elektronenbeugung, experimentell gezeigt mit den Versuchen von Thomson und Davisson, bestätigt. Erwin Schrödinger entwickelte ca. 1920 die Wellenmechanik der Quantenphysik. Er beschrieb mit Differenzialgleichungen eine Wellenamplitude, deren Quadrat später von Max Born als Aufenthaltswahrscheinlichkeit eines Teilchens am betreffenden Raumpunkt zur betreffenden Zeit gedeutet wurde. Mit dieser Methodik war eine Atomtheorie gewonnen, die es erlaubte sämtliche Spektren von Atomstrahlungen zu verstehen und auch solche von noch unbekannten Elementen vorauszuberechnen. Die Bereiche, bei denen die Aufenthaltswahrscheinlichkeit für ein bestimmtes Elektron relativ hoch ist, nennt man dessen Orbital. Auch E. Schrödinger erhielt für diese Arbeiten den Nobelpreis. Zur Orbitaltheorie lieferte der Physiker Wolfgang Pauli noch ein wichtiges Prinzip, das nach ihm benannt ist: Jedes Orbital eines Atoms kann nur 2 Elektronen aufnehmen. Jetzt war es möglich, das Periodensystem der Elemente quasi physikalisch zu belegen und damit zu verstehen. Wir sehen: Im Mikrokosmos sind Strahlungen und Teilchen wie Elektronen teils als Korpuskeln (Teilchen) teils als Wellen zu deuten. Beide Erscheinungen sind stets vorhanden, aber bei den Beobachtungen treten mal die Wellen, mal die Teilcheneigenschaften in den Vordergrund. Man nennt das Welle-TeilchenDualismus. Eine konsistente Teilchentheorie wurde durch eine Gruppe von Mathematikern an der Universität Göttingen entwickelt. Man nannte die Theorie Matrizenmechanik. Werner Heisenberg, ein Mitglied dieser Gruppe, ist schliesslich 1927 der Durchbruch gelungen, die beiden bis dahin nebeneinander und widersprüchlich existierenden Theorien: Wellentheorie im wesentlichen von E. Schrödinger und Teilchentheorie, genannt Matrizenmechanik oder Quantenmechanik zu vereinigen. Dies gelang ihm mit dem Unschärfprinzip, auch Unschärferelation genannt. Es lautet, (etwas vereinfacht): Legt man den Ort von Teilchen mit der Genauigkeit x und den Impuls des Teilchens mit der Genauigkeit p fest, so gilt stets: x · p h Das bedeutet: Kennt man zu einer bestimmten Zeit den Aufenthaltsort eines Teilchens sehr genau, so ist sein Impuls ungenau bekannt (unscharf) und umgekehrt genauso. Man kann es auch so sagen: Es ist nicht möglich, einen Elektronenstrahl zu erzeugen, in dem die Teilchen sowohl einen genau bestimmten Ort als auch eine genau bestimmte Geschwindigkeit haben. Seite -3- Dies hat ganz gravierende Auswirkungen auf die Philosophie des Naturgeschehens. Denn wenn man zu einem Anfangszeitpunkt nicht beliebig genau Ort und Geschwindigkeit eines Teilchens kennen kann, ist es prinzipiell unmöglich länger anhaltende Voraussagen für die künftige Bewegung des Teilchens zu machen. Der von Laplace im 17. Jahrhundert vorgelegte Dämon, nach welchem man in Kenntnis aller Orte und Geschwindigkeiten aller Teilchen dieser Welt und in Kenntnis aller auf diese Teilchen wirkenden mechanischen Kräfte die gesamte Zukunft der Welt voraussagen könne, verliert damit seine Grundlage. Damit ist klar: Das Naturgeschehen ist nicht genau oder genau (mit Fehlern) vorhersagbar. Es ist nicht determiniert. Vielleicht liegt darin die Erkenntnis versteckt, dass es einen freien Willen gibt? Aber so wie sich Theologen und Philosophen nicht mit ihrer Argumentationsart in die Physik mischen sollen, sollen Physiker (und andere Naturwissenschaftler) sich nicht anmassen, ihre Methoden in Bereichen anzuwenden, die nicht die ihren sind. Folgen der Quantenphysik: Verständnis für den inneren Aufbau der Atome und Berechnung dieses Aufbaus Verständnis für zahlreiche Erscheinungen im Zusammenhang mit elektromagnetischer Strahlung Verständnis der Leitungseffekte in Metallen und Halbleitern (Bänderstrukturen) Darauf aufbauend die gesamte Mikrotechnik, integrierte Schaltungen, Informationstechnologie, Datentechnik, Quantenelektronik, Quantenoptik Verstehen zum Atomkern, Kernenergie, Radioaktivität, Kernspaltung, Kernfusion Unsere Hauptenergiequelle: die Sonne; Kosmische Strahlung. Wesentliches im Bereich der Elementarteilchen. Zum heutigen Stand sind allerdings grundlegende Erweiterungen hinzugekommen. (Verlängerung der Liste der Erhaltungssätze, Standardmodell der Elementarteilchen) Festkörperphysik bei normalen und tiefen Temperaturen, z. B. Supraleitfähigkeit (gibt zwar noch immer Rätsel auf), Material- und Werkstoffforschung Was ist noch nicht gelungen: Gesamtverständnis (Vereinigung) Relativitätstheorie und Quantenphysik Einheitliche Feldtheorie (Man muss nach wie vor die Gravitationskräfte, elektromagnetische Kräfte und Kernkräfte getrennt betrachten, obwohl man starke Anzeichen hat, dass diese Naturkräfte Teil einer übergeordneten Feldtheorie sind) Etliche Auswirkungen auf komplexe Systeme Noch viele offene Fragen im Bereich der Elementarteilchenphysik Diese Liste ist ganz unvollständig, da ein Physiklehrer nur sehr teilweise im Forschungsbereich informiert sein kann. Werner Fuchsberger, im April 2003, Seitenzahlen an Sexl II, neu angepasst: März 2005 Seite -4-