Glossar ch-2 zu Farbigkeit
Werbung

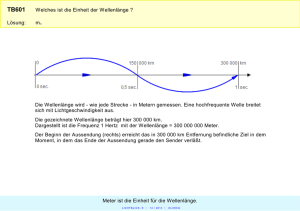
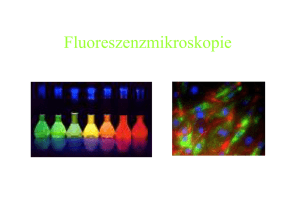
Glossar ch-2 / Lp (meist aus Wikipedia) Die von freien Atomen absorbierte bzw. emittierte Strahlung ergibt aufgrund der gequantelten Aufnahme bzw. Abgabe von Energie scharf abgegrenzte Spektren, die als Linienspektren bezeichnet werden. Ein Beispiel für ein derartiges Linienspektrum liefert Wasserstoff als einfachstes Element. Aus seinen Linienspektren, hier insbesondere die im Bereich des sichtbaren Lichts liegende Balmer-Serie, wurden grundlegende Theorien und deren Beweise zum Aufbau des Atoms abgeleitet. (z.B. Bohrsches Atommodell) Absorptionsspektrum, zeigt die Absorption von z. B. ultraviolettem (Ultraviolett) oder sichtbarem Licht durch eine chemische Verbindung in Abhängigkeit von der Wellenlänge (bzw. Frequenz) des eingestrahlten Lichts (elektromagnetisches Spektrum); wichtig zur Identifizierung und Charakterisierung unter anderem von Coenzymen, Nucleotiden, Nucleinsäuren, aromatischen Aminosäuren, Proteinen, Carotinoiden, Chlorophyll. Frequenz und Wellenlänge Zwischen der Frequenz f und der Wellenlänge (Lambda) einer Schwingung besteht ein direkter physikalischer Zusammenhang. Frequenz Wellenlänge Periodendaue r Formelzeiche n f Maßeinheit Hz = 1/s m T s Elektromagnetische Wellen, wie man sie in der Rundfunkübertragung kennt, breiten sich im Raum mit der Lichtgeschwindigkeit c (~ 300.000 km/s = 300.000.000 m/s) aus. Zwischen der Lichtgeschwindigkeit c der Wellenlänge und der Frequenz f besteht folgender Zusammenhang: Lichtgeschwindigkeit c = Wellenlänge · Frequenz f Ein angeregter Zustand eines physikalischen Systems ist jeder Zustand, dessen Energie größer ist als die des Zustands mit der niedrigst möglichen Energie, des Grundzustands. Der Begriff wird hauptsächlich bei Systemen verwendet, die nur bestimmte Zustände mit diskreten Energien annehmen können, wie sie durch die Quantenmechanik beschrieben werden. Bei einem Atom ist der Grundzustand durch die energetisch niedrigste Elektronenkonfiguration bestimmt. Durch Energiezufuhr, z. B. durch Absorption eines Photons mit geeigneter Energie (Licht) oder unelastischen Stoß (Franck-Hertz-Versuch), kann ein Elektron auf ein höheres Energieniveau angehoben werden. Der Zerfall in einen energetisch tieferen Zustand erfolgt entweder spontan oder wird durch eine äußere Störung ausgelöst. Die frei werdende Energie wird dabei in irgendeiner Form an die Umgebung abgegeben, z. B.: als Photon (spontane oder auch stimulierte Emission) Grundlagen der Fluoreszenzentstehung Bei der Absorption von Licht einer bestimmten Wellenlänge (=Anregungslicht) ist bei verschiedenen Molekülen eine gleichzeitige Emission von Licht mit größerer Wellenlänge beobachtbar. Dieses Verhalten (Absorption von kurzwelligem Licht, Emission von längerwelligem Licht) wird als Fluoreszenz bezeichnet. Bestimmte Elektronen der fluoreszierenden Moleküle absorbieren hierbei die Photonen und gelangen dadurch auf ein höheres Energieniveau. Die Elektronen können sich jedoch nicht auf diesem Niveau halten und fallen deshalb praktisch augenblicklich auf ihr ursprüngliches Energieniveau zurück. Dabei setzen sie die aufgenommene Energie wieder frei und es kommt zur Emission des Fluoreszenzlichts. Allerdings wird die Energie nicht nur als Licht freigesetzt. Deshalb ist das emittierte Licht etwas energieärmer als das Anregungslicht. Energieärmere Lichtstrahlung besitzt jedoch eine größere Wellenlänge und deshalb auch eine andere Lichtfarbe als energiereichere Lichtstrahlung. Für die Fluoreszenz ergibt sich hieraus die bereits eingangs erwähnte Eigenschaft (Absorption von kurzwelligem Licht, Emission von längerwelligem Licht), welche auch als Stokes-Regel bezeichnet wird. Das emittierte Fluoreszenzlicht besitzt oft eine um etwa 20-50 nm größere Wellenlänge als das Anregungslicht. Diese Differenz in der Wellenlänge zwischen den beiden Lichtarten wird als Stokes-Differenz bezeichnet. Animation dazu: http://www.mikroskopie.de/kurse/fluoreszenz/elektron.html Bei Phosphoreszenz handelt sich um eine Photolumineszenz. Sie unterscheidet sich von der Fluoreszenz. Entfernt man bei fluoreszierenden Stoffen die Lichtquelle, so endet das Leuchten sofort, wohingegen bei der Phosphoreszenz ein längeres Nachleuchten zu beobachten ist. Es herrscht die Fehlvorstellung in den Köpfen der Menschen, dass Phosphoreszenz nur vom Leuchten des Phosphors her kommen kann. Dies ist aber ein Trugschluss. Die Ursache für das Leuchten des weißen elementaren Phosphors ist, dass sich der Phosphor mit dem Luftsauerstoff umsetzt. Bei dieser Art von Leuchten, handelt es sich aber um die so genannte Chemolumineszenz. Phosphoreszierende Materialien sind meist Kristalle, in denen Kleinstmengen an Fremdstoffen in den Kristall eingeschlossen sind. Der Begriff Chromophor leitet sich von griechisch chroma "Farbe" und phoros "tragend" her. Er bezeichnet Atom-Gruppierungen, die einer Verbindung durch selektive Lichtabsorption Farbigkeit verleihen. Im Allgemeinen handelt es sich bei den chromophoren Gruppen um πElektronensysteme (Pi). Als Chromophor (griech. Farbträger) bezeichnet man denjenigen Teil eines Farbstoffs, der für das prinzipielle Vorhandensein der Farbigkeit sorgt. Der Begriff Chromophor darf dabei nicht mit dem Begriff der Chromatophoren verwechselt werden, bei denen es sich um Farbstoffe produzierende Zellen von Fischen, Amphibien und Reptilien handelt, wie das bei Säugetieren die Melanozyten tun. Dass ein Farbstoff bei einem Beobachter einen Farbreiz hervorruft, also bunt erscheint, beruht auf mehreren Eigenschaften: der Reflexion und Streuung des Umgebungslichts sowie der selektiven Absorption eines Teils dieses Lichts, das vom Chromophor aufgenommen wird und diesen in einen mehr oder weniger lang andauernden energetisch angeregten Zustand versetzt. Auxochrome (von griech. auxanein = wachsen und chroma = Farbe) sind funktionelle Gruppen in Farbstoff-Molekülen, die das Absorptionsmaximum einer bereits vorhandenen färbenden Gruppe (Chromophor) in den längerwelligen oder kürzerwelligen Bereich des Spektrums verschieben, und dadurch eine Farbänderung hervorrufen. Auxochrome (von griech. auxanein = wachsen und chroma = Farbe) sind funktionelle Gruppen in Farbstoff-Molekülen, die das Absorptionsmaximum einer bereits vorhandenen färbenden Gruppe (Chromophor) in den längerwelligen oder kürzerwelligen Bereich des Spektrums verschieben, und dadurch eine Farbänderung hervorrufen. Meistens ist die gewünschte Farbänderung eine Verschiebung zu längeren Wellenlängen (Bathochromer Effekt), weil die Absorption des Chromophors für sich alleine oft im UV-Bereich liegt, der für das menschliche Auge nicht sichtbar ist. Vom bathochromen Effekt spricht man, wenn sich das Absorptionsspektrum eines Farbstoffs durch Wirkung auxochromer und/oder anti-auxochromer Substituenten bzw. funktioneller Gruppen in Richtung größerer Wellenlängen, d.h. in Richtung des energieärmeren Bereichs des Lichtspektrums verschiebt. Substituenten bzw. funktionelle Gruppen, deren Einführung in ein organisches Farbstoffmolekül zu einer solchen Verschiebung der Absorption ins Längerwellige führt, werden dementsprechend auch Bathochrome bzw. bathochrome Gruppen genannt. Und hier der schon bekannte Text zur Farbigkeit von Molekülen: www.anja-warnecke.de/chemie/doc_download/61-farbstoffe.html