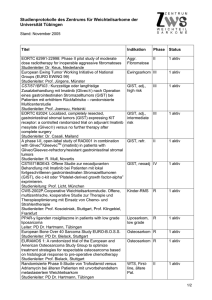
Auch nach 15 Jahren bleibt Glivec das einzige Imatinib mit einer
Werbung

Novartis Pharma GmbH Roonstraße 25 D-90429 Nürnberg http://www.novartis.de MEDIA RELEASE • COMMUNIQUE AUX MEDIAS • MEDIENMITTEILUNG Auch nach 15 Jahren bleibt Glivec® das einzige Imatinib mit einer Zulassung bei GIST Glivec (Imatinib) hat die Behandlung gastrointestinaler Stromatumoren (GIST) ® maßgeblich verbessert, z. B. indem die mediane Überlebensdauer mit Glivec um das 1,2 2,5-Fache erhöht wurde. Derzeit wird in Studien untersucht, inwieweit eine mehr als dreijährige bzw. fünfjährige ® adjuvante Behandlung mit Glivec bei Patienten mit primär operablen GIST und hohem Rezidivrisiko Überlebensvorteile bringen kann. Glivec ist zur Behandlung von GIST bis 2021 patentgeschützt. ® A ® ® Nürnberg, den 17. Oktober 2016 – Seit bald 15 Jahren ist Glivec in Deutschland als A einziges Imatinib-Präparat zur Behandlung von gastrointestinalen Stromatumoren (GIST) ® zugelassen. Glivec hat den Verlauf der Erkrankung GIST maßgeblich verbessert: Im Jahr 1 2000 betrug die mediane Überlebensdauer nach Diagnose 19 Monate und erhöhte sich ® 2 ® durch die Einführung von Glivec um das 2,5-Fache auf 4,5 Jahre. Während Glivec als Originalprodukt in der Indikation GIST noch bis 2021 patentgeschützt bleibt, investiert der Hersteller Novartis auch 15 Jahre nach Markteinführung weiterhin in Studien, z. B. zum adjuvanten Einsatz bei GIST. Ein zentraler Punkt solcher aktueller Untersuchungen ist die Frage, über welchen Zeitraum GIST-Patienten mit primär operablen GIST und hohem ® Rezidivrisiko standardmäßig adjuvant Glivec erhalten sollten. An dieser Studie ist von deutscher Seite Privatdozent Dr. Peter Reichardt, Chefarzt an der Klinik für Interdisziplinäre Onkologie und Leiter des Onkologischen Zentrums Berlin-Buch, involviert. Zu seinen Erwartungen und Erfahrungen gab er im Rahmen eines Interviews Auskunft. Interview mit Privatdozent Dr. Peter Reichardt, Chefarzt an der Klinik für Interdisziplinäre Onkologie und Leiter des Onkologischen Zentrums Berlin-Buch ® Herr Dr. Reichardt, bald ist Glivec 15 Jahre in der Indikation GIST zugelassen. Welche Bedeutung hatte Imatinib in der GIST-Therapie zum Zeitpunkt der Einführung und welche hat es heute? ® Dr. Reichardt: „Um die Relevanz von Imatinib bzw. Glivec erfassen zu können, muss man wissen, dass GIST bei Patienten in einer fortgeschrittenen Erkrankungsphase vor der Verfügbarkeit von Imatinib quasi nicht behandelbar waren. GIST waren von allen Sarkomen jene, die man am allerschlechtesten, nämlich praktisch gar nicht, chemotherapeutisch behandeln konnte. Durch die Einführung von Imatinib in die Behandlung fortgeschrittener GIST wurden schon sehr früh Ansprechraten von 60–80 % berichtet. Nahezu alle Patienten hatten einen klinischen Benefit. Dadurch, dass wir als erstes Zentrum in Deutschland die ersten deutschen GIST-Patienten mit Imatinib behandelten, gibt es aus dieser frühen Phase noch immer einzelne Patienten, von denen wir wissen, dass sie statistisch gesehen ohne A ® Glivec ist angezeigt zur Behandlung c-Kit-(CD 117)-positiver nicht resezierbarer und/oder metastasierter maligner gastrointestinaler Stromatumoren (GIST) bei Erwachsenen sowie zur adjuvanten Behandlung Erwachsener mit signifikantem Risiko eines Rezidivs nach Resektion c-Kit-(CD 117)-positiver GIST. Page 2 of 5 ® Glivec inzwischen schon seit 13 oder 14 Jahren tot wären. Sie leben aber noch und haben inzwischen Kinder, Enkel, unter Umständen Urenkel. Das sind schon sehr eindrucksvolle Erlebnisse. Mittlerweile sind natürlich weitere gute und wichtige Wirkstoffe hinzugekommen, doch noch immer ist Imatinib der unangefochtene Standard in der Erstlinientherapie.“ Was ist Ihr persönliches Behandlungskonzept bei GIST? Dr. Reichardt: „Bei metastasierten oder lokal fortgeschrittenen GIST ist der weltweite Goldstandard 400 mg Imatinib, wobei eine kleine Gruppe der Patienten, deren GIST eine 3 Exon-9-Mutation im c-Kit-(CD 117)-Gen aufweisen, eine höhere Dosierung benötigt. Die Standardtherapie lokalisierter GIST ist hingegen im ersten Schritt die vollständige chirurgische Entfernung. Bei kleineren Tumoren, insbesondere am Magen, ist hier inzwischen die minimalinvasive Chirurgie, zum Teil im ‚Rendezvous‘-Verfahren gemeinsam mit Endoskopie, das Vorgehen der Wahl. Es ist klar belegt, dass die Wahrscheinlichkeit eines Rückfalls nach kompletter operativer Entfernung eines GIST durch mehrere Faktoren bedingt wird. Einer ist die Größe des Tumors. Je größer er ist, desto höher ist das Rückfallrisiko. Der zweite Faktor ist die Lokalisation, z. B. gehen GIST im Dünndarm mit einem höheren Rückfallrisiko einher als bei einem Befund im Magen. Der dritte und mit Abstand wichtigste Faktor ist die mitotische Aktivität. Was auch eine Rolle spielt, aber bislang keinen Eingang in die Rückfallrisikoklassifikationen gefunden hat, ist der Nachweis relevanter Mutationen. Eine Mutationsanalyse sollte im Vorfeld einer Entscheidung für oder gegen eine adjuvante Therapie erfolgen. Das ist eine Therapie, die im Anschluss an die vollständige operative Entfernung eines Tumors verabreicht wird. Und die Mutationsanalyse ist auch relevant hinsichtlich der richtigen Medikamentendosierung. Ein nicht universeller, aber doch mehrheitsfähiger Konsens besteht z. B. in der Empfehlung, Imatinib auch in der adjuvanten Therapie bei einer c-Kit-Exon-9-Mutation in einer Dosierung von 800 mg einzusetzen.“ ® Wie lange sollten GIST-Patienten mit primär operablen GIST standardmäßig Glivec erhalten? Dr. Reichardt: „Derzeit ist eine dreijährige Behandlung mit Imatinib der weltweit empfohlene Standard. Dies besagen nicht zuletzt auch die aktuellen Leitlinien der European Society for 4 Medical Oncology (ESMO). Die Empfehlung gilt für Patienten mit einem nach Operation signifikanten Rückfallrisiko. Für diese Patienten belegt eine skandinavisch-deutsche Studie, von der Anfang des Jahres nochmals Langzeit-Follow-up-Daten publiziert wurden, dass eine 5,6 dreijährige Therapie der einjährigen Therapie signifikant überlegen ist. Ob eine mehr als dreijährige Behandlungsdauer gegebenenfalls noch besser wäre, ist durchaus eine vertretbare Annahme, die aber der Überprüfung in klinischen Studien bedarf. Hierzu laufen derzeit in Europa zwei randomisierte Studien, wobei bei einer nicht zur Stunde null begonnen wird, sondern Patienten eingeschlossen werden, die bereits drei Jahre mit Imatinib vorbehandelt wurden. Für die Studie erhalten die Patienten nach Einschluss weitere zwei Jahre die Behandlung oder werden als Kontrollgruppe weitergeführt. Die Studie wird demnächst auch in Deutschland eröffnet.“ ® Welche Rolle spielen die Patienten für den Therapieerfolg mit Glivec ? Dr. Reichardt: „Der Behandlungserfolg mit Imatinib sowohl bei fortgeschrittenen GIST als auch in der adjuvanten Indikation hängt natürlich von uns Ärzten, aber auch den Patienten ab. Von ärztlicher Seite ist neben der adäquaten Therapieauswahl entscheidend, dass man die Patienten sorgfältig aufklärt über die Erkrankung GIST, die damit einhergehenden Risiken und was passiert, wenn man nicht behandelt. Das ist wichtig, damit die Patienten verstehen, dass es sich hier um eine Dauertherapie handelt, die nur wirkt, wenn die Tabletten regelmäßig eingenommen werden. Man muss auch über mögliche Nebenwirkungen aufklären. Und darüber hinaus, was Patienten selber tun können, um Nebenwirkungen abzumildern oder möglicherweise ganz zum Verschwinden zu bringen. Grundsätzlich gilt, dass Imatinib eine sehr gut verträgliche Therapie darstellt, zumindest in der Standarddosierung von 400 mg. Die Doppeldosierung 800 mg führt meist zu ausgeprägteren Nebenwirkungen. Es hat sich aber gezeigt, dass die Verträglichkeit durch eine schrittweise Page 3 of 5 Gewöhnung besser ist, als wenn man direkt von Tag eins mit 800 mg einsteigt. Dann weise ich Patienten im Gespräch auch durchaus auf die Aktivitäten von Patientenorganisationen bzw. Selbsthilfegruppen hin. Diese verrichten wichtige Aufklärungsarbeit, was für die Compliance wiederum sehr förderlich sein kann.“ ® Ende 2016 läuft das Patent für Glivec weitgehend aus, die Indikation GIST bleibt aber patentgeschützt. Inwieweit sehen Sie hier eine Herausforderung für Ärzte und Patienten? ® Dr. Reichardt: „Wir haben mit dem Medikament Glivec , was den Patentschutz angeht, eine sehr spezielle Situation: Zum Jahresende läuft der Patentschutz teilweise aus, bleibt für die Indikation GIST jedoch bestehen. Was die Patienten betrifft, so können wir sicherlich davon ausgehen, dass Patienten überwiegend ihr gewohntes Medikament, mit dem sie vielleicht seit 10 oder mehr Jahren anhaltend gut leben, weiter bekommen wollen. Auch wird es so sein, dass sich die Information zur Erkrankung GIST logischerweise nur im Beipackzettel des als einzigem zugelassenen Originalpräparates wiederfinden wird, denn Generika werden aufgrund des Patentschutzes keine Zulassung für GIST haben. Trotz dieser speziellen Patentsituation ändert sich für die GIST-Patienten aber im Prinzip nichts: Die Standardtherapie für Patienten mit GIST bleibt, wenn man Imatinib verwendet, weiterhin ® Glivec . Das ist nicht nur für Ärzte und Patienten eine wichtige Information, sondern auch für Apotheker, denn sie sind es ja, die das Präparat an die Patienten ausgeben. Unklarheiten ® können hier für GIST-Patienten umgangen werden, wenn vom Arzt explizit Glivec rezeptiert wird, nicht der Wirkstoff Imatinib.“ Weiterführende Informationen finden Sie unter www.leben-mit-gist.de. Zeichen inkl. Leerzeichen: 10.453 Zeichen ® Quelle: Novartis Oncology Pressemitteilung „Auch nach 15 Jahren bleibt Glivec das einzige Imatinib mit einer Zulassung bei GIST“, 17. Oktober 2016; Autor: Novartis Pharma GmbH. Zusatzinformationen Über GIST Gastrointestinale Stromatumoren (GIST) sind die häufigste Form der gastrointestinalen Sarkome und wurden 1998 als eigenständige Tumorart identifiziert. Die jährliche Inzidenz beträgt ca. 15–20 Fälle / Million Menschen / Jahr weltweit. Die Krankheit tritt meist im Alter 7 von 50–70 Jahren auf und ist vor dem 40. Lebensjahr selten. Über Imatinib Für Patienten mit primär operablem Tumor gab es bis 2009 ausschließlich die Option der Resektion. Erst mit der Zulassung von Imatinib für die adjuvante Behandlung Erwachsener nach der Resektion c-KIT-(CD117)-positiver GIST mit signifikantem Rezidivrisiko verbesserte sich die Situation erheblich. Auch für Patienten mit metastasierten und/oder nicht resezierbaren GIST gab es bis 2002 keine wirksame Therapie. Die Zulassung des Tyrosinkinase-Inhibitors Imatinib ist verbunden mit einer verbesserten Prognose für die Betroffenen: Über 80 % der Patienten profitierten von der Imatinib-Behandlung und in über 68 % der Fälle bildete sich der Tumor ganz oder 8 teilweise zurück. ® Glivec (Imatinib) ist das einzige zugelassene Medikament zur GIST-Erstlinien-Therapie und kann zur Behandlung c-Kit-(CD 117)-positiver nicht-resezierbarer und/oder metastasierter maligner gastrointestinaler Stromatumoren (GIST) bei Erwachsenen sowie der adjuvanten Page 4 of 5 Behandlung Erwachsener mit signifikantem Risiko eines Rezidivs nach Resektion c-Kit-(CD 117)-positiver GIST eingesetzt werden. Über Novartis Novartis bietet innovative medizinische Lösungen an, um damit auf die sich verändernden Bedürfnisse von Patienten und Gesellschaften einzugehen. Novartis, mit Hauptsitz in Basel (Schweiz), verfügt über ein diversifiziertes Portfolio, um diese Bedürfnisse so gut wie möglich zu erfüllen: mit innovativen Arzneimitteln, Produkten für die Augenheilkunde und kostengünstigen generischen Medikamenten. Novartis ist das einzige Unternehmen mit weltweit führenden Positionen in diesen Bereichen. Im Jahr 2015 erzielte der Konzern einen Nettoumsatz von USD 49,4 Milliarden und wies Kosten für Forschung und Entwicklung in Höhe von rund USD 8,9 Milliarden (USD 8,7 Milliarden unter Ausschluss von Wertminderungen und Abschreibungen) aus. Die Novartis Konzerngesellschaften beschäftigen rund 118.000 Mitarbeitende (Vollzeitstellenäquivalente). Die Produkte von Novartis sind in über 180 Ländern weltweit erhältlich. Weitere Informationen finden Sie im Internet unter http://www.novartis.com und http://www.novartis.de oder folgen Sie uns unter http://www.twitter.com/Novartis_DE. Referenzen 1 DeMatteo RP, Lewis JJ, Leung D et al. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000; 231: 51–58. 2 Blanke C, Demetri G, Mehren M et al. Long-term results from a randomised phase II trial of standard versus higher dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumours expressing KIT. J Clin Oncol 2008; 26: 620–625. 3 Reichardt P, Schütte J. Leitlinie Gastrointestinale Stromatumore (GIST) der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO), Stand Juni 2011. https://www.onkopedia.com/de/onkopedia/guidelines/gastrointestinale-stromatumoregist/@@view/html/index.html. Letzter Zugriff: 05.08.2016. 4 The ESMO/European Sarcoma Network Working Group. Gastrointestinal stromal tumors: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014; 25 (Suppl3): iii21– iii26. 5 Joensuu H, Eriksson M, Sundby Hall K et al. One vs three years of adjuvant imatinib for operable gastrointestinal stromal tumor. A randomized trial. JAMA 2012; 307: 1265–1272. 6 Joensuu H, Eriksson M, Sundby Hall K et al. Adjuvant imatinib for high-risk GI stromal tumor: analysis of a randomized trial. JAMA 2016; 34: 244–250. 7 Greenson JK. Gastrointestinal stromal tumors and other mesenchymal lesions of the gut. Modern Pathol 2003; 16(4): 366–375. 8 Blanke CD, Demetri GD, von Mehren M et al. Long-term results from a randomized phase II trial of standard - versus higherdose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromaltumors expressing KIT. J Clin Oncol 2008; 26: 620–625. ### Page 5 of 5 Kontakt Karen Dinkhoff Communications Manager External Affairs & Communications Oncology Novartis Pharma GmbH Roonstraße 25 90429 Nürnberg GERMANY Ina Meyer Head External Affairs & Communications Oncology Novartis Pharma GmbH Roonstraße 25 90429 Nürnberg GERMANY Phone +49 911 27313857 Mobile +49 172 650 79 56 [email protected] www.novartis.de www.novartisoncology.de Phone +49 911 273 12643 Mobile +49 173 301 97 43 [email protected] www.novartis.de www.novartisoncology.de Novartis Pharma GmbH Geschäftsführer: Adib Jacob (Vorsitzender), Alain Dostie, Remo Inglin, Inge Maes Vorsitzender des Aufsichtsrates: Rainer Boehm Sitz der Gesellschaft: Nürnberg • Registergericht: Nürnberg • HRB-Nr. 14500