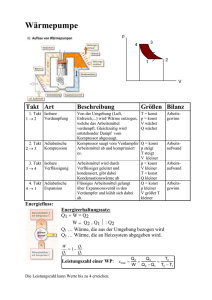
Vorlesung 2: Hauptsätze der Thermodynamik
Werbung

2. Hauptsätze der Thermodynamik
Bekannt sind vor allem der I. und II. Hauptsatz der Thermodynamik. Man spricht auch vom 0.
Hauptsatz und es gibt zusätzlich den III. Hauptsatz.
0. HS:
Einführung der Temperatur als Zustandsgröße
I. HS:
Energieerhaltungssatz
II. HS:
Einführung der Entropie als Zustandsgröße
(Aussagen über die Richtung von Prozeßabläufen)
III. HS:
Nernst‘scher Wärmesatz (Hauptkonsequenz: Unerreichbarkeit des
absoluten Nullpunktes der Temperatur)
2.1. 0. Hauptsatz
Es gibt eine Zustandsgröße, die Temperatur. Ihre Gleichheit ist Bedingung des thermischen
Gleichgewichtes zweier Systeme, S1 und S2, oder zweier Teile desselben Systems, S.
Zum 1. Mal so formuliert von Fowler (1931) bei Bemühungen, der Thermodynamik einen
axiomatischen Aufbau zu geben.
S1
S2
Vor dem Kontakt: S1 sei wärmer als S2
T (S1 ) > T (S 2 )
S1
nach dem Kontakt drei Möglichkeiten denkbar.
S2
a)
T (S1 ) > T (S 2 )
b)
T (S1 ) = T (S 2 )
c)
T (S1 ) < T (S 2 )
← nie beobachtet.
Ob a) oder b) realisiert, hängt von der Art der Kontaktfläche ab;
a) adiabatisch isolierende Wände
16
b)
thermisch leitende Wände
Fall a) kann nicht beliebig lange aufrecht erhalten werden.
2.2. I. Hauptsatz
Energieerhaltungssatz; Robert Mayer, H. Helmholtz (aber eigentlich bereits von W. Leibnitz)
Wir betrachten ein geschlossenes System (kein Stoffaustausch, aber Energieaustausch)
Neben mechanischer Arbeitsleistung wird Wärme als Energieform betrachtet.
I. Hauptsatz:
Jedes thermodynamische System besitzt eine extensive Zustandsgröße U, die sogenannte
innere Energie. Sie wächst durch Zufuhr von Wärme δQ und von Arbeit δA . Für
abgeschlossene Systeme ist die innere Energie eine Erhaltungsgröße (U = konst.).
dU = δQ + δA
δQ
dU
δ : wenn Variation einer Größe, die keine
Zustandsgröße, oder wenn wir noch nicht
δA
wissen, ob Zustandsgröße.
Für abgeschlossene Systeme gilt δA = δQ = 0 und damit
dU = 0 ; U = konst . Energieerhaltungssatz für die innere Energie.
δA : Arbeitsdifferential
δA = − pdV für Kompressionsarbeit (Spezialfall).
Andere Möglichkeiten für die thermodynamische Arbeit:
δA = σ dF ; Oberflächenvergrößerung oder –verkleinerung σ : Oberflächenspannung
dF : Flächenänderung
17
δA = ψ ⋅ de
Änderung der Ladung in einem elektrischen Feld
ψ Potential (s. Elektrolyte), e: Ladung (s. Membranpotential)
Integrale Formulierung des I. Hauptsatzes
Die innere Energie ist eine Zustandsgröße; Also gilt bei Kreisprozeß:
∫ dU = 0 ⇒ ∫ δ A + ∫ δ Q = 0
Zwei Fälle
1. wenn kein Wärmeaustausch stattfindet:
2. mit Wärmeaustausch:
∫ δQ = 0 ⇒ ∫ δA = 0 , keine Arbeit
geleistet
∫ δA < 0 ⇒ ∫ δQ > 0
Wenn Arbeit abgegeben werden soll; muß Wärme zugeführt werden.
Äquivalente Formulierung des I. Hauptsatzes: „Satz von der Unmöglichkeit eines
Perpetuum mobile“
Es ist unmöglich, ein perpetuum mobile 1. Art, d. h. eine periodisch arbeitende Maschine zu
bauen, die Arbeit abgibt, ohne Energie in irgendeiner anderen Form aufzunehmen.
Diese Aussage ist äquivalent zur Aussage, daß U eine Zustandsgröße ist.
Einige Folgerungen aus dem I. Hauptsatz
(für Systeme, die im ( p ,V , T )-Zustandsdiagramm beschrieben werden können; hier waren 2
Zustandsvariablen unabhängig.) U Zustandsgröße:
U = U ( p ,V ) , oder U = U ( p ,T ) ; U = U (V ,T )
Weil unterschiedliche funktionelle Abhängigkeiten möglich sind, ist es wichtig, klarzustellen,
welche Größe konstant bleibt, wenn eine andere variiert wird.
18
z. B.
∂U
∂T V
bedeutet: es wird die Funktion U = U (T ,V ) differenziert
und nicht etwa U = U (T , p ) .
Welche Größen man als unabhängige Variable ansieht, ist z.B. wichtig bei Berechnung der
Wärmekapazität.
C=
∆Q
δQ
=
∆T ∆T →0 dT
Wärme, die bei Temperaturerhöhung von dem Körper absorbiert wird.
dU = δQ − pdV - I. Hauptsatz als Ausgangspunkt
δQ = dU + pdV
1) V, T als unabhängige Zustandsvariable
∂U
∂U
U = U (T ,V ) ⇒ dU =
dT +
dV
∂T V
∂V
∂U
∂U
dT +
+ p dV = δQ
∂T V
∂V T
2) p, T als unabhängige Zustandsvariable
∂U
∂U
U = U (T , p ) ; dU =
dp ,
dT +
∂T p
∂p T
∂U
∂U
dp +
dT +
∂T p
∂p T
∂V
∂V
dV =
dT +
∂T p
∂p
∂V
∂V
dp = δQ
p
dT +
∂T p
∂p T
19
dp
T
∂U
∂U
∂V
∂V
+ p
dp = δQ
+ p
dT +
∂T p
∂T p
∂p T
∂p T
C ist offenbar davon abhängig davon, wie der Prozeß der Temperaturerhöhung abläuft, z. B.
ob bei konstantem Volumen oder bei konstantem Druck.
aus 1)
aus 2)
dV = 0
dp = 0
;
;
V = konst .
p = konst .
,
,
δQ
dT
V = konst.
∂U
= CV =
∂T V
p = konst
∂U
∂V
=
+ p
= Cp
∂T p
∂T p
δQ
dT
In der Regel ist C p ≠ CV . Unterschied in der Wärmekapazitäten resultiert aus der Tatsache,
daß bei p = konst . und variablem Volumen Arbeit geleistet wird.
Das Gewicht wird bei
Erwärmung ein Stück
nach oben geschoben.
V = konst.
p = konst.
(termo17.cw2)
Für ein ideales Gas gilt U = U (T ) , Theoretisches Argument: U nicht vom Volumen und nicht
vom Druck abhängig da keine Wechselwirkung der Teilchen.
20
Experiment: Gay-Lussac‘scher Überströmversuch (irreversible Gasexpansion).
isoliertes System:
δA = 0 , δQ = 0
(termo18.cw2)
dU = 0 , U = konst .
U 1 = U (V1 , T1 )
U 2 = U (V2 ,T2 ) = U 1
1: vor der Expansion, 2: nach der Expansion
U (V1, T1 ) = U (V2 , T2 )
Experimenteller Fakt: Keine (oder nahezu keine) Temperaturveränderung: T1 = T2 = T .
U (V1, T ) = U (V2 , T )
;
V1 ≠ V2
Schlußfolgerung: entweder V1 = V2 , was in der vorgegebenen Situation nicht gilt, oder U
unabhängig von V; Gutes experimentelles Beispiel für ein annähernd ideales Gas: Helium bei
Zimmertemperatur.
Also: U = U (T )
∂U
Daraus folgt (nur für ideales Gas):
∂T
∂U
=
= CV
V ∂ T p
V =
Unter Verwendung der Zustandsgleichung:
C p = CV + p
nR
p
,
C p − CV = nR
21
,
∂V
C p = CV + p
∂T p
nRT
nR
∂V
;
=
p
p
∂T p
Cp
Cp
n
−
CV
=R
n
C
, V
n
n
, {{
/
/
Molwärme (Wärmekapazität/Mol)
c p − cV = R > 0 , wichtige Formel der Thermodynamik.
Aus der kinetischen Gastheorie folgt für ein einatomiges Gas: cV =
2
5
R ⇒ cp = R
3
2
Adiabatische Zustandsänderungen
Treten auf, wenn das System thermisch isoliert ist. (Kein Austausch von Stoff oder Wärme,
nur von Arbeit)
δQ = 0
z. B. Gas Expansion, δA < 0
(System leistet Arbeit)
⇒ δU < 0
U = U (T )
ideales Gas: ⇒ Temperaturerniedrigung
dU = δQ + δA ,
Ideales Gas: wegen
dU + pdV = 0
dU
= CV folgt
dT
22
nRT
dV = 0
V
dT nRdV
+
=0
T
CV V
CV dT +
ln T +
R
ln V = konst .
cV
das bedeutet: TV R / cV = konst .
verwendet man:
R c p − cV c p
=
=
− 1 , mit κ > 1 ,
cV
cV
cV
{
κ
gilt:
T=
konst .
V κ −1
(adiabatische Zustandsgleichung)
Andere Formen :
TV κ
= konst .
V
nRT = pV
T
p
=
V nR
pV κ
= konst .
nR
pV κ = konst .
p
T = konst.
p=
konst .
isotherm
V
p=
konst .
adiabatisch
Vκ
δQ=0
V
(termo19.cw2)
Adiabaten sind im p-V-Diagramm steiler als
Isothermen
23
2.3.
II. Hauptsatz
I. Hauptsatz: Energieerhaltungssatz; es gibt keine Maschine, die Energie produziert.
Aber: keine Limitationen, wie eine Energieform in die andere überführt werden kann.
Erfahrung:
(Mech.) Arbeit
Wärme
Stein, der nach unten fällt:
→ Wärme:
stets vollständig möglich
→ Arbeit:
nicht unbegrenzt möglich
Umwandlung mechanischer Arbeit in Wärme
Umgekehrter Prozeß spontan nicht möglich.
Natürlich kann Wärme in Arbeit umgewandelt werden, aber es gibt Limitationen.
Erfahrungssätze:
Postulat von Lord Kelvin:
Eine Zustandsänderung, deren einziges Endergebnis darin besteht, Wärme aus einem
einzigen Reservoir zu extrahieren und diese in Arbeit umzuwandeln, ist unmöglich.
Äquivalent dazu ist das Postulat von Clausius:
Eine Zustandsänderung, deren einziges Endergebnis darin besteht, Wärme von einem Körper
der Temperatur T1 zu einem anderen Körper T2 mit T2 > T1 zu transportieren, ist unmöglich.
2.3.1. Der Carnot‘sche Kreisprozeß und Entropie als neue Zustandsgröße
24
Wir betrachten den folgenden Kreisprozeß, durchgeführt mit einem idealen Gas.
Quasi-statisch, d. h. unendlich langsam.
Adiabaten
V
p
A
T 2 > T1
Arbeit wird
dem System
zugeführt.
T2
B
D
Isothermen
T1
p
C
V
V
Arbeit wird
von dem System
geleistet.
(termo21.cw2)
p
(termo22.cw2)
Isothermen (1 Mol): pV = RT2 ,
pV = RT1
Adiabaten: pV κ = konst .
∆A
∆U
∆Q
nach Ablauf des Kreisprozesses hat das System Arbeit geleistet und es wurde Wärme
zugeführt
da U eine Zustandsgröße:
∆ U = ∆ A + ∆ Q = 0 , ∆U = 0 ⇒ ∆ A < 0 , ∆ Q > 0
Q ist keine Zustandsgröße, aber wir werden im folgenden sehen, dass man eine neue
Zustandsgröße (Entropie) einführen kann, die direkt von Q abhängt.
∆ A + ∆ Q2 + ∆ Q1 = 0 *)
25
∆ A : die am System geleistete Arbeit, − ∆ A : die vom System geleistete Arbeit (hier positiv)
∆Q2 , ∆Q1 : die von dem System (bei isothermen Abschnitten) aufgenommene Wärme.
Isotherme Zustandsänderungen laufen bei idealen Gasen ohne Änderung der inneren Energie
ab. Daher
B
B
B
∫ dU = 0 = ∫ δQ − ∫ pdV = ∆Q2 + AAB
A
A
,
∆Q2 = − AAB
A
Analog: ∆Q1 = − ACD
Berechnung von ∆Q1 und ∆Q2 über Berechnung der einzelnen Arbeitsanteile möglich
Abschnitt A → B , isotherme Expansion
VB
VB
VA
VA
AAB = − ∫ pdV = − ∫
RT2
V
dV = − RT2 ln B
V
VA
,
VB > VA , AAB < 0 : das System leistet
Arbeit, ∆Q1 > 0 , es wird Wärme aufgenommen.
Abschnitt C → D , isotherme Kompression ist analog zur isothermen Expansion:
VD
VD
VC
VC
ACD = − ∫ pdV = −
∫
RT1
V
dV = − RT1ln D
V
VC
, VD < VC , ACD > 0 , ∆Q1 < 0
Es wird Wärme abgegeben.
Bei reversibler Prozeßführung: läßt sich das Verhältnis ∆Q1 ∆Q2 durch das Verhältnis der
Temperaturen T1 und T2 ausdrücken. Beweis:
26
Wir hatten abgeleitet: ∆ Q2 = RT2 ln
VB
> 0,
VA
∆ Q1 = RT1 ln
VD
<0
VC
Punkte A und D sowie B und C liegen auf adiabatischer Kurve TV κ −1 = konst
κ −1
κ −1
TV
1 D = T2VA
κ −1
TV
= T2VBκ −1
1 C
Division
VDκ −1 VAκ −1
=
VCκ −1 VBκ −1
oder
∆ Q2 = RT2 ln
VB
VA
∆ Q1 = RT1 ln
VD
VC
∆Q1
T1
+
∆Q2
T2
VD VA
=
VC VB
T
∆ Q1
=− 1
V ∆Q2
T2
= − RT1 ln B
V A
=0
infinitesimale Änderungen:
δ Q1 δ Q2
+
=0
T1
T2
Ein beliebiger Kreisprozeß läßt sich stets auffassen als zusammengesetzt aus Isothermen und
Adiabaten, deshalb allgemein:
27
∫
δQ
T
=0
für einen beliebigen Kreisprozeß.
Wir haben eine neue Zustandsgröße gefunden. Hier abgeleitet aus Zustandsgleichung des
idealen Gases.
dS =
δQ
T
Wärme Q keine Zustandsgröße, aber S: Entropie
Diese Beziehung gilt für reversible Zustandsänderung (unendlich langsam).
B
B
A
A
δQrev
T
∫ dS =S B − S A = ∆S = ∫
Wirkungsgrad eines Carnot-Prozesses:
=7
− ∆4
A8
64
∆Q2 + ∆Q1
η=
∆Q2
η = 1+
, geleistete Arbeit im Verhältnis zu aufgewendeten Wärmemenge
∆Q1
T
T −T
= 1 − 1 = 2 1 , wegen T2 > T1 , 0 ≤ η ≤ 1
∆Q2
T2
T2
obige Formel gilt für reversible Zustandsänderungen. Wenn der Prozeß irreversibel ist oder
irreversible Anteile enthält, gilt
η=
∆Q2 + ∆Q1 T2 − T1
∆Q1
T
<
, also
< − 1 , weil die gewonnene Arbeit geringer ist als
∆Q2
T2
∆Q2
T2
∆Q2 + ∆Q1 (z.B. wird mehr Wärme abgegeben, Reibungsverluste o.ä.)
∆Q1
T1
+
∆Q2
T2
≤0
28
allgemeiner:
∫
δQ
T
≤ 0 bei irreversibler oder teilweise irreversiblen Prozessen.
Um die Entropieänderungen bei irrevbersiblen Prozessen zu berechnen, betrachtet man
reversible Ersatzprozesse, die den gleichen Ausgangs- und Endzustand haben:
A
reversibel, Ersatzprozeß
B
irreversibel
Wir betrachten obigen Prozess als Kreisprozess:
0≥∫
B δQ
A δQ
= ∫
+∫
T
T
T
A
irr B
rev
δQ
A
B δQ
B
+ dS = δQ + S − S
0 ≥ ∫
A
B
∫
∫
T
T
A
irr B
A
irr
B δQ
.
⇒ SB − S A ≥ ∫
T
A
irr
Erfolgt der irreversible Prozess in einem abgeschlossenen System, gilt δQirr = 0 ⇒
S B − S A = ∆S ≥ 0
In abgeschlossenen Systemen kann die Entropie nicht abfallen.
δS ges =
δQ
T
{
+ δSirr , mit δSirr > 0 : Entropieproduktion
dS rev
29
Formulierung des 2. Hauptsatzes nach Sommerfeld:
"Jedes thermodynamische System besitzt eine extensive Zustandsgröße S, die Entropie. Ihre
Zunahme bei reversiblen Zustandsänderungen berechnet man, indem man die zugeführte
Wärmemenge
durch
die
absolute
Temperatur
dividiert.
Bei
Zustandsänderungen wird im Inneren des Systems Entropie produziert."
Nachtrag: Arbeitsanteile bei adiabatischer Expansion und Kompression
B → C , adiabatische Expansion.
Hier gilt pV κ = konst . = k = p BV Bκ = pC VCκ
also:
VC
VC
k
ABC = − ∫ pdV = − ∫
VB V
VB
==
pC VCκ VC(1−κ )
1−κ
+
κ
dV = −
p BVBκ V B(1−κ )
1−κ
(
k
V (1−κ ) − V B(1−κ )
(1 − κ ) C
=
)
−1
(p V − p V )
(1 − κ ) C C B B
−R
(T − T ) = +CV (T1 − T2 )
(1 − κ ) 1 2
da T1 < T2 ist ABC < 0 , das System leistet Arbeit
D → A , adiabatische Kompression, umgekehrt analog zu 2.Schritt:
ADA = −CV (T1 − T2 ) = − ABC
ist also positiv, aufgenommene Arbeit
30
allen
irreversiblen