N intedanib * ( Va r ga tef
Werbung

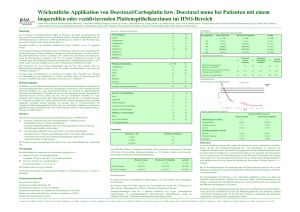
N i n t e d a n i b * ( Va r ga t e f ® ) HINTERGRUND 1. 2. 3. 4. 5. Was ist Nintedanib*? Wirkmechanismus Stand der Entwicklung Studiendaten Klinisches Potential 1. WAS IST NINTEDANIB*? Nintedanib* (Vargatef®) ist ein oraler 3-fach zielgerichteter Angiokinase-Hemmer, der simultan die Signalweiterleitung von Wachstumsfaktoren für drei Rezeptorfamilien blockiert: VEGFR 1–3 (vascular endothelial growth factor receptors 1–3), PDGFR alpha und beta (platelet-derived growth factor receptors alpha/beta) sowie FGFR 1–3 (fibroblast growth factor receptors 1–3).1 Alle drei Rezeptorfamilien sind von zentraler Bedeutung für die Ausbildung und Erhaltung neuer Blutgefäße (Angiogenese) und werden daher Angiokinasen genannt. Ihre Blockade könnte zu einer Inhibition der Angiogenese führen, die eine entscheidende Rolle beim Wachstum und bei der Ausbreitung von Tumoren spielt.2,3 Nintedanib* ist zur Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie zugelassen. Nintedanib* zeigte als Zweitlinientherapie in einer Phase-III-Studie in Kombination mit Docetaxel, im Vergleich zu Docetaxel allein, eine Verlängerung des medianen Gesamtüberlebens (sekundärer Studienendpunkt) in der Population der NSCLC-Patienten mit Adenokarzinom-Histologie auf über ein Jahr (12,6 Monate vs. 10,3 Monate). Der primäre Endpunkt dieser Phase-III-Studie, das progressionsfreie Überleben, wurde erreicht.12 2. WIRKMECHANISMUS Die Angiogenese ist ein essentieller Bestandteil von normalen Wachstums- und Entwicklungsprozessen des Körpers. Sie hat beispielsweise eine wichtige Funktion bei der Embryogenese, der Wundheilung und der Wiederherstellung des Blutflusses in verletztem Gewebe. Allerdings trägt die Angiogenese auch entscheidend dazu bei, dass Tumoren wachsen und in andere Organe metastasieren. Denn ab einer bestimmten Größe ist der Tumor auf die Rekrutierung von neuen Blutgefäßen angewiesen, die ihn zusätzlich mit Sauerstoff und Nährstoffen versorgen, damit er sich weiter ausbreiten kann.4 *Nintedanib ist in der Europäischen Union unter dem Markennamen Vargatef ® in Kombination mit Docetaxel zugelassen zur Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie. Stand: November 2016 © 2016 Boehringer Ingelheim GmbH & Co. KG. All rights reserved. N i n t e d a n i b * ( Va r ga t e f ® ) Der Prozess der Tumorangiogenese unterliegt einer strengen Regulierung und Kontrolle durch Wachstumsfaktoren, die von Tumorzellen und Zellen der Tumorumgebung (z. B. Stromazellen und Fibroblasten) freigesetzt werden. Die nachgeschaltete Weiterleitung der Signale erfolgt über Rezeptor-Tyrosinkinasen, die durch Bindung der Wachstumsfaktoren aktiviert werden. Angiogenese-Inhibitoren wie Nintedanib* greifen auf bestimmten Ebenen in die AngiogeneseSignalkaskade ein und können so möglicherweise Wachstum und Ausbreitung des Tumors unterdrücken. Anders als andere Angiogenese-Inhibitoren, die heute verfügbar sind, blockiert Nintedanib* simultan drei Rezeptorfamilien, die von zentraler Bedeutung für die Angiogenese sind: VEGF aktiviert den VEGFR, der bei endothelialen Zellen das Wachstum, die Teilung, die Resistenz gegenüber Apoptose und die Migration fördert.5 PDGF aktiviert den PDGFR, der die Migration und das Anhaften von Zellen kontrolliert und über Stimulierung der Perizyten Gefäßwände stützt und stabilisiert.6 FGF aktiviert den FGFR, der eine Signalkaskade auslöst, die ebenfalls die Migration und das Anheften von Zellen fördert und somit eine Rolle bei der Ausbildung und Stabilisierung von neuen Blutgefäßen spielt.7 Es wird davon ausgegangen, dass die Inhibition von VEGFR und FGFR die Ausbildung von neuen Tumorblutgefäßen beeinflusst. Die Inhibition von FGFR und PDGFR stört vermutlich die Reifung der Gefäße und die Aufrechterhaltung der vaskulären Integrität, was einen Einfluss auf das Tumorwachstum haben könnte.8,9,10 Darüber hinaus unterdrückt die simultane Inhibition von mehreren Rezeptorklassen inklusive FGFR und PDGFR womöglich Resistenzentwicklungen des Tumors über die Hemmung alternativer Signalwege. Zum Beispiel kann als Reaktion auf eine VEGFR-Blockade die Aktivierung der FGFR-Signalkaskade ein Escape-Mechanismus für Tumorwachstum sein.11 3. STAND DER ENTWICKLUNG BEI LUNGENKREBS In der doppelblinden, randomisierten Placebo-kontrollierten Phase-III-Studie LUME-Lung 1 wurden Wirksamkeit und Sicherheit von Nintedanib* in Kombination mit Docetaxel bei NSCLCPatienten nach Versagen einer Erstlinien-Chemotherapie untersucht. Sie schloss circa 1.300 Patienten mit einem NSCLC aller Histologien im Stadium IIIb/IV oder einem Rezidiv ein. Die Behandlung erfolgte mit Nintedanib* in Kombination mit Docetaxel, einer StandardChemotherapie für die Zweitlinie, im Vergleich zu Placebo plus Docetaxel. Die Ergebnisse der Studie wurden im Lancet Oncology 2014 publiziert.12 *Nintedanib ist in der Europäischen Union unter dem Markennamen Vargatef ® in Kombination mit Docetaxel zugelassen zur Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie. Stand: November 2016 © 2016 Boehringer Ingelheim GmbH & Co. KG. All rights reserved. N i n t e d a n i b * ( Va r ga t e f ® ) 4. STUDIENDATEN Wirksamkeit und Sicherheit Die klinische Wirksamkeit von Nintedanib* in Kombination mit Docetaxel wurde in der Zulassungsstudie LUME-Lung 1 im Vergleich zu Placebo plus Docetaxel gezeigt. Die LUME-Lung 1-Studie erreichte ihren primären Endpunkt: Die Kombination Nintedanib* plus Docetaxel verlängerte bei allen NSCLC-Patienten, unabhängig von der Tumorhistologie, signifikant das progressionsfreie Überleben (PFS) von 2,7 Monaten auf 3,4 Monate (HR=0,79; 95 % KI 0,68–0,92, p=0,0019).12 Zudem verlängerte Nintedanib* in Kombination mit Docetaxel im sekundären Hauptendpunkt in der präspezifizierten Studienpopulation der NSCLC-Patienten mit Adenokarzinom gegenüber Placebo plus Docetaxel das Gesamtüberleben von 10,3 Monaten unter Docetaxel allein auf 12,6 Monate (HR=0,83, 95 % KI 0,70–0,99, p=0,0359).12 Sogar Patienten mit aggressivem Krankheitsverlauf profitierten von der Therapie mit Nintedanib* plus Docetaxel: In der präspezifizierten Studienpopulation der Adenokarzinom-Patienten, die innerhalb von 9 Monaten nach Beginn der Erstlinientherapie einen Progress hatten, wurde unter Nintedanib* plus Docetaxel ein Überlebensvorteil von 3,0 Monaten erzielt, bei einem medianen Gesamtüberleben von 10,9 Monaten im Vergleich zu 7,9 Monaten unter DocetaxelMonotherapie (HR=0,75, 95 % KI 0,60–0,92, p=0,0073). Bei den refraktären Adenokarzinom-Patienten (Progress als bestes Ergebnis der Erstlinientherapie) lag der Überlebensvorteil unter Nintedanib* plus Docetaxel sogar bei 3,5 Monaten (medianes Gesamtüberleben: 9,8 Monate vs. 6,3 Monate unter Placebo plus Docetaxel [HR=0,62, 95 % KI 0,41–0,94, p=0,0246; explorative Analyse]). Die signifikante Verlängerung des Gesamtüberlebens unter Nintedanib* in Kombination mit Docetaxel zeigte sich nochmals deutlicher in einer Post-hoc-Analyse der Studienpopulation der Adenokarzinom-Patienten der geographischen Region Europa (Patienten aus Asien und Südafrika wurden ausgeschlossen) in der Zweitlinie: Diese Patienten profitierten von der Therapie mit Nintedanib* plus Docetaxel mit einer Verlängerung des Gesamtüberlebens im Median um 4,7 Monate im Vergleich zu Placebo plus Docetaxel (Median: 13,4 vs. 8,7 Monate; HR 0,79; p=0,0254).13 Zusammenfassend konnte mit Präsentation der Daten im Jahr 2013 nach beinahe 10 Jahren zum ersten Mal wieder ein signifikanter Überlebensvorteil bei der Zweitlinientherapie von NSCLC-Patienten nach Versagen der initialen Chemotherapie erzielt werden. Dieser Vorteil wurde gezeigt, ohne dass in der Studie die Kombinationstherapie die Lebensqualität gegenüber der Docetaxel-Monotherapie zusätzlich beeinträchtigt hat. Verträglichkeit Das Nebenwirkungsprofil von Nintedanib* ist gut handhabbar und die Hinzunahme zu Docetaxel führte nicht zu einem signifikanten Unterschied in der Lebensqualität. Zu den Nebenwirkungen, die unter der Kombination Nintedanib* plus Docetaxel häufiger waren als unter der Docetaxel-Monotherapie, gehörten gastrointestinale Beschwerden und reversible Leberenzym-Erhöhungen. Diese ließen sich durch supportive Therapien/Dosisreduktion gut beherrschen.12 *Nintedanib ist in der Europäischen Union unter dem Markennamen Vargatef ® in Kombination mit Docetaxel zugelassen zur Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie. Stand: November 2016 © 2016 Boehringer Ingelheim GmbH & Co. KG. All rights reserved. N i n t e d a n i b * ( Va r ga t e f ® ) Die Verträglichkeit von Nintedanib* zeigte sich auch in der guten Kombinierbarkeit mit verschiedenen Chemotherapeutika (z. B. Pemetrexed, Docetaxel oder Paclitaxel/Carboplatin).14,15,16,17 Die LUME-Lung 1-Studie bestätigte das Sicherheitsprofil von Nintedanib* aus früheren Studien. Nebenwirkungen, die als typisch in der Substanzklasse der Angiogenese-Inhibitoren angesehen werden, wie Hypertonie, thromboembolische Ereignisse und Blutungen, traten nur selten auf und waren insbesondere für Patienten mit Adenokarzinom nicht häufiger als unter Docetaxel allein. Mukositis und Hand-Fuß-Syndrom waren nicht in relevantem Umfang zu beobachten. Die Zahl der Studienabbrüche war in beiden Behandlungsarmen vergleichbar.12 Lebensqualität Die Auswertung von Standardfragebögen zur Lebensqualität zeigte zudem, dass unter der Kombinationstherapie Nintedanib* plus Docetaxel die Lebensqualität vergleichbar war wie unter Docetaxel-Monotherapie. Die Verlängerung des Überlebens durch die Nintedanib*Kombinationstherapie ging damit nicht zulasten der Lebensqualität der Patienten.18 5. KLINISCHES POTENTIAL Als Angiokinase-Inhibitor, der simultan drei für die Angiogenese zentrale Rezeptorfamilien blockiert (VEGFR 1–3, PDGFR alpha und beta sowie FGFR 1–3), könnte Nintedanib* möglicherweise bei einem breiten Spektrum an Krebserkrankungen einen wichtigen klinischen Nutzen erzielen. Mehr als 4.000 Krebspatienten wurden weltweit im Rahmen klinischer Studienprogramme bisher mit Nintedanib* behandelt. Nintedanib* ist der zweite zugelassene onkologische Wirkstoff von Boehringer Ingelheim. Im Jahr 2013 erfolgte die Markteinführung von Afatinib (GIOTRIF®), für EGFR-TKI-naive erwachsene Patienten mit lokal fortgeschrittenem und/oder metastasiertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit aktivierenden EGFR-Mutationen. Unter dem Handelsnamen Ofev® ist Nintedanib* in den USA und in Europa auch zur Therapie der idiopathischen Lungenfibrose (IPF) zugelassen.19,20 Nintedanib* wird derzeit bei Patienten mit verschiedenen soliden Tumoren geprüft. Phase-IIIStudien laufen beim therapierefraktären kolorektalen Karzinom21, beim Ovarialkarzinom22 sowie beim malignen Pleura-Mesotheliom.23 In Phase-II-Studien wird Nintedanib* beim Nierenzellkarzinom24 und beim hepatozellulären Karzinom25 evaluiert. *Nintedanib ist in der Europäischen Union unter dem Markennamen Vargatef ® in Kombination mit Docetaxel zugelassen zur Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie. Stand: November 2016 © 2016 Boehringer Ingelheim GmbH & Co. KG. All rights reserved. N i n t e d a n i b * ( Va r ga t e f ® ) QUELLEN 1 Hilberg F et al. BIBF1120: Triple angiokinase inhibitor with sustained receptor blockade and good anti-tumor efficacy. Cancer Research 2008;68(12):4774-4782. 2 Folkman N. Clinical Applications of Research on Angiogenesis. New England Journal of Medicine 1995;333:1757-1763. 3 Ellis LM, Hicklin DJ. VEGF-targeted therapy: mechanisms of anti-tumour activity. Nature Reviews Cancer 2008;8:579-591. 4 Weidner N et al. Tumor Angiogenesis: A New Significant and Independent Prognostic Indicator in Early-Stage Breast Carcinoma. Journal of the National Cancer Institute 1992;84:1875-1887. 5 Ferrara N et al. The biology of VEGF and its receptors. Nature Medicine 2003;9(6):669-676. 6 Andrae J et al. Role of platelet-derived growth factors in psychology and medicine. Genes & Development 2008;22:1276-1312. 7 Carmeliet P, Jain RK. Angiogenesis in cancer and other diseases. Nature 2000;407:249-573. 8 Yu J et al. J Biochem Mol Biol. 2003;36:49-59. 9 Hicklin DJ et al. Role of the Vascular Endothelial Growth Factor Pathway in Tumor Growth and Angiogenesis. Journal of Clinical Oncology 2005;23(5):1011-1027. 10 Heldin CH et al. High interstitial fluid pressure – an obstacle in cancer therapy. Nature Reviews Cancer 2004;4:806-813. 11 Santos ES et al. Targeting angiogenesis from multiple pathways simultaneously: BIBF 1120, an investigational novel triple angiokinase inhibitor. Invest New Drugs. 2012;30(3):1261-1269. 12 Reck M et al. Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated nonsmall-cell lung cancer (LUME-Lung 1): a phase 3, double-blind, randomised controlled trial. Lancet Oncol. 2014 Feb;15(2):143-55. Heigener D et al. Efficacy and safety of nintedanib/docetaxel in patients with lung adenocarcinoma: further analyses from the LUME-Lung 1 study. Ann Oncol. 2016;27(suppl 6):abstr 1276P. 13 14 Raymond E et al. A Phase I dose escalation and pharmacokinetic study of BIBF 1120, a novel tyrosine kinase inhibitor against VEGFR, PDGFR and FGFR, in combination with docetaxel in advanced chemonaive hormone refractory prostate cancer patients (HRPC). Eur J Cancer Suppl 2007;5:108 (abstract 704). 15 du Bois A et al. A phase I open-label dose-escalation study of oral BIBF 1120 combined with standard paclitaxel and carboplatin in patients with advanced gynecological malignancies. Ann Oncol 2010;21:370-5. 16 Ellis PM et al. Phase I open-label study of continuous treatment with BIBF 1120, a triple angiokinase inhibitor, and pemetrexed in pretreated non-small cell lung cancer patients. Clin Cancer Res 2010;16:2881-9. 17 Camidge DR et al. A Phase I open label study of continuous oral treatment with BIBF 1120 together with carboplatin and paclitaxel treated patients with non-small cell lung cancer (NSCLC): P3-138. J Thorac Oncol 2007;2(8, Suppl.4):S738. Novello S et al. WCLC 2013, Analysis of patient-reported outcomes from the LUME-Lung 1 trial a randomized, double-blind, placebo-controlled phase III study in second-line advanced non-small cell lung cancer patients. Idiopathische Lungenfibrose (IPF): Nintedanib* von Boehringer Ingelheim erhält FDA-Zulassung in den USA; Pressemitteilung von Boehringer Ingelheim vom 16.10.2014. OFEV® (Nintedanib) von Boehringer Ingelheim erhält EMA-Zulassung zur Behandlung der idiopathischen Lungenfibrose; Pressemitteilung von Boehringer Ingelheim vom 19.01.2015. Nintedanib (BIBF 1120) vs Placebo in Refractory Colorectal Cancer, https://clinicaltrials.gov/ct2/show/NCT02149108?term=nintedanib+colorectal&rank=2. 18 19 20 21 22 23 24 25 LUME-Ovar 1: Nintedanib (BIBF 1120) or Placebo in Combination With Paclitaxel and Carboplatin in First Line Treatment of Ovarian Cancer. Nintedanib (BIBF 1120) in Mesothelioma; http://clinicaltrials.gov/ct2/show/NCT01907100?term=nintedanib+mesothelioma&rank=1. Phase II: Compare Safety and Efficacy of BIBF 1120 Versus Sunitinib; http://clinicaltrials.gov/ct2/show/NCT01024920?term=Nintedanib+renal&rank=1. Phase I/II Comparison of Efficacy and Safety of BIBF 1120 and Sorafenib in Patients With Advanced Hepatocellular Carcinoma. Available at: clinicaltrials.gov/ct2/show/NCT01004003?term=nintedanib+hepatic+cancer&rank=2. *Nintedanib ist in der Europäischen Union unter dem Markennamen Vargatef ® in Kombination mit Docetaxel zugelassen zur Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinien-Chemotherapie. Stand: November 2016 © 2016 Boehringer Ingelheim GmbH & Co. KG. All rights reserved.