Charakterisierung der frühen Immunantwort auf A. salmonicida in
Werbung
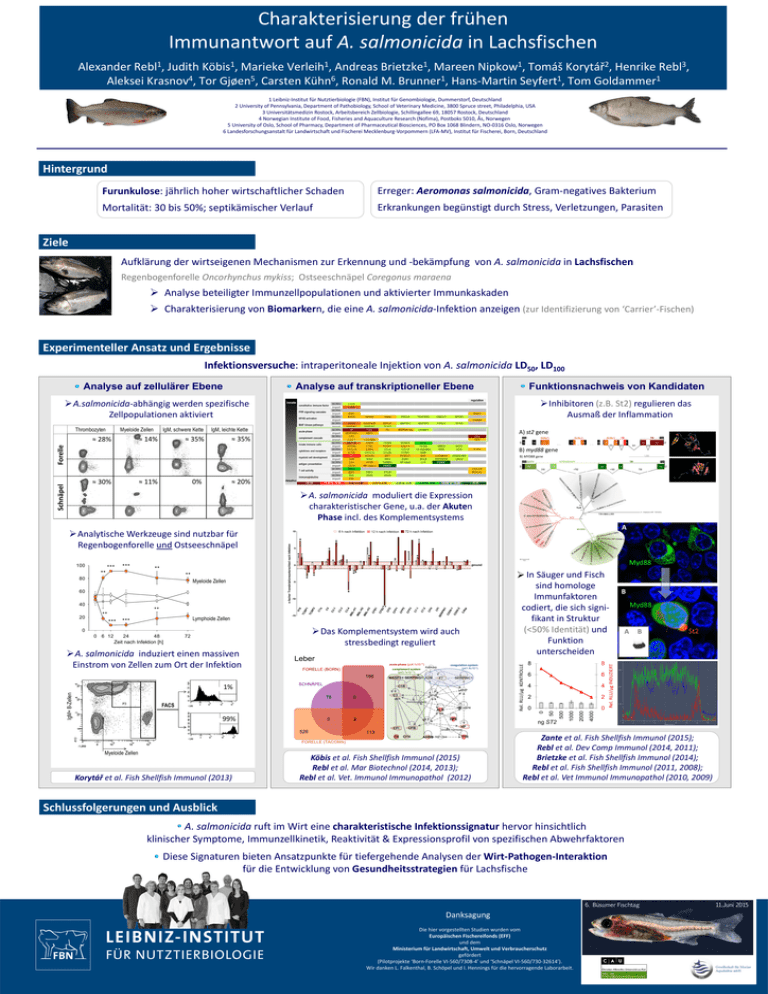
Charakterisierung der frühen Immunantwort auf A. salmonicida in Lachsfischen Alexander Rebl1, Judith Köbis1, Marieke Verleih1, Andreas Brietzke1, Mareen Nipkow1, Tomáš Korytář2, Henrike Rebl3, Aleksei Krasnov4, Tor Gjøen5, Carsten Kühn6, Ronald M. Brunner1, Hans‐Martin Seyfert1, Tom Goldammer1 1 Leibniz‐Institut für Nutztierbiologie (FBN), Institut für Genombiologie, Dummerstorf, Deutschland 2 University of Pennsylvania, Department of Pathobiology, School of Veterinary Medicine, 3800 Spruce street, Philadelphia, USA 3 Universitätsmedizin Rostock, Arbeitsbereich Zellbiologie, Schillingallee 69, 18057 Rostock, Deutschland 4 Norwegian Institute of Food, Fisheries and Aquaculture Research (Nofima), Postboks 5010, Ås, Norwegen 5 University of Oslo, School of Pharmacy, Department of Pharmaceutical Biosciences, PO Box 1068 Blindern, NO‐0316 Oslo, Norwegen 6 Landesforschungsanstalt für Landwirtschaft und Fischerei Mecklenburg‐Vorpommern (LFA‐MV), Institut für Fischerei, Born, Deutschland Hintergrund Furunkulose: jährlich hoher wirtschaftlicher Schaden Erreger: Aeromonas salmonicida, Gram‐negatives Bakterium Mortalität: 30 bis 50%; septikämischer Verlauf Erkrankungen begünstigt durch Stress, Verletzungen, Parasiten Ziele Aufklärung der wirtseigenen Mechanismen zur Erkennung und ‐bekämpfung von A. salmonicida in Lachsfischen Regenbogenforelle Oncorhynchus mykiss; Ostseeschnäpel Coregonus maraena Analyse beteiligter Immunzellpopulationen und aktivierter Immunkaskaden Charakterisierung von Biomarkern, die eine A. salmonicida‐Infektion anzeigen (zur Identifizierung von ‘Carrier’‐Fischen) Experimenteller Ansatz und Ergebnisse Infektionsversuche: intraperitoneale Injektion von A. salmonicida LD50, LD100 Analyse auf zellulärer Ebene Analyse auf transkriptioneller Ebene Funktionsnachweis von Kandidaten Inhibitoren (z.B. St2) regulieren das Ausmaß der Inflammation A.salmonicida‐abhängig werden spezifische Zellpopulationen aktiviert Thrombozyten Myeloide Zellen IgM, schwere Kette ≈ 14% A) st2 gene ≈ 35% ≈ 35% Forelle ≈ 28% IgM, leichte Kette B) myd88 gene ≈ 11% Schnäpel ≈ 30% 0% ≈ 20% A. salmonicida moduliert die Expression charakteristischer Gene, u.a. der Akuten Phase incl. des Komplementsystems A Analytische Werkzeuge sind nutzbar für Regenbogenforelle und Ostseeschnäpel 60 40 20 ** ** *** Lymphoide Zellen *** Das Komplementsystem wird auch stressbedingt reguliert 0 0 6 12 24 48 Zeit nach Infektion [h] 72 Rel. RLU/µg KONTROLLE A. salmonicida induziert einen massiven Einstrom von Zellen zum Ort der Infektion IgM+ B-Zellen 1% FACS 99% Myeloide Zellen Korytář et al. Fish Shellfish Immunol (2013) 8 8 6 6 4 4 2 2 0 0 ng ST2 Köbis et al. Fish Shellfish Immunol (2015) Rebl et al. Mar Biotechnol (2014, 2013); Rebl et al. Vet. Immunol Immunopathol (2012) B Myd88 A B St2 Rel. RLU/µg INDUZIERT Myeloide Zellen In Säuger und Fisch _ sind homologe Immunfaktoren codiert, die sich signi‐ fikant in Struktur (<50% Identität) und Funktion unterscheiden 4000 ** 80 2000 ** 1000 ** Myd88 500 *** 50 *** 0 100 Zante et al. Fish Shellfish Immunol (2015); Rebl et al. Dev Comp Immunol (2014, 2011); Brietzke et al. Fish Shellfish Immunol (2014); Rebl et al. Fish Shellfish Immunol (2011, 2008); Rebl et al. Vet Immunol Immunopathol (2010, 2009) Schlussfolgerungen und Ausblick A. salmonicida ruft im Wirt eine charakteristische Infektionssignatur hervor hinsichtlich klinischer Symptome, Immunzellkinetik, Reaktivität & Expressionsprofil von spezifischen Abwehrfaktoren Diese Signaturen bieten Ansatzpunkte für tiefergehende Analysen der Wirt‐Pathogen‐Interaktion für die Entwicklung von Gesundheitsstrategien für Lachsfische 6. Büsumer Fischtag Danksagung Die hier vorgestellten Studien wurden vom Europäischen Fischereifonds (EFF) und dem Ministerium für Landwirtschaft, Umwelt und Verbraucherschutz gefördert (Pilotprojekte ‘Born‐Forelle VI‐560/7308‐4’ und ‘Schnäpel VI‐560/730‐32614’). Wir danken L. Falkenthal, B. Schöpel und I. Hennings für die hervorragende Laborarbeit. 11.Juni 2015











