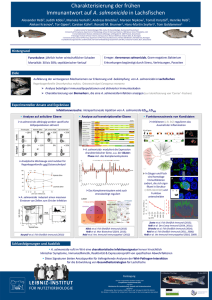
Das angeborene Immunsystem bei der UV-Antwort
Werbung

MolCare Consulting | Dr. Bernd Becker | Schulsiedlung 6 | D-93109 Wiesent | Mobil: +49 173 66 79 505 - Tel: +49 9482 9099 036 - Fax: +49 9482 9099 037 - E-Mail: [email protected] Das angeborene Immunsystem bei der UV-Antwort Die Rezeptoren des angeborenen Immunsystems besitzen die Eigenschaft viele unterschiedliche chemische Strukturen zusätzlich zu den Strukturen mikrobieller, potenzieller Krankheitserreger zu erkennen. Eine weitere, wichtige und umfassende Gruppe solcher Strukturen stellen endogen exprimierte Moleküle dar. Während des Zelltods werden die zellulären Kompartimente aufgelöst und viele dieser zellulären Strukturen werden in den extrazellulären Raum freigesetzt. Als direkte Konsequenz wird eine Immunantwort ausgelöst [1]. Ähnlich wie bei der Konfrontation mit Strukturen eines mikrobiellen Erregers werden die Molekülstrukturen als „fremd“ von den „Pattern Recognition Receptors (PRRs) erkannt, was mit der Auslösung einer Entzündungsreaktion einhergeht. Begleitet wird die Reaktion von der typischen Rekrutierung von Lymphozyten [2]. UVB-Strahlung kann die IL1? Aktivierung und Ausschüttung der Inflammasomen induzieren [3, 4]. Der UV-induzierte programmierte Zelltod geht einher mit der Aktivierung der Kinasen RIPK1 und RIPK3, ein Vorgang, der mit dem Begriff „Nekroptose“ belegt wurde [5, 6]. Durch die Nekroptose werden viele Proteinmoleküle aus den Zellen in den estrazellulären Raum freigesetzt. Darunter HMGB1 [7]), S100 Proteine [8], Hitzeschockproteine [9], ATP [10], Harnsäure [11], Hyaluronsäure [12, 13], Chromatin [14]), und RNA [15-18]. Der Einfluss UVgeschädigter Zellen auf das angeborene Immunsystem wurde auffallender, als gezeigt werden konnte, das der Toll-ähnliche Rezeptor (“Toll-like receptor”) TLR3 RNA-Moleküle, die aus nekroptotischen Zellen nach UV-Bestrahlung freigesetzt worden sind, binden kann und dadurch eine Entzündungsreaktion auslöst. Darüber hinaus kommt es zu einer Induktion der Expression von Genen, die in die Reparatur der Barrierefunktion der Haut involviert sind. Literatur 1. Borkowski, A.W. and R.L. Gallo, UVB Radiation Illuminates the Role of TLR3 in the Epidermis. J Invest Dermatol, 2014. 134(9): p. 2315-20. 2. Ichihashi, M., et al., UV-induced skin damage. Toxicology, 2003. 189(1-2): p. 21-39. 3. Martinon, F., K. Burns, and J. Tschopp, The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell, 2002. 10(2): p. 417-26. 4. Ogura, Y., F.S. Sutterwala, and R.A. Flavell, The inflammasome: first line of the immune response to cell stress. Cell, 2006. 126(4): p. 659-62. 5. Cho, Y.S., et al., Phosphorylation-driven assembly of the RIP1-RIP3 complex regulates programmed necrosis and virus-induced inflammation. Cell, 2009. 137(6): p. 1112-23. 6. Kaczmarek, A., P. Vandenabeele, and D.V. Krysko, Necroptosis: the release of damage-associated molecular patterns and its physiological relevance. Immunity, 2013. 38(2): p. 209-23. 7. Scaffidi, P., T. Misteli, and M.E. Bianchi, Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature, 2002. 418(6894): p. 191-5. 1/2 8. Ryckman, C., et al., Proinflammatory activities of S100: proteins S100A8, S100A9, and S100A8/A9 induce neutrophil chemotaxis and adhesion. J Immunol, 2003. 170(6): p. 3233-42. 9. Basu, S., et al., Necrotic but not apoptotic cell death releases heat shock proteins, which deliver a partial maturation signal to dendritic cells and activate the NF-kappa B pathway. Int Immunol, 2000. 12(11): p. 1539-46. 10. Bours, M.J., et al., Adenosine 5'-triphosphate and adenosine as endogenous signaling molecules in immunity and inflammation. Pharmacol Ther, 2006. 112(2): p. 358-404. 11. Shi, Y., J.E. Evans, and K.L. Rock, Molecular identification of a danger signal that alerts the immune system to dying cells. Nature, 2003. 425(6957): p. 516-21. 12. Scheibner, K.A., et al., Hyaluronan fragments act as an endogenous danger signal by engaging TLR2. J Immunol, 2006. 177(2): p. 1272-81. 13. Taylor, K.R., et al., Hyaluronan fragments stimulate endothelial recognition of injury through TLR4. J Biol Chem, 2004. 279(17): p. 17079-84. 14. Ishii, K.J., et al., Genomic DNA released by dying cells induces the maturation of APCs. J Immunol, 2001. 167(5): p. 2602-7. 15. Bernard, J.J., et al., Ultraviolet radiation damages self noncoding RNA and is detected by TLR3. Nat Med, 2012. 18(8): p. 1286-90. 16. Cavassani, K.A., et al., TLR3 is an endogenous sensor of tissue necrosis during acute inflammatory events. J Exp Med, 2008. 205(11): p. 2609-21. 17. Kariko, K., et al., mRNA is an endogenous ligand for Toll-like receptor 3. J Biol Chem, 2004. 279(13): p. 12542-50. 18. Lai, Y., et al., Commensal bacteria regulate Toll-like receptor 3-dependent inflammation after skin injury. Nat Med, 2009. 15(12): p. 1377-82. 2/2 Powered by TCPDF (www.tcpdf.org)