Cytokine und Chemokine
Werbung

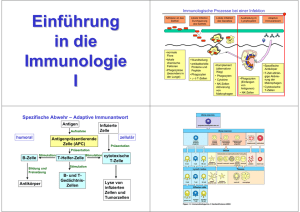
TC/DC Prof. Dr. Albert Duschl Das Problem Wesentliche Medikamente laufen aus dem Patentschutz oder sind bereits auf dem Generikamarkt angekommen. Für das profitabelste Medikament der Welt (Umsatz $100 Mrd!), den Cholesterinsenker Lipitor (atorvastatin), ist der Patentschutz am 30. November 2011 ausgelaufen. Das Problem dabei: Wie können Pharmafirmen bei sinkenden Margen die teure Neuentwicklung von Medikamenten finanzieren? © Nature vol 480, 1. 12. 2011 Ihr Arbeitsplatz Die Ausgaben für bestimmte Klassen von Medikamenten korrelieren recht gut mit den verfügbaren Arbeitsplätzen. Suchen Sie sich also ein Gebiet mit Zukunft aus. Immunologie ist gut vertreten (respiratory agents, autoimmune agents, teils HIV antivirals). Viele Medikamente in diesen Bereichen wirken symptomatisch. Überlegen wir uns statt dessen doch mal die kausale Seite der Immunologie: Die Auslösung von Immunantworten über die DC/TC Wechselwirkung. © Nature vol 480, 1. 12. 2011 Dendritische Zellen DC wurden zuerst als „akzessorische Zellen“ beschrieben, die notwendig waren um T-Zellen Immunantworten zu erlauben. Aus den sehr unterschiedlichen Bystander-Zellen wurde ein Zelltyp charakterisiert durch hohe Plastikadhärenz, wenig Lysosomen, ohne Fc-Rezeptoren und gering endozytisch. Die Zellen bildeten lange, verzweigte Fortsätze aus: Dendriten. Wenige DC waren ausreichend um sowohl CD4+ T-Helferzellen als auch CD8+ CTL zu aktivieren, selbst bei niedrigen Antigendosen. Erforderlich dafür waren bestimmte MHC Komplexe: MHC I bzw. MHC II. ► DC präsentieren über Ihren MHC Komplex antigene Peptide, die vom TCR der T-Zellen erkannt werden: Kognate Stimulierung der T Zellen. © Wikimedia Commons Differenzierung/Maturierung Fast alle DC differenzieren aus Vorläuferzellen im Blut, die ihrerseits aus dem Knochenmark hervorgehen. Man kann in vitro in Monozyten mit GM-CSF und IL-4 eine Differenzierung zu moDC (monocyte-derived DC) auslösen. Differenzierte DC finden sich in Geweben und werden dort bei Kontakt mit Antigenen aktiviert. Dies führt zur Maturierung, die man in vitro mit Antigenen und PRR Liganden erreichen kann. Allerdings … manche DC Typen (Langerhans-Zellen in Haut und Mucosa, Mikroglia im Gehirn) erneuern sich lokal … und niemand hat bisher gezeigt daß Monozyten in vivo zu DC differenzieren. © Paul: Fundamental Immunology Stammbaum Human Stem Cells (HSC) im Knochenmark differenzieren über Common Myeloid Progenitor (CMP) und Granulocyte Macrophage Progenitor (GMP) in Macrophage and DC Progenitor (MDP). Daraus entstehen entweder Monozyten oder Common DC Progenitor (CDP). Monozyten und DC sind daher nahe verwandt, unterscheiden sich aber. Entsprechend sind „moDC“ nicht wirklich DC. Ihr grosser Vorteil: Sie sind verlässlich in grösseren Mengen herstellbar. Eine entsprechende Quelle in der Maus ist Knochenmark: BMDDC. © Chow et al. Nat Rev Immunol. 11:788-798 (2011) DC Subsets Blut enthält im Menschen wenigstens drei Subsets von DC: CD141+ myeloide DC, CD11c+ myeloide DC und plasmacytoide DC. Funktionen und Marker sind unterschiedlich, die Zellen stammen aber wohl von der gleichen Vorläuferzelle ab. Für die Maus ist das allerdings klarer gezeigt als für den Menschen. Die myeloiden DC sind die „klassischen“ DC, wobei die beiden Subtypen davon für CD4+ T-Helferzellen und CD8+ CTL zuständig sind. Plasmacytoide DC produzieren grosse Mengen an IFNsind also auch ohne Zell-Zell-Kontakt aktiv. © Collin et al. Nat Rev Immunol. 11:575-83 (2011) DC als Signalsystem DC sind Sensoren für Non-Self (Bsp. Bakterien) da sie Rezeptoren dafür tragen, wie unterschiedliche TLR and NLR. Sie sind Signalmodulatoren, weil sie aus ganzen Antigenen Peptidfragmente herstellen, die im Kontext von MHCKomplexen von T-Zell Rezeptoren erkannt werden können. Weiterhin sind sie Aktivatoren, weil sie generelle T-Zell-Aktivierungssignale wie CD80/CD86 zur Verfügung stellen. Und sie sind Differenzierungsauslöser, weil sie über separate Signale die Differenzieung von speziellen T-ZellSubtypen anregen. © Collin et al. Nat Rev Immunol. 11:575-83 (2011) Sensoren:TLR (a) Pattern Recognition Rezeptoren (PRR) sind in der innate Immunity dafür zuständig, non-self zu erkennen, obwohl nebenbei auch Danger Associated Molecular Patterns (DAMPs) erkannt werden. DAMPs sind self-Moleküle (wie ATP) die als Alarmsignal verwendbar sind. Die bekannteste Gruppe von PRR sind die Toll Like Rezeptoren (TLR). Beachten Sie die teils erheblichen Unterschiede zwischen Maus und Mensch. Die Expression von TLRs unterscheidet sich auch je nach Zelltyp und sie erlaubt ebenfalls die Differenzierierung von einzelnen DC-Subtypen. TLRs sind wichtige Marker bei der Typisierung von DCs. © Kropshofer and Vogt: Antigen Presenting Cells Sensoren:TLR (b) Antibakterielle TLR (2, 4, 5) sind in der Cytoplasmamembran lokalisiert, antivirale (3, 7/8, 9) in endosomalen Kompartimenten. Man sieht daß DC - im Gegensatz zu moDC und Monozyten - LPS nicht sonderlich gut erkennen. Wie kann man dem moDC Problem entkommen? Es lassen sich aus peripherem Blut oder Geweben primäre humane DC gewinnen. Man kann sie auch sehr gut durch Antigene und andere passende Stimuli aktivieren. Nachteile: Schwierig, teuer, nur geringe Ausbeute. Erhebliche Person-to-Person Variation. © Kropshofer and Vogt: Antigen Presenting Cells © Lombardi and Vasquez: Dendritic Cells Sensoren:NLR NOD-like Rezeptoren (NLR) decken ein sonst nicht überwachtes Kompartiment ab: Das Cytosol. Sie erkennen Peptidoglycane (Komponenten bakterieller Zellwände). NOD2 reagiert auf muramyl dipeptide (MDP) und NOD1 reagiert auf mesodiaminopimelic acid (mDAP oder ieDAP). NOD 1 und NOD2 sind die am besten untersuchten Vertreter der Familie, aber es nicht einmal klar ob MDP und ieDAP direkte Liganden sind. Interaktion in der Signalübertragung verbindet TLR- und NLR-Signale. PAMP: Pathogen Associated Molecular Pattern. © Kanneganti et al., Immunity 27:549-559 (2007) Signalmodulation Das Antigen ist üblicherweise ein non-self Peptid, obwohl natürlich auch self Peptide andauernd präsentiert werden. Gezeigt ist die Produktion von Peptiden für MHC I. Für MHC II Präsentation gibt es andere Mechanismen, da keinesfalls selfund non-self-Peptide im falschen MHC auftauchen dürfen. Das Signal (PAMP + Antigen) wird übersetzt in eine Form auf die die T-Zellen reagieren können: Peptid/MHC-Komplexe plus Aktivierungssignale. © Kropshofer and Vogt: Antigen Presenting Cells T-Aktivierung / Differenzierung Coaktivatioren können allgemein für die vollständige Aktivierung von T-Zellen erforderlich sein. Ohne diese Co-Signale gehen T-Zellen in Anergie. CD28 Stimulierung via CD80/86 ist z.B. essentiell für T-Aktivierung. Inhibierende Signale gibt es ebenfalls. Andere Coaktivatoren induzieren die Differenzierung von spezifischen T-Subsets. Programmed Death Ligand 1 (PD-L1) verstärkt z.B. TH1 Antworten, während PD-L2 Differenzierung von TH2 Zellen favorisiert. Inducible T cell costimulator ligand (ICOSL) ist für die Differenzierung von TFH-Zellen erforderlich. © Kropshofer and Vogt: Antigen Presenting Cells CD-28 Familie Viele der beteiligten Adhäsionsmoleküle sind Verwandte von CD28, bilden also eine Unterfamilie der Immunglobulin-Superfamilie. Die Strukturen sind ähnlich aber die Bindungspartner sind überwiegend sehr spezifisch. Die Funktion ist aus der Struktur also nicht direkt ablesbar, obwohl bestimmte Bindungsmotive inzwischen bekannt sind. © Sharpe and Freeman, Nat Rev Immunol. 2:116-26 (2002) TH: 1-X Das Verzeichnis der THelferzell-Subsets wächst immer noch weiter. Ziemlich klar sind TH1 (Auslösung von Entzündung), TH2 (Parasiten, Allergien), TH9 (Unterstützung für TH2 und TH17?), TH17 (anhaltende Entzündung), Treg (Immunsuppression) TFH (Follicular helper T-cells: Stimulierung von B-Zellen in B Zell Follikelen, B Memory). Die Differenzierungswege sind komplexer als gedacht, Modell a (rechts) ist sicher zu einfach. © King, Nat Rev Immunol 9:757-66 (2009) Plastizität T-Zellen bewahren sich eine wesentlich höhere Plastizität als früher vermutet, was für Problemfälle wie TH2 und TH17 einige Hoffnungen auf Therapieoptionen weckt. Es ist aber notorisch schwierig, T-Zell bestimmte Antworten in Patienten umzulenken oder abzubrechen. Probleme für Sie*: Die Regulierung von T-Zellen in laufenden Immunantworten ist nicht gut verstanden und neben T-Zellen spielen auch weitere Zelltypen eine wichtige Rolle. *Ihr Arbeitsplatz! © King, Nat Rev Immunol 9:757-66 (2009) DC als Target DC als Schlüsselzellen sowohl der adaptiven als auch der angeborenen Immunität sind potenzielle Ziele für Therapien*. Mögliche Targets: PRR, Peptid-Pathways in der Zelle, intrazelluläre Signalmoleküle, sezernierte Cytokine und Chemokine, Adhäsionsmoleküle, Signale zur allgemeinen Aktivierung oder speziellen Differenzierung von T-Zellen. Zu schlagen wären 100 Mrd Umsatz … © Kropshofer and Vogt: Antigen Presenting Cells *Ihr Arbeitsplatz!