Laborgemeinschaft 1
Werbung

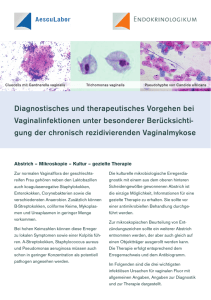
Laborgemeinschaft Institut für medizinische & molekulare Diagnostik AG. Zürich Info Atopobium vaginae 1. Bedeutung Atopobium vaginae wurde 1999 als species nova im Genus Atopobium beschrieben, welches 1992 nach der Überarbeitung der Gattung Lactobacillus neu geschaffen worden war. Das Isolat stammte aus dem Vaginalsekret einer "gesunden Person" [1]. 2003 wurde Atopobium vaginae zum ersten Mal als Erreger bekannt, nachdem es als einziger Mikroorganismus aus einem Tuboovarialabszess isoliert worden war [2]. Das Bakterium ist ein kleines, kokkoides, Gram positives, unbewegliches, nicht Sporen bildendes Stäbchen, das sich nur unter strikt anaeroben Bedingungen züchten lässt [1]. Die neuen Erkenntnisse basieren fast ausschliesslich auf molekularen Methoden, die sich zum Nachweis anspruchsvoller Erreger längst bewährt haben [3]. Bei der Unter-suchung der vaginalen Mikroflora von Patientinnen mit bakterieller Vaginose (BV) wurde Atopobium vaginae häufig als einziger oder prädominanter Keim vorgefunden, was als Hinweis auf einen Zusammenhang zwischen dieser Affektion und Atopobium vaginae erachtet wird. Je nach Studie und verwendeter molekularer Technik wurde es bei 45 bis 70% der Patientinnen mit BV nachgewiesen, bei intakter Flora hingegen in keinem Fall oder bei nur etwa 8% [4,5,6,7]. In 45 laparoskopisch entnommenen Proben von Patientinnen mit gesicherter Salpingitis wurde mit der 16S rDNA PCR in 11 Fällen bakterielle DNA gefunden, wovon in 2 solche von Atopobium vaginae [8]. Die BV ist eine der häufigsten Affektionen der Scheidenschleimhaut. Etwa die Hälfte der betroffenen Frauen haben Beschwerden, nämlich vermehrten, dünnflüssigen, fischig riechenden Ausfluss und gelegentlich Irritationen im Bereich der Vulva. Die BV selbst gilt nicht als sexuell übertragbar, sie soll jedoch das Risiko für aufsteigende Genital-infekte (PID) erhöhen und die Übertragung von STD-Erregern inklusive HI Virus erleichtern. Zunehmend wird sie mit Komplikationen in der Schwangerschaft wie Spontanabort, vorzeitigem Blasensprung, Chorioamnionitis, Frühgeburt, postpartaler Endometritis etc. in Verbindung gebracht [Literaturreferenzen in 5,6,9]. Es ist bis heute nicht geklärt, aus welchem Grund das vaginale Mikroökosystem aus dem Gleichgewicht gerät, d.h. die zur Hauptsache aus Lactobacillen bestehende normale Standortflora überwuchert wird von verschiedenen anaeroben gramnegativen und anderen Bakterien. Einige, z.B. Bacteroides sp., Prevotella sp., Mycoplasma hominis, Mobiluncus sp., vor allem aber Gardnerella vaginalis, sollen eine wichtige Rolle spielen [9]. Ein ursächlicher Keim steht aber bis heute nicht fest. Das Wissen basierte vordem einzig auf kulturellen Untersuchungen. Die Vagina beherbergt jedoch eine sehr komplexe Flora, worunter auch viele anspruchsvolle Bakterien. Es ist wahrscheinlich - und Atopobium vaginae ist dafür ein gutes Beispiel - dass weitere, bis anhin noch nicht kultivierte oder nicht identifizierte Keime eine wichtige(re) Rolle bei der BV spielen als die heute vermuteten. Der vermehrte Einsatz kulturunabhängiger Methoden kann zum besseren Verständnis der vaginalen Mikroflora beitragen, möglicherweise auch zur Klärung der Ursachen für die Störung des Ökosystems und zu weiteren Erkenntnissen über verantwortliche Erreger [7]. Atopobium vaginae ist von Natur aus Metronidazol resistent. Das könnte einige der Fälle, die auf die klassische Behandlung der BV nicht ansprechen, erklären [2,6]. WebSite www.lg1.ch Konsilium All Content Copyright© LG1/IMD Okt. 2006/190405 1 2. Nachweismethoden Die Diagnose BV wird anhand von klinischen Kriterien und mit der Gramfärbung eines Abstrichs gestellt. Dünnflüssiger, homogener Fluor, pH der Vaginalflüssigkeit >4.5, Fischgeruch (besonders nach Zugabe von 10% KOH), mikroskopischer Nachweis von sogenannten "clue cells" und von charakteristischen bakteriellen Morphotypen in hoher Zahl auf Kosten der Laktobazillen gelten als charakteristisch. Eine Kultur wird nicht empfohlen, es sei denn, es finden sich Leukozyten im Präparat, die auf eine mögliche Begleitinfektion hinweisen [10,11]. Der kulturelle Nachweis von Atopobium vaginae ist langwierig, technisch und zeitlich aufwändig. Die sehr kleinen Kolonien können zudem rasch von anderen, schnell wachsenden Begleitkeimen überwuchert werden. Wir verwenden eine spezies-spezifische PCR, basierend auf dem 16S rRNA Gen, deren Sensitivität derjenigen mit universellen bakteriellen Primer überlegen ist [5]. Der Nachweis erfolgt innerhalb von 1-2 Tagen und erlaubt somit ein Resultat im Zeitraum einer allenfalls gleichzeitig laufenden kulturellen Untersuchung. 3. Therapie Clindamycin ist das Antibiotikum der Wahl [6]. 4. Untersuchungsmaterial Folgende Materialien sind für eine Untersuchung auf Atopobium vaginae geeignet: • Vaginalabstrich • Douglas-Punktat • Laparoskopisch entnommene Proben (Salpinx, Ovar, pelvines Peritoneum) 5. Literatur [1] M. Rodriguez Jovita, M.D. Collins, B. Sjödén, E. Falsen. Characterization of a novel Atopobium isolate from the human vagina: description of Atopobium vaginae sp. nov. Int. J. Syst. Bacteriol.1999, 49:1573-1576. [2] W. Geissdörfer, C. Böhmer, K. Pelz, C. Schoerner, W. Frobenius, C. Bogdan. Tuboovarian abscess caused by Atopobium vaginae following oocyte recovery. J. Clin. Microbiol. 2003, 41:2788-2790. [3] D.A. Relman. New technologies, human-microbe interactions, and the search for previously unrecognized pathogens. J. Infect. Dis. 2004, 186(Suppl 2):S254-258. http://www.journals.uchicago.edu/JID/journal/issues/v186nS2/020550/020550.web.pdf [4] J.P. Burton, E. Devillard, P.A. Cadieux, J.-A. Hammond, G. Reid. Detection of Atopobium vaginae in postmenopausal women by cultivation-independent methods warrants further investigation. J. Clin. Microbiol. 2004, 42:1829-1831. [5] M.J. Ferris, A. Masztal, D.H. Martin. Use of species-directed 16S rRNA gene primers for detection of Atopobium vaginae in patients with bacterial vaginosis. J. Clin. Microbiol. 2004, 42:5892-5894. [6] M.J. Ferris, A. Masztal, K.E. Aldridge, J.D. Fortenberry, P.L. Fidel Jr., D.H. Martin. Association of Atopobium vaginae, a recently described metronidazole resistant anaerobe, with bacterial vaginosis. BMC Infect. Dis. 2004, 4:5-12. http://www.biomedcentral.com/1471-2334/4/5 [7] R. Verhelst, H. Verstraelen, G. Claeys, G. Verschraegen, J. Delanghe, L. Van Simaey, C. De Ganck, M. Temmermann, M. Vaneechoutte. Cloning of 16S rRNA genes amplified from normal and disturbed vaginal microflora suggests a strong association between Atopobium vaginae, Gardnerella vaginalis and bacterial vaginosis. BMC Microbiol. 2004, 4:16. http://www. biomedcentral.com/1471-2180/4/16 [8] J.K. Hebb, C.R. Cohen, S.G. Astete, E.A. Bukusi, P.A. Totten. Detection of novel organisms associated with salpingitis, by use of 16S rDNA polymerase chain reaction. J. Infect. Dis. 2004,190:2109-2120. [9] A.A. Aroutcheva, J.A. Simoes, K. Behbakht, S. Faro. Gardnerella vaginalis isolated from patients with bacterial vaginosis and from patients with healthy vaginal ecosystems. Clin. Infect. Dis. 2001, 33:1022-1027. [10] J. Martius, U.B. Hoyme. Empfehlungen zur bakteriellen Vaginose in Gynäkologie und Geburtshilfe 2001, aktualisiert 2004. Deutsche Gesellschaft für Gynäkologie und Geburtshilfe. www.dggg.de/leitlinien/pdf/2-4-3.pdf [11] Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines 2002. Morbid. Mortal. Weekly Rep. 2002, 51:42-44. WebSite www.lg1.ch Konsilium All Content Copyright© LG1/IMD Okt. 2006/190405 2