WÄRME I
Werbung

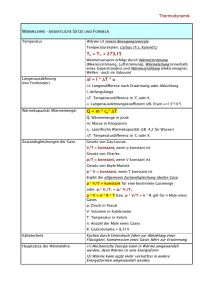
Physik für Pharmazeuten und Biologen WÄRME I Wärmeenergie und Temperatur Beschreibung des Zustands von Gasen Wärmekapazität Wärme • wozu Wärmelehre ? Temperatur bin ich mittags größer als am morgen ? wieso wird Sodaflasche kalt, wenn Gas einströmt ? und warum ist der Kühlschrank kalt ? wie baue ich ein perpetuum mobile ? wieso wird Fleisch im Druckkochtopf schneller gar? Reaktionskinetik ........ 2 Wärme 3.1 Wärmeenergie und Temperatur • Was ist Wärme ? bis ~1800 Vorstellung eines "Wärmestoff" Thompson, Joule: ungeordnete Bewegung! z.B.: Gasmoleküle mit unterschiedlicher Einzelenergie Mechanisches Wärmeäquivalent (Versuch von Joule) 3 Wärme Wärmeenergie und Temperatur • Was ist Wärme ? bis ~1800 Vorstellung eines "Wärmestoff" Thompson, Joule: ungeordnete Bewegung! z.B.: Gasmoleküle mit unterschiedlicher Einzelenergie • in idealem Gas: Temperatur ist Maß für mittlere kinetische Energie 2 3 1 E = mv = trans 2 2 kBT m...Masse eines Gasmoleküls ...quadratisch gemittelte Geschwindigkeit der Moleküle kB2=1,381⋅10-23 JK-1 ... Boltzmann-Konstante v in Festkörper: Bewegung um Ruhelage des Atoms, unabhängig von anderen Atomen. • Absoluter Nullpunkt der Temperatur, wenn alle Moleküle v=0 4 Wärme 3.1.1 Temperaturskala • Einheit der Temperatur: 1K (Kelvin) ( Temperaturänderung von 1°C) 1/100 der Temperaturdifferenz zwischen Gefrierund Siedepunkt von Wasser bei 1,013 bar. Gefrierpunkt liegt dann bei 273,2 K T in K definiere Fixpunkte Fixpunkt Tripelpunkt von Wasserstoff 13,81 zur Übertragung Siedepunkt von Wasserstoff 20,28 zwischen Tripelpunkt von Wasser 273,16 Meßbereichen Siedepunkt von Wasser 373,15 • Temperaturskalen Erstarrungspunkt von Gold 1337,58 Celsius: 0°C ... Gefrierpunkt des Wassers 100°C ... Siedepunkt des Wassers Fahrenheit: über Schmelzpunkt einer Salzmischung und, früher, Körpertemperatur 5 Wärme 3.1.2 Thermische Ausdehnung • lineare Ausdehnung Länge eines Festkörpers l = l0 (1 + α T ) (für kleine Temperaturänderungen denn α auch temperaturabhängig!) Eisenbahnschiene: 30 m ∆TWinter-Sommer ~ 50 K ⇒∆l=1.8 cm früher Schienenstoß, heute verschweiste Schienen u. fixe Montage – hoher Druck 6 Wärme • lineare Ausdehnung Länge eines Festkörpers l = l0 (1 + α T ) (für kleine Temperaturänderungen denn α auch temperaturabhängig!) • Raumausdehnung: bei Festkörper durch Längenausdehnung in 3 Raumrichtungen, γ =3α , bei Flüssigkeiten wesentlich stärker Temperaturabhängigkeit der Dichte ρ = m V = ρ 0 (1 + γ T ) empirische Beobachtungen: Volumenausdehnung bei Gasen linear mit Temperatur (bei konstantem Druck), bzw. umgekehrt prop. Druck (Gesetz von Boyle Mariotte) (Gesetz von Gay-Lussac) p V = p V = ... = const. T = const 0 0 1 1 V = V0 (1 + γ T ) p = const 7 Wärme 3.1.3 Thermometer verwende Temperatureffekte zu deren Messung Längenausdehnung, Volumenausdehnung: Flüssigkeitsthermometer Gasthermomter Bimetallthermometer (Stab aus 2 verbundenen Metallen mit unterschiedlichem α verbiegt sich) elektrische Effekte: Änderung des Widerstands Änderung der Kontaktspanung zwischen unterschiedlichen metallischen Leitern Wärmestrahlung: Köper geben Energie an Umgebung in Form von Wärmestrahlung ab (Wärmebildkamera) 8 Wärme 3.2 Zustandsgleichung • 3.2.1 Zustandsgrößen werden zur Beschreibung der makroskopischen Eigenschaften verwendet Zustandsgröße Art Druck p intensiv Temperatur T intensiv Volumen V extensiv Entropie S extensiv Teilchenzahl n extensiv innere Energie U extensiv extensive Größen addieren sich beim Zusammenfügen (z.B.: V, S, N, U) intensive Größen bleiben gleich (P, T) sind nur für Gleichgewicht definiert 9 Wärme Zustandsgleichung empirische Beobachtungen: Volumenausdehnung bei Gasen linear mit Temperatur (bei konstantem Druck), bzw. umgekehrt prop. Druck (Gesetz von Boyle Mariotte) p0V0 = p1V1 = ... = const. T = const (Gesetz von Gay-Lussac) V = V0 (1 + γ T ) p = const bei konstantem Druck ist V proportinal zu T (Gay-Lussac) bzw. p∝T bei V=const isotherme : Linien bei konst. Temperatur isobare: Linien bei gleichem Druck isochore Linien bei gleichem Volumen 10 Wärme 3.2.2 kinetische Beschreibung • mikroskopische Deutung der makroskopischen Eigenschaften große Zahl von Teilchen ⇒ Mittelungen z.B.: Druck durch Stöße der Teilchen mit Wand: Teilchen i erfährt bei Stoß Impulsänderung, bzw. Kraft. Nach Reaktionsprinzip wirkt gleiche Kraft auf Wand. Fi = p& i = dpi dt 11 Wärme • Annahmen: freie Bewegung, nur elastische Stöße ⇒ zick-zack-Bahnen Brownsche Bewegung ; keine inneren Anregungen, Abstand der Teilchen groß relativ zur Größe der Teilchen (Punktteilchen) Menge eines Gases gegeben durch: molare Masse z.B.: M(H)=1,008⋅10-3 kg/mol = 1,008 g/mol M(H2O)=18,01 g/mol, M(N2)=28,013 g/mol Masse M aus Zahl der Teilchen (N) und m: M=N⋅m Avogadro: unter Normalbedingungen ist molares Volumen Vm,0=22,413996 m3/kmol ~ 22,41 l/mol NA=6,02⋅1023 mol-1 Avogadro (Loschmidt-) Zahl, Zahl der Teilchen pro mol 12 Wärme • Druck eines Gases: in Würfel fliegen n/6 Teilchen in Richtung einer Wand, innerhalb einer Zeit ∆t erreichen diejenigen Teilchen die Wand, die maximal N ∆V N v ∆t entfernt sind, das sind ∆N = = Av ∆t V 6 V Kraft: Impulsänderung/Zeit F = ∆N∆pimp / ∆t , ∆pimp = 2mv Druck: Kraft/Fläche, Mittelung über alle Teilchen p = 13 nmv 2 = nkBT n=N/V 13 Wärme • Druck eines Gases: in Würfel fliegen n/6 Teilchen in Richtung einer Wand, innerhalb einer Zeit ∆t erreichen diejenigen Teilchen die Wand, die maximal v ∆t entfernt sind, das sind N ∆V N ∆N = Kraft: Impulsänderung/Zeit V 6 = V Av ∆t , F = ∆N∆pimp / ∆t ∆pimp = 2mv Druck: Kraft/Fläche, Mittelung über alle Teilchen p = nmv = nkBT • Zustandsgleichung 1 3 2 n=N/V pV = NkBT = ν NA kBT = ν RT ν....Stoffmenge in mol bei Normalbedingungen (T0=273,15 K, p0=101325 Pa) R = p0.Vm,0/T0 = NAkB = 8,315⋅J/mol K ... universelle Gaskonstante 14 Wärme • Gasgemische verschieden Komponenten, reagieren nicht chemisch sei νi Stoffmenge der i-ten Komponente mit mi, Mi RT pi....Partialdruck der i-ten Komponente pi = ν i V Druck eines Gemisches ist gleich der Summe der Einzeldrucke (Dalton) RT p = ∑ i pi = ν ∑ i i V gleiches gilt für Partialvolumen Vi und Stoffmenge xi • Luft: Volumen in % Masse in % Partialdruck in Meereshöhe in Pa Stickstoff N2 78,09 75,52 79125 Sauerstoff O2 20,95 23,15 21228 Argon, Spuren von anderen Edelgasen, H2 0,93 1,28 942 Kohlendioxid 0,03 0,05 30 15 Wärme • reale Gase: bei großen Gasdichten (gesättigeter Dampf) bewirkt Ausdehnung der Moleküle, bzw. Wechselwirkung zwischen Ihnen Abweichungen. Bei van der Waals Kräften (innerer Druck a/V2m, Eigenvolumen der Teilchen – Kovolumen b) ( ) p + a (Vm2 ) (Vm − b ) = RT • Energie mit Ekin = 12 mv 2 = 23 kBT pro Teilchen folgt p = 13 nmv 2 = 13 n2Ekin ,ges / N = 23 V1 Ekin ,ges Ekin ,ges = 23ν RT mittlere Energie der Translation ! 3 Translationsrichtungen Energie pro Translationsfreiheitsgrad pro Teilchen Ekin = 12 νN RT = 12 kBT 16 Wärme • Freiheitsgrad: Möglichkeit der Bewegung 3 Raumrichtungen Kugel hätte im Prinzip noch Möglichkeit der Rotation. Diese hat aber keinen Einfluss auf Translationsbewegung, d.h. auf Temperatur. Moleküle: Rotation koppelt mit Translation + 2 Fgr für 2 atomige Moleküle + 3 Fgr für 3 und mehratomige Moleküle zusätzlich noch Schwingungsfreiheitsgrade etc. • Gleichverteilungssatz im statistischen Gleichgewicht ist Energie im Mittel pro Freiheitsgrad ½kBT bei f Freiheitsgraden: 1 Ekin = 2 f nRT 17 Wärme • Geschwindigkeitsverteilung nicht alle Teilchen mit gleicher Geschwindigkeit Verteilungsfunktion beschreibt, welche Geschwindigkeiten mit größerer Wahrscheinlichkeit angetroffen werden als andere dN / N = f (v)dv Anteil der Teilchen mit Geschwindigkeit zwischen v und v+dv Maxwell-Boltzmann-Verteilung ( ) 3/2 ) f (v)dv = π v 2 e − mv /(2,kBThäufigste dv mittlere Geschwindigkeit 8 kBT z.B.: H2...1694 m/s, N2...453v m/s, ...361 m/s vˆ = = πCO m 2 2 m kBT 2 • mittlere freie Weglänge – Stoßquerschnitt σ 2 kBT m mittlere Weglänge zwischen 2 Stößen l=1/nσ Querschnitt σ=π(r1+r2)2 18 Wärme Was ist Wärme ? • Temperatur: Maß für mittlere kinetische Energie Etrans = 12 mv 2 = 23 kBT Temperaturskala: T=0 alles in Ruhe, 1 Kelvin, (Celsius-, Fahrenheitskala) Längen-, Volumenausdehnung -> Thermometer • Zustandsgrößen – Zustandsgleichung mikroskopisches Modell pV = NkBT = ν NA kBT = ν RT Gasgemische: Summe über Partialdrücke Gleichverteilungssatz im statistischen Gleichgewicht ist Energie im Mittel pro Freiheitsgrad ½kBT, bei f Freiheitsgraden: Geschwindigkeiten verteilt Ekin = 12 f nRT 19 Wärme 3.3 Wärmemenge –Wärmekapazität um Temperatur eines Körper zu erhöhen (senken) muß Wärmemenge zugeführt (entzogen) werden. Mit T1 (T2) Anfangs- (End-) Temperatur • Wärmemenge ∆Q = cM (T2 − T1 ) = cM ∆T Einheit: 1J = 1 Nm = 1 Ws M...Gesamtmasse früher: Kalorie (cal) 1calth = 4,184 J (thermochemische Kalorie) Wärmemenge, um 1g Wasser von 14,5°C auf 15,5°C zu erwärmen. • spezifische Wärmekapazität c Einheit: J / kg K c = ∆Q ( M∆T ) temperaturabhängig ! ebenso abhängig von Art der Erwärmung ⇒ cp bei konst. Druck (Volumen wird größer, d.h. zusätzlich zur Erwärmung Arbeit gegen äußeren Luftdruck notwendig ⇒ cV bei konst. Volumen (zugeführte Energie allein zur Erhöhung der Temperatur) ⇒ cp > cV 20 Wärme c von Atommasse abhängig: c = M∆∆QT = • Wärmekapazität C = ∆Q = c m ∆T molare Wärmekapazität NfkB ∆T 1 2 M ∆T = 2fkm C mol = NA 2f kB = 24,9 Jmol-1 K-1 Wärmekapazitäten bei 0°C in J kg-1 K-1, bzw. J mol-1 K-1 Temperaturabhängigkeit von Cmol Wärmekapazitäten nach kinetischer Gastheorie 21 Wärme • Wärmekapazität von Wasser H2O Molekül gewinkelt sehr viele Freiheitsgrade (3x6) c = 4185 Jkg -1K-1 = 75.3 Jmol-1 K-1 wegen Freiheitsgraden und geringer Masse H2O hoch ! relativ • Kalorimetrie Bestimmung der Wärmekapazitäten Mischkalorimeter: Testkörper (m2) wird in kochendem Wasser / im Wasserdampf (T2) erwärmt, danach in Wasser (m1, T1). Aus Temperaturänderungen folgt c c m + Cw Tm − T1 c= 1 1 m2 T2 − Tm der Messaparatur, Tm...Mischtempertur CW...Wärmekapazität 22 Aggregatzustände der Materie im atomistisches Bild Beispiel Wasser Eis Wasser Wasserdampf Dynamik an der Wasser-Luft Grenzfläche im atomistisches Bild Wärmelehre Thermodynamik P,V,T Die Thermodynamik beschreibt Phänome die mit Wärme zu tun haben durch makroskopische Zustandsgrößen (Temperatur, Druck, Volumen, ...) bzw. Prozeßgrößen (Wärme, Arbeit ...) thermodyn. Gesetze beschreiben Zustände, Zustandsänderungen, Phasenübergänge etc. PV = const. T Statistische Mechanik Wärme ist verknüpft mit ungeordneter Molekularbewegung von sehr vielen Teilchen. In einem atomistischen Bild können nur statistische Aussagen über Mittelwerte und Verteilungen der mechanischen Größen z.B. xi Orte, vi Geschwindigkeiten getroffen werden. Die Temperatur ist ein Maß für die mittlere kinetische Energie 1 2 m 2 T= ⋅ ⋅ v k 3 2 Grundlagen für Messungen mit Wärme Abgeschlossenes System : - System, das mit keinem anderen System in Wechselwirkung steht - Kein Teilchen oder Wärmeaustausch Gleichgewichtszustand "Befinden sich zwei Körper mit einem dritten im thermischen Gleichgewicht, so sind sie auch untereinander im Gleichgewicht" Nullter Hauptsatz der Thermodynamik T1 T2 T0 T3 T0 T0 Celsiusskala und Fahrenheitskala 100°F=37°C Wasser/Ammoniumchlorid Thermometer Messung der Temperatur über stark temperaturabhängige physikalische Größen Thermoelement Flüssigkeitsthermometer VolumenausDehnung ~ ∆T Thermospannung Bimetall-Thermometer Krümmung ~ ∆T Pyrometer Wärmestrahlung Thermische Ausdehnung fester und flüssiger Körper Erwärmung um ∆T = T2 − T1 führt zu einer linearen Längenzunahme ∆L = α ⋅ L ⋅ ∆T α: Längenausdehnungskoeffizient ∆V = γ V ⋅ L ⋅ ∆T ≈ 3α ⋅ L ⋅ ∆T γV: Volumenausdehnungskoeffizient Thermische Kräfte Schätzen Sie die Kraft des Bolzensprengers ab ! ∆L F = E ⋅ A⋅ L = E ⋅ A ⋅ α ⋅ ∆T Lager einer Eisenbrücke zur Vermeidung von thermischen Spannungen E : E-Modul ~ 1011N/m2 A : Fläche ~ cm2 α: 10-5 K-1 ∆T : 100K F ~ 104 N Versuch Atomares Model der thermischen Ausdehnung Tabelle : Wärmeausdehnung bei 20°C Die Atome schwingen um ihre Gleichgewichtslage. Für große Auslenkungen (größere kinetische Energie=höhere Temperatur) ist das Wechselwirkungspotential asymmetrisch und der Mittelwert des atomaren Abstands vergrößert sich. Wärmeausdehnung und Dichte Mit der thermischen Ausdehnung ändert sich auch die Dichte im Allgemeinen: ρ (T ) = ρ0 1 + γ V ⋅ (T − T0 ) Berühmte Ausnahme: die Dichteanomalie des Wassers Höchste Dichte bei 3.9°C negativer Ausdehnungskoeffizient für 0<T<3.9°C Thermische Ausdehnung von Gasen V (T0 + TC ) = V (T0 )(1 + γ V ⋅ TC ) 1. Gay-Lussac-Gesetz Isobare Zustandsänderung : Zustandsänderung findet bei konstantem Druck statt. V 1 1 γV = = T0 273,15 -T0 ϑ[oC] Versuch : Gasthermometer Erfahrungstatsache : Die thermische Ausdehnung verdünnter Gase ist (nahezu) unabhängig vom Stoff Isochore Zustandsänderung Zustandsänderung findet bei konstantem Volumen statt. P (T0 + TC ) = P (T0 )(1 + γ P ⋅ TC ) 2. Gay-Lussac-Gesetz (Gesetz von Charles) p 1 1 γP = = T0 273,15 -T0 Gasthermometer mit Konstantem Volumen ϑ[oC] Ideale Gase und die absolute Temperaturskala P (T0 + TC ) = P (T0 )(1 + γ P ⋅ TC ) Triplepunkt des Wasser TK = 273,16 K Bei -273,15°C hat ein Gas theoretisch keinen Druck und kein Volumen. Dieser natürlicher Fixpunkt wird als absoluter Nullpunkt einer absoluten Temperaturskala (der Kelvinskala) definiert. T [K ] = 273,15 + Tc [°C ] Umrechnung von Celsius in die Kelvinskala Temperturdifferenzen in Kelvin und Celsius-Skala sind gleich. Es gibt keine negativen absoluten Temperaturen,TK=0 prinzipiell nie erreichbar. Isotherme Zustandsänderung Zustandsänderung findet bei konstanter Temperatur statt. p1 ⋅ V1 = p2 ⋅ V2 p Gesetz von Boyle-Mariotte: n ⋅ R⋅Tconst p(V) = V T3 T2 T1 V Versuch Boyle-Mariotte Zustandsgleichung idealer Gase P1V1 P2V2 = = const T1 T2 Allgemeine Zustandsgleichung idealer Gase (Lord Kelvin) p1 ⋅ V1 = n ⋅ R ⋅ T n : Zahl der Mole R= 8,317 J/Mol K Allgemeine Gaskonstante Für ein ideales Gas ist unabhängig von der Gasart, bei einem Normaldruck von 1013,25 hPa und einer Normaltemperatur von 0°, das molare Volume Vm,0=22,4 liter/mol Zustandsänderungen des idealen Gases im p-V-Diagramm p Isotherme : T=const Isobare : P=const Isochore : V=const V Die molekulare Deutung der Temperatur : Kinetische Gastheorie Definition des idealen Gases: Moleküle verhalten sich wie harte Kugeln, d.h. sie führen nur elastische Stöße aus und zeigen keine Anziehung und kein Eigenvolmen. - bei Normalbedingungen ca. 3*1019 Molküle pro cm3 - mittlere freie Weglänge ca. 10-7 m. Demonstration : Rüttler Der Gasdruck - mikroskopisch betrachtet Moleküle treten mit mittlerer Geschwindigkeit <v> in das Volumen dV ein V dV = A ⋅ v x ⋅ dt Anz. Moleküle, die pro Zeit auf die Wand treffen A⋅ v x 1 dV 1 dN = N = N⋅ ⋅ dt 6 V 6 V Druck = Kraft Anz. Stöße Impulsübertrag = Zeit Fläche Fläche P= F dN 2mv 1 N 2mv = ⋅ = Av⋅ A dt A 6V A 2N 1 2N 2 P= ⋅ mv = ⋅ Ekin 3V 2 3V dV N x Gleichverteilungssatz : Äquipartitionsgesetz Im statistischen Gleichgewicht ist die kinetische Energie eines Moleküls pro Freiheitsgrad im Mittel ½ kBT. Die mittlere Energie eines einatomigen Gases beträgt demnach 3 N ⋅ k BT 2 Für mehratomige Moleküle können auch Rotationen und Schwingungen beitragen, dann gilt f ⋅N Ekin = k BT 2 Die Gesamtzahl der Freiheitsgrade, f, eines Gasmoleküls ist die Summe der Translations-, der Schwingungs- und der Rotationsfreiheitsgrade Ekin = Die Boltzmannkonstante ist das Verhältnis aus Gaskonstante und Avogadrokonstante kB= R/NA= 1,38 ·10-23 J/K Maxwellsche Geschwindigkeitsverteilung Gefragt ist nach der Anzahl Moleküle dN mit Geschwindigkeiten zwischen v und (v+dv) : dN = N ⋅ f ( v ) dv f(v) : die Verteilungsfunktion der Geschwindigkeiten f(v) 90 K 3 2 m f ( v) = 4 ⋅ π ⋅ v ⋅ e 2 ⋅π ⋅ k ⋅ T 2 800 X10-6 600 300 K 400 900 K 200 0 0 2000 4000 v[m/s] 6000 8000 − m⋅ v 2 2⋅k ⋅T Wärmemenge und Wärmekapazität - Wärme ist eine Form von Energie (wird also in Einheit Joule gemessen) - Die einem System zugeführte Wärme erhöht seinen Energieinhalt. - Q bezeichnet die einem System zugeführte oder entzogene Wärmemenge Die zugeführte Wärmemenge ist proportional zu Masse und Temperaturänderung ∆Q = c ⋅ m ⋅ ∆T = C ⋅ ∆T C [J/K] : Wärmekapazität c [J/kgK] : spezifische Wärmekapazität Neben der spezifischen Wärmekapazität wird auch häufig die molare Wärmekapazität cm [J/(Mol*K)] verwendet (Wärmekapazität pro Mol) cm = C n n : Anzahl Mol eines Stoffes Messung des elektrischen und mechanischen Wärmeäquivalents Joulesches Experiment 1cal=4,18 Joule=4,18 Ws Versuch Kalorimetrie Die spezifische Wärme cS eines Stoffes kann in einem Mischungskaloriemeter bestimmt werden. T0 S T0w Tm Tm : Mischungstemperatur cw ⋅ mw ⋅ (Tm − T0 w ) = cS ⋅ mS ⋅ (T0 S − Tm ) Die Volumenarbeit eines idealen Gases Die Arbeit, dW, die ein Gas gegen eine äußere Kraft leistet, wird Volumenarbeit genannt. (Die Arbeit hat ein negatives Vorzeichen, weil dem System Energie entzogen wird) Gas dW = − PdV Wisobar = − P0 (V2 − V1 ) P=F/A Wisotherm V2 = − ∫ PdV = − nRT ln V1 Wärmemenge und Wärmekapazität - Wärme ist eine Form von Energie (wird also in Einheit Joule gemessen) - Die einem System zugeführte Wärme erhöht seinen Energieinhalt. - Q bezeichnet die einem System zugeführte oder entzogene Wärmemenge Die zugeführte Wärmemenge ist proportional zu Masse und Temperaturänderung ∆Q = c ⋅ m ⋅ ∆T = C ⋅ ∆T C [J/K] : Wärmekapazität c [J/kgK] : spezifische Wärmekapazität Neben der spezifischen Wärmekapazität wird auch häufig die molare Wärmekapazität cm [J/(Mol*K)] verwendet (Wärmekapazität pro Mol) cm = C n n : Anzahl Mol eines Stoffes Kalorimetrie Die spezifische Wärme cS eines Stoffes kann in einem Mischungskaloriemeter bestimmt werden. T0 S T0w Tm Tm : Mischungstemperatur cw ⋅ mw ⋅ (Tm − T0 w ) = cS ⋅ mS ⋅ (T0 S − Tm ) Messung des elektrischen und mechanischen Wärmeäquivalents Joulesches Experiment 1cal=4,18 Joule=4,18 Ws Die Volumenarbeit eines idealen Gases Die Arbeit, dW, die ein Gas gegen eine äußere Kraft leistet, wird Volumenarbeit genannt. (Die Arbeit hat ein negatives Vorzeichen, weil dem System Energie entzogen wird) Gas dW = − PdV Wisobar = − P0 (V2 − V1 ) P=F/A Wisotherm V2 = − ∫ PdV = − nRT ln V1 Der erste Hauptsatz der Thermodynamik Verallgemeinerung der Energieerhaltung von makroskopischen Systemen auf mikroskopische Der erste Haupsatz der Thermodynamik (Energieerhaltungssatz): dU = dQ + dW ( innere Energie) = (zugeführte Wärme) + (mechanische Arbeit) Die Summe der einem System von außen zugeführten Wärme und der zugeführten Arbeit ist gleich der Zunahme seiner inneren Energie (positive Vorzeichen bedeuten, dass die innere Energie zunimmt) Die Summe der inneren Energien in einem abgeschlossenen System ist konstant (Unmöglichkeit eines Perpetuum mobile 1.Art) Adiabatische Zustandsänderung eines idealen Gases Bei der adiabatischen Zustandsänderung findet keine Wärmeaustausch mit der Umgebung statt. (z.B. weil der Prozess schneller abläuft als der Wärmeaustausch, bzw. der Prozess gut isoliert ist) Damit wird die bei der Kompression geleistete Arbeit vollständig zur Erhitzung des Gases verwendet PdV = −CV dT Es folgt daraus, dass die P-V Kurve „steiler“ wird „Adiabatengleichung“ PV κ = const κ=Cp/CV: Adiabatenkoeffizient Alle Adiabaten schneiden jede Isotherme und umgekehrt Def. Entropie S = k ⋅ ln P P : Wahrscheinlichkeit S : Maß für die Unordnung Der Zweite Hauptsatz der Thermodynamik Es ist unmöglich, eine periodisch arbeitende Maschine zu bauen, die lediglich einem Körper Wärme entzieht und diese vollständig in Nutzarbeit umwandelt (Perpetuum Mobile 2. Art). nach Kelvin-Planck Wärme geht nie spontan, ohne Arbeitsaufwand, vom kälteren zum heißeren Körper über, sondern immer umgekehrt. Satz von Clausius Alle Zustandsänderungen in einem abgeschlossenen System bewirken eine Zunahme der Entropie ∆S > 0 : irreversible Prozesse ∆S = 0 : reversible Prozesse P-T-Phasendiagramm (Zustandsdiagramm) mit fester, flüssiger und gasförmiger Phase Am Tripelpunkt liegen im Gleichgewicht allen drei Phasen gleichzeitig vor. Der Tripelpunkt des Wassers liegt bei 273,16 K und 6,1 mbar. Zum Phasendiagramm von Wasser : - Die Dichte von Eis ist kleiner als die von Wasser unterhalb 4 ºC. - Eis sublimiert bei Drücken p<6.1hPa und T<273 (Gefriertrocknung) - Die Schmelzdruckkurve hat eine negative Steigung. Wasser läßt sich durch äußeren Druck verflüssigen. (Schlittschuhläufer nutzen diesen Effekt aus) Prinzip vom kleinsten Zwang (Le Chatellier-Brown) : „Jedes System reagiert auf eine äußere Einwirkung in der Richtung, dass es die primäre Ursache zu vermindern sucht“ Dampfdruckkurve und Sättigungsdruck Q p (T ) = p0 ⋅ exp − D RT im Gleichgewicht : Sättigungsdampfdruck Im dynamischen Geichgewichtszustand zwischen Flüssigkeit und Dampf stellt sich über einer Flüssigkeit der Sättigungsdampfdruck ein. Er hängt allein von der Art der Flüssigkeit und der Temperatur ab und steigt mit der Temperatur an. Nicht-Gleichgewichtszustände Verdunsten – Sieden - Kondensation Verdunstung : Langsame Verdampfung durch die freie Flüssigkeitsoberfläche Sieden: Eine Flüssigkeit siedet, wenn der Sättigungsdampfdruck bei der gegebenen Temperatur dem Druck über der Flüssigkeit entspricht. Die Siedetemperatur ist druckabhängig. Kondensation: Ausbildung von Flüssigkeitströpfchen aus der Dampfphase bei Abkühlung Für Wasser in Luft gilt insbesondere Absolute Feuchtigkeit: Menge von Wasserdampf in der Luft in g/m3. Die absolute Luftfeuchtigkeit kann bei jeder Temperatur den Wert beim Sättigungsdampfdruck nicht übersteigen. Daher definiert man die relative Feuchtigkeit als Partialdruck des Wasserdampfs geteilt durch den Sättigungsdampfdruck mal 100 in %. Versuch : Siedepunkt Flüssige Mischungen und Lösungen Echte Lösungen, im Gegensatz zu Emulsionen, kolloidalen Lösungen sind molekulardisperse Mischungen. Eine ideale Lösung (z.B. Ethanol/Methanol) zeigt keine Volumenänderung und keine Lösungswärme beim Lösungsvorgang Reale Lösungen haben folgende Merkmale Darstellung der Solvatation (in Wasser Hydratation) eines Festkörpers in einem Lösungsmittel. Lösungswärme (z.B. Schwefelsäure + Wasser) Dampfdruckerniedrigung Gefrierpunktserniedrigung ∆T = 1,83 K /( mol / liter ) cm Raoult'sche Gesetz Methoden zur Erzeugung tiefer Temperaturen Verdampfung (z.B. Chlorethan, C2H5Cl ) Kältemischung (Eis + Salz) entziehen der Umgebung Schmelz, bzw. Lösungswärme tiefste erreichbare Temperatur (eutektischer Punkt) Eine Mischung 23 % NaCl + 77% Wasser erzielt eine Temperaturerniedrigung von -21.2 °C Adiabatische Expansion dT = − p ⋅ dV CV Ideales Gas verrichtet Arbeit gegen äußeren Druck Joule-Thomson Effekt Boltzmannverteilung Verteilungssatz von Boltzmann: Wenn die Moleküle eines Systems bei der Temperatur T zwei verschiedene Energiezustände U1,2 einnehmen können, dann ist das Verhältnis der Besetzungszahlen an den ∆E n2 = exp − n1 k BT Eth = k BT ∆E = U 2 − U1 „Thermische Energie“ „Differenz der potentiellen Energie“ Brownsche Bewegung Die thermische Bewegung der Atome eines Gases oder einer Flüssigkeit lässt sich indirekt durch die Zitterbewegung eines kleinen (aber im Vergleich zum Atom makroskopischen) Teilchens nachweisen. Aus der kinetischen Gastheorie lässt sich nach A. Einstein für das mittleres Verschiebungsquadrat des Brownschen Teilchens ableiten : x 2 = 6D ⋅ t D : Diffusionskoeffizient η : Viskosität, R : Radius D= kT 6πηR Versuch Diffusion DIFFUSION : Nettotransport von Teilchen aus Gebiet hoher Konzentration in Gebiet niedriger Konzentration. jN = dn A ⋅ dt Teilchenstromdichte = Teilchen pro Fläche und Zeiteinheit 1. Fick‘sches Gesetz Transportgleichung der Diffusion dn jN = − D ⋅ dx Der diffusive Teilchenstrom ist proportional zum Konzentrationsgefälle dn/dx Diffusion ist temperaturabhängig Tintentropfen in Wasser kT D= 6π ⋅η (T ) ⋅ R Diffusionskoeffizient Eines kolloidalen Partikels Konvektion : Wärmetransport durch Massentransport Bei schlechten Wärmeleitern (Flüssigkeiten und Gasen) spielt der Wärmetransport durch Transport heisser Substanz die dominante Rolle. Da erwärmte Substanzen eine geringere Dichte besitzen, setzt von selber ein Materialfluss ein, wenn Temperaturunterschiede bestehen. Beispiel: Raumheizung, Wind- und Meeresströmungen. (Freie Konvektion) Kaffee abkühlen durch Pusten. (erzwungene Konvektion) Versuch Konvektion Wärmetransport durch Strahlung Wärmestrahlung sind elektromagnetische Wellen, welche reflektiert, transmittiert und absorbiert werden kann. Die abgegebene Strahlungsleistung eines Körpers wächst mit der 4. Potenz der absoluten Temperatur ( ∆P = σ ⋅ A ⋅ T − T 4 1 4 2 ) σ : Stefan Boltzmann Konstante A : Oberfläche T1 : Körpertemperatur T2 : Umgebungstemperatur Infrarotbild eines Jungen mit Hund Wärmeisolierung Vakuum : keine Wärmeleitung keine Konvektion Verspiegelte Innenwände : keine Verluste durch Wärmestrahlung Thermosflasche Dewar