1.2.1 Nachtrag Energiehot!
Werbung

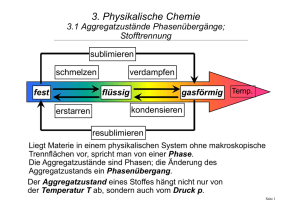
1.2.1 Nachtrag zur Freiwilligkeit von Reaktionen: Meistens laufen exotherme Reaktionen freiwillig ab und endotherme nicht, aber es gibt Ausnahmen. So gibt es endotherme Reaktionen, die freiwillig ablaufen, z. B. die Lösung einer Reihe von Salzen, z. B. KNO3 (Kaliumnitrat) und NH4NO3 (Ammoniumnitrat), bei denen viel Energie zum Aufbrechen der Ionenbindungen im Kristall benötigt wird, oder die Lösung von Harnstoff, die der Umgebung Wärme entzieht, aber freiwillig abläuft. Die treibende Kraft muss in diesen Fällen die Entropie sein, d. h. es muss zu einer Zunahme von Unordnung (mehr Teilchen, Änderung des Aggregatzustandes von fest zu flüssig, bzw. zu gasförmig oder von flüssig zu gasförmig) kommen. Mit Hilfe der Formel ∆G = ∆H -T*∆S kann man grundsätzliche Aussagen darüber machen, unter welchen Umständen eine Reaktion freiwillig ablaufen wird. 1. ∆H < 0 (exotherm) und ∆S >0 (unordentlicher): immer freiwillig, d. h. exergonisch 2. ∆H < 0 (exotherm) und ∆S <0 (ordentlicher): kann freiwillig sein, wenn T nicht zu hoch ist. 3. ∆H > 0 (endotherm) und ∆S >0 (unordentlicher): kann freiwillig sein, Erhöhung der Temperatur gibt ∆S mehr Gewicht. 4. ∆H > 0 (endotherm) und ∆S <0 (ordentlicher): nie freiwillig, d. h. endergonisch. Die Reaktion läuft nur unter Zufuhr von Energie ab. Merke! Im allgemeinen sind Oxidationen exergonisch, d. h. sie laufen freiwillig ab und liefern Energie (z. B. Verbrennungen), während Reduktionen endergonisch sind, d. h. sie laufen nicht freiwillig ab und kosten Energie. Chemisch gesehen ist die Photosynthese eine Reduktion von CO2 (Sie findet mit Hilfe der Energie des Sonnenlichts statt.) und die Zellatmung eine Oxidation von Glucose bzw. anderen Nährstoffen (Sie liefert Energie in Form von ATP.).