Dokument als PDF
Werbung

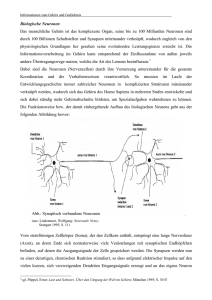
Präsentation von Carlo Sala, Erläuterungen zu den Folien Folie 1: Titel der Präsentation Folie 2: Unser Gehirn macht die korrekte Anordnung von mehr als 100 Billionen Neuronen (Nervenzellen) aus. Jedes Neuron kommuniziert mit anderen Neuronen, wobei es bis zu 30.000 Synapsen benötigt. Die Folie zeigt auch ein Neuron, welches durch einen Zellenkörper geformt wird, sowie verschiedene Dendriten, wo sich die Synapsen befinden. Folie 3: Diese Folie zeigt ein Neuron mit einem Überausdruck an Shank1, welcher mit dem grünen fluoreszierenden Leuchten gekennzeichnet ist. SHANK1 ist wie SHANK3 an Synapsen lokalisiert. Es sind Neuronenzellkörper, Dendriten und Synapsen dargestellt (grüne Punkte). Folie 4: Diese Folie zeigt das Schema einer Synapse. Unser Gehirn ist ein riesiges Netzwerk von elektrisch aktiven Zellen, Neuronen, die miteinander über spezielle Zellenverbindungen kommunizieren: die Synapsen. Es gibt zwei Haupttypen von Synapsen in unserem Gehirn: exzitatorische und inhibitorische Synapsen. Exzitation und Inhibierung werden in unserem Gehirn hauptsächlich durch die Neurotransmitter Glutamat sowie γ-Amino-Buttersäure (GABA) vermittelt. Bemerkenswert ist, dass Neuronen mit besonderem Bedacht jeden Synapsentyp mit characteristischen strukturellen und neurochemischen Eigenschaften ausstatten. Eine drastische Reduktion in Anzahl oder in Funktion der Synapsen wird bei Patienten beobachtet, die an mentaler Retardation leiden, einschließlich Down Syndrom, fragiles-X-Syndrom, u.s.w.. Folie 5: Diese Folie zeigt das Bild von exzitatorischen und inhibitorischen Synapsen als elektronenmikroskopische Aufnahme und als Schema der inhibitorischen Synapse. Folie 6: Diese Folie zeigt das Schema einer exzitatorischen synapse. Die exzitatorische Synapse ist komplexer als die inhibitorische Synapse. Folie 7: Exzitatorische und inhibitorische Synapsen sind auf der selben Dendrite lokalisiert, aber gut voneinander getrennt. Die Neuronen sind in der Lage, die zwei Typen von Neuronen getrennt voneinander zu erhalten. Folie 8: Das Gehirn und die Neuronen benötigen eine korrekte Balance zwischen exzitatorischen und inhibitorischen Synapsen, damit sie gut funktionieren. Diese Folie zeigt ein Schema, das die korrekte Balance zwischen exzitatorischen und inhibitorischen Synapsen illustriert. Folie 9: Mögliche inkorrekte Balance zwischen exzitatorischen (E) und inhibitorischen (I) Synapsen könnten Veränderungen der kognitiven Funktionen verursachen. Es ist möglich, dass die exzitatorischen oder die inhibitorischen Synapsen vorherrschen, sodass das Verhältnis E/I falsch ist. Folie 10: Wo ist SHANK in den Synapsen? Folie 11: Die Folie zeigt das Schema einer exzitatorischen Synapse. Folie 12 und 13: Die Folie zeigt die hauptsächlichen Proteine, die mit Shank wechselwirken. Folie 14: Die Folie zeigt eine Liste von Veröffentlichungen meines Labors, die die Funktion von Shank1 beschreiben, ein Protein, das in den Synapsen Shank3 sehr ähnlich ist. Folie 15: Die Folie zeigt, das Shank1 in der Lage ist, Dentriten in Neuronen zu vergrößern, die im Labor gezüchtet wurden. Folie 15: Die Folie zeigt, dass im Gehirn von Shank1-knock out-Mäusen die Dendriten im Vergleich zu normalen Mäusen kleiner sind. Folie 16: Um die Funktionen von SHANK3 studieren zu können, unterdrückten wir die Ausbildung von Shank3 in Neuronen, die im Labor gezüchtet wurden. Folie 17: Das SHANK3-Gen sitzt auf dem Chromosom 22. Folie 18: Das SHANK3-Gen wird in der mRNA umgeschrieben und in ein Protein übersetzt. Das Schema zeigt wie das SHANK3-Protein hergestellt wird – aus der DNA die das SHANK3-Gen enkodiert produzieren die Zellen die mRNA, die dann in SHANK3-Protein übersetzt wird. 090705 Vortrag Sala in Wartaweil deutsch.doc; 1/2 Folie 19: Wir können durch Herabsetzung von SHANK3-mRNA mit siRNA die Produktion von SHANK3Protein blockieren. Die Folie zeigt die Technologie, die wir verwenden, um SHANK3-Produktion in Neuronen herabzusetzen. Wir verwenden eine Technologie, die siRNA genannt wird, um spezifisch die SHANK3mRNA herabzusetzen. Folie 20: SHANK3-siRNA kann durch Verwendung des Lentivirus zu Neuronen gebracht werden. Wir können die SHANK3-Ausbildung unterdrücken, um die Funktion von SHANK3 zu studieren. Die siRNA für SHANK3 wird durch die Verwendung eines speziellen Virus, genannt Lentivirus, in die Neuronen eingebracht. Das Schema zeigt, wie wir den Lentivirus produzieren und anwenden. Folie 21: Was passiert den Dendriten und Synapsen in Neuronen, für die SHANK3 ausgeschaltet wurde? Folie 22: Morphologie von Dendriten in hippocampalen Neuronen mit SHANK3 knock out: die Dendriten sind in Größe und Anzahl reduziert. Die Folie zeigt Dendriten in Neuronen mit SHANK3 knock out und normale (siRNA kontrollierten) Neuronen. Folie 23: Die Folie stellt die wichtigsten Proteine dar, die mit SHANK3 wechselwirken. Folie 24: Eindruck von synaptischen Proteinen in hippocampalen Neuronen mit SHANK3 konck out: mGLuR5 ist reduziert. Die Folie zeigt Bilder der Anzahl von synaptischen Proteinen, die von Neuronen mit SHANK3 knock out oder normalen (siRNA kontrollierten) Neuronen ausgebildet werden. Folie 25: mGluR5-Phopsphorilation von ERK1/2 ist bei Neuronen mit SHANK3 knock out unterdrückt. Wir haben herausgefunden, dass eine wichtige Funktion in Synapsen von Neuronen mit SHANK3 knock out verloren geht. Folie 26: Wir glauben, dass in Anwesenheit von SHANK3 eine mGluR5-Stimulation die Aktivität von ERK1/2 induziert, was [wiederum] die Produktion von Proteinen induziert, die in der Lage sind, Dendriten und exzitatorische Synapsen zu regulieren. Folie 27: Die in der vorigen Folie beschriebenen Mechanismen gibt es nicht in Neuronen mit SHANK3 knock out. Folie 28: Darum glauben wir, dass in Abwesenheit von SHANK3 das Verhältnis von exzitatorischen zu inhibitorischen (E/I) Synapsen geändert sein könnte, weil die exzitatorischen Synapsen schwächer sind. Folie 29: Mögliche pharmakologische Rettung: Wiederherstellung der ERK1/2 Aktivität, Wiederherstellung der Synthese von Proteinen, die das Dendritenwachstum regulieren oder SHANK3-Synthese wieder einstellen. Folie 30: Wir planen die pharmakologische Rettung in zwei Modellen zu überprüfen: - Verwendung von neuronalen Kulturen von Ratten mit SHANK3 knock down - Verwendung von Mäusen mit SHANK3 knock out - Verwendung von pluripoteneten Stammzellen (iPS-Zellen), die von Patienten mit Fibroblasten abgeleitet werden. Folie 31: Von pluripotenten Zellen werden unsere Organe abgeleitet. Das Schema zeigt, dass jedes individuelle von einer einzelnen pluripotenten Zelle generiert wird, weil sie in alle Gewebe und Organe, die unseren Körper ausmachen, differenzieren kann. Folie 32: Wir können eine unipotente Zelle nehmen (Haut-Fibroblaste) und die Zelle in eine pluriporenete Zelle transformieren. Das Schema zeigt, dass es möglich ist, die umgekehrte Reise zu machen, von einer differenzierten Zelle wie einer Haut-Fibroblaste können wir eine multipotente Zelle ableiten, die iPS-Zelle genannt wird. Dies kann in einer Maus durchgeführt werden. Folie 33: Die Folie zeigt Bilder einer iPS-Zelle. Folie 34: Wir können einen menschliche unipotente Zelle nehmen (Haut-Fibroblaste) und die Zelle in eine pluripotente Zelle transformieren. Folie 35: Was können wir mit iPS-Zellen tun? iPS-Zellen können verwendet werden, um Heilmittel zu testen, die letztendlich verwendet werden, um Erkrankungen bei Menschen zu heilen Folie 36: Die Folie zeigt die Leute, die für unser SHANK3-Projekt arbeiten und zusammenwirken. 090705 Vortrag Sala in Wartaweil deutsch.doc; 2/2