Tab. 2 Infektiologische Aspekte der infundierbaren Immuntherapien
Werbung
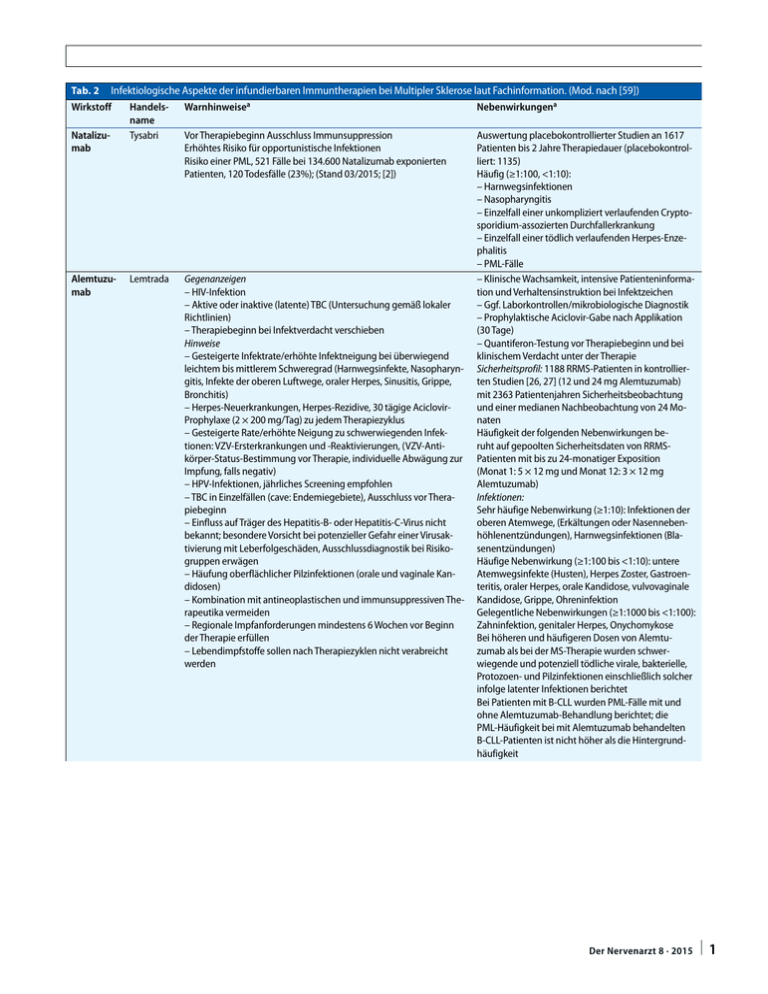
Tab. 2 Infektiologische Aspekte der infundierbaren Immuntherapien bei Multipler Sklerose laut Fachinformation. (Mod. nach [59]) Wirkstoff Natalizumab Alemtuzumab Handelsname Tysabri Warnhinweisea Nebenwirkungena Vor Therapiebeginn Ausschluss Immunsuppression Erhöhtes Risiko für opportunistische Infektionen Risiko einer PML, 521 Fälle bei 134.600 Natalizumab exponierten Patienten, 120 Todesfälle (23%); (Stand 03/2015; [2]) Lemtrada Gegenanzeigen – HIV-Infektion – Aktive oder inaktive (latente) TBC (Untersuchung gemäß lokaler Richtlinien) – Therapiebeginn bei Infektverdacht verschieben Hinweise – Gesteigerte Infektrate/erhöhte Infektneigung bei überwiegend leichtem bis mittlerem Schweregrad (Harnwegsinfekte, Nasopharyngitis, Infekte der oberen Luftwege, oraler Herpes, Sinusitis, Grippe, Bronchitis) – Herpes-Neuerkrankungen, Herpes-Rezidive, 30 tägige AciclovirProphylaxe (2 × 200 mg/Tag) zu jedem Therapiezyklus – Gesteigerte Rate/erhöhte Neigung zu schwerwiegenden Infektionen: VZV-Ersterkrankungen und -Reaktivierungen, (VZV-Antikörper-Status-Bestimmung vor Therapie, individuelle Abwägung zur Impfung, falls negativ) – HPV-Infektionen, jährliches Screening empfohlen – TBC in Einzelfällen (cave: Endemiegebiete), Ausschluss vor Therapiebeginn – Einfluss auf Träger des Hepatitis-B- oder Hepatitis-C-Virus nicht bekannt; besondere Vorsicht bei potenzieller Gefahr einer Virusaktivierung mit Leberfolgeschäden, Ausschlussdiagnostik bei Risikogruppen erwägen – Häufung oberflächlicher Pilzinfektionen (orale und vaginale Kandidosen) – Kombination mit antineoplastischen und immunsuppressiven Therapeutika vermeiden – Regionale Impfanforderungen mindestens 6 Wochen vor Beginn der Therapie erfüllen – Lebendimpfstoffe sollen nach Therapiezyklen nicht verabreicht werden Auswertung placebokontrollierter Studien an 1617 Patienten bis 2 Jahre Therapiedauer (placebokontrolliert: 1135) Häufig (≥1:100, <1:10): – Harnwegsinfektionen – Nasopharyngitis – Einzelfall einer unkompliziert verlaufenden Cryptosporidium-assozierten Durchfallerkrankung – Einzelfall einer tödlich verlaufenden Herpes-Enzephalitis – PML-Fälle – Klinische Wachsamkeit, intensive Patienteninformation und Verhaltensinstruktion bei Infektzeichen – Ggf. Laborkontrollen/mikrobiologische Diagnostik – Prophylaktische Aciclovir-Gabe nach Applikation (30 Tage) – Quantiferon-Testung vor Therapiebeginn und bei klinischem Verdacht unter der Therapie Sicherheitsprofil: 1188 RRMS-Patienten in kontrollierten Studien [26, 27] (12 und 24 mg Alemtuzumab) mit 2363 Patientenjahren Sicherheitsbeobachtung und einer medianen Nachbeobachtung von 24 Monaten Häufigkeit der folgenden Nebenwirkungen beruht auf gepoolten Sicherheitsdaten von RRMSPatienten mit bis zu 24-monatiger Exposition (Monat 1: 5 × 12 mg und Monat 12: 3 × 12 mg Alemtuzumab) Infektionen: Sehr häufige Nebenwirkung (≥1:10): Infektionen der oberen Atemwege, (Erkältungen oder Nasennebenhöhlenentzündungen), Harnwegsinfektionen (Blasenentzündungen) Häufige Nebenwirkung (≥1:100 bis <1:10): untere Atemwegsinfekte (Husten), Herpes Zoster, Gastroenteritis, oraler Herpes, orale Kandidose, vulvovaginale Kandidose, Grippe, Ohreninfektion Gelegentliche Nebenwirkungen (≥1:1000 bis <1:100): Zahninfektion, genitaler Herpes, Onychomykose Bei höheren und häufigeren Dosen von Alemtuzumab als bei der MS-Therapie wurden schwerwiegende und potenziell tödliche virale, bakterielle, Protozoen- und Pilzinfektionen einschließlich solcher infolge latenter Infektionen berichtet Bei Patienten mit B-CLL wurden PML-Fälle mit und ohne Alemtuzumab-Behandlung berichtet; die PML-Häufigkeit bei mit Alemtuzumab behandelten B-CLL-Patienten ist nicht höher als die Hintergrundhäufigkeit Der Nervenarzt 8 · 2015 | 1 Leitthema Tab. 2 Infektiologische Aspekte der infundierbaren Immuntherapien bei Multipler Sklerose laut Fachinformation. (Mod. nach [59]) (Fortsetzung) 2 | Wirkstoff Handelsname Warnhinweisea Nebenwirkungena Rituximabb MabThera Gegenanzeigen – Aktive und/oder schwere Infektionen (z. B. Tuberkulose, Sepsis opportunistische Infektionen – Stark eingeschränkte Immunabwehr (z. B. Hypogammaglobulinämie, reduzierte CD4- oder CD8-Zellzahl) Besondere Vorsicht bei Neutrophilenzahl <1500 Zellen/ml Hinweise – Vorsicht bei rezidivierenden und chronischen Infektionen in der Vorgeschichte oder bei Grunderkrankungen, die das Auftreten von Infektionen begünstigen – Klinische Wachsamkeit bezüglich Infektionen nach Therapie und vor erneutem Therapiezyklus – Bei Infektbericht nach Therapie rasche Abklärung und Behandlung Mitoxantron Z. B. Ralenova Gegenanzeigen – Schwere floride Infekte – Neutrophilenzahl <1500 Zellen/ml (Ausnahme Therapie der akuten nichtlymphozytären Leukämie) – Vor Beginn der Behandlung floride Infektion ausschließen bzw. entsprechend therapieren – Therapiesteuerung und Dosisadjustierung in Abhängigkeit von Differenzialblutbildveränderungen nach bzw. vor der Applikation und der Infektionsanamnese nach Therapie – In-vitro-Untersuchungen zeigen, dass Mitoxantron in Konzentrationen unterhalb 10 mg/l keinen eigenen antimikrobiellen Effekt besitzt – In sehr seltenen Fällen Hepatitis-B-Reaktivierung einschließlich fulminanter Hepatitis – Sehr seltenes Auftreten einer PML in der NHL-Indikation nach Markteinführung – Spontanmeldesystem berichtet Todesfälle aufgrund PML bei Off-label-Anwendung zur Behandlung von SLE und Vaskulitis bei vorangehender oder begleitender immunsuppressiver Behandlung – Keine PML-Meldung bei RA – PML auch bei Autoimmunerkrankungen ohne Rituximab-Therapie Rheumatologische Indikation: – Infektionsrate gesamt 0,9/Patientenjahr – Infekte der oberen Luftwege und Harnwege am häufigsten – Infektionsrate (klinisch bedeutsam, teils tödlich verlaufend) 0,05/Patientenjahr Phase-II- und -III-Studien bei RA (R-MTX vs. MTX; n: 540 zu 398) – Alle Infektionen: 37–41% vs. 30–37% – Harnwegsinfektionen: 5–6% vs. 4–8% – Infektion obere Atemwege: 13–16% vs. 12–15% – Infektion untere Atemwege/Pneumonie: 3–4% vs. 2–5% Hämatologische Indikation: Nebenwirkungen bei NHL in klinischen Studien (n: 356, Monotherapie): – B-Zell-Verlust bei 70–80% der Patienten – Abnahme der Immunglobuline selten – 30,3% Infektionen unabhängig vom Kausalzusammenhang – 3,9% schwere (Grad 3 und 4) Infektionen inklusive Sepsis (1,4% während Behandlung, 2,5% in der Nachbeobachtung) Post-Marketing-Surveillance: – Sehr selten (<1:10.000) schwerwiegende Virusinfektionen: Neuerkrankungen, Reaktivierungen oder Verschlimmerungen durch Herpesviren (CMV, VZV, HSV), JC-Virus oder Hepatitis-C-Virus Sehr häufige Nebenwirkungen (≥10%): – Harnwegsinfektionen – Infektionen der oberen Atemwege Häufigkeit unbekannt: – Infektionen generell – Pneumonie – Sepsis – Opportunistische Infektionen Der Nervenarzt 8 · 2015 Tab. 2 Infektiologische Aspekte der infundierbaren Immuntherapien bei Multipler Sklerose laut Fachinformation. (Mod. nach [59]) (Fortsetzung) Wirkstoff Handelsname Warnhinweisea Nebenwirkungena Cyclophosphamidb Z. B. Endoxan – Interstielle Pneumonien und andere Infektionen (alle Erreger) im Rahmen hämatologischer Konditionierungstherapien – Sekundäre Keimbesiedlung bei primär abakterieller hämorrhagischer Zystitis IVIgb Z. B. Octagam Gegenanzeigen – Floride Infektionen – Zystitis Hinweise – Sanierung von Infekten vor Behandlungsbeginn – Sorgfältige Mundpflege – Regelmäßige Blutbild- und Urinsedimentkontrollen – Überwachung von Patienten mit vorbestehender Hepatitis, da nach Absetzen von Cyclophosphamid Reaktivierungen einer Hepatitis auftreten können – Klinische Wachsamkeit: Infektionen und Reaktivierungen durch Bakterien, Pilze, Viren, Protozoen und Parasiten – Mesna-Prophylaxe (Reduktion urotoxischer Nebenwirkungen und Vermeidung Sekundärinfektion) Bei der Verabreichung von Medikamenten, die aus menschlichem Blut bzw. Plasma hergestellt werden, können Infektionskrankheiten durch Übertragung von Erregern auch bislang unbekannter Natur nicht vollständig ausgeschlossen werden Die Virusinaktivierung/-eliminierung ist bei nicht umhüllten Viren möglicherweise von eingeschränktem Wert Infektionsrisiko siehe Warnhinweise aWarnhinweise und Nebenwirkungen laut Herstellerangaben und Fachinformation (http://www.fachinfo.de). bOff-label-Setting. B-CLL „B-cell chronic lymphocytic leukemia „, HIV „human immunodeficiency virus“, IVIg intravenöse Immunglobuline, NHL Non-Hodgkins-Lymphom, PML progressive multifokale Leukenzephalopathie, RA rheumatoide Arthritis, R-MTX Methotrexat + Rituximab, RRMS „relapsing remitting multiple sclerosis“, HPV humanes Papillomavirus, SLE systemischer Lupus erythematosus, TBC Tuberkulose, VZV Varicella-Zoster-Virus. Der Nervenarzt 8 · 2015 | 3











