Document
Werbung
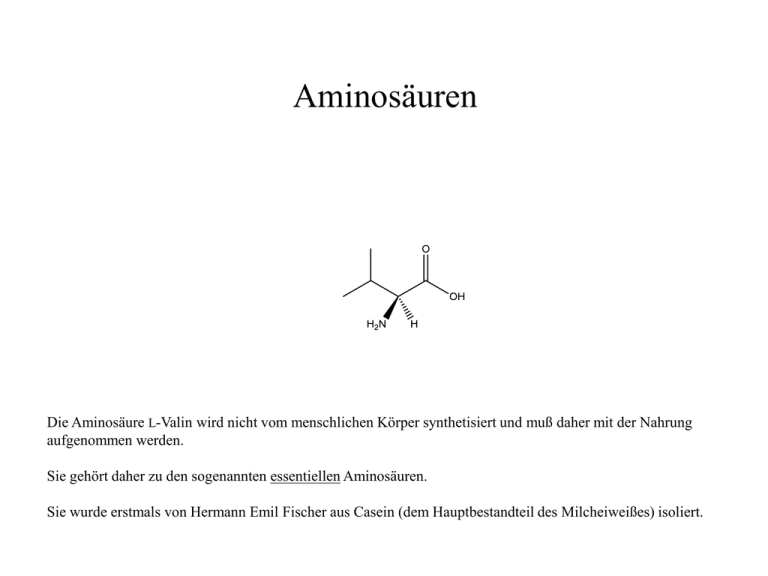
Aminosäuren Die Aminosäure L-Valin wird nicht vom menschlichen Körper synthetisiert und muß daher mit der Nahrung aufgenommen werden. Sie gehört daher zu den sogenannten essentiellen Aminosäuren. Sie wurde erstmals von Hermann Emil Fischer aus Casein (dem Hauptbestandteil des Milcheiweißes) isoliert. n-Butan Für die Konstruktion der Konstitutionsformel des L-Valin gehen wir wiederum vom Kohlenwasserstoff n-Butan aus. 2 1 4 3 2-Methylbutan Zunächst wird die C 4-Kette um eine Methylgruppe an einem der beiden mittleren C-Atome ergänzt. Gemäß der Zählweise ist dieses C-Atom das C-2 in der Struktur des 2-Methylbutans. 3 4 1 2 3-Methylbutansäure Im folgenden Schritt wandeln wir das endständige C-Atom, welches von der Abzweigung weiter entfernt ist, in eine Carbonsäuregruppe –COOH um. Dieses C-Atom ist das nunmehr das C-1, da die C-Kette wegen der Priorität der –COOH-Gruppe nun von rechts nach links numeriert wird. Das ursprüngliche C-2 des 2-Methylbutans (siehe letzte Folie) wird durch diese Umkehrung der Zählrichtung zum C-3 der 3-Methylbutansäure. (S)-2-Amino-3-methylbutansäure Um von dieser Carbonsäure zu einer sogenannten α-Aminosäure zu gelangen, ersetzen wir eines der beiden H-Atome am C-2 durch eine Aminogruppe ( –NH2-Gruppe). Der Buchstabe „ α“ bedeutet, daß die Aminogruppe am C-2 sitzt („β“ wäre eine Aminogruppe am C-3). In der Abbildung ragt die Aminogruppe dem Betrachter aus der Papierebene heraus entgegen. Dies wird durch den durchgezogenen Keil symbolisiert. (S)-2-Amino-3-methylbutansäure Das in der abgekürzten Schreibweise nicht mit eingezeichnete H-Atom am C-2 ragt hinter die Ebene. Die Zuordnung des Stereozentrums am C-2 zur S- bzw. R-Konfiguration ist aus diesem Grund relativ einfach. (S)-2-Amino-3-methylbutansäure Der Substituent niedrigster Priorität (= derjenigen mit den wenigsten Protonen im Kern = derjenige mit der niedrigsten Ordnungszahl im Periodensystem; in diesem Fall wie üblich das H-Atom) ragt nach hinten. Dies ist die Voraussetzung dafür, daß die räumliche Abfolge der Substituenten Nr. 1 (höchste Priorität; hier: N mit der OZ 7), Nr. 2 (hier: C der COOH-Gruppe) und Nr. 3 (hier: C des C3H7-Alkylrests) dem Uhrzeigersinn zugeordnet und in der Abfolge 123 gegen der Uhrzeigersinn (wie in diesem Fall) mit dem Buchstaben S bzw. der Abfolge 123 im Uhrzeigersinn mit dem Buchstaben R belegt werden kann. Die Abbildung zeigt demnach das S-Isomere der 2-Amino-3-methylbutansäure. (S)-2-Amino-3-methylbutansäure = (S)-Valin = L-Valin Der übliche Name für die 2-Amino-3-methylbutansäure ist Valin. Warum wird zur Wiedergabe der dreidimensionalen Verhältnisse am Stereozentrum im Namen der Verbindung das (S)-Valin, einer anderen Nomenklatur folgend, üblicherweise als L-Valin bezeichnet? Ist ein (S)-Isomeres in jedem Fall identisch mit dem L-Isomeren?? Und ist das am Stereozentrum spiegelbildlich aufgebaute (R)-Isomere automatisch identisch mit dem D-Isomeren?? (Wenn ja, dann könnte man ja auf einen Satz an Deskriptoren [(R/S) oder D/L] verzichten!?) (S)-2-Amino-3-methylbutansäure = (S)-Valin = L-Valin Achtung: Das ist nicht der Fall !! Beide Systeme an Deskriptoren für Stereozentren [(R/S) oder D/L] beruhen auf völlig unterschiedlichen Definitionen! Sie sind daher keinesfalls austauschbar! (S)-2-Amino-3-methylbutansäure = (S)-Valin = L-Valin Die (R/S)-Nomenklatur, von den Chemikern Cahn, Ingold und Prelog entwickelt (daher auch CIP-Nomenklatur genannt), beruht ausschließlich auf Ordnungszahlen der Elemente, also der Anzahl an Protonen in deren Kernen. Sie ist vor allem dann von Vorteil, wenn das betreffende Molekül nur ein einziges Stereozentrum hat (wie bei der Aminosäure Valin, deren natürlich vorkommendes Isomeres das L-Enantiomere ist; dies gilt übrigens für alle Aminosäuren mit einem Stereozentrum). Hat ein Molekül nämlich mehrere Stereozentren, dann muß jedes dieser C-Atome separat für sich gemäß der (R/S)Nomenklatur bestimmt und das Ergebnis im Namen angegeben werden. Die offenkettige Form des natürlich vorkommenden Isomeren des Traubenzuckers zum Beispiel muß gemäß der (R/S)-Nomenklatur als (2R,3S,4R,5R)-2,3,4,5,6-Pentahydroxyhexanal bezeichnet werden. Da ist die Bezeichnung als D-Glucose doch einfacher … Quelle: wikipedia Die D/L-Nomenklatur bezieht sich nicht auf die Ordnungszahl der Elemente, sondern einzig und allein auf die Ausrichtung (nach links oder nach rechts) der funktionellen Gruppe (OH-Gruppe oder NH2-Gruppe) am Stereozentrum des Moleküls in der Fischer-Projektion – bzw., im Fall mehrerer Stereozentren im Molekül, an dem Stereozentrum, welches in der FischerProjektion am weitesten unten steht. Die D/L-Nomenklatur ist vor allem dann von Vorteil, wenn, wie im Fall der Kohlenhydrate, mehrere Stereozentren vorliegen und man die Zuordnung der natürlich vorkommenden Isomere auf ein einziges der Stereozentren beschränken kann, nämlich auf das in der Fischer-Projektion am weitesten unten stehende Stereozentrum. Das Ergebnis ist die D-Reihe der meisten natürlich vorkommenden Zucker (D-Glucose, D-Galactose, D-Fructose, D-Ribose, …). Hermann Emil Fischer Aber auch in den Fällen von Naturstoffen, in denen in der Regel nur ein Stereozentrum an einem bestimmten C-Atom vorliegt, wird die D/LNomenklatur gerne angewandt, wenn alle natürlich vorkommenden Enantiomere die gleiche räumliche Anordnung an jenem Stereozentrum aufweisen. Glycin (= Aminoessigsäure) (kein Stereozentrum = nicht chiral = optisch nicht aktiv) Die meisten a-Aminosäuren haben ein solches Stereozentrum am C-2 mit gleicher räumlicher Ausrichtung der NH2-Gruppe (Ausnahme: die Aminosäure Glycin – siehe links – besitzt kein Stereozentrum). Daher ist es von Vorteil, diese natürlich vorkommenden a-Aminosäuren der L-Reihe zuzuordnen. Der Bezug auf die R/S-Nomenklatur birgt bei den Aminosäuren nämlich ein Problem: Das C-Atom Nr. 3 der Aminosäure L-Cystein (siehe links) hat ein SchwefelAtom als Bindungspartner. Schwefel hat die Ordnungszahl 16 und somit höhere Priorität als Sauerstoff (Ordnungszahl 8). L-Cystein = (R)-Cystein Das C-3 des L-Cysteins hat demzufolge gemäß der R/S-Nomenklatur eine höhere Priorität als das C-1 mit seiner COOH-Gruppe! Das natürlich vorkommende L-Cystein entspricht gemäß der R/S-Nomenklatur also nicht wie beiden den übrigen Aminosäuren dem (S)-, sondern dem (R)-Enantiomeren! Zurück zum (S)-Valin: Zur Zuordnung des (S)-Valin gemäß der D/L-Nomenklatur müssen wir dessen Fischer-Projektion konstruieren, wobei wir uns an das Procedere bei den Kohlenhydraten erinnern: Der Betrachter blickt so auf das Stereozentrum, daß die Kette der C-Atome senkrecht verläuft und die beiden dem Stereozentrum direkt benachbarten C-Atome (hier: C-1 und C-3) in der Ebene vom Betrachter aus nach hinten zeigen. Dieser Blick auf das Stereozentrum liefert uns im Fall der Aminosäure (S)-Valin das folgende Ergebnis in der Keilstrich-Schreibweise (siehe rechts). Wiedergabe mit Keilstrichen daraus abgeleitete Fischer-Projektion Die Fischer-Projektion orientiert sich zwar an dieser Wiedergabe der Stereochemie. Sie verzichtet aber auf jene Keilstriche und verwendet die normalen Striche für die Atombindungen. L-Valin Die funktionelle Gruppe in horizontaler Ausrichtung ist im Fall der Aminosäuren die NH2-Gruppe. In diesem Fall ist die NH2-Gruppe in der Fischer-Projektion nach links ausgerichtet (siehe Rechteck). Somit liegt hier die natürlich vorkommende L-Aminosäure vor (lateinisch: laevus = links). Liegen die funktionellen Gruppen in den Aminosäuren in der Realität tatsächlich so vor wie in der Abbildung für das L-Valin wiedergegeben ? –CO2H: saure Gruppe –NH2: basische Gruppe H als Proton (H+ ) abspaltbar freies Elektronenpaar am N-Atom; kann ein Proton (H+ ) aufnehmen Betrachten wir zur Klärung dieser Frage die Eigenschaften der beiden funktionellen Gruppen, nämlich der –COOH-Gruppe und der – NH2-Gruppe. Die erstere ist sauer, tendiert also zur Abgabe eines Protons. Die zweitere ist dank des freien Elektronenpaars basisch, d.h. sie neigt zur Aufnahme eines Protons. L-Valin in der sog. Zwitterionenstruktur In der Realität liegen die Aminosäuren also in ionischer Form vor. Dies erklärt ihre relativ hohen Schmelzpunkte (Ionenkräfte sind relativ stark!) Ein Molekül mit positiven und negativen Ladungen nennt man ein Zwitterion.