15.03.2005
Werbung

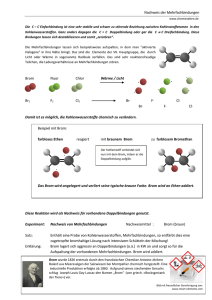
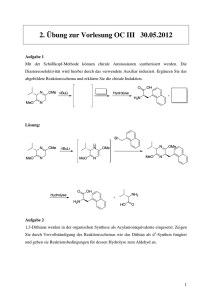
Protokoll Basismodul Chemie I, Praktikum: Carbonylverbindungen Veranstalter: Dr. Ulrich Neuert Jörg Mönnich () Betreuer: Carolin, Christian Versuchstag: Dienstag, 15.03.2005 Carbonylverbindungen Carbonylverbindungen Einleitung Nachdem am 6. Praktiku mstag (10.03.05) schon auf eingegangen worden ist, beschäftigt sich di funktionelle Gruppen eser Text mit einer weit eren, sehr wichtigen funktionellen Gruppe: Der Carbonylgruppe. Diese entsteht durch eine Doppelbindung eines Kohlens toff-Atoms mit einem Sauer Doppelbindung der Carbonylgruppe ist s stoff-Atom (C = O). Die ehr reaktiv, da sie wegen der hohen Elektronegativität des Sauer stoff-Atoms eine ausgepr ägte Dip olarität hat. Durch die positive Ladung am C-At om können nucleophile Gruppen hier leichter angreifen, wie auch elektrophile Gruppen am O-Atom leichter angreifen können. Es gibt zwei Arten der Carbonylgruppe: Eine Verbindung der Gruppe mit mindestens einem Wasserstoff-Atom wird Aldehyd ( Alcoholus Dehydrogenatus) genannt. Sie entstehen bei der O xidation von primären Alkoholen. Sind an die Carbo nylgruppe zwei Alky l- oder Aryl-G ruppen gebunden, wird dies als entstehen bei der Oxidation sekundär Keton bezeichnet. Ketone er Alkohole. Reaktionen der Carbonylverbindungen sind vor allem Additi onsreaktionen, da sie eine so genannte Abgangsgruppe besit zen, die durch Substitution aus getauscht werden ka nn. Unter Zuhilfenahme eines Katalysat ors lasse n sich auch Wassersto ffatome addieren, wobei wieder primäre bzw. sekundäre Alkohole entstehen. Material, Methoden s. Praktikumsskript Ergebnisse, Messwerte I. Darstellung und Charakterisierung eines Semicarbazons Nach dem Abnutschen des Niederschlags und Trock nung bleibt ein weißes Pulver zurück. Die Schmelzpunktbestimmung wurde zweimal durchgeführt. Beim ersten Mal lag der Schmelzpunkt bei 109°C, beim zweiten Mal bei 123,5°C. -1- Carbonylverbindungen II. Keto-Enol Tautometrie Nach Z ugabe v on FeCl 3-Lösung zur Lösung aus Wasser und Acetessigsäureethylester färbt s ich die Lösung violett. Gibt m an etwas Bromwasser hinzu, wird die Lös ung gelb- bräunlich. Die Farbe ändert wieder in violett, kann jedoch durch sich binnen k urzer Zeit erneute Zugabe von Bromwasser wieder gelb- bräunlich gefärbt werden. III. Aldolkondensation Nach dem Abnutschen der erstarrten Reaktionsmischung, dem Waschen mit Ethanol und Zerkleinerung bildet sich ein gelbes Pulver: Das Dibenzalaceton. IV. Bromaddition an Dibenzalaceton Eine kleine Spatelspitze des in III. hergestellten Dibenza lacetons wird in Dichlormethan gelöst und zusammen mit einem Kontrollansatz aus Dichlormethan im Wasserbad erwärmt. Gibt man Brom zum K ontrollansatz, bemerkt man eine braun e Färbung. Gibt man Brom in die Lösung aus Dichlormethan u nd Dibenzalaceton, färbt sich diese erst leicht bräunlich, wird aber schnell wieder hellgelb. Auswertung, Diskussion I. Um den Schmelzpunkt des unbekannten Ket einer Additions- und Kondens ons z u bestimmen, muss zuerst in ationsreaktion das Keton an das Semicarbazid gebunden werden. Dies geschieht so: + Keton Semicarbazid -2- Carbonylverbindungen Additionsprodukt Kondensationsprodukt Durch diese Reaktion entsteht das Semica Verbindung mit scharf abgegrenzten, gut rbazon, eine gut kristallisierende unterscheidbaren Sc hmelzpunkten, die eine Bestimmung des Ketons möglich machen. Leider ist mir hier eine genaue Bestimmung nicht vergönnt gewesen. Es wurden zwei unterschiedliche Schmelzpunkte gemess en, die obendrein nic ht mit dem für das Keton charakteristischen übereinstimmt en. Zu erwarten gewesen wäre ein Schmelzpunkt von 142°C für 4-Phenyl-butanon-2. Die gemessenen Werte von 109°C und 123,5°C sind also vollk ommen daneben. Zu er klären wäre dies einerseits durch die verwendeten Geräte, da die Messwer stammen oder einer evtl. Verunrei te aus zwei versc hiedenen Geräten nigung der Probe, da schon gering e Verschmutzung den Schmelzpunkt verändert. II. Den Anfangszustand der Reaktion stellt ein Tautometrie-Gleichgewicht zwischen der Keto- und der Enol-Form dar, wobei die Keto-Form zu 92% vorliegt und die EnolForm zu 8%. Keto-Form Nach Zugabe von FeCl Enol-Form 3-Lösung bildet sich durch das Eisen ein Eisen-Chelat- Komplex der Enol-Form, welcher die violette Färbung hervorruft. -3- Carbonylverbindungen +H+ Chelat-Komplex Gibt man nun Brom hinzu, so lagert es sich durch elek trophile Addition an die C- Doppelbindung der k omplexgebundenen Enolate an und bildet eine bromierte Verbindung. Dadurch kann sic h der Eisen-Chelat-Komplex nicht mehr bilden und die Färbung zum gelb-bräunlichen tritt ein, j edoch stellt sich das damit gestörte Gleichgewicht zwischen Keto- und Enol-F orm schnell wieder ein, und eine erneute violette Färbung ist zu beobachten. + Fe3+ + 2 HBr Nach Zugabe von Brom III. Ketone und Aldehyde können in Gegenwart starker Ba sen z u geringem Teil in Enolat übergehen. Das Enolat - ein starkes Nucleophil - kann am Carbonyl- C-Atom eines Neut ralteilchens angreifen. In dies em Fall wird Aceton mit Benz aldehyd in Anwesenheit von verdünnter NaOH zu Dibenz alaceton. Ein gelber Feststoff entsteht. Im Folgenden ist die Reaktion aufgezeigt. + Aceton Benzaldehyd -4- Carbonylverbindungen Dibenzalaceton IV. Wie auch schon in Versuch II, handelt es si ch um eine Addition von Brom an die C-Doppelbindungen des Dibenz alacetons. Da s konjugierte Doppelbindungssyste m wird durch das Brom zerstört. Hier die zugehörige Reaktionsgleichung in F orm von Zeichnungen: -5- Carbonylverbindungen + 2 Br2 farblos -6-