2014 Kapitel 5 Mikrobielles Wachstum
Werbung
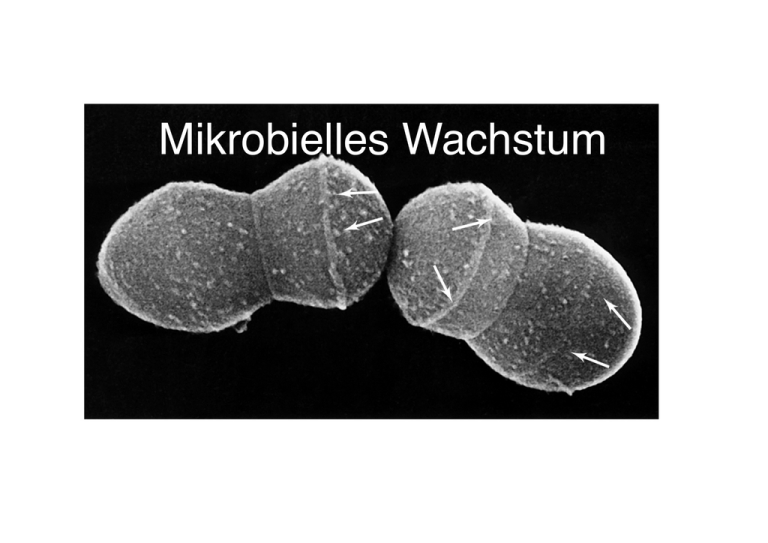
Mikrobielles Wachstum! Zellwachstum und Zweiteilung! Wachstum in der Mikrobiologie = Zunahme der Zellzahl! ! Zellen haben begrenzte Lebensdauer, d.h.! !Erhalt der Population nur durch Wachstum! ! bei den meisten Prokaryoten:! !Vermehrung durch Wachstum einer einzelnen Zelle und! !Zweiteilung Zweiteilung! DNA-Replikation! ! Verdopplung der Zelllänge ! Septumbildung:! inneres Wachstum von ! Zellwand & Cytoplasma-! membran! ! Teilung! ! 1 Generation = Zeit, die 1! Zelle benötigt, um 2 Zellen! zu bilden! abhängig von Nahrung & ! genet. Faktoren! Zellteilung: Fts Proteine! Fts = filamentous temperature-sensitive! beschreibt Eigenschaften von Mutanten in Fts Genen! ! Mutanten können sich nicht teilen ! Fts Proteine bei allen Prokaryonten, Archaea, auch in ! !Chloroplasten & Mitochondrien! ! Fts Proteine bauen den Teilungsapparat der Zelle auf:! Zellteilung: Fts Proteine! FtsZ bildet Ring um ! das Zentrum der Zelle! = Zellteilungsebene! ! FtsA bindet an FtsZ,! hydrolysiert ATP, ! liefert Energie für Divisom-Zusammenbau! ! ZipA verankert FtsZ-Ring! in der Cytoplasmamembran! ! FtsI wirkt an Peptidoglycan-! synthese mit (Penicillin target)! ! Divisom leitet Synthese neuer Zellwand & Cytoplasmamembran! Zellteilung! DNA-Replikation vor der Synthese des FtsZ-Rings! Beendigung signalisiert FtsZ assembly! ! die beiden Chromosomen werden bei! Zellverlängerung auseinander gezogen FtsK beteiligt! ! bei Einschnürung: Depolymerisation von! ! ! !FtsZ! Zellteilung! bei Einschnürung: Depolymerisation von! ! ! !FtsZ! ! löst Wachstum von Zellwand nach ! innen aus! ! FtsZ Polymerisierung/De- über! GTP Hydrolyse! ! Fts Proteine wichtige targets in ! klinischer Mikrobiologie! Peptidoglycansynthese & Zellteilung! wichtig: korrekte Einfügung! neuen Zellwandmaterials! ohne Strukturverlust! ! Autolysine bilden kleine! Öffnungen in der Zellwand! am FtsZ-Ring! ! neues Material wird hier! einfügt! Verbindung mit altem! Material bildet Wulst! ! Fehler in der Verbindung:! Autolyse! Peptidoglycansynthese! Lipidträgermolekül Bactoprenol! transportiert Vorläufer an der! Wachstumsstelle über die! Cytoplasmamembran! ! dann: enzymatische Spaltung! und Einbau in die Zellwand! Peptidoglycansynthese: Transpeptidierung! Verbindung von 2 Muraminsäureresten benachbarter Peptido-! glycanketten! ! wird durch Penicillin unterbrochen! ! mehrere Penicillinbindeproteine,! Penicillin hemmt deren enzymatische Aktivität! Wachstum von Bakterienpopulationen! Generationszeit: Zeit, die eine Zellpopulation braucht, um sich! ! ! zu verdoppeln! ! ! ! abhängig von Organismus und Nährmedium, T! (Prokaryoten < Eukaryoten)! E. coli: 20 min, S. cerevisiae: 90 min! ! in der Natur i.A. länger! Exponentielles Wachstum! Berechnung von ! Generationszeiten unter! spezifischen Bedingungen! im Praktikum! tgen = 30min! Wachstum einer Bakterienkultur! Lag-Phase: abhängig vom Inokulum (Alter, Kulturbedingungen)! exponentielle Phase: “gesündester” Zustand! stationäre Phase: Aufbrauchen von Nährstoffen und/oder ! ! !Anreicherung von Abfallprodukten stoppt Wachstum! Absterben! Messung mikrobiellen Wachstums! Zählung am Mikroskop (Phasenkontrast):! ! ! ! ! ! ! ! ! ! ! ! Vorteil: schnell! Nachteile: lebend/nicht lebend, kleine Zellen schwer zu sehen, ! ! !geringe Dichte, bewegliche Zellen! Messung mikrobiellen Wachstums! Lebendkeimzählung:! ! ! ! ! ! ! ! ! ! ! ! ! Messung mikrobiellen Wachstums! Lebendkeimzählung +! Verdünnung:! ! ! Fehlerquellen:! ! Nährmedium! Inkubationszeit! Koloniegrösse! ! Pipettierfehler! schlechtes Mischen! Messung mikrobiellen Wachstums! Trübung:! Messung mikrobiellen Wachstums! Trübung:! Messung mikrobiellen Wachstums! Trübung =! nur begrenzt! proportional! zur Zellzahl! Kontinuierliche Kultur: Chemostat! diskontinuierliche Kultur:! fixes Volumen Kulturmedium! verändert durch metabolische Aktivität der Mikroben geschlossenes System! ! kontinuierliche Kultur:! offenes System mit konstantem Volumen! ständig frisches Medium zugesetzt & aufgebrauchtes entzogen! Zellzahl & Nährstoffstatus konstant = stationärer Zustand ! Kontinuierliche Kultur: Chemostat! kontrolliert ! Wachstumsgeschwindigkeit! & Populationsdichte! ! ! ! wichtig:! Verdünnungsgeschwindigkeit! Konz. des wachstumsbegrenzenden! Nährstoffs! in diskontinuierlicher Kultur beeinflusst Nährstoffkonzentration! die Wachstumsgeschwindigkeit & den Ertrag! ! ! ! ! ! ! ! ! ! ! ! ! ! im Chemostat kann Wachstumsgeschwindigkeit über ! Verdünnungsgeschwindigkeit geregelt werden & Ertrag über! Anpassung der Nährstoffkonzentration! Chemostat im Gleichgewicht! Bakterienkonz = konstant, abhängig von Nährstoffkonz.! Wachstumsrate abhängig von Verdünnungsgeschwindigkeit! Kontinuierliche Kultur: Chemostat! Vorteile/Anwendungen: ! ! Populationen über lange Zeit (Tage, Wochen) in ! !exponentieller Wachstumsphase! !(z. B. um Enzymaktivitäten zu messen)! ! mikrobielle Ökologie: ! !Nachahmung natürlicher Bedingungen! !Untersuchung mikrobieller Gemeinschaften! ! Anreicherung & Isolierung spezifischer Bakterien aus ! !gemischtem Inokulum! ! !! Umwelt & Wachstum! Wachstum ist beeinflusst von! !Temperatur! !pH Wert! !An-/Abwesenheit von H2O! !O2! !Druck! !Strahlung! !! ! !! Umwelt & Wachstum: Temperatur! TABLE 5.1 Presently known upper temperature limits for growth of living organisms Group Animals Fish and other aquatic vertebratesa Insects Ostracods (crustaceans) Plants Vascular plants Mosses Eukaryotic microorganisms Protozoa Algae Fungi Prokaryotes Bacteria Cyanobacteria Anoxygenic phototrophs Chemoorganotrophic / chemolithotrophic Bacteria Archaea Chemoorganotrophic / chemolithotrophic Archaea Upper temperature limits (°C) 38 45-50 49-50 45 50 56 55-60 60-62 70-74 70-73 95 113 Umwelt & Wachstum: Temperatur! Kardinaltemperaturen:! min, max, opt! ! spezifisch für Organismus! beeinflusst von Nahrung! ! Leben möglich zwischen ! -2 und 113°C! ! einzelner Organismus:! max T-Spektrum 30-40 °C! ! Tmax: Denaturierung! Tmin: Membranstarre?! Umwelt & Wachstum: Temperaturklassen! Extrem thermophil Alicyclobacillus Thermus aquaticus Pyrodictium brockii Bsp mesophiler: E.coli, Tmin 8°C, Topt 39°C, Tmax 48°C! Extremophile: an beiden Enden des Spektrums! Temperaturklassen: ! Psychrophile & Psychrotolerante! der grösste Teil der Erde ist kalt:! Ozeane Durchschnitts T = 5°C, min 1-3°C! Antarktis: Dauerfrost! Arktis & subarktische Regionen; Permafrost! in jeder Form flüssigen Wassers kommen Mikroben vor! (auch in ‘brine channels’ im Eis)! Psychrophile & Psychrotolerante! sea ice core, McMurdo Sound! ! ! ! ! ! ! Diatomeen & Grünalgen aus! dem Eis! Psychrophile & Psychrotolerante! Lake Bonney, Dry Valleys, Antarctica! permanent gefroren! 5m Eisdecke! Wasser 0°C! oxische & anoxische Zonen! ! Psychrophile & Psychrotolerante! niedriges T optimum (< 15°C): ! !psychrophil! T optimum 20-40°C, aber Wachstum ! bei 0°C möglich: ! !psychrotolerant! ! ! Bsp psychrophil: Schneealgen! ! ! !Sierra Nevada! ! Psychrophile & Psychrotolerante! psychrotolerante:! häufiger als psychrophile! Wasser & Böden gemässigter Klimazonen! auch: Milch, Fleisch, Käse aus dem Kühlschrank...! ! ! Psychrophile & Psychrotolerante! Molekulare Anpassungen an die Kälte:! grössere Flexibilität in Enzymen! (Sekundärstruktur, aa-Zusammensetzung)! andere Membranzusammensetzung! ! ! Gefrierschutz:! ! Natürlich: Zucker, Peptide, Glycerin, Glycopeptide, Proteine! ! im Labor: Kryoprotektion durch DMSO, Glycerin! Temperaturklassen: ! Thermophile & Hyperthermophile! T opt > 45°C = thermophil! T opt > 80°C = hyperthermophil! ! Habitate: Wüsten, heisse Quellen, ! ! !Silagen! ! ! ! Bsp: heisse Quelle, Yellowstone! ! i.A.: schnelles Wachstum, ! evolutionäre Vielfalt! Bacteria & Archaea! Temperaturklassen: ! Thermophile & Hyperthermophile! thermale Gradienten entlang heisser Quellen:! besiedelt von verschiedenen mikrobiellen Gemeinschaften! ! Prokaryoten können bei ! höheren T wachsen als Eu-! ! Hyperthermophilste sind ! Archaea! ! nicht phototrophe können ! bei höheren T wachsen als! phototrophe! ! Temperaturklassen: ! Thermophile & Hyperthermophile! Thermophile auch in Heizkesseln, Stromkraftwerken, etc...! ! Molekulare Anpassungen an hohe T:! Enzyme stabiler (ionischen Bindungen, hydrophoberer Kern)! Proteinstabilisatoren im Cytoplasma, z.B. Phosphoglycerat! ! spezifische Membranlipide (C40 bei Archaea, basieren auf ! ! ! ! !Isopren, dadurch Lipidmonoschicht)! ! ! Anwendung in der Biotechnologie:! z. B. Taq-Polymerase in der PCR! Umwelt & mikrobielles Wachstum: ! pH, Osmolarität, O2! pH! innerhalb der Zelle! immer nahe pH 7! ! jeder Organismus! hat ein pH Optimum! ! i.A. 2-3 Einheiten! ! natürlich am ! häufigsten pH 5-9! Mikrobielles Wachstum & pH! Acidophile: pH Optimum ≤ 5! !obligat Acidophile können bei pH 7 nicht wachsen! !limitierend ist Stabilität der Cytoplasmamembran! ! Alkaliphile: pH Optimum ≥ 9! !in Natronseen, carbonat-haltigen Böden! !bei Archaea: oft auch halophil! !Energie aus Na+ Gradienten ! !(statt oder zusätzlich zur PMF)! Mikrobielles Wachstum & Osmolarität! alle Organismen brauchen H2O! gelöste Substanzen beeinflussen Verfügbarkeit von H2O! Mikrobielles Wachstum & Osmolarität! H2O diffundiert aus Region mit hoher [H2O] in Region mit! niederer [H2O] = Osmose! ! i.A. aus der Umgebung in die Zelle = positive H2O-Bilanz! aber: in Umgebung mit geringer Wasseraktivität (wenig H2O! !oder hohe [gelöster Stoffe]) wird Zellen H2O entzogen! Wachstum & Osmolarität: Halophile! Meerwasser: 3% NaCl ! Halophile brauchen Na+ ! schwach Halophile 1-6%! gemässigt Halophile 7-15%! ! Halotolerante können geringe! Salzkonz. überleben ! extrem Halophile: brauchen! 15-30% NaCl! ! Osmophile: können in ! zuckerreichen Habitaten! leben! !Xerophile:! !leben in trockenen Habitaten! Wachstum & Osmolarität! Aufnahme von H2O aus Medium mit niedriger Wasseraktivität! durch Erhöhung der Konz. ‘kompatibler, gelöster Stoffe’ in! der Zelle, z.B.! ! Pumpen anorganischer Ionen in die Zelle! Synthese oder Konzentration organischer gelöster Stoffe! ! Bedingung: ! keine Hemmung biochemischer Prozesse in der Zelle! ! ! Wachstum & Osmolarität! ‘kompatible, gelöster Stoffe’: Alkohole, Zuckeralkohole,! ! ! ! ! !aa & Derivate, K+! Wachstum & Osmolarität! ‘kompatible, gelöste Stoffe’:! Mikrobielles Wachstum & O2! Menschen: obligat aerob! Mikroben sind anders...! ! O2 ist schwach löslich in H2O: ! !in der Natur viele Habitate mit wenig oder keinem O2,! !z. B. Sedimente, Moore, feuchte Böden, Darmtrakte von! !Tieren! Mikroben & O2! Kulturmethoden Aerobe & Anaerobe! in Flüssigkultur:! ! O2 schnell verbraucht, nicht ausreichend Nachschub durch! !Diffusion; aerobe Kulturen werden geschüttelt oder! !aktiv belüftet! ! Anaerobe: schwierig O2 auszuschliessen (21% in der Luft)! !Kulturmethode hängt von der O2-Empfindlichkeit des! !Organismus ab! !Test der O2-Empfindlichkeit mit Thioglycat =! !Reduktionsmittel im Medium; ! !reduziert O2 im Medium zu H2O, so dass O2 nur an ! !der Oberfläche des Mediums zur Verfügung steht;! !ausserdem Redox-Indikator Resazurin:! ! !mit O2 rosa, ohne O2 farblos! Thioglycat-Medium mit Resazurin! a) aerobe! b) anaerobe! c) fakultativ aerobe! d) mikroaerophile! e) aerotolerante! anaerobe! Kulturmethoden Anaerobe! Anaerobentopf: gasdicht! ! ! Luft durch H2 + CO2 ersetzt, Rest-O2 wird! ! ! katalytisch entfernt! streng Anaerobe (z.B. Methanogene): auch Hantieren in O2-! !freier Atmosphäre nötig: Anaerobenkammer (H2 oder N2)! Kulturmethoden Anaerobe! Anaerobentopf: gasdicht! ! ! Luft durch H2 + CO2 ersetzt, Rest-O2 wird! ! ! katalytisch entfernt! streng Anaerobe (z.B. Methanogene): auch Hantieren in O2-! !freier Atmosphäre nötig: Anaerobenkammer (H2 oder N2)! !Medium: Kochen zur O2-Entfernung! ! ! + Reduktionsmittel! ! ! + Versiegelung unter O2-freiem Gas! Toxische Formen von O2! Nebenprodukte der Reduktion von O2 zu H2O! v.a. Superoxid & Hydroxylradikale schädigen alle organischen! !Bestandteile der Zelle! Enzyme, die toxische Formen ! von O2 zerstören! in Aeroben/fakultativ Aeroben! in obligat Anaeroben: kein O2!! Katalase-Nachweis! 30% H2O2 ! ! ! ! ! !30% H2O2! !+ Mikroben mit Katalase! ! !O2 Entstehung!