Nutzen eines krankenhausweiten Infektionspräventions
Werbung

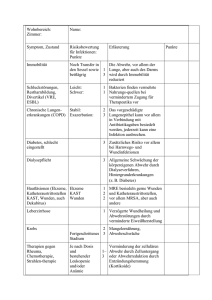
Originalarbeit | Original article 1717 Nutzen eines krankenhausweiten Infektionspräventions-Programmes zur Reduktion nosokomialer Infektionen und assoziierter Sepsisfälle (ALERTS) – Methodik und Zwischenergebnisse Autoren S. Hagel1,2,3 K. Ludewig2,4 J. Frosinski2,3 R. Hutagalung2 C. Porzelius2,5 P. Gastmeier6 S. Harbarth7 M.W. Pletz1,2 F.M. Brunkhorst4,8,9 Institut 1 Institutsangaben am Ende der Arbeit Zusammenfassung ▼ Hintergrund und Fragestellung: Nosokomiale Infektionen (NI) gehören zu den häufigsten Komplikationen eines Krankenhausaufenthaltes, erhöhen Morbidität und Mortalität und verursachen hohe Zusatzkosten. Primäres Ziel der ALERTS-Studie ist es zu zeigen, dass durch eine aktive Implementierung eines krankenhausweiten Infektionspräventionsprogrammes die Rate nosokomialer Infektionen und einer damit assoziierten Sepsis um mindestens 20 % reduziert werden kann. Methodik: Prospektive, interventionelle Kohortenstudie im Vorher-Nachher Design (Quasi-experimentelles Studiendesign). Ein Studienzentrum mit 12 teilnehmenden Fachabteilungen (27 Nomalpflegestationen und 4 Intensivtherapiestationen) mit insgesamt 809 Betten. Die Surveillance von NI erfolgt mittels eines computerbasierten Algorithmus, basierend auf der Gabe von antimikrobiellen Substanzen bei Patienten mit einem erhöhten Risiko für NI (d. h. Vorliegen von Venen- oder Harnblasenkathetern, operative Eingriffe). Im Anschluss an die erste Surveillance-Periode erfolgt die aktive Implementierung eines krankenhausweiten Infektionspräventionsprogrammes, welches die Implementierung von Maßnahmenbündel zur Vermeidung der vier häufigsten NI und eine stringente Umsetzung von Empfehlungen zur Händedesinfekti- on beinhaltet. Beginnend im Mai 2013 erfolgt gegenwärtig eine 18-monatige zweite Surveillance-Periode, in welcher der Erfolg der Maßnahmen beurteilt werden soll. Ergebnisse: Eine Zwischenauswertung der ersten Surveillance-Periode (09/2011–08/2012) ergab, dass in dieser Zeit 30 631 Patienten auf den teilnehmenden Stationen behandelt wurden. Basierend auf den CDC-Kriterien wurden 1637 nosokomiale Infektionen erfasst, was einer Inzidenz von 5,3 % entspricht. Basierend auf einer klinisch-infektiologischen Beurteilung, unabhängig von den CDC-Kriterien, wurden zusätzlich 944 NI diagnostiziert (Gesamtinzidenz: 8,4 %, n = 2581). Bei einem erheblichen Anteil der Patienten entwickelte sich eine schwere Sepsis bzw. ein septischer Schock als Folge der NI (tiefe Atemwegsinfektion, n = 279 [37 %]; postoperative Wundinfektion, n = 114 [25 %]; primäre Sepsis, n = 110 [32 %]; sympt. Harnwegsinfektion, n = 46 [8 %]; andere, n = 87 [22 %]). Folgerung: Bei Anwendung der CDC-Definitionen wird ein substantieller Anteil an nosokomialen Infektionen nicht erfasst, das reale Problem der nosokomialen Infektionen wird demnach unterschätzt. Weiterhin konnte gezeigt werden, dass es bei einem erheblichen Anteil nosokomialer Infektionen zu einer Progression von einer lokalisierten Infektion zu einer schweren Sepsis bzw. septischen Schock kommt. Einleitung ▼ Eine nosokomiale Infektion (NI) ist nach § 2 Infektionsschutzgesetz (IfSG) „eine Infektion mit lokalen oder systemischen Infektionszeichen als Reaktion auf das Vorhandensein von Erregern oder ihrer Toxine, die im zeitlichen Zusammenhang mit einer stationären oder einer ambulanten medizinischen Maßnahme steht, soweit die Infektion nicht bereits vorher bestand“ [11]. Non sokomiale Infektionen führen zu zusätzlichem Leid für die Patienten und deren Angehörigen, zusätzlichen Anstrengungen für das Personal und zusätzlichen Ausgaben für den Krankenhausträger und schlussendlich für die Solidargemeinschaft. Aufgrund ihrer weitreichenden Konsequenzen ist die Prävention von NI in den vergangenen Jahren vermehrt in das zentrale Blick- Prävention, Infektiologie Originalarbeit | Original article Schlüsselwörter nosokomiale Infektionen Sepsis Patientensicherheit Epidemiologie q q q q Keywords healthcare associated infections sepsis patient safety epidemiology q q q q eingereicht 03.05.2013 akzeptiert 25.07.2013 Bibliografie DOI 10.1055/s-0033-1349481 Dtsch Med Wochenschr 0 2013; 1380 0:1717–1722 · © Georg Thieme Verlag KG · Stuttgart · New York · ISSN 0012-04721439-4 13 Korrespondenz Prof. Dr. med. Frank Martin Brunkhorst Zentrum für Klinische Studien, Universitätsklinikum Jena Salvador-Allende Platz 27 07747 Jena Tel. 03641/9-323384 Fax 03641/9-34795 eMail frank.brunkhorst@ med.uni-jena.de Korrekturexemplar: Veröffentlichung (auch online), Vervielfältigung oder Weitergabe nicht erlaubt! n Heruntergeladen von: Thüringer Universitäts- und Landesbibliothek Jena. Urheberrechtlich geschützt. Effectiveness of a hospital-wide educational programme for infection control to reduce the rate of health-care associated infections and related sepsis (ALERTS) – methods and interim results Originalarbeit | Original article feld von Patientenverbänden, Ärzten, Krankenhäusern und Gesundheitsbehörden gerückt, was sich unter anderem in der Novellierung des IfSG im Juli 2011 widerspiegelt. Epidemiologie Pro Jahr treten ca. 400 000 bis 600 000 NI in Deutschland auf. Bei geschätzten 7500–15000 Patienten waren sie die Todesursache [4]. Erst kürzlich wurden die Ergebnisse der ersten europäischen Prävalenzerhebung des European Centre for Disease Prevention and Control (ECDC) zum Vorkommen von NI veröffentlicht. Insgesamt beteiligten sich 132 deutsche Krankenhäuser mit 41539 Patienten an dieser Erhebung. Die Prävalenz in Deutschland lag bei 3,9 %. Die häufigsten Infektionen waren Harnweginfektionen (23 %), postoperative Wundinfektionen (24 %) und untere Atemwegsinfektionen (22 %), gefolgt von C.difficile-Infektionen (6 %) und primärer Sepsis (6 %). Die häufigsten Erreger von NI waren E.coli (18 %), Enterokokken (13 %) und S.aureus (13 %) [1]. Eine vorab durchgeführte Pilotstudie mit 66 Krankenhäusern aus 23 Ländern zeigte eine Prävalenz von 7,1 % [14]. Im internationalen Kontext liegt die Prävalenz in Deutschland somit in einem vergleichsweise günstigen Rahmen. Kosten Bezüglich der ökonomischen Konsequenzen von NI in Deutschland gibt es nur wenige Daten. Eine aktuelle Studie konnte zeigen, dass Patienten mit einer beatmungsassoziierten tiefen Atemwegsinfektion eine durchschnittlich um 9 Tage längere Krankenhausverweildauer aufweisen und Zusatzkosten von insgesamt 17015 € entstehen [8]. Eine Studie aus Hannover konnte zeigen, dass für jeden Patienten mit einer nosokomialen Harnwegsinfektion, durch eine durchschnittliche Verlängerung der Krankenhausverweildauer von 4 Tagen, zusätzliche Kosten von etwa 1000 € entstehen [13]. Schätzungen aus den USA zeigen, dass den Krankenhäusern jährlich insgesamt bis zu 30 Milliarden US $ direkte Zusatzkosten aufgrund NI entstehen [12]. Präventionspotenzial Während die Gruppe von NI, die ihren Ursprung in exogenen Erregern haben, generell vermeidbar sein sollten, können endogen bedingte NI nur teilweise verhindert werden. Im Rahmen von KISS (Krankenhaus-Infektions-Surveillance-System) konnten bei verschiedenen NI wiederholt und in unterschiedlichen Zeitperioden signifikante Reduktionsraten von 20–30 % nachgewiesen werden. In einigen Krankenhäusern, vor allem solchen mit hohen Ausgangsinfektionsraten, kann das Reduktionspotenzial auch bis zu 40 % oder mehr betragen. Somit sind von den jährlich 400 000–600 000 NI ca. 80 000–180 000 NI und ca. 1500– 4500 assoziierte Todesfälle potenziell vermeidbar [5]. ALERTS-Studie Aktuell liegen keine Studien vor, welche die Effektivität eines krankenhausweiten, multimodalen aktiven Programms zur Prävention nosokomialer Infektionen untersucht haben. Entweder wurden nur ausgewählte Bereiche im Krankenhaus (z. B. Intensivtherapiestationen), einzelne Maßnahmen (z. B. Händedesinfektion) oder aber Maßnahmenbündel zur Prävention einer einzelnen nosokomialen Infektion (z. B. Gefäßkatheter-assoziierte Infektionen) untersucht. Weiterhin wurden viele Studien eher in solchen Krankenhäuser durchgeführt, die eine hohe Ausgangsinfektionsrate hatten und aufgrund dessen eine höhere Reduktion an NI erwartet werden konnte. Daten, wie häufig es zu einer Progression von einer lokalisierten NI zu einer schwe- ren Sepsis/septischem Schock kommt, sind ebenfalls nicht verfügbar. Ziel der ALERTS-Studie ist es, erstmals wissenschaftliche Grundlagen für ein krankenhausweites Infektionspräventionsprogramm zu schaffen und zu zeigen, dass hierdurch die Rate der NI und der damit verbundenen septischen Komplikationen um mindestens 20 % reduziert werden kann. Neben dem primären Studienziel werden gesundheitsökonomische Aspekte untersucht (COST – ALERTS) und ein klinischer Risikoscore (RISK – ALERTS) und laborchemische Parameter (LAB – ALERTS) zur frühzeitigen Identifizierung von Patienten mit einem erhöhten Risiko für eine Progression von einer lokalisierten NI zu einer schweren Sepsis/septischem Schock entwickelt bzw. identifiziert. Die Studie wird seit August 2011 in dem Integrierten Forschungs- und Behandlungszentrum (IFB) „Sepsis und Sepsisfolgen“ am Universitätsklinikum Jena durchgeführt. Nachfolgend werden Zwischenergebnisse der ersten Surveillance-Periode präsentiert. Methodik ▼ ALERTS ist eine prospektive, monozentrische, interventionelle Kohortenstudie im Vorher-Nachher-Design (quasi-experimentelles Studiendesign). Hierbei handelt es sich um ein gängiges Studiendesign im Bereich der Prävention nosokomialer Infektionen. Nachteil des nicht-randomisierten Studiendesign ist die Tatsache, dass z. B. konfundierende Variablen oder Störvariablen nicht vollständig ausgeschlossen werden können. Eine Randomisierung, z. B. auf Stationsebene einer Fachabteilung, ist jedoch nur eingeschränkt möglich, da sich die Patienten zwischen den Stationen in ihrem Krankheitsbild und Schweregrad teilweise deutlich unterscheiden und die Mitarbeiter ebenfalls nicht einem einzigen Bereich (z. B. Station) zugeordnet sind. Eine klare Trennung einer Intervention ist somit schwer umsetzbar und Effekte einer Intervention nur schwer vergleichbar. Das Universitätsklinikum Jena (UKJ) ist ein Haus der Maximalversorgung mit 1566 Betten und ca. 4500 Mitarbeitern, die personelle Besetzung des Hygienefachpersonal entspricht den Empfehlungen der KRINKO von 2009 [9]. Jährlich werden am UKJ über 52 000 Patienten stationär behandelt. An der ALERTSStudie nehmen 27 Normal- und 4 Intensivtherapiestationen der zentralen Abteilungen (q Tab. 1) mit insgesamt 809 Betten teil (Normalstation: 737, Intensivstation: 72). Zur Erhebung der Inzidenz nosokomialer Infektionen erfolgte vom 1. September 2011 bis zum 31. August 2012 eine erste Surveillance-Periode, an die sich die Intervention mit Implementierung der Infektionspräventionsmaßnahmen anschließt. Nachfolgend erfolgt über 18 Monate eine erneute Surveillance-Periode zur Messung der Ergebnisqualität (April 2013 bis September 2014). Das Studienpersonal besteht aus drei Krankenschwestern und zwei Ärzten (ein Internist/Infektiologe, ein Anästhesist/Intensivmediziner), die in Vollzeit mit der Durchführung der Studie betraut sind und in der Surveillance nosokomialer Infektionen, u. a. im „NRZ für die Surveillance von nosokomialen Infektionen“ in Berlin, geschult wurden. Ein positives Votum der lokalen Ethikkommission und des Datenschutzbeauftragten wurde vor Beginn der Studie eingeholt. Die Anmeldung im Deutschen Register Klinischer Studien erfolgte unter DRKS00003166. Dtsch Med Wochenschr 2013; 138: 1717–1722 · S. Hagel et al., Nutzen eines krankenhausweiten … Heruntergeladen von: Thüringer Universitäts- und Landesbibliothek Jena. Urheberrechtlich geschützt. 1718 Originalarbeit | Original article Tab. 1 Liste der teilnehmenden Abteilungen. 1719 Tab. 2 Anzahl nosokomialer Infektionen nach Infektfokus (CDC: CDC Kriterien erfüllt, Non-CDC: CDC Kriterien nicht erfüllt). Teilnehmende Abteilungen Infektionsfokus CDC (n,%) Non-CDC (n,%) Gesamt (n) Intensivmedizin Postoperative Wund- Klinik für Innere Medizin II, Hämatologie, Internistische Onkologie infektion 457 Klinik für Innere Medizin III, Nephrologie, Endokrinologie, Stoffwechselerkran- 3A1 131 (29 %) – 131 kungen und Rheumatologie/Osteologie 3A2 92 (20 %) – 92 Klinik für Innere Medizin IV, Gastroenterologie, Hepatologie und Infektiologie 3A3 234 (51 %) – 234 Klinik für Neurologie Infektion der unteren Klinik für Allgemein-, Viszeral- und Gefäßchirurgie Atemwege Klinik für Unfall-, Hand- und Wiederherstellungschirurgie 3Pneumonie 319 (57 %) 241 (43 %) 560 Klinik für Neurochirurgie 3Bronchitis 76 (38 %) 126 (62 %) 202 Klinik für Herz- und Thoraxchirurgie Primäre Sepsis 219 (64 %) 122 (36 %) 341 Klinik für Anästhesiologie und Intensivmedizin Harnwegsinfektion 175 (38 %) 283 (62 %) 458 Klinik für Frauenheilkunde C. difficile-Infektion 171 (100 %) – 171 Klinik für Geriatrie Andere Infektion 220 (56 %) 172 (44 %) 392 Summe 1637 (63 %) 944 (37 %) 2581 762 Surveillance Die Identifikation von Patienten mit einer möglichen NI erfolgt über die Verschreibung einer antimikrobiellen Therapie während des stationären Aufenthaltes. Diese Information wird täglich von dem Stationspflegepersonal der Normalstationen in der elektronischen Patientenakte (COPRA) oder dem Krankenhausinformationssystem (SAP) dokumentiert. Wird bei einem Patienten, der eine Liegedauer von mehr als 48 h und mindestens einen Risikofaktor für eine NI (operativer Eingriff, zentraler oder peripherer Venenkatheter oder Harnblasenkatheter) aufweist, eine antimikrobielle Therapie neu begonnen oder der Wirkstoff gewechselt, erfolgt eine Meldung an das Studienpersonal. Dieses evaluiert im Anschluss anhand klinischer, laborchemischer, mikrobiologischer und bildgebender Befunde, ob bei dem Patienten eine NI vorliegt. Im Gegensatz hierzu wird auf den Intensivtherapiestationen, aufgrund des breiten Einsatzes von antimikrobiellen Substanzen und des hohen Risikos für eine NI, bei jedem Patienten eine patientenbezogene Surveillance durchgeführt. Die Definition der NI erfolgt gemäß den Empfehlungen des „Centers for Disease Control and Prevention“ (CDC) [7]. Darüberhinaus erfolgt zusätzlich eine klinisch-infektiologische Einschätzung durch das Studienpersonal, um NI zu erfassen, welche nicht die CDC-Kriterien erfüllen (non-CDC). Neben demographischen Daten werden Fokus und Therapie der Infektion sowie die SIRS- bzw. Organdysfunktionskriterien nach Definition der Deutschen Sepsis-Gesellschaft [10] über 5 Tage nach Beginn der NI dokumentiert. Für die korrekte Berechnung der Inzidenzdichte von Device-assoziierten Infektionen pro 1000 Device-Tage wird weiterhin durch das Stationspersonal täglich für jeden Patienten das Vorhandensein eines zentralen bzw. eines peripheren Venenkatheters oder eines Harnblasenkatheters dokumentiert. maßnahmen zielen auf die Prävention der vier häufigsten NI (Harnwegsinfektionen, Infektionen der unteren Atemwege, postoperative Wundinfektionen und Gefäßkatheter-assoziierte Infektionen). Aktuelle evidenzbasierte, internationale Empfehlungen zur Infektionsprävention sollen in pragmatische, im Stationsalltag einfach umzusetzende Maßnahmenbündel zusammengefasst werden. Für die Implementierung und Umsetzung der Maßnahmen kommen Schulungen des Personals, Poster, Daten-Rückkopplung, öffentliche Veranstaltungen, Öffentlichkeitsarbeit, Checklisten und Optimierung von Arbeitsabläufen zum Einsatz. Unter anderem wurde in Kooperation mit der BAUHAUS Universität in Weimar eine Posterkampagne zur Händedesinfektion gestaltet (q Abb. 1). Die Schulung der Infektionspräventionsmaßnahmen werden während der zweiten Surveillance-Periode aktiv fortgeführt. Ergebnisse ▼ In der ersten Surveillance-Periode wurden in den teilnehmenden Abteilungen 30 631 Patienten stationär behandelt, von denen 26 949 eine Liegedauer von mehr als 2 Tagen aufwiesen. In Intervention Ziel ist es, für jede Organisationsebene (z. B. Station) spezifische Infektionspräventionsmaßnahmen in Form von Bündeln zu implementieren. Diese Maßnahmen richten sich nach den individuellen Bedürfnissen und Defiziten der jeweiligen Organisationsebene und werden mit Hilfe der Ergebnisse aus der ersten Surveillance-Periode erarbeitet. Zentraler Punkt der Infektionspräventionsmaßnahmen wird eine Optimierung der Maßnahmen zur Händehygiene sein. Weitere Infektionspräventions- Abb. 1 Posterkampagne in Kooperation mit der BAUHAUS Universität Weimar (©Sabrina Rossow). Dtsch Med Wochenschr 2013; 138: 1717–1722 · S. Hagel et al., Nutzen eines krankenhausweiten … Heruntergeladen von: Thüringer Universitäts- und Landesbibliothek Jena. Urheberrechtlich geschützt. Klinik für Innere Medizin I Kardiologie, Angiologie, Pneumologie, Internistische Originalarbeit | Original article Tab. 3 Andere Infektionen 13% Demographie (Patienten mit nosokomialer Infektion). Parameter Statistik Alter in Jahren (Median, IQR) 70 (57–77) Geschlecht 3Männlich 967 (53,75 %) 3Weiblich 832 (46,25 %) Body-Mass-Index in kg/m2 (Mittelwert, SD) 27,01 ± 5,79 Bestehende Infektion bei Aufnahme (n, %) 628 (34,91 %) Aufnahmeart 1799 (100 %) 3Elektiv operativ 576 (32,02 %) 3Elektiv konservativ 341 (18.95 %) 3Notfall operativ 329 (18.29 %) 3Notfall konservativ 553 (30.74 %) Unterbringung vor Aufnahme 1799 (100 %) 3Eigene Wohnung 1276 (70,93 %) 3Altersheim/Pflegeheim 78 (4,34 %) 3Anderes KKH/Reha 386 (2,46 %) 3Unbekannt 59 (3,28 %) Stationärer Voraufenthalt innerhalb 30 Tagen im UKJ (n, %) 495 (27,52 %) C. difficile Infektion 10 % Primäre Sepsis 13 % Diskussion ▼ Die Auswertung der ersten Surveillance-Periode zeigt eine Inzidenz nosokomialer Infektionen nach CDC-Definition von 5,3 %. Ein Vergleich mit bisherigen Studien zur Epidemiologie von NI in Deutschland ist schwierig, da bisher nur vereinzelt Inzidenzuntersuchungen durchgeführt wurden. Ein Vergleich der Ergebnisse aus Querschnittsuntersuchungen ist nicht möglich, da Da- Infektion der unteren Atemwege 25 % Symptomatische Harnwegsinfektionen 11 % Abb. 2 Verteilung der nosokomialen Infektionen (CDC-Definition, n = 1637). 40 35 37 33 30 diesen 12 Monaten wurden 1637 nosokomiale Infektionen nach CDC-Definition erfasst. Dies entspricht einer Inzidenz von 5,3 %. Zusätzlich wurden 944 Infektionen diagnostiziert, bei denen die CDC-Kriterien nicht erfüllt waren, jedoch im Rahmen der klinisch-infektiologischen Einschätzung eine nosokomiale Infektion vorlag (non-CDC). Somit wurden insgesamt 2581 nosokomiale Infektionen bei 1825 Patientenfällen erfasst (Gesamtinzidenz 8,4 %) (q Tab. 2). Die Verteilung aller 2581 diagnostizierten NI ist in q Abb. 2 dargestellt, eine Übersicht über demographische Parameter in q Tab. 3. Bei 3355 Meldungen, d. h. Episoden von Beginn bzw. Wechsel der antimikrobiellen Therapie und Vorliegen eines Risikofaktors für eine NI und einer Krankenhausverweildauer > 48 Stunden, konnte eine NI ausgeschlossen werden. Gründe hierfür waren z. B. Therapie einer ambulant erworbenen Infektion oder Behandlung einer NI, die in einem externen Krankenhaus erworben wurde. Bei 37 % der Patienten mit einer tiefen Atemwegsinfektion, bei 33 % der Patienten mit einer primären Sepsis, bei 25 % der Patienten mit einer postoperativen Wundinfektion und 8 % der Patienten mit einer symptomatischen Harnwegsinfektion kam es zu einer Progression von einer lokalisierten NI zu einer schweren Sepsis oder septischen Schock (q Abb. 3). Diese Progression spiegelt sich auch in der Rate der notwendigen Verlegungen von einer Normalstation auf eine Intensivstation aufgrund der NI wider (Atemwegsinfektion: 25 %, primäre Sepsis: 17 %, postoperative Wundinfektion: 23 %, sympt. Harnwegsinfektion: 6 %, Andere: 11 %). Weitere Analysen, u. a. zur Inzidenzdichte Katheter-assoziierter Infektionen, gesundheitsökonomische Aspekte (COST-ALERTS) und Risikostratifizierung (RISK-ALERTS), sind noch nicht abgeschlossen. Postoperative Wundinfektionen 28 % 25 25 20 22 15 10 8 5 0 Atemwegsinfektion Primäre Sepsis Wundinfektion Harnwegsinfektion Andere Abb. 3 Progression von einer lokalisierten Infektion zu einer schweren Sepsis oder septischem Schock (n = 2 581, Angaben in Prozent). ten zur Prävalenz und Inzidenz von NI nicht uneingeschränkt miteinander verglichen werden können. Die erste große nationale Inzidenzstudie ist die retrospektiv durchgeführte Studie der Deutschen Krankenhaus-Gesellschaft (DKG) aus dem Jahr 1990, bei der 5561 Patienten hinsichtlich des Auftretens von NI während des gesamten Krankenhausaufenthaltes beurteilt wurden. Hierbei wurden solche Infektionen, die frühestens am zweiten Krankenhaustag auftraten, als NI definiert (keine CDCDefinitionen) und eine Inzidenz von 6,3 % ermittelt [2]. Eine weitere umfangreiche Untersuchung wurde in den Jahren 1995 bis 1998 auf Intensivstationen und in chirurgischen Abteilungen von 8 mittelgroßen Krankenhäusern im Raum Freiburg und Berlin durchgeführt (NIDEP 2). Prospektiv wurden mehr als 11 000 Patienten im Hinblick auf die Entwicklung einer nosokomialen Infektion verfolgt, und es wurde eine Inzidenzrate von 6,9 % ermittelt [3]. Ein Vergleich dieser Ergebnisse mit unseren Daten ist jedoch nur eingeschränkt möglich, da sich die Untersuchungen zum einen in ihren Definitionen für nosokomiale Infektionen (DKG-Studie: keine CDC-Definition) und zum anderen in der untersuchten Patientenpopulation (NIDEP-2: nur Patienten der Chirurgie und Intensivmedizin) unterscheiden. Ebenfalls ist es nur eingeschränkt möglich, unsere Ergebnisse generell auf andere deutsche Krankenhäuser zu übertragen, da die Rate NI u. a. von der Versorgungsstufe und der Patientenpopulation bzw. dem case-mix abhängig ist. So hatten in der nationalen Prävalenzstudie des ECDC große Krankenhäuser (> 800 Betten) höhere Prävalenzraten als kleinere Krankenhäuser (Gesamtpräva- Dtsch Med Wochenschr 2013; 138: 1717–1722 · S. Hagel et al., Nutzen eines krankenhausweiten … Heruntergeladen von: Thüringer Universitäts- und Landesbibliothek Jena. Urheberrechtlich geschützt. 1720 Originalarbeit | Original article Die Verteilung der NI deckt sich mit den Ergebnissen der ECDCPrävalenzstudie für die Infektionen der unteren Atemwege (ALERTS 25 % vs. 22 % ECDC), der postoperativen Wundinfektionen (ALERTS 28 % vs. 25 % ECDC) und bei den C.difficile-Infektionen (ALERTS 10 % vs. 7 % ECDC). Auffällig sind jedoch die Unterschiede bei den symptomatischen Harnwegsinfektionen (ALERTS 11 % vs. 22 % ECDC) und bei der primären Sepsis (ALERTS 13 % vs. 6 % ECDC). Ein Grund für die niedrige Rate an nosokomialen Harnwegsinfektionen könnte in den unterschiedlichen Studiendesigns liegen. Die Surveillance nosokomialer Infektionen erfolgt in der ALERTS-Studie hauptsächlich anhand klinischer, laborchemischer, mikrobiologischer und bildgebender Befunde und ist somit in einem hohen Maße auf die Qualität der Krankenaktendokumentation der behandelnden Pflegekräfte und Ärzte angewiesen. Wichtige klinische Symptome (z. B. Harndrang, erhöhte Miktionsfrequenz) für die Diagnose einer Harnwegsinfektion nach CDC-Definition werden jedoch häufig nicht dokumentiert und können somit nicht in die Beurteilung einbezogen werden. Eine Untersuchung bzw. Befragung des Patienten durch das Studienteam wäre für die Qualität der Entscheidung, ob eine NI vorliegt, wünschenswert, aufgrund der Anzahl der Meldungen (15–20 Stück/Tag) jedoch nicht umsetzbar. Im Gegensatz hierzu besteht bei Querschnittsuntersuchungen häufig die Gelegenheit das Pflegepersonal, die Ärzte oder den Patienten direkt zu befragen, da er sich zu diesem Zeitpunkt noch in Behandlung befindet. Die CDC-Kriterien für die Diagnose einer nosokomialen Harnwegsinfektion können somit exakter beurteilt werden. Ein Grund für die erhöhte Rate an primären Sepsisfällen könnte in der Diagnostikintensität liegen. Da nach den CDC-Definitionen erst der Erregernachweis in der Blutkultur eine Blutstrominfektion eindeutig anzeigt, wird die Chance, nosokomiale Blutstrominfektionen zu identifizieren, eindeutig höher, wenn viele Kulturen abgenommen werden. Erst kürzlich konnten Gastmeier et al. für Deutschland zeigen, dass ein Zusammenhang zwischen der Zahl an abgenommenen Blutkulturen und den ermittelten ZVK-assoziierten Sepsisraten besteht [6]. Unabhängig davon können natürlich auch Defizite im Bereich der Prävention von Gefäßkatheter-assoziierten Infektionen eine Rolle spielen. Wundinfektion, einer tiefen Atemwegsinfektion oder einer primären Sepsis, eine Progression zu einer schweren Sepsis oder septischen Schock aufweisen und eine Verlegung von einer Normal- auf eine Intensivstation erforderlich macht. Dies impliziert einen Einfluss auf die Morbidität und Mortalität sowie zusätzliche Behandlungskosten – beides Punkte, die in weiteren Analysen genauer betrachtet werden müssen. Limitierend muss erwähnt werden, dass in unserer Studie die Surveillance für postoperative Wundinfektionen nur bis zur Krankenhausentlassung durchgeführt wird, und nicht 30 Tage postoperativ bzw. ein Jahr bei Implantaten. Weiterhin kann ein Melde-Bias (fehlende Meldung bei Beginn bzw. Wechsel einer antimikrobiellen Substanz) nicht ausgeschlossen werden, sodass die von uns ermittelten Zahlen für NI möglicherweise nicht das ganze Ausmaß widerspiegeln. Konsequenz für Klinik und Praxis 3Nosokomiale Infektionen führen zu zusätzlichem Leid für die Patienten und deren Angehörigen, zusätzlichen Anstrengungen für das Personal und zusätzlichen Ausgaben für den Krankenhausträger und die Solidargemeinschaft. 3Bei Anwendung der CDC-Definitionen wird ein substantieller Anteil an nosokomialen Infektionen nicht erfasst – das reale Problem der nosokomialen Infektionen wird demnach unterschätzt. 3Bei einem erheblichen Anteil nosokomialer Infektionen kommt es zu einer Progression von einer lokalisierten Infektion zu einer schweren Sepsis bzw. septischen Schock Förderung: Diese Arbeiten wurden durch das Bundesministerium für Bildung und Forschung (BMBF), FKZ: 01EO1002, gefördert. Autorenerklärung: Die Autoren erklären, dass sie keine finanzielle Verbindung mit einer Firma haben, deren Produkt in diesem Beitrag eine Rolle spielt (oder mit einer Firma, die ein Konkurrenzprodukt vertreibt). Institutsangaben 1Zentrum für Infektionsmedizin und Krankenhaushygiene, Universitätsklinikum Jena 2Integriertes Forschungs- und Behandlungszentrum (IFB) Sepsis und Sepsisfolgen (CSCC), Universitätsklinikum Jena Unsere Ergebnisse zeigen weiterhin, dass ein großer Anteil nosokomialer Infektionen nicht erfasst wird, wenn man die CDCKriterien als Definition zu Grunde legt. In unserer Studie wurden 944 Infektionen diagnostiziert, bei denen die CDC-Kriterien nicht erfüllt waren, jedoch im Rahmen der klinisch-infektiologischen Einschätzung eine NI vorlag. Dies entspricht 36 % aller erfassten NI, sodass vermutet werden kann, dass die bisherigen Schätzung zum Vorkommen von NI das reale Problem unterschätzen. Ein Grund hierfür liegt in den teils sehr eng gefassten CDC-Kriterien, bei denen eine NI nicht als solche gewertet werden kann, auch wenn die klinisch-infektiologische Einschätzung zu einem anderen Ergebnis kommt (z. B. bei Fehlen der von der CDC geforderten zweiten Röntgen-Thorax-Untersuchung zur Bestätigung einer Pneumonie bei Patienten mit bekannter pulmonaler oder kardialer Grundkrankheit). Als weiterer wichtiger Punkt in unserer Studie zeigt sich, dass ein großer Anteil der Patienten mit einer NI, zumindest mit einer postoperativen 3Klinik für Innere Medizin IV, Gastroenterologie, Hepatologie, Infektiologie Universitätsklinikum Jena 4Klinik für Anästhesiologie und Intensivtherapie, Universitätsklinikum Jena 5Institut für Medizinische Informatik, Statistik und Epidemiologie, Universität Leipzig 6Institut für Hygiene und Umweltmedizin, Charité, Universitätsmedizin Berlin 7Service Prévention et Contrôle de l`Infection, Hôpitaux Universitaires de Genève, Genf 8Paul-Martini-Forschergruppe für Klinische Sepsisforschung, Universitätsklinikum Jena 9Zentrum für Klinische Studien (ZKS), Universitätsklinikum Jena Dtsch Med Wochenschr 2013; 138: 1717–1722 · S. Hagel et al., Nutzen eines krankenhausweiten … Heruntergeladen von: Thüringer Universitäts- und Landesbibliothek Jena. Urheberrechtlich geschützt. lenzrate für Universitätskliniken 6,0 % vs. 3,3 % für die repräsentative Stichprobe mit einer medianen Bettenzahl von 216 Betten) [1]. 1721 Originalarbeit | Original article Abstract Effectiveness of a hospital-wide educational programme for infection control to reduce the rate of health-care associated infections and related sepsis (ALERTS) – methods and interim results ▼ Background and aim: Health care associated infections (HAIs) are one of the most frequent complications of hospital care, associated with increased morbidity, mortality and considerable extra costs for the health care system. The overarching objective of the ALERTS study is to demonstrate the feasibility of a hospitalwide programme to reduce the burden of HAIs and related sepsis of at least 20 %. Methods: Prospective, quasi-experimental study covering all acute care units (27 general wards, 4 ICUs, overall 809 beds) at Jena University Hospital. Surveillance for HAIs is performed by computerized antibiotic monitoring in patients with risk factors for HAIs (i. e. intravenous and urinary catheters, surgery) on a daily basis. Following the first surveillance period a multifaceted, pragmatic infection control programme, aimed at proper hand hygiene and bundles for the prevention of the four most common HAIs will be implemented. Subsequently, a second surveillance period lasting 18 months will be conducted to measure the effect of the infection control programme, starting in May 2013. Results: Interim results for the first surveillance period (09/2011 to 08/2012) are presented. During this period, 30,631 patients were admitted to the participating departments. According to CDC definitions we identified 1,637 HAIs, resulting in an overall incidence of 5.3 %. Based on clinical evaluation only, irrespective of the CDC definitions, an additional 944 HAIs were detected (overall HAI rate, 8.4 % [n =2581]). A substantial proportion of patients had HAI associated severe sepsis or septic shock (lower respiratory tract infection, n = 279 [37 %]; surgical site infection, n = 114 [25 %]; primary sepsis, n = 110 [32 %]; urinary tract infection, n = 46 [8 %]; other, n = 87 [22 %]). Conclusion: Our numbers reveal that a high number of HAIs are missed using CDC-definitions and therefore the magnitude of the problem might be underestimated. Furthermore, a high percentage of HAIs progress from localized infection to severe sepsis or septic shock, requiring ICU treatment. Literatur 1 Behnke M, Hansen S, Leistner R et al. Die zweite nationale Prävalenzstudie zu nosokomialen Infektionen und Antibiotika-Anwendung in Deutschland. Dtsch Arztebl im Druck 2 Deutsche Krankenhausgesellschaft. Ermittlung und Analyse von Krankenhausinfektionen: Grundsätze und Massnahmen zur Optimierung der Hygiene im Krankenhaus. Düsseldorf, 1990 3 Gastmeier P, Bräuer H, Forster D et al. A quality management project in 8 selected hospitals to reduce nosocomial infections: a prospective, controlled study. Infect Control Hosp Epidemiol 2002; 23: 91–97 4 Gastmeier P, Geffers C. Nosokomiale Infektionen in Deutschland: Wie viele gibt es wirklich? Dtsch Med Wochenschr 2008; 133: 1111– 1115 5 Gastmeier P, Brunkhorst F, Schrappe M et al. Wie viele nosokomiale Infektionen sind vermeidbar? Dtsch Med Wochenschr 2010; 135: 91–93 6 Gastmeier P, Schwab M, Behnke C et al. Wenige Blutkulturproben – wenige Infektionen?. Anaesthesist 2011; 60: 902–907 7 Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control 2008; 36: 309–332 8 Leistner R, Kankura L, Bloch A et al. Attributable costs of ventilatorassociated lower respiratory tract infection (LRTI) acquired on intensive care units: a retrospectively matched cohort study. Antimicrob Resist Infect Control 2013; 2: 13 9 Kommission für Krankenhaushygiene und Infektionsprävention. Personelle und organisatorische Voraussetzungen zur Prävention nosokomialer Infektionen. Bundesgesundheitsbl 2009; 52: 951–962 10 Reinhart K, Brunkhorst FM, Bone H-G et al. Prevention, diagnosis, treatment, and follow-up care of sepsis. First revision of the S2k Guidelines of the German Sepsis Society (DSG) and the German Interdisciplinary Association for Intensive and Emergency Care Medicine (DIVI). Anaesthesist 2010; 59: 347–370 11 Robert Koch Institut. Prävention von nosokomialen Infektionen und Krankenhaushygiene im Infektionsschutzgesetz (IfSG) 2011. http://www.rki.de/DE/Content/Infekt/Krankenhaushygiene/Praevention_nosokomial/Noso_infekt_01.pdf?__blob=publicationFile 12 Scott R. The direct medical costs of healthcare-associated infections in U.S. hospitals and the benefits of prevention. 2009; Zugriff: http://www.cdc.gov/hai/pdfs/hai/scott_costpaper.pdf 13 Vonberg RP, Behnke M, Rüden H et al. Kosten durch Harnweginfektionen in Deutschland. Urologe A 2008; 47: 54–58 14 Zarb P, Coignard B, Griskeviciene J. The European Centre for Disease Prevention and Control (ECDC) pilot point prevalence survey of healthcare -asociated infections and antimicrobial use.Euro Surveill 2012; http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20316 Dtsch Med Wochenschr 2013; 138: 1717–1722 · S. Hagel et al., Nutzen eines krankenhausweiten … Heruntergeladen von: Thüringer Universitäts- und Landesbibliothek Jena. Urheberrechtlich geschützt. 1722