Peptidtransport
Werbung

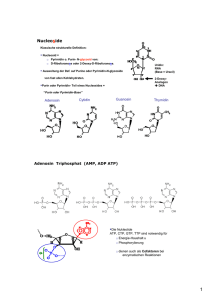
Peptidtransport Versuch 1E Glycosylierung O-Glycosylierung: Ser, Thr N-Glycosylierung: Asn ~ 50% eukaryotischer Proteine sind glycosyliert; 90% dieser enthalten N- verknüpfte Glycane (Motiv: Asn-X-Ser/Thr) “TAP-Peptid (NST-f)”: (RRYQNSTC(f)L) Versuchsdurchführung Membranen auf Eis auftauen ATP oder Apyrase, MgCl2 und PBS zugeben Transport durch Zugabe von NST-f Peptid starten 3 min @ 32°C Abstoppen durch Zugabe von 1 ml eiskaltem Stop-Puffer, 8 min @ 14000 rpm Pellet resuspendieren in 100 µl Lysepuffer, 800 µl Lysepuffer zugeben, 15 min @ RT inkubieren 8 min @ 14000 rpm zentrifugieren, 50 µl Concanavalin A beads zum Überstand geben, 1 h @ 4°C rotieren ConA beads 2x mit 1 ml Lysepuffer waschen; beads in 300 µl Elutionspuffer resuspendieren für 30 min @ 4°C rotieren 2 min @ 1000 rpm abzentrifugieren, 250 µl der Elution in eine 96well plate überführen, im ELISA-Reader quantifizieren Apyrase Hintergrundbestimmung: ATP wird durch 1 unit Apyrase ersetzt. Apyrase (Enzym) besitzt Adenosin 5’-triphosphatase- und Adenosin 5’diphosphataseaktivität. Apyrase ATP + H2O AMP + 2 Pi Concanavalin A 2 Concanavalin A (Con A) ist ein Metalloprptoein aus der Jackbohne (Canavalia ensiformis) und gehört zur Gruppe der Lektine. 2 bindet α-D-Glucose und ähnliche Zucker, ohne eine enzymatische Aktivität aufzuweisen. 2 Das Concanavalin Monomer besteht aus 237 AS und enthält strukturbildendes Mangan und Calcium. 2 Die Anwesenheit dieser Metallionen bewirkt, dass Con A in der Lage ist Kohlenhydrate zu binden. Bei einem neutralen pH-wert (um 7) lagert es sich zu einem Tetramer zusammen, im sauren pH-Bereich zerfällt es zu einem Dimer. N-Glycosylierung von Asn-Resten n m l g i k f h j d core e c b a N-verknüpfte Glycoproteine enthalten einen gemeinsamen Zuckerbaum besthend aus 3 Mannoseund 2 GlcNAc-Gruppen. Ein pre-synthetisiertes Glycan (Glc3Man9GlcNac2) wird an die Konsensus-Sequenz Asn-X-Ser/Thr übertragen, wenn eine Polypeptidkette im ER synthetisiert wird.