Wo die Elektronen wohnen Magnetische Eigenschaften
Werbung

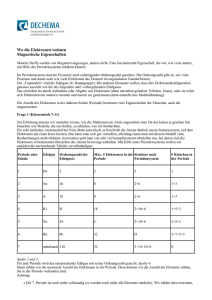
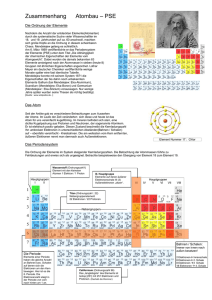
Wo die Elektronen wohnen Magnetische Eigenschaften Manche Stoffe werden von Magneten angezogen, andere nicht. Eine faszinierende Eigenschaft, die wir, wie viele andere, mit Hilfe des Periodensystems erklären können. Im Periodensystem sind die Elemente nach aufsteigender Ordnungszahl geordnet. Die Ordnungszahl gibt an, wie viele Protonen und damit auch wie viele Elektronen das Element im ungeladenen Zustand besitzt. Die „Topmodels“ sind die Edelgase (8. Hauptgruppe): Die anderen Elemente wollen, dass ihre Elektronenkonfiguration genauso aussieht wie die des folgenden oder vorhergehenden Edelgases. Das erreichen sie durch Aufnahme oder Abgabe von Elektronen (dann entstehen geladene Teilchen, Ionen), oder sie teilen sich Elektronen mit anderen Atomen und nutzen sie gemeinsam (dann entsteht eine Molekülbindung). Die Anzahl der Elektronen in der äußeren Schale (Periode) bestimmt viele Eigenschaften der Elemente, auch die magnetischen. Frage 1 (Klassenstufe 7-11) Zur Erklärung müssen wir zunächst wissen, wie die Elektronen im Atom angeordnet sind. Da das keiner je gesehen hat, brauchen wie Modelle, die uns helfen, zu erklären, was wir beobachten. Ein sehr einfaches Atommodell hat Niels Bohr entwickelt; er beschrieb die Atome ähnlich einem Sonnensystem, auf dem Elektronen um einen Kern kreisen. Das kann man sich gut vorstellen, allerdings kann man mit diesem Modell viele Beobachtungen nicht erklären. Inzwischen geht man von sehr viel komplizierteren Modellen aus, bei denen sich die Elektronen in bestimmten Bereichen des Atoms bevorzugt aufhalten. Mit Hilfe eines Periodensystems wollen wir zunächst die nachstehende Tabelle vervollständigen: Periode oder Schale Edelgas Ordnungszahl des Edelgases Max. # Elektronen in der Struktur nach Periode Periodensystem # Kästchen in der Periode 1 He 2 2 2 1 2 Ne 10 8 2+6 1+3 3 A 18 8 2+6 1+3 4 Kr B 18 2+10+6 1+5+3 5 Xe 54 C 2+10+6 1+5+3 6 Rn 86 32 D 1+7+5+3 7 unbekannt 118 32 2+14+10+6 E Spalte 2 und 3: Für jede Periode wird das entsprechende Edelgas mit seiner Ordnungszahl gesucht. Spalte 4: Dann zählen wir die maximale Anzahl der Elektronen in der Periode. Dazu können wir die Anzahl der Elemente zählen, die in der Periode vorhanden sind. Achtung: Die 7. Periode ist noch nicht vollständig (es wurden noch nicht alle Elemente entdeckt). Wir zählen diese trotzdem, Die 7. Periode ist noch nicht vollständig (es wurden noch nicht alle Elemente entdeckt). Wir zählen diese trotzdem, als ob es die fehlenden Elemente schon geben würde. Je nachdem, was für ein Periodensystem ihr benutzt, sind in der 6. und 7. Periode jeweils Elementreihen aus dem Periodensystem herausgenommen (die sogenannten Lanthanoide und Actinoide). Dies ist aber nur passiert, damit das Periodensystem gut auf ein Blatt Papier passt. Wir müssen diese Elemente an der richtigen Stelle mitzählen. Spalte 5: Das Periodensystem hat mehrere Stufen. Wir müssen die Anzahl der Elemente innerhalb jeder einzelnen Stufe zählen. Nicht alle Stufen kommen in jeder Periode vor. In Gedanken (oder auf unserem Periodensystem) ziehen wir am Ende jeder Stufe einen dicken Strich: zwischen Be, Mg, Ca, Sr, Ba, Ra und La, Ac zwischen Yb, No und Sc, Y, Lu, Lr zwischen Zn, Cd, Hg und B, Al, Ga, In, Tl Jetzt zählen wir für jede Periode die Anzahl der Elemente zwischen Anfang, den jeweiligen Strichen und dem Ende der Periode und schreiben diese auf. Spalte 6: Wir nehmen das Ergebnis von Spalte 5 und teilen die Zahl jeweils durch 2. Was muss in den Kästchen anstelle der roten Buchstaben stehen? A: Lösung: Ar (Argon) B: Lösung: 36 C: Lösung: 18 D: Lösung: 2+14+10+6 E: Lösung: 1+7+5+3 Zusatzfrage für die Klassen 9-11 Was hat es nun mit den Kästchen der Spalte 6 auf sich? Das müsst ihr euch wie Zugfahren vorstellen: Jeder, der einsteigt, setzt sich zunächst auf einen freien 2er- Platz. Erst, wenn die Plätze alle einfach besetzt sind, setzten sich die fremden Leute auch mal nebeneinander. Um Platzierung und Zustand von Elektronen anschaulich zu machen, hat man sich die Kästchen (Orbitale) als Hilfsmittel genommen. In jedes passen 2 Elektronen. Allerdings benehmen sich diese wie die Fahrgäste: erst eines in jedes Kästchen und dann wird aufgefüllt. Die einzelnen Perioden sind dann wie Züge. Erst, wenn der eine voll ist, dürfen die Fährgäste in den nächsten einsteigen. Wie im Zug, gibt es auch im Atom unterschiedliche „Abteile“. Um im Bild zu bleiben: Die Fahrgäste sitzen lieber im Zweierabteil. Erst, wenn das voll ist, gehen sie auch in den Großraumwagen. So wird in der 2. Periode mit Li (1 Elektron) und Be (2 Elektronen) zuerst das 1. Kästchen gefüllt. Die folgenden 3 Kästchen sind der Großraumwagen. Erst werden drei einzelne Plätze besetzt, dann die Doppelsitze. Abfahrt! In dem Bild unten haben wir die Besetzung der Kästchen (Orbitale) mit Elektronen dargestellt. Wir können uns die Elektronen als kleine Magnete mit Nord- und Südpol vorstellen. Solange jedes Elektron ein Kästchen für sich hat, richten sie sich alle in dieselbe Richtung aus (z.B. alle mit dem Nordpol nach oben). So bekommt jedes zusätzliche Elektron von B bis N sein eigenes Kästchen. Kommt aber ein zweites Elektron in ein Kästchen hinzu, muss dieses in die entgegengesetzte Richtung weisen. Beim Stickstoff sind 4 Kästchen gefüllt. Eins mit 2 Elektronen und 3 Wir können uns die Elektronen als kleine Magnete mit Nord- und Südpol vorstellen. Solange jedes Elektron ein Kästchen für sich hat, richten sie sich alle in dieselbe Richtung aus (z.B. alle mit dem Nordpol nach oben). So bekommt jedes zusätzliche Elektron von B bis N sein eigenes Kästchen. Kommt aber ein zweites Elektron in ein Kästchen hinzu, muss dieses in die entgegengesetzte Richtung weisen. Beim Stickstoff sind 4 Kästchen gefüllt. Eins mit 2 Elektronen und 3 Kästchen mit jeweils 1 Elektron. Auf diese Art und Weise lässt sich das ganze Periodensystem mit Elektronen auffüllen. So ergibt sich z.B. für die 2. Periode: Quelle: DECHEMAX Wo sind nun die magnetisch aktivsten Elemente? Für die magnetischen Eigenschaften der Elemente ist es entscheidend wie viele „ungepaarte“ Elektronen vorhanden sind (d.h. wie viele Elektronen ein Kästchen für sich alleine haben). Periode Anzahl Elektronen, die alleine in Kästchen sind Element 1 1 H 2 3 N 3 3 P 4 5 Mn 5 5 Tc 6 7 Eu 7 7 Am Diese Elemente sind theoretisch die maximal magnetisch aktivsten Elemente in der jeweiligen Periode. Wenn ihr euch jetzt fragt, warum ihr noch nie etwas von magnetischem Mangan gehört habt, liegt das wahrscheinlich daran, dass man – wenn überhaupt – mit verschiedenen Manganverbindungen zu tun hat, aber nur im seltensten Fall mit metallischem Mangan. Um Magnetismus technisch einsetzen zu können, sind deshalb noch andere Eigenschaften der Elemente wichtig: Kommen diese überhaupt elementar vor, lassen sie sich gut verarbeiten, wie teuer sind sie... Magnetische Bauteile gibt es in sehr verschiedenen Geräten. Ordnet im folgenden die Materialien ihren Einsatzgebieten zu. Vor der Cloud, der Festplatte und sogar der CD waren Kassetten die wichtigsten Speichermedien für Musik. Sie waren mit Eisenoxid oder mit diesem Material beschichtet: Neodym Chromdioxid Nickel- Eisen- Kobalt- Legierung Ferrit Lösung: Chromdioxid oder CrO2 Bei diesem „Selten- Erd“- Element werden die ungepaarten Elektronen von den äußeren Schalen „abgeschirmt“. Daraus resultiert ein besonders starker Magnetismus – wichtig zum Beispiel für die Windkrafterzeugung. Neodym Chromdioxid Nickel- Eisen- Kobalt- Legierung Ferrit Lösung: Neodym Das sogenannte „Mu- Metall“ dient vor allem dazu, magnetische Felder abzuschirmen. So kann verhindert werden, dass empfindliche Messgeräte oder Bildröhren durch äußere Magnetfelder gestört werden Neodym Chromdioxid Nickel- Eisen- Kobalt- Legierung Ferrit Lösung: Nickel- Eisen- Kobalt- Legierung Dieses Material, dessen Hauptbestandteil Eisenoxid ist, gehört zu den kostengünstigsten Materialien; daraus bestehen zum Beispiel die klassischen Hufeisenmagnete, die ihr aus der Schule kennt. Neodym Chromdioxid Nickel- Eisen- Kobalt- Legierung Ferrit Lösung: Ferrit Zusatzfrage (Klassenstufe 11) Damit verstehen wir den Magnetismus der einzelnen Atome. Aber wie funktioniert das in einem Metallblock? Ein Stück Eisen besteht zwar aus lauter Atomen, die magnetisch sind (wie wir mit unseren Kästchen beweisen können), dennoch zeigt ein frisch aus der Schmelze kommender Block Eisen erst einmal keine magnetischen Eigenschaften. Wie die magnetischen Eigenschaften zustande kommen, veranschaulicht das folgende Diagramm: Quelle: DECHEMAX Die einzelnen Atome und damit ihre Elektronen in den Kästchen liegen zunächst bunt gemischt nebeneinander. Die Anordnung ist zufällig und damit zeigt sich nach außen keine magnetische Eigenschaft. Das liegt daran, dass die magnetischen Kräfte der einzelnen Atome in verschiedene Richtungen wirken und sich so gegenseitig aufheben (Punkt 1). Wird nun ein starkes magnetisches Feld angelegt (x- Achse), richten sich die einzelnen Elektronen innerhalb der Kästchen in die Richtung des magnetischen Feldes aus. Dieser Effekt hängt von der Stärke des angelegten Magnetfeldes ab. Das Material hat seine maximale Magnetisierung erreicht, wenn alle Elektronen in ihren Kästchen in die Richtung des Magnetfeldes zeigen (Punkt 3). Es gibt noch eine Besonderheit: Man kann die gestrichelte Linie nicht mehr zurück gehen. Auch wenn das Magnetfeld abgeschaltet wird, bleibt das Stück Eisen dauerhaft magnetisiert (Punkt 4). Die Magnetisierung kann nur durch Erhitzen des Metalls wieder ungeschehen gemacht werden. Punkt im Diagramm Zustand des Materials Elektronenstruktur Stärke und Richtung des (angelegten) Magnetfeldes Magnetisierung des Materials 1. Frisch aus der Schmelze, nicht magnetisch ++-- 0 Keine 2. 1. Magnetisierung ++-+ + Schwach magnetisch 3. Maximale Magnetisierung (+) ++++ +++ Stark magnetisch 4. Kein äußeres Magnetfeld +++- 0 Schwach magnetisch 5. Äußeres Magnetfeld kompensiert Material -++- - Nicht magnetisch 6. Maximale Magnetisierung (-) A --- Stark magnetisch 7. B -+-- 0 Schwach magnetisch 8. Äußeres Magnetfeld kompensiert Material --++ + C Ergänze anhand der Abbildung diese Tabelle. Füllt aus, was anstelle der roten Buchstaben stehen muss: A: Lösung: ---B: Lösung: Kein äußeres Magnetfeld C: Lösung: Nicht magnetisch Quelle: http:// dechemax.de/- p-122975.htm? rewrite_engine=id&no301=1&EGOTEC=7scp1q9udin76jnru7q32orp22&quickedithide=1 © DECHEMA e.V. 1995-2017 alle Rechte vorbehalten