Bundesrealgymnasium Imst Chemie 2010
Werbung

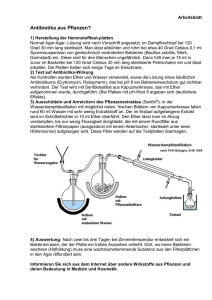
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 8 Funktionelle Gruppen Inhalt 5 Funktionelle Gruppen .................................................................................................... 28 5.1 Überblick .................................................................................................................. 28 5.2 Halogen-Kohlenwasserstoffe ................................................................................... 28 5.2.1 Derivate aliphatischer Kohlenwasserstoffe ........................................................ 28 5.2.2 Derivate aromatischer Kohlenwasserstoffe ........................................................ 28 5.3 Derivate .................................................................................................................... 30 5.4 Alkohol ..................................................................................................................... 30 5.4.1 Synthese von Alkohol ........................................................................................ 31 5.4.2 Eigenschaften von Alkohol ................................................................................ 31 5.4.3 Löslichkeit von Alkohol ..................................................................................... 31 5.4.4 Reaktionen von Alkohol..................................................................................... 31 5.5 Phenole ..................................................................................................................... 32 5.6 Oxo-Derivate ............................................................................................................ 32 5.6.1 Bildung von Oxo-Derivaten ............................................................................... 32 5.6.2 Reaktionen von Oxo-Derivaten .......................................................................... 32 5.6.3 Anwendungen von Oxo-Derivaten ..................................................................... 33 5.7 Ester .......................................................................................................................... 33 5.8 Ether ......................................................................................................................... 33 5.9 Amine ....................................................................................................................... 34 5.9.1 Nitroverbindungen ............................................................................................. 35 5.9.2 Säureamide und Nitrile....................................................................................... 35 5.10 Aminosäuren ............................................................................................................ 35 5.11 Carbonsäuren ............................................................................................................ 36 5.11.1 Di- und Tricarbonsäuren .................................................................................... 38 5.12 Chiralität ................................................................................................................... 38 5.12.1 Racemat .............................................................................................................. 39 5.12.2 Exkurs: I-Effekt .................................................................................................. 40 Chemie Klasse 8 5 5.1 Funktionelle Gruppen Funktionelle unktionelle Gruppen Überblick 5.2 Halogen-Kohlenwasserstoffe Kohlenwasserstoffe Bei Halogen – Kohlenwasserstoffen werden ein oder mehrere Wasserstoffatome durch Halogene ersetzt. Das führt aufgrund der höheren Elektronegativitätswerte zu einer verstärkten Polarisierungen im Molekül. Halogen – Derivate kann man aus durch verschieden Reaktionen erhalten - aus Alkanen durch Substitution stitution - aus Alkinen und Alkenen durch Addition - aus Aromaten durch Substitution und Addition Mögliche Stellungsisomerie lässt meistens ein Gemisch aus verschiedenen Halogenen Halogen – Verbindungen entstehen. Die Eigenschaften der Halogen – Derivate werden sehr stark durch die Stellung der Halogene – Atome bestimmt. Beispiel Trichlorethan: Abb. 5-1: Die Stellung der Chlor-Atome Chlor entscheidet, ob es sich bei Trichlorethan um ein starkes Lebergift (links; 1,1,2-Trichlorethan) ethan) oder um eine weniger giftige Substanz (rechts; 1,1,1-Trichlorethan) 1,1,1 Trichlorethan) handelt. 5.2.1 Derivate aliphatischer Kohlenwasserstoffe Die meisten aliphatischen Kohlenwasserstoffe sind gesundheitsschädlich und wirken narkotisierend weshalb sie als Lösungsmittel in Lacken, Farben, Klebstoffen und Holzschutzmittel verboten sind. Flüssige chlorierte Kohlenwasserstoffe sind wichtige Lösungsmittel für Fette, Harze und Öle. Chlor - Derivate des Methans CH3Cl Chlormethan CH2Cl2 Dichlormethan CHCl3 Trichlormethan CCl4 Tetrachlormethan ist das am wenigsten giftige Chlor-Methan-Derivat Chlor Chloroform:: wurde früher wegen seiner lähmenden Wirkung auf das zentrale Nervensystem Ne als Narkosemittel verwendet Fleckenentferner, r, giftig und deswegen verboten Fluor-Chlor-Kohlenwasserstoffe Kohlenwasserstoffe wurden als Kühlmittel, Treibgase in Spraydosen und zum Aufschäumen von Schaumstoffen verwendet. Infolge ihrer Reaktionsträgheit gelangen diese Stoffe in die oberen Schichten der Atmosphäre wo sie unter Einwirkung der UV Strahlung und niedriger Temperaturen zum Ozonkiller werden. 5.2.2 Derivate aromatischer Kohlenwasserstoffe Z. B. Pestizide: Pestizide sind nur wenig gefährlich. Die für Menschen tödliche Menge liegt bei 10 – 30 Gramm. Allerdings reichert sich DDT in der Nahrungskette an und ist deswegen verboten worden. Zwei Gruppen chlorierter aromatischer sind wegen ihrer toxikologischen und ökotoxikologischen bekannt. Dr. K.-H. Offenbecher Seite 28 Chemie Klasse 8 Funktionelle Gruppen Polychlorierte Dibenzodioxine (PCDD), kurz Dioxine genannt, sind heterocyclische Verbindungen bei denen C – Atome durch Heteroatome ersetzt sind. Aufgrund der Stellungsisomerie gibt es 75 verschiedene Möglichkeiten. Chlorierte Dioxine sind ein unerwünschtes Nebenprodukt bei der Herstellung chlorierter aromatischer Kohlenwasserstoffe. 2,3,7,8-Terachlor-benzodioxin (TCDD, Seveso-Gift) ist das giftigste chlorierte Dioxin. Auch dieses Dioxin reichert sich in der Nahrungskette an. Von den polychlorierten Dibenzofurane (PCDF) sind je nach Anzahl und Stellung der Chloratome 135 verschiedene chlorierte Furane denkbar. Wichtige Quellen dieser Stoffe sind: - ungereinigte Abgase und Verbrennungsrückstände aus Müllverbrennungsanlagen Nebenprodukt bei Sinterprozessen für die Metallgewinnung - Nebenprodukt verschiedener Produktionsprozesse der chemischen Industrie PCDD und PCDF haben keine technische Anwendung. Sie entstehen in Nebenreaktionen chemischer Prozesse aus aromatischen Chlorverbindungen wie z. B. Pentachlorphenol (PCP) oder von chlorierten Biphenylen (PCB). PCDD und PCDF bilden sich aus stabilen 5- bzw. 6-gliedrigen ringförmigen Atomanordnungen. Gegen Reaktionen mit Sauerstoff sind diese Moleküle durch die Chloratome geschützt. Stabil sind diese Verbindungen bis ca. 800 °C. In Autoabgasen bilden sich auch bromierte Dibenzodioxine und –furane. Umweltchemisch relevant sind außer 2,3,7,8-TCDD weitere, weniger toxische Vertreter dieser Stoffklasse. Um deren Toxizität klassifizieren zu können, wurden Toxizitätsäquivalentfaktoren eingeführt (TEF). Beispiele für Toxizitätsäquivalentfaktoren: Verbindung TEF 2,3,7,8-TCDD 1 1,2,3,7,8-PnCDD 1 1,2,3,4,7,8-HxCDD 0,1 1,2,3,4,6,7,8-HpCDD 0,01 OCDD 0,001 2,3,7,8-TCDF 0,1 2,3,4,7,8-PnCDF 0,5 OCDF 0,0001 Chlor-Dioxine werden erst bei Temperaturen oberhalb 1000 °C zerstört. Diese Temperaturen werden in Müllverbrennungsanlagen nicht erreicht und Dioxine müssen deshalb durch spezielle Filter entfernt werden. Polychlorierte Biphenyle (PCB) gehören zur Klasse der chlorierten Kohlenwasserstoffe, in denen mehr als ein Wasserstoffatom durch Chloratome ersetzt ist. Bei Biphenyle sind 209 Verbindungen theoretisch möglich. PCB sind nur geringfügig akut toxisch und werden nur in größeren Mengen für Organismen schädliche. Der Grenzwert für Klärschlamm, der auf landwirtschaftlichen Flächen aufgebracht wird, liegt bei 0,2 mg/ kg. Aufgrund der hohen Persistenz (Dauer des Abbaus), der geringen Wasserlöslichkeit und der geringen Mobilität, sind PCB inzwischen ubiquitär (überall verbreitet). Sie reichern sich in der Nahrungskette an. So weisen z. B. Meeressäuger gegenüber dem Meerwasser eine Konzentrationserhöhung um den Faktor 80 000 000 auf. Ein ähnliches umweltrelevantes Verhalten zeigen auch polychlorierte Terphenyle und Naphtaline. Dr. K.-H. Offenbecher Seite 29 Chemie Klasse 8 Funktionelle Gruppen 5.3 Derivate Aus Kohlenstoff-Atomen lassen sich unendliche viele Strukturen konstruieren. Diese Vielfalt wir durch den Einbau von Hetero-Atomen noch vergrößert. Als Derivat (=abgeleitete Verbindung) bezeichnet man organische Verbindungen, die Heteroatome enthalten. Solche Atome, die ein H-Atom ersetzen, werden als Substituenten bezeichnet. Substituenten verändern die chemischen Eigenschaften des Kohlenwasserstoffs, von dem sie sich ableiten. Substituenten die die charakteristischen Eigenschaften einer Stoffklasse bestimmen, heißen „funktionelle Gruppe“. Beispiel: Derivate des Ethan Ethan Formel CH3-CH3 Siedepunkt - 89 °C Wässrige Lösung Physiologische Wirkung Ethanol CH3-CH2-OH + 73 °C neutral berauschend bis giftig Ethansäure CH3-COOH + 118 °C sauer ätzend Benennung von Derivaten mit einer funktionellen Gruppe - Zuordnung des Derivats zum entsprechenden Kohlenwasserstoffgerüst - Bezeichnung für Substituenten niederer Priorität werden dem Namen als Präfix vorgesetzt. Z. B. CH3Cl Chlormethan - Bezeichnung für Substituenten höherer Priorität werden dem Namen als Suffix angehängt. Z. B. CH3-CH2OH Ethanol - Die Stellung des Substituenten wird durch eine der Endung vorangestellte Nummer (Lokant) angegeben. Benennung von Derivaten mit mehreren funktionellen Gruppen - Die Anzahl mehrerer gleicher Substituenten wird durch die Silben –di-, -tri- usw. angegeben - die Stellung der Substituenten wird durch Lokanden vor den Silben angegeben. Bei Substituenten niederer Priorität werden die Silben vor den Namen geschrieben. - bei Substituenten hoher Priorität werden die Silben und die Lokanden zwischen den Namen und der charakteristischen Endung geschrieben. 5.4 Alkohol Alkohole sind Verbindungen, die ein oder mehrere sp3-hybridisierte Kohlenstoffatome mit je einer Hydroxy-Gruppe enthalten. Nach der Anzahl der Hydroxy-Gruppen unterteilt man in einwertige und mehrwertige Alkohole. Einwertig gesättigte Alkohole werden Alkanole genannt. Bei Phenolen ist die Hydroxy-Gruppe an den Benzenring gebunden. Benennung der Alkohole: Die Endung –ol wird an den Namen des C – Grundgerüstes gehängt. Einteilung der Alkohole Nach der Stellung der OH – Gruppe werden primäre, sekundäre, tertiäre Alkohole unterschieden; Anzahl der OH – Gruppen gibt die Wertigkeit an. Dr. K.-H. Offenbecher Seite 30 Chemie Klasse 8 Funktionelle Gruppen 5.4.1 Synthese von Alkohol Halogen Alkane sind geeignete Ausgangsstoffe für die die Herstellung (Synthese) von Alkoholen. Setzt man einem Halogen-Alkan Alkan konzentrierte Natronlauge zu, wird das Halogen-Atom Halogen durch eine Hydroxyl Gruppe ersetzt. Es findet eine Substitution statt. Das OH- -Ion Ion der Natronlauge (Nucleophil) sucht eine positive Ladung, Ladung, die von dem C– C Atom, an das das Halogen gebunden ist, angeboten wird. Dadurch entsteht ein Übergangszustand mit 5 Bindungen am C-Atom. C Atom. Dieser ist instabil und führt zur Abspaltung des Halogenid-Ions. Ist das Halogen-Atom Atom an ein tertiäres C-Atom C gebunden, nden, wird es als Halogenid-Ion Halogenid abgespalten. Das C-Atom Atom wird positiv (Carbenium-Ion) (Carbenium Ion) und reagiert mit dem OH- -Ion. 5.4.2 Eigenschaften von Alkohol Schmelz- und Siedepunkte: Alkohole werden mit zunehmender Kettenlänge immer dickflüssiger. Ab C12H25OH (Laurylalkohol) (Laurylalko sind sie fest. Alkohole sind polar O-Atom Atom der OH -Gruppe Gruppe bildet Wasserstoffbrücken zu andern OH- Gruppen Siedepunkte der Alkohole sind viel höher als beim entsprechenden Alkan. Alkohole bestehen aus einem polaren Hydroxyl-Anteil, Hydroxyl Anteil, durch den eine Wasserlöslichkeit des Alkohols entsteht und einen unpolaren Alkyl-Rest. Alkyl Rest. Mit zunehmender Kettenlänge nimmt die Löslichkeit in polaren Lösungsmitteln (Wasser) ab. 5.4.3 Löslichkeit von Alkohol 5.4.4 Reaktionen von Alkohol Alkohole reagieren in wässriger Lösung neutral. Im Gegensatz zu anorganischen HydroxidHydroxid Verbindungen sind die Bindungen zur OH-Gruppe OH Gruppe kovalent. Alkohole können in Verbindung mit reaktionsfähigen Metallen auch als Säure reagieren. Dabei bilden sich Salze, die als Alkanolate bzw. Alkoholate bezeichnet werden. Dr. K.-H. Offenbecher Seite 31 Chemie Klasse 8 Funktionelle Gruppen 5.5 Phenole Benzenringe mit Hydroxyl-Gruppen werden als Phenole bezeichnet. (Phen = alter Begriff für Benzen). Die einfachste aromatische Hydroxy-Verbindung ist Phenol. Die Verbindung ist giftig und kann über die Haut aufgenommen werden. Früher wurden wässrige Phenollösungen als Desinfektionsmittel unter dem Namen Carbolsäure verwendet. Phenol ähnelt einem einwertigen Alkohol. Er reagiert aber stärker sauer weil die nichtbindenden Elektronenpaare des Sauerstoffs mit der Elektronenwolke des Rings in Wechselwirkung treten. Dadurch vergrößern sie das mesomere System des Aromaten und erhöhen seine Stabilität. Die Abgabe des H+-Ions wird dadurch unter Bildung eines PhenolatIons erleichtert. 5.6 Oxo-Derivate Zur Gruppe der Oxo-Derivate gehören Aldehyde und Ketone. Oxo-Derivate haben oft einen charakteristischen, aromatischen oder blumenähnlichen Geruch. Aldehyden und Ketonen gemeinsam ist ein Sauerstoffatom, dass über eine Doppelbindung mit einem C-Atom verknüpft ist. Ketone: werden durch eine Carbonyl-Gruppe in der Mitte eines C-Gerüsts definiert. Aldehyde: Ist mit der Carbonyl-Gruppe noch ein H-Atom verknüpft, entsteht eine AldehydGruppe. Aldehyde enden auf –al. Ist das C-Atom der Aldehyd-Gruppe nicht Bestandteil des C-Gerüsts lauetet die Endung auf –carbaldehyd. 5.6.1 Bildung von Oxo-Derivaten Die Carbonyl-Gruppe kann durch die Oxidation von Alkoholen gebildet werden. Aus primären Alkoholen entstehen Aldehyde. Aus sekundären Alkoholen entstehen Ketone. Bei der Oxidation von tertiären Alkoholen wird das C-Gerüst zertrümmert. Bei der Oxidation eines Alkohols werden H-Atome abgegeben. Dabei steigt die Oxidationszahl jenes C-Atoms, an dem die OH-Gruppe gebunden war von -1 nach +1. 5.6.2 Reaktionen von Oxo-Derivaten Die Carbonyl-Gruppe ist stark polar. Das C-Atom der Carbonyl-Gruppe trägt eine starke positive Teilladung Das O-Atom der Carbonyl-Gruppe trägt eine stark negative Teilladung Die der Carbonyl-Gruppe nächsten C-Atome binden ihre H-Atome nicht mehr so stark. Diese könne als Protonen ihren Platz verlassen. Diese Eigenschaften sind Grundlage für viele technische Anwendungen Additionsreaktionen Bei C=O Doppelbindung ist das C-Atom der Carbonyl-Gruppe positiv polarisiert. Daher werden Nucleophile leicht an diesem Atom addiert. Additionsreaktionen an der Oxo-Gruppe sind nucleophil (AN). Niedermolekulare Aldehyde können auch polymerisieren. So bildet sich aus Ethanal z.B. Metaldehyd, der als Trockenspiritus verwendet wird. Keto-Enol-Tautomerie Das O-Atom wirkt nicht nur auf das C-Atom der Oxo-Gruppe anziehend. Auch benachbarte H-Atome werden positiv polarisiert. Diese H-Atome werden abgespalten und von den OAtomen aufgenommen. So entsteht aus dem ursprünglichen Keton ein ungesättigter Alkohol Enol. Tautomerie: Schnelles chemisches Gleichgewicht zwischen Isomeren. Neben der Keto-Enol-Tautomerie gibt es noch weitere Tautomerien, die bei Verbindungen mit C=O Doppelbindungen und benachbarten H-Atomen auftreten. Dr. K.-H. Offenbecher Seite 32 Chemie Klasse 8 Funktionelle Gruppen Aldol-Addition Die Aldol-Addition Addition von Aldehyden ist ebenfalls auf die polare C=O Bindung und ihre polarisierende Wirkung auf benachbarte C-H C Bindungen zurückzuführen. 5.6.3 Anwendungen von Oxo-Derivaten Oxo Methanal (Formaldehyd, H-CHO): CHO): Zellgift, da Proteine gehärtet werden. Wird aus diesem Grund aber auch als Desinfektionsmittel und Konservierungststoff verwendet. Technisch wird Methanal zur Herstellung von Kunstharzen eingesetzt. Ethanal (Acetaldehyd, CH3-CHO): CHO): wichtiges Stoffwechselprodukt. Es wird im menschlichen Körper durch Oxidation von Ethanol durch das Enzym Alkoholdehydrogenase in der Leber gebildet. Benzencarbaldehyd (Benzaldehyd): intensiver Geschmack nach Marzipan. Kommt in verschiedenen Früchten vor wo er mit Blausäure und Traubenzucker den Aromastoff Amygdalin bildet. Citral (3,7-Dimethyl-octa-2,6 2,6-dienal): dienal): Ist in Zitronen enthalten und kommt in vielen Blumenduftstoffen vor. Propanon (Aceton, CH3-CO CO-CH3): Nagellackentferner, wird aus Propan-2-ol Propan durch Dehydrogenierung gewonnen 5.7 Ester Die einfachste Veresterung führt zur Bildung von Methansäuremethylester. Die Reaktion ist eine Kondensationsreaktion. Dieser Reaktionstyp läuft über mehrere Zwischenschritte ab und es werden kleinere Teile (z. B. Wasser) abgespalten. Die Veresterung führt zu einem Gleichgewicht, bei dem AusgangsAusgangs und Endstoffe in vergleichbaren Mengen vorliegen. Um die Ausbeute zu erhöhen, muss muss das Gleichgewicht verschoben werden indem man z. B. Endstoffe entfernt oder einen der Ausgangsstoffe im Überschuss zusetzt. Die Veresterung von Carbonsäuren benötigt als Katalysator eine starke Säure. Das doppelt gebundene O-Atom Atom der Carboxyl-Gruppe Carboxyl kann ein H+ aufnehmen. Dadurch entsteht ein mesomeriestabilisiertes Carbenium-Ion. Carbenium 5.8 Ether Unter Einwirkung von konzentrierter Schwefelsäure auf Alkohol findet eine Kondensationsreaktion zwischen zwei Alkoholmolekülen statt. Dabei entsteht Ether und Wasser. Wirdd die Reaktion mit einem einzigen Alkohol durchgeführt, entsteht ein einziger Ether. Z. B. entsteht aus Ethanol mit H2SO4 bei 140 °C Diethylether Werden zwei verschiedene Alkohole (R und R‘) eingesetzt, entsteht ein Gemisch aus drei verschiedenen Ether R-O--R ; R‘-O-R‘ ; R‘-O-R Dr. K.-H. Offenbecher Seite 33 Chemie Klasse 8 Funktionelle Gruppen Zur Nomenklatur: Die Struktur der Ether besteht aus einem Substituent RO, der an ein C-Gerüst C Gerüst gebunden ist. Ist R ein Alkylrest, spricht man von einer Alkoxy-Gruppe. Alkoxy Z. B. C2H5O Ethoxy-Gruppe. Ist R aromatisch, nennt man RO eine Aryloxy-Gruppe. Gruppe. Da der Rest des Benzens C6H5 Phenylrest heißt, bezeichnet man die Gruppe C6H5O als Phenoxy-Gruppe. Nach der IUPAC-Nomenklatur Nomenklatur wird der Name dieser Gruppe vor den Namen des d Kohlenwasserstoffes gesetzt. Eigenschaften Ether sind wie Wassermoleküle gewinkelt gebaut und daher Dipolmoleküle. Können jedoch keine Wasserstoff-Brückenbindungen Brückenbindungen aufbauen (kein H-Atom). H Atom). Daher sind bei kleinen (niedermolekularen) Ethermolekülen die zwischenmolekularen Kräfte klein niedere Siedepunkte. In polaren Lösungsmitteln (Wasser) sind Ether nicht löslich, in unpolaren Lösungsmitteln jedoch sehr gut. Beispiele für wichtige Ether Ethoxyethan:: Narkosemittel; führt zu tiefer tiefer Bewusstlosigkeit und Schmerzunempfindlichkeit. unempfindlichkeit. Hat jedoch starke Nebenwirkungen. Neb Da sich durch Licht und Sauerstoff leicht hochexplosive, nicht flüchtige Peroxide bilden, muss Ether in braunen Flaschen luftdicht aufbewahrt werden. Oxiran (Ethylenoxid): Aufgrund der Ringspannung sehr reaktionsfreudig. Ausgangsstoff für die Erzeugung von Polyester, er, Epoxidharze und Waschmittelrohstoffen. Waschmittel Diethylenglycol: Ein, dem Glycerol in Geschmack und Viskosität ähnlicher Ether, der zur Verfälschung von Prädikatsweinen verwendet worden ist. HO-CH2-CH2-O-CH2-CH2-OH 5.9 Amine Ammoniak besitzt drei H-Atome, Atome, die formal durch organische Reste ersetzt werden können. Somit entstehen durch Ersatz von einem H-Atom primäre Amine; RNH2 zwei H-Atomen sekundäre Amine; R2NH drei H-Atomen tertiäre Amine; R3 N Als funktionelle Gruppe werden primäre Amine als Amino-Gruppe Amino Gruppe bezeichnet Nomenklatur: An den Namen des Kohlenwasserstoffes wird die Endung Amin angehängt. Beispiel: CH3-NH2 Methanamin Bei mehrwertigen Aminen werden Zahl und Art der KW-Reste KW Reste der Endung Endun –amin vorangestellt. Beim Vorhandensein einer zusätzlichen funktionellen Gruppe höherer Priorität, wird die Amino-Gruppe durch die Vorsilbe AminoAmino gekennzeichnet. Bsp.: Aminoethansäure Dr. K.-H. Offenbecher Seite 34 Chemie Klasse 8 Funktionelle Gruppen Eigenschaften: Amine sind Protonenakzeptoren. Sie reagieren reagieren mit Wasser und bilden Ionen. Mit HCl bilden Amine einen weißen Rauch eines Alkylammoniumsalzes Beispiel: Methylamin + HCl Methanammoniumchlorid Wichtige Amine: Methanamin: Wie andere leichte Amine gasförmig. Kommen kleinen Mengen in Fischen vor und verursachen nach deren Tad den charakteristischen Verwesungsgeruch. Anilin: wichtiger Ausgangsstoff für die Farbstoffindustrie Cholin: quartäre Ammoniumverbindung, die bei Veresterung mit Ethansäure Acetylcholin bildet, dass für Nervenzellen wichtig ist. Als Phospholipid ist Cholin Bestandteil von Zellmembranen. 5.9.1 Nitroverbindungen Nitroverbindungen enthalten die Nitrogruppe NO2. Dem entsprechenden KW wird der Präfix „Nitro-““ vorangesetzt. Nitroalkane werden als Spezialkraftstoff oder als Sprengstoff eingesetzt. Beispiel Nitrobenzen: wird durch die Nitrierung von Benzen hergestellt. Es lässt sich leicht reduzieren und reagiert dabei zu Anilin. Mehrfach nitrierte KW‘s sind häufig explosiv. 5.9.2 Säureamide und nd Nitrile Carbonsäuren können mit Ammoniak unter Wasserabspaltung reagieren indem die OHOH Gruppe der Carboxyl-Gruppe Gruppe durch die NH2-Gruppe Gruppe ersetzt wird. Es entsteht ein Säureamid. Beispiel: Harnstoff (Diamid) entsteht, wenn zwei OH-Gruppen OH Gruppen der Kohlensäure ersetzt werden. Harnstoff wird im Körper als Abbauprodukt von Proteinen und Nucleinsäuren gebildet. 5.10 Aminosäuren Aminosäuren sind die Grundbausteine von Proteinen. Von ihrem Grundgerüst kann man alle Aminosäuren ableiten, die in Proteinen enthalten sind. Dr. K.-H. Offenbecher Seite 35 Chemie Klasse 8 Funktionelle Gruppen Das α-C-Atom Atom aller Aminosäuren (außer Glycin) ist mit vier verschiedenen Substituenten verbunden. Es ist somit ein asymmetrisches C-Atom. C Von den möglichen Konfigurationen DD und L- kommt in Proteinen nur die L-Konfiguration L vor. Heterocyclen Heterocyclen clen mit Stickstoffatomen sind im Allgemeinen basisch. Sie sind Bestandteil von Nukleinsäuren, Enzymen, Vitaminen, Farbstoffen und Alkaloiden. Beispiele: Pyridin: Sechserring mit einem N-Atom. N Atom. Es ist giftig und hat einen widerlichen aromatischen aromatisch Geruch. Ein in Derivat des Pyridins ist z. B. die Nicotinsäure. Pyrimidin: ebenfalls aromatisch, bildet das Grundgerüst der Basen von Nucleinsäuren 5.11 Carbonsäuren Werden Alkohole mehrfach oxidiert entsteht über das Zwischenprodukt Aldehyd eine organische Säure. Im einfachsten achsten Fall entsteht aus Ethanol zuerst Ethanal und in einer weiteren Oxidation Ethansäure (Essigsäure). Dr. K.-H. Offenbecher Seite 36 Chemie Klasse 8 Funktionelle Gruppen Entsprechend den Alkanen lässt sich auch bei den Carbonsäuren eine homologe Reihe ableiten: Methansäure Ameisensäure H – COOH Ethansäure Essigsäure CH3 – COOH Propansäure Propionsäure C2H5 – COOH Butansäure Buttersäure C3H7 – COOH Hexadecansäure Octadecansäure Palmitinsäure Stearinsäure C15H31 – COOH C17H35 – COOH An die Carboxyl-Gruppen können auch Reste mit Doppelbindungen oder aromatischen Ringen gebunden werden. Physikalische Eigenschaften: Die Sauerstoffatome der Carboxyl-Gruppe besitzen eine relativ große Elektronegativität. Die Gruppe ist somit polar und in der Lage, neben Dipolkräften auch WasserstoffbrückenBindungen auszubilden. Dabei bilden sich Doppelmoleküle deren Schmelz und Siedepunkte höher als bei vergleichbaren Oxo-Derivaten oder Alkohol ist. Chemische Eigenschaften Alkansäuren sind schwache Säuren. Sie bilden wie anorganische Säuren Salze. Na- und KSalze langkettiger Carbonsäuren werden als Seifen verwendet. Sie bilden sich aus höheren Alkansäuren Aus Calciumsalze entstehen schwer lösliche Kalkseifen, die beim waschen unerwünscht sind. Nomenklatur substituierter Carbonsäuren: Da diese Moleküle mehrere funktionelle Gruppen haben, bestimmt die Gruppe der höchsten Priorität die Endung. Andere Gruppen werden voran gestellt. Wichtige Carbonsäuren Methansäure (Ameisensäure): H – COOH chemische Waffe von Ameisen und anderen Insekten. Gewinnung: aus Natronlauge und Kohlenstoffmonooxid entsteht Natriumsalz Methansäure dient zur Desinfektion von Fässern, entkalken von Kaffeemaschinen, Imprägnieren und Beizen von Textilien und Leder, als Na oder K-Salze auch als Konservierungsstoff. Das Molekül der einfachsten Carbonsäure besitzt nur ein C-Atom an das als Rest nur ein HAtom gebunden ist. Somit enthält das Molekül auch eine Aldehyd-Gruppe die leicht oxidierbar ist. Ethansäure (Essigsäure): CH3 – COOH entsteht bei der bakteriologischen Oxidation Essiggärung C2H5OH + O2 CH3COOH + H2O Die dabei gebildete 4 – 7 %ige Ethansäure bezeichnet man als Essig. Technisch gewinnt man Essig durch oxidation von Alkoholläsungen durch Bakterien (Submerse-Verfahren). Durch die Art der Alkohol-Lösung kann die entstehende Essigsorte bestimmt werden. Reine Ethansäure gewinnt man durch katalytische Oxidation von Ethen CH3 + CHO + 0,5 O2 CH3 – COOH Verwendung: Herstellung von Kunstseide, Filmen und als Lösungsmittel; auch Zwischenprodukt bei der Herstellung von Aspirin Dr. K.-H. Offenbecher Seite 37 Chemie Klasse 8 Funktionelle Gruppen Propansäure (Propionsäure, C2H5 – COOH): wird wegen der bakteriziden Wirkung als Konservierungsstoff für Brot, Backwaren, Käse und Futtermittel verwendet Butansäure (Buttersäure; C3H7 – COOH): unangenehmer Geruch, entsteht beim Ranzigwerden von Butter und bei der bakteriellen Zersetzung von Schweiß. Fettsäuren: mindestens 4 C--Atome, Atome, Bausteine von Fetten. Bestehen die Ketten nur aus Einfachbindungen, spricht man von gesättigten Fettsäuren. Bei C = C Doppelbindungen spricht man von ungesättigten Fettsäuren. Bsp. Ölsäure CH3 – (CH2)7 – CH = C – (CH2)7 – COOH Sorbinsäure: ungesättigte Carbonsäure als wichtiger Konservierungsstoff in Lebensmittel und Ausgangsstoff bei der Herstellung von Vitamin C. Benzoesäure: aromatische Monocarbonsäure, wird wie Na-, K- und Ca-Salze Ca als Konservierungsmittel in sauren Lebensmitteln verwendet. 5.11.1 Di- und Tricarbonsäuren Oxalsäure (Ethandisäure): einfachste Dicarbonsäure, besteht nur aus zwei Carboxyl-Gruppen Carboxyl HOOC – COOH Die Salze der Oxalsäure heißen Oxalate HOOC – COO-K+ Oxalsäure ist Bestandteil von sauren Pflanzen wie Sauerklee, Sauerampfer oder Rhabarber und Spinat Oxalat-Ionen (C2O42-) bildet mit Ca2+ schwer lösliche Calciumoxalate die im Blut zur Bildung von Kristallen führen können. Blutgefäße können verstopfen verstopfen und die Bildung von HarnHarn oder Nierensteinen wird begünstigt. Weinsäure (2,3-Dihydroxybutandisäure): Dihydroxybutandisäure): Die Salze der Weinsäure werden als Tartrate bezeichnet. Kaliumhydrogentartrat scheidet sich im Wein ab. Weinsäure ist im Brausepulver, Kunsthonig und Speiseeis enthalten. enthalten Citronensäure (3-Carboxy-3--hydrogenpentan-1,3,5-trisäure): Tricarbonsäure mit großer Bedeutung für den Stoffwechsel. Wird hauptsächlich enzymatisch aus Traubenzucker gewonnen. Citronensäure wird einigen Lebensmitteln zugesetzt oder od als Entkalkungsmittel verwendet. 5.12 Chiralität Chiralität bedeutet Händigkeit: Zwei Hände sehen gleich aus, sind aber spiegelbildlich gebaut. Das heißt, dass sie sich nicht durch Drehungen übereinander legen lassen. Beispiel Milchsäure: Dr. K.-H. Offenbecher Seite 38 Chemie Klasse 8 Funktionelle Gruppen Viele physikalische Eigenschaften der beiden Arten sind gleich (Siedepunkt, Schmelzpunkt, Dichte). Eigenschaften die von der Molekülgeometrie abhängen, wie die optische Aktivität, sind aber unterschiedlich. Optische Aktivität: Jedes dieser beiden Moleküle dreht linear polarisiertes Licht um den gleichen Betrag aber entgegengesetzte Richtung. Man spricht von optischen Antipoden (Enantiomere). Wird die Schwingungsebene des polarisierten Lichts im Uhrzeigersinn gedreht, spricht man von rechtsdrehend. Im anderen Fall von linksdrehend. Richtung und Betrag sind für jeden Stoff charakteristisch und auch abhängig von Temperatur, Konzentration, Wellenlängen des Lichtes usw. D-L-Nomenklatur Schreibt man die Formel einer Hydroxycarbonsäure in der Fischer-Projektion Fischer Projektion an, lassen las sich Spiegelbildisomere durch die Anordnung der OH-Gruppen OH Gruppen am asymmetrischen C-Atom C unterscheiden. Bezugssubstanz ist dabei das Glycerinaldehyd. Bei Molekülen mit Symmetrieebenen wird das Molekül in zwei deckungsgleiche Teile unterteilt. Die Drehung an den asymmetrischen C-Atomen C Atomen können sich aufheben. Bsp.: Weinsäure R-S-Nomenklatur Allgemeiner Fall der D-L-Nomenklatur. Nomenklatur. Die vier Substituenten werden nach fallender Ordnungszahl gereiht. Atomen gibt es 2n optische Isomere Bei n asymmetrischen C-Atomen 5.12.1 Racemat Liegen die beiden optisch aktiven Isomere im Verhältnis 1:1 vor, hebt sich si die optische Aktivität auf. Das Gemisch ist optisch inaktiv. Eine solche Mischung aus 2 optischen Antipoden im Verhältnis 1:1 wird als Racemat bezeichnet. Zur Trennung in diee beiden optisch aktiven Substanzen lässt man einen Racemat mit einer anderen optisch aktiven Substanz reagieren. D-Weinsäure + D-Base Base D,D-Salz L-Weinsäure + D-Base Base L,D-Salz Die entstehenden Produkte werden als Diastereomere bezeichnet und sind s nicht mehr Spiegelbildlich gebaut. Dr. K.-H. Offenbecher Seite 39 Chemie Klasse 8 Funktionelle Gruppen Eine Trennung kann auch mit Hilfe von Bakterien erfolgen, die nur eines der Enantiomere abbauen. 5.12.2 Exkurs: I-Effekt Effekt Die Wirkung eines Atoms oder einer Atomgruppe auf die Elektronenverteilung im Rest des Moleküls wird als induktiver Effekt bezeichnet (I – Effekt). Er beruht auf Differenzen zwischen Elektronegativitäten (EN) benachbarter Atome oder Atomgruppen und wird relativ zur EN des Wasserstoffatoms beurteilt. Beim +I-Effekt +I Effekt wird die Elektronendichte am benachbarten Atom erhöht, beim –I-Effekt erniedrigt. +I-Effekt: EN(R) < EN (H) -I-Effekt: EN(R) > EN (H) Dr. K.-H. Offenbecher Seite 40