Document
Werbung

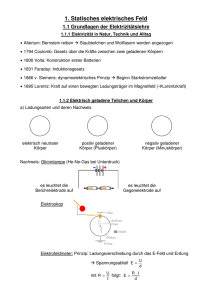
Vorlesung Physik für Pharmazeuten PPh - 08 Wärmelehre Elektrizitätslehre 18.06.2007 Wärmemenge und Wärmekapazität - Wärme ist eine Form von Energie (wird also in Einheit Joule gemessen) - Die einem System zugeführte Wärme erhöht seinen Energieinhalt. - Q bezeichnet die einem System zugeführte oder entzogene Wärmemenge Die zugeführte Wärmemenge ist proportional zu Masse und Temperaturänderung ∆Q = c ⋅ m ⋅ ∆T = C ⋅ ∆T C [J/K] : Wärmekapazität c [J/kgK] : spezifische Wärmekapazität Neben der spezifischen Wärmekapazität wird auch häufig die molare Wärmekapazität cm [J/(Mol*K)] verwendet (Wärmekapazität pro Mol) cm = C n n : Anzahl Mol eines Stoffes Kalorimetrie Die spezifische Wärme cS eines Stoffes kann in einem Mischungskaloriemeter bestimmt werden. T0 S T0w Tm Tm : Mischungstemperatur cw ⋅ mw ⋅ (Tm − T0 w ) = cS ⋅ mS ⋅ (T0 S − Tm ) Messung des elektrischen und mechanischen Wärmeäquivalents Joulesches Experiment 1cal=4,18 Joule=4,18 Ws Die Volumenarbeit eines idealen Gases Die Arbeit, dW, die ein Gas gegen eine äußere Kraft leistet, wird Volumenarbeit genannt. (Die Arbeit hat ein negatives Vorzeichen, weil dem System Energie entzogen wird) Gas P=F/A dW = − PdV Wisobar = − P0 (V2 − V1 ) Wisotherm V2 = − ∫ PdV = − nRT ln V1 Der erste Hauptsatz der Thermodynamik Verallgemeinerung der Energieerhaltung von makroskopischen Systemen auf mikroskopische Der erste Haupsatz der Thermodynamik (Energieerhaltungssatz): dU = dQ + dW ( innere Energie) = (zugeführte Wärme) + (mechanische Arbeit) Die Summe der einem System von außen zugeführten Wärme und der zugeführten Arbeit ist gleich der Zunahme seiner inneren Energie (positive Vorzeichen bedeuten, dass die innere Energie zunimmt) Die Summe der inneren Energien in einem abgeschlossenen System ist konstant (Unmöglichkeit eines Perpetuum mobile 1.Art) Adiabatische Zustandsänderung eines idealen Gases Bei der adiabatischen Zustandsänderung findet keine Wärmeaustausch mit der Umgebung statt. (z.B. weil der Prozess schneller abläuft als der Wärmeaustausch, bzw. der Prozess gut isoliert ist) Damit wird die bei der Kompression geleistete Arbeit vollständig zur Erhitzung des Gases verwendet PdV = −CV dT Es folgt daraus, dass die P-V Kurve „steiler“ wird „Adiabatengleichung“ PV κ = const κ=Cp/CV: Adiabatenkoeffizient Alle Adiabaten schneiden jede Isotherme und umgekehrt Def. Entropie S = k ⋅ ln P P : Wahrscheinlichkeit S : Maß für die Unordnung Der Zweite Hauptsatz der Thermodynamik Es ist unmöglich, eine periodisch arbeitende Maschine zu bauen, die lediglich einem Körper Wärme entzieht und diese vollständig in Nutzarbeit umwandelt (Perpetuum Mobile 2. Art). nach Kelvin-Planck Wärme geht nie spontan, ohne Arbeitsaufwand, vom kälteren zum heißeren Körper über, sondern immer umgekehrt. Satz von Clausius Alle Zustandsänderungen in einem abgeschlossenen System bewirken eine Zunahme der Entropie ∆S > 0 : irreversible Prozesse ∆S = 0 : reversible Prozesse P-T-Phasendiagramm (Zustandsdiagramm) mit fester, flüssiger und gasförmiger Phase Am Tripelpunkt liegen im Gleichgewicht allen drei Phasen gleichzeitig vor. Der Tripelpunkt des Wassers liegt bei 273,16 K und 6,1 mbar. Zum Phasendiagramm von Wasser : - Die Dichte von Eis ist kleiner als die von Wasser unterhalb 4 ºC. - Eis sublimiert bei Drücken p<6.1hPa und T<273 (Gefriertrocknung) - Die Schmelzdruckkurve hat eine negative Steigung. Wasser läßt sich durch äußeren Druck verflüssigen. (Schlittschuhläufer nutzen diesen Effekt aus) Prinzip vom kleinsten Zwang (Le Chatellier-Brown) : „Jedes System reagiert auf eine äußere Einwirkung in der Richtung, dass es die primäre Ursache zu vermindern sucht“ Dampfdruckkurve und Sättigungsdruck ⎛ Q ⎞ p (T ) = p0 ⋅ exp⎜ − D ⎟ ⎝ RT ⎠ im Gleichgewicht : Sättigungsdampfdruck Im dynamischen Geichgewichtszustand zwischen Flüssigkeit und Dampf stellt sich über einer Flüssigkeit der Sättigungsdampfdruck ein. Er hängt allein von der Art der Flüssigkeit und der Temperatur ab und steigt mit der Temperatur an. Nicht-Gleichgewichtszustände Verdunsten – Sieden - Kondensation Verdunstung : Langsame Verdampfung durch die freie Flüssigkeitsoberfläche Sieden: Eine Flüssigkeit siedet, wenn der Sättigungsdampfdruck bei der gegebenen Temperatur dem Druck über der Flüssigkeit entspricht. Die Siedetemperatur ist druckabhängig. Kondensation: Ausbildung von Flüssigkeitströpfchen aus der Dampfphase bei Abkühlung Für Wasser in Luft gilt insbesondere Absolute Feuchtigkeit: Menge von Wasserdampf in der Luft in g/m3. Die absolute Luftfeuchtigkeit kann bei jeder Temperatur den Wert beim Sättigungsdampfdruck nicht übersteigen. Daher definiert man die relative Feuchtigkeit als Partialdruck des Wasserdampfs geteilt durch den Sättigungsdampfdruck mal 100 in %. Versuch : Siedepunkt Flüssige Mischungen und Lösungen Echte Lösungen, im Gegensatz zu Emulsionen, kolloidalen Lösungen sind molekulardisperse Mischungen. Eine ideale Lösung (z.B. Ethanol/Methanol) zeigt keine Volumenänderung und keine Lösungswärme beim Lösungsvorgang Reale Lösungen haben folgende Merkmale Darstellung der Solvatation (in Wasser Hydratation) eines Festkörpers in einem Lösungsmittel. Lösungswärme (z.B. Schwefelsäure + Wasser) Dampfdruckerniedrigung Gefrierpunktserniedrigung ∆T = 1,83 K /( mol / liter ) cm Raoult'sche Gesetz Methoden zur Erzeugung tiefer Temperaturen Verdampfung (z.B. Chlorethan, C2H5Cl ) Kältemischung (Eis + Salz) entziehen der Umgebung Schmelz, bzw. Lösungswärme tiefste erreichbare Temperatur (eutektischer Punkt) Eine Mischung 23 % NaCl + 77% Wasser erzielt eine Temperaturerniedrigung von -21.2 °C Adiabatische Expansion dT = − p ⋅ dV CV Ideales Gas verrichtet Arbeit gegen äußeren Druck Joule-Thomson Effekt Boltzmannverteilung Verteilungssatz von Boltzmann: Wenn die Moleküle eines Systems bei der Temperatur T zwei verschiedene Energiezustände U1,2 einnehmen können, dann ist das Verhältnis der Besetzungszahlen an den ⎛ ∆E ⎞ n2 ⎟⎟ = exp⎜⎜ − n1 ⎝ k BT ⎠ Eth = k BT ∆E = U 2 − U1 „Thermische Energie“ „Differenz der potentiellen Energie“ Brownsche Bewegung Die thermische Bewegung der Atome eines Gases oder einer Flüssigkeit lässt sich indirekt durch die Zitterbewegung eines kleinen (aber im Vergleich zum Atom makroskopischen) Teilchens nachweisen. Aus der kinetischen Gastheorie lässt sich nach A. Einstein für das mittleres Verschiebungsquadrat des Brownschen Teilchens ableiten : x 2 = 6D ⋅ t D : Diffusionskoeffizient η : Viskosität, R : Radius D= kT 6πηR Versuch Diffusion DIFFUSION : Nettotransport von Teilchen aus Gebiet hoher Konzentration in Gebiet niedriger Konzentration. jN = dn A ⋅ dt Teilchenstromdichte = Teilchen pro Fläche und Zeiteinheit 1. Fick‘sches Gesetz Transportgleichung der Diffusion dn jN = − D ⋅ dx Der diffusive Teilchenstrom ist proportional zum Konzentrationsgefälle dn/dx Diffusion ist temperaturabhängig Tintentropfen in Wasser kT D= 6π ⋅η (T ) ⋅ R Diffusionskoeffizient Eines kolloidalen Partikels Konvektion : Wärmetransport durch Massentransport Bei schlechten Wärmeleitern (Flüssigkeiten und Gasen) spielt der Wärmetransport durch Transport heisser Substanz die dominante Rolle. Da erwärmte Substanzen eine geringere Dichte besitzen, setzt von selber ein Materialfluss ein, wenn Temperaturunterschiede bestehen. Beispiel: Raumheizung, Wind- und Meeresströmungen. (Freie Konvektion) Kaffee abkühlen durch Pusten. (erzwungene Konvektion) Versuch Konvektion Wärmetransport durch Strahlung Wärmestrahlung sind elektromagnetische Wellen, welche reflektiert, transmittiert und absorbiert werden kann. Die abgegebene Strahlungsleistung eines Körpers wächst mit der 4. Potenz der absoluten Temperatur ( ∆P = σ ⋅ A ⋅ T − T 4 1 4 2 ) σ : Stefan Boltzmann Konstante A : Oberfläche T1 : Körpertemperatur T2 : Umgebungstemperatur Infrarotbild eines Jungen mit Hund Wärmeisolierung Vakuum : keine Wärmeleitung keine Konvektion Verspiegelte Innenwände : keine Verluste durch Wärmestrahlung Thermosflasche Dewar Entdeckung der Elektrizität Erscheinungen elektrischer Anziehung wurde schon von den Griechen am Bernstein (griech. ηλεκτρον) beobachtet Barocke Hofgesellschaft bestaunt elektrische Aufladung im Kabinett des Physikers um 1750 Erzeugung von el. Ladung durch Reibung Das Elektrometer ist ein Ladungs-Meter Zur Messung der Ladung wird ein Elektrometer benutzt. Ladung wird auf eine leitende Kugel übertragen die mit zwei Goldlamellen verbunden ist. Die beweglichen Goldlamellen stoßen sich ab und schwenken gegen die Schwerkraft aus. Der Ausschlag ist für kleine Winkel proportional zur übertragenen Ladung Ursache für elektrische Effekte sind elektrische Ladungen - Es gibt zwei Arten von elektrischen Ladungen : positive (+) und negative (-) - Gleichnamige Ladungen stoßen sich ab, ungleichnamige ziehen sich an. - Die Kraft zwischen zwei ruhenden Ladungen Q1 und Q2 im Abstand r beträgt Q1 ⋅ Q2 F =k⋅ 2 r (Coulombsches Gesetz) - In einem abgeschlossenen System ist die Summe aller Ladungen konstant. (Ladungserhaltung) - Es gibt Materialien, in denen sich Ladungen leicht bewegen, sog. Leiter und andere Stoffe, sog. Isolatoren, ohne elektrisches Leitvermögen Coulombsches Gesetz Zwischen den Ladungen wirken Kräfte, die von der Größe der Ladungen und dem Abstand abhängen. In Analogie zur Gravitation gilt das „Coulombsche Gesetz“ F = 1 4 πε 0 q1 ⋅ q 2 r2 ε0 : Elektrische Feldkonstante r : Abstand der Ladungen q1 und q2 r r v r12 = r2 − r1 Vektorielle Schreibweise : r F = 1 4 πε 0 q1 ⋅ q 2 r 2 r12 r r12 r r12 v r1 q1 q2 v r2 Elektrische Ladung ist eine Eigenschaft der Elementarteilchen (Elementarladung) Ladung ist eine Eigenschaft der Materie. Materie besteht aus "Teilchen", die Ladung und Masse besitzen. Jeder Ladungstransport ist mit Massetransport verbunden Millikan Versuch (Öltröpfchenversuch) Jede Ladung ist ein ganzzahliges Vielfaches, Q=Z · e der Elementarladung e = -1,6022·10-19 C (Quantisierung der elektrischen Ladung) Die Ladungsträger, die in Leitern frei beweglich sind heißen Elektronen (e- ). Sie sind Elementarteilchen (Ladung e=-1,6022*10-19 C, Masse: 9*10-31kg). Positive Ladungen tragen die Protonen in den Kernen (Ladung Qp=+1,6022*10-19 C, Masse:1,67*10-27kg). Atome : Gebilde aus gleicher Anzahl Elektronen, Protronen (und Neutronen) sind exakt neutral







![Elektrische Spannung U [V]](http://s1.studylibde.com/store/data/002479720_1-141ad09aa3ab46fc5af48362f775ec08-300x300.png)


