Die Suzuki-Kupplung
Werbung

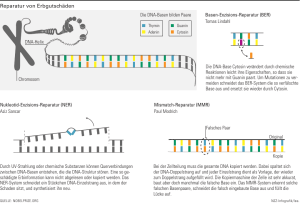
Die Suzuki-Kupplung 1.0 Theoretische Grundlagen 1.1 Die Suzuki-Reaktion Die moderne organische Chemie stellt hinsichtlich Effizienz, Atomökonomie, Stereo-selektivität und Ausbeute höchste Anforderung an Synthese und Reaktion. Die palladiumkatalysierte Kreuzkupplungsreaktion von Organoboronsäuren mit Halogen- aromaten ist eine vielseitige Methode zur C-C-Verknüpfung. Als sogenannte Kreuzkupplung bezeichnet man die Verknüpfung zweier unterschiedlicher Aryleinheiten. Diese palladium-katalysierte Verknüpfung zweier sp2-hybridiesierter Kohlenstoffatome ist auch als Suzuki-Reaktion bekannt.(2,3) Normalerweise werden Suzuki-Reaktionen in organischen Lösungsmittel oder in einer Mischung aus organischen Lösungsmittel und wäßrigen Base in Gegenwart von Pd[P(Ph)3]4, PdCl2 und Pd(ac)2-Katalysatoren durchgeführt.(1) X + B(OH)2 PdX2, Base H2O Schema 1.1: Suzuki-Kupplung (X = Cl, Br, J) 1.2 Organoboronsäure Die wichtige Kupplungskomponente - die Arylboronsäure - ist leicht zugänglich und an der Luft stabil. Sie ist gegenüber einer Vielzahl von funktionellen Gruppen innert, die normalerweise vor Durchführung einer gewöhnlichen Kupplungsreaktion geschützt werden müßten. Sie sind weder toxisch noch umweltgefährdend. Die meisten Organoboronsäuren spalten teilweise schon bei Raumtemperatur Wasser ab. Dabei entstehen trimercyclische Anhydride. Die Trimere können teilweise nur schwer von den monomeren Formen der Boronsäuren unterschieden werden.(5) 1.3 Funktion des Katalysators Die Vorteile der palladiumkatalysierten Reaktion sind die moderaten Reaktionstemperaturen und eine breite Anwendbarkeit des Verfahrens. So können neben Aryhalogeniden auch Alkenyl-, Alkinyl-, Allyl- und Benzylhalogenide mit entsprechenden Organoboronsäuren gekuppelt werden. Beim Versuch, eine Kupplung von Arylboronsäuren mit Alkylhalogeniden durchzuführen, dominiert oft eine Nebenreaktion: Aus dem Alkylhalogenid entsteht ein Alken. Die Arylboronsäure wird dabei zum aromatischen Kohlenwasserstoff reduziert, ohne daß eine Kupplung stattfindet. Die Tendenz zur Bildung der reduzierten aromatischen Verbindung nimmt von Alkyliodiden zu Alkylchloriden stark zu. Während die Reaktion in Bezug auf Palladium katalytisch ist, wird die entsprechende Organoboronsäure im stöchiometrischen Mengen eingesetzt (d.h. mol zu mol ). Der katalytische Komplex ist eine Palladium(0)spezies, die in der Regel vom Liganden mit schwachen Donoreigenschaften koordiniert wird (z.B. Pd[P(Ph)3]4 ). Liegt eine Palladium(II)-Verbindung wie PdCl2 vor, wird diese im ersten Schritt des Katalysezyklus zu Pd(0) reduziert. Der Mechanismus ist so zu verstehen, daß sich die Pd(0)-Spezies im ersten Schritt des Katalysatorzyklus in die Kohlenstoff-Halogen-Bindung einschiebt. Es entsteht ein trans- -Paladium(II)-Komplex. Die Geschwindigkeit des Einschubs ist abhängig von derAbgangs-gruppe und meist der geschwindigkeitsbestimmende Schritt der Reaktion. Die Reaktivität der Organohalogenidverbindung sinkt in der Reihenfolge J>Br>Cl. Elektronenziehende Gruppen (-M-Effekt) beeinflussen die Geschwindigkeit der oxidativen Addition positiv. Analog dazu wirken elektronenschiebende Gruppen (+M) desaktivierend. Das Diorganyl bildet sich nach Übertragung des organischen Restes der Organobor-verbindung auf den trans- -Palladium(II)-Komplex. Dabei wird der Palladium(II)-Komplex zu einer Palladium(0)-Spezies reduziert. Der Katalysezyklus ist vollendet9) 1.4 Funktion der Base Ohne eine Base ist die Transmetallierung und die Regeneration des Katalysators nicht möglich: Eine C-C-Verknüpfung findet entweder gar nicht oder nur mit geringen Umsätzen statt. Geeignete Basen sind vorzugsweise die Salze der Alkali- und Erdalkalimetalle. In der Literatur werden jedoch auch SuzukiKopplungen mit Aluminiumsalzen, Natriumalkoholaten und Aminen erwähnt.(8,10) Die Base wird normalerweise mindestens im zweifachen Überschuß eingesetzt. 2.0 Quellenangaben Peter Sykes; Reaktionsmechanismen der organischen Chemie R-R´ R-X Pd(0) reduktive Eliminierung oxidative Addition R-Pd(II)-R´ [B(OH)4] - R-Pd(II)-X KOH Transmetallierung R-Pd(II)-OH R´-B(OH)2 OH - R´-B(OH)3- KX Schema 1.2: Allgemeiner Katalysezyklus der palladiumkatalysierten Kreuzkupplung (5)