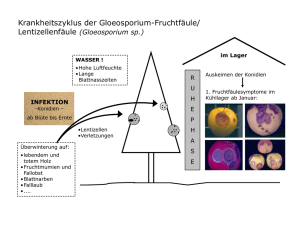
Dissertation - Digitale Bibliothek Braunschweig
Werbung

Entwicklung eines Modellsystems zur Untersuchung spezifischer T-Zell Reaktionen gegen Aspergillus fumigatus Von der Fakultät für Lebenswissenschaften der Technischen Universität Carolo-Wilhelmina zu Braunschweig zur Erlangung des Grades eines Doktors der Naturwissenschaften (Dr. rer. nat.) genehmigte DISSERTATION von Mike Hasenberg aus Salzgitter 1. Referent: Prof. Dr. Dieter Jahn 2. Referent: Prof. Dr. Jürgen Wehland eingereicht am: 30.04.2008 mündliche Prüfung (Disputation) am: 14.07.2008 Druckjahr 2008 Vorveröffentlichungen der Dissertation Teilergebnisse aus dieser Arbeit wurden mit Genehmigung der Fakultät für Lebenswissenschaften, vertreten durch den Mentor dieser Arbeit, in folgenden Beiträgen vorab veröffentlicht: Fachartikel 1. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans Behnsen,J.; Narang,P.; Hasenberg,M.; Gunzer,F.; Bilitewski,U.; Klippel,N.; Rohde,M.; Brock,M.; Brakhage,A.A.; Gunzer,M. ; PLoS.Pathog. 2007; 3;2 Posterpräsentationen 1. FEBS Advanced Lecture Course Human Fungal Pathogens: Molecular Mechanisms of Host-Pathogen Interactions and Virulence 21. – 28.05.2005; La Colle sur Loup, Frankreich 2. DGFI-Herbsttagung 2005 21. – 24.09.2005; Kiel, Deutschland 3. Second FEBS Advanced Lecture Course Human Fungal Pathogens: Molecular Mechanisms of Host-Pathogen Interactions and Virulence 11. – 17.05.2007; La Colle sur Loup, Frankreich 4. 3rd Trends in Medical Mycology 28. – 31.10.2007; Turin, Italien Auch aus Steinen, die dir in den Weg gelegt werden, kannst du etwas Schönes bauen. Erich Kästner - für Anja - Abkürzungsverzeichnis Abkürzungsverzeichnis °C Grad Celsius CFP Cyan Fluorescent Protein µg Mikrogramm CGD Chronic Granulomatous Dis- μl Mikroliter μm Mikrometer ease CM complete medium CNPA Chronische, nekrotisierende, pulmonare Aspergillose A α anti A. Aspergillus Abb. Abbildung ABPA Allergische Bronchopulmona- CPG Cytosin-phosphatidylGuanosin CTL re Aspergillose cytotoxic T lymphcyte D Ag Antigen Δ Deletion AK Antikörper d.h. das heißt AmB Amphotericin B DC dendritic cell AMM Aspergillus Minimalmedium deion. deionisiert Amp Ampicillin dest. destilliert APC Allophycocyanin DNA Deoxyribonucleic acid APC antigen presenting cell dNTP Desoxyribonukleo- AS Aminosäure(n) ATCC American Type Culture Col- sidtriphosphat DsRed lection Discosoma sp. Rotes Fluoreszenzprotein B BAL bronchoalveoläre Lavage bp E E. Escherichia Basenpaare EDTA Ethylendiamintetraacetat BMDC bone barrow dendritic cell EGFP enhanced green fluorescent Bsp. Beispiel bzgl. bezüglich et al. und andere bzw. beziehungsweise evtl. eventuell EYFP enhanced yellow fluorescent protein C protein C. Candida CA Cortisonacetat CD cluster of differentiation CFSE CarboxyFluoroscein nimidyl Ester F FACS Succi- Fluorescence activated cell sorting FCS fetal calf serum 5 Abkürzungsverzeichnis fps frames per second MACS magnet cell sorting FSC forward scatter MHC major histocompatibility complex G min Minute g Gramm mM millimolar g Erdbeschleunigung mRNA messenger ribonucleic acid GAPDH Glycerinaldehyd-3-Phosphat- mS Millisekunde Dehydrogenase GFP green fluorescent protein N GPI Glycosylphosphatidylinositol NALT nose associated lymphatic tissue H NEAA non essential amino acids h hora ng Nanogramm HEPES N-2Hydroxyethylpiperazin-N’- NK Natürliche Killerzelle 2-ethansulfonsäure nm Nanometer I O i.e. in example o.g. oben genannt i.n. intranasal OD optische Dichte i.p. intraperitoneal Ova Hühner Ovalbumin i.v. intravenös IA invasive Aspergillose P IFN Interferon PAMP Ig Immunglobulin IL Interleukin PE Phyco-Erythrin IPTG Isopropyl-β-D- PEG Polyethylenglykol thiogalaktopyranosid PBS phosphate buffered saline PCR polymerase chain reaction pH negativer dekadischer Loga- K Pathogen Associated lecular Patterns K.O. Knockout rithmus Kan Kanamycin zentration kb Kilobasenpaare kDA Kilodalton PMN der Protonenkon- Polymorphonukleäre Leukozyten PRR Pattern Recognition Receptor L l Liter LB Luria-Bertani-Medium LPS Lipopolysaccharid M M molar 6 Mo- PVDF Polyvinyliden Difluorid R R Resistenz REM Rasterelektronenmikro- skop(ie) Abkürzungsverzeichnis RNA ribonucleic acid ROI reactive oxygen intermediate ROS reactive oxygen species RPMI Roswell Park Memorial Insti- U tute U Unit Raumtemperatur ü.N. über Nacht upm Umdrehungen pro Minute UV Ultraviolett RT S Tris Tris(hydroxymethyl)aminomethan s Sekunde s.c. subcutan s.u. siehe unten V SDS Sodiumdodecylsulfate V Volt SDS-PAGE SDS-Polyacrylamidgel- v/v volume per volume elektrophorese SSC side scatter T W w/v weight per volume WT Wildtyp t Tag Tab. Tabelle X TBS tris buffered saline X-Gal Taq Thermus aquaticus TCR T cell receptor TEMED N,N,N’,N’-Tetramethyl- Y ethylenediamine YFP 5-Brom-4-Chlor-3-Indolyl-βD-Galaktopyranosid TGF Transforming growth factor Th-Zelle T Helferzelle Z TLR toll like receptor z.B. TNF Tumornekrosefaktor yellow fluorescent protein zum Beispiel 7 Inhaltsverzeichnis Inhaltsverzeichnis Vorveröffentlichungen der Dissertation ....................................................................................... 3 Fachartikel ..................................................................................................................................... 3 Posterpräsentationen .................................................................................................................. 3 Abkürzungsverzeichnis ................................................................................................................. 5 Inhaltsverzeichnis .......................................................................................................................... 8 1 EINLEITUNG ................................................................................................... 12 1.1 Das Immunsystem .......................................................................................................... 13 1.1.1 Das angeborene/natürliche Immunsystem ................................................................ 14 1.1.1.1 Phagozytische Leukozyten und natürliche Killerzellen ..................................... 14 1.1.1.2 Antimikrobielle Proteine – Das Komplementsystem.......................................... 17 1.1.1.3 Kommunikation innerhalb des Immunsystems................................................... 17 1.1.2 Das erworbene/adaptive Immunsystem .................................................................... 18 1.1.2.1 Antigenpräsentierende Zellen (APC) .................................................................. 19 1.1.2.2 T Lymphozyten ........................................................................................................ 21 1.1.2.3 B Lymphozyten........................................................................................................ 24 1.1.2.4 Das immunologische Gedächtnis: Immunisierung und Vakzinierung............ 27 1.2 Die Luftwege als Haupteintrittsort von Pathogenen..................................................... 29 1.3 Aspergillus fumigatus ..................................................................................................... 32 1.3.1 Der Organismus ............................................................................................................... 32 1.3.2 Lebenszyklus..................................................................................................................... 34 1.3.3 Zellwand von Hyphen und Konidien ............................................................................ 35 1.3.4 Pathogenität.................................................................................................................... 37 1.4 1.3.4.1 Formen von Aspergillosen..................................................................................... 39 1.3.4.2 Virulenzdeterminanten von A. fumigatus........................................................... 43 1.3.4.3 Immunantworten bei der Etablierung einer invasiven Aspergillose............... 47 1.3.4.4 Therapiemöglichkeiten einer invasiven Aspergillose........................................ 50 Problemstellung und Zielsetzung................................................................................... 54 8 Inhaltsverzeichnis 2 2.1 MATERIAL UND METHODEN ......................................................................... 56 Material: allgemein ........................................................................................................ 56 2.1.1 Verbrausmaterial ............................................................................................................ 56 2.1.2 Geräte .............................................................................................................................. 57 2.1.3 Aspergillus fumigatus Stämme ...................................................................................... 58 2.1.4 Versuchstiere ................................................................................................................... 58 2.1.5 Chemikalien und Puffer ................................................................................................. 59 2.1.6 Mikrobiologische Nährmedien...................................................................................... 61 2.1.7 Zellkultur Nährmedien..................................................................................................... 63 2.2 Material: Molekularbiologische Methoden.................................................................. 64 2.2.1 E. coli Stämme................................................................................................................. 64 2.2.2 Plasmide ........................................................................................................................... 64 2.2.3 Oligonukleotide............................................................................................................... 65 2.2.4 Material, Reagenzien und Enzyme .............................................................................. 66 2.2.5 Antikörper für Westernblot Analysen ........................................................................... 67 2.2.6 Medien, Lösungen und Puffer....................................................................................... 67 2.3 2.2.6.1 Gentechnische Arbeiten ...................................................................................... 67 2.2.6.2 Southernblot............................................................................................................ 70 2.2.6.3 Westernblot ............................................................................................................. 71 Material: Immunologische Methoden .......................................................................... 73 2.3.1 Antikörper und Sekundärfarbstoffe für durchflusszytometrische Analysen ........... 73 2.3.2 Lösungen und Puffer....................................................................................................... 73 2.4 Material: Mikroskopie..................................................................................................... 74 2.4.1 Material und Reagenzien .............................................................................................. 74 2.4.2 Lösungen und Puffer....................................................................................................... 74 2.5 Material: IT-Bereich......................................................................................................... 75 2.5.1 Software ........................................................................................................................... 75 2.5.2 Internetdatenbanken..................................................................................................... 75 2.6 Mikro- und Molekularbiologische Methoden .............................................................. 76 2.6.1 Kultivierung und Sporenernte Aspergillus fumigatus ................................................. 76 2.6.2 Kultivierung und Induktion E. coli.................................................................................. 76 2.6.3 Polymerase Kettenreaktion (PCR) ................................................................................ 77 2.6.4 Restriktionsverdau ........................................................................................................... 77 2.6.5 Agarose-Gelelektrophorese.......................................................................................... 77 2.6.6 Isolierung von DNA-Fragmenten aus Agarose........................................................... 77 9 Inhaltsverzeichnis 2.6.7 Ligation von DNA Fragmenten ..................................................................................... 78 2.6.8 Herstellung chemisch kompetenter E. coli.................................................................. 78 2.6.9 Transformation E. coli...................................................................................................... 78 2.6.10 Protoplastierung von Aspergillus fumigatus ................................................................ 79 2.6.11 Transformation Aspergillus fumigatus........................................................................... 79 2.6.12 Plasmidpräparation aus E. coli...................................................................................... 80 2.6.13 Genomische-DNA-Extraktion aus Aspergillus fumigatus ........................................... 80 2.6.14 Sequenzierung von DNA ................................................................................................ 81 2.6.15 Western Blot ..................................................................................................................... 81 2.6.16 Southern Blot .................................................................................................................... 82 2.6.16.1 Herstellung der Sonden-DNA ........................................................................... 82 2.6.16.2 Southern-Hybridisierung (Southern, 1975) ...................................................... 82 2.7 Immunologische Methoden .......................................................................................... 83 2.7.1 Isolierung von Lymphozytenpopulationen aus der Milz ............................................ 83 2.7.2 Isolierung von T-Zellen aus einer Lymphozytensuspension........................................ 83 2.7.3 Generierung von dendritischen Zellen aus Knochenmark....................................... 84 2.7.4 Immunsuppressionen ...................................................................................................... 84 2.7.5 Infektion einer Maus mit Aspergillus fumigatus ........................................................... 85 2.7.6 Detektion der Zellteilung einer aktivierten T-Zelle (Proliferationsassay) .................. 85 2.7.6.1 Färben von Lymphozyten mit Carboxyfluoreszein Diazetat, Succinimidyl Ester (CFSE)................................................................................................................................ 85 2.7.6.2 Ablauf eines Proliferationsassays ......................................................................... 86 2.7.6.3 Analyse der Proliferation ....................................................................................... 87 2.7.7 Immunisierungen ............................................................................................................. 88 2.8 Mikroskopische Methoden ............................................................................................ 89 2.8.1 Rasterelektronenmikroskopische Untersuchung infizierter Lungen ......................... 89 2.8.2 Mikroskopische Visualisierung von Zell-Zell-Interaktionen unter Widefieldbedingungen ............................................................................................................. 89 3 ERGEBNISSE .................................................................................................. 91 3.1 Erzeugung und molekularbiologische Charakterisierung des Stammes A. fumigatus D1.41ΔOvaCit ................................................................................................................................... 91 3.1.1 Erzeugung des Stammes A. fumigatus D141ΔOvaCit .................................................... 93 3.1.1.1 Erzeugung der Fusionskonstrukte in E. coli.......................................................... 93 3.1.1.2 Erzeugung des Aspergillus-Shuttle-Vektors pSK379oc....................................... 98 3.1.1.3 Transformation des Aspergillus Stamms ............................................................ 100 10 Inhaltsverzeichnis 3.1.2 Mikroskopische Charakterisierung des A. fumigatus D1.41ΔOvaCit .......................... 100 3.1.3 Molekularbiologische Charakterisierung des A. fumigatus D1.41ΔOvaCit ............... 102 3.1.3.1 Charakterisierung durch PCR............................................................................. 102 3.1.3.2 Charakterisierung durch Southernblot ............................................................. 103 3.1.3.3 Charakterisierung durch Westernblotanalyse ................................................. 105 3.1.4 Charakterisierung durch in vitro T-Zellproliferationsassays...................................... 106 3.2 Infektionsstudien ........................................................................................................... 107 3.2.1 Induktion einer spezifischen T-Zellproliferation durch unterschiedliche Applikationen von gelöstem Ovalbumin ............................................................................. 107 3.2.2 Infektion unter Immunsuppression durch Gr-1 Depletion (Neutropenie)............. 111 3.2.3 Infektion ohne Immunsuppression.............................................................................. 116 3.3 Imaging ......................................................................................................................... 125 3.3.1 In vitro Widefield-Mikroskopie ..................................................................................... 125 3.3.2 Rasterelektronenmikroskopie von infizierten Mauslungen...................................... 126 3.4 Immunisierungsexperimente ....................................................................................... 128 4 DISKUSSION UND AUSBLICK ...................................................................... 130 5 SUMMARY................................................................................................... 139 Referenzliste ............................................................................................................................... 141 Bücher und Schriftliche Veröffentlichungen in wissenschaftlichen Journalen............... 141 Internetseiten ............................................................................................................................ 154 Diplom- und Doktorarbeiten .................................................................................................. 154 Danksagung .............................................................................................................................. 156 Lebenslauf .................................................................................................................................. 158 11 Einleitung 1 Einleitung Aspergillus fumigatus ist ein ubiquitär vorkommender Schimmelpilz, der eine sehr hohe klinische Relevanz dadurch erlangt, dass er in passiv oder aktiv immungeschwächten Patienten eine invasive, gewebsschädigende, teils systemische Mykose hervorrufen kann (invasive Aspergillose), die äußerst schwierig zu behandeln ist (Denning 1998). Grundlegende Mechanismen der Pathogenität des Pilzes, aber auch der verantwortlichen Immunantworten sind bisher unvollständig verstanden. Es fehlen nach wie vor klinische Diagnoseverfahren zur frühzeitigen Erkennung einer AspergillusInfektion, und auch Therapiemaßnahmen sind nur begrenzt verfügbar. Eine Möglichkeit der Impfung gegen die Infektion ist ebenfalls bisher nicht gegeben. Diese Arbeit soll dazu beitragen den Einfluss, den die adaptive Immunität bei einer invasiven Aspergillose hat, näher zu beleuchten, und insbesondere die Rolle von T-Zellen bei der Infektion zu klären. Neben immunologischen Standardmethoden kommen unterschiedliche Mikroskopieverfahren, wie 2-Photonenmikroskopie, Widefield Fluoreszensmikroskopie über die Zeit und Rasterelektronenmikroskopie (REM) zur Klärung der Fragestellungen zum Einsatz. Ein großer Teil der Arbeit beschäftigt sich mit der Erzeugung eines Aspergillusstamms, der notwendige Elemente für die immunologischen Experimente synthetisiert. 12 Einleitung 1.1 Das Immunsystem Zum Schutz eines Organismus vor den unterschiedlichsten Krankheitserregern hat sich über Jahrmillionen hinweg ein äußerst komplexes System gebildet, ohne welches kein Lebewesen in der Lage wäre längere Zeit zu überleben, das Immunsystem. Im Vertebratenkörper wehrt es sehr effektiv Infektionen durch Pilze, Viren, Bakterien und Parasiten ab und ist maßgeblich an der Eliminierung anormaler und abgestorbener Körperzellen (z.B. maligne entartete oder apoptotische Zellen) beteiligt. Diese außerordentliche Leistung wird durch einen dreistufigen stufigen Prozess realisiert: Die erste Verteidigungslinie bilden die mechanisch-chemischen Elemente. Intakte Haut und Schleimhäute sind für Abb. 1.1: Die 3 Schutzbarrieren des Immun- Pathogene in der Regel nicht zu über- systems. winden. Neben der physischen Ge- Quelle: [Internet 1011 ] schlossenheit dieser Barrieren, die ein Durchdringen in das Körperinnere bereits sehr unwahrscheinlich machen, sind ihnen oftmals antibiotisch wirkende Sekrete, Talg und Schweiß aufgelagert (Janeway, Travers, and Walport 2002; Welsh and Mason 2001; Mayer and Dalpke 2007). Durch diese wird beispielsweise der pH Werte der Haut auf 3 – 5 abgesenkt. Solche Auflagerungen enthalten antimikrobisch wirkende Enzyme, wie das Lysozym im Speichel, der Tränenflüssigkeit und anderen Schleimhäuten. Der zähflüssige Schleim der Mukosa ist großflächig auf Innenwände von Kanälen aufgebracht, die häufig Umwelteinflüssen ausgesetzt sind, wie z.B. die bronchialen Luftwege (siehe 1.4). Hier wird die klebrige Eigenschaft des Mukus durch ein Flimmerepithel unterstützt, das kontinuierlich den Schleim mit anhaftenden Mikroben und Staub aus der Lunge heraustransportiert (Mayer and Dalpke 2007). Ver- 13 Einleitung schluckte Keime müssen den sehr sauren Magensaft passieren, was ein Großteil der Mikroorganismen und Parasiten nicht übersteht. Die zweite Verteidigungsfront bildet die angeborene oder natürliche Immunität und die dritte wird von dem erworbenen oder adaptiven Immunsystem realisiert. Als deutlicher Unterschied zwischen diesen beiden Systemen ist die Spezifität zu nennen. Während die Bestandteile des angeborenen Immunsystems körperfremde Strukturen relativ unspezifisch, ohne vorherigen Kontakt mit ihnen, direkt bekämpfen, liegt der adaptiven Immunantwort stets eine Erkennung spezifischer Strukturen und eine, dem Pathogen angepasste Immunantwort zugrunde. 1.1.1 Das angeborene/natürliche Immunsystem 1.1.1.1 Phagozytische Leukozyten und natürliche Killerzellen Sollten es Pathogene geschafft haben, die mechanisch-chemische Barriere zu überwinden, müssen sie sich als nächstes einem zellulären Bestandteil des Immunsystems stellen, den Phagozyten (Fresszellen). Damit auch nur körperfremde Zellen durch Phagozyten eliminiert werden, müssen diese als „Eindringlinge“ erkannt werden. Diese Erkennung kann auf zwei Arten erfolgen: Zum einen besitzen Fresszellen ein eingeschränktes Repertoire an zelloberflächengebundenen Rezeptoren, die immer wiederkehrende Strukturen auf potentiell gefährlichen Zellen erkennen. Diese Rezeptoren werden als PRR (Pattern Recognition Receptor) bezeichnet. Eine sehr bekannte Untergruppe repräsentieren die Toll-like Rezeptoren. Sie erkennen ebenfalls krankheitserregerspezifische Muster und Strukturen (PAMP = Pathogen Associated Molecular Pattern) und steuern eine Aktivierung von Genen, die eine entsprechende Bekämpfung der Keime einleiten (Arancibia et al. 2007). Durch solche PRR werden zum einen körpereigene von körperfremden Strukturen unterschieden und zum anderen Teile der erworbenen Immunität aktiviert (Romani 2004; Beutler et al. 2006). 14 Einleitung Abb. 1.2: Rezeptorvermittelte Phagozytose. Phagozyten tragen mehrere unterschiedliche Rezeptoren auf ihrer Oberfläche, die mikrobielle Bestandteile erkennen und eine Phagozytose einleiten. Quelle: (Gordon 2007) Die zweite Variante, über die Phagozyten ihr Ziel erkennen können verläuft darüber, dass die zu bekämpfenden Zellen von Antikörpern und Teilen des Komplementsystems (s.u.) zuvor opsonisiert werden. Phagozyten weisen ebenfalls phagozytoseeinleitende Rezeptoren für diese Opsonine auf. Die internalisierten Partikel werden von den Phagozyten in intrazelluläre Vakuolen aufgenommen, die mit Lysosomen verschmelzen, worauf die hydrolytischen Verdauungsenzyme und hochreaktive Sauerstoffspezies der Lysosomen die Partikel verdauen. Fragmente der verdauten Partikel können anschließend auf der Oberfläche präsentiert werden (Janeway, Travers, and Walport 2002). Monozyten machen etwa 5% der weißen Blutzellen (Leukozyten) aus (Janeway, Travers, and Walport 2002). Sie zirkulieren nach ihrer Reifung mehrere Stunden im Blut, bevor sie ins Gewebe einwandern und dort zu Makrophagen (großen Fresszellen) ausdifferenzieren. Diese Phagozyten patrouillieren durch das Gewe15 Einleitung be, wo sie, vermittelt durch die oben genannten Mechanismen, körperfremde Partikel und Trümmer abgestorbener Zellen aufnehmen und beseitigen. Parallel zur Phagozytose werden Makrophagen durch Bindung ihrer Oberflächenrezeptoren dazu angeregt, so genannte Zytokine und Chemokine freizusetzen (siehe 1.1.1.2). Nach Aktivierung der Makrophagen wird beispielsweise Interleukin-1 und TNF-α ausgeschüttet, wodurch das Gefäßendothel in dem angrenzenden Gewebe erweitert wird, so dass weitere Immunzellen besser zu dem Infektionsherd einströmen können. Des Weiteren wird Interleukin-8 ausgeschüttet, welches als chemotaktischer Lockstoff für verschiedene Zellsorten, wie neutrophile Granulozyten, aber auch weitere Monozyten, die an der Abwehrreaktion beteiligt sind, dient (Janeway, Travers, and Walport 2002). Neutrophile Granulozyten machen etwa 60 – 70% aller Leukozyten aus. Sie werden durch chemische Signale dazu angeregt, die Blutbahn zu verlassen und durch amöboide Bewegung in infiziertes Gewebe einzuwandern, wo sie ihrer Aufgabe als Fresszelle nachkommen. In einer klassischen Entzündungsreaktion wandern Neutrophile innerhalb von Stunden bis Tagen in befallenes Gewebe ein, wohingegen Monozyten eher Tage bis Wochen benötigen. Sie stellen also in der Regel die erste phagozytische Verteidigungslinie. Diese Zellsorte hat eine relativ kurze Überlebensdauer von maximal wenigen Tagen und im Falle einer Phagozytose kommt es schnell nach der Eliminierung des Keimes zu einem sehr raschen Absterben der Neutrophilen (Janeway, Travers, and Walport 2002). Eosinophile Granulozyten verfügen nur über eine geringe Phagozytoseaktivität. Ihre Hauptaufgabe ist die Bekämpfung von größeren, häufig eukaryotischen Parasiten. Diese werden durch zirkulierende Antikörper des Typs IgE spezifisch markiert, was für die Eosinophilen ein Zeichen zum Andocken darstellt. Über exozytotische Vorgänge werden stark basische Substanzen und verdauende Enzyme entlassen, welche die Außenhülle der Parasiten schädigt und somit zur Bekämpfung des Eindringlings führt. Eosinophile Granulozyten kommen in einer ungefähren Konzentration von 1,5% unter den weißen Blutkörperchen vor (Janeway, Travers, and Walport 2002). Als letzte Zellgruppe des angeborenen Immunsystems müssen noch die Natürlichen Killerzellen erwähnt werden. Diese erkennen über ein verändertes Oberflächenmuster zum einen intrazellulär durch Viren und Bakterien infizierte Körperzellen und zum anderen entartete Krebszellen. In der Folge leiten sie über exozytier16 Einleitung te, zytotoxische Granulae die Apoptose der veränderten Zelle ein. Ihre Aktivität kann durch Zytokine und Chemokine, die von Makrophagen sezerniert werden, deutlich gesteigert werden (IL-12, IFN-α und IFN-β) (Janeway, Travers, and Walport 2002). 1.1.1.2 Antimikrobielle Proteine – Das Komplementsystem Das Komplementsystem ist ein sehr komplexes System aus mehr als 30 Proteinen, die im Blutplasma gelöst oder zellgebunden vorliegen. Viele dieser Eiweiße sind Zymogene (Proenzyme), die im Fall einer Infektion kaskadenartig durch proteolytische Spaltung aktiviert werden und ihrerseits zur Aktivierung eines neuen Zymogens oder Effektors befähigt werden. Die zentrale Aufgabe des Komplementsystems ist die Opsonisierung körperfremder Zellen. Dabei können die entsprechenden Proteine des Komplements entweder direkt an spezifische Oberflächenstrukturen binden, oder aber an bereits oberflächenstrukturgebundene Antikörper des Typs IgG/IgM. Einige dieser Opsonine dienen direkt als Erkennungssignal für Phagozyten, andere leiten die Aktivierung einer Enzymkaskade ein. Als Resultat dieser Kaskade entsteht ein Membranlysekomplex, bestehend aus mehreren Proteinuntereinheiten auf der Zielzelle, der durch Zerstörung der Zellmembran zur Eliminierung der Zelle führt. Während der proteolytischen Spaltung der einzelnen Proenzyme entstehen Spaltprodukte, die als Lockstoff für andere Zellen des Immunsystems dienen (Janeway, Travers, and Walport 2002; Kemper and Atkinson 2007). 1.1.1.3 Kommunikation innerhalb des Immunsystems Um eine Kommunikation innerhalb des Immunsystems bereitzustellen, haben sich im Laufe der Evolution verschiedene Gruppen von Zytokinen gebildet. Hierbei handelt es sich um kleine Proteine, die als Botenstoffe in unserem Körper durch Bindung an Zellrezeptoren in der Lage sind, diese Zellen zu aktivieren/reprimieren oder bestimmte Stoffwechsel- und Syntheseleistungen in ihnen auszulösen. Interleukine werden auch als Peptidhormone bezeichnet. Sie regen spezifisch bestimmte Zellen des Immunsystems zu Wachstum, Reifung und Teilung an oder verhindern genau diese Prozesse der Aktivierung. Sie werden spezifisch von un17 Einleitung terschiedlichen Zellen des Immunsystems sekretiert. Derzeit sind über 30 verschiedene Interleukine bekannt [Internet 1016]. Interferone sind Gewebshormone, die der Aktivierung insbesondere antiviraler und antitumoraler Immunprozesse dienen. Ausgeschüttet von verschiedenen Zelltypen stimulieren sie z.B. die Makrophagenaktivität, sie erhöhen in virusinfizierten und umliegenden Zellen die Synthese an Proteinen, die eine weitere Virensynthese hemmen und sie sorgen für die Veränderung an Oberflächenproteinen von Zielzellen, so dass zytotoxische T-Zellen (siehe 1.1.2.2) diese Zellen effektiver binden und zerstören können [Internet 1017]. Tumornekrosefaktor ist ein sehr komplex agierendes Zytokin. Es wird insbesondere von Makrophagen, aber auch von verschiedensten anderen Zellen, wie Lymphozyten, Mastzellen, Endothelzellen, Herzmuskelzellen, Fibroblasten und neuronalem Gewebe gebildet. Genauso unterschiedlich wie die synthetisierende Zellsorte kann seine Effektorfunktion sein. Je nach Rezeptor und Signaltransduktionskaskade kann TNF zu Zelltod (Apoptose), Zellproliferation, Zelldifferenzierung und Ausschüttung anderer Zytokine führen. Oftmals aktiviert TNF über einen MAP Kinase Signalweg den Transkriptionsfaktor NF-κB, der zu einer Transkription entzündungsfördender und antiapoptotischer Gene führt [Internet 1018]. 1.1.2 Das erworbene/adaptive Immunsystem Während bereits nach kurzer Zeit nach Eintritt eines Pathogens in den Körper die Mechanismen der angeborenen Immunität beginnen, eine mögliche Infektion zu unterbinden, benötigt das adaptive Immunsystem 5- 10 Tage, bis es zur vollen Entfaltung seiner Wirkung kommt. Dieser Pfeiler des Immunsystems greift also zu einem Zeitpunkt in die Infektion ein, in der die ersten beiden Barrieren nicht zu einer erfolgreichen Eliminierung des Keims geführt haben. Zentrale Bestandteile des angeborenen Immunsystems, sind antigenpräsentierende Zellen (APC), TZellen, B-Zellen und Antikörper. Das adaptive Immunsystem setzt sich grob betrachtet aus 2 Teilen zusammen: Dem zellvermittelten Teil, bei dem spezielle T-Zellen in der Lage sind, infizierte und entartete Körperzellen direkt zu töten, und dem humoralen Teil, bei dem durch 18 Einleitung B-Zellen produzierte Antikörper für eine Bekämpfung der Pathogene sorgen (Janeway, Travers, and Walport 2002). 1.1.2.1 Antigenpräsentierende Zellen (APC) Die zentrale Erkennung von Partikeln, die dem Organismus schaden können läuft im Falle der adaptiven Immunantwort über die Gruppe der antigenpräsentierenden Zellen. Hierbei handelt es sich um Zellen, die Bruchstücke schädlicher Partikel (meist Peptide) auf ihrer Oberfläche den Effektor-T-Zellen präsentieren und diese dadurch aktivieren. Die Präsentation erfolgt in MHC-Molekülen. MHC bedeutet „major histocompatibility complex“ und bezeichnet eine Familie von Genen, die maßgeblich zur SelbstErkennung durch das Immunsystem beiträgt. Diese Genfamilie besteht aus etwa 20 Genen und 100 Allelen, was zur Folge hat, dass die Genprodukte auf der Oberfläche sämtlicher Körperzellen wie ein genetischer Fingerabdruck jedes Individuum von einem anderen unterscheidet (bis auf eineiige Zwillinge). Hierauf beruht der Mechanismus, dass körpereigene Zellen normalerweise nicht von dem Immunsystem bekämpft werden (Janeway, Travers, and Walport 2002). Abb. 1.3: Aufbau der beiden MHC Moleküle. Zu sehen sind das jeweils unbeladene MHC-I Molekül (links) und das MHC-II Molekül (rechts) Quelle: (Janeway, Travers, and Walport 2002) Immunologisch relevant sind die MHC Moleküle der Klasse I und II, wobei MHC-I Moleküle in der Regel mit Peptiden beladen sind, die zytosolischen Ursprungs sind, also Peptide die entweder aus der Degradation zytoplasmatischer, körperei19 Einleitung gener Proteine stammen, aber auch Peptide, die durch den Verdau zytosolisch vorliegender Krankheitserreger, wie Viren entstanden sind. MHC-I Moleküle kommen auf allen kernhaltigen Körperzellen vor und dienen als Sensor für eine intrazelluläre Infektion. Aufgrund ihrer Struktur binden sie Peptide von 8-10 Aminosäuren (AS) Länge (Janeway, Travers, and Walport 2002). MHC-II Moleküle werden mit Peptiden (12 – 25 AS) aus Phagolysosomen beladen und präsentieren demnach immer Bruchstücke von extrazellulär durch Makropinozytose aufgenommenen Partikeln. Diese Strukturen findet man auf so genannten „professionellen“ antigenpräsentierenden Zellen, wie dendritischen Zellen, Makrophagen und B-Zellen. T- und B-Zellen sind in der Lage den Komplex aus körpereigenem MHC Molekül und körperfremden Partikelbruchstück (Peptid) zu erkennen und darauf zu reagieren (s.u.) (Janeway, Travers, and Walport 2002). Dendritische Zellen, als effektivste Population der APC, sind überall im Körper auffindbar und nehmen in dieser unreifen Form über spezifische und unspezifische Mechanismen kontinuierlich Antigene aus der Umgebung durch Phagozytose, Pinozytose und Endozytose auf und präsentieren diese über MHC-II Moleküle an ihrer Oberfläche. Mit den einsetzenden Signalen einer Entzündungsreaktion (Zytokine) beginnt ein lokaler Reifeprozess der DCs. Sie stoppen die Antigenaufnahme, verdichten präsentierende MHC-II Komplexe und begeben sich in die nächsten, drainierenden Lymphknoten, wo sie die gesammelte Antigeninformation TZellen präsentieren (s.u.) (Janeway, Travers, and Walport 2002). Abb. 1.4: Aufbau eines Lymphknotens. An den Kreuzungspunkten von Lymphgefäßen befinden sich diese extrem wichtigen, immunologischen Strukturen. Neben der Aktivierung von T-Zellen durch antigenpräsentierende Zellen in der T- Zellzone kommt es hier strukturell lokalisiert zu einer sehr effizienten B- Zellaktivierung durch T Helferzellen zum einen an der Grenzschicht zwischen T und B-Zellareal und im weiteren Verlauf dann auch in den germinalen Zentren im B-Zellfolikel. Quelle: [Internet 1012] 20 Einleitung Makrophagen/Monozyten zählen ebenfalls zu den antigenpräsentierenden Zellen. Als Unterschied zu den dendritischen Zellen verbleiben sie bei der Präsentation allerdings in dem Gewebe, wo sie das Antigen aufgenommen haben. Sie dienen im Gegensatz zu den DCs daher eher der Aktivierung patrouillierender T Gedächtniszellen (s.u.) (Janeway, Travers, and Walport 2002). Als letzter Zelltyp zählen auch die B-Lymphozyten zu den Antigenpräsentierern. Dies ergibt sich aus dem normalen Aktivierungsmechanismus von B-Zellen und wird unter 1.1.2.3 näher erläutert. 1.1.2.2 T-Lymphozyten In dieser Untergruppe der Leukozyten, die nach ihrem Entstehungsort, dem Thymus benannt ist, finden sich mehrere unterschiedliche Zellpopulationen mit sehr unterschiedlichen Aufgaben. Ihnen gemein ist der zelloberflächengebundene heterodimere T-Zellrezeptor (TCR). Dieser besteht aus zwei Transmembranglykoproteinketten, wobei zwei unterschiedliche Versionen dieses Dimers vorkommen: Auf etwa 95% aller T-Zellen befindet sich die α:β-TCR Variante wohingegen die restlichen T-Zellen die γ:δ Form tragen. Der TCR ist mit den verschiedenen Ketten (γ, δ, ε und ζ) des CD3-Komplexes assoziiert, welche bei Stimulation die Signaltransduktion in das Zellinnere initiieren (Abb. 1.5). Diese Initiation erfolgt durch CD3 assoziierte Kinasen wie dem Zeta-Kette-assoziierten Protein-70 (ZAP-70) und der Lymphozyten-spezifischen Kinase (Lck), durch welche die Signalkaskade ins Innere weitergeleitet wird (Friedl, den Boer, and Gunzer 2005). 21 Einleitung Abb. 1.5: Der T-Zellrezeptorkomplex. Die zentralen Elemente bilden die α- und β-Ketten, die über ihren variablen Teil für die spezifische Antigenerkennung zuständig sind. Für eine vollständige Zellaktivierung bedarf es des costimulatorischen Signals von CD4, bzw. CD8. CD3 dient der Signalweiterleitung in das Zellinnere. Quelle: [Internet 1013] Die Aufgabe des TCR ist die Erkennung von präsentierten Fremdantigenen im Komplex mit MHC Molekülen und die anschließende Einleitung immunologischer Reaktionen gegen die erkannten schädlichen Partikel. Im Gegensatz zu dem BZellrezeptor, der gelöste Antigene in ihrer nativen, 3-dimensionalen Form bindet (siehe 1.1.2.3), erkennt der TCR lediglich den Komplex aus linearem Antigenpeptid und MHC Molekül (Janeway, Travers, and Walport 2002). Bei der Bindung des TCR an eine antigenpräsentierende Zelle bedarf es eines zusätzlichen Corezeptors, der an das jeweilige MHC Molekül bindet. Unter den TZellen kann man zwei Populationen unterscheiden, die unterschiedliche Formen dieses Corezeptors tragen, zum einen CD4 positive T-Zellen, die auch T Helferzellen genannt werden und an MHC Moleküle des Typs II binden und zum anderen CD8 positive zytotoxische T-Zellen (CTL), die Peptid:MHC-I Komplexe erkennen (Janeway, Travers, and Walport 2002). Mit Bindung des TCR:Corezeptor Komplexes an den Peptid:MHC-Komplex bildet sich eine distinkte Kontaktzone zwischen APC und T-Zelle aus. In dieser finden sich zum einen Molekülinteraktionen, die der Stabilität dieser immunologischen Synapse dienen und zum anderen findet man eine Vielzahl an signalübermittelnden Rezeptor-Ligand Interaktionen 22 Einleitung (Reichardt et al. 2007). Bei Erkennung eines Fremdantigens in einem körpereigenen MHC Komplex und bei passenden immunologischen Umständen kommt es zu einer sehr komplexen, kinasegesteuerten Aktivierung der T-Zelle. Diese Aktivierung führt zu einer Proliferation (Zellteilung) der Zelle, wodurch ermöglicht wird, dass aus der sehr geringen Anzahl an „passenden“ T-Zellen eine große Population an Effektorzellen für den Kampf gegen ein erkanntes Pathogen entsteht. Dieses Prinzip wird als klonale Selektion bezeichnet und ist ein zentrales Dogma der Immunbiologie (Janeway, Travers, and Walport 2002). CD8+ zytotoxische Effektor-T-Zellen binden an Fremdantigen präsentierende Körperzellen über den MHC-Klasse-I Komplex, also an Zellen, die mit einem intrazellulär persistierenden Erreger infiziert sind. Über die Ausschüttung von Perforinen und Granzymen oder die Bindung des membranständigen Fas-Liganden wird die befallene Zelle direkt zerstört, bzw. in die Apoptose getrieben, um die weitere Vermehrung des Keims einzudämmen. Zusätzlich sekretieren CTLs Interferone des Typs γ, welche zum Beispiel veranlassen, dass mehr MHC-I Komplexe an der Zelloberfläche von benachbarten Zellen präsentiert werden und diese dadurch effizienter auf eine ebenfalls vorherrschende Infektion untersucht werden können. Durch die Erkennung veränderter Eigenantigene in MHC-I Komplexen spielen CTLs ebenfalls eine sehr bedeutende Rolle in der Beseitigung entarteter Körperzellen (Krebszellen) (Janeway, Travers, and Walport 2002). Die T Helfereffektorzellen unterteilen sich in zwei Hauptklassen, die als gemeinsamen Vorläufer naϊve CD4+ T-Zellen haben. Die von Zellen des angeborenen Immunsystems nach Pathogenkontakt sekretierten Zytokine haben maßgeblichen Einfluss darauf, in welche Richtung sich die CD4+ Zelle nach ihrer Aktivierung durch Bindung des MHC-II Komplexes differenziert. Angeregt durch IFN-γ und IL-12, welches von NK- und dendritischen Zellen ausgeschüttet wird sekretieren die so genannten TH1 Zellen unter anderem weiteres IFN-γ und IL-2 und stimulieren dadurch eine zelluläre Immunantwort. Es werden Makrophagen aktiviert, die MHC-I basierte Peptidpräsentation erhöht, B-Zellen dazu veranlasst opsonisierende Antikörper zu produzieren und CTLs zur Proliferation angeregt. Parallel wird durch die ausgeschütteten Zytokine eine TH2 Antwort inhibiert (Janeway, Travers, and Walport 2002). 23 Einleitung TH2 Zellen hingegen exozytieren nach Aktivierung durch IL-4 TNF-β, IL-4 und IL10, wobei IL-10 die Makrophagenaktivierung hemmt und IL-4 B-Zellen sehr stark zur Produktion von neutralisierenden Antikörpern anregt (humorale Immunantwort). Auch im Falle einer TH2 Antwort wird die TH1 Antwort zytokinvermittelt unterdrückt (Janeway, Travers, and Walport 2002). Relativ neu sind Veröffentlichungen, die eine Subklasse von T-Helferzellen beschreibt, die sich weder in die Th1 noch in die Th2 Gruppe eingliedern lässt. Diese Th17 Zellen sezernieren IL-17, IL-6 und TNF-α (Harrington, Mangan, and Weaver 2006) wobei die Zytokine IL-6 und TGF-β entscheidend für die Differenzierung dieser Zellen sind (Mangan et al. 2006; Veldhoen et al. 2006). Dabei ist das von APC sezernierte Zytokin IL-23 wichtig für die Expansion und das Überleben dieser Zellen und die Differenzierung zu Th17 Zellen kann durch IL-4 und IFN-γ inhibiert werden. Th17-Zellen scheinen bei chronischen Entzündungsvorgängen beteiligt zu sein. Als letzte bedeutende T Helferzellen sind die regulatorischen T-Helferzellen (Treg) zu nennen. Klassisch werden sie durch die beiden Oberflächenmarker CD4 und CD25 und dem intrazellulär lokalisierten Transkriptionsfaktor Foxp3 charakterisiert (Sakaguchi et al. 1995), wobei kontinuierlich Veröffentlichungen über T-Zellen mit regulatorischen Potenzial erscheinen, die von dem klassischen Expressionsschema abweichen (Hori, Nomura, and Sakaguchi 2003; Wilczynski, Radwan, and Kalinka 2008). Regulatorische T Helferzellen können die Aktivierung von CD4 und CD8 T-Zellen kontaktunabhängig oder über die Sekretion von antiinflammatorischen Zytokinen hemmen. 1.1.2.3 B-Lymphozyten Die B-Zellen bilden die Grundlage für die humorale Immunantwort. Sie sind die einzige Zellsorte, die in der Lage ist, Antikörper zu produzieren. Antikörper sind Proteine, die im Blut und anderen Körperflüssigkeiten dazu dienen das Immunsystem beim Kampf gegen fremde Partikel zu unterstützen. Aufgebaut sind sie aus 2 schweren und 2 leichten Ketten, die in sich jeweils noch einmal in einen konstanten und einen variablen Teil unterteilt sind. Alle Ketten sind über Disulfidbrücken miteinander verbunden. 24 Einleitung Abb. 1.6: Aufbau der fünf unterschiedlichen Antikörperklassen. Die Schweren und leichten Ketten sind über Disulfidbrücken miteinander verknüpft. An den oberen Enden der Y-Struktur befinden sich die hypervariablen, antigenerkennenden Bereiche. Die konstanten Bereiche der Antikörper weisen fünf unterschiedliche Formen auf, anhand derer man die Immunglobuline in verschieden Klassen einordnen kann. Quelle: [Internet 1014] Bei der Synthese der variablen Regionen der Antikörper greifen ähnliche Mechanismen, wie bei der Entstehung der T-Zellrezeptoren. Über genetische Rekombination von vielen leicht unterschiedlichen Genbausteinen und Hypermutationsraten vor der Transkription der AK Gene entsteht eine sehr große Anzahl an Erkennungsstrukturen. Über diese variablen Bereiche binden Antikörper sehr spezifisch an mechanisch zugängliche Oberflächenstrukturen, so genannte Epitope. Aber auch die konstanten Teile von Antikörpern können sich unterscheiden. Derzeit sind 5 verschiedene konstante Teile bekannt, die nach Bindung des Antigens eine Auswirkung auf nachfolgende Effektormechanismen haben. Man kann Antikörper anhand ihres konstanten Teils in 5 Isotypen unterteilen. 25 Einleitung Tab. 1.1: Übersicht über die 5 verschiedenen Antikörperisotypen. Quelle: [Internet 1015] (Campbell 1998) Name Beschreibung Aggregate wird hauptsächlich in Schleimhäuten, wie Darm, IgA Atemtrakt, Urogenitaltrakt gebildet und schützt vor ihrer Besiedlung, indem die Anheftung von Bakterien und Viren unterbunden wird. Hauptfunktion als Antigenrezeptor auf B-Zellen. IgD Andere Funktionen bisher kaum beschrieben. Vermittelt die Ausschüttung proinflammatorischer IgE Mediatoren, wie Histamin durch Mastzellen und Basophile. Außerdem beteiligt an der Parasitenabwehr. IgG Er ist der häufigste Antikörpertyp. Er schützt vor in Blut und Lymphe zirkulierenden Viren, Bakterien und Toxinen und aktiviert das Komplementsystem IgM Die ersten im Blut zirkulierenden Antikörper als Reaktion auf eine Infektion. Sie befinden sich auch auf der Oberfläche von B-Zellen, wo sie als Haupt B-Zellrezeptor agieren. Sezernierte Antikörper können auf verschiedene Weise dazu beitragen, gefährdende Partikel zu eliminieren (Janeway, Travers, and Walport 2002). • Antikörper neutralisieren Keime und Gifte, indem sie durch Bindung Strukturen blockieren, die für eine schädliche Auswirkung verantwortlich sind, z.B. können sie das Anheften von Bakterien und Viren an das Wirtsepithel verhindern. • Sie können Partikel opsonisieren und damit als Ziel für Phagozyten und das Komplementsystem markieren. • Durch die zwei vorhandenen Bindestellen können mehrere Partikel durch Antikörper zusammengehalten werden. Diese Agglutinate können dann ebenfalls sehr effizient von Phagozyten beseitigt werden. 26 Einleitung Die Bezeichnung „B-Zellen“ stammt ursprünglich von ihrem Bildungsort in der Bursa Fabricii bei Vögeln. Bei Säugetieren entstehen die B-Zellen im Knochenmark, daher erhielt der Buchstabe B hier nachträglich die Bedeutung bone marrow (engl. für Knochenmark). Während der B-Zellreifung im Knochenmark beginnen die Lymphozyten bereits Antikörper des Typs IgM und später auch IgD zu produzieren. Beide AK Isotypen werden auf einer reifen, naϊven B-Zelle als B-Zellrezeptor membranverankert präsentiert, wobei, wie auch bei den T-Lymphozyten, jede B-Zelle Rezeptoren einer Spezifität trägt. Trifft diese B-Zelle auf ihr spezifisches Epitop und werden durch die Bindung an dieses die B-Zellrezeptoren quervernetzt wird der Immunkomplex durch Endozytose in die Zelle aufgenommen, dort prozessiert und im Anschluss Bruchstücke des verdauten Partikels in MHC-II Molekülen auf der Zelloberfläche der B-Zelle präsentiert. An diese präsentierenden MHC Komplexe können nun parallel aktivierte TH2 Zellen binden und durch Ausschüttung eines Zytokincocktails für eine vollständige Aktivierung der B-Zelle sorgen. Durch diese Aktivierung wandern B-Zellen in die Keimzentren der sekundären, lymphatischen Organe (Lymphknoten, Milz) ein, wo sie zu antikörpersezernierenden Plasmazellen reifen und stark proliferieren. Die sezernierten Antikörper haben die gleiche Spezifität wir der membranständige Rezeptor der jeweiligen B-Zelle, wobei durch eine somatische Hypermutation zusätzliche Veränderungen in die variablen Bereiche der AK eingebracht werden, um die Bindungsaffinität der Antikörper zusätzlich zu erhöhen. In dieser Phase kommt es zusätzlich zum Klassenwechsel der produzierten Antikörper von anfänglichem IgM hin zu anderen Isotypen, vornehmlich IgG (Janeway, Travers, and Walport 2002). 1.1.2.4 Das immunologische Gedächtnis: Immunisierung und Vakzinierung Nach der Immunisierung/Infektion eines Organismus und einer erfolgreichen, adaptiven Immunantwort gegen das immunogene Agenz, werden die meisten Tund B-Effektorzellen aus dem Körper durch Einleitung des programmierten Zelltods (Apoptose) eliminiert. Durch einen noch nicht verstandenen Prozess bleiben allerdings einige Effektorzellen erhalten (T und B Gedächtniszellen), die bei einer Reinfektion/Reimmunisierung für eine deutlich schnellere und stärkere Immunreaktion sorgen. Die klonale Expansion der betreffenden Zellen verläuft auf diese Weise wesentlich schneller, so dass zum einen effektiver Antikörper gegen das 27 Einleitung betreffende Antigen durch B-Zellen synthetisiert werden können und zum anderen T Effektorzellen deutlich schneller die spezifischen zellulären oder humoralen Immunantworten beeinflussen können(Janeway, Travers, and Walport 2002). 28 Einleitung 1.2 Die Luftwege als Haupteintrittsort von Pathogenen Bevor Pathogene in Kontakt mit dem Immunsystem kommen, müssen diese zunächst einmal in den Körper gelangen. Hier dienen die Luftwege häufig als Eintrittsort, da diese, bedingt durch den kontinuierlichen Gasaustausch, in stetiger Verbindung mit der Außenwelt stehen. Durch eine muskelbedingte Unterdruckatmung strömt in den meisten Säugetieren beim Einatmen sauerstoffreiche Umweltluft durch Nase und Mund in die knorpelstabilisierte Luftröhre (Trachea), um am Ende den körpereigenen Energiestoffwechsel durch Bereitstellung des für die Zellatmung notwendigen Sauerstoffs am Laufen zu halten. An der Bifurcatio tracheae gabelt sich die Trachea in zwei Bronchien, die sich im weiteren Verlauf etwa 20 weitere Male in immer kleiner werdende Kanäle (Bronchiolen) verzweigen. Dabei entsteht eine Struktur, die an einen umgedrehten Baum erinnert, bei dem die Luftröhre den Stamm und das Bronchialnetzwerk die Krone bildet. Abb. 1.7: Kernspintomographiebild der Lun- Abb. 1.8: Aufbau des bronchialen Flimmere- ge. pithels. Zu sehen sind die bronchialen Verästelungen in Die Schleimhaut gliedert sich in die obere beiden menschlichen Lungenflügeln. Die Tra- Schleimschicht mit durchragenden Härchen chea als luftzuleitendes Organ ist nicht erkenn- und einer darunter liegende Muskelschicht. bar. Quelle: [Internet 1003] Quelle: [Internet 1002] 29 Einleitung Die Hauptäste in den Bronchien sind mit einem Flimmerepithel ausgekleidet, welches aus einer Schleim- und einer Muskelschicht aufgebaut ist. Becherzellen, die in der Epithelschicht eingebettet sind sekretieren Mukus, durch den kontinuierlich hin- und herschlagende Härchen des Epithels hindurchragen. Durch dieses System werden eingeatmete Fremdkörper sehr effizient aus der Lunge in den Pharynx befördert, wo der Schleim heruntergeschluckt oder ausgehustet wird und dadurch potentiell gefährliche Fremdkörper eliminiert werden. Im unteren Teil der Schleimhaut befindet sich eine ringförmige Muskelschicht, durch die der Bronchiolendurchmesser zur Unterstützung der Respiration variiert werden kann (Campbell 1998). Abb. 1.9: Die Alveolen. Der Gasaustausch findet in den traubenförmig angeordneten Alveolen statt, die von einem Blutkapillarnetz umgeben sind. Quelle: [Internet 1009] Die feinsten Bronchiolen enden blind in den Alveolen, den Lungenbläschen. Traubenförmig angeordnet werden diese von einem dichten Netzwerk an kapillaren Blutgefäßen umschlossen. Durch die sehr dünne Wand der Alveolen kommt es zum Gasaustausch zwischen Alveoleninhalt und dem Blut. Dabei tritt Sauerstoff aus der eingeatmeten Luft in das Blut über und Kohlendioxid als Stoffwechselendprodukt der Atmung verlässt das Blut und wird mit dem nächsten Atemvorgang aus der Lunge entlassen [Internet 1001 ]. Eine menschliche Lunge enthält etwa 300 Millionen Alveolen, die einen durchschnittlichen Durchmesser von 250 – 300 µm aufweisen (Schiebler, Schmidt, and Zilles 1999). Die Alveolen dehnen sich während des Einatmens stark aus. Damit sie durch diese extreme Dehnung nicht beschädigt werden und während des Ausatmens nicht kollabieren sind sie an ihrer Innenwand mit einem Gemisch aus Phospholipiden (Surfactant), zur Senkung der Oberflächenspannung ausgekleidet[Internet 1001]. 30 Einleitung Abb. 1.10: Schematische Übersicht über den Aufbau des Alveolarsystems. Die Alveolen werden von einem Plattenepithel aus Zellen des Typs I und II ausgekleidet. Eine wichtige Immunzellsorte sind die Alveolarmakrophagen, die maßgeblich an der Eliminierung der bis hierhin vorgedrungenen, organischen Partikel beteiligt sind. Quelle: [Internet 1010] Der Innenraum der Lungenbläschen wird von einem Plattenepithel ausgekleidet, welches zu 95% aus Alveolarepithelzellen des Typs I und zu 5% des Typs II besteht. Die Epithelzellen des Typs II dienen der Sekretion des Surfactants. Zur Kommunikation stehen die Alveolen durch die Alveolarpore miteinander in direkter Verbindung. Im Interstitiellen Raum verlaufen äußerst dünne Blutkapillaren, über die der Gasaustausch verläuft. Des Weiteren befinden sich in diesen auch Alveolarmakrophagen und dendritische Zellen, die neben neutrophilen Granulozyten die erste Immunzellbarriere auf Ebene der angeborenen und der adaptiven Immunität darstellen. Beide Zellsorten können durch das Epithel hindurch in das Lumen der Alveole gelangen, wo sie äußerst effizient an der Eliminierung eingedrungener Krankheitserreger beteiligt sind (Schiebler, Schmidt, and Zilles 1999). Polymorphonukleäre Neutrophile (PMN) sind ebenfalls in dem engen Kapillarnetz vorhanden und es wird berichtet, dass diese durch den engen Durchmesser der Blutgefäße gestaut werden, wodurch sich die Zahl dieser ersten zellulären Verteidigungslinie in der Lunge erhöht (Doerschuk 2001). Während einer pulmonaren Infektion verlassen die Neutrophilen ebenfalls das Blutsystem in den Alveolarraum hinein, wo sie durch Phagozytose und Ausschüttung von reaktiven Sauerstoffspezies und Enzymen Mikroben effektiv bekämpfen. Darüber hinaus modulieren sie andere Immunreaktionen durch die Ausschüttung von Zytokinen und proinflammatorischen Chemokinen (Mizgerd 2008). 31 Einleitung 1.3 Aspergillus fumigatus Die Sporen als Verbreitungsstadium des Schimmelpilzes Aspergillus fumigatus können sehr leicht über den Atemtrakt eines Organismus aufgenommen werden und verursachen in immunsupprimierten Individuen schwerwiegende Infektionen. Nachfolgend wird dieses opportunistische Pathogen, welches den Modelorganismus der vorliegenden Arbeit darstellt, vorgestellt. 1.3.1 Der Organismus Abteilung: Schlauchpilze (Ascomycota) Aspergillus fumigatus ist ein Schimmel- Klasse: Echte Schlauchpilze (Ascomycetes) pilz aus der Gattung Aspergillus. Diese Unterklasse: Eurotiomycetidae Gattung erhielt ihren historischen Na- Ordnung: Eurotiales men im Jahre 1729 durch den italieni- Familie: Trichocomaceae schen Gärtner und Botaniker Pietro An- Gattung: Gießkannenschimmel (Aspergillus) Art: Aspergillus fumigatus tonio Micheli, der die Form ihrer Fruchtkörper, mit einem Aspergill (Weihwas- serwedel) verglich (siehe Abb. 1.11). Heute wird die Gattung auch als Gießkannenschimmel bezeichnet, da die Sporenträger (Konidiophoren) auch an den Brausekopf einer Gießkanne mit austretendem Wasser erinnern (siehe Abb. 1.12). Fumigatus leitet sich von dem lateinischen Wort fumus, der Rauch, ab und bezeichnet die rauchgrüne Farbe des Pilzes, die durch die pigmentierten Konidien (griechisch konia, Staub) auf der Oberfläche des Myzels entsteht, bzw. beschreibt die rauchartigen Konidienwolken, die entstehen, wenn diese durch den Wind weggeweht werden. Die Art Aspergillus fumigatus wurde durch den deutschen Arzt und Botaniker Johann Baptist Georg Wolfgang Fresenius im Jahr 1863 zum ersten Mal beschrieben (Fresenius 1863). 32 Einleitung Abb. 1.11: Weihwasserwedel (Aspergill). Quelle: [Internet 1004 ] Abb. 1.12: Fruchtkörper von Aspergillus fumigatus. Deutlich erkennbar sind die abgeschnürten Konidien Quelle: [Internet 1005] Systematisch gesehen ist die Einordnung von A. fumigatus in die Klasse der Ascomyceten schwierig, da der Ascus als schlauchförmiger Träger von sexuell entstandenen Sporen der Namensgeber dieser Klasse ist. Für A. fumigatus ist bisher allerdings kein sexueller Lebenszyklus beschrieben, so dass lediglich molekulargenetische Marker darauf hinweisen, dass dieser Pilz der Klasse der Ascomycota zugeordnet werden kann (Nierman et al. 2005). Aus diesem Grund wird er häufig noch in die Gruppe der Deuteromyceten (fungi imperfecti) eingeordnet. Hierbei handelt es sich um keine einheitliche Verwandtschaftsgruppe, sondern eine künstliche Einteilung, die alle Pilze umfasst, von denen derzeit nur die vegetative Lebensform bekannt ist. Die Gattung Aspergillus umfasst etwa 200 Arten, von denen ca. 40 als pathogen eingestuft werden (Klich 2006). A. fumigatus ist ein aerob lebender Saprobiont, der durch seinen vielseitigen Metabolismus fähig ist, auf verschiedensten Substraten zu wachsen, wobei er kohlenhydratreiche Umgebungen bevorzugt. Durch die Produktion verschiedener Amylasen ist er fähig, Polysaccharide, wie zum Beispiel Stärke, als Kohlenstoffquelle zu nutzen. Man findet ihn weit verbreitet auf verrottendem Pflanzenmaterial, im Erdreich, aber auch auf stärkehaltigen Lebensmitteln wie Brot oder Kartoffeln. Durch eine Umstellung seines Stoffwechsels ist der Pilz in der Lage, Salz- und Stickstoffverbindungen als Energiequellen zu nutzen, was ihm ermöglicht auch in sehr unwirtlichen Umgebungen zu vegetieren. Durch diese saprobionten Stoff- 33 Einleitung wechselleistungen liefert er einen beachtlichen Beitrag am natürlichen Kohlenstoffund Stickstoffkreislauf. Der Pilz weist eine hohe Thermotoleranz auf. Er überlebt Temperaturen bis zu 75°C und ist in der Lage bei bis 55°C zu wachsen (Beffa et al. 1998; Ryckeboer et al. 2003). Sein Temperaturoptimum liegt bei 37°C. Diese Merkmale befähigen ihn dazu von der Antarktis bis in die Sahara zu persistieren. Die komplette Genomsequenz wurde im Jahr 2005 publiziert (Nierman et al. 2005). Aus dem klinischen Pilzisolat Af293 wurden 29,4 Megabasen sequenziert, die sich auf acht Chromosomen verteilen und 9926 vorausgesagte Gene beinhalten. 1.3.2 Lebenszyklus Ausgehend von einer haploiden Konidie beginnt unter günstigen Bedingungen aus dieser ein Keimschlauch zu wachsen. Unter Wasseraufnahme geht diesem Keimungsprozess eine Schwellung der Konidie voraus. Durch Spitzenwachstum verlängert sich der Keimschlauch und es werden in regelmäßigen Abständen Septen eingezogen, die der Stabilität der entstehenden Hyphe dienen. Die septierten Kompartimente stehen durch einen zentralen Porus miteinander in Verbindung. Hierdurch ist ein guter Austausch des Zytoplasmas gewährleistet. Gelegentlich kommt es zur Verzweigung der Hyphen, so Abb. 1.13: Elektronenmikroskopische Aufnahme eines Konidi- dass im Laufe der Zeit ein stark verästeltes ophors von A. fumigatus. Hyphennetzwerk, K = Konidien 1008]. ein Myzel, entsteht [Internet P = Phialiden S = Stammzelle Quelle: (Samson 1999) Zur asexuellen Vermehrung von A. fumigatus kann sich an der Spitze eines Stielchens, das vertikal von einer als Fußzelle bezeichneten Hyphenzelle abzweigt, ein Vesikel mit einem Durchmesser von 20 bis 30 µm bilden, an dessen Oberfläche sich die konidienbildenden Phialiden herausdifferenzieren. Beide Strukturen zu34 Einleitung sammen bilden das Konidiophor. An dem freien Ende der flaschenförmigen Phialide werden kontinuierlich haploide, kugelförmige Konidien durch Einziehen eines Septums abgeschnürt. Hierdurch entstehen lange Sporenketten, bei denen die jeweils jüngste Konidie der Phialide am nächsten steht. Diese Art der Konidiogenese wird blastisch-phialidisch genannt. Durch den Luftstrom können die Sporen mit ihrem Durchmesser von 2 bis 3 µm leicht weggeweht werden und sich im Anschluss gut in der Umwelt verteilen. An geeigneter Stelle kommt es erneut zum Auskeimen des Konidiums, womit der vegetative Lebenszyklus von neuem beginnt [Internet 1008]. Abb. 1.14: Schematische Darstellung des asexuellen Lebenszyklus von Aspergillus fumigatus. Nach Keimung der Konidien beginnt das Längenwachstum und die Verzweigung der Hyphen, bis es gelegentlich zur Bildung von Konidiophoren kommt. Diese sind die Entstehungsorte von neuen Sporen. Quelle: [Internet 1006] Ein sexueller Zyklus ist bei Aspergillus fumigatus nicht bekannt, aber es wird vermutet, dass dieser vorhanden ist und dem Typus der Ascomyzeten entspricht (Paoletti et al. 2005). 1.3.3 Zellwand von Hyphen und Konidien Die Zellwände von Konidien und Hyphen stellen die ersten Strukturen dar, mit denen das Immunsystem in Kontakt kommt. Aus diesem Grund ist es nicht verwunderlich, dass PRR, wie das Dectin-1, die ersten Schritte einer Immunantwort gegen den Pilz einleiten (Romani 2004), und dass Komponenten der äußeren Aspergillusschichten extrem immunogen wirken (Moutaouakil et al. 1993). Die spezifische, der Zellmembran aufgelagerte Hyphenzellwand wird vornehmlich von einem dichten Geflecht aus Polysacchariden gebildet, wobei β(1,3)/(1,4)Glukan, verzweigtes β(1,3)/(1,6)-Glukan, Chitin und Galaktomannan die mengen35 Einleitung mäßig dominierenden Polysaccharide ausmachen (Bernard and Latge 2001; Latge 2007). Abb. 1.15: Aufbau der Hyphenzellwand von Aspergillus fumigatus. Ein dichtes Netzwerk aus verschiedenen Polysacchariden bildet die Zellwand des Pilzes. Durch dieses Geflecht ragen unter anderem Proteine, die zum Teil in der Zellmembran verankert sind und als Rezeptoren und Adhäsine fungieren. Quelle: (Bernard and Latge 2001) Im Gegensatz zu den Hyphen ist bisher nicht sehr viel über die Polysaccharidzusammensetzung der Zellwand von Konidien bekannt. Hier lag der Fokus des Forschungsinteresses bisher auf der äußeren Schicht der Zellwand. Diese ist aus einer äußerst hydrophoben Proteinschicht (Hydrophobine) und unterschiedlichen Rezeptoren für Wirtsproteine zusammengesetzt. Die Hydrophobine haben keinen ausgeprägten Einfluss auf die Pathogenität von A. fumigatus (Thau et al. 1994), wobei die Wirtsrezeptoren unerlässlich für die Adhäsion der Konidien am Wirtsepithel sind (Latge 1999). In dieser äußeren Schicht findet sich ebenfalls Melanin, welches für die Pigmentierung der Konidien verantwortlich ist. Knockoutmutanten für die Melaninsynthese sind um ein vielfaches anfälliger für die ROS von Phagozyten als WT Stämme (Jahn et al. 2000). 36 Einleitung 1.3.4 Pathogenität Wie weiter oben beschrieben werden die Aspergillussporen sehr effizient über die Luft verbreitet. Jeder Mensch in unseren Breitengraden ist daher permanent dem Kontakt mit diesem Aspergillus-Verbreitungsstadium ausgesetzt und atmet täglich mehrere hundert Konidien ein. Zwar kommt es auch durch andere Eintrittsorte als dem respiratorischen System (Haut, Augen, Bauchhöhle, Nieren, Knochen Gastrointestinaltrakt) zu AspergillusInfektionen, allerdings sind diese Fälle äußerst selten und stellen klinische Einzelfälle dar. Des Weiteren synthetisiert A. fumigatus eine Reihe von zum Teil kanzerogenen Mykotoxinen, wie dem Gliotoxin (Spikes et al. 2008), wobei die resultierenden Vergiftungserscheinungen auch nicht in den klinischen Alltag einzuordnen sind. Der Hauptgrund für das gesteigerte medizinische Interesse an diesem Pilz liegt eindeutig an Erkrankungen, die durch die Inhalation der unter besonderen Bedingungen infektiösen Pilzsporen hervorgerufen werden (Denning 1998; Latge 1999). Bei nachhaltigem inhalativen Kontakt mit den Pilzsporen kann es zur Etablierung von allergischen Reaktionen, wie allergisch bedingtem Schnupfen oder klassischem Asthma kommen. Dieses Krankheitsbild ist in die Reihe der weltweit stetig wachsenden Zahl an allergischen Erkrankungen einzugliedern und ist durch den Einsatz klassischer Therapiemaßnahmen, wie die Vermeidung von Expositionsherden und medikamentöser Behandlung durch Antihistaminika und Kortikosteroiden in den Griff zu bekommen (Denning 1998). Galaktomannan als Hauptbestandteil der Zellwand war das erste identifizierte Aspergillus-Antigen (Reiss and Lehmann 1979), welches bis heute ein wichtiges, klinisches Diagnosekriterium für Aspergillus-Infektionen ist (Latge 1999). 2006 wurden 29 A. fumigatus Antigene charakterisiert, die sich funktional in eine Gruppe mit enzymatischer Aktivität und in eine andere Gruppe bestehend aus Regulatorproteinen aufteilt. Die Allergene Asp f1, Asp f 5 und Asp f 10 sind hierbei besonders zu erwähnen, da sie gattungsspezifisch nur bei Aspergilli vorzukommen scheinen (Crameri 1999). 37 Einleitung Tabelle 1.2: Übersicht über Aspergillus fumigatus Antigene, deren Gene nach Kontrolle Ihrer IgE Bindekapazität (phage display) geklont und im Anschluss analysiert wurden. Quelle: (Nierman et al. 2005; Crameri et al. 2006). Allergen Größe Funktion / Ähnlichkeit (kDa) Accession No. / Genidentifikationsnr. Asp f 1 16.9 Ribotoxin S889330 / Afu5g02330 Asp f 2 37.0 b-glucanase U56938 / Afu4g09580 Asp f 3 18.5 Peroxisomal protein U58050 / Afu6g02280 Asp f 4 30.0 Glucosidase AJ001732 / Afu2g03830 Asp f 5 42.1 Metalloprotease Z30424 / Afu8g07080 Asp f 6 23.0 MnSOD U53661 / Afu1g14550 Asp f 7 11.6 Glucosidase AJ223315 / Afu4g06670 Asp f 8 11.1 P2 ribosomal protein AJ224333 / Afu2g10100 Asp f 9 32.3 Cell wall glucanase AJ223327 / Afu1g16190 Asp f 10 34.4 Aspartic protease (aspergillopepsin F) X85092 / Afu5g13300 Asp f 11 18.8 Cyclophilin AJ006689 / Afu2g03720 Asp f 12 65.0 Heat shock protein U924665 / Afu5g04170 Asp f 13 34.0 Alkaline serine protease Z11580 / Afu2g12630 Asp f 15 19.5 Serine protease? AJ002026 / Afu2g12620 Asp f 16 43.0 b-glucanase G3643813 / Afu1g16190 Asp f 17 19.4 Galactomannan protein MP1 AJ224865 / Afu4g03240 Asp f 18 34.0 Vacuolar serine protease Y13338 / Afu5g09210 Asp f 22 46.0 Enolase AF284645 / Afu6g06770 Asp f 23 44.0 L3 ribosomal protein AF464911 / Afu2g11850 Asp f 27 18.0 Cyclophilin AJ937743 / Afu3g07430 Asp f 28 12.0 Thioredoxin AJ937744 / Afu6g10300 Asp f 29 12.0 Hioredoxin AJ937745 / Afu5g11320 Bedingt durch die geringe Größe sind die Konidien nach Inhalation relativ gut lungengängig. Sie erreichen mühelos tiefere Bereiche der Lunge bis hin zu den Alveolen und können dort, je nach immunologischer Verfassung und Prädisposition des Menschen, zu verheerenden, extrem schwierig zu behandelnden Erkrankungen (Mykosen) führen, bei denen es dann auch zu einem Hyphenwachstum kommt. Abhängig vom Ausmaß und der Art des Hyphenwachstums und dem Ort der Infektion in der Lunge kann man unterschiedliche Aspergilluserkrankungen voneinander abgrenzen. 38 Einleitung Inhalation von Aspergillussporen Koloniebildung chronische höhlenbil- Lungener- Gesunder dende Lun- krankung Immunsup- Mensch generkran- oder leichte pression kung Immunsup- Asthma oder Cystische Fibrose pression chronische, keine Folgekrankheit nekrotisie- Aspergillom rende Aspergillose invasive Pulmonare ABPA Aspergillose Abb. 1.16: Überblick über mögliche pulmonare Erkrankungen nach Inhalation von Aspergillus fumigatus Sporen. Entscheidend für den Krankheitsverlauf ist der vorherrschende Gesundheitsstatus des Menschen Quelle: (Kumar, Chugh, and Gaur 2003) 1.3.4.1 Formen von Aspergillosen Allergische Bronchopulmonare Aspergillose – ABPA Voraussetzung für diese Art der Mykose ist eine bereits vorliegende Erkrankung an Asthma oder Cystischer Fibrose (Denning 1998; Latge 1999; Kumar, Chugh, and Gaur 2003). Durch bisher unverstandene Mechanismen ist es A. fumigatus in einem geringen Prozentsatz dieser Patienten möglich, Bereiche der Bronchien zu besiedeln und dort lokal im atemwegsadherierten Sputum zu wachsen. Durch die einsetzende Entzündungsreaktion werden verstärkt Aspergillus Antigene aufgenommen und gegen diese spezifische Antikörper der Typen IgG, IgE und IgA gebildet. IgE führt bei anhaltendem Kontakt zu einer Mastzelldegranulation, wodurch zum einen asthmatypische Bronchospasmen auftreten, und zum anderen die Permeabilität des Bronchialepithels erhöht wird. Es kommt zu einem verstärkten Einwandern von Eosinophilen, die ebenfalls, angeregt durch IgE, zytotoxische Proteine und andere basische Abwehrstoffe exozytieren. IgG und IgA führen zu einer Aktivierung des Komplementsystems und damit zu einer komplementvermittelten 39 Einleitung Zellzerstörung. Im Laufe der Immunreaktion erfolgt eine zytokinvermittelte Makrophagenrekrutierung, die durch die Produktion von reaktiven Sauerstoffspezies (ROS) ebenfalls zu einer Zerstörung der Zellen führt. Neben der Bekämpfung des Pathogens führen diese unspezifischen Abwehrreaktionen zur massiven Schädigung des Lungengewebes. Neue Forschungsergebnisse konnten zeigen, dass es zu einem krankheitsbedingt verstärkten Auftreten von speziellen Aspergillus-Antigenen in Blutseren kommt. Bei der ABPA beispielsweise war der Titer an Asp f 2, 4, 6 und 8 signifikant erhöht, wodurch eine diagnostische Abgrenzung zum Aspergillus bedingten Asthma gegeben ist (Crameri et al. 2006; Crameri et al. 1998; Hemmann et al. 1998). Aspergillom Hierbei handelt es sich um einen Abb. 1.17: Röntgenbild so genannten Pilzball, der sich in eines Aspergillompatien- krankheitsbedingt ten. entstandenen Kavernen etabliert. In der Regel handelt es sich hierbei um Ver- Durch eine Tuberkuloseerkrankung ist eine Höhle in der Lunge entstanden, die narbungen einer überstandenen nachfolgend Tuberkuloseinfektion oder durch Aspergillus besiedelt wur- eine chronische Sinusitis (Nasen- de. nebenhöhlenentzündung) ent- von einem Quelle: [Internet 1007] standene Hohlräume. Nach Auskeimen der durch Inhalation aufgenommenen Konidien kommt es zu einem kugelförmigen Hyphenwachstum, bis die gesamte Höhle dicht mit Myzel bewachsen ist. Dieses Wachstum ist in der Regel nicht invasiv, die Hyphen dringen also nicht in das umliegende Gewebe ein. An der Oberfläche des Balls, angrenzend zu der Höhlenwand bilden sich die Sporenträger, so dass es zu einer Pigmentierung des Aspergilloms kommt. In Aspergillompatienten lassen sich hohe Aspergillus Antikörpertiter feststellen und eines der schwerwiegendsten Probleme bereiten Lungenblutungen, die durch die Zerstörung angrenzender Blutgefäße hervorgerufen werden. Ein Lungenaspergillom ist gut im Röntgenbild zu erkennen (siehe Abb. 1.17) und zeichnet sich durch Mobilität der Pilzmasse aus. 40 Einleitung Chronische, nekrotisierende, pulmonare Aspergillose (CNPA) Patienten, die sich in einer leichten Immunsuppression befinden, entweder durch Medikamente (Kortikosteroide), aber auch hervorgerufen durch Krankheiten wie Alkoholismus oder Lungenerkrankungen, die die „normale“ Funktion des Immunsystems beeinträchtigen, sind dem Risiko ausgesetzt, eine chronische, nekrotisierende Aspergillose zu erlangen. Bei diesem Krankheitsbild handelt es sich um eine so genannte halb-invasive, nekrotisierende Form der Aspergillose. In diesem Fall dringt das Myzel in umliegendes Gewebe vor, wo es, bedingt durch die Blockierung der Blutzufuhr, zur Bildung von Granulae und im weiteren Verlauf zum Absterben von Lungengewebe kommt. An diesen Orten bilden sich Kavernen mit innenliegendem abgestorbenen Material, welches ein wichtiges, radiologisches Diagnosekriterium darstellt. Diese Erkrankung ist relativ selten zu beobachten und die Invasion in angrenzendes Gewebe ist stets lokal begrenzt. Oftmals entsteht eine CNPA in einem Aspergillompatienten durch Behandlung mit Kortikosteroiden (Yella, Krishnan, and Gillego 2005). Invasive Aspergillose Die invasive Aspergillose (IA) stellt ein immer größer werdendes medizinisches und finanzielles Problem im klinischen Betrieb dar. So stieg die Anzahl an Todesfällen, die auf eine invasive Aspergillose zurückzuführen war von 1980 bis 1995 um 375% (McNeil et al. 2001), wobei jeder Einzelfall durchschnittliche Kosten in Höhe von etwa 65000 $ verursacht, was einer Gesamtsumme von 633 Millionen US $ im Jahr 1996 in den USA entspricht (Kontoyiannis and Bodey 2002). In der Regel ist die Grundvoraussetzung, um an einer IA zu erkranken, eine massive Immunsuppression. Insbesondere neutropenische Patienten sind einem hohen Risiko ausgeliefert, an der invasiven Form der Mykose zu erkranken. 41 Einleitung Tab. 1.3: Inzidenz der invasiven Aspergillose bei verschiedenen Erkrankungen und klinischen Eingriffen. Quelle: (Denning 1998) Art der Erkrankung / des klinischen Eingriffs Herz- und Lungen- bzw. Lungentransplantationen 19-26 % Chronisch granulomatösen Erkrankungen 25-40 % Akuten Leukämien Allogenen Knochenmarkstransplantationen/KMT 5-24 % 4-9 % Autologen Knochenmarkstransplantationen/KMT ohne Zytokine 0,5-6 % AIDS 0-12 % Lebertransplantationen 1,5-10 % Herz- und Nierentransplantationen 0,5-10 % Schwerer kombinierter Immundefizienz 3,5 % Verbrennungen 1-7 % Systemischem Lupus erythematodes Autologen Knochenmarkstransplantationen/KMT mit Zytokinen 1% <1 % Bedingt durch fehlende oder geschwächte neutrophile Granulozyten, die eine der ersten Verteidigungslinien gegen eine Aspergillus-Infektion darstellen kommt es nach Eintreten des Pathogens in den Wirt zu einer mehr oder weniger ungehinderten Auskeimung der Konidien und zum hyphenartigen Wachstum des Pilzes. Dabei tritt granulomatöse Gewebszerstörung bedingt durch das Pilzwachstum auf. Hauptorte der initialen Pilzbesiedlung sind die Lunge (pulmonare invasive Aspergillose) und die Nasennebenhöhlen. Eine große Gefahr geht von den Orten aus, an denen Hyphenfragmente in die Blutbahn gelangen und systemisch mit dem Blutstrom verteilt werden (Filler and Sheppard 2006). Im weiteren Verlauf ist es möglich, dass andere Organe besiedelt werden, was die Heilchancen drastisch herabsetzt. Neben der gegebenenfalls vorhandenen Neutropenie wirkt sich natürlich jegliche andere Art der Immunsuppression positiv auf die Dissemination des Pilzes und somit negativ auf den Gesundheitsstatus des Patienten aus. Gravierende Auswirkungen kann auch eine systemische Kortikosteroidbehandlung haben, durch die unter anderem Makrophagen als zweiter wichtiger Teil der ersten Immunbarriere massiv geschwächt werden (Denning 1998; Arroyo et al. 2007). Durch diese generelle Art der Immunsuppression werden im Folgenden zusätzlich die Mechanismen der adaptiven Immunität auf vielfältige Weise herunterreguliert (Janeway, Travers, and Walport 2002). 42 Einleitung Risikogruppen für die Erkrankung an der invasiven Aspergillose stellen zum einen Patienten dar, die krankheitsbedingt an einer Schwächung des Immunsystems leiden. Hier sind insbesondere AIDS und CGD Patienten zu nennen. Zum anderen weisen Patienten ein gesteigertes Aspergilloserisiko auf, die aufgrund eines komplett anderen medizinischen Eingriffs passiv immunsupprimiert werden. Folgende Trends erklären die steigende Zahl an IA Fällen (Denning 1998): • der global anhaltende Vormarsch der Immunschwächekrankheit AIDS • die Entwicklung neuer, intensiver Chemotherapieverfahren bei verschiedenen Krebserkrankungen (Tumore, Lymphome, Myelome und resistente Leukämien) • die steigende Anzahl an Organtransplantationen, bei denen die Patienten zu Unterdrückung der Abstoßreaktion gegen das Implantat künstlich immunsupprimiert werden • der Vermehrte Einsatz von Immunsuppressionsverfahren bei Autoimmunerkrankungen. Durch den intensiven Einsatz neuer Antibiotika und die Verbesserung der stationären Behandlung können Bakterieninfektionen immer effizienter Behandelt werden, so dass insbesondere in Leukämieabteilungen und Knochenmarks- und Organtransplantationszentren die invasive Aspergillose eine der Haupttodesursachen darstellt und dementsprechend immer weiter in den Fokus des wissenschaftlichen Interesses rückt (Denning 1998). 1.3.4.2 Virulenzdeterminanten von A. fumigatus Opportunistische Krankheitserreger, zu denen auch Aspergillus fumigatus gehört sind dadurch gekennzeichnet, dass sie üblicherweise als harmlos einzustufen sind. Erst mit dem Auftreten einer gestörten Immunabwehr auf Wirtsseite sind sie in der Lage, ihr pathogenes Potential auszuschöpfen. Aus diesem Grund ist es schwierig diesem Organismus spezifische Pathogenitätsfaktoren zuzuordnen. Erst die Kombination aus vielen zellulären Faktoren, die das Wachstum des Mikroorganismus’ im Wirt begünstigen ermöglichen eine erfolgreiche Infektion. Diese Virulenzdeterminanten tragen zur pathogenen Besiedlung eines Wirts bei, sind einzeln betrachtet aber keinesfalls wirtsschädigende Pathogenitätsfaktoren. Derzeit sind diese Mechanismen, mit denen es Aspergillus fumigatus gelingt als gefährlicher 43 Einleitung Krankheitserreger zu agieren ein Schwerpunkt der Pilzforschung (Brakhage 2005; Tekaia and Latge 2005; Krappmann 2006). Durch die geringe Sporengröße können die Konidien von A. fumigatus sehr tief in das Lungengewebe vordringen, was ihm bereits einen beachtlichen Pathogenitätsvorteil verschafft. Die Konidien besitzen eine spezielle, hydrophobe Proteinhülle, die in der Lage ist an Laminin, Fibronectin, Kollagen Typ I und IV und Fibrinogen als Bestandteile der extrazellulären Matrix des bronchialen Bindegewebes zu adhärieren (Bouchara et al. 1999; Gil et al. 1996). Diese spezielle Eiweißhülle ist im weiteren Verlauf auch ein hervorragender Schutz gegen den Angriff von verschieden Zellen des Immunsystems, wie Makrophagen und neutrophile Granulozyten, was Phagozytoseassays mit Hydrophobin-Deletions-Mutanten belegen (Paris et al. 2003; Thau et al. 1994). Interessanterweise scheinen Mutanten, die in der Synthese ihrer eigentlichen Zellwand behindert sind, keine großen Einschränkungen in ihrer Pathogenität aufzuweisen. Dies zeigen z.B. Infektionsstudien mit Aspergillusstämmen, deren α- und β-Glukansynthese inhibiert ist (Beauvais et al. 2005). Nach der Adhäsion ist A. fumigatus in der Lage bei 37°C mit einer sehr hohen Verdopplungsrate zu wachsen, was ihn von den nicht pathogenen Aspergillus Arten deutlich abgrenzt, die meist ein Temperaturoptimum von 25-35°C aufweisen. In der Vergangenheit wurde viel Forschungsarbeit an unterschiedlichsten Signaltransduktionskaskaden geleistet, um an der Pathogenität beteiligte Signalwege aufzudecken. Durch den Einsatz von Enzym-Deletions-Mutanten wurden einige involvierte Transduktionswege ermittelt, wobei vielfach eine Einordnung der betroffenen Enzyme in die Gesamtzusammenhänge noch nicht möglich war. Beispiele für solche Enzymkaskaden sind die Stressantwort auf pH-Änderungen in der Umgebung (Bignell et al. 2005), die Regulation des polarisierten Hyphenwachstums während einer invasiven Infektion (Fortwendel et al. 2005) oder die cAMP-vermittelte Transduktionskaskade als Antwort auf das Vorhandensein eukaryotischer Abwehrzellen (Borges-Walmsley and Walmsley 2000; Brakhage and Liebmann 2005; Liebmann et al. 2003; Liebmann et al. 2004a; Liebmann et al. 2004b). Durch ebensolche Deletions-Experimente wurde herausgefunden, dass der Zitronensäurezyklus unabdingbar für die volle Virulenz von Aspergillus fumiga44 Einleitung tus ist (Maerker et al. 2005; Ibrahim-Granet et al. 2008) und dass das in vivo Wachstum von A. fumigatus einer strikten Kohlenstoffkatabolitrepression unterliegt, damit bevorzugte Kohlenstoffquellen mit dem höchsten Energieoutput am effizientesten genutzt werden können (Ruijter and Visser 1997). Gleiches gilt für den Stickstoffmetabolismus. Um die bestmögliche Nutzung vorhandener N2 Quellen am Infektionsort sicherzustellen existiert auch hier ein molekularer Mechanismus zur genregulierten Aufnahme und Verwertung des chemisch gebundenen Stickstoffs (Natarajan et al. 2001; Hensel et al. 1998; Krappmann and Braus 2005). Unabdingbar für mikrobielles Wachstum ist eine ausreichende Eisenversorgung. A. fumigatus hat ein komplexes Sytsem entwickelt, um diese Grundversorgung sicherzustellen und der Toxizität von Intermediaten vorzubeugen (Eisendle et al. 2003; Haas 2003; Haas et al. 2003; Oberegger et al. 2002). Einen gravierenden Einfluss auf die Pathogenität hat dabei das sidA-Gen der Siderophorbiosynthese, welches unabdingbar notwendig für die Ausbildung einer pulmonaren Aspergillose im Tiermodell ist (Schrettl et al. 2004). Um während der Besiedlung des Wirts eine ausreichende Versorgung mit Kohlenstoff und anderen Nährstoffen sicher zu stellen bedarf es des Metabolismus’ umgebender Gewebestrukturen. In erster Linie werden Makromoleküle des Bindegewebes, wie Elastin und Kollagen abgebaut. Um diese Eiweißstrukturen nutzen zu können sekretiert A. fumigatus eine Reihe an Proteasen an den sich entwickelnden Keimschläuchen und an den Spitzenregionen der apikal wachsenden Hyphe (Monod, Jaton-Ogay, and Reichard 1999; Monod et al. 2002). Zum Schutz vor phagozytierenden Immunzellen sekretiert der Pilz eine Reihe an Mykotoxinen, wie Gliotoxin, Fumagillin, Helvolinsäure, Fumitremorgin A und AspHämolysin (Kamei and Watanabe 2005). Den stärksten immunsuppressorischen Effekt hat dabei das Gliotoxin. Es inhibiert die NADPH-Oxidase und somit die Ausschüttung von reaktiven Sauerstoffspezies durch Abwehrzellen (Nishida et al. 2005) und es behindert den proinflammatorischen Zytokinausstoß durch Leukozyten (Watanabe et al. 2003; Wichmann, Herbarth, and Lehmann 2002) und die TZell vermittelte Zytotoxizität (Yamada, Kataoka, and Nagai 2000). Darüber hinaus 45 Einleitung wird beschrieben, dass Gliotoxin Makrophagen in den programmierten Zelltod (Apoptose) treiben kann (Suen et al. 2001). Um sich vor den von Phagozyten produzierten reaktiven Sauerstoffspezies zu schützen synthetisiert A. fumigatus zum einen verschiedenen Enzyme, wie Katalasen, Peroxidasen und Superoxiddismutasen und zum anderen schützt sich der Pilz über einen Glutathionstoffwechselweg vor dem Redoxangriff (Tekaia and Latge 2005). Zusammenfassend kann gesagt werden, dass bereits viele Hinweise auf Virulenzdeterminanten vorliegen, dass es aber oft durch Redundanz in fast allen beteiligten Systemen schwierig ist, konkrete Aussagen über zentrale Faktoren zu treffen, die die multifaktorielle Eigenschaft „Pathogenität“ im opportunistischen Organismus ausmachen. Trotz der Vielfältigkeit der bereits betrachteten Determinanten können diese in wenige Gruppen einsortiert werden (siehe Abb. 1.18). Ein Teil der Faktoren findet sich bei der Anpassung des Pilzes an die Wirtsumgebung wieder. Durch Modulierung von Signaltransduktionskaskaden und der daraus resultierenden Genregulation erlangt der Pilz klare Vorteile bei der Besiedlung des Organismus’. Durch unterschiedliche, primäre Stoffwechselwege wird das Wachstum von A. fumigatus sichergestellt und die Synthese verschiedener Sekundärmetabolite erlaubt eine gezielte Anpassung an wechselnde Umweltbedingungen. Ein zentraler Punkt bei der Infektion ist die effiziente Anpassung an Stresssituationen, wie Mangelbedingungen oder rasche Änderungen des Umgebungsmilieus, sowie die Erlangung von Resistenzmechanismen gegen Immunreaktionen. Eine Invasion und damit eine Ausbreitung des Pilzes im Körper stellt einen weiteren wichtigen Faktor im Überlebenskampf des opportunistischen Pathogens dar. 46 Einleitung Abb. 1.18: Begünstigende Faktoren bei der Ausbildung einer Aspergillose. Neben einer massiven Immunsuppression auf Wirtsseite begünstigen unterschiedliche Virulenzdeterminanten die erfolgreiche Besiedlung eines Organismus’ durch A. fumigatus. Diese Faktoren können in der Regel in die Bereiche Anpassung, Wachstum, Resistenz oder Invasion eingeordnet werden. Quelle: (Krappmann 2007) Vielleicht liegt es an der natürlichen Nische des Pilzes, dass er in der Evolution nicht „gezwungen“ wurde, hoch spezialisierte Pathogenitätsmechanismen zu entwickeln, sondern als Saprobiont generell schon mit einem sehr vielfältigen Metabolismus ausgestattet ist, der es ihm erlaubt an sehr unterschiedlichen Lebensräumen zu wachsen. Dieser Umstand könnte erklären, warum es sich in diesem Pilz so schwierig gestaltet, distinkte Pathogenitätsfaktoren zu ermitteln. Es wird noch sehr viel Forschung geleistet werden müssen, um das komplizierte Zusammenspiel vieler Faktoren in diesem Organismus zu verstehen und daraus resultierend Therapiemöglichkeiten abzuleiten. Durch den Einsatz neuster molekularbiologischer Techniken, wie Transkriptomanalysen ist diese Arbeit allerdings um ein vielfaches einfacher und teilweise überhaupt erst möglich geworden, so dass die Aufklärung vieler Zusammenhänge mit Spannung erwartet werden kann. 1.3.4.3 Immunantworten bei der Etablierung einer invasiven Aspergillose Im gesunden, immunkompetenten Menschen kommt es, abgesehen von Allergien, nur äußerst selten zu Komplikationen, die auf A. fumigatus zurückzuführen sind. 47 Einleitung Ein Großteil eingeatmeter Konidien wird vom Immunsystem unbemerkt über die „Mukus-Clearance“ aus dem Bronchialtrakt wieder herausbefördert. Konidien, die den Alveolarraum erreichen, treffen als zweite Abwehrlinie auf Phagozyten, wie Alveolarmakrophagen, neutrophile Granulozyten und DCs. Vermittelt über PRRs kommt es zur Phagozytose, wobei es zu einem MYD88- (myeloid differentiation primary response gene 88) vermittelten „Toll-like Rezeptorsignaling“ kommt (Romani 2004). Im Falle von A. fumigatus wird dieses in erster Linie durch die TLRs 2 und 4 ausgelöst, wobei Myzelstrukturen von TLR 4 und nicht von TLR2 erkannt werden können (Wang et al. 2001). In DCs ist der MYD88-abhängige Signalweg unabdingbar für die TH1-vermittelte, adaptive Immunität gegen den Pilz (Bellocchio et al. 2004), aber er wird im Gegensatz zu einer Candida albicansInfektion nicht für die Aktivierung der angeborene Immunität benötigt (Marr et al. 2003). Abb. 1.19: Übersicht über Toll-like Rezeptoren, die Pilzstrukturen erkennen. Nach der Bindung der PRRs an konservierte Oberflächenstrukturen wird ein MYD88 abhängiger Signaltransduktionsweg eingeleitet, der proinflammatorische Signale erzeugt. Quelle: (Romani 2004) Der Rezeptor Dectin-1 hingegen erkennt ebenfalls morphotypabhängig βGlukanstrukturen, hauptsächlich auf geschwollenen Konidien und Keimlingen, und leitet über die Sekretion von proinflammatorischen Zytokinen eine Rekrutierung und Aktivierung von Phagozyten, insbesondere Makrophagen, ein (Steele et al. 2005). In neutrophilen Granulozyten steuern Toll-like Rezeptoren die Ausschüttung von Produkten des „respiratory bursts“, also äußerst reaktiver Sauerstoffspezies (ROIs) und sind somit ein wichtiges Kontrollorgan bei der Eindämmung der Gewebeschäden, die mit der Degranulation von Neutrophilen immer einher48 Einleitung gehen (Bellocchio et al. 2004). Diese ROIs werden von Phagozyten synthetisiert und wirken entweder intra- oder extrazellulär durch die Veränderung von PilzProteinen, durch DNA-Schädigungen oder durch Schädigung der Zellwand (Mansour and Levitz 2002). Eine sehr wichtige Rolle bei der Eindämmung einer Aspergillus-Infektion kommt sowohl dem Komplementsystem, als auch der opsoninvermittelten Phagozytose zu, wie z.B. Knockoutversuche mit dem Kollektin Pentraxin 3 (löslicher PRR; dient der Opsonisierung) zeigen. Entsprechende Knockoutmäuse sind um ein vielfaches anfälliger als WT Tiere, in denen die opsoninvermittelte Aktivierung einer Phagozytose nicht gestört ist (Garlanda et al. 2002; Jaillon et al. 2007). Antikörper verschiedener Isotypen übernehmen bei der Bekämpfung einer Pilzinfektion unterschiedliche, direkt und indirekt schützende Aufgaben. Sie verhindern die Adhärenz von Pilzen an Oberflächen, sie neutralisieren Toxine, sie opsonisieren und sie leiten eine antikörpervermittelte Zytotoxizität ein, was eindeutig durch erhöhte AKTiter während einer Infektion zu belegen ist (Casadevall, Feldmesser, and Pirofski 2002; Gross et al. 2006). In der Literatur wurde mehrfach die extrem wichtige Rolle von T-Zellen bei der Bekämpfung einer Pilzinfektion hervorgehoben (Hage, Goldman, and Wheat 2002; Fleming, Walsh, and Anaissie 2002; Clark and Hajjeh 2002), wodurch klar gezeigt wird, dass nicht nur die Mechanismen der angeborenen Immunität an der Bekämpfung einer Aspergillus-Infektion beteiligt sind. Insbesondere die IL-12 vermittelte TH1-Antwort ist notwendig für den Schutz gegen eine Aspergillus-Infektion (Romani, Puccetti, and Bistoni 1997). Der Grund hierfür liegt wohl in der Sekretion verschiedener Zytokine, die wiederum die Antikörperproduktion in die Wege leiten und als Stimulus für Phagozyten dienen. Neben den sekretorischen Fähigkeiten der TH1 Zellen sind für T-Zellen noch folgende Mechanismen der Pilzabwehr beschrieben: Sie weisen eine direkte antifungale Aktivität auf (Levitz, Mathews, and Murphy 1995), CD8+ Zellen synthetisieren antimikrobielle Peptide (Ma et al. 2002) und Wirtszellen, die überdauernde Pilze enthalten, werden abgetötet (Huffnagle, Yates, and Lipscomb 1991). Regulatorische T-Zellen hingegen scheinen einer wichtigen Aufgabe bei der Kontrolle der Immunantwort gegen einen Pilz nachzukommen. So wird beispielsweise in Infektionsversuchen durch den adoptiven Transfer von CD4+CD25+TReg verhindert, dass eine normalerweise gut zu bekämpfende Candida-Infektion vollstän49 Einleitung dig beseitigt wird (Romani, Bistoni, and Puccetti 2002). Die von ihnen ausgeschütteten Faktoren IL-10 und TGF-β wirken dabei entzündungsregulierend. Abb. 1.20: Überblick über die Teile des Immunsystems, die bei einer Pilzinfektion eine Rolle spielen. Nachdem die mechanischen Barrieren überwunden sind kommt greifen sowohl Teile der angeborenen, als auch der adaptiven Immunität in die Abwehr ein. Eine wichtige Feststellung ist, dass beide Arme des Immunsystems zytokingesteuert ineinander greifen, um eine möglichst effiziente Eliminierung des Pilzes zu bewerkstelligen. Quelle: (Romani 2004) 1.3.4.4 Therapiemöglichkeiten einer invasiven Aspergillose Die Standardtherapie einer IA beruht auf dem Einsatz diverser Antimykotika, wobei die Substanzen Amphotericin B (Brajtburg and Bolard 1996) und Itrakonazol, sowie die neueren Präparate Vorikonazol und Caspofungin die bedeutendsten Wirkstoffe darstellen. Unterteilt werden die Antimykotika in folgende Stoffklassen: 50 Einleitung • Polyene (konventionelles und lipid-assoziiertes Amphotericin B) Sie werden auch als „Porenbildner“ bezeichnet. Ihr amphiphiler Charakter erlaubt die Wechselwirkung mit Ergosterin, welches ausschließlich in der Zellwand von Pilzen vorkommt. Dadurch ändern sich die Permeabilitätseigenschaften der Membran, was fungiziden Eigenschaften erklärt. Quelle: [Internet 1020] • Azole (Itrakonazol, Vorikonazol, Flukonazol) Imidazol- und Triazolderivate hemmen die 14-alpha-Demethylase des Cytochrom P450Systems der Pilzzelle. Dadurch wird die Umwandlung von Lanosterol zu Ergosterol unterbrochen, was zu Membrandefekten der Pilzzelle führt. Die menschliche Demethylase wird durch Fluconazol deutlich schwächer gehemmt. Quelle: [Internet 1019] • Allylamine (Terbinafin) Sie hemmen das Enzym Squalenepoxidase, ebenfalls aus dem Ergosterolbiosyntheseweg. Dadurch wird der Aufbau der Pilz-Zellwand behindert. Außerdem reichert sich ein nicht weiter umgebauter Ausgangsstoff, das Squalen, in der Pilzzelle an, der auf die Zelle zytotoxisch wirkt. Quelle: [Internet 1021] • Morpholine (Fluorzytosin) Sie sind Nukleosid-Analogons. Fluorzytosin wird zunächst durch eine Cytosin-Deaminase in 5-Fluorouracil (= 5-FU), einen Antimetaboliten mit zytostatischer Wirkung, umgewandelt, bevor intrazellulär eine fungizide Wirkung ausgeübt werden kann. Die erforderliche Deaminase ist nur in Pilzzellen aber nicht in menschlichen Zellen vorhanden. [Internet 1022] • Kandine (Kaspofungin). Kandine hemmen die Synthese des ß-(1,3)-D-Glukans in der Zellmembran einiger pathogener Pilzspezies, so dass sein Einbau in die Zellwand nicht erfolgen kann. [Internet 1023] Amphotericin B (AmB) bindet an die Ergosterole der Pilzmembran und stört dadurch die Membranfunktion (Ramos et al. 1989; Bolard 1986). Gleichzeitig bindet es aber auch an die Sterole humaner Zellmembranen und führt dadurch zu einer starken Nephrotoxizität (Brajtburg and Bolard 1996). Liposomales AmB, welches entwickelt wurde, um durch verbesserte Aufnahme des Wirkstoffs die therapeutische Wirkung zu erhöhen, zeigt ein deutlich günstigeres Nebenwirkungsprofil (Ringden et al. 1994), allerdings ist der therapeutische, gegen die IA gerichtete Nutzen fraglich (Coukell and Brogden 1998). Obwohl AmB bis heute als „Goldstandard“ in der IA Therapie bezeichnet wird liegt die Erfolgsrate nur bei etwa 34% (Denning 1998), was deutlich anzeigt, wie dramatisch die klinische Situation ist. 51 Einleitung Der Wirkstoff Itrakonazol, ist ein Breitband-Antimykotikum und hemmt die Ergosterolsynthese durch Blockierung des pilzlichen Cytochroms P-450 (Grant and Clissold 1989), wohingegen es kaum Auswirkungen auf das humane P-450 hat. Probleme mit diesem Antimykotikum ergeben sich aus der Tatsache, dass es von diesem Medikament keine injizierbare Form gibt. Es existieren lediglich orale Applikationsformen, wobei diese nur schwer resorbierbar sind. Kombiniert mit einer hohen Wechselwirkungsrate mit anderen Medikamenten scheidet die Itrakonazoltherapie häufig aus (Denning 1996; Denning et al. 1994). Zusätzlich wurden auch die ersten resistenten Aspergillusstämme beobachtet (Chryssanthou 1997). Die neueren Wirkstoffe Vorikonazol und das Caspofungin bieten eine bessere Verträglichkeit und zeigten in klinischen Studien eine höhere Wirksamkeit gegenüber dem Pilz. Vorikonazol greift ebenfalls in die Ergosterolsynthese ein. Caspofungin zählt zu den Echinocandinen und hemmt die (1-3)-β-D-Glukan-Synthase. (1-3)-βD-Glukan ist ein essentieller Bestandteil der Zellwand von Pilzen (Petrikkos and Skiada 2007). Zusammenfassend ist bzgl. der antimykotischen Therapie zu sagen, dass noch viel Bedarf an Verbesserung besteht. Die derzeit auf dem Markt befindlichen Stoffe weisen nur eine eingeschränkte Wirksamkeit, gepaart mit starken Neben- und Wechselwirkungen auf. Zusätzlich wird ihr Einsatz durch immer neu auftretende Resistenzen gestört (Kontoyiannis and Lewis 2002; Perea et al. 2001). Anders als bei Bakterien können die antimykotischen Resistenzen nicht durch horizontalen Gentransfer weitergegeben werden, allerdings sind viele humanpathogene Pilze intrinsisch resistent gegen eine Reihe von Antimykotika. Erworbene Resistenzen beruhen meist auf einer durch Mutation veränderten Strukturerkennung von Enzymen, wie der Deaminase, die dadurch das Antimykotikum nicht mehr in seine aktive Form umwandeln kann (Internet 1024). Ein operativer Eingriff zur Entfernung invasiven Pilzwachstums im Bronchialtrakt oder der Nasenhöhlen ist sinnvoll, wenn das Myzel lokal gut erkennbar ist, bzw. wenn Lungenblutungen auftreten und dabei große Blutgefäße betroffen sind, bzw. Hauptatemwege in Mitleidenschaft geraten. Ein wichtiger Punkt für den operativen Eingriff ist die Neutropenie. Stark neutropenische Patienten sollten keiner operativen Entfernung der Pilzmasse unterzogen werden, da hier das Risiko einer systemischen Dissemination zu groß ist (McWhinney et al. 1993; Caillot et al. 1997; 52 Einleitung Denning and Stevens 1990; Robinson et al. 1995; Kennedy et al. 1997). Eine invasive Aspergillose geht meistens mit einer Neutropenie einher. Durch starke Immunsuppresiva sind große Teile des Immunsystems nicht mehr vorhanden, so dass der Pilz bei Wachstum und Verbreitung keine große Gegenwehr erfährt. Ein sehr viel versprechender Ansatz ist die Rekonstitution des Patienten mit wichtigen Teilen der Immunität und die Aktivierung vorhandener Mechanismen. Eine Behandlung mit G-CSF (granulocyte-colony-stimulating factor) und GM-CSF (granulocyte-macrophage colony-stimulating factor) würde zu einer Rekrutierung von Neutrophilen und Monozyten aus dem Knochenmark führen (sofern vorhanden) und IFN-γ erhöht die Phagozytoseaktivität und Eliminierungseffizienz von Phagozyten. Wie effektiv diese Zytokinbehandlungen sind müssen klinische Studien allerdings erst belegen (Roilides et al. 1994; Roilides et al. 1993; Roilides et al. 1996; Rex et al. 1991). Die Möglichkeit einer Vakzinierung ist bisher nicht gegeben, allerdings gibt es viel versprechende Ansätze, wie Teile dieser Arbeit, aber auch Ergebnisse anderer Forschergruppen zeigen (Torosantucci et al. 2005; Cassone and Torosantucci 2006). 53 Einleitung 1.4 Problemstellung und Zielsetzung Betrachtet man die Fachliteratur der letzten Jahre, so fällt auf, dass mykologische Infektion immer weiter in den Mittelpunkt des klinischen Interesses rücken. Ausgelöst durch eine stetig steigende Zahl an fatalen Mykosen im klinischen Alltag und der Tatsache, dass bestehende Therapien extrem kostspielig sind kommt es zu einer verstärkten Förderung der mykologischen Infektionsforschung. Das Basiswissen zu den Pathogenstrategien bei einer Pilzinfektion und den beteiligten Abwehrmechanismen auf Wirtsseite ist dabei aber noch sehr lückenhaft. Hier versucht diese Arbeit anzusetzen: Sie beschäftigt sich mit Untersuchungen zu immunologischen Abwehreaktionen gegen eine invasive Aspergillose, wobei das Hauptaugenmerk auf die beteiligte adaptive Immunantwort gelegt wird. Es soll verstanden werden mit welcher Kinetik es zu einer Bekämpfung der Pilzinfektion nach Inhalation der Verbreitungsstadien (Sporen/Koniden) kommt und welche Zelltypen des adaptiven Immunsystems daran beteiligt sind. Um diesen Fragen nachzugehen soll ein transgener Aspergillus fumigatus erzeugt werden, der als Fusionskonstrukt neben einem gelben Fluoreszenzprotein (Citrin/EYFP) das Modellantigen Ovalbumin (Hühnereiweiß) synthetisiert. Das Citrin soll der (intravitalen) Mikroskopie dienen und die Visualisierung des Pilzes in infizierten Mauslinien ermöglichen. Durch den adoptiven Transfer gefärbter Immunzellen können so ZellZellinteraktionen untersucht und analysiert werden und durch Ausnutzung mikroskopischer Techniken wird erhofft, die Adhärenz und Penetration lebenden Gewebes durch den Pilz darstellen zu können. In Kombination mit T-Zellrezeptor transgenen Mauslinien, die präsentierte Peptide des Ovalbumins nach dessen Prozessierung in APCs erkennen, ist es möglich kinetische Untersuchungen der TZellaktivierung in lymphatischem Gewebe durchzuführen. Hierbei wird die Frage gestellt, in welchen Lymphknoten es nach Infektion mit A. fumigatus in welchem zeitlichen Verlauf zu Immunreaktionen kommt und ob diese zur Aktivierung einer CD4 oder CD8 Antwort führen. Eine weiterführende Frage dieser Arbeit befasst sich mit der Möglichkeit der passiven oder aktiven Immunisierung als Schutz vor einer Aspergillus-Infektion in Patienten, die absehbar in eine neutropenische Situation geraten werden. In einer Kooperation mit der Technischen Universität Braunschweig (AG Dübel) sollen re54 Einleitung kombinant hergestellte Aspergillus Antigene auf ihre Fähigkeit getestet werden einen Impfschutz hervorzurufen und ebenfalls rekombinant hergestellte Antikörper gegen diese Proteinstrukturen werden eingesetzt, um die Möglichkeit einer passiven Immunisierung zu verifizieren. 55 Material und Methoden 2 Material und Methoden 2.1 Material: allgemein 2.1.1 Verbrausmaterial Verbrauchsmaterial in der Zellkultur wurde, soweit nicht anders angegeben, von Assistent, B. Braun, Becton Dickinson, Eppendorf, Falcon BD, Nunc, Sarstedt, Schott oder Terumo bezogen. Tab. 2.1: In dieser Arbeit verwendete Verbrauchmaterialien mit Herstellerangaben. Material Hersteller Best. Nr. − 96-Well-Rundbodenplatte „Nunclon Nunc 163320 − Drigalski Spatel, einweg, steril verpackt VWR 391-3018 − FACS-Röhrchen 5 ml Falcon BD (Heidelberg) 340334 − Feindosierungsspritzen, einweg, 1 ml Braun (Melsungen) 9151133 − Kanülen: 20Gx11/2“;21Gx2“; 23Gx11/4“; Becton Dickinson Δ Surface“ -- 26Gx23 − Kunststoffröhrchen, konisch mit Schraubde- Falcon BD 352095 Falcon BD 352070 ckel, 15 ml − Kunststoffröhrchen, konisch mit Schraubdeckel, 50 ml, − Mörser und Pistill, 10 cm Durchmesser Schmidt (Braunschweig) L553 (Mörser) E1144 (Pistill) − Petrischalen (∅ 100 mm) Corning (New York, USA) − Pipetten, serologisch, 5 ml Sarstedt (Nümbrecht, Deutschland) 56 3262 86.1253.001 Material und Methoden Tab. 2.1: In dieser Arbeit verwendete Verbrauchmaterialien mit Herstellerangaben. Material Hersteller Best. Nr. − Pipetten, serologisch, 10 ml Sarstedt 86.1254.001 − Pipetten, serologisch, 25 ml Sarstedt 86.1685.001 − Reaktionsgefäß, 0,5 ml, 1,5 ml, 2 ml Eppendorf GmbH -- (Wesseling-Berzdorf) − Spritzen (Luer-Lock), 1 ml; 2 ml; 5 ml; 10 ml; Becton Dickinson -- (Heidelberg) 50 ml − Venenverweilkanüle, 22G (0,9x25 mm) Braun − Zählkammer nach Neubauer Zeiss (Jena) 717805 − Zellsiebe, 100 μm Porendurchmesser Falcon BD 352360 4268091B 2.1.2 Geräte Tab. 2.2: In dieser Arbeit verwendete Geräte mit Herstellerangaben. Gerät Typ Firma − Beatmungsgerät für Kleinsäuger Mini Vent Hugo Sachs (MarchHugstetten, Deutschland) (Inhalationsnarkose) − Durchflusszytometer FACSCalibur BD Biosciences − Feldemissions- Gemini DSM982 Zeiss − Photometer SmartSpec Plus BioRad − SDS PAGE Apparatur Mini-PROTEAN 3 Cell BioRad − Thermocycler Thermocycler T3 Biometra − Thermogradientencycler Thermocycler T-Gradient Biometra − Werkbank KS 18 / PE AC Heraeus Rasterelektronenmikroskop 57 Material und Methoden Tab. 2.2: In dieser Arbeit verwendete Geräte mit Herstellerangaben. Gerät Typ Firma − Westernblot Apparatur Mini Trans-Blot Electro- BioRad phoretic Transfer Cell − Zentrifuge für Kunststoffröhrchen Megafuge 3.0R Heraeus (Hanau, Deutschland) (15 und 50 ml) − Zellkultur-Mikroskop ICM 405 Zeiss (Jena, Deutschland) 2.1.3 Aspergillus fumigatus Stämme Tab. 2.3: Übersicht über die, in dieser Arbeit verwendeten Pilzstämme. Stamm Genotyp Referenz − CEA17 pyrG (d'Enfert 1996) − D1.41 Wildtypstamm (Staib et al. 1980) − D1.41ΔOvaCit ΔOvalbumin, Citrin, gpda, His2at, ampR, ptrA diese Arbeit − D1.41CitΔOva ΔOvalbumin, Citrin, gpda, His2at, ampR, ptrA diese Arbeit − iclp-Red pyrG1, iclp-DsRed2, PyrG+ (Behnsen et al. 2007) 2.1.4 Versuchstiere Die verwendeten Mäuse wurden unter tierärztlicher Aufsicht im Tierhaus des Helmholtz-Zentrums für Infektionsforschung unter SPF-Bedingungen gehalten. Soweit nicht anders erwähnt, wurden Tiere verwendet, die zwischen 8 und 16 Wochen alt waren. Ankaufmäuse (Balb/c- und C57BL/6-Hintergrund) wurden von der Harlan-Winkelmann GmbH (Borchen, Deutschland) bezogen. Die T-Zellrezeptor transgenen Mauslinien DO11.10 (Murphy, Heimberger, and Loh 1990), OT-I (Hogquist, Jameson, and Bevan 1995) und OT-II (Barnden et al. 1998) wurden im Tierhaus des Helmholtz-Zentrums gezüchtet. CD4+ T-Zellen der transgenen Mauslinien DO11.10 und OT-II erkennen spezifisch das Epitop der Ovalbumin-Aminosäuren 323-339 bei Präsentation durch MHC-II58 Material und Methoden IAd-Moleküle (Balb/c-Hintergrund bei DO11.10) bzw. durch MHC-II-IAb-Moleküle (C57BL/6-Hintergrund bei OT-II) (Robertson, Jensen, and Evavold 2000). Die Mauslinie OT-I hingegen ist eine CD8+ T-Zell transgene Linie, bei der der CD8+ TZellrezeptor das Peptid SIINFEKL (Aminosäuren 257-264 aus Ovalbumin) bei Präsentation durch MHC-I-Kb erkennt (Sterry et al. 1995). Balb/c- und C57BL/6-Mäuse wurden zur Isolation von antigenpräsentierenden, dendritischen Zellen (DC) verwendet, die T-Zellrezeptor transgenen Mauslinien für die Isolation von T-Zellen. 2.1.5 Chemikalien und Puffer Die verwendeten Chemikalien und Zusätze waren von p.A.-Qualität oder „extrarein“. Sie wurden von Becton Dickinson, Calbiochem, Cytogen, Fluka, Gibco, Invitrogen, Miltenyi Biotech, Molecular Probes, PAA, Roth oder Sigma bezogen und werden bis auf ein paar spezielle Ausnahmen nicht einzeln aufgelistet. Tab. 2.4: Übersicht, über allgemeine Reagenzien und Chemikalien, die in dieser Arbeit eingesetzt wurden Bezeichnung Hersteller − β-Mercaptoethanol Gibco (Langley, USA) − Carboxy Fluoroscein Succi- Molecular Probes (deutscher Vertrieb über nimidyl Ester-Farbstoff Bestell-Nr. 31350-010 C-1157 Invitrogen, Karlsruhe) − Fötales Kälberserum (FCS) Gibco 40F8123K − Gentamycin Gibco 15750-037 − L-Glutamin Sigma-Aldrich (München, Deutschland) − GM-CSF gewonnen aus dem Kulturüberstand spezifischer murines GM-CSF produzierender Zell-Linien aus dem Labor von Thomas Blankenstein, MDC, Berlin. − HEPES Gibco G1250 -- 15630-106 59 Material und Methoden Tab. 2.4: Übersicht, über allgemeine Reagenzien und Chemikalien, die in dieser Arbeit eingesetzt wurden Bezeichnung Hersteller Bestell-Nr. − IL-4 gewonnen aus dem Kulturüberstand spezifischer murines IL-4 produzierender Zell-Linien aus dem Labor von Thomas Blankenstein, MDC, Berlin. − Isofluran Delta Select (Dreieich, Deutschland) 9611506 − Ketamin 50 mg/ml Inresa (Freiburg) 7714091 − Natrium-Pyruvat PAA S11-003 − NEAA (Non Essential Amino Sigma-Aldrich -- M7145 Acids) − Penicillin / Streptomycin Gibco − Pyrithiamin TaKaRa Bio Inc. (Japan) − Rompun 2% Bayer − RPMI 1640 Biochrom F1215 − Trypanblau Lösung (0,4%) Sigma-Aldrich T8154 15070-063 9001 -- Puffer und Lösungen wurden, soweit nicht anders angegeben, in deionisiertem Wasser angesetzt, welches über das Milli-Q-System (Millipore, Schmalbach, Deutschland) aufgereinigt wurde und bei Einsatz in der Zellkultur oder in den mikrobiologischen Methoden bei 121°C für 20 min autoklaviert. Mehrfach konzentrierte Stammlösungen wurden vor Gebrauch bis zur 1x-Konzentration mit deion. Wasser verdünnt. 60 Material und Methoden FCS.…………………………………... Das verwendete FCS wurde 30 min bei 56° C Hitzeinaktiviert Ketamin-Rompun (Mausnarkose).… 8,5 ml NaCl [0,9%] 1 ml Ketamin 0,5 ml Rompun PBS.…………………………………... 80,0 g NaCl 2,0 g KCl 14,3 g Na2HPO4 + 2 H2O 2,0 g K2HPO4 mit H2O. deion. auf 1000 ml auffüllen, pH 7,4 einstellen PBS + 1% FCS.……………………… 1000 ml PBS (1x), pH 7,4 10 ml FCS 2.1.6 Mikrobiologische Nährmedien • Aspergillus Minimalmedium (AMM) 20 ml wässrige Glukoselösung [50%] 20 ml 50x AMM Stock 2 ml wässrige MgSO4-Lösung [1 M] 1 ml Hutners Spurenelementlösung mit 957 ml sterilem H2O deion. auf 1000 ml auffüllen – für Festmedium 30 g BactoAgar zufügen und autoklavieren o 50x AMM Stock……………….…... 297,47g NaNO3 26,1 g KCl 74,85 g KH2PO4 auf 1000 ml mit deion. H2O auffüllen, dabei mit 10 M KOH auf pH 5,5 einstellen und im Anschluss autoklavieren 61 Material und Methoden o Hutners Spurenelementlösung − vereinen der Lösungen HSL 1 und HSL 3 − einstellen auf pH 6,5 (zunächst mit KOH Pellets, anschließend mit KOH Lsg.) − auffüllen auf 200 ml mit H2O deion. Æ es sollte eine hellgrüne Lösung entstehen, die sich bei Lagerung lila verfärbt − sterilfiltrieren und dabei aliquotieren in 50 ml Kunststoffröhrchen mit Schraubdeckel (4 x 45 ml, Rest verwerfen) − Lagerung bei 4-8°C HSL 1……………………..…………. 1 g FeSO4·7H2O 10 g EDTA nacheinander in 80 ml H2O deion. lösen und den pH-Wert mit KOH Pellets auf 5,5 einstellen, wobei eine goldgelbe Lösung entsteht HSL 2………………….……………. 0,22 g (NH4)6Mo7O24·4H2O in 5 ml deion. H2O lösen HSL 3………………….……………. 2,75 g ZnSO4·1H2O 2,2 g H3BO3 1 g MnCl2·4H2O 0,32 g CoCl2·6H2O 0,32 g CuSO4·5H2O 5 ml HSL 2 nacheinander in 75 ml H2O deion. lösen Luria-Bertani-Vollmedium 10 g Trypton 5 g Hefeextrakt 10 g NaCl auf 1000 ml mit H2O deion. auffüllen und autoklavieren - für Festmedium 15 g Bacto-Agar vor dem Autoklavieren zufügen 62 Material und Methoden 2.1.7 Zellkultur Nährmedien Zellkultur-Medien wurden in 500 ml RPMI 1640 angesetzt und anschließend sterilfiltriert (Bottle-Top-System, Nalgene, Belgien). Komplettmedium…………………….. 50 μM β-Mercaptoethanol 10% FCS 10 mM HEPES 2 mM L-Glutamin 1 mM Natrium-Pyruvat 1 x NEAA 100 U/ml Penicillin / Streptomycin BMDC-Medium…………..………….. 50 μM β-Mercaptoethanol 5 % FCS 50 μg/ml Gentamycin 2 mM L-Glutamin 1 x NEAA 250 ng GM-CSF 25 ng IL-4 63 Material und Methoden 2.2 Material: Molekularbiologische Methoden 2.2.1 E. coli Stämme Tab. 2.5: Übersicht über die, in dieser Arbeit verwendeten E. coli Stämme. Stamm Genotyp Referenz − BL21(DE3) E. coli B F– dcm ompT hsdS(rB– mB–) gal λ(DE3) (Weiner et al. 1994) − DH5α F-, ϕ80dlacZΔM15, Δ(lacZYA-argF), U169, deoR, re- (Woodcock et al. 1989) - + cA1, endA1, hsd17, (rK , mK ), supE44, λ-, thi-1, gyrA96, relA1 − TG1 F` traD36 lacIq Δ(lacZ)M15 proA+B+/supE Δ(hsdS- Stratagene, Heildelberg mrcB)5 (rk-mk+McrB-) thi Δ (lacproAB) − TOP10 F- mcrA Δ(mrr-hsdRMS-mcrBC) Φ80lacZΔM15 Invitrogen, Karlsruhe ΔlacΧ74 recA1 araD139 Δ(araleu) 7697 galU galK rpsL (StrR) endA1 nupG 2.2.2 Plasmide Tab. 2.6: Übersicht über die, in dieser Arbeit verwendeten Plasmide. Name Merkmale Referenz − pCGA15 lacZ, AmpR, Ova HZI, Braunschweig − pCR®2.1-TOPO® lacZ, AmpR, KanR Invitrogen, Karlsruhe − pET-21b(+) AmpR, lacI Novagen, Darmstadt − pET-ovacit1 ΔOvalbumin, Citrin, AmpR, lacI diese Arbeit − pSK269 MH Hannover, Philipp Schmalhorst − pSK379 t R gpda, His2a , amp , ptr A Universität Göttingen, Sven Krappmann − pSK379ΔOvaCit t ΔOvalbumin, Citrin, gpda, His2a , amp , ptr − pSK-ovacit1 − pSTAT2-EYFP 64 R A diese Arbeit HZI, Braunschweig AmpR, Citrin HZI, Braunschweig Material und Methoden 2.2.3 Oligonukleotide MH3 30 bp • • • MH4 MH7 MH9 MH10 MH11 MH12 5’-ATATGGATCCGAGCAGCTTGAGAGTATAATC-3’ sense Ovalbumin trunkiert ohne Start Codon inkl BamHI Schnittstelle 33 bp • • • 5’-TAATGGATCCTACCACCTCTCTGCCTGCTT-3’ reverse Ovalbumin trunkiert ohne Stop Codon inkl BamHI Schnittstelle 31 bp • • • 5’-AGGCCATATGGAGCAGCTTGAGAGTATAAT-3’ sense Ovalbumin trunkiert inkl. Start Codon inkl NdeI Schnittstelle 30 bp • • • 5’-ATTAGGATCCCTTGTACAGCTCGTCCATGCCGA-3’ reverse Citrin inkl. Stop Codon inkl BamHI Schnittstelle 30 bp • • • 5’-ATCTCATATGGTGAGCAAGGGCGAGGAGCTGTT-3’ sense Citrin inkl. Start Codon inkl NdeI Schnittstelle 33 bp • • • 5’-CCGCGAATTCTTACTTGTACAGCTCGTCCA-3’ reverse Citrin inkl. Stop Codon inkl EcoRI Schnittstelle 33 bp • • • MH8 sense Citrin ohne Start Codon inkl BamHI Schnittstelle 30 bp • • • 5’-ATATGGATCCGTGAGCAAGGGCGAGGAGCT-3’ 5’-TATCGAATTCTTACCCTACCACCTCTCTGCCTG-3’ reverse Ovalbumin trunkiert inkl. Stop Codon inkl EcoRI Schnittstelle 65 Material und Methoden 2.2.4 Material, Reagenzien und Enzyme Tab. 2.7: Übersicht über spezielles, molekularbiologisches Material, Reagenzien und Enzyme, die in dieser Arbeit verwendet wurden. Bezeichnung Hersteller Bestell-Nr. − Acrylamid / Bis Roth 3029.1 − APS Roth 9178.1 − Chemilumineszenz-Substrat „Lumilight“ Roche − Glucanex 200G Novozymes L1412 − GoTaq® DNA Polymerase Promega M3175 − Lysozym Serva 28262 − Magermilchpulver Saliter -- − Miracloth Calbiochem 475855 − Nylonmembran für Southernblot, „Biodyne B Pall GmbH, Dreieich 60251 − Pfu DNA Polymerase Promega M7745 − Phenol/Chloroform Carl Roth A156.2 − Phusion™ High-Fidelity DNA Polymerase New England Biolabs F-530L 12 015 196 001 Transfer Membrane“, (NEB) − Proteinquantifizierungs-Kit „Quick Start Bradford Bio-Rad 500-0202 − PVDF Membran für Westernblot „Immobilon-P“ Millipore IPVH00010 − Restriktionsenzyme MBI Fermentas, Protein Assay Kit“ -- St.Leon-Rot − Seesand Sigma Aldrich − synthetische Oligonukleotide BioSpring GmbH, Frank- 28-0410 -- furt/Main − T4 DNA Ligase 66 Promega M1804 Material und Methoden Tab. 2.7: Übersicht über spezielles, molekularbiologisches Material, Reagenzien und Enzyme, die in dieser Arbeit verwendet wurden. Bezeichnung Hersteller − TEMED Roth − TiterMax CytRX (US) Bestell-Nr. 2367.3 R-10 2.2.5 Antikörper für Westernblot Analysen Tab. 2.8: Übersicht über die, in dieser Arbeit verwendeten Western Blot Antikörper. Antigen − Kaninchen IgG und Isotyp Hersteller Label Verdünnung Ziege Dianova Peroxidase 1:4000 -- 1:4000 -- 1:4000 # 111-035-045 IgM − Ovalbumin, polyklonal IgG Kaninchen abcam, US # ab1221 − Ovalbumin, polyklonal IgG Kaninchen US Biological # O8075-10 2.2.6 Medien, Lösungen und Puffer 2.2.6.1 Gentechnische Arbeiten DNA Auftragspuffer [5x]…………….. 0,5 ml Ficoll [30%] 0,2 ml EDTA pH8 [250 mM] 25 µl SDS [20%] 20 µl Tris-Acetat [50x] pH 7,5 90 µl Xylenblau [0,5%] 90 µl Bromphenolblau [0,5%] mit deion. H2O auf 1 ml auffüllen 67 Material und Methoden Tris-Acetat [50x] pH 7,5…………….. 242 g Tris Base 82 g Na-Acetat 18,6 g EDTA in etwas deion. H2O lösen, mit ca. 57,1 ml Eisessig auf pH 7,5 einstellen und mit deion. H2O auf 1000 ml auffüllen TAE Puffer [50x]…………………….. 242 g Tris-Base 57,1 ml Eisessig 100 ml EDTA [0.5 M] pH 8,0 mit deion. H2O auf 1000 ml auffüllen SOB Medium………………………… 20 g Bacto-Trypton 5 g Hefeextrakt 0,584 g NaCl 0,186 g KCl mit deion. H2O auf 1000 ml auffüllen, zuvor den pH Wert mit NaOH auf 7,0 einstellen und im Anschluss autoklavieren Mg ++ Stock………………………… 20,33 g MgCl2·6H2O 24,65 g MgSO4·7H2O mit deion. H2O auf 100 ml auffüllen und im Anschluss autoklavieren SOC Medium………………………… 98 ml SOB Medium, steril 1 ml Mg ++ Stock, steril 1 ml Glukoselösung [2 M], steril 68 Material und Methoden Citrat Puffer………………………….. 22,36 g KCl 67,78 g NaCl 29,4 g tri-Natriumcitrat·2H2O mit 2M Zitronensäure auf pH 5,5 einstellen und auf 2000 ml mit deion. H2O auffüllen Glucanase/Lysozym-Lösung……… 150 mg Glucanex 200G 150 mg Lysozym auf 10 ml mit Citrat-Puffer auffüllen und nach vollständigem Lösen sterilfiltrieren STC1700…….……………………….. 218 g Sorbitol 10 ml TRIS [1 M] pH 5,5 5,55 g CaCl2·2H2O mit deion. H2O auf 1000 ml auffüllen PEG4000….……………………….. 1 ml TRIS [1 M] pH 7,5 0,74 g CaCl2·2H2O 60 g PEG4000 mit deion. H2O auf 100 ml auffüllen Protoplastenmedium……………….. 10 ml wässrige Glukoselösung [50%] 10 ml 50x AMM Stock (siehe 2.1.6) 1 ml wässrige MgSO4-Lösung [1 M] 0,5 ml Hutners Spurenelementlösung 109 g Sorbitol 10 g Agar mit deion. H2O auf 500 ml auffüllen, autoklavieren und vor dem Gießen von Agarplatten ggf. Pyrithiamin ([100 ng/ml] Endkonzentration) zugeben 69 Material und Methoden Top Agar……………….…………….. 10 ml wässrige Glukoselösung [50%] 10 ml 50x AMM Stock (siehe 2.1.6) 1 ml wässrige MgSO4-Lösung [1 M] 0,5 ml Hutners Spurenelementlösung 109 g Sorbitol 3,5 g Agar mit deion. H2O auf 500 ml auffüllen und autoklavieren Aspergillus-Lysis-Puffer…………….. 5 ml Tris-HCl [1 M] pH 7,2 1,46 g EDTA 3 g SDS 1 ml β-Mercaptoethanol (konz.) mit deion. H2O auf 100 ml auffüllen 2.2.6.2 Southernblot Church-Buffer………………………... 70 g SDS 10 g BSA 0,29 g EDTA 40,99 g Na-Phosphat mit deion. H2O auf 100 ml auffüllen 70 Material und Methoden 2.2.6.3 Westernblot Puffer B+……………………………... 100 ml Tris-HCl [1 M] pH 7.5 11,69 g NaCl 200 ml Glycerin 1,46 g EDTA mit deion. H2O auf 1000 ml auffüllen und direkt vor der Verwendung folgendes frisch zugeben: − 1 μl/ml β-Mercaptoethanol (konz.) − 5 μl/ml Proteaseinhibitormix (PIM) − 1 mM Phenylmethylsulfonylfluorid (PMSF); Stocklösung: 40 mM in EtOH SDS-Probenpuffer [4x]…………….. 2,3 ml deion. H2O 4 ml Glycerin [87%] 600 μl Tris-HCl [0,5 M], pH 6.8 200 μl Bromphenolblau [5% (w/v)] 4 ml SDS-Lösung [10% (w/v)] 400 μl β-Mercaptoethanol (konz.) Trenngel [12%ig]………..…………. 4,08 ml deion. H2O 3,04 ml Tris-HCl [1,5 M], pH 8,8 4,8 ml Acrylamid / Bis 120 μ SDS-Lösung [10% (w/v)] 16 μl TEMED 16 μl APS [25%] Sammelgel…………………………… 1,8 ml deion. H2O 320 μl Tris-HCl [0,5 M], pH 6,8 330 μl Acrylamid / Bis 25 μl SDS-Lösung [10% (w/v)] 12,5 μl TEMED 12,5 μl APS [25%] 71 Material und Methoden SDS-Laufpuffer [10x]……………….. 30,3 g Tris-Bas 144,1 g Glycin 10 g SDS mit deion. H2O auf 1000 ml auffüllen Transfer-Puffer [10x]………………... 144,1 g Glycin 30,3 g Tris-Base 200 mg SDS mit deion. H2O auf 1000 ml auffüllen und vor Gebrauch in deion. H2O + 20% Methanol verdünnen TBS [10x]…………………………… 24,22 g Tris-HCl 80,0 g NaCl mit deion. H2O auf 1000 auffüllen und zuvor mit HCl [konz.] auf pH 7,6 einstellen TBS-T 1x TBS + 0,1% Tween-20 TBS-T / NaCl 1x TBS-T + 500 mM NaCl TBS-T / Triton 72 1x TBS-T + 0,5% Triton X-100 Material und Methoden 2.3 Material: Immunologische Methoden 2.3.1 Antikörper und Sekundärfarbstoffe für durchflusszytometrische Analysen Tab. 2.9: Übersicht über die, in dieser Arbeit verwendeten FACS Antikörper. Antigen Isotyp Klon Hersteller Label Verdünnung Streptavidin -- BD, # 349024 APC 1:400 − CD4 (L3T4) Ratte GK1.5 BD, # 553729 PE 1:1000 − CD4 (L3T4) Ratte RM4-5 BD, # 557308 PerCP 1:1000 − CD8 Ratte 53-6.7 BD, # 553032 PE 1:800 − CD8 Ratte 53-6.7 BD, # 553035 APC 1:800 − Biotin 2.3.2 Lösungen und Puffer Erythrozyten-Lysispuffer.…………… 4,15 g NH4Cl 0,5 g KHCO3 1,85 mg Na-EDTA mit H2O. deion. auf 500 ml auffüllen, sterilfiltrieren MACS-Puffer………………………… 980 ml PBS 20 ml FCS 0,58 g EDTA 73 Material und Methoden 2.4 Material: Mikroskopie 2.4.1 Material und Reagenzien Tab. 2.10: Übersicht über spezielles Mikroskopiematerial und -reagenzien die in dieser Arbeit verwendet wurden. Bezeichnung Hersteller Bestell-Nr. − Minimum Essential Media (MEM) ICN Biochemicals − Paraffin Fluka 76244 − Rinderkollagen Typ I Nutacon (NL) 5409 − Vaseline Apotheke Braunschweig -- − Mini Vent Hugo Sachs (March- -- 1410049 Hugstetten) − 2-Photonenmikroskop LaVision Biotec (Biele- -- feld) − Cell^R Mikroskopsystem Olympus − Feldemissions-Rasterelektronenmikroskop Gemi- Zeiss ni DSM982 2.4.2 Lösungen und Puffer Cacodylatpuffer………....…………… 13,8 g Cacodylat 1,1 g CaCl2 1,0 g MgCl2 30,8 g Saccharose mit H2O. deion. auf 1000 ml auffüllen und den pH Wert auf 6,9 einstellen TE-Puffer………………………… 1,2 g TRIS 0,6 g EDTA mit H2O. deion. auf 1000 ml auffüllen und den pH Wert auf 6,9 einstellen 74 --- Material und Methoden 2.5 Material: IT-Bereich 2.5.1 Software Allgemeine Büroanwendungen und tabellarische Zahlenanalysen wurden mit der Office Suite der Firma Microsoft in der Version 2003 erledigt. Die primäre Datenerfassung in der Durchflusszytometrie erfolgte mit dem Programm CellQuest Pro der Firma BD Biosciences in der Apple Macintosh Version 4.0.2, wobei die nachfolgende Analyse dieser Daten mit Hilfe der Software Summit (Fa. Dako, Version 4.3) durchgeführt wurde. Die Planung und Analyse von molekularbiologischen Daten wurde mit Vector NTI (Fa. Invitrogen, Version 10) realisiert und die Aufnahme der 2-Photonendaten mit der Software Suite Imspector (Fa. LaVision Biotec). Eine Akquisition des Bildmaterials erfolgte im Widefield System mit dem Programm cell^R der Firma Olympus und eine Nachbearbeitung sämtlicher Mikroskopiedaten mit den Programmen ImageJ (open source: http://rsb.info.nih.gov/ij/download.html, Version 1.38), Adobe Premiere (Fa. Adobe, Version 5.1), Quicktime Pro (Fa. Apple, Version 7), Tmpeg (Pegasys Inc., Version 2.524) und Volocity (Fa. Improvision, Version 4). Zur Bildbearbeitung wurde die CorelDraw X3 Suite (Fa. Corel) verwendet. 2.5.2 Internetdatenbanken Tab. 2.11: Übersicht über die, in dieser Arbeit verwendeten Internetdatenbanken. − NCBI http://www.ncbi.nlm.nih.gov/BLAST − Sanger Institute Blast Server http://www.sanger.ac.uk/cgi-bin/blast/submitblast/a_fumigatus − TIGR Blast Server http://tigrblast.tigr.org/ufmg 75 Material und Methoden 2.6 Mikro- und Molekularbiologische Methoden 2.6.1 Kultivierung und Sporenernte Aspergillus fumigatus Sämtliche A. fumigatus Stämme wurden in sterilem Minimalmedium (siehe 2.1.6), ggf. unter Zugabe des Selektionsmarkers Pyrithiamin (Endkonzentration 100 ng/ml) bei 37°C kultiviert. Für die Anzucht vegetativen Myzels wurde Flüssigmedium mit 1·108 Sporen pro 300 ml inokuliert und der Pilz für 15-20 h bei 37°C/180 upm angezogen. Um geschwollene Konidien zu erhalten wurden lebende Konidien für 5-6 Stunden bei 180 upm und 37°C in RPMI + 5% FCS inkubiert. Für die Gewinnung einer Sporensuspension wurden 100 μl wässrige Sporensuspension mit 2·107 Konidien durch Hilfe eines sterilen Drigalskispatels auf einer entsprechenden Agarplatte ausplattiert und für 72 bis 96 Stunden inkubiert. Zum Ernten wurden 15 ml steriles Leitungswasser auf der Agarplatte verteilt und die Sporen mit Hilfe einer ausgeglühten Impföse abgeschwemmt. Die Sporensuspension wurde im Anschluss durch Filtration durch ein Zellsieb von Myzelresten gereinigt und die Sporenkonzentration in einer Neubauer-Zählkammer bestimmt. Eine Lagerung dieser Konidien-Stock-Suspensionen erfolgte entweder in 15 ml Kunststoffröhrchen mit Schraubverschluss bei 4°C oder unter Vermischung mit Glycerin (30% Endkonzentration) bei -80°C oder in flüssigem Stickstoff. 2.6.2 Kultivierung und Induktion E. coli Sämtliche E. coli Stämme wurden in sterilem LB Medium (siehe 2.1.6), ggf. unter Zugabe von Antibiotika als Selektionsmarkers bei 37°C kultiviert. Die Inkubation von Fest- und Flüssigkulturen erfolgte für 12 - 15 Stunden, wobei Flüssigkulturen bei 180 upm auf einem Horizontalschüttler kultiviert wurden. Zur Induktion der Synthese des Fusionskonstruktes „trunkiertes Ovalbumin:Citrin“ in den Bl.21 Klonen wurden 25 ml Flüssigkulturen (LB + Ampicillin [100 µg/ml]) mit 50 μl stationärer Vorkulturen angeimpft und kontinuierlich die OD600 verfolgt. Bei einer OD600 von 0,6 - 0,8 wurden die Kulturen mit 0,1 M IPTG induziert und für weitere 4 – 15 Stunden schüttelnd inkubiert. 76 Material und Methoden 2.6.3 Polymerase Kettenreaktion (PCR) Polymerase-Kettenreaktionen wurden mit den thermostabilen Enzymen GoTaq DNA Polymerase (Promega), Phusion High-Fidelity DNA Polymerase (New England Biolabs) oder Pfu-Polymerase (Promega) durchgeführt. Es wurden 2 μl 10x Reaktionspuffer, 10 pmol Primer-Oligonukleotid, 1 nmol (each) dNTP und 10-100 ng DNA als Matrize in 20 µl Reaktionsvolumen entsprechend den Angaben des Herstellers verwendet. Art und Dauer des Temperaturprofils richteten sich nach den Angaben der Hersteller, den verwendeten Oligonukleotiden und der MatrizenDNA. In der Regel wurde eine Reaktion mit 30 Zyklen gestartet. 2.6.4 Restriktionsverdau Für analytische Restriktionsreaktionen wurden 0.5 µg DNA mit 1-2 Units Restriktionsenzym (Fermentas) in einem Volumen von 20 µl angesetzt und bei spezifischer Temperatur nach Angaben des Herstellers für 1-3 Stunden inkubiert. Für die Restriktion präparativer Mengen an DNA wurden entsprechend größere Volumina und Enzymmengen eingesetzt. Reaktionspuffer wurden nach den Angaben des Herstellers verwendet. Gegebenenfalls wurden Restriktionsansätze über eine "Mini-Säule" des Gelextraktionssystems QiaQuick (Qiagen) aufgereinigt. 2.6.5 Agarose-Gelelektrophorese Zur DNA-Lösung wurden 0,2 Volumen DNA Auftragspuffer gegeben und die DNAFragmente in einem 1%-igen horizontalen Agarosegel in TAE-Puffer in Gegenwart von 0,5 µg/ml Ethidiumbromid bei 80-100 V elektrophoretisch aufgetrennt. DNABanden wurden mittels eines UV-Transilluminators bei λ=254 nm detektiert. 2.6.6 Isolierung von DNA-Fragmenten aus Agarose DNA-Banden wurden unter UV-Licht niedriger Energie (λ=366nm) ausgeschnitten. Zur Isolierung der DNA-Fragmente aus dem Agarosegel wurden die Säulen und Puffer des Gelextraktionssystems QiaQuick (Qiagen) gemäß der Gebrauchsanweisung des Herstellers verwendet. Zur Elution der DNA wurden 50 µl deion. H2O verwendet. Die erhaltene DNA wurde bei –20°C aufbewahrt. 77 Material und Methoden 2.6.7 Ligation von DNA Fragmenten Lineare DNA-Fragmente wurden in einem 20 µl Reaktionsgemisch aus 10x Ligationspuffer (Promega), 3 U T4 DNA-Ligase und der DNA-Lösung über Nacht bei 16°C inkubiert. Die Gesamtkonzentration der DNA betrug 60 ng pro Ligationsansatz, das molare Verhältnis Vektor:Insert-DNA lag 1:3. Die Ligationsreaktion wurde durch fünfzehnminütiges Erhitzen auf 65°C abgestoppt und die DNA wurde ohne weitere Reinigung in die Transformation eingesetzt. 2.6.8 Herstellung chemisch kompetenter E. coli Von dem Bakterienstamm, aus dem die transformationskompetenten Zellen hergestellt werden sollten wurde über Nacht eine Vorkultur in LB Flüssigmedium angezogen und von dieser am nächsten Tag die Hauptkultur (1:100 in 300 ml LB Medium). Bei dem Erreichen einer OD600 von 0,6 wurden die Kulturen umgehend auf Eis heruntergekühlt und zehn Minuten bei 5500 x g und 4°C zentrifugiert. Der Überstand wurde verworfen, das Zellsediment in 60 ml eiskalter Calciumchloridlösung [0,1 M] resuspendiert und die Suspension 20 Minuten auf Eis inkubiert. Das Protokoll wurde ab dem Zentrifugationsschritt noch zwei Mal wiederholt und die Bakterien im Anschluss, nach einem weiteren Zentrifugationsschritt, in 3 ml eiskalter Calciumchloridlösung [0,1 M] resuspendiert. Nach dreistündiger Inkubation auf Eis wurde die Bakteriensuspension mit Glyzerin in einer Endkonzentration von 10% versetzt und die Zellen in 250 μl Aliquots in flüssigem Stickstoff schockgefroren und danach bei -70°C bis zur weiteren Verwendung gelagert. 2.6.9 Transformation E. coli 60 μl der schnell aufgetauten, kompetenten Bakterien wurden in einem 1 ml Reaktionsgefäß mit 1-60 μl DNA-Lösung (in der Regel der gesamte Ligationsansatz) versetzt und das Gemisch 30 Minuten auf Eis inkubiert. Nach einem Hitzeschock (40 s/ 42°C) wurde der Ansatz 1 Minute auf Eis heruntergekühlt, mit 1 ml SOC Medium vermischt und für eine Stunde bei 37°C auf einem temperierten Heizblock bei 1000 upm inkubiert. Von diesem Ansatz wurden 100 μl direkt auf Selektionsmedium ausplattiert und nach einem Zentrifugationsschritt (13000 x g / 1 min) und Resuspendieren im Rückfluss der restliche Teil der Bakterien. 78 Material und Methoden 2.6.10 Protoplastierung von Aspergillus fumigatus Die zu protoplastierenden Pilzstämme wurden über Nacht in 200 ml AMM Flüssigmedium (ggf. in Gegenwart von Pyrithiamin [100 ng/ml]) in einem 1000 ml Schikanekolben unter stetigem Schütteln (180 upm) mit einem Inokulum von 2·108 Konidien angezogen. Zur Protolplastierung wurde die Myzelmasse nach etwa 20 Stunden durch steriles Miracloth abfiltriert und 3 x mit 100 ml Citrat Puffer gewaschen. Zwei Spatel (vorher Abflammen) Myzel wurden nachfolgend in einen sterilen 100 ml Erlenmeyerkolben überführt und in 20 – 30 ml sterilfiltrieter Glucanase/Lysozym-Lösung für ein bis zwei Stunden bei 30°C/80 upm inkubiert. Dabei wurde regelmäßig der Fortschritt der Protoplastierung mikroskopisch verfolgt. Sobald der Großteil des Myzels protoplastiert erschien wurde die Suspension erneut durch steriles Miracloth filtriert und dabei von Myzelresten befreit. Die aufgefangene Protoplastensuspension wurde anschließend zur osmotischen Stabilisierung und zur Abstoppung der Enzymreaktion in einem Kunststoffröhrchen mit eiskaltem STC1700 auf 50 ml aufgefüllt und für 10 Minuten auf Eis inkubiert. Es folgte ein Zentrifugationsschritt (1300 x g / 12 min / 4 °C) an dessen Ende, das Zellsediment nach Verwerfen des Überstands im Rückfluss resuspendiert und anschließend einmal mit 50 ml eiskalten STC1700 gewaschen wurde. Nach dem Waschschritt wurde das Pellet erneut im Rückfluss resuspendiert und je nach Anwendung weiterbehandelt. 2.6.11 Transformation Aspergillus fumigatus Für die Transformation eines Pilzstammes wurde dieser zunächst nach 2.6.10 protoplastiert und am Ende eine Protoplastenkonzentration von 1·107 Protoplasten pro ml STC1700 eingestellt. Zur Transformation wurden 10 µg DNA mit 150 µl Protoplastenlösung 20 Minuten über Eis inkubiert, und dann sukzessiv mit 250 µl, 250 µl und 850 µl PEG4000-Lösung versetzt, so dass in jedem Schritt keine Schlieren mehr zu sehen waren. Darauf folgte eine zwanzigminütige Inkubation über Eis. Im Anschluss wurde die Suspension mit eiskaltem STC1700 auf 15 ml verdünnt und die Protoplasten bei 1300 x g und 4°C für 15 min abzentrifugiert. Das Sediment wurde dann vorsichtig in 500 µl STC1700 resuspendiert und in verflüssigten und auf 55°C temperierten Top Agar (5 ml Aliquots) überführt. Nach kurzem Schwenken wurde der Top Agar gleichmäßig auf Agarplatten aus Pro79 Material und Methoden toplastenmedium aufgebracht und durch Schwenken der Platte gleichmäßig auf dieser verteilt. 2.6.12 Plasmidpräparation aus E. coli Die Plasmid-Mini, -Midi und –Maxi-Präparation aus E. coli-Kulturen erfolgte mit den standardisierten Systemen der Firma Qiagen. Dazu wurden die Bakterienkulturen über Nacht in einem entsprechenden Volumen Selektivmedium kultiviert. Die Präparation erfolgte nach Angaben des Herstellers. Die Plasmid-DNA wurde in dem angegebenen Volumen sterilem, deion. H2O aufgenommen und bei –20°C gelagert. 2.6.13 Genomische-DNA-Extraktion aus Aspergillus fumiga- tus Zur Gewinnung der gesamt DNA aus einem Pilzstamm wurde eine 50 ml Übernachtkultur in Minimalmedium (Inokulum 5·107 Konidien) komplett durch steriles Miracloth abfiltriert, drei Mal mit sterilem, deion. H2O gewaschen und die Myzelmasse zwischen mehreren Lagen saugfähigem Filterpapier durch Pressen kurz getrocknet. Anschließend wurde das Myzel in flüssigem Stickstoff unter Zugabe einer Spatelspitze Seesand fein zermörsert und 0,5 bis 1 ml dieses Pulvers in ein 2 ml Reaktionsgefäß überführt. Nach Zugabe von 800 μl Aspergillus-Lysis-Puffer wurde das Pilzhomogenisat für 60 min bei 65°C aufgeschlossen. Es folgte die Zugabe von 800 μl TE-gesättigtem Phenol/Chloroform und nach Durchmischung eine Zentrifugation bei 13000 g und Raumtemperatur für 15 Minuten. Die in der oberen, wässrigen Phase enthaltene DNA wurde anschließend durch Zugabe von 20 μl Natriumacetat [3 M] und 450 μl Isopropanol gefällt und die Suspension bei 13000 g für zwei Minuten zentrifugiert. Die pelletierte DNA wurde dann mit 70%-igem Ethanol gewaschen und in 100-150 μl Wasser aufgenommen. Zum Lösen der DNA wurde der Ansatz 10 min auf 65°C erhitzt. Anschließend wurden 1,5-2 μl RNase A (20mg/ml) hinzugegeben und der Ansatz für 10-15 Minuten bei 37°C inkubiert. Die erhaltene genomische DNA wurde bei –20°C aufbewahrt. 80 Material und Methoden 2.6.14 Sequenzierung von DNA DNA-Sequenzierungen wurden standardmäßig von der Firma GATC (Konstanz) durchgeführt. Hierzu wurden die Plasmidproben in einem Volumen von 30 μl und einer Konzentration von 30-100 ng/μl an diese Firma versand. 2.6.15 Western Blot Zur Untersuchung der zytoplasmatischen Aspergillus Proteine mit Hilfe eines Westernblots wurde eine 50 ml Übernachtkultur in Minimalmedium (Inokulum 5·107 Konidien) komplett durch steriles Miracloth abfiltriert, drei Mal mit sterilem, deion. H2O gewaschen und die Myzelmasse zwischen mehreren Lagen saugfähigem Filterpapier durch Pressen kurz getrocknet. Anschließend wurde das Myzel in flüssigem Stickstoff unter Zugabe einer Spatelspitze Seesand fein zermörsert, 1 ml dieses Pulvers in ein 2 ml Reaktionsgefäß überführt und mit 300 μl B+-Puffer versetzt. Nach vier Mal 15 Sekunden kräftigem Durchmischen (zwischendurch auf Eis halten) wurde das Lysat zehn Minuten bei 4°C und 13000 x g zentrifugiert, der Überstand (Rohextrakt) abgenommen und Proteinkonzentration mit Hilfe eines Proteinquantifizierungs-Kits (BioRad) bestimmt. Der Überstand wurde mit SDS-Probenpuffer versetzt (final 1x konzentriert) und bei 95°C für 10 min aufgekocht. 10 -50 μg Protein wurden im Anschluss in 12%igen SDS-Gelen mittels der Mini-PROTEAN 3 Cell (Bio-Rad) aufgetrennt (70 V bis Einlaufen ins Trenngel, 120 V bei Auftrennung im Trenngel) und die Proteine anschließend in einer Mini Trans-Blot Electrophoretic Transfer Cell auf eine, durch Waschen in Methanol (96%) aktivierte und anschließend in Transfer-Puffer äquilibrierte, PVDF-Membran transferiert (80V für 1,5 h). Die Membran wurde dann mit 10% Milchpulver in TBS-T über Nacht bei 4°C geblockt, bevor die Primärantikörperinkubation in 1% Milchpulver in TBS-T für 1 h bei RT erfolgte. Anschließend wurde die Membran je 10 min mit TBS-T, TBS-T/NaCl, TBS-T/Triton und abschließend wieder mit TBS-T gewaschen. Die Inkubation mit peroxidasekonjugierten Sekundärantikörpern erfolgte in 1% Milchpulver in TSB-T für 1 h bei RT, gefolgt von den vier oben beschriebenen Waschschritten und zusätzlichem Waschen mit deionisiertem Wasser. Die Membran wurde dann für 5 min mit dem Chemilumineszenz-Substrat Lumilight (Roche) inkubiert und anschließend zur Belichtung von Hyperfilm ECL (Amersham Biosciences, Freiburg, Deutschland) durch die Chemilumineszenz-Reaktion der auf der Membran detektierten Proteine verwen81 Material und Methoden det. Die Inkubation von Membran mit Hyperfilm ECL erfolgte in Abhängigkeit der Signalstärke für 5 sec bis 30 min, die Filme wurde anschließend in einem Curix 50 Entwickler (AGFA, Leverkusen, Deutschland) entwickelt. 2.6.16 Southern Blot 2.6.16.1 Herstellung der Sonden-DNA Zur Herstellung der Sonden-DNA wurden das "HexaLabelTM DNA Labeling“ -Kit der Firma MBI Fermentas bzw. der „Prime-It II random primer labeling“ -Kit der Firma Stratagene gemäß der Anleitung des Herstellers verwendet. Die benötigte DNA wurde als PCR-Amplifikat eingesetzt. 2.6.16.2 Southern-Hybridisierung (Southern, 1975) Für die Southern-Hybridisierung wurden ca. 10 μg chromosomale DNA zwölf Stunden mit einem geeigneten Restriktionsenzym geschnitten. Die Fragmente wurden in einem 1%-igen Agarosegel aufgetrennt. Dieses Gel wurde 30 Minuten in 0,25 M HCl geschwenkt. Anschließend wurde es je zweimal in 0,5 M NaOH/1,0 M NaCl und 1 M NH4OAc/0,02 M NaOH 20 Minuten gewaschen. Die DNA wurde nun durch einen mindestens vierstündigen Kapillarblot auf eine Nylonmembran transferiert. Auf dieser wurde die DNA anschließend durch 5-minütige UVBestrahlung (254 nm) und 30-minütiges Erhitzen auf 80°C kovalent gebunden. Die Membran wurde mit 50 ml Church-Puffer (7% SDS, 1% BSA, 1 mM EDTA, 250 mM Na-Phosphat, pH 7.2) 2 h bei 65°C prä-hybridisiert und der Puffer anschließend verworfen. Nun wurde die mit [α-32P]-dATP radioaktiv markierte DNA-Sonde in 15 ml Church-Puffer zugegeben und die Hybridisierung bei 65°C über Nacht durchgeführt. Im Anschluss an die Hybridisierung wurde die Membran zweimal 30 Minuten bei 65°C mit 0,1x SSC/0,1% SDS gewaschen. Danach wurde ein Negativfilm der Firma Kodak auf die Membran gebracht und über Nacht bei —20°C exponiert. Anschließend wurde der Film entwickelt. 82 Material und Methoden 2.7 Immunologische Methoden 2.7.1 Isolierung von Lymphozytenpopulationen aus der Milz Die Mäuse wurden durch CO2-Zufuhr euthanasiert, die Milz entnommen, in PBS/FCS aufgenommen und mit dem Stempel einer 5 ml Spritze durch ein Zellsieb mit einem Porendurchmesser von 100 μm gerieben. Nach Zentrifugation der Zellen (345xg für 5 min) wurde das Pellet in 5 ml pro Milz Erythrozyten-LysisPuffer resuspendiert und für 1 min bei Raumtemperatur inkubiert. Die osmotische Reaktion wurde durch Auffüllen auf 50 ml mit PBS/FCS gestoppt und die Suspension zur Entfernung von Zelltrümmern und Gewebsresten erneut gefiltert. Nach anschließender Zentrifugation wurden die Zellen in PBS/FCS resuspendiert und in einer Neubauer-Zählkammer gezählt (1:1 in 0,4%iger Trypanblau- Lösung zur Bestimmung der Lebendzellzahl). 2.7.2 Isolierung von T-Zellen aus einer Lymphozytensuspension Zur Isolation von T-Zellen aus der erhaltenen Lymphozytensuspension wurde ein MACS-Zellseparations-System von Miltenyi Biotech verwendet. Hierbei werden nicht erwünschte Zelltypen durch Zugabe eines Antikörper-Cocktails durch biotinylierte Antikörper markiert. Anschließende Inkubation mit magnetischen anti-BiotinMicroBeads ermöglicht es, mittels einer Separationssäule und eines starken Permanentmagneten, den gewünschten Zelltyp zu eluieren, während markierte Zellen in der Säule verbleiben (Negativ-Isolation). Die Reinheit der erhaltenen Zellpopulation beträgt bis zu 95%. Die Anwendung des MACS-Kits erfolgte nach Herstellerangaben. Pro 1x107 Zellen wurde die Milzzell-Suspension in 40 μl PBS/FCS aufgenommen und für 10 min im Kühlschrank mit 10 μl Antikörper-Cocktail des entsprechenden MACS-T-Zell-Isolations-Kits inkubiert. Nach Zugabe von 30 μl MACS-Puffer wurden die Zellen weitere 15 min mit 20 μl anti-Biotin-MicroBeads im Kühlschrank inkubiert. Die Zellen wurden anschließend mit MACS-Puffer gewaschen, zentrifugiert und das Pellet in 500 μl MACS-Puffer pro 1x108 Zellen resuspendiert. Die MACS-Zell-Separationssäulen wurden am entsprechenden MACS-Magneten befestigt und vor Nutzung mit 3 ml MACS-Puffer äquilibriert. Das Gemisch aus Milzzell-Suspension und MACS-Zell-Isolations-Kit wurde auf die 83 Material und Methoden Säulen gegeben und diese anschließend dreimal mit je 3 ml MACS-Puffer durchgespült. Die erhaltene T-Zell-Population wurde danach zentrifugiert, in PBS/FCS aufgenommen und konnte für weitere Versuche verwendet werden. 2.7.3 Generierung von dendritischen Zellen aus Knochenmark Die Isolation und Kultur von dendritischen Zellen (DCs) wurden durchgeführt wie beschrieben in (Inaba et al., 1992), das Protokoll hierbei leicht modifiziert. Femur und Tibia von euthanasierten Mäusen wurden entnommen und das Knochenmark anschließend mit einer 26G-Kanüle mit PBS/FCS aus den Knochen gespült und gut resuspendiert. Erythrozyten wurden mittels Erythrozyten-Lyse (siehe 3.5) depletiert und die Knochenmarks-Zellsuspension in 20 ml BMDC-Medium für 2 h in einer Petrischale präplattiert. In dieser Zeit adhärieren Zellen, welche sich im weiteren Verlauf der Kultur zu Makrophagen differenzieren würden, während DCVorläuferzellen in der Suspension verbleiben. Der Überstand wurde schließlich abgenommen und je 1·107 Knochenmarks-Zellen in 10 ml BMDC-Medium für sieben Tage in Petrischalen inkubiert (37°C, 7% CO2). Am Tag 3 wurde die Hälfte, am Tag 6 das komplette Medium gewechselt und die Zellen wieder entsprechend in BMDC-Medium ausplattiert. Die reifen DCs konnten ab Tag 7 für Versuche eingesetzt werden. 2.7.4 Immunsuppressionen Die Immunsuppression von Mäusen erfolgte meistens durch i.p. Injektion von 100 µg anti-Gr-1 Antikörper (Klon RB6-8C5) in einem Volumen von 50 μl 24 Stunden vor der Infektion. Dieser Antikörper bewirkte die Depletion von Gr-1 positiven Zellen (Oberflächenmarker), welches zum größten Teil neutrophile Granulozyten entspricht (Neutropenie). Die zweite in dieser Arbeit verwendete Art der Immunsuppression ist die Corticosteroidbehandlung, bei der es zu einer generellen Entzündungsreaktionshemmung kommt. Dazu wurde den Tieren an sechs aufeinander folgenden Tagen vor der Infektion (t-6 bis t-1) jeweils 2,5 mg oder 5 mg Cortisonacetat s.c. in die Nackenfalte in einem Volumen von 100 μl injiziert. Zur Verbesserung der Löslichkeit wurde dieser Suspension im späteren Verlauf der Experimente 0,002% Tween 80 beigemischt. 84 Material und Methoden 2.7.5 Infektion einer Maus mit Aspergillus fumigatus Die intranasale Infektion einer Maus erfolgte mit 1·106 bis 1·108 Konidien (Standardmenge: 5·106) in einem Volumen von 30 μl. Zur Applikation der Konidiensuspension wurden die Tiere entweder durch eine Inhalationsnarkose mit Isofluran oder durch i.p. Injektion von 100 μl Ketamin/Rompun pro 10 g Lebendgewicht leicht anästhesiert und die Suspension mittels einer 200 μl Pipette auf die Nasenspitze aufgebracht, wobei die Maus annähernd senkrecht gehalten wurde. Nach kompletter Inhalation wurde die Maus für weitere 30 Sekunden senkrecht gelagert und im Anschluss zur Regeneration in den Käfig gelegt. Zur intratrachealen Infektion wurde die Maus mit 100 μl Ketamin/Rompun pro 10 g Lebendgewicht durch eine i.p. Injektion anästhesiert. Unter visueller Kontrolle wurde die Maus auf einer selbstgefertigten Intubationswippe mit Hilfe einer Schwanenhalslampe (zur Detektion des Larynx) und eines Laryngoskops (zur weiten Öffnung des Rachenraums) mit einer 22G (0,9x25 mm) Venenverweilkanüle intubiert. Durch diesen Tubus wurde das jeweilige Volumen Konidiensuspension mit der entsprechenden Sporenkonzentration appliziert. Nach vollständiger Inhalation der Suspension wurde die Maus zur gleichmäßigen Verteilung der Konidien eine Minute mit dem „Mini Vent“ (Hugo Sachs) künstlich beatmet. Das Atemvolumen betrug hierbei 200 μl bei einer Frequenz von 250 Atemzügen/min. 2.7.6 Detektion der Zellteilung einer aktivierten T-Zelle (Proliferationsassay) 2.7.6.1 Färben von Lymphozyten mit Carboxyfluoreszein Diazetat, Succinimidyl Ester (CFSE) Um die Teilung von T-Zellen zu visualisieren wurden diese vor der Injektion in eine Maus (in vivo Ansatz), bzw. vor dem Vereinigen mit APC in einer Multiwellplatte (in vitro) mit dem Farbstoff CFSE (CarboxyFluoroscein Succinimidyl Ester) angefärbt. Hierzu wurden die isolierten und bei 345 x g in einem 15 ml Kunststoffröhrchen pelletierten Zellen in der Färbelösung (1μM CFSE in PBS) unter Lichtausschluss inkubiert (2·108 Zellen/ml). In dieser Phase diffundiert der Farbstoff durch die Zellwand und wird intrazellulär, wo es durch Esterasen zur Abspaltung der beiden Acetatgruppen kommt, in seine aktive, fluoreszierende Form überführt. Durch Bindung an amine, zelluläre Proteinseitenketten verbleibt der Farbstoff irreversibel in 85 Material und Methoden der Zelle (Weston and Parish 1990). Nach 10 min wurde die Färbereaktion durch die Zugabe von 14 ml/ml Färbelösung PBS/FCS abgestoppt und die Zellen einmal in weiteren 15 ml PBS/FCS gewaschen (Zentrifugation bei 345 x g). Im Anschluss wurden die Zellen direkt in die verschiedenen Experimente eingesetzt. 2.7.6.2 Ablauf eines Proliferationsassays Für in vitro Studien wurden dendritische Zellen und reaktive, transgene T-Zellen in einem Verhältnis von 1:10 eingesetzt (2·104 DC + 2·105 T-Zellen in 250 μl CM pro Well einer 96-Well-Rundbodenplatte). Als Positivkontrollen diente entweder eine Ovalbuminlösung (Endkonzentration 1 μg/ml) oder eine Lösung des spezifischen Ova-Peptids AS 257-264 für OT-I T-Zellen und AS 323-339 für OT-II und Do11.10 T-Zellen (Endkonzentration je 10 µg/ml), die während der Inkubationsphase in dem Medium verblieb. Proteine, die auf die Fähigkeit getestet werden sollten, eine Proliferation hervorzurufen wurden von 0,1 µg/ml bis 100 µg/ml titriert. Zugesetzte Konidien wurden durch das Antimykotikum Voriconazol [4 µg/ml] am Auskeimen während der Inkubationsphase gehindert und wurden in den Stufen 1·105 Æ 2·105 Æ 1·106 Æ 2·106 titriert eingesetzt. Die Inkubation erfolgte für 72 bis 96 Stunden bei 37°C und 7 % CO2 und im Anschluss wurde der gesamte Proliferationsansatz in die FACS Analyse eingebracht (s.u.). Zur Studie der T-Zellproliferation in vivo wurden 1·106 CFSE gefärbte T-Zellen in einem Volumen von 150 μl PBS retrobulbär in eine C57/Bl.6, bzw. Balb/c Maus injiziert. Die Proliferation wurde nach 24 Stunden durch i.p., s.c. oder i.v. Injektion von 100 µg Ovalbumin in 100 μl PBS ausgelöst, oder aber durch intranasale Applikation von 400 µg/20 μl PBS (anfänglich in Gegenwart von 10 nmol CpG als Adjuvanz). Zum Test der Induktion einer Proliferation durch Konidien wurden Mäuse 24 Stunden nach Injektion der gefärbten T-Zellen und ggf. Injektion des anti-Gr-1 Antikörpers (Immunsuppression) intranasal mit 1·106 bis 1·107 Konidien infiziert (Standard: 5·106). Nach 72 bis 96 Stunden wurden die Mäuse durch CO2Zufuhr euthanasiert, immunologisch wichtige Organe, wie inguinale LK, bronchoalveoläre LK, Payers Patches, Milz, popliteale LK, cervicale LK, Lunge und NALT präpariert und durch Homogenisierung durch ein Zellsieb mit anschließender Erythrozytenlyse die Zellen für eine FACS Analyse vorbereitet. 86 Material und Methoden 2.7.6.3 Analyse der Proliferation Beginnt eine CFSE markierte Zelle sich zu Teilen werden die Farbstoffmoleküle zu gleichen Teilen an die beiden Tochterzellen weitergegeben, so dass diese ca. 50% der Fluoreszenz der Mutterzelle aufweisen. Diese Aufteilung geschieht mit jeder neuen Zellteilung, so dass man anhand der Fluoreszenzintensität auf die Anzahl der Zellteilungen rückschliessen kann, die diese Zelle durchlaufen hat. Abb. 2.1: CFSE (CarboxyFluoroscein Succinimidyl Ester) Verdünnung bei einem TZellproliferationsexperiment Ausgehend von einer CFSE gefärbten Mutterzelle kommt es nach Aktivierung und resultierender TZellteilung zu einer 1:1 Aufteilung des membranungängigen Farbstoffs auf die Tochterzellen. Die Fluoreszenzintensitäten der Teilungspopulationen können durchflusszytometrisch analysiert werden und geben Rückschluss auf die Anzahl an Teilungen, die eine Zellpopulation durchlaufen hat. Zur Auswertung der Proliferation wurden die Fluoreszenzintensitäten der T-Zellen mit Hilfe des Durchflusszytometers FACSCalibur der Firma BD Biosciences, in dem FITC optimierten Detektionskanal bei 530 nm ermittelt. Hierzu wurden die isolierten Zellpopulationen zunächst einer AK-Färbung unterzogen, um alle T-Zellen spezifisch zu markieren. Die Färbung erfolgte in 96-WellRundboden-Platten mit maximal 1x107 Zellen pro Well in 70 μl PBS für 20 min bei RT in Dunkelheit. Die verwendeten Antikörper und Verdünnungen sind der Tabelle 2.9 zu entnehmen. Die gefärbten Zellen wurden im Anschluss ein Mal mit je 250 μl PBS gewaschen in 300 μl PBS resuspendiert und in kleine FACS Röhrchen überführt. In der nachfolgenden FACS Analyse wurden zwischen 1·104 und 1·106 Zellen analysiert. 87 Material und Methoden 2.7.7 Immunisierungen Die initiale Immunisierung erfolgte am Tag t-33 durch die s.c. Injektion von 50 µg Protein in 30 μl PBS nach Herstellerangaben vermischt mit 30 μl des Adjuvanz TiterMax® in die Nackenfalte einer Maus. Zwei oder drei Wochen im Anschluss (Tag t-19 oder t-12) erfolgte das „Boosten“ durch dieselbe Applikationsform des aufgereinigten und adäquat verdünnten Proteins. Je nach Experiment wurden die Mäuse ab Tag t-6 einer Immunsuppression durch Cortisonbehandlung oder am Tag t-1 einer Immunsuppression durch anti-Gr-1 Injektion unterzogen und am Tag t0 mit 5·106 Aspergillus WT Konidien infiziert. Abb. 2.2: Immunisierungsschema Die initiale Immunisierung der Mäuse fand am Tag -33 statt, gefolgt von einer erneuten Antigengabe am Tag -12. Je nach durchgeführter Immunsuppressionsstrategie wurden die Mäuse entweder an den Tagen -6 bis -1 durch Applikation einer Cortisonacetatlösung behandelt oder durch Injektion des anti-Gr-1 Antikörpers am Tag -1 und die Tiere nachfolgend, am Tag 0 infiziert. Der Gesundheitsstatus der Mäuse wurde bis zum Tag +10 regelmäßig bestimmt. Bis Tag t+5 erfolgte dann eine tägliche Sichtung und Gewichtsbestimmung der Tiere, die ab Tag t+6 auf einen Zweitagesrhythmus verlängert wurde. Hierbei wurden Tiere euthanasiert, die entweder optisch einen sehr schlechten Gesundheitszustand aufwiesen, nach Infektion mehr als 25% Gewicht verloren hatten oder eine ZNS Symptomatik aufwiesen, bei der sie sich kontinuierlich um die AnteriorPosterior-Achse drehten (siehe CD-Rom, Filmbeispiel 4). Alle Tiere, die entweder tot aufgefunden oder aufgrund der o.g. Gründe euthanasiert wurden gingen an diesem Tag als „tot“ in die Statistik ein. 88 Material und Methoden 2.8 Mikroskopische Methoden 2.8.1 Rasterelektronenmikroskopische Untersuchung infizierter Lungen Die Mäuse wurden mit Ketamin/Rompun anästhesiert, intratracheal mit 1·107 Konidien infiziert und direkt im Anschluss zur effektiven Verteilung der Sporen eine weitere Minute durch den Tubus künstlich beatmet (Mini Vent; 250 μl Atemvolumen bei 250 Atemzüge/min). Zum gewünschten Zeitpunkt wurden die Tiere durch CO2 Inhalation euthanasiert, die Lungen rasch präpariert und in 5% Formaldehyd und 2% Glutardialdehyd in Cacodylatpuffer auf Eis fixiert. Nach Entgasung in einem Urglas unter Vakuumbedingungen wurden die Organe dreimal mit TE-Puffer gewaschen und anschließend in einer ansteigenden Acetonreihe (10, 30, 50, 70, 90, 100%) jeweils für 30 min auf Eis entwässert. Anschließend erfolgte noch zweimal eine Inkubation der Proben in 100% Aceton bei Raumtemperatur für 30 min. Eine Kritische-Punkt-Trocknung mit flüssigem Kohlendioxid schloss sich an und nachfolgend wurden die getrockneten Proben mit Hilfe von Kohleaufklebern auf Präparatehalter befestigt. Mit einem zweiten Präparatehalter, ebenfalls mit einem Kohleaufkleber versehen, wurden die Proben leicht zusammengedrückt und durch auseinander ziehen der beiden Präparatehalter gebrochen. Die entstandenen Bruchflächen wurden mit einem dünnen Goldfilm besputtert und die Proben in einem Zeiss Feldemissions-Rasterelektronenmikroskop Gemini DSM982 bei einer Beschleunigungsspannung von 5 kV betrachtet. Die Bilder wurden digital gespeichert. 2.8.2 Mikroskopische Visualisierung von Zell-Zell-Interaktionen unter Widefieldbedingungen Die Zell-Zell-Interaktionen wurden in Kollagengelen aus Typ I Rinderkollagen untersucht. Ihre Herstellung erfolgte nach einem, bereits in anderen Studien verwendeten Protokoll (Gunzer et al. 2000; Parkhurst and Saltzman 1992): Zunächst wurde eine Kollagenausgangslösung durch sorgfältiges Vermischen von 5 μl Natriumhydrogencarbonat [7,5%], 10 μl MEM [10x] und 75 μl kommerziell erhältlichem Rinderkollagen hergestellt. Parallel dazu wurden 3·106 Phagozyten (DC) mit 89 Material und Methoden 3·107 Konidien in CM vermischt und fünf Minuten bei 300 X g zentrifugiert. Nach vorsichtigem Abgießen des Überstands wurden die Zellen in 66 μl Rückfluss resuspendiert. Diese Zellsuspension wurde im Anschluss mit 133 μl der Kollagenausgangslösung gut vermischt und zur Polymerisation in eine Mikroskopiekammer überführt. Zur Herstellung dieser Kammer wurden mit einem feinen Pinsel Uförmig etwa 1-2 mm hohe Stege aus erhitztem 2:1 Paraffin:Vaselinegemisch auf einen Objektträger aufgebracht. Nach Erkalten des Gemischs wurde auf die Stege ein Deckgläschen aufgelegt und die Ränder mit dem Paraffin-Vaseline-Gemisch so versiegelt, dass die obere Seite des „Us“ weiterhin geöffnet blieb. In diese Tasche wurde die Zellsuspension in Kollagen mittels einer Mikropipette eingebracht und für ca. 20 Minuten bei 37°C auspolymerisiert. Die abgeschlossene Polymerisation konnte durch eine milchige Trübung des Gels verifiziert werden. Nachfolgend wurde das Leervolumen der Kammer mit CM aufgefüllt, die Kammer mit dem Paraffin-Vaseline-Gemisch versiegelt und umgehend in die Mikroskopieexperimente eingesetzt. Die Mikroskopie erfolgte mit einem Olympus Cell^R System, welches zur Temperierung auf 37°C in eine digital gesteuerte Wärmebox aus Plexiglas installiert wurde. Die Bilder wurden entweder mit einem 40x oder einem 60x Objektiv bei 10x Nachvergrößerung akquäriert. Zur Generierung der Filme wurde alle 60 s je ein Bild pro Position im Kollagengel über einen Zeitraum von sechs Stunden aufgenommen und die avi-Dateien mit der Software Cell^R bei 10 fps exportiert. 90 Ergebnisse 3 Ergebnisse 3.1 Erzeugung und molekularbiologische Charakterisierung des Stammes A. fumigatus D1.41ΔOvaCit Als Grundlage dieser Arbeit sollte ein ovalbumin- und EYFP-synthetisierender Aspergillus fumigatus-Stamm durch genetische Manipulation erzeugt werden. Das Ovalbumin sollte als Modellantigen für immunologische in vivo und in vitro Experimente fungieren. Diese Versuche beruhten auf dem Prinzip der Antigenspezifität des T-Zellrezeptors. T-Zellen bestimmter transgener Mauslinien (z.B. Do11.10 (Murphy, Heimberger, and Loh 1990), OT-I (Hogquist, Jameson, and Bevan 1995) und OT-II (Barnden et al. 1998)) sind in der Lage über ihren spezifischen Rezeptor ein bestimmtes Bruchstück (Peptid) des Ovalbumins im Komplex mit dem präsentierenden MHC Molekül einer APC zu erkennen. Die Bindung der T-Zelle an die APC führt zur Aktivierung der T-Zelle, die sich daraufhin teilt (proliferiert). Diese Zellteilung kann durch durchflusszytometrische Analysen detektiert werden (siehe 2.7.6). So sollten die Kinetik und Lokalisation einer spezifischen Immunreaktion gegen A. fumigatus, zu denen bisher keine Details bekannt sind, studiert werden. Nach Aufnahme des transgenen Pilzes durch verschiedene antigenpräsentierende Zellen sollten diese in der Lage sein über die präsentierten Ovapeptide TZellrezeptor transgene T-Zellen spezifisch zur Proliferation anzuregen. Diese Beobachtung sollten als Kriterium für eine gerade ablaufende Immunreaktion gegen den Pilz definiert werden. So sollte die Analyse der spezifischen T-Zellproliferation in murinen, lymphatischen Geweben bei der Klärung des zeitlichen Verlaufs einer Aspergillus-Infektion die entsprechenden Antworten liefern. CD8+ T-Zellen aus OT-I Mäusen benötigen die Aminosäuren 257-264 des Ovalbumins präsentiert in MHC-I Molekülen, um zur Proliferation angeregt zu werden und CD4+ T-Zellen aus Do11.10 und OT-II Mäusen die Aminosäuren 323-339 im Komplex mit MHC-II Molekülen (Murphy, Heimberger, and Loh 1990; Hogquist, 91 Ergebnisse Jameson, and Bevan 1995; Barnden et al. 1998). Um die Erzeugung und die Prozessierung des Fusionskonstruktes durch APC möglichst effektiv zu gestalten sollte die Konstruktgröße möglichst gering gehalten werden. Da nur wenige Aminosäuren des Ovalbumins für die immunologischen Assays nötig waren und die 3dimensionale Konformation dieses Teils des Fusionsproteins zu vernachlässigen war, bot es sich an, eine trunkierte Form des Modellantigens einzusetzen. Die Klonierung wurde daher so geplant, dass die verkürzte Variante des Ovalbumins im Kernbereich die beiden, für die T-Zellaktivierung relevanten Peptide enthielt und dieser N- und C-terminal von jeweils vier Aminosäuren flankiert wurde (siehe Abb. 3.1). trunkiertes Ovalbumin (AS 253-343) Erkennung durch transgene T-Zelle OT-I OT-II T-Zellen T-Zellen AS 257-264 AS 323-339 Präsentation durch MHC-Komplex komplettes Ovalbumin // 386 AA Abb. 3.1: Bedeutung des trunkierten Ovalbumins Zur Aktivierung von CD8+ T-Zellen aus OT-I Mäusen wird das Peptid AS 257-264 im Komplex mit einem MHC-I Molekül benötigt und zur Aktivierung von CD4+ T-Zellen aus OT-II und Do11.10 Mäusen das Peptid AS 323-339 im Komplex mit dem entsprechenden MHC-II. Das trunkierte Ovalbumin wurde so gewählt, dass es die beiden relevanten Peptide überlagert und sowohl N- als auch C-terminal jeweils vier Aminosäuren länger ist, um eine effektivere Prozessierung durch APC zu gewährleisten. Als Fluoreszenzprotein sollte Citrin die Visualisierung des Pilzes mit mikroskopischen Methoden ermöglichen. Hierbei war geplant, durch mikroskopische Observierung der Lunge einer lebenden, infizierten Maus („live imaging“) die Disseminationsvorgänge des Pilzes, aber auch die einsetzenden Immunreaktionen zu beobachten und zu beschreiben. Da die Fluoreszenz entscheidend von der Konforma92 Ergebnisse tion des Proteins abhängt wurde für diesen Teil der Fusion das ungekürzte Gen in die Planung der Synthese eingesetzt. 3.1.1 Erzeugung des Stammes A. fumigatus D141ΔOvaCit 3.1.1.1 Erzeugung der Fusionskonstrukte in E. coli Den ersten Schritt der Synthese des transgenen Pilzstamms stellte die Synthese zweier Fusionskonstrukte in den Escherichia coli Expressionsvektor pET-21b(+) dar. Um die bestmögliche Fluoreszenz des Citrins in dem Fusionsprotein sicherzustellen sollten beide möglichen Positionsvarianten des Fluorochroms getestet werden: In dem ersten Konstrukt wurde das trunkierte Gen des Ovalbumins vor dem Citrin positioniert und im zweiten wurden die beiden Gene vertauscht. Aus Tabelle 3.1 ist ersichtlich mit Hilfe welcher Primerpaare und welcher Annealingtemperaturen die Einzelfragmente der Fusionskonstrukte aus den Ausgangsvektoren pCGA15 und pSTAT2-EYFP amplifiziert wurden. Als Enzym kam die GoTaq Polymerase (Fa. Promega) zum Einsatz. Tab. 3.1: Für die Klonierung verwendete Primerpaare mit zugehörigen Annealingtemperatu- Startcodon Größe Fragment Stopcodon ren für die PCR 1 pCGA15 MH9/MH10 58°C + trunk. Ova - 290 2 pCGA15 MH11/MH12 58°C - trunk. Ova + 286 3 pSTAT2-EYFP MH3/MH4 61°C - Citrin + 737 4 pSTAT2-EYFP MH7/MH8 60°C + Citrin - 737 # Template Primerpaar Annealingtemp. (bp) Die amplifizierten Einzelfragmente wurden zunächst über das TOPO-TA Cloning Kit der Firma Invitrogen in den in dem Kit enthaltenen Vektor pCR®2.1-TOPO® ligiert und die ebenfalls im Lieferumfang des Kits enthaltenen, kompetenten TOP10® E. colis mit diesen Plasmiden nach Protokoll des Herstellers transformiert. Nach Inkubation auf einem Selektivmedium (Ampicillin) wurden die Vektoren durch eine Plasmid-Maxi-Präparation isoliert und die Einzelfragmente nach einem erfolgreichen Kontrollrestriktionsverdau aus den pCR®2.1-TOPO® Vektoren 93 Ergebnisse herausgeschnitten. Hierbei wurden NdeI, BamHI und EcoRI für den enzymatischen Verdau benutzt, deren Schnittstellen durch die Primer im ersten Schritt eingefügt wurden. Über eine Dreifachligation nach Standardprotokoll wurden die jeweiligen Genfragmente mit dem zuvor passend verdauten (NdeI, BamHI, EcoRI) pET-21b(+) Vektor verbunden und der E. coli. Expressionsstamm BL21(DE3) mit den beiden Plasmidvarianten transformiert. Abb. 3.2: Die zwei Orientierungen des Fusionskonstrukts Da die Fluoreszenz des Citrins und die Prozessierbarkeit des Modellantigens Ovalbumin ggf. von der räumlichen Struktur des Fusionskonstrukts abhängen sollten beide Varianten der räumlichen Orientierung unter in vitro Bedingungen getestet werden. Je eine Flüssigkultur der mit beiden Fusionsvarianten transformierten E. coli Stämme wurde in der exponentiellen Wachstumsphase nach Angaben des Herstellers durch die Zugabe des Transkriptionsfaktors IPTG induziert, um unter Kontrolle des T7 Promotors das jeweilige Fusionsprotein zu synthetisieren (siehe 2.6.2). Der erste Test auf eine erfolgreiche Transformation war die mikroskopische Kontrolle der Kulturen. Als Negativkontrolle dienten untransformierte BL21(DE3) E. coli. 94 Ergebnisse transformiert untransformiert 2-PhotonenMikroskopie WidefieldMikroskopie Abb. 3.3: Fluoreszenz des transgenen E. coli Es ist eine deutliche Fluoreszenz des Citrins in den transgenen Bakterien sowohl in der Widefield-, als auch der 2-Photonenmikroskopie (linke Spalte) verglichen mit dem untransformierten Bakterienstamm (rechte Spalte) zu erkennen. Das bipolare Auftreten der Fluoreszenz in den stäbchenförmigen Bakterien ist mit der Akkumulation des Proteins an den Enden zu erklären. In den transformierten Bakterien ist sowohl unter Widefieldbedingungen, als auch in einem 2-Photonenexperiment eine deutliche Fluoreszenz des Citrins detektierbar, wobei in dem untransformierten Ausgangsstamm lediglich eine schwache Hintergrundfluoreszenz zu erkennen ist. Die Reihenfolge „trunkiertes Ovalbumin:Citrin“ lieferte im Vergleich zu der entgegen gesetzten Reihenfolge eine wesentlich bessere Fluoreszenz (ungezeigte Daten), so dass ab diesem Zeitpunkt mit diesem Konstrukt weitergearbeitet wurde. 95 Ergebnisse Abb. 3.4: Expressionsvektor pET-ovacit1 Die Genreihenfolge „trunkiertes Ovalbumin:Citrin“ lieferte die bessere Fluoreszenz in Bakterien, die mit diesem Vektor transformiert wurden. Nach dem Nachweis der Fluoreszenz galt es nun zu beweisen, dass auch das Ovalbumin in einer für APC verwertbaren Form vorliegt. Hierzu wurden dendritische Zellen zusammen mit CFSE gefärbten OT-II T-Zellen und transformierten, induzierten Bakterien inkubiert und nach 72 Stunden durchflusszytometrisch eine Aktivierung der T-Zellen gemessen. Als Negativkontrollen dienten zum einen unbeladene DC und zum anderen untransformierte Bakterien. Zur Kontrolle der Proliferationsfähigkeit der T-Zellen (Positivkontrolle) wurden dendritische Zellen eingesetzt, die zuvor mit dem für die CD4+ OT-II T-Zellen relevanten Ovalbuminpeptid beladen wurden. Eine generelle Aktivierung der frisch isolierten T-Zellen wurde 96 T-Zellen + DCOvapeptid T-Zellen + DCunbeladen T-Zellen alleine ausgeschlossen, indem diese ohne APC und Antigen inkubiert wurden. T-Zellen + DC + BL21(DE3)untransf. T-Zellen + DC + BL21(DE3)OvaCit Ergebnisse Abb. 3.5: T-Zellproliferation, hervorgerufen durch transgene Bakterien T-Zellen alleine, sowie T-Zellen, die mit unbeladenen dendritischen Zellen, bzw. mit DC und untransformierten Bakterien koinkubiert wurden zeigten keine Zellteilung, wohingegen T-Zellen in der Positivkontrolle und in der Koinkubation mit DC und transgenen E. coli eine deutliche Proliferation aufwiesen. Dieses Experiment zeigte, dass das Ovalbumin in den Bakterien durch APC prozessiert und Bruchstücke auf ihrer Oberfläche präsentiert werden konnten. Die präsentierten Ovalbuminpeptide waren in der Lage T-Zellen spezifisch zu einer Proliferation anzuregen. Anschließend wurde das Fusionskonstrukt in den Vektor pSK269 eingebracht. Dieses Konstrukt diente als Ausgangsmaterial für die folgenden Schritte. Abb. 3.6: pSK-ovacit1 als genetisches Ausgangsmaterial für die weitere Klonierung 97 Ergebnisse 3.1.1.2 Erzeugung des Aspergillus-Shuttle-Vektors pSK379oc Nach einer Plasmid-Maxi-Präparation wurde das Fusionskonstrukt „trunk. Ovalbumin:Citrin“ über die Schnittstellen NcoI/SmaI aus dem pSK-ovacit1 Vektor ausgeschnitten und in einer „Fill-In Reaktion“ mit dem Klenow-Fragment, das überhängende Ende der NcoI Schnittstelle aufgefüllt. In dem Labor von Sven Krappmann (Universität Göttingen) wurde das Fragment im Anschluss über eine „BluntEnd-Ligation“ in den Vektor pSK379 eingebracht. Durch diese Ligation wurde erreicht, dass die Transkription des Fusionskonstrukts unter Kontrolle des gpdAPromotors stand. Als Schlüsselenzym der Glykolyse wird die Glycerinaldehyd-3phosphat-Dehydrogenase in einem wachsenden Pilz in größeren Mengen benötigt. Deshalb wurde dieser Promotor ausgewählt, um eine verlässliche Synthese des Fusionskonstrukts zu gewährleisten. Der Vektor pSK379 wurde vor der Ligation mit dem Restriktionsenzym PmeI linearisiert, welches bei einem Verdau ebenfalls glatte Enden entstehen ließ. Abb. 3.7: Der Shuttle-Vektor pSK379ΔOvaCit Durch Ligation des Fusionskonstrukts in die PmeI Schnittstelle des Vektors pSK379 entstand dieser Aspergillus- Transformationsvektor, bei dem die Translation des Konstrukts von der Aktivität des gpda-Promotors abhängt. Nach Transformation des E. coli Stamms DH5α mit dem Shuttlevektor wurden die entstehenden Klone mittels Kolonie-PCR (Primer T7/MH7 und T7/MH12) auf das Vorhandensein des Konstrukts und seine korrekte Orientierung in dem Plasmid überprüft. 98 Ergebnisse a) MH7 trunk. Ova. Citrin his2Ater T7 MH12 MH12 Citrin his2Ater T7 trunk. Ova. MH7 b) Spur 1: Klon 1 PCR mit Primerpaar T7/MH7 Spur 2: Klon 2 PCR mit Primerpaar T7/MH7 Spur 3: Klon 3 PCR mit Primerpaar T7/MH7 Spur M: Größenstandard Spur 4: Klon 2 PCR mit Primerpaar T7/MH12 Spur 5: Klon 3 PCR mit Primerpaar T7/MH12 Spur 6: Klon 1 PCR mit Primerpaar T7/MH12 Abb. 3.8: Kolonie-PCR der DH5α-Klone a) Anhand der Entstehung von Fragmenten spezifischer Größe war es möglich, die Orientierung des Fusionskonstrukts in dem Plasmid pSK379 zu bestimmen Bei korrekter Orientierung (oben) würde durch den Einsatz des Primerpaars MH7/T7 ein PCR Produkt entstehen. Durch Einsatz des Primerpaars MH12/T7 dürfte kein Amplifikat detektierbar sein. b) Die Abbildung zeigt das Ergebnis einer Kolonie-PCR von drei beliebig ausgewählten DH5αKlonen nach der Transformation mit dem Plasmid pSK379Δovacit. Eine Bande in der Laufhöhe von 2798 bp bei der PCR mit dem Primerpaar T7/MH7 deutet auf eine Integration des Fusionskonstruktes in der korrekten Orientierung hin. Eine Bande in der Laufhöhe von 2351 bp bei der PCR mit den Primern T7/MH12 ist Indiz für eine falsche Orientierung. Von drei durch PCR getesteten Klonen wies der Klon 1 das Konstrukt in der richtigen Ausrichtung auf. Durch eine Plasmid-Minipräparation wurde die Vektor-DNA dieses Klons isoliert und durch einen Kontrollrestriktionsverdau mit dem Enzym NcoI die korrekte Integration des Fusionskonstrukts noch einmal bestätigte. Von 99 Ergebnisse diesem wurde anschließend eine Plasmid-Midi-Präparation angefertigt, die das Ausgangsmaterial für die nachfolgende Transformation des Pilzstamms lieferte. 3.1.1.3 Transformation des Aspergillus Stamms Nach 2.6.11 erfolgte eine Transformation des klinischen Aspergillus fumigatus WT Isolats D141 (Staib et al. 1980) mit 10 µg Plasmid DNA pro Transformationsansatz, welcher am Ende des Protokolls auf Minimalmedium mit Pyrithiamin als Selektionsmarker ausplattiert wurde. Über die His2At Sequenz erfolgte nach der Transformation eine gezielte Integration des gesamten Vektors in das Chromosom 5 des Aspergillus Genoms (Doonan et al. 1991). Da die Histongene in A. fumigatus in zwei Kopien vorliegen, die sich aber in der Terminatorsequenz unterscheiden, war es möglich, eine gezielte Integration vorzunehmen, ohne dabei ein anderes, essentielles Genprodukt auszuschalten. Nach 96 Stunden Inkubation wurden Konidien von je acht Kolonien verschiedenen Phänotyps auf Minimalmediumplatten mit Pyrithiamin in einem Verdünnungsausstrich neu ausplattiert und nach weiteren 72 Stunden Inkubation wurden insgesamt 21 Einzelkolonien durch Ausschneiden aus dem Agar und Resuspendieren in 500 μl Tween/NaCl geerntet. Von allen Klonen wurden im Anschluss Stammkulturen angefertigt. 3.1.2 Mikroskopische Charakterisierung des A. fumigatus D1.41ΔOvaCit Als erster Test auf die erfolgreiche Transformation des Aspergillus WT Stamms erfolgte eine mikroskopische Kontrolle. Hierzu wurden von allen 21 geernteten Klonen Flüssigkulturen über einen Zeitraum von ca. 20 Stunden in Minimalmedium inkubiert und anschließend die Fluoreszenz des Citrins in der Myzelmasse und den Konidien nachgewiesen. 100 2-Photonen-Mikroskopie Widefield-Mikroskopie Ergebnisse Abb. 3.9: Fluoreszenz des transgenen Aspergillus Stamms Wie auch in den Bakterien gezeigt ist eine deutliche Fluoreszenz des Citrins unter Widefield- und 2-Photonenbedingungen in dem transgenen Aspergillus fumigatus Stamm D1.41ΔOvaCit detektierbar. In der oberen Zeile sind fluoreszierende Konidien in der Widefieldmikroskopie dargestellt und in der unteren Reihe erfolgte eine Mikroskopie der Myzelmasse im 2-Photonenaufbau. Von den 21 untersuchten Aspergillus-Klonen wiesen 20 eine deutliche Fluoreszenz auf, die auf die Synthese des Citrins rückschliessen ließ. Diese Fluoreszenz war unter Widefieldbedingungen sowohl in Konidien, als auch in Hyphen gut detektierbar. In dem 2-Photonensystem waren die Konidien aufgrund der geringeren Vergrößerungsmöglichkeit (Limitierung durch 20x Objektiv) und der ineffizienteren Anregungswellenlänge von 900 nm (Optimum 950 nm (Heikal et al. 2000)) nur sehr schlecht zu beobachten. Nach Auskeimung und einer damit einhergehenden stärkeren Expression des Citrins war das Hyphengeflecht des Stammes durch die Fluoreszenz gut zu sehen. Nach der Mikroskopie von Hyphenmasse des transgenen Aspergillus fumigatus D1.41ΔOvaCit im 2-Photonenmikroskop sollten in weiteren Experimenten die Visualisierungsmöglichkeiten und die 3-D Rekonstruktion des Pilzes in dem verfügbaren System ausgetestet werden. 101 Ergebnisse Abb. 3.10: 3-D Rekonstruktion des Hyphengeflechts Myzelmasse des transgenen D1.41ΔOv aus einer Übernachtkultur war direkt in die 2Photonenmikroskopie einsetzbar. Das Myzel wurde aus Konidien über Nacht in einer AMM Schüttelkultur angezogen und zur Mikroskopie in einer Petrischale mit AMM überschichtet. Die Fluoreszenz des Citrins ließ nach der Mikroskopie eine gut aufgelöste 3-D Rekonstruktion des Hyphengeflechts mit der Software Suite „Volocity“ zu. Eine bewegte Animation dieser Darstellung ist auf der CD-Rom, die dieser Arbeit beiliegt enthalten (siehe Filmbeispiel 1). 3.1.3 Molekularbiologische Charakterisierung des A. fumigatus D1.41ΔOvaCit Eine genauere Charakterisierung sollte die molekularbiologische Analyse der Klone liefern. Hierzu wurde aus allen 21 Klonen die genomische DNA isoliert und diese durch folgende Tests charakterisiert. 3.1.3.1 Charakterisierung durch PCR Zur Amplifikation des genetischen Fusionskonstrukts „trunkiertes Ovalbumin:Citrin“ wurde unter Verwendung der Primer MH9 und MH4 eine PCR nach 2.6.3 durchgeführt. Als Template diente die isolierte, genomische DNA der 21 Klone. Die Annealing Temperatur betrug 61 °C und als Polymerase wurde die GoTaq 102 Ergebnisse Fa. Promega) eingesetzt. Abb. 3.11: PCR-Analyse von 21 unterschiedlichen Klonen Zur Detektion des Fusionskonstrukts in den 21 isolierten Aspergillus Klonen wurde eine PCR mit spezifischen Primern auf genomische DNA als Template durchgeführt. In allen Klonen konnte das 1012 bp große Konstrukt nachgewiesen werden. Zu erkennen ist, dass aus allen 21 Klonen das erwartete Konstrukt mit einer Länge von 1012 Basenpaaren amplifiziert werden konnte. 3.1.3.2 Charakterisierung durch Southernblot Um die korrekte Integration des Fusionskonstrukts in den His2At-Locus sicherzustellen wurde im folgenden Schritt ein Southernblot nach 2.6.16 durchgeführt. Hierfür wurde die genomische DNA von sieben ausgewählten Klonen (1, 2, 3, 5, 10, 14, 24) und als Vergleichskontrolle die DNA des untransfizierten Wildtypstamms D141 mit den Restriktionsenzymen HindIII, SalI, MscI und NsbI verdaut und im Anschluss mit radioaktiv markierten Sonden auf das Fusionskonstrukt „ovacit“ (Verdau HindII und SalI), bzw. die Histonterminatorregion „his2At“ (Verdau MscI und NsbI) beprobt. 103 Ergebnisse Abb. 3.12: Southernblot von 7 ausgewählten Klonen Die Beprobung der spezifisch verdauten, genomischen DNA mit einer radioaktiv markierten Sonde ergab, dass in allen ausgewählten Klonen mindestens eine Einfachinsertion des Konstrukts ovacit im Gegensatz zu dem Wildtypstamm erfolgt war. Durch den Rekombinationsvorgang bei der Integration des Vektors in das Pilzgenom wurde auch die Histonterminatorregion his2At übertragen. Somit sind von diesem Genfragment in den Klonen mindestens zwei Kopien vorhanden. In der Wildtypprobe ist lediglich die endogen vorhandene Kopie der Terminatorregion nachzuweisen. Nach Hybridisierung mit der Sonde für das Fusionskonstrukt konnte gezeigt werden, dass in allen sieben Klonen eine Insertion dieser kombinierten Gene stattgefunden hat. Das Bandenmuster der Klone 3, 5 und 10 zeigt eine Mehrfachinsertion in das Genom, wobei durch die Insertion bei Klon 10 ein Teil der Melaninbiosynthese betroffen sein muss, da die Konidien dieses Stammes auf der Agarplatte weiß erscheinen. In den Wildtyphybridisierungen kann das Fusionskonstrukt nicht nachgewiesen werden. Die Detektion mit der Sonde für das Histonterminatorfragment ergab eine einzelne Bande in den Wildtypproben, was dem natürlich vorkommenden Gen entspricht. Nach homologer Rekombination und Insertion des Shuttlevektors in das Genom muss dieses Fragment in doppelter Anzahl vorliegen, was in den Hybridisierungen aller Klone gut zu erkennen ist. Auch hier ist wieder die Mehrfachinsertion bei den Klonen 3, 5, und 10 zu erkennen. 104 Ergebnisse Durch diese Charakterisierung konnte die erfolgreiche Generierung des Aspergillus fumigatus Stammes D141ΔOvaCit auf molekulargenetischer ebene zweifelsfrei belegt werden. 3.1.3.3 Charakterisierung durch Westernblotanalyse Als nächstes sollte der Beweis geführt werden, dass das Fusionskonstrukt auch auf Proteinebene nachgewiesen werden kann. Hierzu wurde Myzelmasse aus Flüssigkulturen, die über Nacht gewachsen waren, aufgeschlossen, die zytoplasmatischen Proteine extrahiert und diese durch Einsatz einer SDS PAGE aufgetrennt. Nach dem Transfer der Proteine auf eine Membran wurde diese mit einem kommerziell erhältlichen, polyklonalen Ovalbuminantikörper (abcam, US) inkubiert und nach Standardprotokoll analysiert (siehe 2.6.15). Abb. 3.13: Westernblot von 7 ausgewählten Klonen Dieser Westernblot zeigt das Fehlen der beiden Banden bei einer Laufhöhe von 37 kD in den Wildtypproben (CEA17 und D1.41), die dem Fusionskonstrukt ovacit entsprechen. Die Analyse erfolgte mit einem polyklonalen α-Ovalbumin Antikörper. Dieser Westernblot zeigt, dass das Fusionskonstrukt auch auf Proteinebene nachgewiesen werden konnte. Der polyklonale Ovalbuminantikörper hat an das trunkierte Hühnereiweiß gebunden, welches in einem 37 kD großen Komplex mit dem Citrin vorlag. Diese Struktur wurde in allen untersuchten Klonen detektiert, nicht aber in den beiden WT Stämmen. Nach Abgleich der molekularbiologischen mit den mikroskopischen Daten wurde der Klon 2 als repräsentativ eingestuft und fortan unter der Bezeichnung A. fumigatus D1.41ΔOvaCit für die weitergehenden Untersuchungen verwendet. 105 Ergebnisse 3.1.4 Charakterisierung durch in vitro T-Zellproliferationsassays Als erste funktionale Tests des transgenen Stammes schlossen sich in vitro TZellproliferationsassays an. In mehreren Versuchen war es nicht möglich eine spezifische Teilung der transgenen T-Zellen (OT-I, OT-II oder Do11.10) bei Einsatz intakter Konidien zu erzielen. Erst durch die enzymatische Entfernung der Zellwand, bzw. durch die völlige Lyse der Pilzsporen konnte die Fähigkeit des transgenen Pilzes demonstriert werden, eine antigenspezifische T-Zellteilung zu induzieren. a) b) 3,5 5 % proliferierende T-Zellen % proliferierende T-Zellen 3 2,5 2 1,5 1 4 3 2 1 0,5 0 0 1·10^4 1·10^3 1·10^2 1·10^1 Anzahl eingesetzte Protoplasten WT D1.41ΔOvaCit 1 μl 0,1 μl 0,01 μl 0,001 μl Volumen eingesetztes Pilzlysat WT D1.41ΔOvaCit Abb. 3.14: Antigenspezifische T-Zellproliferation nach Induktion durch die APC Präsentation von D1.41ΔOvaCit Fragmenten a) In einen T-Zellproliferationsansatz nach Standardprotokoll (siehe 2.7.6) wurden 1·104, 1·103, 1·102 oder 1·101 Protoplasten pro Well einer 96-Well-Zellkulturplatte nach Entfernung ihrer Zellwand durch einstündige Glukanasebehandlung eingesetzt und die prozentuale Zellproliferation nach 120 Stunden Inkubation bei 37°C bestimmt. b) In diesen Proliferationsansatz nach Standardprotokoll wurden 1 μl, 0,1 μl, 0,01 μl oder 0,001 μl zytoplasmatische Zellfraktion (gewonnen aus je 1 ml gemörsertem Myzel nach WB-Protokoll 2.6.15) pro Well einer 96-Well-Zellkulturplatte eingesetzt und die prozentuale Zellproliferation nach 120 Stunden Inkubation bei 37°C bestimmt. Sowohl bei Einsatz von Protoplasten, als auch bei Induktion durch die zytoplasmatische Zellfraktion war, verglichen mit den WT Proben, eine deutlich stärkere TZellteilung bei Verwendung von transgenem Material zu erkennen. Dass die beobachteten Effekte auf das eingesetzte Pilzmaterial zurückzuführen war konnte dadurch gezeigt werden, dass sich die Proliferation durch Titration an die WT Proben angleichen ließ. 106 Ergebnisse 3.2 Infektionsstudien Nach der abgeschlossenen Charakterisierung des A. fumigatus D1.41ΔOvaCit wurde dieser Stamm direkt in Infektionsstudien eingesetzt, um zu überprüfen, ob auch hier die erwarteten ovalbuminspezifischen Immunreaktionen zu beobachten sind. Zuvor wurde getestet, ob sich unter unseren Bedingungen generell spezifische TZellen nach CFSE Färbung und adoptiven Transfer in genetisch identische Empfängermäuse durch intranasale Applikation von gelöstem Ovalbumin zur in vivo Proliferation anregen lassen. 3.2.1 Induktion einer spezifischen T-Zellproliferation durch unterschiedliche Applikationen von gelöstem Ovalbumin Um zu klären, ob dieses immunologische Modell generell funktioniert wurden am Tag vor der Ovalbuminapplikation T-Zellrezeptor transgene T-Zellen aus OT-I, OTII oder Do11.10 Mäusen isoliert, CFSE gefärbt und im Anschluss adoptiv in genetisch kompatible Empfängertiere zurückgeführt. In den ersten Versuchen wurde einen Tag später eine Ovalbuminlösung i.v. oder s.c injiziert und drei Tage später mehrere lymphatische Organe (inguinale LK, Thymus, bronchoalveoläre LK, Payers Patches, renale LK, Leber, Milz, popliteale LK, mesenteriale LK, cervicale LK, axilläre LK) durchflusszytometrisch auf eine TZellproliferation untersucht. 107 popliteale LK Milz Leber renale LK Payers Patches 108 LK bronchoalveolärer Thymus inguinaler LK Ergebnisse Forward/Side Scatter CD4-APC CD8-PE Ergebnisse CD4-APC CD8-PE axilläre LK cervicale LK mesenteriale LK Forward/Side Scatter Abb. 3.15: T-Zellproliferationsassay nach subkutaner Ovalbumininjektion Diese durchflusszytometrischen Daten visualisieren die T-Zellteilung in verschiedenen immunologisch relevanten Geweben einer C57/Bl.6 Maus am Tag +3 nach subkutaner Ovalbuminapplikation. Am Tag -1 wurde der Maus adoptiv CFSE gefärbte CD4+ (OT-II) und CD8+ T-Zellen (OT-I) transferiert. In der Leber und dem Thymus wurden nach diesen Applikationsformen in mehreren Wiederholungen nur sehr wenig CFSE positive T-Zellen wieder gefunden und in den Payers Patches konnte keine Proliferation nachgewiesen werden. In allen anderen sekundären, lymphatischen Organen war die Zellteilung sehr gut detektierbar. Diese Ergebnisse waren konsistent für das C57/Bl.6 – OT-I/II und das Balb/c – Do11.10 Mausmodell. Im Folgenden wurde das C57/Bl.6 – OT-I/II Modell verwendet, da dies die Möglichkeit bot, CD4+ und CD8+ T-Zellen parallel zueinander zu beobachten. Es sollte als nächstes untersucht werden, ob diese spezifische Immunantwort auch nach i.n. Applikation des Ovalbumins einsetzt. Hierzu wurden nach 2.7.6.2 die T-Zellen am Tag vor der Antigengabe CFSE gefärbt, adoptiv transferiert und einen Tag später die Ovalbuminlösung zusammen mit dem Adjuvanz CpG auf die Nasenspitze der vorbereiteten Tiere geträufelt. Drei Tage später erfolgte die FACS Analyse folgender Organe: inguinale LK, bronchoalveoläre LK, Payers Patches, Milz, 109 Ergebnisse popliteale LK, cervicale LK, Lunge und dem NALT als erstes Immungewebe, welches mit dem Antigen in Berührung kommt. LK NALT cervicale LK popliteale LK Milz Payers Patches bronchoalveolärer inguinaler LK Forward/Side Scatter 110 CD4-APC CD8-PE Ergebnisse CD4-APC CD8-PE Lunge Forward/Side Scatter Abb. 3.16: T-Zellproliferationsassay nach intranasaler Ovalbumingabe Diese durchflusszytometrischen Daten visualisieren die T-Zellteilung am Tag +3 nach intranasaler Ovalbuminapplikation. Am Tag -1 wurden den Mäusen adoptiv CFSE gefärbte CD4+ und CD8+ TZellen transferiert. Es ist deutlich zu erkennen, dass in den kopf- und atmungstraktassoziierten lymphatischen Geweben eine spezifische Immunreaktion in Form einer TZellproliferation ablief. Diese Proliferation war auch ohne Adjuvanzbehandlung detektierbar, allerdings in einem schwächeren Ausmaß (ungezeigte Daten). Im NALT kam es auch in mehreren Wiederholungen des Experiments zu keiner Zellteilung. 3.2.2 Infektion unter Immunsuppression durch Gr-1 Depletion (Neutropenie) Wie unter 2.7.6.2 beschrieben wurden am Tag vor der Infektion CFSE gefärbte OT-I (CD8+) und OT-II (CD4+) T-Zellen adoptiv in eine C57/Bl.6 Maus transferiert und die Mäuse durch Injektion von anti-Gr-1 Antikörper immunsupprimiert. Am Tag der Infektion wurden aus diesen vorbehandelten Tieren zwei Dreiergruppen gebildet, wobei eine mit D1.41 WT Konidien intranasal infiziert wurde und die andere mit Konidien des transgenen Pilzes D1.41ΔOvaCit. Die Tiere wurden täglich auf ihren Gesundheitsstaus hin observiert und am Tag +3 und +4 nach Infektion wurden aus je einer Maus die Milz, die inguinalen und die cervikalen Lymphknoten präpariert und nach Herstellung einer Zellsuspension die enthaltenen T-Zellen durchflusszytometrisch auf Proliferation untersucht. Als Vergleichsgruppe diente eine völlig unbehandelte Dreiergruppe (keine Immunsuppression, keine Infektion). 111 Ergebnisse a) 23 22 Gewicht in g 21 20 19 18 17 -2 -1 0 1 2 3 4 Tage nach Infektion Gruppe 1: nicht immunsupprimiert, nicht infiziert Gruppe 2: A. fumigatus D1.41ΔOvaCit + Immunsuppression Gruppe 3: A. fumigatus WT + Immunsuppression b) Gruppe 2 ing LK Gruppe 1 Milz Gruppe 1 cerv LK Gruppe 1 ing LK Forward/Side Scatter 112 CD4-PE CD8-APC 5 Ergebnisse CD4-PE CD8-APC Gruppe 3 Milz Gruppe 3 cerv LK Gruppe 3 ing LK Gruppe 2 Milz Gruppe 2 cerv LK Forward/Side Scatter Abb. 3.17: T-Zellproliferationsassay nach intranasaler Infektion bei Gr-1-Depletion Gruppe 1: nicht immunsupprimiert, nicht infiziert; Gruppe 2: Gr-1 Depletion, infiziert mit transgenem Pilz; Gruppe 3: Gr-1 Depletion, infiziert mit WT Pilz. a) Gewichtskurven der drei Gruppen als Mittel der jeweils lebenden Tiere. b) Durchflusszytometrische Proliferationsmessung der T-Zellen am Tag +4 nach Infektion. Deutlich zu erkennen ist, dass es sowohl nach Infektion mit dem transgenen Pilz, als auch mit dem WT Pilz zu einer Proliferation von CD4+ und CD8+ T-Zellen kam. Um den Einfluss der Immunsuppression an der Proliferation zu ermitteln wurde das Experiment noch einmal wiederholt, wobei auch die unbehandelte Vergleichsgruppe durch anti-Gr-1 Applikation immunsupprimiert, allerdings nicht infiziert wurde. 113 Ergebnisse a) 25 24 23 Gewicht in g 22 21 20 19 18 17 16 15 -2 -1 0 1 2 3 4 Tage nach Infektion Gruppe 1: nicht infiziert Gruppe 2: A. fumigatus D1.41ΔOvaCit + Immunsuppression Gruppe 3: A. fumigatus WT + Immunsuppression b) Gruppe 2 ing LK Gruppe 1 Milz Gruppe 1 cerv LK Gruppe 1 ing LK Forward/Side Scatter 114 CD4-PE CD8-APC 5 Ergebnisse CD4-PE CD8-APC Gruppe 3 Milz Gruppe 3 cerv LK Gruppe 3 ing LK Gruppe 2 Milz Gruppe 2 cerv LK Forward/Side Scatter Abb. 3.18: T-Zellproliferationsassay nach intranasaler Infektion bei Gr-1-Depletion Gruppe 1: GR-1 Depletion, nicht infiziert; Gruppe 2: Gr-1 Depletion, infiziert mit transgenem Pilz; Gruppe 3: Gr-1 Depletion, infiziert mit WT Pilz. a) Gewichtskurven der drei Gruppen als Mittel der jeweils lebenden Tiere. b) Durchflusszytometrische Proliferationsmessung der T-Zellen am Tag +3 nach Infektion. In diesem Versuch ist deutlich zu erkennen, dass es nach Depletion von Gr-1 positiven Zellen auch in nicht infizierten Tieren zu einer unspezifischen TZellproliferation kam, womit diese Art der Immunsuppression für diese Experimente im Folgenden nicht mehr anwendbar war. 115 Ergebnisse 3.2.3 Infektion ohne Immunsuppression Nach (Rivera et al. 2006) ist es möglich in murinen Infektionsstudien eine spezifische T-Zellantwort in immunkompetenten Mäusen hervorzurufen. Somit wurde der transgene Stamm A. fumigatus D1.41ΔOvaCit nachfolgend in immunkompetenten Mäusen auf seine Fähigkeit getestet ovalbuminspezifische T-Zellen zur Proliferation anzuregen. Für diese Experimente wurden am Tag vor der Infektion CFSE gefärbte CD4+ TZellen (OT-II) adoptiv in genetisch kompatible Empfängertiere transferiert und diese einen Tag später infiziert. In Anlehnung an (Rivera et al. 2006) wurden die Gruppen sechs Tage observiert und an den Tagen +4, +5 und +6 auf spezifische T-Zellproliferation in Milz, zervikalen und inguinalen Lymphknoten untersucht. Abb. 3.19 zeigt ein repräsentatives Experiment, in dem neben frisch geernteten Konidien (1·107/Maus) aus einer Stocklösung auch geschwollene und damit immunogener wirkende Konidien (1·105/Maus) getestet werden. a) 20,5 20 Gewicht in g 19,5 19 18,5 18 17,5 17 16,5 -1 0 1 2 3 4 Tage nach Infektion Gruppe 1: nicht infiziert Gruppe 2: A. fumigatus D1.41ΔOvaCit Gruppe 3: A. fumigatus WT Gruppe 4: A. fumigatus D1.41ΔOvaCit swollen Conidia Gruppe 5 A. fumigatus WT swollen Conidia 116 5 Gruppe 3 ing LK Gruppe 4 ing LK Gruppe 3 cerv LK Gruppe 4 cerv LK Gruppe 2 cerv LK Gruppe 1 cerv LK Gruppe 2 ing LK Gruppe 1 ing LK Forward/Side Scatter Gruppe 2 Milz Gruppe 1 Milz Ergebnisse b) CD4-PE Forward/Side Scatter CD4-PE 117 Ergebnisse Forward/Side Scatter CD4-PE Gruppe 4 Milz CD4-PE Gruppe 5 Milz Gruppe 5 cerv LK Gruppe 5 ing LK Gruppe 3 Milz Forward/Side Scatter Abb. 3.19: T-Zellproliferationsassay nach intranasaler Infektion ohne Immunsuppression Gruppe 1: nicht infiziert; Gruppe 2: infiziert mit ruhenden Konidien des transgenen Pilzes; Gruppe 3: infiziert mit ruhenden Konidien des WT Pilzes; Gruppe 4: infiziert mit geschwollen Konidien des transgenen Pilzes, Gruppe 5: infiziert mit geschwollenen Konidien des WT Pilzes. a) Gewichtskurven der fünf Gruppen als Mittel der jeweils lebenden Tiere. b) Durchflusszytometrische Proliferationsmessung der T-Zellen am Tag +6 nach Infektion. (E0965) 118 Ergebnisse Bei Verwendung immunkompetenter Mäuse ließ sich in vier Wiederholungen des Experiments unter diesen Bedingungen keine eindeutige T-Zellproliferation hervorrufen. Um die Möglichkeit auszuschließen, dass es sich hierbei um Probleme bei der Prozessierung von Konidien durch APCs nach intranasaler Infektion handelt wurden anschließend noch einmal modifizierte Infektionen mit Variationen in der Konidienmenge, dem Applikationsweg und der Beschaffenheit des Proteinmaterials durchgeführt. Abb. 3.20 zeigt die Daten zu diesem Versuch, in dem neben einer Positiv- (Ovalbumin intranasal, Gruppe 1) und einer Negativkontrolle (PBS intranasal, Gruppe 2) folgende Parameter verändert wurden: − Gruppen 3+4: retrobulbäre i.v. Infektion mit Konidien (5·105 Konidien/Maus) − Gruppen 5+6: i.n. Infektion (2·108 Konidien/Maus) − Gruppen 7+8: i.n. Applikation von 30 μl zytoplasmatischer Zellfraktion (siehe 2.6.15) − Gruppen 9+10: retrobulbäre i.v. Applikation von 30 μl zytoplasmatischer Zellfraktion (siehe 2.6.15) Pro Parameter sind immer 2 Gruppen aufgeführt, da jeweils der WT Stamm gegen den transgenen A. fumigatus D1.41ΔOvaCit getestet wurde. Gruppe 2 ing LK Gruppe 2 cerv LK Forward/Side Scatter Gruppe 1 ing LK CD4-PE Gruppe 1 cerv LK Forward/Side Scatter CD4-PE 119 Gruppe 6 Milz Gruppe 5 Milz Gruppe 6 cerv LK Gruppe 5 cerv LK Gruppe 6 ing LK Gruppe 5 ing LK Gruppe 4 Milz Gruppe 3 Milz Gruppe 4 cerv LK Gruppe 3 cerv LK Gruppe 4 ing LK Gruppe 3 ing LK Gruppe 2 Milz Gruppe 1 Milz Ergebnisse Forward/Side Scatter 120 CD4-PE Forward/Side Scatter CD4-PE Gruppe 10 Milz Gruppe 9 Milz Gruppe 10 cerv LK Gruppe 9 cerv LK Gruppe 10 ing LK Gruppe 9 ing LK Gruppe 8 Milz Gruppe 7 Milz Gruppe 8 cerv LK Gruppe 7 cerv LK Gruppe 8 ing LK Gruppe 7 ing LK Ergebnisse Forward/Side Scatter CD4-PE Forward/Side Scatter CD4-PE Æ Legende siehe nächste Seite 121 Ergebnisse Abb. 3.20: T-Zellproliferationsassay nach unterschiedlichen Varianten der Infektion ohne Immunsuppression Gruppe 1: Ovalbumin intranasal; Gruppe 2: PBS intranasal; Gruppe 3: infiziert mit WT Konidien i.v.; Gruppe 4: infiziert mit transgenen Konidien i.v.; Gruppe 5: infiziert mit WT Konidien intranasal (2·108); Gruppe 6: infiziert mit transgenen Konidien intranasal (2·108); Gruppe 7: Pilzlysat (WT Pilz) intranasal; Gruppe 8: Pilzlysat (transgener Pilz) intranasal; Gruppe 9: Pilzlysat (WT Pilz) i.v.; Gruppe 10: Pilzlysat (transgener Pilz) i.v. Durchflusszytometrische Proliferationsmessung der T-Zellen am Tag +5 nach Infektion. In diesem Experiment war zu erkennen, dass die Ovalbuminkontrolle positiv ausfiel, dass aber erneut unter keinen anderen Bedingungen eine T-Zellproliferation detektierbar war. Als letzter Versuch sollte überprüft werden, ob der Effekt der ausbleibenden Immunantwort gegebenenfalls durch die verwendete Mauslinie zu begründen ist. Korrespondierend mit dem C57/Bl.6 – OT-II System wurden hier am Tag vor der Infektion CD4+ T-Zellen aus Do11.10 Mäusen isoliert, CFSE gefärbt und adaptiv in Balb/c Tiere transferiert. Eine Tag später wurden die Mäuse mit WT Konidien, transgenen Konidien und PBS als Negativkontrolle i.n. infiziert und für 6 Tage beobachtet. a) 20,5 20 Gewicht in g 19,5 19 18,5 18 17,5 17 16,5 -2 -1 0 1 2 3 4 Tage nach Infektion Gruppe 1: nicht infiziert Gruppe 2: A. fumigatus D1.41ΔOvaCit Gruppe 3: A. fumigatus WT 122 5 6 Gruppe 3 Milz Gruppe 3 cerv LK Gruppe 3 ing LK Gruppe 2 Milz Gruppe 1 Milz Gruppe 2 cerv LK Gruppe 1 cerv LK Gruppe 2 ing LK Gruppe 1 ing LK Ergebnisse b) Forward/Side Scatter CD4-PE Forward/Side Scatter CD4-PE Æ Legende siehe nächste Seite 123 Ergebnisse Abb. 3.21: T-Zellproliferationsassay nach intranasaler Infektion ohne Immunsuppression in Balb/c Mäusen Gruppe 1: nicht infiziert; Gruppe 2: infiziert mit Konidien des transgenen Pilzes; Gruppe 3: infiziert mit Konidien des WT Pilzes a) Gewichtskurven der drei Gruppen als Mittel der jeweils lebenden Tiere. b) Durchflusszytometrische Proliferationsmessung der T-Zellen am Tag +6 nach Infektion. (E0977) Auch nach Verwendung eines anderen Mausmodells konnte keine, durch den ovalbuminsynthetisierenden Pilz hervorgerufene, spezifische T-Zellantwort in sekundären, lymphatischen Organen nachgewiesen werden. 124 Ergebnisse 3.3 Imaging 3.3.1 In vitro Widefield-Mikroskopie Die in vitro Fluoreszensmikroskopie in Kollagengelen sollte die Interaktionen zwischen dendritischen Zellen als APC und Konidien des Aspergillusstamms D1.41ΔOvaCit näher charakterisieren. Abb. 3.22: Phagozytose einer D1.41ΔOvaCit Konidie durch eine dendritische Zelle im Kollagengel Die dendritischen Zellen wurden aus knochenmarksisolierten Monozyten gewonnen und am Tag +7 nach in vitro Reifung mit frisch geernteten Konidien des Stamms D1.41ΔOvaCit im Verhältnis von 1:10 in ein Kollagengel eingebettet. Über einen Zeitraum von sechs Stunden wurden Zell-ZellInteraktionen und Phagozytosevorgänge bei einer 600fachen Vergrößerung beobachtet. Nach 2.8.2 wurden diese Interaktionsstudien über einen Zeitraum von sechs Stunden angefertigt. In diesen Filmen ist gut zu erkennen, dass der in dieser Arbeit generierte A. fumigatus Stamm, verglichen mit dem WT (Behnsen et al. 2007), unverändert mit dendritischen Zellen interagieren und von diesen phagozytiert werden kann. Filme aus diesem Experiment befinden sich in voller Länge auf der beigefügten CD-Rom (Filmbeispiele 2 und 3). 125 Ergebnisse 3.3.2 Rasterelektronenmikroskopie von infizierten Mauslungen Durch die Technik der Elektronenmikroskopie sollten in Kooperation mit Manfred Rohde (HZI Braunschweig) erste Einblicke in eine infizierte Mauslunge gewonnen werden. Es sollten der Zustand und die Lokalisation der Konidien visualisiert werden und ein besonderes Augenmerk wurde auf bereits kurz nach der Infektion sichtbare Immunzellen gelegt. In dem ersten Experiment wurden Mäuse nach einer leichten Isoflurannarkose mit 1·107 Konidien intranasal infiziert und augenblicklich, bzw. nach vier Stunden die Lungen präpariert und für die Mikroskopie vorbereitet. In diesem Versuchsansatz waren keine Konidien oder andere Auffälligkeiten in den Atmungsorganen festzustellen, so dass das Experiment mit einer intratrachealen Infektion nach 2.8.1 wiederholt wurde. Diesmal waren deutliche Konidienanhäufungen in dem Lungengewebe zu erkennen und in Dünnschnitten waren sogar Zellen des Immunsystems mit internalisierten Konidien visualisierbar. a) b) c) d) 126 Ergebnisse e) f) Abb. 3.23: Rasterelektronenmikroskopie von infizierten Mauslungen Die Bilder zeigen elektronenmikroskopische Aufnahmen von Mauslungen, die vier Stunden zuvor mit WT Aspergillus fumigatus Sporen infiziert wurden. a) Alveolarraum mit Ansammlungen an Konidien; b) blau eingefärbte Konidien und c) Konidien in Originalton, die in die Epithelwand „einsinken“; d) und e) Dünnschnitte, in denen Phagozyten (rot eingefärbt) mit internalisierten Konidien zu erkennen sind; f) eine in das Epithel „eingesunkene“ Konidie im Dünnschnitt Diese Bilder bestätigen die in vitro Ergebnisse unseres Labors, dass es bereits sehr zeitig nach Eintritt der Pilzsporen in das Lungengewebe zu einer heftigen Phagozytoseaktivität von Immunzellen der ersten Verteidigungslinie kommt. Bereits vier Stunden nach Infektion sind Phagozyten, wahrscheinlich Alveolarmakrophagen, zu erkennen die sehr aktiv Konidien aufgenommen haben (Abb. 3.23, d) und e)). dendritische Zellen waren zu diesem frühen Zeitpunkt noch nicht zu erkennen. Zusätzlich war ein sehr auffälliges „Einsinken“ der Konidien in die Epithelwand zu erkennen (Abb. 3.23, b), c) und f)). Dieser Effekt ist bislang unbeschrieben und es muss in weiterführenden Experimenten untersucht werden, ob er eine immunologische Relevanz besitzt. 127 Ergebnisse 3.4 Immunisierungsexperimente Es sollte abschließend getestet werden, ob sich durch gezielte Induktion einer spezifischen Immunantwort eine Protektion gegen eine invasive Aspergillose im Mausmodell erreichen lässt. Nach Literaturrecherche haben Mitarbeiter der AG Dübel (TU Braunschweig) drei verschiedene Gene von immunogenen Proteinen isoliert, diese in E. coli überexprimiert und aus dem Kulturüberstand aufgereinigt. Die exakte Information über die Identität der Proteine ist Gegenstand von Patentansprüchen der AG Dübel und kann erst nach erfolgter Anmeldung und Publikation der Ergebnisse preisgegeben werden. Bei den Proteinen handelt es sich um ein GPI-zelloberflächenverankertes Antigen, nachfolgend Protein 2 genannt und zwei intrazelluläre Antigene, bezeichnet mit Protein 1 und Protein 3. In Vorexperimenten konnte gezeigt werden, dass das oberflächenlokalisierte Protein 2 im Gegensatz zu den intrazellulär vorkommenden Proteinen 1 und 3 eine protektive Tendenz bei der Immunisierung von Mäusen aufwies. Dementsprechend wurde dieses Protein in einem weiteren Versuch nach 2.7.7 der Negativkontrolle mit PBS gegenübergestellt. Als Immunsuppressionen wurden zum einen die Gr-1 Depletion und zum anderen die Cortisonbehandlung (5 mg/s.c. Injektion) verwendet. Am Tag t-33 erfolgte die initiale Immunisierung mit 50 µg Protein pro Tier und am Tag t-19 wurde diese wiederholt (Boost). Tab. 3.2: Prozentuale Überlebenszahlen nach Immunisierung mit den Protein 2 Zu erkennen sind die Prozentwerte an überlebenden Mäusen in den unterschiedlich immunisierten und immunsupprimierten Gruppen. Tag nach Immunisierung Protein 2 immunisiert PBS immunisiert 128 0 1 2 3 4 7 CA Immunsuppression 100 100 40 40 10 0 Gr-1 Depletion 100 100 100 100 100 100 CA Immunsuppression 100 100 22,2 22,2 11,1 11,1 Gr-1 Depletion 100 100 40 20 20 20 Ergebnisse Überlebenszahlen in % 100 80 60 40 20 0 0 1 2 3 4 5 6 7 8 Tag nach Infektion Protein 2 CA Protein 2 Gr.1 PBS CA PBS Gr.1 Abb. 3.25: Überlebenskurve nach Immunisierung mit Protein 2 und verschiedenen Arten der Immunsuppression Dargestellt ist die Anzahl an überlebenden Tiere nach Infektion in %. Die ersten beiden Gruppen wurden im Vorfeld mit dem rekombinant hergestellten Protein 2 immunisiert und die letzten beiden Gruppen mit PBS als Negativkontrolle. In den Gruppen 1+3 und 2+4 wurden jeweils die unterschiedlichen Immunsuppressionsmethoden gegenübergestellt, also die Cortisonacetattherapie und die Gr-1 Depletion. Diese Daten verdeutlichen, dass eine Immunisierung von Mäusen mit dem Protein 2 zu einem Impfschutz bei der Etablierung einer Aspergillus-Infektion in einem neutropenischen Tier führt. Bei einer generellen Suppression des Immunsystems durch Cortisonacetat hingegen ist der protektive Effekt nicht mehr nachzuweisen. 129 Diskussion und Ausblick 4 Diskussion und Ausblick Bereits in anderen Organismen wurde Ovalbumin alleine (Chen and Jenkins 1999) und als Fusionskonstrukt in Kombination mit einem Fluoreszenzprotein (Bumann 2001a; Bumann 2001b) als Modellantigen eingesetzt, um adoptiv transferierte, transgene T-Zellen in WT Empfängertieren zur Proliferation anzuregen und damit eine genaue Analyse der T-Zellaktivierung bei der Etablierung einer spezifischen Infektion zu ermöglichen. In den ersten Experimenten dieser Arbeit konnte deutlich gezeigt werden, dass das Modellantigen Ovalbumin in gelöster Form, intranasal appliziert, eine spezifische T-Zellaktivierung in den kopfassoziierten, drainierenden Lymphknoten zur Folge hatte. Besonders in den cervikalen und den bronchoalveolären Lymphknoten war eine überzeugende Zellproliferation darstellbar. Unerwartet war der Befund, dass sich in den Immungeweben der Nase (NALT) in mehreren Wiederholungen keine T-Zellteilung nachweisen ließ. Dies ist möglicherweise erklärbar durch die Ergebnisse einer Untersuchung, die zeigte, dass intranasale Applikation von Ovalbumin Toleranz hinsichtlich einer Th1/Th2 Antwort in Mäusen hervorruft (Unger et al. 2003). Generell ist das NALT durch den direkten Kontakt zur Umwelt permanenter Antigenpräsenz ausgesetzt, wodurch Toleranzinduktion in diesem Bereich eine sehr gravierende Rolle spielt. Würde ein solcher Effekt ausbleiben, liefen stetig Inflammationsprozesse in diesem Teil der Immungewebe ab (Hall et al. 2003). In dieser Hinsicht ähnelt das NALT offenbar dem GALT, dem Immunsystem des Verdauungstrakts (Par 2000; Song and Whitacre 2001). Nachdem gezeigt war, dass das Modellsystem prinzipiell funktioniert, wurde der transgene A. fumigatus Stamm D1.41ΔOvaCit hergestellt. Durch die Kontrollexperimente zur Charakterisierung dieses Stamms wurde gezeigt, dass der Pilz das Fusionskonstrukt „trunkiertes Ovalbumin:Citrin“ exprimierte. Einen ersten Beweis lieferten die Mikroskopiedaten, die zweifelsfrei belegten, dass der Pilzstamm das gelbe Fluoreszenzprotein Citrin synthetisierte. Da das Citrin den C-terminalen Teil des Fusionsproteins darstellte konnte davon ausgegangen werden, dass der Nterminal lokalisierte Ovalbuminrest von dem Pilz ebenfalls translatiert wurde. Die erfolgreiche Synthese des Fusionskonstruktes wurde auf genetischer Ebene durch eine PCR mit spezifischen Primern und einem Southernblot verifiziert, in dem das 130 Diskussion und Ausblick gesamte Protein mit einer radioaktiv markierten Sonde genomisch integriert detektiert wurde. Durch den Einsatz eines polyklonalen α-Ovalbumin Antikörpers wurde in einem Immunoblot das mögliche Fehlen des trunkierten Ovalbumins, z.B. aufgrund einer posttranslationalen Proteinmodifikation, ausgeschlossen. Mit intakten Konidien blieb in in vitro Versuchen der Beweis aus, dass das Konstrukt funktionell, T-Zell aktivierend, in dem Pilz exprimiert wurde. Erst durch eine Lyse der Zellwand und den Einsatz der extrahierten, zytoplasmatischen Proteinfraktion aus Hyphen konnte gezeigt werden, dass durch eine DC Präsentation des spezifischen Ovalbuminpeptids transgene T-Zellen zur Teilung angeregt wurden. Bis zum Ende der Arbeit konnte allerdings keine Funktionalität des Konstrukts in vivo nachgewiesen werden. In den ersten Experimenten wurden Mäuse durch Depletion Gr-1 positiver Zellen immunsupprimiert. Durch i.v. Injektion des Antikörpers RB6-8C5 (Tepper, Coffman, and Leder 1992) wurden neutrophile Granulozyten eliminiert, die positiv für den Oberflächenmarker Ly6G waren. Diese Standardmethode, die auch in zahlreichen anderen Publikationen zur Erzeugung einer Neutropenie verwendet wurde (Mednick et al. 2003; Tateda et al. 2001; Bliss et al. 2001) führte allerdings auch zu einer Depletion anderer Zellsubpopulationen. So wurde bereits 1993 gezeigt, dass der RB6-8C5 Antikörper auch an das Oberflächenmolekül Ly6C bindet (Fleming, Fleming, and Malek 1993), welches neben Granulozyten auch auf dendritischen Zellen und Untergruppen von Monozyten, Makrophagen und Leukozyten zu finden ist (Hestdal et al. 1991; Jutila, Kurk, and Jutila 1994; Kung et al. 1991; Jutila et al. 1988; Shortman and Naik 2007). Neben der Erzeugung einer Neutropenie führte die RB6-8C5 Behandlung somit auch zu einer Depletion von Gr1+/CD11b+ myeloiden Suppressorzellen (Makarenkova et al. 2006; Dietlin et al. 2005), die die äußerst wichtige Aufgabe besitzen, eine unkontrollierte, unspezifische T-Zellproliferation im lebenden Tier zu unterdrücken. Als Folge war eine massive T-Zellteilung in allen lymphatischen Organen, auch der nicht infizierten, aber immunsupprimierten Kontrolltiere zu erkennen. Eine aktuelle Veröffentlichung zeigt einen proinflammatorischen Effekt durch erhöhte TNF-α Ausschüttung nach Neutrophilendepletion durch Injektion des RB6-8C5 Antikörpers und verweist ebenfalls auf ungewollte Immunzelleffekte durch diese Art der Immunsuppression (Daley et al. 2008). Eine Messung der T-Zellaktivierung war in diesem Modell folglich nicht möglich. 131 Diskussion und Ausblick 2005 konnten Rivera et al. (Rivera et al. 2005) zeigen, dass Aspergillusspezifische CD4+ Antworten in transgenen, immunkompetenten Mäusen nach intratrachealer Infektion detektierbar sind. Basierend auf diesem Ergebnis wurden die nachfolgenden Infektionsexperimente dieser Arbeit ebenfalls in immunkompetenten Tieren durchgeführt, wobei die intranasale Infektionsroute beibehalten wurde, um eine möglichst natürliche Infektion zu simulieren. Unter diesen Bedingungen konnte allerdings in keinem Experiment eine spezifische T-Zellteilung nachgewiesen werden. Evtl. war die Anzahl an Konidien, die von antigenpräsentierenden Zellen prozessiert wurden zu gering. Bei einer intranasalen Infektion mussten die eindringenden Pathogene eine lange Strecke durch enge, verwinkelte Luftwege überwinden, die auf nahezu gesamter Länge mit Mukosa ausgekleidet sind (Gomez and Prince 2008). Diese mechanischen Barrieren verhinderten bereits zu einem großen Teil das Eindringen der Sporen in den Alveolarraum. Elektronenmikroskopiebilder (nicht gezeigt) belegten, dass nach einer intranasalen Infektion nahezu keine Sporen in der Lunge wieder zu finden waren. In immunkompetenten Mäusen trafen die sehr wenigen, Ovalbumin enthaltenden Sporen im Anschluss auf die Hauptabwehrlinie des Immunsystems gegen eine Aspergillus-Infektion (Latge 1999; Denning 1998), welche mit Alveolarmakrophagen und neutrophilen Granulozyten hauptsächlich aus Zellen des angeborenen Immunsystems bestanden. Die Hauptaufgabe dieser Zellen besteht darin, eingedrungene Pathogene durch Phagozytose und durch Ausschüttung reaktiver Sauerstoffspezies und antimikrobieller Enzyme direkt zu eliminieren (Mizgerd 2008). Bei dieser Art der Abwehr kommt es nur zu einer sehr schwachen Form der Antigenpräsentation durch Makrophagen (Gordon 2007). Der Großteil der Konidien wurde somit vermutlich durch Bestandteile des angeborenen Immunsystems eliminiert, ohne dass der adaptive Teil involviert wurde. Möglicherweise war lediglich ein geringer Prozentsatz an dendritischen Zellen in der Lage, Pilzsporen aus dem Alveolarlumen aufzunehmen, um als professionelle APC Bruchstücke des enthaltenen Ovalbumins zu präsentieren. Gegebenenfalls lag die auf diese Weise präsentierte Peptidmenge unter einem kritischen Limit, was dazu führte, dass keine spezifische Immunreaktion detektierbar war. Um eine spezifische T-Zellantwort messen zu können muss der Pilz wahrscheinlich intratracheal appliziert werden, wie es in anderen Arbeiten bereits erfolgreich praktiziert wurde (Rivera et al. 2006). Der Effekt der geringen Antigenaufnahme durch APC könnte noch dadurch ver132 Diskussion und Ausblick stärkt worden sein, dass zytoplasmatische Proteine durch APC schlechter prozessiert werden als Oberflächenmoleküle. Unter den bisher bekannten Aspergillus Antigenen kommen sowohl intra-, als auch extrazelluläre Proteine vor (Crameri et al. 2006) und es wurden erste Daten veröffentlicht, in denen gezeigt wurde, dass Mäuse mit Hilfe eines zytoplasmatischen, peroxisomalen Membranproteins (Asp f 3) (Hemmann, Blaser, and Crameri 1997) gegen eine Aspergillus-Infektion geschützt werden konnten (Ito et al. 2006). Allerdings belegen die Beobachtungen aus dieser Arbeit, dass eine spezifische T-Zellantwort in vitro erst nach Lyse der Pilzstrukturen und Einsatz der zytoplasmatischen Proteinfraktion nachgewiesen werden konnte. Des Weiteren existieren andere Veröffentlichungen, die Antigene, deren Struktur Zellwandbestandteilen von Aspergillus fumigatus ähneln, beschreiben, um in murinen Tiermodellen eine Protektion gegen den Pilz zu erzielen (Torosantucci et al. 2005; Cassone and Torosantucci 2006). Das erste beschriebene Aspergillusantigen, Asp f 1(Arruda et al. 1990), und das als Hauptantigen angesehene Asp f 2 (Banerjee et al. 1999) sind in einer Infektionssituation als Zellsekrete ebenfalls extrazellulär lokalisiert und die Vorversuche zu dem Immunisierungsteil dieser Arbeit zeigten das oberflächenlokalisierte Protein 2 ebenfalls einen besseren Schutz vermittelte, als die beiden zytoplasmatischen Proteine. Die These, dass intrazelluläre Proteine von professionellen, antigenpräsentierenden Zellen schlechter prozessiert und präsentiert werden, muss auf jeden Fall noch weiter untersucht werden, um eine definitive Aussage treffen zu können. Es existieren aber Hinweise auf diesen Umstand und das Phänomen könnte in Zusammenhang mit den generell sehr wenigen Konidien, die bei einer intranasalen Infektion in der Lunge mit APC in Kontakt kommen erklären, weshalb keine in vivo Proliferation von spezifischen T-Zellen gezeigt werden konnte. Für die Zukunft ist eine andere Variante des Pilzes notwendig. Es müssen Pilzstämme generiert werden, die das Modellantigen auf ihrer Zelloberfläche tragen. Als Strategie empfiehlt sich, das Ovalbumin als Fusionskonstrukt mit dem RODAProtein zu exprimieren. RODAp kodiert die Aminosäuresequenz für ein konidienlokalisiertes Hydrophobin (Paris et al. 2003). Hydrophobine sind stäbchenförmige Proteine auf der Zelloberfläche verschiedener Pilze, die für ihren stark wasserabweisenden Charakter verantwortlich sind. Durch diese Lokalisation des Modellantigens soll versucht werden, die bisher ausbleibende spezifische Immunantwort zu aktivieren, indem es für professionelle APC leichter zu prozessieren ist. Zusätzlich 133 Diskussion und Ausblick ist es sinnvoll, neben dem Fusionskonstrukt „trunkiertes Ovalbumin:Citrin“ auch Einzelvarianten der Proteine herzustellen, um auszuschließen, dass es durch das Fusionieren zu unerwünschten Effekten, wie posttranslationale Modifikationen in dem Pilz kommt. Des Weiteren sollte in zukünftigen Arbeiten, eine intratracheale Infektion mit der bisher verwendeten intranasalen Route verglichen werden, um eventuelle Toleranzeffekte auszuschließen und generelle eine größere Pilzmasse in die Lungen einzubringen. Der zweite sehr wichtige Fokus dieser Arbeit sollte die Frage beleuchten, ob durch Ausnutzung einer spezifischen Immunantwort eine Protektion von Mäusen gegen eine invasive Aspergillose erzielt werden kann. In der Literatur findet man viele Aussagen, die die Dringlichkeit einer Vakzinierung gegen Aspergillus fumigatus unterstreichen (Bellocchio et al. 2005; Casadevall and Pirofski 2005; Feldmesser 2005; Segal et al. 2006; Stevens 2004). Die Herausforderung bei dieser Art der Immunisierung liegt in dem Immunstatus der Patienten. Menschen, die sich in dem Risiko befinden, eine (invasive) Aspergillus-Infektion zu erlangen, weisen in der Regel eine distinkte Schwächung des Immunsystems auf und eine Impfung muss deshalb so gewählt werden, dass der geschwächte Teil des Abwehrsystems keinen Einfluss auf den Erfolg der Immunisierung hat. Die Idee einer Impfung gegen diese Art der Infektion ist aus zweierlei Gründen sehr reizvoll: Ein großer Teil der Patienten, die sich in dem Risiko befinden, eine invasive Aspergillus-Infektion zu erlangen werden künstlich, z.B. durch eine Chemotherapie oder eine Immunsuppression zu Verhinderung einer Transplantatabstoßung in den Zustand der Immunschwäche versetzt. Da der Zeitpunkt dieser Immunschwächephase sehr gut kalkulierbar ist, könnte in großen Teilen dieser Patienten ein Impfschutz aufgebaut werden bevor es zu der Immunschwächung kommt. Zum anderen müsste durch die Impfung nicht einmal ein kompletter Schutz gegen den Pilz erzielt werden. Eine Unterstützung des Immunsystems zur Verlangsamung des Pilzwachstums bis sich die Effekte der Immunsuppression zurückgebildet haben würde in vielen Fällen ausreichen. Beispielsweise sollte ein funktionierendes Immunsystem nach der Erholung von einer Neutropenie (z.B. nach einer Knochenmarkstransplantation) in der Lage sein, eine nicht invasive Pilzmasse bis zu einem bestimmten Ausmaß an Wachstum vollständig zu eliminieren (Stevens 2004). Dass eine Vakzinierung überhaupt möglich und sinnvoll ist wurde dadurch bestätigt, dass Mäuse, die eine 134 Diskussion und Ausblick sublethale Infektion überstanden hatten im Anschluss gegen eine Reinfektion geschützt waren (Cenci et al. 1997; de et al. 1993; Lehmann and White 1976). Die Hauptfrage beschäftigt sich nun damit, auf welche Art eine vernünftige Vakzinierung durchgeführt werden kann. In verschiedenen Publikationen wurde gezeigt, dass homogenisiertes Pilzmaterial einen ausreichenden Impfschutz erzielte (Cenci et al. 2000; Richard, Peden, and Sacks 1991; Richard et al. 1982; Ito and Lyons 2002). Untersuchungen mit anderen pathogenen Pilzarten haben allerdings verdeutlicht, dass ein aus komplettem Pilzmaterial bestehender Impfstoff in Menschen wahrscheinlich nicht anwendbar wäre, da das Vorkommen diverser Mykotoxine in einem solchen, undefinierten Proteingemisch zu großen Komplikationen führt (Pappagianis 1993; Pappagianis and Levine 1975; Pappagianis et al. 1979). Aus diesem Grund wurden in dieser Arbeit, in Kooperation mit der AG Prof. Dr. Stefan Dübel (TU Braunschweig) rekombinante, genau definierte Antigene auf ihre Fähigkeit getestet, einen Impfschutz in Mäusen hervorzurufen. Unter den Proteinen befanden sich zwei intrazellulär exprimierte Antigene und ein zellmembranverankertes Molekül. In einleitenden Experimenten lieferten die beiden intrazellulär lokalisierten Proteine keinen detektierbaren Schutz. Lediglich das Oberflächenprotein vermittelte eine Immunität gegen eine intranasale Infektion von neutropenischen Tieren. Dieser Befund deutet darauf hin, dass die Impfung gegen Oberflächenstrukturen von Aspergillus fumigatus schnell und effektiv zu einer protektiven Immunantwort führen kann, die auch 19 Tage nach der zweiten Immunisierung für einen zuverlässigen Schutz gegen eine Infektion sorgte. Weitere Arbeiten müssen nun, den Typ der induzierten Immunität klären. Wie aus den gezeigten Daten ersichtlich sind die Tiere nach Immunisierung unter neutropenischen Bedingungen gegen eine Infektion geschützt. Induziert man vor der Infektion jedoch eine generelle Immunsuppression durch repetitive Behandlung mit Cortisonacetat, so scheint die protektive Wirkung der Immunisierung aufgehoben zu sein. Dieses Phänomen deutet auf einen zellvermittelten Mechanismus hin. Viele Forschungsergebnisse beschreiben die Induktion einer protektiven Th1 Antwort durch eine Aspergillus fumigatus Infektion bei gleichzeitiger Unterdrückung einer Th2 Reaktion (Cenci et al. 1997; Clemons and Stevens 2001; Clemons et al. 2000), wobei dieser Effekt bei einer parallelen Behandlung mit Th1 dirigierenden, proinflammatorischen Zytokinen noch verstärkt werden konnte (Stevens 1998; Vora et al. 1998). Es ist durchaus denkbar, dass unser verwendetes Protein2 die 135 Diskussion und Ausblick Generierung von Th1 Gedächtniszellen induzierte und somit einen Impfschutz durch die effektive Aktivierung der T-Zell-vermittelten Immunität lieferte. Bereits vor einigen Jahren konnte in Mausmodellen gezeigt werden, dass durch adoptiven Transfer von induzierten Th1 Zellen ein Impfschutz in Mäusen hervorgerufen werden konnte (Cenci et al. 2000). Zur Klärung dieser Situation müssen daher analoge Zelltransferexperimente durchgeführt werden. Auf der anderen Seite könnte der Effekt auch antikörpervermittelt sein oder aus einer Kombination von humoraler und zellulärer Immunantwort bestehen. Für diese These sprechen Immunfluoreszenzbilder der AG Dübel, in denen eine deutliche Opsonisierung von Pilzmaterial mit spezifischen Antikörpern aus den Immunseren geimpfter Tiere nachgewiesen werden konnte. In der Fachliteratur findet man häufig Hinweise, dass der humorale Arm des Immunsystems lediglich eine untergeordnete Rolle bei der natürlichen Bekämpfung einer Aspergillus-Infektion spielt (Clemons and Stevens 2001). Allerdings zeigen neuere Ergebnisse, dass Antikörper durchaus Effekte bei der Modulation von Immunantworten während der Aspergillusbekämpfung haben (Montagnoli et al. 2003; Cenci et al. 2002). In der Therapie von Cryptococcus- und Candidaerkrankungen werden bereits monoklonale Antikörper eingesetzt (Stevens et al. 2000; Moragues et al. 2003) und bereits im Jahr 1979 wurde die schützende Wirkung von transferiertem Immunserum in einem murinen Aspergillus Infektionsmodell beschrieben (Kisch, Echols, and Maydew 1979). Ob die in der vorliegenden Arbeit beobachteten Impfeffekte eine humorale Ursache haben, muss daher in Immunserumtransferexperimenten verifiziert werden. Neben Antikörpern könnten eventuell auch lösliche PPR (pattern recognition receptor), wie das unter anderem von Neutrophilen und Makrophagen, aber auch Endothelzellen und Fibroblasten sezernierte PTX3 eine wichtige Rolle spielen (Jaillon et al. 2007; Mantovani, Garlanda, and Bottazzi 2003). Die Entwicklung einer erfolgreichen Impfstrategie gegen Aspergillus-Infektionen ist nach wie vor eines der Hauptbestandteile aktueller immunologisch/mykologischer Forschung. Diese Art der klinischen Erkrankungen sind in der Therapie enorm kostenintensiv und führen dennoch häufig zum Tod der Patienten (Denning 1998). Bis heute befinden sich keine Impfmedikamente gegen den ubiquitär vorkommenden Schimmelpilz in einer klinischen Testphase (Stevens 2004). Der letzte Teil der vorliegenden Arbeit befasste sich mit der Visualisierung des 136 Diskussion und Ausblick Pilzes in Infektionssituationen. Zunächst konnte die Darstellung des transgenen Pilzes sowohl in einem 2-Photonensystem, als auch unter Widefieldbedingungen bestätigt und auf die Fluoreszenz des Citrins zurückgeführt werden. Nach Wachstum unter in vitro Kulturbedingungen wurden erfolgreich 3-D Rekonstruktionen von Myzelmasse erstellt, die verdeutlichten, dass eine Analyse von Zell-Zell-Kontakten mit Bestandteilen des Immunsystems generell möglich ist. Diese Phagozytosevorgänge wurden in einem in vitro Kollagengelsystem nachgestellt und bewiesen, dass der in dieser Arbeit generierte Aspergillus Stamm keine Unterschiede bezüglich phagozytischer Immunreaktionen im Vergleich zu anderen Stämmen aufwies (Behnsen et al. 2007). Hinsichtlich der Mikroskopiestudien bleibt allerdings festzuhalten, dass die Fluoreszenz des D1.41ΔOvaCit nicht ausreichte, um Immunvorgänge gegen den Pilz in einer infizierten Mauslunge darzustellen. Offensichtlich war der GAPDH-Promotor in Konidien nicht sehr aktiv, so dass die Expression des Citrins ebenfalls relativ schwach ausfiel. Hinzu kam eine deutliche Autofluoreszenz des Lungengewebes, die die Detektion der Sporen ebenfalls stark beeinträchtigte. Zusätzlich ist zu erwähnen, dass mit dem vorhandenen 2-Photonensystems das Citrin nur ineffektiv angeregt werden kann. Das 2-P Absorptionsmaximum dieses Proteins liegt bei ca. 950 nm (Heikal et al. 2000), wobei der integrierte Laser eine maximale Wellenlänge von 900 nm generieren konnte. Wie bereits für das Modellantigen Ovalbumin diskutiert muss in zukünftigen Arbeiten die Expression des Fluoreszenzproteins optimiert werden. Auch hierfür ist eine Fusion mit dem RODAp sehr viel versprechend. Dieses Protein ist in hoher Anzahl auf der Oberfläche von Konidien lokalisiert (Paris et al. 2003). Da es nach einer Infektion in erster Linie zu Immunreaktionen gegen die Pilzsporen kommt, ist es sinnvoll diese Strukturen fluoreszenzmikroskopisch zugänglich zu machen. Des Weiteren müssen das Problem der Fluoreszenzdetektion vor dem Hintergrund der Gewebe- Autofluoreszenz und die Effektivität der Fluorochromanregung gelöst werden. Für beide Probleme bietet sich die Verwendung eines Proteins mit anderer Anregungswellenlänge an. Die Verwendung eine GFP- oder CFP-Derivats könnte die Visualisierung des Pilzes in dem bereits bestehenden 2-Photonensystem ermöglichen, wobei aktuelle Veröffentlichungen zeigen, dass gerade DsRed Abkömmlinge extrem hell erscheinen (Shcherbo et al. 2007; Merzlyak et al. 2007). Für rote Fluoreszenzfarbstoffe muss allerdings das Mikroskopiesystem mit einem Laser 137 Diskussion und Ausblick ausgestattet werden, der in der Lage ist, Anregungswellenlängen bis etwa 1100 nm zu generieren (Jakobs et al. 2000). Unsere Arbeitsgruppe arbeitet schon länger an der Thematik, Immunzellvorgänge im lebenden Organismus zu visualisieren. Hierbei kam es bereits zu mehreren Veröffentlichungen, die Mechanismen in Lymphknoten beschrieben (Reichardt, Dornbach, and Gunzer 2007; Reichardt et al. 2007; Gunzer et al. 2005; Gunzer et al. 2004). Die Mikroskopie der Lunge gestaltete sich insofern schwierig, als dass es sich bei diesem Organ um das Atmungsorgan handelt, welches auch in einem anästhesierten Tier in permanenter Bewegung ist. Diese Bewegung verursachte massive Fokusschwankungen, durch die eine Mikroskopie mit der derzeitigen apparativen Ausstattung nicht möglich war. Um dieses Problem zu lösen kommen unterschiedliche Strategien in Frage: Zum einen soll versucht werden, die Atmungsbewegung mit einer Bewegung des fokussierenden Objektivs über Piezoelemente zu synchronisieren. Die zweite zu testende Möglichkeit ist, den zu filmenden Lungenbereich physikalisch, zum Beispiel durch Auflegen eines dünnen Glasplättchens zu fixieren. Eine weitere Alternative ist, das Lungengewebe durch einen stetigen Gasstrom permanent gedehnt zu halten und so die Atmungsbewegungen zu umgehen. Welche dieser Möglichkeiten sich am praktikabelsten erweist muss in Zukunft getestet werden. Bislang existieren keine Veröffentlichungen, die eine solche „live imaging“ Methode im Lungengewebe beschreiben. Allerdings ist die Lunge als Eintrittsort vieler Fremdpartikel und damit Pathogene ein zentraler Ort für Immunzellvorgänge (Mizgerd 2008) und damit hochinteressant für die Entwicklung einer beschreibenden und analysierenden Methodik. 138 Summary 5 Summary Aspergillus fumigatus is an ubiquitous mould with airborne spores which are inhaled in large numbers by each air breathing organism every day. In healthy persons, these inhaled conidia are immediately eliminated by components of the innate immune system, mainly by alveolar macrophages and PMN (Polymorphonuclear leukocytes). However, individuals with an impaired immune status are often targets of a pathogenic attack of the fungus. Costs for antimycotic therapies are extremely high and the outcome of an antifungal treatment is still very poor. Thus there is a strong need for new therapeutic strategies. Despite the efficiency of the innate immune system also the adaptive immunity plays an important role in the clearance of a pathogenic Aspergillus colonization. To improve the understanding of T-cell behavior towards an A. fumigatus infection in this study a transgenic fungal strain (D141ΔOvaCit), expressing a protein fusion construct consisting of the hen egg white protein ovalbumin as a model antigen and the fluorescent protein Citrin (EYFP) was generated. This construct was expressed under control of the glyceraldehyde-3-phosphate dehydrogenase (GAPDH) promotor. By different molecular and in vitro approaches the occurrence of the model antigen inside the fungal strain was demonstrated. Ovalbumin was detectable on genomic and protein level and by processing conidial lysate of the transgenic fungus dendritic cells were able to drive T-cell receptor transgenic OT-II T-cells into proliferation. After including this strain in in vivo T-cell proliferation assays it became clear that it was not suitable for these kind of experiments. Besides the finding that the GAPDH promoter is not strongly enough activated in resting spores, immunization experiments of this study pointed out that the intracellular localization of the fusion construct might not be ideal for an effective immune response, including the presentation of the ovalbumin. The infection of mice in this study was performed by intranasal application of a freshly harvested conidia suspension. Electron microscopy data from this study revealed that the use of this infection route resulted in a very small spore number in the lungs which also could have contributed to the ineffective activation of the adoptively transferred T-cells. 139 Summary The fluorescent protein Citrin was incorporated into the transgenic fungal strain to allow microscopic observations of immune reactions towards the fungus in relevant tissues, i.e. the lung. The data generated in this work clearly show that D141ΔOvaCit expresses a well detectable fluorescence signal. It is shown that this strain can be used for analysis in either fluorescence-Widefield-microscopy or 2photon-microscopy and that clear 3-D reconstructions of the fungal mycelium can be obtained from microscopic data. Because of the strong auto fluorescence of the lung tissue the strain appeared not to be bright enough for intravital imaging so that a de novo generation of the construct with an altered expression system has to be realized. In the last part of this thesis the question was addressed if it is possible to protect mice from a normally lethal Aspergillus infection by inducing a specific immune reaction in advance. We succeeded in immunizing mice against a novel cell surface restricted antigen of A. fumigatus. Where in the mock control group almost all animals died within seven days, a 100% survival rate was generated by vaccination with this protein. The main future task is to clarify the underlying immune response. The impact of either Th cells or antibodies on this effect has to be evaluated and finally the possibility of adapting this immunization to a human (clinical) setting has to be investigated. 140 Referenzliste Referenzliste Bücher und Schriftliche Veröffentlichungen in wissenschaftlichen Journalen Arancibia, S. A. et al., "Toll-like receptors are key participants in innate immune responses," Biol.Res. 40 (2): 97-112 (2007). Arroyo, J. et al., "The GPI-anchored Gas and Crh families are fungal antigens," Yeast 24 (4): 289-296 (2007). Arruda, L. K. et al., "Aspergillus fumigatus allergen I, a major IgE-binding protein, is a member of the mitogillin family of cytotoxins," J.Exp.Med. 172 (5): 1529-1532 (1990). Banerjee, B. et al., "Conformational and linear B-cell epitopes of Asp f 2, a major allergen of Aspergillus fumigatus, bind differently to immunoglobulin E antibody in the sera of allergic bronchopulmonary aspergillosis patients," Infect.Immun. 67 (5): 2284-2291 (1999). Barnden, M. J. et al., "Defective TCR expression in transgenic mice constructed using cDNA-based alpha- and beta-chain genes under the control of heterologous regulatory elements," Immunol Cell Biol. 76 (1): 34-40 (1998). Beauvais, A. et al., "Two alpha(1-3) glucan synthases with different functions in Aspergillus fumigatus," Appl.Environ.Microbiol. 71 (3): 1531-1538 (2005). Beffa, T. et al., "Mycological control and surveillance of biological waste and compost," Med.Mycol. 36 Suppl 1: 137-145 (1998). Behnsen, J. et al., "Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans," PLoS.Pathog. 3 (2): e13 (2007). Bellocchio, S. et al., "Immunity to Aspergillus fumigatus: the basis for immunotherapy and vaccination," Med.Mycol. 43 Suppl 1: S181-S188 (2005). Bellocchio, S. et al., "The contribution of the Toll-like/IL-1 receptor superfamily to innate and adaptive immunity to fungal pathogens in vivo," J.Immunol 172 (5): 3059-3069 (2004). Bernard, M. and J. P. Latge, "Aspergillus fumigatus cell wall: composition and biosynthesis," Med.Mycol. 39 Suppl 1: 9-17 (2001). Beutler, B. et al., "Genetic analysis of host resistance: Toll-like receptor signaling and immunity at large," Annu.Rev.Immunol 24: 353-389 (2006). 141 Referenzliste Bignell, E. et al., "The Aspergillus pH-responsive transcription factor PacC regulates virulence," Mol.Microbiol. 55 (4): 1072-1084 (2005). Bliss, S. K. et al., "Neutrophil depletion during Toxoplasma gondii infection leads to impaired immunity and lethal systemic pathology," Infect.Immun. 69 (8): 4898-4905 (2001). Bolard, J., "How do the polyene macrolide antibiotics affect the cellular membrane properties?," Biochim.Biophys.Acta 864 (3-4): 257-304 (1986). Borges-Walmsley, M. I. and A. R. Walmsley, "cAMP signalling in pathogenic fungi: control of dimorphic switching and pathogenicity," Trends Microbiol. 8 (3): 133-141 (2000). Bouchara, J. P. et al., "Interactions between Aspergillus fumigatus and host matrix proteins," Contrib.Microbiol. 2: 167-181 (1999). Brajtburg, J. and J. Bolard, "Carrier effects on biological activity of amphotericin B," Clin.Microbiol.Rev. 9 (4): 512-531 (1996). Brakhage, A. A., "Systemic fungal infections caused by Aspergillus species: epidemiology, infection process and virulence determinants," Curr.Drug Targets. 6 (8): 875-886 (2005). Brakhage, A. A. and B. Liebmann, "Aspergillus fumigatus conidial pigment and cAMP signal transduction: significance for virulence," Med.Mycol. 43 Suppl 1: S75-S82 (2005). Bumann, D., "In vivo visualization of bacterial colonization, antigen expression, and specific T-cell induction following oral administration of live recombinant Salmonella enterica serovar Typhimurium," Infect.Immun. 69 (7): 46184626 (2001a). Bumann, D., "Regulated antigen expression in live recombinant Salmonella enterica serovar Typhimurium strongly affects colonization capabilities and specific CD4(+)-T-cell responses," Infect.Immun. 69 (12): 7493-7500 (2001b). Caillot, D. et al., "Improved management of invasive pulmonary aspergillosis in neutropenic patients using early thoracic computed tomographic scan and surgery," J.Clin.Oncol. 15 (1): 139-147 (1997). Campbell, N. A. 1998. Biologie. 4 ed.Spektrum, Akad. Verlag. Casadevall, A., M. Feldmesser, and L. A. Pirofski, "Induced humoral immunity and vaccination against major human fungal pathogens," Curr.Opin.Microbiol. 5 (4): 386-391 (2002). Casadevall, A. and L. A. Pirofski, "Feasibility and prospects for a vaccine to prevent cryptococcosis," Med.Mycol. 43 (8): 667-680 (2005). Cassone, A. and A. Torosantucci, "Opportunistic fungi and fungal infections: the challenge of a single, general antifungal vaccine," Expert.Rev.Vaccines. 5 142 Referenzliste (6): 859-867 (2006). Cenci, E. et al., "T cell vaccination in mice with invasive pulmonary aspergillosis," J.Immunol. 165 (1): 381-388 (2000). Cenci, E. et al., "Protection of killer antiidiotypic antibodies against early invasive aspergillosis in a murine model of allogeneic T-cell-depleted bone marrow transplantation," Infect.Immun. 70 (5): 2375-2382 (2002). Cenci, E. et al., "Th1 and Th2 cytokines in mice with invasive aspergillosis," Infect.Immun. 65 (2): 564-570 (1997). Chen, Z. M. and M. K. Jenkins, "Clonal expansion of antigen-specific CD4 T cells following infection with Salmonella typhimurium is similar in susceptible (Itys) and resistant (Ityr) BALB/c mice," Infect.Immun. 67 (4): 2025-2029 (1999). Chryssanthou, E., "In vitro susceptibility of respiratory isolates of Aspergillus species to itraconazole and amphotericin B. acquired resistance to itraconazole," Scand.J.Infect.Dis. 29 (5): 509-512 (1997). Clark, T. A. and R. A. Hajjeh, "Recent trends in the epidemiology of invasive mycoses," Curr.Opin.Infect.Dis. 15 (6): 569-574 (2002). Clemons, K. V. et al., "Role of IL-10 in invasive aspergillosis: increased resistance of IL-10 gene knockout mice to lethal systemic aspergillosis," Clin.Exp.Immunol 122 (2): 186-191 (2000). Clemons, K. V. and D. A. Stevens, "Overview of host defense mechanisms in systemic mycoses and the basis for immunotherapy," Semin.Respir.Infect. 16 (1): 60-66 (2001). Coukell, A. J. and R. N. Brogden, "Liposomal amphotericin B. Therapeutic use in the management of fungal infections and visceral leishmaniasis," Drugs 55 (4): 585-612 (1998). Crameri, R., "Epidemiology and molecular basis of the involvement of Aspergillus fumigatus in allergic diseases," Contrib.Microbiol. 2: 44-56 (1999). Crameri, R. et al., "Disease-specific recombinant allergens for the diagnosis of allergic bronchopulmonary aspergillosis," Int.Immunol. 10 (8): 1211-1216 (1998). Crameri, R. et al., "Structural aspects and clinical relevance of Aspergillus fumigatus antigens/allergens," Med.Mycol. 44: 261-267 (2006). d'Enfert, C., "Selection of multiple disruption events in Aspergillus fumigatus using the orotidine-5'-decarboxylase gene, pyrG, as a unique transformation marker," Curr.Genet. 30 (1): 76-82 (1996). Daley, J. M. et al., "Use of Ly6G-specific monoclonal antibody to deplete neutrophils in mice," J.Leukoc.Biol. 83 (1): 64-70 (2008). 143 Referenzliste de, Repentigny L. et al., "Acquired immunity in experimental murine aspergillosis is mediated by macrophages," Infect.Immun. 61 (9): 3791-3802 (1993). Denning, D. W., "Therapeutic outcome in invasive aspergillosis," Clin.Infect.Dis. 23 (3): 608-615 (1996). Denning, D. W., "Invasive aspergillosis," Clin.Infect.Dis. 26 (4): 781-803 (1998). Denning, D. W. et al., "NIAID Mycoses Study Group Multicenter Trial of Oral Itraconazole Therapy for Invasive Aspergillosis," Am.J.Med. 97 (2): 135-144 (1994). Denning, D. W. and D. A. Stevens, "Antifungal and surgical treatment of invasive aspergillosis: review of 2,121 published cases," Rev.Infect.Dis. 12 (6): 1147-1201 (1990). Dietlin, T. A. et al., "T cell expansion is regulated by activated Gr-1+ splenocytes," Cell Immunol. 235 (1): 39-45 (2005). Doerschuk, C. M., "Mechanisms of leukocyte sequestration in inflamed lungs," Microcirculation. 8 (2): 71-88 (2001). Doonan, J. H. et al., "A cDNA encoding rabbit muscle protein phosphatase 1 alpha complements the Aspergillus cell cycle mutation, bimG11," J.Biol.Chem. 266 (28): 18889-18894 (1991). Eisendle, M. et al., "The siderophore system is essential for viability of Aspergillus nidulans: functional analysis of two genes encoding l-ornithine N 5monooxygenase (sidA) and a non-ribosomal peptide synthetase (sidC)," Mol.Microbiol. 49 (2): 359-375 (2003). Feldmesser, M., "Prospects of vaccines for invasive aspergillosis," Med.Mycol. 43 (7): 571-587 (2005). Filler, S. G. and D. C. Sheppard, "Fungal invasion of normally non-phagocytic host cells," PLoS.Pathog. 2 (12): e129 (2006). Fleming, R. V., T. J. Walsh, and E. J. Anaissie, "Emerging and less common fungal pathogens," Infect.Dis.Clin.North Am. 16 (4): 915-vii (2002). Fleming, T. J., M. L. Fleming, and T. R. Malek, "Selective expression of Ly-6G on myeloid lineage cells in mouse bone marrow. RB6-8C5 mAb to granulocytedifferentiation antigen (Gr-1) detects members of the Ly-6 family," J.Immunol. 151 (5): 2399-2408 (1993). Fortwendel, J. R. et al., "A fungus-specific ras homolog contributes to the hyphal growth and virulence of Aspergillus fumigatus," Eukaryot.Cell 4 (12): 19821989 (2005). Fresenius, G. 1863. Beiträge zur Mykologie. Frankfurt a.M.: Brönner. Friedl, P., A. T. den Boer, and M. Gunzer, "Tuning immune responses: diversity and adaptation of the immunological synapse," Nat.Rev.Immunol. 5 (7): 144 Referenzliste 532-545 (2005). Garlanda, C. et al., "Non-redundant role of the long pentraxin PTX3 in anti-fungal innate immune response," Nature 420 (6912): 182-186 (2002). Gil, M. L. et al., "Binding of extracellular matrix proteins to Aspergillus fumigatus conidia," Infect.Immun. 64 (12): 5239-5247 (1996). Gomez, M. I. and A. Prince, "Airway epithelial cell signaling in response to bacterial pathogens," Pediatr.Pulmonol. 43 (1): 11-19 (2008). Gordon, S., "The macrophage: past, present and future," Eur.J.Immunol 37 Suppl 1: S9-17 (2007). Grant, S. M. and S. P. Clissold, "Itraconazole. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in superficial and systemic mycoses," Drugs 37 (3): 310-344 (1989). Gross, O. et al., "Card9 controls a non-TLR signalling pathway for innate antifungal immunity," Nature 442 (7103): 651-656 (2006). Gunzer, M. et al., "Systemic administration of a TLR7 ligand leads to transient immune incompetence due to peripheral-blood leukocyte depletion," Blood 106 (7): 2424-2432 (2005). Gunzer, M. et al., "Antigen presentation in extracellular matrix: interactions of T cells with dendritic cells are dynamic, short lived, and sequential," Immunity. 13 (3): 323-332 (2000). Gunzer, M. et al., "A spectrum of biophysical interaction modes between T cells and different antigen-presenting cells during priming in 3-D collagen and in vivo," Blood 104 (9): 2801-2809 (2004). Haas, H., "Molecular genetics of fungal siderophore biosynthesis and uptake: the role of siderophores in iron uptake and storage," Appl.Microbiol.Biotechnol. 62 (4): 316-330 (2003). Haas, H. et al., "Characterization of the Aspergillus nidulans transporters for the siderophores enterobactin and triacetylfusarinine C," Biochem.J. 371 (Pt 2): 505-513 (2003). Hage, C. A., M. Goldman, and L. J. Wheat, "Mucosal and invasive fungal infections in HIV/AIDS," Eur.J.Med.Res. 7 (5): 236-241 (2002). Hall, G. et al., "Suppression of allergen reactive Th2 mediated responses and pulmonary eosinophilia by intranasal administration of an immunodominant peptide is linked to IL-10 production," Vaccine 21 (5-6): 549-561 (2003). Harrington, L. E., P. R. Mangan, and C. T. Weaver, "Expanding the effector CD4 T-cell repertoire: the Th17 lineage," Curr.Opin.Immunol 18 (3): 349-356 (2006). 145 Referenzliste Heikal, A. A. et al., "Molecular spectroscopy and dynamics of intrinsically fluorescent proteins: coral red (dsRed) and yellow (Citrine)," Proc.Natl.Acad.Sci.U.S.A 97 (22): 11996-12001 (2000). Hemmann, S., K. Blaser, and R. Crameri, "Allergens of Aspergillus fumigatus and Candida boidinii share IgE-binding epitopes," Am.J.Respir.Crit Care Med. 156 (6): 1956-1962 (1997). Hemmann, S. et al., "Differential IgE recognition of recombinant Aspergillus fumigatus allergens by cystic fibrosis patients with allergic bronchopulmonary aspergillosis or Aspergillus allergy," Eur.J.Immunol. 28 (4): 1155-1160 (1998). Hensel, M. et al., "The role of the Aspergillus fumigatus areA gene in invasive pulmonary aspergillosis," Mol.Gen.Genet. 258 (5): 553-557 (1998). Hestdal, K. et al., "Characterization and regulation of RB6-8C5 antigen expression on murine bone marrow cells," J.Immunol. 147 (1): 22-28 (1991). Hogquist, K. A., S. C. Jameson, and M. J. Bevan, "Strong agonist ligands for the T cell receptor do not mediate positive selection of functional CD8+ T cells," Immunity. 3 (1): 79-86 (1995). Hori, S., T. Nomura, and S. Sakaguchi, "Control of regulatory T cell development by the transcription factor Foxp3," Science 299 (5609): 1057-1061 (2003). Huffnagle, G. B., J. L. Yates, and M. F. Lipscomb, "Immunity to a pulmonary Cryptococcus neoformans infection requires both CD4+ and CD8+ T cells," J.Exp.Med. 173 (4): 793-800 (1991). Ibrahim-Granet, O. et al., "Methylcitrate synthase from Aspergillus fumigatus is essential for manifestation of invasive aspergillosis," Cell Microbiol. 10 (1): 134-148 (2008). Ito, J. I. and J. M. Lyons, "Vaccination of corticosteroid immunosuppressed mice against invasive pulmonary aspergillosis," J.Infect.Dis. 186 (6): 869-871 (2002). Ito, J. I. et al., "Vaccinations with Recombinant Variants of Aspergillus fumigatus Allergen Asp f 3 Protect Mice against Invasive Aspergillosis," Infect.Immun. 74 (9): 5075-5084 (2006). Jahn, B. et al., "Interaction of human phagocytes with pigmentless Aspergillus conidia," Infect.Immun. 68 (6): 3736-3739 (2000). Jaillon, S. et al., "The humoral pattern recognition receptor PTX3 is stored in neutrophil granules and localizes in extracellular traps," J.Exp.Med. 204 (4): 793-804 (2007). Jakobs, S. et al., "EFGP and DsRed expressing cultures of Escherichia coli imaged by confocal, two-photon and fluorescence lifetime microscopy," FEBS Lett. 479 (3): 131-135 (2000). 146 Referenzliste Janeway, C. A., P. Travers, and M. Walport. 2002. Immunologie. 5 ed.Spektrum Akademischer Verlag. Jutila, D. B., S. Kurk, and M. A. Jutila, "Differences in the expression of Ly-6C on neutrophils and monocytes following PI-PLC hydrolysis and cellular activation," Immunol.Lett. 41 (1): 49-57 (1994). Jutila, M. A. et al., "Ly-6C is a monocyte/macrophage and endothelial cell differentiation antigen regulated by interferon-gamma," Eur.J.Immunol. 18 (11): 1819-1826 (1988). Kamei, K. and A. Watanabe, "Aspergillus mycotoxins and their effect on the host," Med.Mycol. 43 Suppl 1: S95-S99 (2005). Kemper, C. and J. P. Atkinson, "T-cell regulation: with complements from innate immunity," Nat.Rev.Immunol 7 (1): 9-18 (2007). Kennedy, C. A. et al., "Impact of surgical treatment on paranasal fungal infections in bone marrow transplant patients," Otolaryngol.Head Neck Surg. 116 (6 Pt 1): 610-616 (1997). Kisch, A. L., R. M. Echols, and R. P. Maydew, "Protective efficacy of antifungal immunization in opportunistic murine pulmonary aspergillosis," Clin.Res. 27 (83) (1979). Klich, M. A., "Identification of clinically relevant aspergilli," Med.Mycol. 44: 127-131 (2006). Kontoyiannis, D. P. and G. P. Bodey, "Invasive aspergillosis in 2002: an update," Eur.J.Clin.Microbiol.Infect.Dis. 21 (3): 161-172 (2002). Kontoyiannis, D. P. and R. E. Lewis, "Antifungal drug resistance of pathogenic fungi," Lancet 359 (9312): 1135-1144 (2002). Krappmann, S., "Tools to study molecular mechanisms of Aspergillus pathogenicity," Trends Microbiol. 14 (8): 356-364 (2006). Krappmann, S. 2007. Pathogenicity Determinants and Allergens. In The Aspergilli: Genomics, Medical Aspects, Biotechnology, and Research Methods. Edited by S. Osmani and G. H. Goldman. Florida: CRC Press - Taylor and Francis Group. Krappmann, S. and G. H. Braus, "Nitrogen metabolism of Aspergillus and its role in pathogenicity," Med.Mycol. 43 Suppl 1: S31-S40 (2005). Kumar, R., T. Chugh, and S. N. Gaur, "Allergic Bronchopulmonary Aspergillosis A review," Indian J.Allergy Asthma Immunol 17 (2): 55-66 (2003). Kung, J. T. et al., "Subpopulations of CD8+ cytotoxic T cell precursors collaborate in the absence of conventional CD4+ helper T cells," J.Immunol. 146 (6): 1783-1790 (1991). 147 Referenzliste Latge, J. P., "Aspergillus fumigatus and aspergillosis," Clin.Microbiol.Rev. 12 (2): 310-350 (1999). Latge, J. P., "The cell wall: a carbohydrate armour for the fungal cell," Mol.Microbiol. 66 (2): 279-290 (2007). Lehmann, P. F. and L. O. White, "Acquired immunity to Aspergillus fumigatus," Infect.Immun. 13 (4): 1296-1298 (1976). Levitz, S. M., H. L. Mathews, and J. W. Murphy, "Direct antimicrobial activity of T cells," Immunol Today 16 (8): 387-391 (1995). Liebmann, B. et al., "cAMP signaling in Aspergillus fumigatus is involved in the regulation of the virulence gene pksP and in defense against killing by macrophages," Mol.Genet.Genomics 269 (3): 420-435 (2003). Liebmann, B. et al., "Deletion of the Aspergillus fumigatus lysine biosynthesis gene lysF encoding homoaconitase leads to attenuated virulence in a low-dose mouse infection model of invasive aspergillosis," Arch.Microbiol. 181 (5): 378-383 (2004a). Liebmann, B. et al., "The cyclic AMP-dependent protein kinase a network regulates development and virulence in Aspergillus fumigatus," Infect.Immun. 72 (9): 5193-5203 (2004b). Ma, L. L. et al., "CD8 T cell-mediated killing of Cryptococcus neoformans requires granulysin and is dependent on CD4 T cells and IL-15," J.Immunol 169 (10): 5787-5795 (2002). Maerker, C. et al., "Methylcitrate synthase from Aspergillus fumigatus. PropionylCoA affects polyketide synthesis, growth and morphology of conidia," FEBS J. 272 (14): 3615-3630 (2005). Makarenkova, V. P. et al., "CD11b+/Gr-1+ myeloid suppressor cells cause T cell dysfunction after traumatic stress," J.Immunol. 176 (4): 2085-2094 (2006). Mangan, P. R. et al., "Transforming growth factor-beta induces development of the T(H)17 lineage," Nature 441 (7090): 231-234 (2006). Mansour, M. K. and S. M. Levitz, "Interactions of fungi with phagocytes," Curr.Opin.Microbiol. 5 (4): 359-365 (2002). Mantovani, A., C. Garlanda, and B. Bottazzi, "Pentraxin 3, a non-redundant soluble pattern recognition receptor involved in innate immunity," Vaccine 21 Suppl 2: S43-S47 (2003). Marr, K. A. et al., "Differential role of MyD88 in macrophage-mediated responses to opportunistic fungal pathogens," Infect.Immun. 71 (9): 5280-5286 (2003). Mayer, A. K. and A. H. Dalpke, "Regulation of local immunity by airway epithelial cells," Arch.Immunol Ther.Exp.(Warsz.) 55 (6): 353-362 (2007). McNeil, M. M. et al., "Trends in mortality due to invasive mycotic diseases in the 148 Referenzliste United States, 1980-1997," Clin.Infect.Dis. 33 (5): 641-647 (2001). McWhinney, P. H. et al., "Progress in the diagnosis and management of aspergillosis in bone marrow transplantation: 13 years' experience," Clin.Infect.Dis. 17 (3): 397-404 (1993). Mednick, A. J. et al., "Neutropenia alters lung cytokine production in mice and reduces their susceptibility to pulmonary cryptococcosis," Eur.J.Immunol. 33 (6): 1744-1753 (2003). Merzlyak, E. M. et al., "Bright monomeric red fluorescent protein with an extended fluorescence lifetime," Nat.Methods 4 (7): 555-557 (2007). Mizgerd, J. P., "Acute lower respiratory tract infection," N.Engl.J.Med. 358 (7): 716-727 (2008). Monod, M. et al., "Secreted proteases from pathogenic fungi," Int.J.Med.Microbiol. 292 (5-6): 405-419 (2002). Monod, M., K. Jaton-Ogay, and U. Reichard, "Aspergillus fumigatus-secreted proteases as antigenic molecules and virulence factors," Contrib.Microbiol. 2: 182-192 (1999). Montagnoli, C. et al., "A role for antibodies in the generation of memory antifungal immunity," Eur.J.Immunol 33 (5): 1193-1204 (2003). Moragues, M. D. et al., "A monoclonal antibody directed against a Candida albicans cell wall mannoprotein exerts three anti-C. albicans activities," Infect.Immun. 71 (9): 5273-5279 (2003). Moutaouakil, M. et al., "Identification of the 33-kDa alkaline protease of Aspergillus fumigatus in vitro and in vivo," J.Med.Microbiol. 39 (5): 393-399 (1993). Murphy, K. M., A. B. Heimberger, and D. Y. Loh, "Induction by antigen of intrathymic apoptosis of CD4+CD8+TCRlo thymocytes in vivo," Science 250 (4988): 1720-1723 (1990). Natarajan, K. et al., "Transcriptional profiling shows that Gcn4p is a master regulator of gene expression during amino acid starvation in yeast," Mol.Cell Biol. 21 (13): 4347-4368 (2001). Nierman, W. C. et al., "Genomic sequence of the pathogenic and allergenic filamentous fungus Aspergillus fumigatus," Nature 438 (7071): 1151-1156 (2005). Nishida, S. et al., "Fungal metabolite gliotoxin targets flavocytochrome b558 in the activation of the human neutrophil NADPH oxidase," Infect.Immun. 73 (1): 235-244 (2005). Oberegger, H. et al., "Identification of members of the Aspergillus nidulans SREA regulon: genes involved in siderophore biosynthesis and utilization," Biochem.Soc.Trans. 30 (4): 781-783 (2002). 149 Referenzliste Paoletti, M. et al., "Evidence for sexuality in the opportunistic fungal pathogen Aspergillus fumigatus," Curr.Biol. 15 (13): 1242-1248 (2005). Pappagianis, D., "Evaluation of the protective efficacy of the killed Coccidioides immitis spherule vaccine in humans. The Valley Fever Vaccine Study Group," Am.Rev.Respir.Dis. 148 (3): 656-660 (1993). Pappagianis, D. et al., "Immunization of mice against coccidioidomycosis with a subcellular vaccine," Infect.Immun. 25 (1): 440-445 (1979). Pappagianis, D. and H. B. Levine, "The present status of vaccination against coccidioidomycosis in man," Am.J.Epidemiol. 102 (1): 30-41 (1975). Par, A., "Gastrointestinal tract as a part of immune defence," Acta Physiol Hung. 87 (4): 291-304 (2000). Paris, S. et al., "Conidial hydrophobins of Aspergillus fumigatus," Appl.Environ.Microbiol. 69 (3): 1581-1588 (2003). Parkhurst, M. R. and W. M. Saltzman, "Quantification of human neutrophil motility in three-dimensional collagen gels. Effect of collagen concentration," Biophys.J. 61 (2): 306-315 (1992). Perea, S. et al., "Prevalence of molecular mechanisms of resistance to azole antifungal agents in Candida albicans strains displaying high-level fluconazole resistance isolated from human immunodeficiency virus-infected patients," Antimicrob.Agents Chemother. 45 (10): 2676-2684 (2001). Petrikkos, G. and A. Skiada, "Recent advances in antifungal chemotherapy," Int.J.Antimicrob.Agents 30 (2): 108-117 (2007). Ramos, H. et al., "The polyene antibiotic amphotericin B acts as a Ca2+ ionophore in sterol-containing liposomes," Biochim.Biophys.Acta 982 (2): 303-306 (1989). Reichardt, P., B. Dornbach, and M. Gunzer, "The molecular makeup and function of regulatory and effector synapses," Immunol Rev. 218: 165-177 (2007). Reichardt, P. et al., "Naive B cells generate regulatory T cells in the presence of a mature immunologic synapse," Blood 110 (5): 1519-1529 (2007). Reiss, E. and P. F. Lehmann, "Galactomannan antigenemia in invasive aspergillosis," Infect.Immun. 25 (1): 357-365 (1979). Rex, J. H. et al., "In vivo interferon-gamma therapy augments the in vitro ability of chronic granulomatous disease neutrophils to damage Aspergillus hyphae," J.Infect.Dis. 163 (4): 849-852 (1991). Richard, J. L., W. M. Peden, and J. M. Sacks, "Effects of adjuvant-augmented germling vaccines in turkey poults challenged with Aspergillus fumigatus," Avian Dis. 35 (1): 93-99 (1991). Richard, J. L. et al., "Vaccination studies of aspergillosis in turkeys: subcutaneous 150 Referenzliste inoculation with several vaccine preparations followed by aerosol challenge exposure," Am.J.Vet.Res. 43 (3): 488-492 (1982). Ringden, O. et al., "High cure rate of invasive fungal infections in immunocompromised children using ambisome," Transplant.Proc. 26 (1): 175-177 (1994). Rivera, A. et al., "Innate immune activation and CD4+ T cell priming during respiratory fungal infection," Immunity. 25 (4): 665-675 (2006). Rivera, A. et al., "Distinct CD4+-T-cell responses to live and heat-inactivated Aspergillus fumigatus conidia," Infect.Immun. 73 (11): 7170-7179 (2005). Robertson, J. M., P. E. Jensen, and B. D. Evavold, "DO11.10 and OT-II T cells recognize a C-terminal ovalbumin 323-339 epitope," J.Immunol 164 (9): 4706-4712 (2000). Robinson, L. A. et al., "Pulmonary resection for invasive Aspergillus infections in immunocompromised patients," J.Thorac.Cardiovasc.Surg. 109 (6): 11821196 (1995). Roilides, E. et al., "Granulocyte-macrophage colony-stimulating factor and interferon-gamma prevent dexamethasone-induced immunosuppression of antifungal monocyte activity against Aspergillus fumigatus hyphae," J.Med.Vet.Mycol. 34 (1): 63-69 (1996). Roilides, E. et al., "Antifungal activity of elutriated human monocytes against Aspergillus fumigatus hyphae: enhancement by granulocyte-macrophage colony-stimulating factor and interferon-gamma," J.Infect.Dis. 170 (4): 894-899 (1994). Roilides, E. et al., "Prevention of corticosteroid-induced suppression of human polymorphonuclear leukocyte-induced damage of Aspergillus fumigatus hyphae by granulocyte colony-stimulating factor and gamma interferon," Infect.Immun. 61 (11): 4870-4877 (1993). Romani, L., "Immunity to fungal infections," Nat.Rev.Immunol. 4 (1): 1-23 (2004). Romani, L., F. Bistoni, and P. Puccetti, "Fungi, dendritic cells and receptors: a host perspective of fungal virulence," Trends Microbiol. 10 (11): 508-514 (2002). Romani, L., P. Puccetti, and F. Bistoni, "Interleukin-12 in infectious diseases," Clin.Microbiol.Rev. 10 (4): 611-636 (1997). Ruijter, G. J. and J. Visser, "Carbon repression in Aspergilli," FEMS Microbiol.Lett. 151 (2): 103-114 (1997). Ryckeboer, J. et al., "Microbiological aspects of biowaste during composting in a monitored compost bin," J.Appl.Microbiol. 94 (1): 127-137 (2003). Sakaguchi, S. et al., "Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases," J.Immunol 155 (3): 1151-1164 (1995). 151 Referenzliste Samson, R. A., "The genus Aspergillus with special regard to the Aspergillus fumigatus group," Contrib.Microbiol. 2: 5-20 (1999). Schiebler, T. H., W. Schmidt, and K. Zilles. 1999. Anatomie. 8 ed.Springer Verlag. Schrettl, M. et al., "Siderophore biosynthesis but not reductive iron assimilation is essential for Aspergillus fumigatus virulence," J.Exp.Med. 200 (9): 12131219 (2004). Segal, B. H. et al., "Immunotherapy for fungal infections," Clin.Infect.Dis. 42 (4): 507-515 (2006). Shcherbo, D. et al., "Bright far-red fluorescent protein for whole-body imaging," Nat.Methods 4 (9): 741-746 (2007). Shortman, K. and S. H. Naik, "Steady-state and inflammatory dendritic-cell development," Nat.Rev.Immunol. 7 (1): 19-30 (2007). Song, F. and C. C. Whitacre, "The role of the gut lymphoid tissue in induction of oral tolerance," Curr.Opin.Investig.Drugs 2 (10): 1382-1386 (2001). Spikes, S. et al., "Gliotoxin production in Aspergillus fumigatus contributes to hostspecific differences in virulence," J.Infect.Dis. 197 (3): 479-486 (2008). Staib, F. et al., "A notable Aspergillus from a mortal aspergilloma of the lung. New aspects of the epidemiology, serodiagnosis and taxonomy of Aspergillus fumigatus," Zentralbl.Bakteriol.A 247 (4): 530-536 (1980). Steele, C. et al., "The beta-glucan receptor dectin-1 recognizes specific morphologies of Aspergillus fumigatus," PLoS.Pathog. 1 (4): e42 (2005). Sterry, S. J. et al., "T cell receptor V alpha bias can be determined by TCR-contact residues within an MHC-bound peptide," Immunol Cell Biol. 73 (1): 89-94 (1995). Stevens, D. A., "Combination immunotherapy and antifungal chemotherapy," Clin.Infect.Dis. 26 (6): 1266-1269 (1998). Stevens, D. A., "Vaccinate against aspergillosis! A call to arms of the immune system," Clin.Infect.Dis. 38 (8): 1131-1136 (2004). Stevens, D. A. et al., "Combined treatment: antifungal drugs with antibodies, cytokines or drugs," Med.Mycol. 38 Suppl 1: 305-315 (2000). Suen, Y. K. et al., "Gliotoxin induces apoptosis in cultured macrophages via production of reactive oxygen species and cytochrome c release without mitochondrial depolarization," Free Radic.Res. 35 (1): 1-10 (2001). Tateda, K. et al., "Early recruitment of neutrophils determines subsequent T1/T2 host responses in a murine model of Legionella pneumophila pneumonia," J.Immunol. 166 (5): 3355-3361 (2001). Tekaia, F. and J. P. Latge, "Aspergillus fumigatus: saprophyte or pathogen?," 152 Referenzliste Curr.Opin.Microbiol. 8 (4): 385-392 (2005). Tepper, R. I., R. L. Coffman, and P. Leder, "An eosinophil-dependent mechanism for the antitumor effect of interleukin-4," Science 257 (5069): 548-551 (1992). Thau, N. et al., "rodletless mutants of Aspergillus fumigatus," Infect.Immun. 62 (10): 4380-4388 (1994). Torosantucci, A. et al., "A novel glyco-conjugate vaccine against fungal pathogens," J.Exp.Med. 202 (5): 597-606 (2005). Unger, W. W. et al., "Nasal tolerance induces antigen-specific CD4+," Int.Immunol 15 (6): 731-739 (2003). Veldhoen, M. et al., "TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells," Immunity. 24 (2): 179-189 (2006). Vora, S. et al., "Activity of voriconazole combined with neutrophils or monocytes against Aspergillus fumigatus: effects of granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor," Antimicrob.Agents Chemother. 42 (9): 2299-2303 (1998). Wang, J. E. et al., "Involvement of CD14 and toll-like receptors in activation of human monocytes by Aspergillus fumigatus hyphae," Infect.Immun. 69 (4): 2402-2406 (2001). Watanabe, A. et al., "Immunosuppressive substances in Aspergillus fumigatus culture filtrate," J.Infect.Chemother. 9 (2): 114-121 (2003). Weiner, M. P. et al. 1994. Strategies. Vol. 2. 7 ed. Welsh, D. A. and C. M. Mason, "Host defense in respiratory infections," Med.Clin.North Am. 85 (6): 1329-1347 (2001). Weston, S. A. and C. R. Parish, "New fluorescent dyes for lymphocyte migration studies. Analysis by flow cytometry and fluorescence microscopy," J.Immunol Methods 133 (1): 87-97 (1990). Wichmann, G., O. Herbarth, and I. Lehmann, "The mycotoxins citrinin, gliotoxin, and patulin affect interferon-gamma rather than interleukin-4 production in human blood cells," Environ.Toxicol. 17 (3): 211-218 (2002). Wilczynski, J. R., M. Radwan, and J. Kalinka, "The characterization and role of regulatory T cells in immune reactions," Front Biosci. 13: 2266-2274 (2008). Woodcock, D. M. et al., "Quantitative evaluation of Escherichia coli host strains for tolerance to cytosine methylation in plasmid and phage recombinants," Nucleic Acids Res. 17 (9): 3469-3478 (1989). 153 Referenzliste Yamada, A., T. Kataoka, and K. Nagai, "The fungal metabolite gliotoxin: immunosuppressive activity on CTL-mediated cytotoxicity," Immunol.Lett. 71 (1): 27-32 (2000). Yella, L. K., P. Krishnan, and V. Gillego, "The air crescent sign: A clue to the etiology of chronic necrotizing pneumonia," Chest 127 (1): 395-397 (2005). Internetseiten 1001 http://www.medizinfo.de/lungeundatmung/anatomie/bronchien.shtml 1002 http://www.radiologie-oldenburg.de/grafik/ct2_kl.jpg 1003 http://www.luft-zum-leben.de/lzl/e8/e49/e50/ 1004 http://de.wikipedia.org/wiki/Bild:Aspergill.jpg 1005 http://www2.aclyon.fr/enseigne/biotech/galerie/champignons/tableau/aspergillus14.gif 1006 http://www.fao.org/inpho/content/compend/img/ch31/fig_4_1_4b.jpg 1007 http://www.thieme-connect.com/ejournals/html/pneumologie/doi/10.1055/s-2003-812529#fg 1008 http://www.aber.ac.uk/fungi/fungi/taxonomy.htm 1009 http://www.versorgungsleitlinien.de/patienten/pl_asthma/erkrankung_atmung 1010 http://academic.kellogg.cc.mi.us/herbrandsonc/bio201_McKinley/Respiratory%20System.htm 1011 http://www.webmed.ch/Aktuell/Immunsystem.htm 1012 http://www.ilo.at/text.php?M_ID=34 1013 http://www-immuno.path.cam.ac.uk/~immuno/part1/lec08/lec8_97.html 1014 http://www.britannica.com/eb/art-17661/The-five-main-classes-of-antibodies-IgG-IgA-IgD-IgE 1015 http://en.wikipedia.org/wiki/Antibody 1016 http://de.wikipedia.org/wiki/Interleukin 1017 http://de.wikipedia.org/wiki/Interferon 1018 http://de.wikipedia.org/wiki/Tumornekrosefaktor 1019 http://de.wikipedia.org/wiki/Fluconazol 1020 http://de.wikipedia.org/wiki/Amphotericin_B 1021 http://medikamente.onmeda.de/Wirkstoffe/Terbinafin/wirkung-medikament-10.html# 1022 http://www.mykosen-online.de/antimykotika/fluorcytosin/wirkungsmechanismus.htm 1023 http://www.mykosen-online.de/antimykotika/caspofungin/wirkungsmechanismus.htm 1024 http://ec.europa.eu/food/fs/sc/ssc/out278_en.pdf Diplom- und Doktorarbeiten 2001 „Charakterisierung der Aspergillus-spezifischen T-Helferzellantwort bei gesunden Probanden und Patienten nach Chemotherapie und allogener Stammzelltransplantation“; Claudia Ruth Bollinger; Medizinische Fakultät der Eberhard-Karls-Universität Tübingen; 2004 154 Referenzliste 2002 „Herstellung eines definiert immunogenen Aspergillus fumigatus-Stammes und erste Analyse von dessen Wirtszellinteraktion“; Judith Behnsen; Institut für Mikrobiologie der Universität Hannover; 2005 2003 „cAMP-abhängige Regulation von Morphogenese und Virulenz in Aspergillus fumigatus“; Burghard Liebman; Institut für Mikrobiologie der Universität Hannover; 2003 155 Danksagung Danksagung Zunächst möchte ich mich bei Herrn Prof. Dr. Dieter Jahn für die Betreuung des Promotionsverfahrens und die Übernahme des Hauptreferats bedanken. Ebenso danke ich Herrn Prof. Dr. Jürgen Wehland für die Übernahme des Koreferats und Frau Prof. Dr. Petra Dersch für die Übernahme des Prüfungsvorsitzes. Des Weiteren möchte ich mich sehr stark bei dem Betreuer meiner Arbeit, Herrn Prof. Dr. Matthias Gunzer bedanken. Durch ihn wurde mir die Möglichkeit geboten, die ersten Schritte in dem weiten und spannenden Feld der Immunologie zu gehen und mich dort als Wissenschaftler zu entfalten. Ich danke ihm insbesondere für die Ausarbeitung des immer noch sehr reizvollen und herausfordernden Themas, für die stets hervorragende Betreuung und Unterstützung, auch während der langen „Durststrecken“, und für die Möglichkeit, auch über meine Dissertation hinaus Mitglied seiner Arbeitsgruppe zu sein und mein Projekt zu vertiefen. Mein nächster Dank geht an alle Kooperationspartner, die sich während der letzten Jahre ergeben haben und ohne die es mir sicherlich nicht möglich gewesen wäre, eine Arbeit in diesem Umfang anzufertigen. Hervorheben möchte ich zum einen Herrn Prof. Dr. Axel Brakhage, Alexander Gehrke und Judith Behnsen aus dem HKI Jena, die uns bis zum heutigen Tag stetig mit neuen Pilzstämmen versorgen und immer ein offenes Ohr für Klonierungsprobleme hatten. Frau Prof. Dr. Francoise Routier und insbesondere Philipp Schmalhorst aus der MH Hannover haben mich bei meinen ersten Pilz-Klonierungsschritten begleitet und mir elementares Grundwissen zu diesem Thema vermittelt. Die Klonierung vollendet habe ich dann in Zusammenarbeit mit PD Dr. Sven Krappmann (Universität Würzburg) der für mich die entscheidende Klonierungsstrategie entwickelt hat und ebenfalls immer ansprechbar für Probleme jeglicher, wissenschaftlicher Art war. Aus seiner Arbeitsgruppe in Göttingen möchte ich mich außerdem bei Christoph Sasse und Verena Große für die liebe Unterstützung im Labor bedanken. Als letzten Kooperationspartner mag ich Herrn Prof. Dr. Stefan Dübel mit seinen Mitarbeitern Mark Schütte und Dr. Michael Hust erwähnen, mit deren Hilfe das äußerst spannende Projekt rund um die Immunisierung ermöglicht wurde. Bei der Etablierung der molekularbiologischen Methoden in unserem Labor hat mich maßgeblich Andree Meissner (HZI Braunschweig) unterstützt und bei der Umsetzung der ersten Ideen stand mir Kai Schlüter (MH Hannover) als Laborpraktikant zur Seite. Durch seine kritischen Fragen und selbstständige Recherche wurden viele Zusammenhänge deutlicher und einige 156 Probleme geklärt. Ihm verdanke ich die Klonierung des Plasmid- Danksagung Zwischenkonstrukts „pSK-ovacit1“. Als nächstes möchte ich die „(EX-)Immundynamos“ kräftig umarmen. Danke Bastian, für die vielen netten, lustigen, besinnlichen, informativen und auch traurigen Stunden auf dem Fahrrad, am Südsee und in der Cafeteria. Ebenso danke ich Priyanka, Sabine, Peter und Julia für das alltägliche Labormiteinander mit all den vielen Kleinigkeiten, die dieses ausmachen. Dafür danke ich natürlich auch der lieben Cindy, die maßgeblich an meiner Erkenntnis beteiligt war, dass der Osten doch gar nicht so „doof“ ist. Weiterhin mag ich mich über unsere Arbeitsgruppe hinaus, stellvertretend für das super Arbeits- und PrivatKlima zwischen den Doktoranden am HZI, besonders bei folgenden Leuten bedanken: Andreas, Andree, Yuf, Matz, der Badminton-Clique und den vielen anderen Mitstreitern, für die der Platz hier leider nicht ausreicht. Auf privater Seite mag ich mich bei meinen Eltern bedanken, die mich zu dem Menschen erzogen haben, der ich bin und ohne deren vielfältige Unterstützung ich mit Sicherheit nie das Ziel erreicht hätte, eine Doktorarbeit erfolgreich abzugeben. Der abschließende Dank geht an meine Freundin Anja Köhler, die auch in unseren privaten Räumen immer wieder Ansprech- und Diskussionspartner für diverse Laborprobleme war. Durch sie habe ich die Kraft gefunden, stets motiviert neue Herausforderungen in Angriff zu nehmen und Niederschläge zu verkraften – nicht zuletzt auch durch die notwendige Ablenkung von der Wissenschaft. 157 Lebenslauf Lebenslauf Persönliche Daten Ausbildungsdetails • Geschlecht: männlich • Familienstand: ledig • Nationalität: deutsch • Geburtstag: 08.07.1976 • Geburtsort: Salzgitter • Vater: Peter Hasenberg; *18.05.1940 • Mutter: Ingrid Hasenberg (Geburtsname: Rother); *04.01.1943 • Adresse: Olvenstedter Strasse 65; 39108 Magdeburg • 1982 – 1986: Grundschule am Fredenberg • 1986 – 1988: Orientierungsstufe am Fredenberg • 1988 – 1996: Gymnasium am Fredenberg mit Abschluss der Allgemeinen Hochschulreife (Note 2,4) • − 1. Leistungskurs: Mathematik − 2. Leistungskurs: Biologie − schriftlicher Prüfungskurs: Englisch − mündlicher Prüfungskurs: Erdkunde Oktober 1997 bis März 2004: Studium der Biologie an der Technischen Universität Braunschweig (Abschluss Diplom „sehr gut“); Hauptfach: Mikrobiologie; 1. Nebenfach: Genetik; 2. Nebenfach: Zoologie 158 − Vordiplom 30. November 1999 − Ende der Diplomprüfungen: Juni 2003 Lebenslauf − Juni 2003 bis März 2004: Diplomarbeit mit dem Titel “Proteomund Sekretomuntersuchungen von planktonisch anaerob gewachsenem Pseudomonas aeruginosa und seinen Biofilmen“ in dem Labor von Prof. Dieter Jahn an der TU Braunschweig • Juni 2004 Beginn der Doktorarbeit mit dem Titel “Entwicklung eines Modellsystems zur Untersuchung spezifischer T-Zell Reaktionen gegen Aspergillus fumigatus“ in dem Labor von Prof. Dr. Matthias Gunzer am Helmholtz Zentrum für Infektionsforschung (ehemals GBF) in Braunschweig • Ende 2007: Umzug der Arbeitsgruppe „Immundynamik“ von Prof. Dr. Matthias Gunzer an das Institut für Molekulare und Klinische Immunologie der Otto-Von-Guericke Universität Magdeburg Zivildienst • August 1996 bis September 1997 im Städtischen Krankenhaus Salzgitter-Lebenstedt schriftliche, wissenschaftliche Veröffentlichungen • Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans Behnsen,J.; Narang,P.; Hasenberg,M.; Gunzer,F.; Bilitewski,U.; Klippel,N.; Rohde,M.; Brock,M.; Brakhage,A.A.; Gunzer,M. ; PLoS.Pathog. 2007; 3;2 • Basal expression of the Aspergillus fumigatus transcriptional activator CpcA is sufficient to support pulmonary aspergillosis. Sasse,C.; Bignell,E.M.; Hasenberg,M.; Haynes,K.; Gunzer,M.; Braus,G.H.; Krappmann,S.; Fungal Genet Biol. 2008 Jan 3 • Vaccination with a human disease specific splice variant of CRF protects mice from invasive aspergillosis Schütte,M.*; Hasenberg,M.*; Rosenstock,P.; Hinz,D.; Kirsch,M.I.; Hust,M.; Gunzer,M.*; Dübel,S.*; submitted 2008 Apr *the first and last two authors contributed equally to this work 159