Höhere Experimentalphysik: Atom- und Molekülphysik - IUP
Werbung

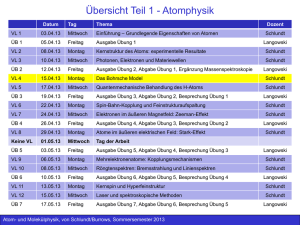
Höhere Experimentalphysik: Atom- und Molekülphysik Sommersemester 2013 (02.04. – 06.07.2013) Dozenten: Prof. Dr. John Burrows Institut für Umweltphysik Büro: U 2120 Telefon: 0421 218 62100 E-mail: [email protected] Dr. Cornelia Schlundt Institut für Umweltphysik Büro: U 2175 Telefon: 0421 218 62094 E-mail: [email protected] Übungsgruppenleiter: Dipl.-Phys. Martin Langowski Institut für Umweltphysik Büro: U 3220 Tel.: 0421 218 62178 E-Mail: [email protected] Atomphysik: 03.04. – 15.05.2013 Montag 10 – 12 Uhr NW1, S1260 VL Mittwoch 8 – 10 Uhr NW1, H3 VL Freitag 12 – 14 Uhr NW1, H3 ÜB Molekülphysik: 24.05. – 01.07.2013 Montag 10 – 12 Uhr NW1, S1260 VL Mittwoch 8 – 10 Uhr NW1, H3 ÜB Freitag 12 – 14 Uhr NW1, H3 VL Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Allgemeines Übungen: • Insgesamt 12 Übungen (10 Übungszettel, 2 Vorbereitungen für die Klausur) • Ausgabe der Übungen in der Übungsgruppe (Ausnahme erste Woche), Rückgabe eine Woche später in der Übungsgruppe • Erster Übungszettel wird in der ersten Woche ausgeteilt (05.04.013) Prüfung: • • Klausur voraussichtlich am 19.Juli 2013 Modulteilprüfung: 80% für Klausur, 20% für Übung (abgegebene Übungszettel) Folien/Skript: • • Die Folien und Übungsaufgaben liegen auf der studIP Webseite als pdf Dokumente vor http://www.iup.uni-bremen.de/~cornelia/?Lectures:Atomphysik_und_Molekuelphysik Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Literatur zum Gebrauch neben der Vorlesung • H. Haken - H.C. Wolf: Molekülphysik und Quantenchemie, Springer Verlag, Heidelberg • P. W. Atkins: Physikalische Chemie, VCH Verlagsgesellschaft, Weinheim • C. N. Banwell and E.M. McCash: Fundamentals of Molecular Spectroscopy, McGraw-Hill Book Company, London • G.M. Barrow: Physikalische Chemie, Vieweg Verlag, Braunschweig • P. R. Bunker: Molecular Symmetry and Spectroscopy, Academic Press, New York, San Francisco, London • F. Engelke: Aufbau der Moleküle, Teubner Studienbücher Physik/ Chemie, B.G. Teubner, Stuttgart • H.-D. Försterling und H. Kuhn: Moleküle und Molekülanhäufungen, Springer Verlag, Heidelberg • K. H. Hellwege: Einführung in die Physik der Molekülen, Heidelberger Taschenbücher, Springer Verlag, Heidelberg • G. Herzberg: Molecular Spectra and Molecular Structure, Van Norstrand, New York • J. M. Hollas: Die Symmetrie von Molekülen, de Gruyter Lehrbuch, Walter de Gruyter, Berlin, New York • G. W. King: Spectroscopy and Molecular Structure, Holt, Rinehardt and Winston, New York • A. Lösche: Molekülphysik, Akademie-Verlag, Berlin • J. I. Steinfeld: Molecules and Radiation, The MIT Press Cambridge, Massachusetts • M. Weissbluth: Atoms and Molecules, Academic Press, New York, San Francisco, London Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Übersicht Teil 1 - Atomphysik Datum Tag Thema Dozent Schlundt VL 1 03.04.13 Mittwoch Einführung – Grundlegende Eigenschaften von Atomen ÜB 1 05.04.13 Freitag Ausgabe Übung 1 VL 2 08.04.13 Montag Kernstruktur des Atoms: experimentelle Resultate Schlundt VL 3 10.04.13 Mittwoch Photonen, Elektronen und Materiewellen Schlundt ÜB 2 12.04.13 Freitag Ausgabe Übung 2, Abgabe Übung 1, Ergänzung Massenspektroskopie VL 4 15.04.13 Montag Das Bohrsche Model Schlundt VL 5 17.04.13 Mittwoch Quantenmechanische Behandlung des H-Atoms Schlundt ÜB 3 19.04.13 Freitag Ausgabe Übung 3, Abgabe Übung 2, Besprechung Übung 1 VL 6 22.04.13 Montag Spin-Bahn-Kopplung und Feinstrukturaufspaltung Schlundt VL 7 24.04.13 Mittwoch Elektronen im äußeren Magnetfeld: Zeeman-Effekt Schlundt ÜB 4 26.04.13 Freitag Ausgabe Übung 4, Abgabe Übung 3, Besprechung Übung 2 VL 8 29.04.13 Montag Atome im äußeren elektrischen Feld: Stark-Effekt Keine VL 01.05.13 Mittwoch Tag der Arbeit ÜB 5 03.05.13 Freitag Ausgabe Übung 5, Abgabe Übung 4, Besprechung Übung 3 VL 9 06.05.13 Montag Mehrelektronenatome: Kopplungsmechanismen Schlundt VL 10 08.05.13 Mittwoch Röngtenspektren: Bremsstrahlung und Linienspektren Schlundt ÜB 6 10.05.13 Freitag Ausgabe Übung 6, Abgabe Übung 5, Besprechung Übung 4 VL 11 13.05.13 Montag Kernspin und Hyperfeinstruktur Schlundt VL 12 15.05.13 Mittwoch Laser und spektroskopische Methoden Schlundt ÜB 7 17.05.13 Freitag Ausgabe Übung 7, Abgabe Übung 6, Besprechung Übung 5 Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Langowski Langowski Langowski Langowski Schlundt Langowski Langowski Langowski Übersicht Teil 2 - Molekülphysik Datum Tag Thema Dozent Keine VL 20.05.13 Montag Pfingstmontag Keine ÜB 22.05.13 Mittwoch Labortour VL 13 24.05.13 Freitag Einführung in die Molekülphysik Burrows VL 14 27.05.13 Montag Chemische Bindungen Burrows ÜB 8 29.05.13 Mittwoch Ausgabe Übung 8, Abgabe Übung 7, Besprechung Übung 6 VL 15 31.05.13 Freitag Einführung in die Gruppentheorie Burrows VL 16 03.06.13 Montag Symmetrien und Symmetrieoperationen I Burrows ÜB 9 05.06.13 Mittowch Ausgabe Übung 9, Abgabe Übung 8, Besprechung Übung 7 VL 17 07.06.13 Freitag Symmetrien und Symmetrieoperationen II Burrows VL 18 10.06.13 Montag Symmetrien und Symmetrieoperationen III Burrows ÜB 10 12.06.13 Mittwoch Ausgabe Übung 10, Abgabe Übung 9, Besprechung Übung 8 VL 19 14.06.13 Freitag Rotationsspektren Burrows VL 20 17.06.13 Montag Schwingungsspektren Burrows ÜB 11 19.06.13 Mittwoch Abgabe Übung 10, Besprechung Übung 9 VL 21 21.06.13 Freitag Elektronenspektren Burrows VL 22 24.06.13 Montag Raman-Spektren Burrows ÜB 12 26.06.13 Mittwoch Besprechung Übung 10 VL 23 28.06.13 Freitag Zusammenfassung Molekülphysik Burrows VL 24 01.07.13 Montag Zusammenfassung Atomphysik Schlundt Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Langowski Langowski Langowski Langowski Langowski Langowski Überblick über die historische Entwicklung I Atom = das Unzerschneidbare/Unzerteilbare Urväter des Atomismus: • Leukipp • Demokrit • Platon • Aristoteles (Demokrits Lehrer, genaue Lebensdaten undbekannt) (460 – 370 v.u.Z.) (429 – 348 v.u.Z.) (382 – 322 v.u.Z.) Individuum: • kleinste Einheit einer größeren Menge, die noch alle für diese Menge wesentlichen Eigenschaften besitzt. Beispiel: ein Atom Wasserstoff • kann man zwar weiter spalten in Proton und Elektron • aber der Wasserstoff ist durch die Teilung zerstört Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Überblick über die historische Entwicklung II Atomistik der Materie: Gesetz der konstanten und multiplen Proportionen (1803 Dalton): 14 g Stickstoff + 16 g Sauerstoff 14 g Stickstoff + 32 g Sauerstoff 30 g NO 46 g NO2 Interpretation im “Atommodell”: • Die Atomgewichte von N und O verhalten sich wie 14 : 16 • Nur ganze Atome können miteinander reagieren Atommodell von Prout (1815): Alle Elemente sind zusammengesetzt aus H-Atomen Gay-Lussacsches Gesetz (1808): Die Volumina gasförmiger Reaktionspartner verhalten sich wie ganze Zahlen 1 Volumen N2 + 1 Volumen O2 1 Volumen N2 + 2 Volumina O2 2 Volumina NO 2 Volumina NO2 Avogadrosche Hypothese (1811): Gleiche Volumina verschiedener Gase enthalten gleich viele Moleküle (bei gleichem Druck und gleicher Temperatur) Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Überblick über die historische Entwicklung III Atomistik der Elektrizität: Faraday-Gesetze (1833): • Die abgeschiedene Menge eines Elements transportierten Ladungsmenge proportional ist der dabei • Verschiedene Elemente werden von der gleichen Elektrizitätsmenge in äquivalenten Mengen abgeschieden Faraday folgerte: • die Existenz von “Atomen” der Elektrizität • dass die “Atome” der Elektrizität mit den Atomen der Materie verkoppelt sind Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Überblick über die historische Entwicklung IV Atomistik der Energie: 14. 12. 1900: • Planck trug der Physikalischen Gesellschaft in Berlin die Ableitung seines Strahlungsgesetzes für die Hohlraumstrahlung vor. • Energie harmonischer annehmen. • Geburtstag der Quantentheorie Oszillatoren Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 kann nur diskrete Werte Überblick über die historische Entwicklung V Kirchhoff und Bunsen (1860) zeigten: • dass die optischen Spektren charakteristisch für die chemischen Elemente sind, die das Licht emittieren oder absorbieren. Balmer (1885) fand: • einfache Formel, die es ermöglichte, die Wellenlängen für eine Serie von Spektrallinien des Elements Wasserstoff wiederzugeben. • Wellenlängen des Wasserstoffspektrums – Differenz der Kehrwerte der Quadrate ganzer Zahlen, mit einem gemeinsamen Faktor (RydbergKonstante) 1911 Rutherford stellt sein Atommodell auf 1913 Bohr formuliert Grundlagen für die Quantisierung der Elektronenbahnen im Atom Sommerfeld verfeinerte diese Quantisierungsvorschriften De Broglie entwickelte parallel dazu seine Vorstellung über Materiewellen 1920 – 1930: Born, Heisenberg, Schrödinger , Pauli, Dirac, etc. Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Atomphysik Grundlagenforschung Bestimmung von Atomdaten Physik Technik Anwendungen Festkörperphysik Quantenelektronik Messung von Einheiten Chemische Physik Medizinische Technik Weltraumforschung Astrophysik Nachrichtentechnik Umweltschutz Plasmaphysik Biophysik Geophysik Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Energieprobleme Konzept der relativen Atommassen Experimentelle Grundlagen: Daltons Gesetz der multiplen Proportionen und Avogdro Hypothese Einführung relativer Atommassen Arel Erkenntnis, dass die Atommassen ungefähr ganzzahlige Vielfache der Masse von H-Atomen sind Beispiele: relative Atommassen von Sauerstoff und Stickstoff sind dann: Arel (O) = 16, Arel (N) = 14 Einführung der atomaren Masseneinheit “u”: 1u Masse eines H-Atoms 1u 1 / 12 der Masse eines neutralen 126C Atoms (seit 1961) 1 MEchem 1 / 16 der Massen von O-Atomen im natürlichen Isotopen-Verhältnis 1 MEphys 1 / 16 der Masse eines 16O Atoms MEchem : MEphys : u = 0,99996 : 0,99968 : 1,00000 Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Absolute Atommassen und das Mol 1 Mol eines Stoffes hat die Masse, die der relativen Atommasse in der Einheit Gramm entpricht NA Avogradro-Konstante, oder auch Loschmidt-Zahl (NL) 1 Mol einer Substanz enthält NL Atome oder Moleküle Bestimmung der Atomasse durch Bestimmung der Loschmidt-Zahl NL und: Aktuelle Werte: NL = (6,022045 ± 0,000005) 1023 Mol-1 1 u = (1,660565 ± 0,000005) 10-27 kg Massenzahl A eines Atoms: die ganze Zahl, die der relativen Atommassen am nächsten liegt (A = Zahl der Nukleonen, d.h. Protonen und Neutronen) Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Experimentelle Methoden zur Messung von NL • Elektrolyse • Aus Gas- und Boltzmann-Konstante • Röntgenbeugung an Kristallen • Radioaktive Erzeugung von He-Gas Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Methoden zur Bestimmung der Loschmidt-Zahl NL I 1. Elektrolyse: • Geflossene Ladung ist proportional zur elektrolytisch abgeschiedenen Stoffmenge • 1 Mol einer einwertigen Substanz entspricht der Ladung 96485 As (C) = F (F: Faraday-Zahl) Da jedes Ion eine Elementarladung trägt gilt: NL = F / e Beispiel: • 1 Mol Kupfer aus einer Lösung von CuSO4 benötigt 2 NL Elektronen, da Cu in CuSO4 zweifach positiv geladen ist. Bestimmung von NL durch Wiegen der abgeschiedenen Masse und Messung von Stromstärke und Zeit Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Methoden zur Bestimmung der Loschmidt-Zahl NL II 2. Ideale Gase Relation zwischen allgemeiner Gaskonstante R und Boltzmann-Konstanten k: Messung der Gaskonstanten R mittels pV = NRT (ideale Gasgleichung) Messung von k durch Sedimentationsexperiment (Perrin 1908) n(h): Teilchendichte h: Höhe n0: Teilchendicht bei h = 0 g: 9,81 m s-2 T: absolute Temperatur m’: “korrigierte” Teilchenmasse (Auftrieb in Flüssigkeit berücksichtigt) h Abb 2.1 Haken & Wolf Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Methoden zur Bestimmung der Loschmidt-Zahl NL III 3. Röntgenbeugung an Kristallen Messung von a durch Röntgenbeugung möglich, wenn Wellenlänge der Röntgenstrahlung bekannt ist. In einem Würfel der Kantenlänge a/2 befindet sich ½ NaCl Moleküle. Zahl der Moleküle pro Volumeneinheit: Dies ist identisch mit dem Quotienten: Abb 2.2 Haken & Wolf M: : Vmol: Molmasse Massendichte Molvolumen Messung von NL mit relativer Unsicherheit von 5·10-6 Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Methoden zur Bestimmung der Loschmidt-Zahl NL IV 4. Messung mittels des radioaktiven Zerfalls (nach Rutherford und Royds, 1909) Radonpräparat (22286Rd), welches 42He2+ emittiert Ionisation und Elektroneneinfang Bildung von He-Gas Nachweis von He durch optische Spektroskopie Wenn Aktivität des radioaktiven Präparats bekannt ist, dann lässt sich die Anzahl der Atome und NL bestimmen Abb 2.3 Haken & Wolf Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Methoden zur Bestimmung der Größe von Atomen • Messung von Wirkungsquerschnitten • Röntgenbeugung an Kristallen Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Methoden zur Bestimmung der Größe von Atomen I Wirkungsquerschnitt: = (r1 + r2) 2 Die Wahrscheinlichkeit, dass ein Stoss erfolgt ist gegeben durch: Betrachte eine dünne Teilschicht der Dicke x: Die Anzahl der in x gestreuten Atome: N0 Gesamtzahl der Atome, die in die Schicht eintreten N Zahl der Atome, die in der Teilschicht x ausscheiden n Teilchendichte Wirkungsquerschnitt A Fläche Abb 2.4 Haken & Wolf Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Methoden zur Bestimmung der Größe von Atomen II =n Totaler Wirkungsquerschnitt Streukoeffizient Messung von = (r1 + r2)2 ergibt r1 + r2 Falls r1= r2 kann die Größe der Atome bestimmt werden Analogie: Extinktion von elektromagetischer Strahlung absorbierendes oder streuendes Medium. beim Durchgang durch ein Mathematische Beschreibung durch Lambert-Beer-Gesetz: n nx Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Totaler Wirkungsquerschnitt Streukoeffizient optische Dichte Methoden zur Bestimmung der Größe von Atomen III Röntgenbeugung an Kristallen: • Messung der Gitterkonstanten von Kristallen Aussagen über Größe von Atomen • Huygensches Prinzip: Jedes Atom ist Zentrum einer neuen Elementarwelle • Konstruktive Interferenz, wenn Gangunterschied ein ganzzahliges Vielfaches der Wellenlänge ist: =n . E A D C d B Netzebenen Ableitung des Bragg-Gesetzes: Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Methoden zur Bestimmung der Größe von Atomen IV Standardverfahren zur Röntgenbeugung an Kristallen: • Laue-Verfahren: Verwendung eines Einkristalls, fester Einfallwinkel und polychromatisches Röntgenlicht • Bragg´sches Drehkristallverfahren: Einkristall, monochromatisches Licht und Variation des Einfallswinkels durch Drehung des Kristalls • Debye-Scherrer-Verfahren: Polykristalline oder pulverförmige Probe, und monochromatisches Licht Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Massenspektroskopie Massenspektroskopie erlaubt die genaue Messung von Atom-Massen und die Trennen von Atomen unterschiedlicher Masse Massenspektroskopie basiert auf der elektrischen und magnetischen Feld: Ablenkung ionisierter Atome im Älteste Methode: Thomsonsche “Parabelmethode” Teilchen mit gleichem Verhältnis von Masse und Ladung, aber unterschiedlicher Geschwindigkeit enden auf einer Parabel Abb 3.2 Haken & Wolf Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Massenspektroskopie – Die Thomsonsche Parabelmethode Abb 3.3 Haken & Wolf Relative Intensitäten entsprechen relativen Isotopenhäufigkeiten • Erste exakte Messungen von Isotopenverhältnissen durch Aston 1920 mittels der Thomsonschen Parabelmethode • Außerdem: Feststellung, dass es von vielen Elementen mehrere Isotope gibt Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Verbesserungen der Massenspektroskopie Geschwindigkeitsfokusierung (Aston 1919): • Elektrisches Feld spaltet bzgl. e/m, aber auch v auf • Wähle B-Feld derart, dass Ionen mit gleichem v und e/m wieder vereint werden Abb 3.4 Haken & Wolf Richtungsfokusierung (Dempster 1918): • Fokusierung von Ionen mit gleichem e/m, aber etwas unterschiedlicher Richtung Abb 3.5 Haken & Wolf Moderne Massenspektrometer sind “doppelfokusierend” Geschwindigkeits- und richtungsfokusierend Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Isotopentrennung • Elektromagnetische Trennung (Massenspektrometrie) • Diffusion: • Zentrifugen • Fraktionierte Destilation Beispiel: Siedepunkt von D2O liegt 1,42º über dem von H2O • Elektrolyse • Chemische Reaktionen • Laser-Photochemie Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013 Zusammenfassung Atom- und Molekülphysik, von Schlundt/Burrows, Sommersemester 2013










![Aufgabe 7 Produktivität [5 Punkte]](http://s1.studylibde.com/store/data/002054622_1-3a545f02a634c0b2b66d1a220be3e293-300x300.png)