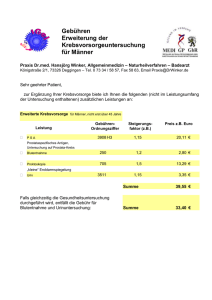
Leistungsverzeichnis Allg. Teil
Werbung

I n h a lt s v e r z e i c h n i s Allgemeines Das Ärzteteam����������������������������������������������������������������������������� 3 Kompetente Auskunft����������������������������������������������������������������� 4 Mitgliedschaften�������������������������������������������������������������������������� 6 Qualitätsmanagement����������������������������������������������������������������� 7. Lageplan��������������������������������������������������������������������������������������� 517 F a c h i n f o r m at i o n e n A.Hinweise zur Präanalytik������������������������������������������������������� 9 B.Mikrobiologische Untersuchungen�������������������������������������� 19 C. Verzeichnis gebräuchlicher Abkürzungen��������������������������� 33 D. Alphabetisches Untersuchungsverzeichnis��������������������������� 39 E.Allergie��������������������������������������������������������������������������������� 421 F. Auszug aus dem Infektionsschutzgesetz (IfSG)������������������� 431 G.Virusinfektionen�������������������������������������������������������������������� 439 H. Diagnostik in Gravidität und Perinatalperiode������������������� 441 I.Tumormarker������������������������������������������������������������������������� 449 J.Autoantikörper���������������������������������������������������������������������� 461 K.Schilddrüsendiagnostik��������������������������������������������������������� 469 L.Gerinnungsuntersuchungen������������������������������������������������� 473 M.Funktionstests������������������������������������������������������������������������ 479 N.Index��������������������������������������������������������������������������������������� 511 1 Das Ärzteteam Partner Rufnummer E-mail Tätigkeitschwerpunkte Dr. med. Thomas Lehners FA für Mikrobiologie, Virologie und Infektionsepidemiologie 0511-85622-130 [email protected] Bakteriologie, Mykologie, Virologie, Parasitologie, Antibiotikatherapie, Molekularbiologie, Hygiene Dr. med. Michael Weimann FA für Laboratoriumsmedizin 0511-85622-140 [email protected] Klinische Chemie, Hämatologie, Hämostaseologie, Blutgruppen, Proteinchemie, Drogen, TDM* Dr. med. Veronika Imse FÄ für Laboratoriumsmedizin 0511-85622-150 [email protected] Endokrinologie, Tumormarker, Autoimmunität, Allergie, TDM*, Drogenscreening, Blutgruppen Dr. med. Silvia Lehners FÄ für Laboratoriumsmedizin 0511-85622-160 [email protected] Klinische Chemie, Hämostaseo­logie, Hämatologie, TDM*, Immunologie, Serologie, Allergie, Autoimmunität, Med. Mikrobiologie, Molekularbiologie TDM* = Therapeutic Drug Monitoring 3 K omp e t e n t e A u s k u n f t Verwaltung/Organisation Rufnummer E-mail Zentrale / Befundauskunft 0511-85622-0 [email protected] Zentrale Fax-Nr. 0511-85622-710 Auftragserfassung Claudia Thisius 0511-85622-310 0511-85622-314 [email protected] [email protected] Verwaltung Christa Heinen 0511-85622-360 0511-85622-180 [email protected] [email protected] 0511-85622-330 [email protected] 0511-85622-340 0511-85622-341 [email protected] [email protected] EDV/Technik Thomas Göttsch Christian Scholz 0511-85622-290 0511-85622-292 0511-85622-294 [email protected] [email protected] [email protected] Einsenderbetreuung Cinzia Napoleoni Tanja Wiegmann Kristina Zymelka 0511-85622-350 0172-5151991 0162-1314483 0172-5657562 [email protected] [email protected] [email protected] [email protected] Qualitätsmanagement Aurelia Hannig 0511-85622-372 [email protected] [email protected] Materialversand 0511-85622-355 / -310 [email protected] Abrechnung: - gesetzliche Krankenkassen Manuela Richter So-Ming Wong - Krankenhäuser/Privatkassen Hanna Cano 4 K omp e tDe a n st eÄA ru z tsektuenafm t Diagnostische Bereiche Rufnummer E-mail Sprechstunde / Blutentnahme Maria L. Cabeza 0511-85622-300 / -310 [email protected] [email protected] Probeneingang Mareen Bruschkewitz 0511-85622-200 [email protected] [email protected] Klinische Chemie/Hämatologie/ Gerinnung Bianca Wittbold Sabrina Meyer [email protected] 0511-85622-230 Serologie/Immunologie Nicole Winkler 0511-85622-240 [email protected] [email protected] AAS/HPLC Lilia Makarov 0511-85622-581 [email protected] [email protected] Mikrobiologie Dr. rer. nat. Simone Jacob Birgit Paul Molekularbiologie Heidi Koschine 0511-85622-170 0511-85622-260 [email protected] [email protected] [email protected] 0511-85622-280 [email protected] [email protected] Hygiene Heidi Koschine 0511-85622-270 [email protected] [email protected] 5 Mitgliedschaften PDeutsche Vereinte Gesellschaft für Klinische Chemie und Laboratoriumsmedizin e.V. (DGKL) PDeutsche Gesellschaft für Hygiene und Mikrobiologie e.V. (DGHM) Arbeitsgemeinschaft niedergelas­sener Ärzte in der Versorgung HIV-Infizierter (NieAGNÄ) PPaul-Ehrlich-Gesellschaft PINSTAND PGesellschaft für Thrombose- und Hämostaseforschung (GTH) PDeutsche Gesellschaft für Transfusions­medizin und Immunhämatologie (DGTI) PDeutsche PNiedersächsische für Chemotherapie e.V. (PEG) e.V. PECAT Foundation (International External Quality Assessment Programme in Thrombosis and Haemostasis) PG-EQUAS (The German External Quality Assessment Scheme) Gesellschaft für Endokrinologie (DGE) PDeutschsprachige Mykologische Gesellschaft PDeutsche Gesellschaft für Parasitologie PDeutsche Gesellschaft für Ernährung (DGE) PDeutsche Gesellschaft für Ernährungs­medizin (DGEM) Arbeitsgemeinschaft niedergelas­sener Ärzte in der Versorgung HIV-Infizierter (DAGNÄ) PBerufsverband Deutscher Laborärzte e.V. PBerufsverband der Ärzte für Mikrobiologie und Infektionsepidemiologie e.V. (BÄMI) PDELAB e.V. PDeutsche 6 PEuropean Society of Clinical Microbiology and Infectious Diseases (ESCMID) PEuropean Society of Endocrinology (ESE) PAmerican Association for Clinical Chemistry (AACC) PAmerican Society for Microbiology (ASM) s a Än rz ea mt Q u a l i t äDta sm atgeetm en Das Medizinische Labor Hannover wurde 2005 für den Bereich Medizinische Laboratoriums­diagnostik gemäß der Norm DIN EN ISO 15189 durch die Deutsche Akkreditierungsstelle Chemie (DACH) erstakkreditiert. Die Reakkreditierung fand im Jahr 2010 durch die Deutsche Akkreditierungsstelle (DAkkS) statt. Die Urkunde mit Anlagen finden Sie auf unserer Homepage (www.mlh.de) im Internet. Mit Hilfe des Qualitätsmanagementsystems sollen die diagnostischen Möglichkeiten laufend optimiert sowie ein hoher Leistungsstandard erhalten werden. Ständige Fortbildung des gesamten Laborteams sichert den hohen Anspruch an Qualität auch in der Zukunft. Für Fragen und Anregungen zu diesem Themenbereich steht Ihnen unsere Qualitätsmanagement-Beauftragte (QMB) gerne zur Verfügung. Messunsicherheit: Die Messunsicherheit beschreibt die Streuung von Messergebnissen. Bei jedem Einzelprozess innerhalb des Analysenganges treten gemäß statistischer Grundsätze Abweichungen vom wahren Wert auf. Zur Feststellung und Minimierung von Abweichungen und Schwankungen werden regelmäßige Überprüfungen bezüglich Präzision und Richtigkeit der Messergebnisse durchgeführt. Auskünfte zur Messunsicherheit der quantitativen Prüfverfahren werden auf Anfrage jederzeit gern erteilt. Interne Qualitätssicherung: Die hausinternen Qualitätskontrollen werden gemäß der Richtlinien der Bundesärztekammer zur Qualitäts­sicherung in medizinischen Laboratorien (RiLiBÄK) durchgeführt. Untersuchungsverfahren außerhalb der Akkreditierung: Diese Verfahren sind im alphabetischen Teil des Untersuchungsprogramms sowie in den Befunden mit der Bemerkung „nicht akkreditierbare Methode“ gekennzeichnet. Unterauftragsvergabe: Im alphabetischen Verzeichnis des Untersuchungsprogramms mit ° bzw. in den Befunden mit * ge­kennzeichnete Untersuchungen werden als Fremdleistungen durch kooperierende Laboratorien erbracht. Ein Verzeichnis der Unterauftragnehmer stellen wir Ihnen auf Anfrage gerne zur Verfügung. Externe Qualitätssicherung: Die externe Qualitätskontrolle erfolgt durch die regelmäßige Teilnahme an Ringversuchen der folgenden Organisationen: PInstitut für Standardisierung und Dokumentation im Medizinischen Laboratorium e.V. (INSTAND) PDeutsche Vereinte Gesellschaft für Klinische Chemie und Laboratoriumsmedizin e.V. (DGKL) PLandesgesundheitsamt Baden-Württemberg 7 A . Hi n w e i s e z u r P r ä a n a ly t ik Die präanalytische Phase hat entscheidenden Einfluss auf die Qualität der Analytik im Labor sowie die Interpretation der erhobenen Befunde. Aus diesem Grunde bitten wir um Beachtung der folgenden Hinweise. Bitte zögern Sie nicht, bei offenen Fragen telefonisch Kontakt mit unserem Laborteam aufzunehmen. Wir beraten Sie gerne zu allen Fragen der optimalen Probenentnahme1. Bitte übermitteln Sie uns mit der Untersuchungsanforderung auch Hinweise zur Klinik des Patienten (Diagnosen, Medikation) sowie zu externen Voruntersuchungen. Diese Informationen erleichtern die Einordnung der erhobenen Resultate und erlauben häufig erst eine exakte Befundinterpretation. 1. Einsendung von Untersuchungsmaterial: Im Untersuchungsprogramm sind für jeden Analyten das erforderliche Material und die optimalen Abnahmebedingungen verzeichnet. Das benötigte Abnahme- und Versandmaterial stellen wir Ihnen kostenfrei zur Verfügung. Verwenden Sie bitte unsere Materialanforderungsscheine, die jederzeit im Labor bestellt werden können. Falls der Versand oder Transport einer Probe gefroren erfolgen muss, verwenden Sie bitte unsere Kühlboxen, die wir Ihnen auf Anforderung ebenfalls zur Verfügung stellen. Die Einsendung der Untersuchungsproben erfolgt entweder über unseren Fahrdienst oder auf dem Postweg. Der Patient ist vom anfordernden Arzt rechtzeitig über die notwendigen Verhaltensregeln vor der Probennahme zu informieren. Zur Vermeidung von Fehlinterpretationen der Laborergebnisse sollte die Probennahme nach 12-stündiger Nahrungskarenz und eingeschränkter körperlicher Aktivität möglichst morgens zwischen 7.00 Uhr und 9.00 Uhr sowie vor Anwendung potentiell störender diagnostischer und therapeutischer Maßnahmen erfolgen. Ggf. wird ein der jeweiligen Analytik angemessener Zeitabstand eingehalten (z.B. entsprechende Diätvorschrift siehe Untersuchungsverfahren in alphabetischer Ordnung in Kapitel D, Funktionstests, Kapitel M). Beim Therapeutischen Drug Monitoring (TDM) wird das Konzentrationsmaximum nach Arzneimittelgabe (siehe Einzelparameter im alphabetischen Untersuchungsverzeichnis) und die Steady State Phase vor der folgenden Gabe berücksichtigt. 2. Beschriftung der Proben und Begleitscheine: Zur Sicherung der Identität der eingesandten Probe bitte Namen, Vornamen und Geburtsdatum des Patienten auf dem Probengefäß (nicht dem Versandbehälter) sowie dem Begleitschein vermerken; bei Patienten mit wenig geläufigen Vornamen ist die zusätzliche Angabe des Geschlechts notwendig. Bitte geben Sie zusätzlich Abnahmetag und Uhrzeit an; diese Information ist insbesondere bei Mehrfachentnahmen, bestimmten Hormonuntersuchungen (z.B. Cortisol) sowie für die Auswertung von Funktionstesten unverzichtbar. Bitte die gewünschte Untersuchung, Materialart, Absender sowie Angaben zu Diagnose und Pharmakotherapie unbedingt auf dem Begleitschein vermerken. Verwenden Sie bei Kassenpatienten bitte nur vollständig ausgefüllte Überweisungsscheine (Muster 10). Ein zusätzlicher Begleitschein ist nicht notwendig. Bei Privatpatienten und IGeL-Anforderungen bitten wir um Angabe der vollständigen Anschrift des Patienten. Der Patient muss über die geplante Laboruntersuchung informiert werden und dieser per Unterschrift zustimmen. Dies gilt insbesondere für Untersuchungen, die unter das Gendiagnostikgesetz (GenDG) fallen, und denen der Patient ausdrücklich und schriftlich zustimmen muss (Nachweis der Einwilligung nach § 8 GenDG). 1Auf unserer Homepage (www.mlh.de) steht Ihnen außerdem unser Handbuch zur Primärprobenentnahme zur Einsicht, sowie zum Download zur Verfügung. 9 A . H i n w e i s e z u r P r ä a n a ly t i k 3. Entnahme von Probenmaterial: Die Blutproben für die unterschiedlichen Analysen werden mittels spezieller Entnahmeröhrchen mit entsprechenden Zusätzen gewonnen. Dabei ist folgende Reihenfolge empfehlenswert: 1.Blutkultur 2.Röhrchen ohne Zusatz 3.Citratblut 4.Heparinblut 5.EDTA-Blut 6.Na-Fluorid-Blut (Glykolysehemmer) 7.Spezialröhrchen für weitere Untersuchungen (siehe Einzelparameter im alphabetischen Teil) Die Farbcodierungen der Entnahmeröhrchen divergieren in Abhängigkeit vom jeweiligen Hersteller, die entsprechenden Firmenangaben sind zu beachten. Die im alphabetischen Teil des Leistungsverzeichnisses angegebenen Mengen wurden für Einzelanalysen ermittelt. Bei Anforderung mehrerer Untersuchungen aus identischem Untersuchungsmaterial sind ca. 5 ml Serum bzw. Plasma bzw. 10 ml EDTA- oder Heparinblut ausreichend. Venöse Blutentnahme: Übereinstimmung der perönlichen Angaben des Patienten mit der Angabe auf dem Anforderungsformular wird überprüft Pder Patient sollte die Körperlage (sitzend oder liegend) mindestens 15 min vor der Blutentnahme eingenommen haben Pdie zur Blutentnahme erforderlich Materialien liegen bereit Pes folgt die Inspektion zur Suche einer geeigneten Punktionsstelle, in dem der Patient die Faust schließt Pdie 10 Pdie Punktionsstelle wird desinfiziert Staubinde wird angelegt PPunktion und Füllung der Blutentnahmeröhrchen. Sicherheitskanülen bzw. -butterflies verwenden! PZur Vermeidung von Nachbluten und beim Herausziehen der Nadel wird ein Tupfer auf die Punktionsstelle gedrückt und für 15–20 Sekunden komprimiert. Pdie Kapilare Blutentnahme: PPassende Safety-Einmal-Lanzette nach Nadelgröße und Einstichtiefe auswählen PSchutzkappe abdrehen PSafety-Lanzette gegen die ausgewählte und desinfizierte Punktionsstelle halten, Auslöseknopf drücken PSafety-Lanzette in eine geeignete Entsorgunsgsbox geben PDurch vorsichtiges Massieren des Fingers, des Ohrläppchens oder der Ferse in Richtung Punktionsstelle erhalten Sie die erforderliche Blutmenge PBlut mit passender End-to-End-Kapillare aufnehmen (z.B.: Glukose 20 µl, HbA1C: 10µl) PTupfer auf die Punktionsstelle drücken und für 15–20 Sekunden komprimieren. A . Hi n w e i s e z u r P r ä a n a ly t ik Serum: Die Mehrzahl der Untersuchungen wird im Serum durchgeführt. Soweit nicht ausdrücklich angegeben, sollte nach Möglichkeit kein Vollblut versandt werden. Bei der Bestimmung von z.B. Kalium, Phosphat, LDH, Aldolase oder auch bei Hormonen und Antikörpern können bei Versand von Vollblut, bedingt durch Hämolyse, falsch erhöhte Werte im Serum gemessen werden. Vollblut: Diese Monovetten® sollten nur für spezielle Untersuchungen verwendet werden (z.B. Blutgruppenbestimmung). Citrat-Blut: Hauptsächlich für die Bestimmung der Gerinnungsparameter erforderlich sowie für Spezialanalysen (z.B. C1-Esterase-InhibitorAktivität; APC-Resistenz). Die Monovette unbedingt bis zur Markierung aufziehen (andernfalls stimmt das Mischungsverhältnis Blut/Antikoagulans nicht) und gut durchmischen (siehe auch 4.). EDTA-Blut: Zur Bestimmung des Blutbildes, aber auch für Spezialanforderungen (z.B. ACTH, Lymphozytendifferenzierung, molekulargenetische Unter­suchungen) vorgesehen. Die Monovetten® enthalten EDTA, daher Röhrchen nach der Materialentnahme mehrfach umwenden, jedoch nicht schütteln. Heparinblut: NH4-Heparinat-Röhrchen sowie LithiumHeparinat-Röhrchen werden nur für Spezialanforderungen benötigt (siehe alphabetischer Teil des Untersuchungsverzeichnisses). Monovette® nach der Entnahme mehrfach umwenden, jedoch nicht schütteln. Na-Fluorid-Blut: Monovette® wird z.B. zur Glucose- und Fructosebestimmung aus Vollblut oder zur Bestimmung von Laktat verwendet. NaF dient als Glykolysehemmer und erlaubt die korrekte Bestimmung leicht abbaubarer Kohlenhydrate. Die Röhrchen beinhalten zusätzlich ein Antikoagulanz. Probe nach Entnahme gut mischen, jedoch nicht schütteln. EGTA-Blut: Glutathion-Röhrchen, z.B. zur Katecholaminbestimmung im Plasma notwendig; bitte achten Sie auf gute Durchmischung nach Probenentnahme, jedoch nicht schütteln. NaHSO4-Blut: Zur Bestimmung der sauren Phosphatase und Prostataphosphatase (enzymatische Aktivität). Probenröhrchen mit 1 ml Serum füllen und gut mischen, jedoch nicht schütteln. 11 A . H i n w e i s e z u r P r ä a n a ly t i k Kapillarblut: Bestimmung von Glucose und HBA1c im Kapillarblut (Hämolysat); hierzu bitte jeweils spezielles Entnahmematerial anfordern. 24-h-Sammelurin: Viele klinisch-chemische und endokrinologische Urinanalysen werden aus 24-h-Sammelurin durchgeführt, da die gemessenen Konzentrationen auf die Tagesausscheidung der Analyten bezogen werden, um Einflüsse der Flüssigkeitszufuhr und -ausscheidung zu eliminieren. Der Patient wird persönlich und über ein dem Sammelbehälter angefügtes Informationsblatt über die Verfahrensweise der Probengewinnung informiert. Der Urin wird in einem sauberen, lichtgeschützten Gefäß gesammelt (ggfs. nach vorheriger Zugabe von Salzsäure zur Stabilisierung gemäß Angaben bei den entsprechenden Analyten). Die Sammelperiode beginnt nach dem Morgenurin und endet 12 mit dem Morgenurin des nächsten Tages. Nach Ende der Sammelperiode werden ca. 30 ml des gut durchmischten Urins abgefüllt und unter genauer Angabe des Sammelvolumens eingeschickt. (Ein spezielles Entnahmeset für die Gewinnung von Sammelurin, bestehend aus Urinbecher, Sammelgefäß mit HCl 20% (grüner Deckel) bzw. ohne Zusatz (gelber Deckel) und Aliquot-Röhrchen stellen wir auf Anfrage zur Verfügung.) Da die Analytik von Katecholaminen und 5-Hydroxyindolessigsäure (5-HIES) im 24-h-Sammelurin durch bestimmte Lebensmittel sowie Medikamente gestört werden kann, haben wir zur Optimierung der Präanalytik spezielle Informationsblätter für Arzt und Patient erstellt, die wir auf Anfrage gerne zur Verfügung stellen. A . Hi n w e i s e z u r P r ä a n a ly t ik 4. Gerinnungsuntersuchungen: Die optimale Blutentnahme ist eine der wichtigsten Voraussetzungen für die Erstellung valider Ergebnisse in der Gerinnungs­diagnostik! Die folgenden Empfehlungen hierzu entsprechen der DIN 58905. Die „richtige“ Blutentnahme: P Die Blutentnahme sollte stressarm erfolgen P Der Staudruck sollte zwischen systolischem und diastolischem Blutdruck liegen und die Stauzeit sollte möglichst kurz sein (≤ 1min!) P die verwendete Nadel sollte großlumig sein (21 G) Pdie ersten 2-3 ml Blut sollten für andere Analysen verwendet werden (Serumgewinnung etc.; eine punktionsbedingte Freisetzung von Gewebsthromboplastin beeinflusst die Testergebnisse) P das Blut muss bis zur Markierung aufgezogen werden (richtiges Mischungsverhältnis Citrat : Blut = 1 : 10) P das Probenmaterial soll sofort nach der Entnahme 2-3 mal geschwenkt werden (optimale Vermischung von Citrat und Blut) P der Probentransport in das Labor muss am gleichen Tag erfolgen Falsch ist: P Zu schnelles Aspirieren (hierdurch kommt es zu Hämolyse und Schaumbildung) P Unterfüllung oder Überfüllung des Röhrchens (falsche Blut-Citrat-Relation) PHeftiges Schütteln oder keine Durchmischung (kann zur Gerinnung der Probe führen) Benötigtes Probenmaterial: Untersuchung Gerinnungsstatus (z.B. PTT, Quick, Fibrinogen) Thrombophilie-Diagnostik Thrombozyten-Funktionstest Heparin-Induzierte-ThrombozytopenieDiagnostik Probe ca. 3 ml frisches Citratblut ca. 9 ml Citratblut ca. 2 ml EDTA-Blut 1 Serummonovette ca. 9 ml Citrat-/Spezialblut ca. 9 ml Citratblut, 1 Serummonovette Bemerkung Bestimmung in tiefgefrorenen Plasma­ proben nur zur Überprüfung der Stabilität Für Details: siehe Information Thrombose – Risiko Blutentnahme nur im Labor! Tel. Vorankündigung/Rücksprache mit Laborarzt notwendig 13 A . Hi n w e i s e z u r P r ä a n a ly t ik Probentransport: Grundsätzlich muss Blut für Gerinnungstests schnellstmöglichst (!) ungekühlt und ohne Zentrifugation im Labor eintreffen (Ausnahme: Homocystein). Ein Postversand von Citratblut ist nur für von-Willebrand-Faktor, FXIII, AT, Heparinspiegel und HIT-Diagnostik (Heparininduzierte Thrombopenie) möglich. Im Übrigen darf nur tiefgefrorenes Citratplasma verschickt werden, ggfs. bitte tel. Rücksprache. 5. Funtionsteste Vor der Durchführung von Funktionstesten ist der Patient über Verhaltensweisen (Diäten ect.) und Risiken aufzuklären. Hierzu ist z.B. für die Durchführung von oralen Belastungstesten eine Absprache ca.1 Woche vor der geplanten Untersuchung erforderlich. Für den Test „Fructosemalabsorption“ unterschreibt der Patient eine Einverständniserklärung. 6. Identifizierung und Prüfung eingehender Aufträge Unsere Proben werden durch Kurierdienste in das Labor gebracht oder per Post entsprechend den jeweils gültigen Transportvorschriften verschickt. Spezielle Anforderungen an den Transport (z. B. Kühlung, Warmhaltung, Sofortlieferung) sind – sofern notwendig – dem alphabetischen Untersuchungsverzeichnis zu entnehmen. Die in unserer Praxis eingehenden Aufträge werden auf Korrektheit bezüglich Etikettierung, Auftagserteilung, Material und Durchführbarkeit des Auftrages geprüft. Dies betrifft auch Untersuchungen, die an Auftragslaboratorien vergeben werden. Bei Unklarheiten wird Rücksprache mit dem Einsender gehalten und es erfolgt eine Abklärung mit der Laborleitung. Es werden ausschließlich Untersuchungsmethoden durchgeführt, für die das Labor die entsprechende personelle und technische Befähigung hat. Annahmekriterien: Die Proben und Aufträge werden auf Vollständigkeit geprüft, ob zu jedem Auftrag das geeignete Material vorhanden ist und ob die Analysierbarkeit der Probe gewährleistet ist. Auf den Anforderungsbelegen müssen mindestens folgende Angaben vorhanden sein: 14 Art der Primärprobe und ggf. anatomischer Herkunfsort Klinische Angaben, Alter und Geschlecht des Patienten A . Hi n w e i s e z u r P r ä a n a ly t ik Datum und Uhrzeit der Entnahme Anforderer (Name, LANR; BSNR, postalische Anschrift) Angeforderte Untersuchungen Für Kassenpatienten außerdem die für die korrekte Abrechnung benötigten Angaben wie Kassen- und Versichertennummer etc. und die Angabe der Diagnose. Die Proben werden im Laboratorium mit Datum und Uhrzeit des Eingangs der Probe sowie einem Barcodeetikett versehen. Proben mit falschem oder ohne den erforderlichen Zusatz werden nicht akzeptiert und der Auftrag wird entsprechend kommentiert. Gleiches gilt für Proben, bei denen die Anforderungen an die Präanalytik nicht berücksichtigt wurden, z. B. Proben, die nicht temperiert in das Labor gebracht wurden. In diesen Fällen wird mit dem Einsender telefonisch Rücksprache gehalten. Wenn nach Rücksprache mit dem einsendenden Arzt die Untersuchung dennoch auf ausdrücklichen Wunsch des Einsenders entgegen dem Vorgehen des Labors durchgeführt werden soll (z. B. unersetzbare bzw. kritische Primärprobe wie Liquor oder Biopsie), wird dies auf dem Befund dokumentiert und die dafür verantwortliche Person (z.B. einsendender Arzt) ebenfalls im Befundbericht ausgewiesen. Laboranforderungsbeleg: Die Anforderung von Laboruntersuchungen ist grundsätzlich eine ärztliche Handlung, die den Charakter einer ärztlichen Verordnung trägt. Sie bedarf grundsätzlich der Schriftform (Laboranforderungskarte, Überweisungsschein o.ä.) und prinzipiell der Unterschrift des Arztes. Mit der Unterschrift bestätigt der Arzt u.a.: Die Indikation bzw. die Fragestellung der Anforderung Die Repräsentanz des Untersuchungsmaterials Die Richtigkeit spezieller Daten wie Diagnose, bisherige Medikamentengaben usw. Die Identität zwischen dem Namen auf dem Untersuchungsgefäß und dem Patienten, von dem das Untersuchungsmaterial gewonnen wurde. Fehlen die diagnostische Fragestellung, Diagnose, Angaben zur Sammelzeit und Menge, Alter, Geburtsdatum, Geschlecht, Schwangerschaftswoche u.v.a.m., kann zwar ein Laborergebnis erstellt werden, jedoch können die Plausibilität, die Einordnung in entsprechende Referenzbereiche, weiterführende Berechnungen etc. nicht durchgeführt werden. 15 A . Hi n w e i s e z u r P r ä a n a ly t ik Telefonische Nachmeldung von Anforderungen/Aufbewahrungszeiten: Telefonische Nachmeldungen von Anforderungen sind untersuchungsabhängig innerhalb einer bestimmten Zeit möglich. Nach Abschluss der Analysen werden die Proben in Abhängigkeit von der Stabilität aufbewahrt und danach entsorgt. In dieser Zeit können weitere Untersuchungen sowie Kontrolluntersuchungen nach Rücksprache mit der Leitung nachgefordert werden. Die Stabilität des gelagerten Materials bezüglich der nachgeforderten Untersuchung wird geprüft. Mündliche (Nach-)Anforderungen werden duch unsere Aufragserfassung in unserem Laborinformationssystem unter „Diagnosen“ dokumentiert und auf dem Original-Überweisungsschein/ Auftragsformular nachgetragen. Proben Blutbildausstriche, gefärbt Bereich Hämatologie Aufbewahrungszeit 6 Monate Temperatur Raumtemperatur Citratplasma Gerinnung Tiefgefrorenes (!) Citratplasma nach Rücksprache bzw. Aufbewahrungsanforderung Gerinnung 7 Tage nur (!) zur Identifikation 2 Wochen Citrat-Vollblut Blutsenkung 7 Tage EDTA-Vollblut Hämatologie 7 Tage Vollblut (Blutkuchen und Serum getrennt), EDTA-Vollblut (Erythrozyten und Plasma getrennt) Blutgruppenserologische Untersuchungen 2 Wochen Raumtemperatur nur (!) zur Identifikation Im – 20°C Tiefkühlschrank (- 70°C für längere Aufbewahrungszeiten) Raumtemperatur nur (!) zur Identifikation Raumtemperatur nur (!) zur Identifikation Kühlschrank NaF-Röhrchen/-Plasma Kohlenhydratstoffw. 1 Woche 16 Kühlschrank (Stabilität der Glucose 2 Tage), danach nur (!) zur Identifikation A . Hi n w e i s e z u r P r ä a n a ly t ik Serum Immunologie 7 Tage Kühlschrank Serum-/ LiHep.-Plasma Klinische-Chemie 7 Tage Kühlschrank Serum, Urin, etc. Toxikologie 4 Wochen Tiefkühlschrank Malariapräparate Mikrobiologie 3 Monate Raumtemperatur Untersuchungsmaterial (Abstrich, Sekret, Sputum, Stuhl, Urin, etc.) Mikrobiologie 7 Tage Kühlschrank Hinweis: Aufbewahrungszeiten über die Stabilität der Probe hinaus dienen nur zur Identifikation. Notfallanalytik: Notfall-/EILT-Proben werden von Ihnen als Einsender mit dem von uns zur Verfügung gestellten sog. „Roten Aufkleber“ („Notfall/EILT!) gekennzeichnet, in gesonderte, ebenfalls „Rote Versandbeutel“ aus Kunststoff gelegt. Werden derart gekennzeichnete EILT-Proben dem Fahrdienst mitgegeben, werden sie nach Eintreffen in unserem Labor vorrangig bearbeitet. D.h.: Da der Fahrdienst nicht jede Praxis isoliert anfahren kann, sondern in der Regel seine Tour einhalten muss, erfolgt nur eine beschleunigte Bearbeitung. Dabei kann man mit Bearbeitungszeiten inklusive Erfassung, Analyse und Faxen des Befundes von 2 Stunden rechnen. Für Proben, die als Notfall in kürzester Zeit in unserem Labor analysiert werden sollen, müssen Sie immer telefonisch ein Taxi oder einen sog. „Schnellen Fahrradboten“ bei uns anfordern! Zeitkritische Untersuchungen werden, falls erforderlich, wie Notfalluntersuchungen behandelt und bei entsprechender Kennzeichnung und/oder nach tel. Ankündigung vorrangig analysiert. 17 A . H i n w e i s e z u r P r ä a n a ly t i k Zurückweisung von Primärproben/Nichtbearbeitung: Primärproben müssen, üblicherweise durch das Anforderungsformular, auf eine identifizierte Person rückverfolgbar sein. Primärproben, bei denen ein Nachweis der Identität fehlt, dürfen durch unser Labor nicht angenommen oder bearbeitet werden! Der Einsender wird grundsätzlich benachrichtigt, wenn die eingesandten Proben wegen Ungewissheit über die Identität nicht bearbeitet werden können. Im Befundbericht wird die Art des Problems (z. B. Transportbedingungen nicht eingehalten) ausgewiesen und ggf. darauf hingewiesen, dass das Ergebnis mit Vorsicht zu interpretieren ist. Mögliche Ursachen für Veränderungen in der Probe: Stoffwechsel der Blutzellen, Verdunstung, chemische Reaktionen, mikrobiologische Zersetzung, osmotische Prozesse, Lichteinflüsse, Gasdiffusion u. a.. Mögliche Gegenmaßnahmen: Schneller Transport (falls erforderlich), angemessene Kühlung (beachte alphabetisches Untersuchungsverzeichnis), verschlossene Einweg-Probengefäße (Verdunstung), Glykolyse vermeiden durch Verwendung von Probenröhrchen mit Glykolyseinhibitoren (NaF-Röhrchen), Lichteinwirkung vermeiden (z.B. kein Konzentrationsverlust von Bilirubin in speziellen Mikrogefäßen für Neugeborene, dunkle Urinsammelgefäße für Porphyrinnachweis, etc.)., Kühlung von Urinproben, sorgfältiges Durchmischen der Proben nach dem Auftauen bzw. nach dem Sammeln. Sichere Entsorgung des bei der Probennahme verwendeten Materials: Die Entsorgung der verwendeten Sicherheitskanülen oder –butterflies erfolgt in dichte, durchstichresistente Behälter, die entsprechend gekennzeichnet sind. Bei Verwendung von Mikroblutentnahmesystemen wie z. B. „Butterflies“ wird das gesamte Blutentnahmesystem entsorgt. Ein „Recapping“, d. h. das Wiederaufstecken von Nadeln auf Schutzköcher, ist nicht statthaft. Evtl. nicht benötigte Probenröhrchen mit Blut und anderen Körperflüssigkeiten stellen ein Infektionsrisiko dar und werden ebenfalls in bruch- und stichfesten Behältern direkt in Ihrer Praxis entsorgt. Bitte sorgen Sie in Ihrer Praxis bzw. auf Ihrer Station für eine ordnungsgemäße Entsorgung der Sammelgefäße! 18 B . M ik r obio l ogi s c h e U n t e r s u c h u n g e n Unser Labor verfügt über ein breites Spektrum an mikrobiologischen Untersuchungsverfahren. Die eingesendeten Untersuchungsmaterialien werden für die von Ihnen gewünschten Untersuchungen mittels der am besten geeigneten Untersuchungverfahren untersucht. Die Verfahrensweisen richten sich in der Regel nach den Empfehlungen der jeweiligen wissenschaftlichen Fachgesellschaften. Beim kulturellen Nachweis eines Krankheitserregers wird von uns, neben der Differenzierung nach Gattung und Art, eine Resistenzbestimmung gegen die gebräuchlichsten Antiobiotika durchgeführt. Um den bestmöglichen Untersuchungsgang auswählen zu können, bitten wir Sie um Angaben zu Materialentnahmeort und –zeitpunkt, dem Untersuchungsziel und der Diagnose bzw. Symptomatik. Wir stellen Ihnen alle erforderlichen Entnahme- und Versandmaterialien zur Verfügung: Universalröhrchen: Steril, für Untersuchung von Urin, Punktaten, Liquor sowie Serum und Vollblut. Abstrichtupfer(dick/dünn) Steril, für Abstriche unterschiedlicher mit Transportmedium: Art wie Nase, Rachen, Ohr, Auge und Genitalbereich. Abstrichtupfer ohne Transportmedien sollten wegen der hohen Absterberate der Keime wäh­ rend des Transports nicht verwendet werden. Blutkulturflaschen: Zur Anzucht von aeroben und anae­roben Keimen. Die Flaschen sind ebenfalls zum Transport anderer flüssiger, primär steriler Materialien wie Liquor oder Pleurapunktat geeignet, insbesondere bei Verdacht auf Infektion durch empfindliche Keime wie Meningokok­ ken oder Haemophilus . Für die Untersuchungsanforderung können Sie unseren Begleitschein für mikrobiologische Untersuchungen verwenden, auf dem die wichtigsten Materialien und Untersuchungen bereits vorgedruckt sind und nur angekreuzt werden müssen. Routinemäßig sind die nachfolgend aufgeführten Untersuchungsverfahren verfügbar. Sollten Sie die gewünschte Untersuchung hier nicht finden, so bitten wir Sie, mit uns Kontakt aufzunehmen. Sollten wir das gewünschte Verfahren tatsächlich nicht durchführen, sind wir Ihnen gerne behilflich, nach einem alternativen Verfahren zu suchen und ggf. ein Speziallabor für seltene Erreger zu vermitteln. Wir stehen als Fachärzte für Mikrobiologie, Virologie, Infektionsepide­ miologie und Laboratori­ umsmedizin allen Kolleginnen und Kollegen jederzeit für mikrobiologisch-infektiologi­ sche sowie hygienische Fragen, auf Wunsch auch im Krankenhaus oder in der Praxis, zur Verfügung. Ohne TransportmediumPCR und weitere spezielle Untersuchungsverfahren Stuhlröhrchen: Steril, mit Plastiklöffelchen. Sputumröhrchen: Steril, mit großer Öffnung. 19 B. Mikrobiologische Untersuchungen 1. Bakteriologische Standarduntersuchung P mikroskopisch P kulturell P Resistenzbestimmung 2. Gezielte Untersuchung auf P ß-hämolys. Streptokokken P Anaerobier P Gardnerella vaginalis P Diphtherie P Gonokokken P Helicobacter pylori P Mykoplasmen/Ureaplasmen P Legionellen 3. Darmpathogene Erreger P Salmonellen/Shigellen P Campylobacter P Yersinien P EHEC P (darmpathogene) E.coli P Clostridium difficile (Toxin) P Aeromonaden P Adenoviren P Rotaviren P Noroviren 4. Tuberkulose / atypische Mykobakterien (MOTT) P mikroskopisch P kulturell (konventionell und BACTEC) P PCR (Polymerase-Kettenreaktion) P Resistenzbestimmung 20 5. Direktnachweise P Chlamydien (PCR) P Gonokokken (PCR) P Influenza A, B P Pertussis (PCR) P Herpes simplex Typ 1 / 2 (PCR) 6. Pilzinfektionen Sprosspilze P Hautpilze P Schimmelpilze P Pneumocystis jiroveci P 7. Parasiten: P Amöben P Cryptosporidien P Lamblien P Leishmanien P Malaria P Mikrosporidien P Schistosomen (Bilharziose) P Trichomonaden P Trypanosomen P Wurmeier/Wurmglieder 8. Sterilisations- und Desinfektionskontrolle: PSporenpäckchen und Testkörper mit zugehörigem Dokumen­ ta­tionsmaterial werden von uns zur Verfügung gestellt Die nachstehenden Hinweise wurden in Anlehnung an die Verfah­rensrichtlinien der Deutschen Gesellschaft für Hygiene und Mikro­biologie erstellt. B . M ik r obio l ogi s c h e U n t e r s u c h u n g e n 1. Abstriche: PMit Abstrichtupfer Material unter Sicht von verdächtigen Stellen entnehmen und in beigefügtes Röhrchen mit Trans­ portmedium einbringen. Tupfer nie trocken einsenden, da Anzucht anspruchsvoller Keime anschließend nicht mehr gelingt. PLagerung sowie anschließender Transport bei Raum­temperatur. a. Augenabstrich: PProbenentnahme muss vor Beginn jeglicher Antibiotika- oder Lokalanästhetikatherapie erfolgen. Lokalanästhetika enthal­ ten häufig antibakterielle Additive! PSind beide Augen betroffen, sollten beide Seiten getrennt untersucht werden. PUnteres Augenlid herunterziehen, um die Konjunktiva freizu­legen. PMaterial mit Wattetupfer von Bindehautoberfläche entneh­ men und sofort in Transportmedium einbringen. b. Gehörgangsabstrich: PMaterial unter Sicht (Otoskop) von entzündeten Bereichen mit Tupfer entnehmen und in Transportmedium einbringen. PBei trockenen Entzündungsformen Tupfer zuvor mit steriler NaCl anfeuchten! PBerührung unauffälliger Hautbereiche vermeiden (Konta­mination!). PBei Verdacht auf Otomykose sollten auch Hautschuppen von der Wand des Gehörgangs mit einem sterilen Spatel entnommen und trocken in einem Universalröhrchen ein­gesandt werden. PBei akuter Otitis media kann Sekret vom Tubenausgang im Pharynx mittels Tupfer entnommen werden. Bei Trommel­ felldefekten gelingt die Entnahme meist auch aus dem Gehörgang. c. Larynxabstrich: PNur bei isolierten Affektionen im Bereich von Larynx und Epiglottis. Besteht parallel eine Tracheobronchitis, ist der Gewinnung von Tracheal- bzw. Bronchialsekret der Vorzug zu geben. PDurchführung mit Spiegel oder Lupenendoskop. Material­ entnahme mittels dünnem Tupfer. Transportmedium ver­wenden! d. Urethralabstrich: POptimale Entnahme morgens vor dem ersten Wasserlassen, Entnahme vor Ablauf einer Stunde nach dem letzten Was­ serlassen nicht sinnvoll. PAusfluss aus der Urethra, falls vorhanden, mit Tupfer aufneh­ men und in Transportmedium einbringen. PAndernfalls Tupfer mit dünnem Stiel ca. 2 cm in die Urethra einführen und nach vorsichtigem Drehen in Transportme­ dium einbringen. e. Vaginalabstrich: PMittels Abstrichtupfer Material zum Nachweis von Mycoplas­ men, Gardnerella, Sprosspilzen sowie von B-Streptokokken in der Schwangerschaft entnehmen und im Transportmedi­um einsenden. (zum GO-Nachweis spezielle Hinweise unter 10.d beachten) f. Zervixabstrich: PNach Spekulumeinstellung Zervix mit separatem Wattetupfer trocken­wischen. Leichte Kompression der Portio führt zum Austritt endozervikalen Sekrets (zur GO-Diagnostik geeignet). 21 B. Mikrobiologische Untersuchungen 2. Blutkulturen: a. Vorbereitungen: PBlutkulturflasche(n) auf Raumtemperatur oder Körper­ temperatur erwärmen. Unbedingt zwei Blutkulturflaschen - für aerobe und anaerobe Kultur - getrennt beimp­fen (bitte genau beschriften!). Die entsprechenden Systeme stellen wir auf Anfrage zur Verfügung. b. Hautdesinfektion und Blutentnahme: PHaut im Bereich der Punktionsstelle sorgfältig reinigen und entfetten. PAnschließend Desinfektionsmittel mit sterilem Tupfer einrei­ ben und zwei Minuten einwirken lassen. PNach Lufttrocknung Vene oder Arterie mit Einmalspritze oder Blutentnahmebesteck punktieren. PBei Erwachsenen ca. 10 ml Blut pro Flasche entnehmen. Für Kinder sind spezielle Blutkulturflaschen (Blutmenge ca. 1-3 ml) verfügbar. Nach Entfernen der Abdeckkappe Septum mit 70%-igem Alkohol desinfizieren. Bei Blutentnahme mit einer Spritze eine frische, sterile Kanüle zum Inokulieren der Blutkulturflasche benutzen. Blutkulturflaschen nicht belüften. PExakte Beschriftung der Flasche(n) unter Angabe von Name, Vorname, Datum und Uhrzeit. c. Lagerung – Transport: PBeimpfte Flaschen bis zum Trans­port ausschließlich bei Raumtemperatur aufbewahren, nicht in den Brutschrank stellen! PSo rasch als möglich in das Labor bringen. 22 d. Hinweise: PMit der Anzahl der entnommenen Proben steigt die Häufig­ keit eines Erregernachweises aus der Blutkultur. Das Anle­gen von mehr als 5 Blutkulturen von einem Patienten ist in der Regel nicht sinnvoll. PDie Entnahme einer einzigen Probe reicht für den sicheren Nachweis einer Bakteriämie bzw. Fungämie nicht aus. PDie erste Blutentnahme sollte nach Möglichkeit vor Thera­ piebeginn erfolgen. Bei bereits begonnener antibiotischer Therapie sollten wäh­ rend der ersten 48 Stunden insgesamt 4 Proben jeweils kurz vor einer Antibiotikagabe entnommen werden. PBei den meisten bakteriellen Endokarditiden sind die Erre­ger kontinuierlich im Blut vorhanden, in größerer Menge jedoch nur im Fieberanstieg. Es ist deshalb für eine erfolg­reiche Erregeranzucht sehr wichtig, das Blut so früh wie möglich in der Fieberperiode zu entnehmen. 3. Bronchialsekret - Trachealsekret: Bronchialsekret wird instrumentell mit oder ohne Spülung aus den tiefen Atemwegen gewonnen. a. Bronchoskopiematerial: PMittels bronchoskopischer Technik wird die Kontamination des Untersuchungsmaterials durch die Flora des MundRachen-Raums gemindert, kann aber aufgrund einer Verschleppung der dort ansässigen Mikroorganismen bei Einführung des Gerätes nicht sicher ausgeschlossen werden. PDie Sekretgewinnung soll möglichst ohne Spülung mittels Aspiration durch das Bronchoskop erfolgen. Ist ausreichen­de Materialgewinnung so nicht möglich, sollte ausschließlich mit steriler Ringer-Laktat-Lösung und nicht mit physiologi­ scher Kochsalzlösung (bakterizide Wirkung möglich!) gespült werden. B . M ik r obio l ogi s c h e U n t e r s u c h u n g e n POptimal erfolgt die bronchoskopische Gewinnung von Unter­ suchungsmaterial für mikrobiologische Untersuchungen durch Bürstenbiopsie, da diese Methode am häufigsten sig­nifikante Keimnachweise ermöglicht. Das gewonnene Material sollte möglischst rasch zum Labor transportiert werden. b. Transtracheale Aspiration: PDie Kontamination mit Oropharyngealflora wird mit großer Sicherheit vermieden. PAnwendung zwingend indiziert bei schweren Anaerobier­ infektionen und nekrotisierender Pneumonie. PInsertionsstelle und nähere Umgebung gründlich desin­fi­zie­ren. PKatheter mit steriler Pinzette entfernen und zu unter­su­ chende Abschnitte in ein steriles Leerröhrchen einbringen. PKatheter bis ca. 10 cm Länge: etwas unterhalb der Inser­ tions­stelle mit steriler Schere abschneiden und diese Kathe­ terspitze steril in Röhrchen einbringen. PKatheter über 10 cm Länge: Zusätzlich zur Katheterspitze ein ca. 5 cm langes Stück distal der Insertionsstelle heraus­ schneiden und ebenfalls steril einsenden. c. G ewinnung von Untersuchungsmaterial aus Trachealtubus bzw. Tracheostoma: PBei Tubus- bzw. Kanülenwechsel sterilen Absaugkatheter einführen, Sekret aspirieren und in ein steriles Röhrchen einbringen. Ein Abschneiden der Katheterspitze mit steriler Schere und Einsendung in einem mit Transportmedium ge­füllten Röhrchen ist ebenfalls möglich. PNach intratrachealer Intubation bzw. Anlegen eines Tracheostomas kommt es rasch zu einer Besiedlung der tiefen Atemwege mit Oropharyngealflora. Dies muss bei der Interpretation der Untersuchungsergebnisse berücksichtigt werden. PFür mikrobiologische Diagnostik Material direkt nach Gewin­ nung in ein steriles Röhrchen einbringen und bei Raumtem­ peratur transportieren. 5. Liquor: PVor Punktion sorgfältige Hautdesinfektion entsprechend der Vorgehensweise bei der Entnahme von Blutkulturen (siehe unter 2 b). PNach der Lumbal- oder Subokzipitalpunktion die ersten 2–5 Tropfen verwerfen (Abtrennung von Desinfektionsmittel, Ge­websflüssigkeit und Blut). Anschließend 5-10 ml Liquor in einem, besser zwei sterilen Röhrchen auffangen. Röhrchen unter sterilen Kautelen verschließen. PSofortiger Transport der bei Raumtemperatur (nicht im Kühl­ schrank!) zu lagernden Probe in das Labor, da empfindliche Erreger (v.a. Meningokokken) bereits nach kurzer Zeit ab­ster­ben. PBei Verdacht auf eitrige Meningitis empfiehlt sich das Ein­brin­gen eines Teils des Materials in eine (vorgewärmte) Blutkulturflasche. Anschließend Lagerung der Flasche bei 36°C im Brutschrank und eiliger Transport in das Labor. 4. Intravasale Katheter: PBei Verdacht auf Kathetersepsis oder Entzündung im Be­reich der Insertionsstelle ist häufig die Entfernung und nach­folgende mikrobiologische Untersuchung des Katheters indi­ziert. 6. Sputum: (auf Anforderung Kurzinformationsblatt (Patienteninformation) bei uns erhältlich) PHäufigstes Untersuchungsmaterial zur mikrobiologischen Diagnostik von Infektionen der Lunge und tiefen Atemwege. 23 B. Mikrobiologische Untersuchungen Durch die praktisch unvermeidbare Speichelbeimengung kommt es regelmäßig zu einer Verunreinigung der Probe mit Oropharyngealflora. Zur Erzielung verwertbarer Befunde sind an die Gewinnung von Sputum daher besonders hohe Anforderungen zu stellen. PAm geeignetsten ist Morgensputum, d.h. Sekret aus den tie­ fen Atemwegen, das sich während der Nacht angesammelt hat und nach dem Erwachen abgehustet wird. Folgende Hinweise müssen beachtet werden: PVor der ersten Expektoration nicht den Mund ausspülen (Gefahr der Kontamination mit atypischen Mykobakterien aus Leitungswasser). PSekret in einen sterilen Sputumbecher abhusten. Gefäß ver­schließen, ohne Innenrand oder Verschlusskappen­innen­flä­ che zu berühren. Becher korrekt beschriften. PFür raschen Transport in das Labor sorgen. PIst eine spontane Sputumgewinnung nicht möglich, empfiehlt sich ein Provokationsversuch durch Inhalation eines etwa 45°C warmen, hypertonen Aerosols (z.B. 10 % NaClLösung in 15 % Propylenglykol) 7. Stuhl - Rektalabstrich - Analabstrich: ist das geeignete Untersuchungsmaterial. Rektalabstriche sollen aufgrund der zu erwartenden gerin­ gen Ausbeute nur dann entnommen werden, wenn kein Stuhl zu gewinnen ist. Abstrichtupfer nach Entnahme sofort in Transportmedium einbringen. PUntersuchung von Stuhl auf pathogene Darmkeime grund­ sätzlich an drei verschiedenen Tagen, da der Erregernach­weis in einer einzigen Probe nicht immer gelingt. PStuhl 24 PStuhlentleerung in ein sauberes Gefäß, das keine Seifenoder Desinfektionsmittelreste enthalten darf, Urinbeimen­ gungen müssen unbedingt vermieden werden. PÜberführen eines doppeltbohnengroßen Stücks in ein Stuhl­röhrchen. Größere Stuhlmengen treiben aufgrund der auf­tretenden Gasbildung den Deckel aus dem Röhrchen. Bei dünnflüssigem Stuhl ca. 0,5 bis 1 ml des Materials einsen­den. PJede einzelne Stuhlprobe zügig in das Labor transpor­tieren, nicht sammeln. Empfindliche Keime wie Shigellen sterben schon nach kurzer Zeit ab. PSind dem Stuhl Eiter- oder Schleimflocken aufgelagert oder finden sich blutige Anteile, sollten diese sehr bakterienhal­ ti­gen Strukturen mit Wattetupfern entnommen und nach Ein­brin­gen in ein Transportmedium getrennt untersucht werden. PBei Verdacht auf Typhus und Paratyphus ist die (parallele) Entnahme von Blutkulturen, vor allem in der ersten Krank­ heitswoche, in jedem Falle notwendig. Analabklatsch (Nachweis von Enterobius vermicularis (Oxyuren)-Eiern) PMaterialgewinnung frühmorgens durchführen. PDie Wurmeier werden im äußeren Analbereich abgelegt. Nach Spreizen der Perianalfal­ten glasklaren Klebefilm über die Anal­öffnung und die flachgezogenen Perianalfalten kle­ben. PKlebefilm mit den anhaftenden Wurmeiern abziehen und auf Objektträger aufkleben. PObjektträger mit Patientendaten beschriften und in Trans­ port­hülse zur mikroskopischen Untersuchung in das Labor einsenden. B . M ik r obio l ogi s c h e U n t e r s u c h u n g e n 8. Urin: a. Mittelstrahlurin (MSU): PMethode der Wahl für die orientierende bakteriologische Urin­untersuchung (außer bei Vorliegen einer Phimose). PAm besten geeignet ist Morgenurin, da hier besonders hohe Keimzahlen zu erwarten sind. In jedem Falle sollte die letzte Miktion länger als drei Stunden zurückliegen. Keine In­fu­ sions­therapie vor Urinentnahme durchführen (Ver­dünnungs­ effekt), Probe vor Chemotherapiebeginn entneh­men. PTritt innerhalb von drei Tagen keine Besserung ein, so ist zur Erkennung resistenter Erreger unter Antibiotikatherapie eine Kontrolluntersuchung notwendig. Gewinnung von MSU (Mittelstrahlurin) beim Mann: PHände mit Seife waschen und mit Einmalhandtuch abtroc­knen. PVorhaut mit der einen Hand vollständig zurückziehen, mit der anderen Hand Glans penis mittels eines in sauberes Wasser getauchten Tupfers reinigen, dann mit einem zwei­ten Tupfer in gleicher Weise nachreinigen. Orificium urethrae mit einem dritten Tupfer trocknen. PErste Urinportion (ca. 50 ml) in die Toilette oder ein Gefäß entleeren, dann - ohne den Harnstrahl zu unterbrechen - etwa 5 ml Urin im vorher griffbereit abgestellten Transport­ gefäß auffangen, und zwar unter strikter Vermeidung einer Verunreinigung des Gefäßrandes durch Hand, Kleidung etc. Verschluß sofort aufsetzen und Probe bis zur Weiterleitung in das Labor im Kühlschrank bei 4°C lagern. Gewinnung von MSU (Mittelstrahlurin) bei der Frau: mit Seife waschen und mit Einmalhandtuch abtroc­knen. PMit einer Hand die Labien spreizen und geöffnet halten, bis die Uringewinnung abgeschlossen ist. PVulva mit der anderen Hand mittels eines in sauberes Was­ser getauchten Tupfers durch Wischen von vorn nach hinten reinigen, dann mit einem zweiten Tupfer in gleicher Weise nachreinigen. PBereich um das Orificium urethrae mit trockenem dritten Tupfer trocknen und diesen in den Introitus vaginae ein­le­ gen, um einen möglichen Harnreflux und damit eine Verun­ reinigung durch Fluor auszuschließen. PErste Urinportion (ca. 50 ml) ablaufen lassen, dann - ohne den Harnstrahl zu unterbrechen - etwa 5 ml Urin im Einweg­ becher auffangen und zwar unter strikter Vermeidung einer Verunreinigung des Gefäßrandes durch Hand, Oberschen­kel, Vulva oder Kleidung. Tupfer anschließend aus der Scheide entfernen. PUrin in Transportröhrchen füllen, Verschluß aufsetzen. Probe bis zur Weiterleitung in das Labor im Kühlschrank bei 4°C lagern. PHände b. Katheterurin: Eine Indikation zur Gewinnung von Katheterurin ist unter fol­ genden Umständen gegeben: PDie einwandfreie Gewinnung von Mittelstrahlurin ist nicht möglich. PBlasenpunktion kommt nicht in Betracht. PGrundsätzlich sind Einwegkatheter zu verwenden, ein ge­wis­ses Risiko der Keimeinschleppung bleibt jedoch beste­ hen. Eine sorgfältige Reinigung des Genitale muß vor dem Eingriff durchgeführt werden (s. MSU). Das Risiko einer 25 B. Mikrobiologische Untersuchungen Keim­einschleppung wird insbesondere bei der Frau nur dann ausreichend gemindert, wenn spezielle Unter­su­chungs­ einrichtungen (gynäkologischer Untersuchungsstuhl) zur Verfügung stehen. PDauerkatheterträger: Urin für mikrobiologische Unter­su­chun­ gen darf keinesfalls aus dem Urinbeutel entnommen werden. Die Entnahme erfolgt nach sorgfältiger Desinfektion per Kathe­terpunktion im proximalen Abschnitt. c. Blasenpunktionsurin: Blasenpunktion setzt eine gefüllte Blase voraus. Im Be­reich der Punktionsstelle ist eine Entfernung der Scham­haare sowie eine Hautdesinfektion erforderlich. Die Methode schließt die Gefahr einer Kontamination des Urins nahezu aus und ist daher aus bakteriologischer Sicht die sicherste Grundlage eines aussagekräftigen Befundes. Zu berück­sich­tigen ist jedoch, daß dabei keine hinreichende Sicherheit einer Erkennung der Infektion infravesikal gelegener Ab­schnit­te der Harnwege (z.B. Prostatitis, Urethritis) gegeben ist. PBei der ambulanten Betreuung von Patienten in der Praxis wird diese Methode aufgrund der organisatorischen Pro­ bleme (Wartezeit bis zur Prallfüllung der Blase) Sonderfällen vorbehalten sein müssen. PDie Als Indikation gelten: PProbleme hinsichtlich einwandfreier Gewinnung von Mittel­ strahl- und Katheterurin (z.B. Phimose). PWiederholt uneinheitlicher bakteriologischer und zellulärer Befund. PMehrfach fragliche Ergebnisse der quantitativ-bakterio­lo­ gischen Untersuchung, insbeson­dere bei Mischinfektionen. 26 d. Uringewinnung bei Säuglingen und Kleinkindern: PHäufig ist die Verwendung von Kunststoffklebebeuteln un­ver­zichtbar: PVor Aufkleben gründliche Reinigung der Dammregion ohne Verwendung von Desinfektionsmitteln vornehmen, da sonst ein bakterizides Milieu im Beutel entstehen kann. PBakteriologische Befunde sollten zurückhaltend interpretiert werden. PWiederholte Kontrollen empfehlenswert. 9. Wundsekrete - Punktate - OP.-Material: a. Material aus geschlossenen Prozessen: PMaterialgewinnung durch Punktion und Aspiration mit einer Spritze unter aseptischen Bedingungen. Material in steriles Röhrchen einbringen, Lagerung und Transport bei Raum­temperatur. PBei Verdacht auf Anaerobier verbleibt das Material in der am Ansatzkonus zu verschließenden Spritze. Anschließend so­for­tiger Transport bei Raumtemperatur in das Labor. Keine Kühlschranklagerung, da Anaerobier sehr kälteempfindlich sind. Alternativ ist auch das Einspritzen des Materials in eine vorgewärmte Blutkulturflasche möglich. Anschließend sofortiger Transport in das Labor oder Lagerung der Probe bei 36°C im Brutschrank. Diese Vorgehensweise eignet sich besonders für Pleura- und Peritonealpunktate. PFür die optimale mikrobiologische Punktatdiagnostik sollten bei ausreichender Flüssigkeitsmenge je 5-10 ml in aerobe und anaerobe Blutkulturflaschen injiziert sowie gleichzeitig 10 ml in sterilem Universalröhrchen eingesandt werden. PBestimmung des spezifischen Gewichts sowie des Gesamt­ eiweißes im Punktat sowie Kristallnachweise und ähnliche Untersuchungen sind aus Transportmedien nicht möglich. B . M ik r obio l ogi s c h e U n t e r s u c h u n g e n b. Material aus offenen Prozessen: PSekret vom Wundrand mit Abstrichtupfer entnehmen und in Transportmedium einbringen. Weiterhin kann auch etwas Geschabsel vom Wundrand in ein steriles Röhrchen mit steriler physiologischer Kochsalzlösung eingebracht werden. 10. G ewinnung von Material für Spezialuntersuchungen: a. Chlamydien-Diagnostik: PChlamydien können auf üblichen Nährböden nicht kultiviert werden, die Anzucht gelingt nur in Zell- und Gewebekultu­ ren. Ein kultureller Chlamydien-Nachweis ist daher sehr auf­wendig und sollte nur in Ausnahmefällen angefordert wer­den. PEinfach und schnell gelingt der Direktnachweis mittels PCR (benötigtes Versandmaterial wird auf Anforderung zur Verfügung gestellt). Der PCR-Nachweis verfügt über eine sehr hohe Spezifität und Sensitivität, daher ist auch ein einfacher Nachweis aus dem Urin möglich und die häufig schmerzhafte Abstrich­entnahme aus Urethra oder Zervix ist nicht mehr erfor­derlich. PNatürlich wird auf Wunsch auch weiterhin Abstrichmaterial untersucht. Hierbei ist zu beachten, dass sich Chlamydien innerhalb der von ihnen infizierten Epithelzellen befinden. Das Untersuchungsmaterial muss daher zellreich sein. Eiter und Exsudate sind somit zur Chlamydien-Diagnostik unge­eignet. PCR-Nachweis: PHierzu kann eine Urinprobe oder ein trockener Abstrichtupfer ein­geschickt werden. Ein paralleler GonokokkenDirektnachweis aus derselben Probe ist möglich. Zervixabstrich: PMit einem Tupfer Ausfluss und überflüssigen Schleim vom Ostium und der umliegenden Schleimhaut entfernen. Tupfer verwerfen. PProbenentnahmetupfer 1 – 1,5 cm in den Zervikalkanal ein­führen, bis die Tupferspitze gerade den squamös-kolum­nä­ ren Übergang passiert hat. Tupfer ca. 30 Sekunden inner­halb des Zevrixkanals drehen, um genü­gend Epithelzellen zu gewinnen. PAbstrichtupfer vorsichtig entfernen, ohne die Vaginal­ schleimhaut zu berühren. PAlternativ kann die Materialentnahme mit einer ZytologieBürste durchgeführt werden. Bürste etwas über die Hälfte in den Zervikalkanal einführen und langsam eine ganze Drehung vornehmen. Cave: Bürstenabstrich nicht in der Schwangerschaft! PPCR: Es werden normale bakteriologische Abstrichtupfer verwendet (nicht im Transportmedium, sondern trocken einsenden, siehe oben). Urethralabstrich: PDurch die PCR-Chlamydiendiagnostik aus dem Urin wird sich der belastende Urethralabstrich in vielen Fällen er­übri­gen (siehe oben). PPatient sollte vor Probenentnahme mindestens eine Stunde nicht uriniert haben. PDünnen Abstrichtupfer 2–4 cm tief in die Urethra einführen. Tupfer 2–3 Sekunden eingeführt lassen und vorsichtig rotie­ ren, um ausreichend Epithelzellen abzulösen. PTupfer entfernen und je nach angewandter Methode wie im Abschnitt „Zervixabstrich“ beschrieben fortfahren. 27 B. Mikrobiologische Untersuchungen Bindehautabstrich: PSind beide Augen betroffen, so sollte bei beiden Augen eine Probenentnahme mit getrennter Untersuchung erfolgen. PEiter und Exsudat, falls vorhanden, vorsichtig mit einem Tupfer entfernen. Tupfer anschließend verwerfen. PDünnen Tupfer trocken oder mit etwas steriler physiolo­ gischer NaCl-Lösung befeuchtet unter leichtem Druck auf der Konjunktivaloberfläche des unteren und oberen Lides drehen, es muss Epithelzellmaterial gewonnen werden! PTupfer je nach angewandter Methode wie oben beschrieben weiterverarbeiten. b. Cholera-Diagnostik: PAufgrund spezieller Anforderungen an Gewinnung und Trans­port des Untersuchungsmaterials ist vor Einsendung die telefonische Kontaktaufnahme mit dem Labor unbe­dingt erforderlich. PFlüssiger Stuhl, Schleimflocken oder Rektalabstriche müs­sen in einem Spezialtransportmedium (alkalisches Pepton­wasser) per Eiltransport eingesandt werden. c. Diphtherieverdacht: PBei Verdacht auf Diphtherie muss die Materialgewinnung un­verzüglich, auf jeden Fall vor Beginn einer Therapie mit Anti­biotika oder lokalen Antiseptika erfolgen. (Bereits bei begründetem V. a. Diphtherie ist eine sofortige Antitoxingabe indiziert!) PRachenabstrich: Vorhandene Membranen mit Tupfer ab­strei­ chen, nach Möglichkeit Membranen mit Pinzette abhe­ben und Untersuchungsmaterial von der meist sehr bakteri­en­ haltigen Unterseite gewinnen. Tupfer im Transportmedium einsenden. PJe nach klinischer Situation weitere Abstriche von Nase, Haut oder Nabel entnehmen. 28 PParallel muss immer ein luftgetrockneter Objektträgeraus­ strich vorgenommen und der Objektträger in einer Schutz­ hülle eingesandt werden. d. Gonorrhoe-Diagnostik: PNeben dem konventionellen Gonokokken-Nachweis mittels Mikroskopie und Kultur ist heute zusätzlich ein molekular­ biologisches Verfahren (PCR) zum Direktnachweis verfüg­bar (siehe auch Chlamydien). Diese Methode weist Gono­kok­ken im Vergleich zu den konventionellen Verfahren mit wesentlich verbesserter Empfindlichkeit nach. PCR-Nachweis: PHierzu kann entweder eine Urinprobe eingeschickt werden oder ein trockener Abstrichtupfer verwendet werden. PEin paralleler Chlamydien-Direktnachweis aus derselben Probe ist möglich und auch empfehlenswert, da nicht selten eine Doppelinfektion vorliegt. Konventionelle Diagnostik: PNeben einem Abstrichtupfer im Transportmedium immer zwei luftgetrocknete Ausstriche auf Objektträgern einsenden. Urethralabstrich: PDie sehr sensitive PCR-Methode erlaubt die Untersuchung einer Urinprobe und ersetzt in der Regel die schmerzhafte Abstrichentnahme (siehe oben). PProbengewinnung frühestens eine Stunde nach der letzten Miktion. PMänner: Aus­fluss, falls vorhanden, mit Abstrichtupfer aufnehmen, ggfs. Eiter aus Harnröhre von proximal nach distal ausstreichen, andernfalls dünnen Abstrichtupfer einige cm in die Urethra einführen und vorsichtig drehen. B . M ik r obio l ogi s c h e U n t e r s u c h u n g e n PFrauen: Nach Abwischen der äußeren Urethra mit sterilem Tupfer Harnröhre von vaginal komprimieren und ggfs. aus­tre­ tendes Sekret mit dem Tupfer aufnehmen. Lässt sich so kein Sekret gewinnen, dünnen Abstrichtupfer ca. 2 cm in die Urethra einführen und vorsichtig drehen. Zervixabstrich: PEndocervix mit Spekulum einstellen, aufliegendes Sekret mit sterilem Tupfer entfernen, Zervix komprimieren und austretendes Sekret mit Tupfer auf­nehmen. Bartholinischer Abszess: PNach Drüsenkompression Exsudat auffangen, ggfs. Abszess steril punktieren. Rektalabstrich: PMaterialentnahme aus dem rektalen Kryptenbereich. Gelenkpunktat: Verdacht auf gonorrhoische Arthritis Gelenk unter steri­len Kautelen punktieren; Punktat umgehend in vorgewärmte Blutkulturflasche injizieren und sofort in das Labor einsen­den. PBei der späten Serokonversion zur Diagnose der akuten Malaria vollständig ungeeignet. PBlutentnahme möglichst im Fieberanstieg (bei hoher Para­ sitendichte) vornehmen. Untersuchungsmaterial: EDTA-Blut Die Herstellung von dicken Tropfen und dünnen Ausstrichen erfolgt im Labor. f. Mykologische Untersuchungen: Dermatomykosen (Haut-Haare-Nägel): PAbstriche sind zur Untersuchung auf Dermatophyten grund­ sätzlich nicht geeignet. PVor der eigentlichen Materialgewinnung grobe Krusten und Schuppen entfernen. PMaterial aus bakteriell superinfizierten Bereichen sollte nicht zur mykologischen Untersuchung gelangen. PVersand des Untersuchungsmaterials in trockenem Zustand in sterilen Gefäßen. PKein Transportmedium verwenden! Hautmykose: PHautoberfläche Blutkultur: PBei Verdacht auf generalisierte Infektion bzw. GonokokkenEndokarditis mehrere Blutkulturen, wie unter 2. beschrieben, entnehmen. mit 70%-igem Alkohol abtupfen und troc­knen lassen. PAus der Randzone zwischen krankem und gesundem Gewe­ be ca. 20-40 Hautschuppen mit Skalpell oder scharfem Löffel abschaben (im Zentrum der Läsion sind die Erreger häufig schon abgestorben). e. Malaria-Diagnostik (Direktnachweis): PDer mikroskopische Direktnachweis von Plasmodien im Blut ist die Methode der Wahl. Ein serologischer Nachweis einer früher durchgemachten Infektion ist möglich, aber aufgrund Haarmykose: PVerdächtige Haare und Haarstümpfe mit Epilationspinzette aus der Randzone des Infektionsherdes gewinnen. Reichlich Material einsenden. 29 B. Mikrobiologische Untersuchungen Nagelmykose: PSorgfältige Entfernung aller leicht ablösbaren Nagel- und Gewebsanteile. PNach Vorreinigung mit 70 %-igem Alkohol Abtragung von ca. 30 - 40 feinen Nagelspänen mittels Skalpell, scharfem Löffel o.ä.. PExtrahierte Nägel sollten als Ganzes zur Untersuchung gelan­gen. Schleimhautmykosen (z.B. Soor): PHier gelten die allgemeinen Richtlinien zur Gewinnung von Material für bakteriologische Untersuchungen, wie oben be­schrieben. Lungenmykose: PHohe diagnostische Aussagekraft besitzt z.B. durch Bron­chos­ kopie gewonnenes Bronchialsekret. Ist Bronchialsekret nicht verfügbar, kann auch Morgen­spu­ tum an mehreren, aufeinanderfolgenden Tagen untersucht werden. Wenige Tage vor Beginn der Sputumgewinnung sollte zur Vermeidung einer Kontamination eine Reduktion der oropharyngealen Pilzflora mittels lokaler Antimykotika durchgeführt werden. Nierenmykose: PUntersuchung von Blasenpunktionsurin ist Methode der Wahl zum Nachweis einer Nierenmykose. PDie Verwendung von Katheter- oder Mittelstrahlurin birgt ein erhebliches Kontaminationsri­siko. 30 Fungämie - Sepsis: PAbnahme von 4-5 venösen Blutkulturen, wie unter 2. be­schrieben, an aufeinanderfolgen­den Tagen. PErgänzend kann ein direkter Antigennachweis z.B. für Candida spp. im Serum geführt werden, der insbesondere zum Nachweis einer Sprosspilzsepsis eine gegenüber der Blutkul­turdiagnostik deutlich höhere Sensitivität aufweist. PIm Falle einer Sepsis werden die Erreger regelmäßig renal aus­geschieden, so dass eine zusätzliche mykologische Urin­untersuchung eine wichtige Ergänzung der Diagnostik dar­stellen kann. g. Mykoplasmen- / Ureaplasmen-Diagnostik: Urogenitalinfektionen: PDirekter Erregernachweis ist die Methode der Wahl. Ein Antikörpernachweis ist ohne diagnostische Bedeutung. PUrogenitalabstriche müssen wegen der großen Empfind­ lichkeit der Mykoplasmen gegenüber Umwelteinflüssen in ein Transportmedium eingebracht werden. PUrin kann bei Einsendung im Spezialtransportmedium (wird auf Anfrage vom Labor zur Verfügung gestellt) zum Direkt­ nachweis Verwendung finden. PEine parallele Untersuchung hinsichtlich anderer patho­ge­ner Erreger ist im Zusammenhang mit einer Mykoplasmen­ diagnostik unbedingt notwendig. Infektionen des Respirationstrakts: PDer serologische Nachweis einer Infektion mit Mycoplasma pneumoniae ist aufgrund der guten Aussagekraft des Verfahrens auch heute noch die Methode der Wahl, obwohl bereits Direktnachweise mittels PCR zur Verfügung stehen. B . M ik r obio l ogi s c h e U n t e r s u c h u n g e n h. Pertussis- Diagnostik (Keuchhusten): PIm Stadium catarrhale sowie im beginnenden Stadium con­vul­sivum lassen sich die Erreger zuverlässig mit molekularbiologischen Verfahren (PCR) nachweisen. PTrockene Ab­strich­tupfer für die PCR werden auf Anforderung zur Verfügung gestellt. Auch die Speziesdifferenzierung der angezüchteten Myko­ bakterien wird heute durch den Einsatz moderner molekularbiologischer Nachweisverfahren erheblich vereinfacht und beschleunigt. Folgende Körperflüssigkeiten sind zur Tuberkulosediag­nostik geeignet: Nasopharyngealabstrich: PDünnen Dacrontupfer durch das Nasenloch via unterer Nasengang bis in den Retropharynx einführen, mehrfach drehen, auch wenn dadurch ein Hustenstoß aus­gelöst wird. Wenn möglich, Material von beiden Seiten ge­winnen. Poder: Nasopharyngealsekret mittels Sonde, die durch den unteren Nasengang in den Retropharynx eingeführt wird, gewinnen und in steriler Kochsalzlösung oder Phosphatpuffer einsenden. Sputum - Bronchialsekret: PSpontan oder nach Provokation aus den tiefen Atemwegen hervorgebrachtes Sekret wird in einem sterilen Gefäß aufge­ fangen. Mindestens 2 ml einsenden. PDurchführung an drei aufeinanderfolgenden Tagen. Mittels Bronchoskopie gewonnenes Sekret in einem sterilen Röhr­chen einsenden. Material nach Gewinnung sofort ein­ schicken, nicht sammeln! i. Tuberkulose-Diagnostik: PBei allen Untersuchungen auf Tuberkulose ist es aufgrund der häufig nur geringen Keimzahlen wichtig, genügend Ma­terial für die Untersuchung zur Verfügung zu stellen. Neben der konventionellen Diagnostik unter Verwendung fester Nährmedien (Zeitbedarf ca. 6-8 Wochen) ist es heute möglich, mit Hilfe verschiedener Nachweisverfahren aus Flüssigmedien positive Kulturergebnisse und Resistenzbe­ stimmungen bereits nach wesentlich kürzerer Zeit (1-3 Wochen) zu erhalten. Neben den kulturellen Verfahren ist der Direktnachweis von Tuberkulosebakterien über sensitive PCR-Methoden innerhalb von wenigen Tagen möglich. Für die anschließende Resistenzbestimmung muss jedoch zusätzlich eine Tuberkulosekultur duchgeführt werden. Magennüchternsekret - Magenspülwasser: PDie Untersuchung von Magennüchternsekret oder Magen­ spülwasser ist nur dann sinnvoll, falls nicht ausreichend Sputum oder Bronchialsekret (z.B. bei Kindern) gewonnen werden kann. PMagensaft des nüchternen Patienten wird mittels Sonde gewonnen und in einem Spezial­röhrchen für die Tbc-Magen­ saft­diagnostik eingesandt. Durch das Transportmedium wird saurer Magensaft abge­puffert, der andernfalls ein Absterben der Mykobakterien verursachen kann. Die oft erwähnte „Säurefestigkeit“ der Mykobakterien bezieht sich ausschließlich auf das Färbe­verhalten dieser Keimgattung. PLässt sich mittels einfacher Aspiration nicht genügend Unter­ suchungsmaterial gewinnen, so kann zuvor mit physiolo­ gischer Kochsalzlösung gespült und anschließend erneut aspiriert werden. 31 B. Mikrobiologische Untersuchungen Morgenurin: P Untersuchung des ersten nach der Nachtruhe entleerten Urins. Nach Einschränkung der Flüssigkeitszufuhr am Vor­abend (Konzentration!) wird der Morgenurin unter Vermei­dung von Verunreinigungen in einem sterilen Gefäß aufge­fangen. PDas Mindestvolumen für die Untersuchung beträgt 100 ml. PDie Untersuchung von Sammelurin ist im Rahmen der Tbc-Diagnostik nicht sinnvoll (Verunreinigung durch Kontami­nanten). Venenblut: PZur Mykobakterienkultur aus peripherem Blut werden mindestens 10 ml Heparinblut (Na.-Heparinat-Röhrchen) benötigt. Alternativ kann die gleiche Menge Na.-Citrat-Blut eingesandt werden. EDTA-Blut ist ungeeignet! Menstrualblut: PDas während der Menstruation aufgefangene blutige Sekret wird zu gleichen Teilen mit sterilem Aqua dest. versetzt, vom entstandenen Hämolysat 10 ml zur Untersuchung einsen­den. Liquor: PMaterialentnahme, wie unter 5. beschrieben durchführen und mindestens 5 ml in sterilem Röhrchen einsenden. Stuhl: PMaterialentnahme, wie unter 7. beschrieben durchführen und in gewöhnlichem Stuhlröhrchen einsenden. Andere Materialien (z.B. Sekrete, Punktate etc.): PMaterialien steril entnehmen und in einem sterilen Röhrchen ohne Zusätze einsenden. Das Einbringen von Punktaten oder Sekreten in Transportmedien ist im Rahmen der Tuber­ kulosediagnostik mit Ausnahme der Magensaftuntersuchung nicht sinnvoll. 32 j. Virologische Diagnostik: Bei V. a. Virusinfektionen gibt es zwei unterschiedliche Nachweismethoden: Direkter Erregernachweis: PAnzucht und Identifizierung (schneller Transport und Küh­lung erforderlich, Abstriche in Virus-Transport-Medium, Sekrete, Blut, Liquor, Punktate etc. nativ in sterilen Röhr­chen). PAntigennachweis mittels Enzymimmunoassay (EIA). PVirus-DNA/RNA-Nachweis unter Anwendung molekularbiologischer Methoden (PCR). Indirekter Erregernachweis: PDurch den Nachweis von spezifischen Antikörpern der Klas­sen IgA, IgG und IgM im Serum. Allgemein verbindliche Norm- oder Referenzwerte existieren nicht, da die Antikör­ perbildung indivi­duell unterschiedlich stark ausgeprägt ist. Daher ist häufig die Abnahme eines Serumpaares zur Fest­ stel­lung eines signifikanten Titeranstieges innerhalb eines Inter­valles von ca. 14 Tagen erforderlich (siehe auch Kapitel Virusinfek­tionen). C . V e r z e i c h n i s g e b r ä u c h l i c h e r Abk ü r z u n g e n AAPAlanin-Aminopeptidase AASAtom-Absorptions-Spektrometrie ABOA-B-Null-System ACAAnti-Cardiolipin-Ak. ACE Angiotensin-I-Converting Enzyme AChRA Ak. gegen Acetylcholin-Rezeptoren ACPA Anti-cytoplasmatische Ak. (syn.ANCA) ACTH Adrenocorticotropes Hormon ADH Antidiuretisches Hormon, Vaso­pressin ADNase-B Anti-Desoxyribonuclease B AESAtom-Emissions-Spektrometrie AFPAlpha-1-Fetoprotein AgAntigen AgglAgglutination AHyAnti-Hyaluronidase AIDS Acquired immunodeficiency syndrome AkAntikörper AlAluminium ALAT Alanin-Aminotransferase (GPT) ALP Alkal. Leukozyten-Phosphatase ALSAminolävulinsäure AMA Antimitochondriale Ak. AMPAdenosinmonophosphat ANA Antinukleäre Ak. ANCA Anti-Neutrophilen-Cytoplasma-Ak. (syn ACPA) ANF Aninukleäre Faktoren (ANA) ANP Alkal. Neutrophilen-Phosphatase AP Alkalische Phosphatase APC Aktiviertes Protein C aPTT aktiv. partielle Thromboplastinzeit APUD amin precursor uptake and decarboxylation Arbo-VirenArthropode-borne-Viren ARC AIDS related complex ARDS Adult Respiratory Distress-Syndrome AsArsen ASAT Aspartat-Aminotransferase (GOT) ASCA Anti-Saccharomyces cerevisiae-Ak. ASGPRAsialoglykoproteinrezeptor ASLAnti-Streptolysin-Reaktion ASMA Ak. gegen glatte Muskulatur ASTAnti-Streptolysin-Titer ASTAAnti-Staphylolysin-Ak. AT Antithrombin (syn. AT III) AUGold B2GPI Beta-2-Glykoprotein I BAT Biolog. Arbeitsstoff-Toleranzwert BKSBlutkörperchensenkungs­geschwindigkeit (syn. BSG) BPI Bacterial Permeability Increasing Protein BSG Blutkörperchensenkungs­geschwindigkeit (syn. BKS) C1-INHC1-Esterase-Inhibitor C1q Komplementprotein C1q C3C3-Komplement C4C4-Komplement CaCalcium cAMP cyclisches Adenosinmonophosphat cANCA cytoplasmat. Anti-Neutrophilen-Cytoplasma-Ak. CCPCyclisches Citrulliniertes Peptid CdCadmium CD 3T-3-Lymphozyten CD 4T-4-Lymphozyten (Helferzellen) CD 8T-8-Lymphozyten (Suppressor­zellen) CDTCarbohydrate deficient transferrin CEACarcino-Embryonales Antigen CENP Zentromer-assoziierte Proteine 33 C. Verzeichnis gebräuchlicher Abkürzungen CH 50 Komplement, gesamthämolytisch CHECholinesterase CKCreatin-Kinase ClChlorid CLAChemilumineszenz-Assay CLLChronisch-lymphatische Leukämie CMLChronisch-myeloische Leukämie CMTCardiolipin-Mikroflockungstest­(syn. VDRL) CMVCytomegalie-Virus CoCobalt CO-HbCarboxy-Hämoglobin CrChrom CRFCorticotropin-Releasing Factor CRPC-reaktives Protein CuKupfer DCDünnschicht-Chromatographie DDDifferentialdiagnose DDTDichlor-Diphenyl-Trichlorethan DHEADehydroepiandrosteron DHEASDehydroepiandrosteron-Sulfat DHTDihydrotestosteron DISK Diskontinuierlich (Elektrophorese) DNase B Anti-Streptokokken-DNase-B DNA Desoxyribonukleinsäure (syn. DNS) DPA Dipropylacetat (syn. Valproinsäure) DPTDiphtherie-Pertussis-Tetanus ds-DNADoppelstrang-DNA DTDiphtherie-Tetanus D-WeakSchwaches D-Antigen weak D (Rhesusfaktor, früher Du) 34 E1Östron E2Östradiol E3Östriol EAEarly Antigen EBKEisenbindungskapazität EBVEpstein-Barr-Virus ECHOEnteric-cytopathogenic-human-orphan-(Viren) ECLIAElektrochemilumineszenz Immuno-Assay ECPEosinophiles kationisches Protein EDTAEthylen-Diamin-Tetraessigsäure EHECEnterohämorrhagische E. coli EIAEnzymimmunoassay EIECEnteroinvasive E. coli ELISAEnzyme linked immunosorbent assay ENAExtrahierbares nucleäres Antigen EPECEnteropathogene E. coli EPOErythropoetin ETECEnterotoxische E. coli FACS Fluorescence Activated Cell Sorter FeEisen FIFärbeindex FISHFluoreszenz-in-situ-Hybridisierung FPIAFluoreszenz-Polarisations-Immunoassay FPSA Freies Prostataspezifisches Antigen FSH Follikelstimulierendes Hormon FSMEFrühsommer-Meningoencephalitis FSPFibrin(ogen)-Spaltprodukte FT3 freies Trijodthyronin FT4 freies Thyroxin FTA ABS Fluoreszenz-Treponema-Ak.-Absorptionstest C . V e r z e i c h n i s g e b r ä u c h l i c h e r Abk ü r z u n g e n G6PDHGlucose-6-Phosphat-Dehydro­genase GADGlutamin Decarboxylase GBMAGlomeruläre Basalmembran-Ak. GCGaschromatographie GC-MSGaschromatographie-Massen­spektrometrie GFRGlomeruläre Filtrationsrate GLDHGlutamat-Dehydrogenase Gn-RHGonadotropin-releasing-hormone GOGonorrhoe GOTGlutamat-Oxalacetat-Transaminase (syn. ASAT) GPTGlutamat-Pyruvat-Transaminase (syn. ALAT) GGTGamma-Glutamyl-Transpeptidase (Transferase) GHGrowth Hormone (STH, HGH) GSEGluten-Sensitive-Enteropathie HAHämagglutination HAHHämagglutinations-Hemmtest HANEHereditäres angioneurotisches Ödem HATHämagglutinationstest HAVHepatitis-A-Virus HbA1cHämoglobin A1c-Fraktion HBcHepatitis-B-core-Antigen HBDHHydroxybutyrat-Dehydrogenase HbEHämoglobingehalt eines Erythrozyten HBeHepatitis-B-envelope-Antigen HbF Fetales Hämoglobin HBsHepatitis-B-Surface-Antigen HBVHepatitis-B-Virus HCHHexachlorcyclohexan (u.a. Lindan) HCBHexachlorbenzol HCGHumanes Choriongonadotropin HCVHepatitis-C-Virus HDLHigh-Density-Lipoproteins HDVHepatitis-D-Virus HEVHepatitis-E-Virus HgQuecksilber HGHHuman-Growth-Hormone HGVHepatitis-G-Virus HHTHämagglutinations-Hemmtest HIESHydroxy-Indolessigsäure HIGHämolyse-in-Gel-Test HIVHumanes-Immundefizienz-Virus HkHämatokrit HLAHumanes-Leukozyten-Antigen HMAHerzmuskel-Ak. HPLHumanes-Placenta-Lactogen HPLCHigh-Pressure (-Performance)Liquid-Chromatography HPTHyperparathyreoidismus HSHarnsäure HSVHerpes-simplex-Virus HTLVHumanes-T-Zell-Leukämie-Virus HUSHämolytisch-urämisches Syndrom HVSHomovanillinsäure IA2Inselzellantigen 2 IAAInsulin-Auto-Ak. ICAInselzell-Ak. ICP/MSInduktiv gekoppeltes Plasma/­Massenspektrometrie ICSHInterstitial cell stimulating hormone IEInternationale Einheit IEFIsoelektrische Fokussierung IFIntrinsic factor IFTImmunfluoreszenztest IgImmunglobulin 35 C. Verzeichnis gebräuchlicher Abkürzungen IGeLIndividuelle Gesundheitsleistung IGF-IInsulin-like-growth-factor I (syn. Somatomedin) IGFBP-3Insulin-like-growth-factor-binding protein 3 IHAIndirekte Hämagglutination IHATIndirekter Hämagglutinationstest IIFTIndirekter Immunfluoreszenztest ILInterleukin INRInternational normalized ratio IRInfrarot-Spektroskopie IRMAImmunradiometrischer Assay ISAGAImmunosorbent agglutination assay ISEIonenselektive Elektrode ITPIdiopathische thrombozytopenische Purpura IU international unit JJod KKalium KBRKomplement-Bindungsreaktion LAPLeucin-Arylamidase LBMALungenbasalmembran-Ak. LC1Lebercytosol Antigen Typ 1 LCMLymphozytäre Choriomeningitis LC/MSLiquid Chromatographie/Massen­spektrometrie LCRLigase chain reaction LDHLactat-Dehydrogenase LDLLow-Density-Lipoproteins LELupus erythematodes LHLuteinisierendes Hormon LH-RHLH-Releasing hormone LIALumineszenz Immunoassay LKMLiver-kidney-microsomes 36 LMALebermembran-Ak. LPSLipopolysaccharid Lp-XLipoprotein X LSDLysergsäurediäthylamid LSRLues-Suchreaktion LTTLaktose-Toleranz-Test LTTLymphozyten-Transformationstest MAKMax. Arbeitsplatz-Konzentration MAKMikrosomale Ak. MBKMinimale bakterizide Konzentration MCAMucin-like cancer associated Ag. MCHMittlere korpuskuläre Hb-Menge MCHCMittlere korpuskuläre Hb-Konz. MCDTMixed connective tissue disease MCVMittleres korpuskuläres Volumen MEIAMikropartikel Enzymimmunoassay Met-HbMethämoglobin MgMagnesium MHKMinimale Hemmstoffkonzentration MnMangan MSMassenspektrometrie MSMultiple Sklerose NaNatrium NaClKochsalz NaFNatrium-Fluorid NiNickel NNRNebennierenrinde NSENeuronspezifische Enolase NTNeutralisationstest OGTTOraler Glucose-Toleranztest C . V e r z e i c h n i s g e b r ä u c h l i c h e r Abk ü r z u n g e n PPhosphat PAGEPolyacrylamidgel-Elektrophorese p-ANCA perinucleäre Anti-Neutrophilen-Cytoplasma-Ak. PAP Prostataspezifische saure Phosphatase PbBlei PBGPorphobilinogen PCAParietalzell-Ak. PCB Polychlorierte Biphenyle PCPPentachlorphenol PCRPolymerase-chain-reaction PHA Passive Hämagglutination PHIPhosphohexose-Isomerase PIAPolarisations-Immunoassay PKUPhenylketonurie PLTPsittakose-Lymphogranulom-Trachom PNH Paroxysmale nächtliche Hämo­globinurie PSA Prostataspezifisches Antigen PTHParathormon PTT Partielle Thromboplastinzeit PTZ Plasmathrombinzeit (syn. Quick) RARheumatoide Arthritis RASTRadio-Allergo-Sorbent-Test REO-VirenRespiratory enteric orphan Viren RFRheumafaktor RhRhesusfaktor RIARadio-Immunoassay RIDRadiale Immundiffusion RIPRadioimmunopräzipitationstest RNPRibonukleoprotein RNARibonukleinsäure RSVRespiratory-Syncytial-Virus SARSSevere-Acute-Respiratory-Syndrome SCCSquamous cell carcinoma SeSelen SHBGSexualhormon-bindendes Globulin SKMASkelettmuskel-Ak. SLAsolubile-liver-antigen SLESystemischer Lupus erythematodes SMAsmooth-muscle-Ak. SM-CSomatomedin C (syn. IGF I) SPSaure Phosphatase SPPSaure Prostata-Phosphatase SSASjögren-Syndrom assoziiertes Antigen A SSBSjögren-Syndrom assoziiertes Antigen B SSPE subakute sklerosierende Panencephalitis SSWSchwangerschaftswoche ss-DNAEinzelstrang-DNA STHSomatotropes Hormon T3Trijodthyronin T4Thyroxin TAKThyreoglobulin-Antkörper TBGThyroxin-bindendes Globulin TGThyreoglobulin TGBThyreoglobulin THCTetrahydrocannabinol TKThymidinkinase TNFTumor Necrosis Factor TPATissue Polypeptide Antigen TPETyphus-Paratyphus-Enteritis TPHATreponema-pallidum-Häm­agglutinationstest TPPATreponema-pallidum-Partikel­agglutinationstest TPZThromboplastinzeit (syn. Quick-Test) TRAKTSH-Rezeptor-Ak. 37 C. Verzeichnis gebräuchlicher Abkürzungen TRHThyreotropin-releasing hormone TSHThyreoidea stimulierendes Hormon TZThrombinzeit UUnit VCAVirus-Capsid-Antigen VDRL Veneral Disease research laboratory VIP Vasoaktives intestinales Peptid VLDL Very low density lipoproteins VMSVanillinmandelsäure VZVVarizella-Zoster-Virus 38 WB Western Blot WHOWeltgesundheitsorganisation ZnZink ZNSZentralnervensystem °Fremdleistung E . A l l e r gi e 1. Einzelallergene (spezifische IgE-Ak.): tBaumpollen/Sträucher t 01 Ahorn t 02Erle/Grauerle t 03 Birke t 04Hasel t 05 Buche t 06 Wacholder (Sadebaum) t 07Eiche t 08 Ulme t 09Olive t 10 Walnuss t 11 Platane (ahornblättr.) t 13 Jasmin t 14 Pappel (amerikan.) t 16 Kiefer t 17 Kastanie (Esskastanie) t 18Eukalyptus t 19Mimose t 20Liguster t 21 Flieder t 22 Weißdorn t 23 Zypresse t 25Goldregen t 26Holunder t 27Linde t 28Robinie t 70Maulbeerbaum t 71 Zeder t 72 Palme (Königspalme) t 73 Australische Kiefer t 901Esche t t t t 903Hainbuche 904Salweide 905 Palmenpollen 906 Jasmin, falscher w Kräuter- u. Blumenpollen w 01 Ambrosie (beifußblättrige) w 02 Ambrosie (ausdauernde) w 03 Ambrosie (dreilappige) w 04 Ambrosie (falsche) w 05 Wermuth w 06 Beifuß w 07Margerite w 08Löwenzahn w 09Spitzwegerich w 10 Weißer Gänsefuß w 11Salzkraut w 12Echte Goldrute w 13Spitzklette w 14 Amarant (Fuchsschwanz) w 15Melde w 16Schlagkraut w 17 Aster w 18Sauerampfer w 19Glaskraut (Parietaria officinalis) w 20 Brennessel w 21Glaskraut (Parietaria judaica) w 22Chrysantheme w 23 Dahlie w 24Luzerne w 25 Kamille (echte) w 26Narzisse w 27Nelke w 28Rose w 29Sonnenblume w 30Tulpe w 31Heidekraut w 32Raps w 34 Klee w 35Geranie w 36 Primel w 40Hyazinthe w 45 Forsythie w 100Huflattich w 901Hahnenfuß w 902Hopfen w 905Segge w 207Lupine wa 16 Weidenröschen g g g g g g g g g g g g g g g g g g Gräser- u. Getreidepollen 01Ruchgras 02Hundszahngras 03 Knäuelgras 04 Wiesenschwingel 05Lolch/Raygras 06 Wiesenlieschgras 07Schilf 08 Wiesenrispengras 09 Weißes Straußgras 10Mohrenhirse (Sorgho/Sudangras) 11Trespe 12Roggen 13 Wolliges Honiggras 14Hafer 15 Weizen 16 Wiesenfuchsschwanz 17Glatthafer 421 E. Allergie g g g g g g g g 18Gerste 19 Kammgras 20Mais 21 Quecke 22 Bahiagras 70Haargerste 901Straußgras 902Trespe (weiche) d Milben/Stäube d 01Dermatophagoides pteronyssinus (Hausstaubmilbe) d 02Dermatophagoides farinae (Mehlmilbe) d d d d d d d h 03 Dermatphagoides microceras 70 Acarus siro (Vorratsmilbe) 71Lepidoglyphus destructor 72Tyrophagus putreus 73Glycophagus domesticus 74Euroglyphus maynei 201 Blomia tropicalis 04Hausstaub (Allergopharma) e e e e e e e e e e Epithelien/Haare/Federn 01 Katzenepithel u. -schuppen 02Hundeepithel 03 Pferdeschuppen 04Rinderepithel 05Hundeschuppen 06Meerschweinchenepithel 08Nerzepithel 10 Papageienfedern 11Taubenfedern 422 e 50 Zierfinkenfedern e 70Gänsefedern e 71Mäuseepithel e 73Rattenepithel e 78 Wellensittichfedern e 80 Ziegenepithel e 81Schafepithel e 82 Kaninchenepithel e 83 Schweineepithel e 84Hamsterepithel e 85Hühnerfedern e 86Entenfedern e 92Truthahnfedern e 96Gänsedaunen e 201 Kanarienvogelfedern e 203Chinchillaepithel ea 205 Fuchsepithel e 206 Kamelepithel e 207Nymphensittichfedern eSerum- , Urin- u. Kotproteine e 07Taubenkot e 13Taubenserumprotein e 14 Kanarienvogelserumprotein e 15Hühnerserumprotein e 16 Papageienserumprotein e 51 Zierfinkenkot e 72Mäuseurinprotein e 74Rattenurinprotein e 75Rattenserumprotein e 76Mäuseserumprotein e 77 Wellensittichkot e 79 Wellensittichserumprotein e 87Ratte (Epithel und Proteine) e 88Maus (Epithel und Protein) e 89Mäusekot e 90Rattenkot e 91Nymphensittichkot e 98 Papageienkot e 99 Kanarienvogelkot ea 211Rinderserum e 212Rinderserumalbumin iInsekten i 01 Bienengift i 03 Wespengift (Vespula spp.) i 06 Küchenschabe i 08Hummel i 09Reismehlkäfer i 70 Feuerameise i 71Stechmücke i 73Rote Mückenlarve i 74 Wasserflöhe i 75Hornisse (europäisch) i 901Taubenzecke i 902Rote Baumspinne i 903 Kleidermotte ia 903 Küchenschabe (amerikanisch) cMedikamente c 01 Penicilloyl G c 02 Penicilloyl V c 03Chymopapain c 70Insulin (Schwein) c 71Insulin (Rind) c 72 ACTH c 73Insulin (Human) c 201Cephalosporin E . A l l e r gi e c c c c c c c c c c c c c c c 202Trimethoprim 203Sulfamethoxazol 204 Amoxicillin 205 Ampicillin 206 Doxycyclin 207 Acetylsalicylsäure 208 Pyrazolon 209 Paracetamol/Phenacetin 210 Furosemid 211Tetracyclin 212Erythromycin 213Gentamicin 267 Bromelain 901Haemaccel 902Gelifundol fNahrungsmittel f f f f f f f f f f f f f f f Milch und Milchprodukte 02Milcheiweiß (Kuh) 60Camembert 63Roquefort 70Schweizer Käse 76 Alpha-Lactalbumin 77 Beta-Lactoglobulin 78 Kasein 81Cheddarkäse 82Schimmelkäse 150Edamer Käse 201Gouda Käse 203Milch (gekocht) 204Muttermilch 205 Joghurt 206 Kefir f 207 Parmesankäse fa 208Schafskäse f 209 Ziegenkäse f 236Molke f 910Nutramigen f 911 Pregestimil f 912 Alfare f 913 Pregomin f 914 Beba HA f 915 Aptamil f 916Humana H.A. f 917Humana SL Fleisch f 26Schweinefleisch f 27Rindfleisch f 57Entenfleisch f 58Gänsefleisch f 59 Pferdefleisch f 83Hühnerfleisch f 88Lammfleisch f 130 Putenfleisch f 221Rehfleisch f 222 Wildschweinfleisch Hühnerei f 01Eiklar (Hühnereiweiß) f 67Ovalbumin f 68Ovomucoid f 75Eigelb f 245 Vollei Gemüse f 12Erbse f 14Sojabohne f 15 Weiße Bohne f 25Tomate f 31 Karotte f 35 Kartoffel f 38Spinat f 39 Kohl f 47 Knoblauch f 48 Zwiebel f 61 Blumenkohl (gekocht) f 62 Blumenkohl (roh) f 64 Kresse f 65Linse f 66 Porree f 85Sellerie f 86 Petersilie f 96 Avocado f 100 Kopfsalat f 121Maisgemüse f 127Champignon f 132Grüne Bohne f 133Gurke f 134 Broccoli f 135 Kürbis f 136Rote Beete f 137Spargel f 163 Kohlrabi f 218 Paprika f 301 Aubergine f 302 Austernpilz f 303Chinakohl 423 E. Allergie f f f f f f f f f f f f f 306 Fenchel 308Grünkohl 309Radieschen 310Rettich 311Rosenkohl 312Rotkohl 314Sauerampfer (roh) 315Sauerkraut 316Schwarzwurzel 317 Wirsing 318 Zucchini 319 Artischocken 901 Peperoni Obst f 30Grapefruit f 33Orange f 34Mandarine f 44Erdbeere f 49 Apfel f 50 Weintraube f 72 Ananas f 73 Kirsche f 84 Kiwi f 87Melone f 91Mango f 92 Banane f 94 Birne f 95 Pfirsich f 122 Pflaume f 162Nektarine f 208 Zitrone f 271 Aprikose 424 f 272 Blaubeere f 273 Brombeere f 274 Feige fa 275Himbeere f 276 Johannisbeere f 277 Preiselbeere f 278Rhabarber fa 279Rosine f 280Sauerkirsche f 281Stachelbeere f f f f f f f f f f f f f f f f f f f f f Fische und Meeresfrüchte 03 Dorsch/Kabeljau 21Hering 22 Forelle 23 Krabbe 24Garnele 37Miesmuschel 40Thunfisch 41Lachs 42Schellfisch 55 Aal 56Rotbarsch 71Languste 80Hummer 101 Venusmuschel 152Scholle 231 Auster 232Hecht 233 Karpfen 234 Krebs 235Makrele 237Sardine f f f f 238Seezunge 239Tintenfisch 805Sardelle 902Heilbutt Cerealien und Mehle f 04 Weizenmehl f 05Roggenmehl f 06Gerstenmehl f 07Hafermehl f 08Maismehl f 09Reis (roh) f 10Sesamschrot f 11 Buchweizenmehl f 51Sojaschrot f 53Guarkernmehl f 79Gluten (Gliadin) f 98Leinsamenschrot f 251 Dinkel f 252Gries f 253Hirse f 255 Johanniskernmehl fa 256 Kartoffelmehl f 257 Kokosflocken f 258Rizinus f 259Sago f 260 Weizenschrot f 903Gerstenkleie f 904Maiskleie f 905Roggenkleie f 906 Weizenkleie f 907Rizinusschrot f 918Langkornreis (gekocht) E . A l l e r gi e f 919Rundkornreis (gekocht) f 909Gelatine (Rind) Nüsse und Ölsaaten f 13Erdnuss f 17Haselnuss f 18 Paranuss f 19Esskastanie f 20Mandel f 36 Kokosnuss f 103 Pecannuss f 104 Pistazie f 105Cashew-Nuss f 256 Walnuss sGewürze s 01 Anis s 02Curry-Mischung s 03 Kümmel s 04Lorbeerblatt s 05Muskatnuss s 06 Paprika (Gewürz) s 07 Pfeffer s 09Oregano s 10 Basilikum s 11 Dill s 12 Vanille s 201 Bohnenkraut s 202 Koriander s 203Ingwer s 206Majoran s 207Mohn s 211Rosmarin s 212Thymian f 220 Zimt s 902 Kamille Sonstige Nahrungsmittel f 45 Bäckerhefe f 89Senf f 90Malz f 93 Kakao f 97 Kamillentee f 99Tee (schwarz) f 102 Kaffee f 105Schokolade f 125 Pfefferminz-Tee f 126 Pfefferminz-Kräuter f 128Schnecke f 131Schwarze Olive f 332 Backhilfsmittel f 333Honig f 334Hopfen f 336 Weinessig f 337 Weinhefe f 801Gummibärchen f 908Gelatine (Schwein) k Beruf und Hobby k 01 Acylon k 02 Baumwolle (bearbeitet) k 04 Dreschstaub k 05 Flachs k 07Heustaub k 14 Kapok k 15 Kunstseide (Rayon) k 16Leinen k 17Nylon k k k k k k k k k k k k k k k k k k k k k k k k k k k k k k k k k 20Schafwolle (bearbeitet) 21Schafwolle (unbearbeitet) 22Seide 23Strohstaub 25Terylene 26 Weizendrusch 31 Ahornholz 32 Buchenholz 33Eichenholz 34Eschenholz 35 Fichtenholz 36 Kiefernholz 38Macoreholz 39Mahagoniholz 42Raminholz 44Tannenholz 70Grüne Kaffebohne 73 Wildseide 74Rohseide 75Isocyanat TDI 76Isocyanat MDI 77Isocyanat HDI 78 Äthylenoxid 79 Phthalsäure-Anhydrid 80 Formaldehyd 81 Ficus sp. 82Latex (Neotex) 83 Baumwollsamen 84Sonnenblumensamen 86Trimellitsäure-Anhydrid (TMA) 87 Alpha-Amylase 203 Phospholipase 208Lysozym 425 E. Allergie k k k k k 263Lakritz 270 Alkalase 903 POD-Enzym 904GOD-Enzym 905HSA-Scheiben mSchimmelpilze und Hefen m 01 Penicillium notatum m 02Cladosporium herbarum m 03 Aspergillus fumigatus m 04Mucor racemosus m 05Candida albicans m 06 Alternaria tenuis m 07 Botrytis cinerea m 08Helminthosporium halodes m 09 Fusarium moniliforme m 10Stemphylium botryosum m 11Rhizopus nigricans m 12 Aureobasidium pullulans m 13 Phoma betae m 14Epicoccum purpurascens m 15Trichoderma viride m 16Curvularia lunata m 17Cladosporium fulvum m 18 Fusarium culmorum m 19 Aspergillus versicolor m 20Mucor mucedo m 21 Aspergillus clavatus m 22Mucor spinosus m 23Neurospora sitophila m 24 Paecilomyces spp. m 25 Penicillium brevicompactum m 27 Penicillium commune 426 m m m m m m m m m m m m m m m m m m m 28 Penicillium expansum 29 Aspergillus repens 30 Penicillium roqueforti 33 Aspergillus niger 34Serpula lacrymans 35Sporobolomyces roseus 36 Aspergillus terreus 37Trichophyton mentagrophytes 39Trichophyton verrucosum 40 Aspergillus amstelodami 42 Ustilago nuda/tritici 43 Brauereihefe 44 Bäckerhefe 45Chaetomium globosum 47 Aspergillus nidulans 48 Aspergillus oryzae 205Trichophyton rubrum 901Microsporum canis 902 Pullularia pullulans oSonstige o 202 Fischfutter Artemia salina o 203 Fischfutter Tetramin o 204 Fischfutter Daphnia Hinweis: Bitte bei Kindern unter sechs Jahren maximal 15 Allergene pro Untersuchungsauftrag und pro Quartal anfordern (Befreiungsziffer 32009 nicht vergessen!) Bei Erwachsenen bitte maximal 8 Allergene pro Untersuchungsauftrag und pro Quartal anfordern (laut Änderung EBM seit 01.10.09) E . A l l e r gi e 2. Gruppenallergene (spezifische IgE-Ak.): dp 01 Milben ex ex ex ex Epithelien Haustiere Nutztiere Nagermischung 01 02 03 70 ep 71 ex 72 ex 901 Federn Käfigvogelfedern Tierepithelien I ex 902 ex 903 fp 01 fp 02 fp 03 fp 05 fx 07 fx 08 fx 10 fp 13 fp 15 fx 15 fx 16 fp 73 fx 901 Tierepithelien II Mischung Federn Nüsse Meeresfrüchte Getreide/Cerealien Kleinkindernahrung Gemüse II Gemüse III Früchte II Nahrungsmittel Obst Geflügel (Fleisch) Käse Fleisch Mehlmischung Blomia tropicalis, Dermatophagoides farinae, Dermatophagoides microceras, Dermatophagoides pteronyssinus, Euroglyphus maynei, Glycophagus domesticus,Lepidoglyphus destructor, Tyrophagus putreus Hundeschuppen, Katzenepithel und –schuppen, Pferdeschuppen, Rinderepithel Hundeepithel, Katzenepithel, Hamsterepithel, Meerschweinchenepithel Kaninchenepithel, Pferdeschuppen, Rinderepithel, Schafepithel Goldhamsterepithel, Kaninchenepithel, Meerschweinchenepithel, Mäuseepithel, Rattenepithel Gänsefedern, Hühnerfedern, Entenfedern, Truthahnfedern Kanarienvogelfedern, Papageienfedern, Wellensittichfedern, Zierfinkenfedern Goldhamsterepithel, Hundeepithel, Kaninchenepithel, Katzenepithel und –schuppen, Meerschweinchenepithel Pferdeschuppen, Rinderepithel, Schafwolle (unbehandelt), Schweine­epithel, Ziegenepithel Entenfedern, Gänsefedern, Hühnerfedern Erdnuss, Haselnuss, Kokosnuss, Mandel, Paranuss Dorsch, Garnele, Lachs, Miesmuschel, Thunfisch Buchweizen, Hafer, Mais, Sesamsamen, Weizen Dorsch, Erdnuss, Hühnereiweiß, Milcheiweiß (Kuh), Sojabohne, Weizen Kohl, Paprika (Gemüse), Spinat, Tomate Champignon, Selleriewurzel, Sojabohne, Zwiebel Ananas, Birne, Erdbeere, Zitrone Erbse, Karotte, Kartoffel, Weiße Bohne Apfel, Banane, Orange, Pfirsich Entenfleisch, Gänsefleisch, Hühnerfleich, Putenfleisch Cheddarkäse, Edamer Käse, Schimmelkäse, Schweizer Käse Hühnerfleisch, Lammfleisch, Rindfleisch, Schweinefleisch Hafermehl, Maismehl, Roggenmehl, Weizenmehl 427 E. Allergie fx 903 Nahrungsmittel-Screening gp 01 gp 04 gx 901 Gräser (Frühblüher) Gräser (Spätblüher) 6-Gräser (Allergopharma) gx 902 Gräser-Getreide-Mix hp 01 ip 08 Hausstäube Inhalationsallergene kx 01 kx 02 kx 03 kx 04 mp 01 Synthetische Stoffe Stoffe/Fasern Getreidestäube Weichhölzer Schimmelpilz-Mischung mx mx mx mx Schimmelpilze II Aspergilli I Aspergilli II Penicillia 02 06 07 08 mx 901 Mischung Schimmelpilze I mx 902 Mischung Schimmelpilze II sx 01 sx 02 tp 05 Gewürze Gewürze II Bäume (Frühblüher) 428 Erdnuss, Haselnuss, Hühnerei (gesamt), Kabeljau (Dorsch), Krabbe, Kuhmilcheiweiß, Maismehl, Sojabohne, Tomate, Weizenmehl Knäuelgras, Lieschgras, Lolch, Wiesenrispengras, Wiesenschwingel Lolch, Roggen, Ruchgras, Schilf, Wolliges Honiggras Honiggras, Knäuelgras, Raygras (Lolch), Wiesenlieschgras, Wiesenrispengras, Wiesenschwingel Honiggras, Knäuelgras, Raygras (Lolch), Wiesenlieschgras, Wiesenrispengras, Wiesenschwingel, Gerste, Hafer, Roggen, Weizen Dermatophagoides farinae, Greer, Küchenschabe, Dermatophagoides pteronyssinus Beifuß, Birke, Cladosporium herbarum, Dermatophagoides pteronyssinus, Hundeschuppen, Katzenepithel, Lieschgras, Roggen Acylon, Kunstseide (Rayon), Nylon, Terylene Baumwolle (bearbeitet), Jute, Schafwolle (bearbeitet), Seide Dreschstaub, Heustaub, Strohstaub, Weizendrusch Buchenholz, Kiefernholz Alternaria tenuis, Aspergillus fumigatus, Candida albicans, Cladosporium herbarum, Penicillium notatum Rhizopus nigricans, Mucor spinosus, Pullularia pullulans, Neurospora sitophila Aspergillus fumigatus, Aspergillus clavatus, Aspergillus amstelodami, Apergillus nidulans Aspergillus versicolor, Aspergillus repens, Aspergillus niger, Apergillus terreus Penicillium notatum, Penicillium brevicompactum, Penicillium expansum, Penicillium roqueforti Alternaria tenuis, Botrytis cinerea, Curvularia lunata, Fusarium moniliforme, Helminthosporium halodes, Cladosporium herbarum Aspergillus fumigatus, Mucor mucedo, Penicillium notatum, Pullularia pullulans, Rhizopus nigricans, Serpula lacrymans Anis, Curry-Mischung, Kümmel, Knoblauch Muskatnuss, Paprika (Gewürz), Pfeffer, Senf Erle, Hasel, Pappel, Salweide, Ulme E . A l l e r gi e tp 06 tx 901 tx 902 wp 03 wx 05 wx 06 Bäume (Spätblüher) Bäume (Mittelblüher) Bäume-Mischung Kräutermischung 3 Blumen I Blumen II Ahorn, Birke, Buche, Eiche, Walnuss Birke, Rotbuche, Eiche, Platane Erle, Birke, Hasel Beifuß, Brennessel, Echte Goldrute, Spitzwegerich, Weißer Gänsefuß Aster, Chrysantheme, Dahlie, Hyanzinthe Margerite, Primel, Rose, Tulpe Hinweis:Mischallergene weisen eine etwas geringere Empfindlichkeit auf als Einzelallergene. 3. Symptombezogene Allergiediagnostik mittels verschiedener Profile Für verschiedene Symtomkomplexe können Sie folgende Allergie-Profile in Form von Aufklebern im Labor anforden und diese auf den Untersuchungsauftrag aufkleben: Ekzem f01 Eiklar (Hühnereiweiß) f02 Milcheiweiß (Kuh) f03 Dorsch/Kabeljau f04 Weizenmehl f13 Erdnuss f14 Sojabohne f17 Haselnuss d01 D. pteronyssinus Gastro Erwachsene f03 Dorsch/Kabeljau f04 Weizenmehl f13 Erdnuss f14 Sojabohne f17 Haselnuss f24 Garnele (Shrimps) f84 Kiwi f85 Sellerie Asthma/Rhinnitis saisonal/perennial d01 D. pteronyssinus e01 Katzenepithel/-schuppen e02 Hundeepithel mp01 Schimmelpilze g06 Lieschgras t03 Birke w01 Ambrosie/beifußblättrig w06 Beifuß 429 E. Allergie Gastro Kinder f01 Eiklar (hühnereiweiß) f02 Milcheiweiß f03 Dorsch/Kabeljau f04 Weizenmehl f13 Erdnuss f14 Sojabohne f31 Karotte f85 Sellerie Kinder-Profil g06 Lieschgras t03 Birke w06 Beifuß e01 Katzenepithel/-schuppen e02 Hundeepithel d01 D. pteronyssinus m06 Alternaria tenius (alternata) f01 Eiklar (Hühnereiweiß) f02 Milcheiweiß (Kuh) f03 Dorsch/Kabeljau f04 Weizenmehl f13 Erdnuss f14 Sojabohne f31 Karotte f85 Sellerie Hinweis zu den CLA-Allergen-Panels: Beachten Sie! Die Panel-Teste bzw. CLA-Teste (Atopy Panel 20, Inhalation 20 und Nahrungsmittel 20) werden wegen zu geringer Anforderungsmenge ab 01.10.10 nicht mehr in unserem Hause durchgeführt! 430 F. A u s z u g a u s d e m I n f e k t io n s s c h u t z g e s e t z ( I f S G ) Meldewesen § 6 Meldepflichtige Krankheiten (1)Namentlich ist zu melden: 1. der Krankheitsverdacht, die Erkrankung sowie der Tod an a)Botulismus b)Cholera c)Diphtherie d)humaner spongiformer Enzephalopathie, außer f­ amiliärhereditärer Formen e) akuter Virushepatitis enteropathischem hämolytisch-urämischem Syndrom (HUS) f) g) virusbedingtem hämorrhagischen Fieber h)Masern i)Meningokokken-Meningitis oder -Sepsis j)Milzbrand k)Poliomyelitis (als Verdacht gilt jede akute schlaffe Lähmung, außer wenn traumatisch bedingt) l)Pest m)Tollwut n)Typhus abdominalis/Paratyphus sowie die Erkrankung und der Tod an einer behandlungsbedürftigen Tuberkulose, auch wenn ein bakteriologischer Nachweis nicht vorliegt, 2.der Verdacht auf und die Erkrankung an einer mikrobiell bedingten Lebensmittelvergiftung oder an einer akuten infektiösen Gastroenteritis, wenn a)eine Person betroffen ist, die eine Tätigkeit im Sinne des § 42 Abs. 1 ausübt, b)zwei oder mehr gleichartige Erkrankungen auftreten, bei denen ein epidemischer Zusammenhang wahrscheinlich ist oder vermutet wird, 3. der Verdacht einer über das übliche Ausmaß einer Impfreaktion hinausgehenden gesundheitlichen Schädigung, 4. die Verletzung eines Menschen durch ein tollwutkrankes, -verdächtiges oder -ansteckungsverdächtiges Tier sowie die Berührung eines solchen Tieres oder Tierkörpers, 5. soweit nicht nach den Nummern 1 bis 4 meldepflichtig, das Auftreten a) einer bedrohlichen Krankheit oder b) von zwei oder mehr gleichartigen Erkrankungen, bei denen ein epidemischer Zusammenhang wahrscheinlich ist oder vermutet wird, wenn dies auf eine schwerwiegende Gefahr für die Allgemeinheit hinweist und Krankheitserreger als Ursache in Betracht kommen, die nicht in § 7 genannt sind. Die Meldung nach Satz 1 hat gemäß § 8 Abs. 1 Nr. 1, 3 bis 8, § 9 Abs. 1, 2, 3 Satz 1 oder 3 oder Abs. 4 zu erfolgen. (2) Dem Gesundheitsamt ist über die Meldung nach Absatz 1 Nr. 1 hinaus mitzuteilen, wenn Personen, die an einer behandlungsbedürftigen Lungentuberkulose leiden, eine Behandlung verweigern oder abbrechen. Die Meldung nach Satz 1 hat gemäß § 8 Abs. 1 Nr. 1, § 9 Abs. 1 und 3 Satz 1 oder 3 zu erfolgen. (3) Dem Gesundheitsamt ist unverzüglich das gehäufte Auftreten nosokomialer Infektionen, bei denen ein epidemischer Zusammenhang wahrscheinlich ist oder vermutet wird, als Ausbruch nichtnamentlich zu melden. Die Meldung nach Satz 1 hat gemäß § 8 Abs. 1 Nr. 1, 3 und 5, § 10 Abs. 1 Satz 3, Abs. 3 und 4 Satz 3 zu erfolgen. § 7 Meldepflichtige Nachweise von Krankheitserregern (1) Namentlich ist bei folgenden Krankheitserregern, soweit nicht anders bestimmt, der direkte oder indirekte Nachweis 431 F. A u s z u g a u s d e m I n f e k t i o n s s c h u t z g e s e t z ( I f SG ) zu melden, soweit die Nachweise auf eine akute Infektion hinweisen: 1. Adenoviren; Meldepflicht nur für den direkten Nachweis im Konjunktivalabstrich 2. Bacillus anthracis 3. Borrelia recurrentis 4. Brucella sp. 5. Campylobacter sp., darmpathogen 6. Chlamydia psittaci 7. Clostridium botulinum oder Toxinnachweis 8. Corynebacterium diphtheriae, Toxin bildend 9. Coxiella burnetii 10. Cryptosporidium parvum 11. Ebolavirus 12. a) Escherichia coli, enterohämorrhagische Stämme (EHEC) b) Escherichia coli, sonstige darmpathogene Stämme 13. Francisella tularensis 14.FSME-Virus 15. Gelbfiebervirus 16. Giardia lamblia 17. Haemophilus influenzae; Meldepflicht nur für den direkten Nachweis aus Liquor oder Blut 18. Hantaviren 19. Hepatitis -A-Virus 20. Hepatitis -B-Virus 21. Hepatitis -C-Virus; Meldepflicht für alle Nachweise, soweit nicht bekannt ist, dass eine chronische Infektion vorliegt 22. Hepatitis -D-Virus 23. Hepatitis -E-Virus 24. Influenzaviren; Meldepflicht nur für den direkten Nachweis 25. Lassavirus 26. Legionella sp. 27. Leptospira interrogans 432 28. Listeria monocytogenes; Meldepflicht nur für den direkten Nachweis aus Blut, Liquor oder anderen normalerweise sterilen Substraten sowie aus Abstrichen von Neugeborenen 29. Marburgvirus 30. Masernvirus 31. Mycobacterium leprae 32. Mycobacterium tuberculosis/africanum, Mycobacterium bovis; Meldepflicht für den direkten Erregernachweis sowie nachfolgend für das Ergebnis der Resistenzbestimmung, vorab auch für den Nachweis säurefester Stäbchen im Sputum 33. Neisseria meningitidis; Meldepflicht nur für den direkten Nachweis aus Liquor, Blut, hämorrhagischen Hautinfiltraten oder anderen normalerweise sterilen Substraten 34. Norwalk-ähnliches Virus; Meldepflicht nur für den direkten Nachweis aus Stuhl 35. Poliovirus 36. Rabiesvirus 37. Rickettsia prowazekii 38. Rotavirus 39. Salmonella Paratyphi; Meldepflicht für alle direkten Nachweise 40. Salmonella Typhi; Meldepflicht für alle direkten Nachweise 41. Salmonella, sonstige 42. Shigella sp. 43. Trichinella spiralis 44. Vibrio cholerae O 1 und O 139 45. Yersinia enterocolitica, darmpathogen 46. Yersinia pestis 47. andere Erreger hämorrhagischer Fieber. Die Meldung nach Satz 1 hat gemäß § 8 Abs. 1 Nr. 2, 3, 4 und Abs. 4, § 9 Abs. 1, 2, 3 Satz 1 oder 3 zu erfolgen. F. A u s z u g a u s d e m I n f e k t io n s s c h u t z g e s e t z ( I f S G ) (2) Namentlich sind in dieser Vorschrift nicht genannte Krankheitserreger zu melden, soweit deren örtliche und zeitliche Häufung auf eine schwerwiegende Gefahr für die Allgemeinheit hinweist. Die Meldung nach Satz 1 hat gemäß § 8 Abs. 1 Nr. 2, 3 und Abs. 4, § 9 Abs. 2, 3 Satz 1 oder 3 zu erfolgen. (3) Nichtnamentlich ist bei folgenden Krankheitserregern der direkte oder indirekte Nachweis zu melden: 1. Treponema pallidum 2. HIV 3. Echinococcus sp. 4. Plasmodium sp. 5. Rubellavirus; Meldepflicht nur bei konnatalen Infektionen 6. Toxoplasma gondii; Meldepflicht nur bei konnatalen Infektionen. Die Meldung nach Satz 1 hat gemäß § 8 Abs. 1 Nr. 2, 3 und Abs. 4, § 10 Abs. 1 Satz 1, Abs. 3, 4 Satz 1 zu erfolgen. § 8 Zur Meldung verpflichtete Personen (1) Zur Meldung oder Mitteilung sind verpflichtet: 1. im Falle des § 6 der feststellende Arzt; in Krankenhäusern oder anderen Einrichtungen der stationären Pflege ist für die Einhaltung der Meldepflicht neben dem feststellenden Arzt auch der leitende Arzt, in Krankenhäusern mit mehreren selbständigen Abteilungen der leitende Abteilungsarzt, in Einrichtungen ohne leitenden Arzt der behandelnde Arzt verantwortlich, 2. im Falle des § 7 die Leiter von Medizinaluntersuchungsämtern und sonstigen privaten oder öffentlichen Untersuchungsstellen einschließlich der Krankenhauslaboratorien, 3. im Falle der §§ 6 und 7 die Leiter von Einrichtungen der pathologisch-anatomischen Diagnostik, wenn ein Befund 4. 5. 6. 7. 8. erhoben wird, der sicher oder mit hoher Wahrscheinlichkeit auf das Vorliegen einer meldepflichtigen Erkrankung oder Infektion durch einen meldepflichtigen Krankheitserreger schließen lässt, im Falle des § 6 Abs. 1 Nr. 4 und im Falle des § 7 Abs. 1 Nr. 36 bei Tieren, mit denen Menschen Kontakt gehabt haben, auch der Tierarzt, im Falle des § 6 Abs. 1 Nr. 1, 2 und 5 und Abs. 3 Angehörige eines anderen Heil- oder Pflegeberufs, der für die Berufsausübung oder die Führung der Berufsbezeichnung eine staatlich geregelte Ausbildung oder Anerkennung erfordert, im Falle des § 6 Abs. 1 Nr. 1, 2 und 5 der verantwortliche Luftfahrzeugführer oder der Kapitän eines Seeschiffes, im Falle des § 6 Abs. 1 Nr. 1, 2 und 5 die Leiter von Pflegeeinrichtungen, Justizvollzugsanstalten, Heimen, Lagern oder ähnlichen Einrichtungen, im Falle des § 6 Abs. 1 der Heilpraktiker. (2) Die Meldepflicht besteht nicht für Personen des Not- und Rettungsdienstes, wenn der Patient unverzüglich in eine ärztlich geleitete Einrichtung gebracht wurde. Die Meldepflicht besteht für die in Absatz 1 Nr. 5 bis 7 bezeichneten Personen nur, wenn ein Arzt nicht hinzugezogen wurde. (3) Die Meldepflicht besteht nicht, wenn dem Meldepflichtigen ein Nachweis vorliegt, dass die Meldung bereits erfolgte und andere als die bereits gemeldeten Angaben nicht erhoben wurden. Satz 1 gilt auch für Erkrankungen, bei denen der Verdacht bereits gemeldet wurde. (4) Absatz 1 Nr. 2 gilt entsprechend für Personen, die die Untersuchung zum Nachweis von Krankheitserregern außerhalb des Geltungsbereichs dieses Gesetzes durchführen lassen. 433 F. A u s z u g a u s d e m I n f e k t i o n s s c h u t z g e s e t z ( I f SG ) (5) Der Meldepflichtige hat dem Gesundheitsamt unverzüglich mitzuteilen, wenn sich eine Verdachtsmeldung nicht bestätigt hat. § 9 Namentliche Meldung (1) D ie namentliche Meldung durch eine der in § 8 Abs. 1 Nr. 1, 4 bis 8 genannten Personen muss folgende Angaben enthalten: 1. Name, Vorname des Patienten 2. Geschlecht 3. Tag, Monat und Jahr der Geburt 4. Anschrift der Hauptwohnung und, falls abweichend: Anschrift des derzeitigen Aufenthaltsortes 5. Tätigkeit in Einrichtungen im Sinne des § 36 Abs. 1 oder 2; Tätigkeit im Sinne des § 42 Abs. 1 bei akuter Gastroenteritis, akuter Virushepatitis, Typhus abdominalis/ Paratyphus und Cholera 6. Betreuung in einer Gemeinschaftseinrichtung gemäß § 33 7. Diagnose beziehungsweise Verdachtsdiagnose 8. Tag der Erkrankung oder Tag der Diagnose, gegebenenfalls Tag des Todes 9. wahrscheinliche Infektionsquelle 10. Land, in dem die Infektion wahrscheinlich erworben wurde; bei Tuberkulose Geburtsland und Staatsangehörigkeit 11. Name, Anschrift und Telefonnummer der mit der Erregerdiagnostik beauftragten Untersuchungsstelle 12. Überweisung in ein Krankenhaus beziehungsweise Aufnahme in einem Krankenhaus oder einer anderen Einrichtung der stationären Pflege und Entlassung aus der Einrichtung, soweit dem Meldepflichtigen bekannt 13. Blut-, Organ- oder Gewebespende in den letzten sechs Monaten 14. Name, Anschrift und Telefonnummer des Meldenden 434 15. bei einer Meldung nach § 6 Abs. 1 Nr. 3 die Angaben nach § 22 Abs. 2. Bei den in § 8 Abs. 1 Nr. 4 bis 8 genannten Personen beschränkt sich die Meldepflicht auf die ihnen vorliegenden Angaben. (2) Die namentliche Meldung durch eine in § 8 Abs. 1 Nr. 2 und 3 genannte Person muss folgende Angaben enthalten: 1. Name, Vorname des Patienten 2. Geschlecht, soweit die Angabe vorliegt 3. Tag, Monat und Jahr der Geburt, soweit die Angaben vorliegen 4. Anschrift der Hauptwohnung und, falls abweichend: Anschrift des derzeitigen Aufenthaltsortes, soweit die Angaben vorliegen 5. Art des Untersuchungsmaterials 6. Eingangsdatum des Untersuchungsmaterials 7. Nachweismethode 8. Untersuchungsbefund 9. Name, Anschrift und Telefonnummer des einsendenden Arztes beziehungsweise des Krankenhauses 10. Name, Anschrift und Telefonnummer des Meldenden. Der einsendende Arzt hat bei einer Untersuchung auf Hepatitis C dem Meldepflichtigen mitzuteilen, ob ihm eine chronische Hepatitis C bei dem Patienten bekannt ist. (3) Die namentliche Meldung muss unverzüglich, spätestens innerhalb von 24 Stunden nach erlangter Kenntnis gegenüber dem für den Aufenthalt des Betroffenen zuständigen Gesundheitsamt, im Falle des Absatzes 2 gegenüber dem für den Einsender zuständigen Gesundheitsamt erfolgen. Eine Meldung darf wegen einzelner fehlender Angaben nicht verzögert werden. Die Nachmeldung oder Korrektur von Angaben hat unverzüglich nach deren Vorliegen zu erfolgen. Liegt die Hauptwohnung oder der gewöhnliche Aufenthaltsort der betroffenen F. A u s z u g a u s d e m I n f e k t io n s s c h u t z g e s e t z ( I f S G ) Person im Bereich eines anderen Gesundheitsamtes, so hat das unterrichtete Gesundheitsamt das für die Hauptwohnung, bei mehreren Wohnungen das für den gewöhnlichen Aufenthaltsort des Betroffenen zuständige Gesundheitsamt unverzüglich zu benachrichtigen. (4) Der verantwortliche Luftfahrzeugführer oder der Kapitän eines Seeschiffes meldet unterwegs festgestellte meldepflichtige Krankheiten an den Flughafen- oder Hafenarzt des inländischen Ziel- und Abfahrtsortes. Die dort verantwortlichen Ärzte melden an das für den jeweiligen Flughafen oder Hafen zuständige Gesundheitsamt. (5) Das Gesundheitsamt darf die gemeldeten personenbezogenen Daten nur für seine Aufgaben nach diesem Gesetz verarbeiten und nutzen. Personenbezogene Daten sind zu löschen, wenn ihre Kenntnis für das Gesundheitsamt zur Erfüllung der in seiner Zuständigkeit liegenden Aufgaben nicht mehr erforderlich ist, Daten zu § 7 Abs. 1 Nr. 21 spätestens jedoch nach drei Jahren. § 10 Nichtnamentliche Meldung (1) Die nichtnamentliche Meldung nach § 7 Abs. 3 muss folgende Angaben enthalten: 1. im Falle des § 7 Abs. 3 Nr. 2 eine fallbezogene Verschlüsselung gemäß Absatz 2 2. Geschlecht 3. Monat und Jahr der Geburt 4. erste drei Ziffern der Postleitzahl der Hauptwohnung 5. Untersuchungsbefund 6. Monat und Jahr der Diagnose 7. Art des Untersuchungsmaterials 8. Nachweismethode 9. wahrscheinlicher Infektionsweg, wahrscheinliches Infektionsrisiko 10. Land, in dem die Infektion wahrscheinlich erworben wurde 11. Name, Anschrift und Telefonnummer des Meldenden 12. bei Malaria Angaben zur Expositions- und Chemoprophylaxe. Der einsendende Arzt hat den Meldepflichtigen insbesondere bei den Angaben zu den Nummern 9, 10 und 12 zu unterstützen. Die nichtnamentliche Meldung nach § 6 Abs. 3 muss die Angaben nach den Nummern 5, 9 und 11 sowie Name und Anschrift der betroffenen Einrichtung enthalten. (2) Die fallbezogene Verschlüsselung besteht aus dem dritten Buchstaben des ersten Vornamens in Verbindung mit der Anzahl der Buchstaben des ersten Vornamens sowie dem dritten Buchstaben des ersten Nachnamens in Verbindung mit der Anzahl der Buchstaben des ersten Nachnamens. Bei Doppelnamen wird jeweils nur der erste Teil des Namens berücksichtigt; Umlaute werden in zwei Buchstaben dargestellt. Namenszusätze bleiben unberücksichtigt. (3) Bei den in § 8 Abs. 1 Nr. 3 und 5 genannten Personen beschränkt sich der Umfang der Meldung auf die ihnen vorliegenden Angaben. (4) Die nichtnamentliche Meldung nach § 7 Abs. 3 muss innerhalb von zwei Wochen gegenüber dem Robert Koch-Institut erfolgen. Es ist ein vom Robert Koch-Institut erstelltes Formblatt oder ein geeigneter Datenträger zu verwenden. Für die nichtnamentliche Meldung nach § 6 Abs. 3 gilt § 9 Abs. 3 Satz 1 bis 3 entsprechend. (5) Die Angaben nach Absatz 2 und die Angaben zum Monat der Geburt dürfen vom Robert Koch-Institut lediglich zu der Prüfung verarbeitet und genutzt werden, ob verschiedene Meldungen sich auf dieselbe Person beziehen. Sie sind zu löschen, 435 F. A u s z u g a u s d e m I n f e k t i o n s s c h u t z g e s e t z ( I f SG ) sobald nicht mehr zu erwarten ist, dass die damit bewirkte Einschränkung der Prüfungen nach Satz 1 eine nicht unerhebliche Verfälschung der aus den Meldungen zu gewinnenden epidemiologischen Beurteilung bewirkt, jedoch spätestens nach zehn Jahren. § 23 Nosokomiale Infektionen, Resistenzen (1) Leiter von Krankenhäusern und von Einrichtungen für ambulantes Operieren sind verpflichtet, die vom Robert Koch-Institut nach § 4 Abs. 2 Nr. 2 Buchstabe b festgelegten nosokomialen Infektionen und das Auftreten von Krankheitserregern mit speziellen Resistenzen und Multiresistenzen fortlaufend in einer gesonderten Niederschrift aufzuzeichnen und zu bewerten. Die Aufzeichnungen nach Satz 1 sind zehn Jahre aufzubewahren. Dem zuständigen Gesundheitsamt ist auf Verlangen Einsicht in die Aufzeichnungen zu gewähren. (2) Beim Robert Koch-Institut wird eine Kommission für Krankenhaushygiene und Infektionsprävention eingerichtet. Die Kommission gibt sich eine Geschäftsordnung, die der Zustimmung des Bundesministeriums für Gesundheit bedarf. Die Kommission erstellt Empfehlungen zur Prävention nosokomialer Infektionen sowie zu betrieblich-organisatorischen und baulich-funktionellen Maßnahmen der Hygiene in Krankenhäusern und anderen medizinischen Einrichtungen. Die Empfehlungen der Kommission werden von dem Robert Koch-Institut veröffentlicht. Die Mitglieder der Kommission werden vom Bundesministerium für Gesundheit im Benehmen mit den obersten Landesgesundheitsbehörden berufen. Vertreter des Bundesministeriums für Gesundheit, der obersten Landesgesundheitsbehörden und des Robert Koch-Institutes nehmen mit beratender Stimme an den Sitzungen teil. 436 § 42 Tätigkeits- und Beschäftigungsverbote (1) Personen, die 1. an Typhus abdominalis, Paratyphus, Cholera, Shigellenruhr, Salmonellose, einer anderen infektiösen Gastroenteritis oder Virushepatitis A oder E erkrankt oder dessen verdächtig sind, 2. an infizierten Wunden oder an Hautkrankheiten erkrankt sind, bei denen die Möglichkeit besteht, dass deren Krankheitserreger über Lebensmittel übertragen werden können, 3. die Krankheitserreger Shigellen, Salmonellen, enterohämorrhagische Escherichia coli oder Choleravibrionen ausscheiden dürfen nicht tätig sein oder beschäftigt werden a) beim Herstellen, Behandeln oder Inverkehrbringen der in Absatz 2 genannten Lebensmittel, wenn sie dabei mit diesen in Berührung kommen, oder b) in Küchen von Gaststätten und sonstigen Einrichtungen mit oder zur Gemeinschaftsverpflegung. Satz 1 gilt entsprechend für Personen, die mit Bedarfsgegenständen, die für die dort genannten Tätigkeiten verwendet werden, so in Berührung kommen, dass eine Übertragung von Krankheitserregern auf die Lebensmittel im Sinne des Absatzes 2 zu befürchten ist. Die Sätze 1 und 2 gelten nicht für den privaten hauswirtschaftlichen Bereich. (2) Lebensmittel im Sinne des Absatzes 1 sind 1. Fleisch, Geflügelfleisch und Erzeugnisse daraus 2. Milch und Erzeugnisse auf Milchbasis 3. Fische, Krebse oder Weichtiere und Erzeugnisse daraus 4. Eiprodukte 5. Säuglings- und Kleinkindernahrung 6. Speiseeis und Speiseeishalberzeugnisse F. A u s z u g a u s d e m I n f e k t io n s s c h u t z g e s e t z ( I f S G ) 7. Backwaren mit nicht durchgebackener oder durcherhitzter Füllung oder Auflage 8. Feinkost-, Rohkost- und Kartoffelsalate, Marinaden, Mayonnaisen, andere emulgierte Soßen, Nahrungshefen. (3) Personen, die in amtlicher Eigenschaft, auch im Rahmen ihrer Ausbildung, mit den in Absatz 2 bezeichneten Lebensmitteln oder mit Bedarfsgegenständen im Sinne des Absatzes 1 Satz 2 in Berührung kommen, dürfen ihre Tätigkeit nicht ausüben, wenn sie an einer der in Absatz 1 Nr. 1 genannten Krankheiten erkrankt oder dessen verdächtig sind, an einer der in Absatz 1 Nr. 2 genannten Krankheiten erkrankt sind oder die in Absatz 1 Nr. 3 genannten Krankheitserreger ausscheiden. (5) Das Bundesministerium für Gesundheit wird ermächtigt, durch Rechtsverordnung mit Zustimmung des Bundesrates den Kreis der in Absatz 1 Nr. 1 und 2 genannten Krankheiten, der in Absatz 1 Nr. 3 genannten Krankheitserreger und der in Absatz 2 genannten Lebensmittel einzuschränken, wenn epidemiologische Erkenntnisse dies zulassen, oder zu erweitern, wenn dies zum Schutz der menschlichen Gesundheit vor einer Gefährdung durch Krankheitserreger erforderlich ist. In dringenden Fällen kann zum Schutz der Bevölkerung die Rechtsverordnung ohne Zustimmung des Bundesrates erlassen werden. Eine auf der Grundlage des Satzes 2 erlassene Verordnung tritt ein Jahr nach ihrem Inkrafttreten außer Kraft; ihre Geltungsdauer kann mit Zustimmung des Bundesrates verlängert werden. (4) Das Gesundheitsamt kann Ausnahmen von den Verboten nach dieser Vorschrift zulassen, wenn Maßnahmen durchgeführt werden, mit denen eine Übertragung der aufgeführten Erkrankungen und Krankheitserreger verhütet werden kann. 437 G . Vi r u s i n f e k t io n e n 1. Infektlokalisationen viraler Erkrankungen Respirations­ trakt Adenoviren Coxsackie-Vieren Cytomegalie-Virus ECHO-Viren Epstein-Barr-Virus FSME-Virus Herpes-simplex-Virus HAV / HBV / HCV HIV Influenza-Viren LCM-Virus Masern-Virus Mumps-Virus Norwalk-(Noro-) Virus Parainfluenza-Viren Parvovirus B19 Polio-Viren Röteln-Virus RS-Virus Rota-Viren Varizella-Zoster-Virus Leber Herz ZNS Gelenke GITrakt () Haut Auge Lymph­knoten/ Hämatolog. System Pankreas 439 G. Virusinfektionen 2. Serologische Diagnostik viraler Erkrankungen Folgende Indikationen bestehen für die Durchführung einer viro­ logisch-serologischen Untersuchung: Nachweis einer akuten, primären oder erst kürzlich erworbenen Infektion Nachweis einer prä- oder perinatal erworbenen Infektion Nachweis einer reaktivierten Infektion Nachweis einer Immunität gegenüber Erregern viraler Erkrankungen Eine Beurteilung von Antikörperbestimmungen bei akuten viralen Erkrankungen ist in der Regel nur unter Berücksichtigung des Titerverlaufs im Abstand von 7–14 Tagen möglich. Gleiches gilt analog für den Anstieg der Antikörper­konzentration (z.B. IU/ml oder mIU/ml). Zu Beginn einer Erkrankung viraler Genese finden sich häufig nicht oder nur gering erhöhte Titer. Gegenüber vielen viralen Erregern ist der Nachweis spezifischer IgM-Antikörper möglich (z.B. Epstein-Barr-Virus, Röteln-Virus, Varizella-Zoster-Virus etc.). Das Vorhandensein dieser Antikörperklasse weist auf das Vorlie­ gen einer akuten Infektion hin. Bei einer Einzelblutprobe kann bei einer akuten Virusinfektion nur der Verdacht auf das Vorliegen der Infektion ausgesprochen wer­den. Die Einzelprobe reicht jedoch für die Feststellung aus, ob ein Zustand nach Infektion bzw. Impfung (Immunität) vorliegt. Ein signifikanter Titeranstieg (2 oder mehr Verdünnungsstufen) im Intervall weist auf eine frische bzw. reaktivierte Virusinfektion hin. 440 Beispiel: 1. Untersuchung: 2. Untersuchung: Ak-Titer = 1:8 Ak-Titer = 1:64 Bewertung:Titeranstieg um mehr als 2 Verdünnungsstufen spricht für frische bzw. reaktivierte Infektion. Gelegentlich weisen sehr hohe IgG–Ak-Titer auch auf eine reaktivierte Infektion hin (Beispiel: HSV-Ak > 1:1000), ohne dass ein IgM-Ak-Nachweis möglich ist. Eine akute kann von einer früher durchgemachten Infektion häufig auch durch den Nachweis niedrig-avider (im Gegensatz zu hoch-aviden) Antikörpern unterschieden werden. Kreuzreaktionen zwischen Antikörpern gegen „verwandte“ Viren sind möglich (z.B. HSV 1-, HSV 2–Antikörper), werden allerdings mit zunehmend verbesserter Testspezifität seltener. H . D i a g n o s t ik i n G r a v idi t ä t u n d P e r i n ata l p e r iod e 1. Mutterschaftsvorsorge: (gemäß Mutterschafts-Richtlinien, 2009) a.Obligate Untersuchungen während der Schwangerschaft: Untersuchung Lues-Suchreaktion Röteln-HAH Suchtest irreguläre Ak. Blutgruppe, Rh-Faktor D HIV-Ak.-Test HBs-Ag.-Nachweis Chlamydia trachomatis Material Serum Serum Serum/Vollblut Vollblut Serum Serum (Erststrahl-) Urin Zeitpunkt 4. – 8. SSW 4. – 8. SSW 4. – 8. SSW u. 24.-27. SSW 4. – 8. SSW 4. – 8. SSW nach der 32. SSW 4. – 8. SSW Bemerkung TPHA Immunität: Titer ≥ 1:32 Einwilligung erforderlich nahe am Geburtstermin Direktnachweis (NAT) b. Weitere infektiologische Untersuchungen bei begründetem Verdacht: Erkrankung Material Parameter Bemerkung Cytomegalie (CMV) Serum CMV IgG/IgM-Ak. * Immunstatus sinnvoll vor oder früh in der Schwagerschaft (IGEL) Herpes-simplex (HSV) Serum HSV I/HSV II IgG/IgM-Ak. LCM-Virus Serum LCM IgG/IgM-Ak. Listeriose Serum/Stuhl Ak.-/Direktnachweis Masern Serum Masern IgG/IgM-Ak. Mumps Serum Mumps IgG/IgM-Ak. Ringelröteln (Parvovirus B19) Serum Parvo-B19 IgG/IgM-Ak. * s.o. Streptokokken-Infektion Vaginalabstrich B-Streptokokken-Nachweis Toxoplasmose Serum Toxo IgG/IgM/IgA-Ak. zum Ende der Schwangerschaft (35. –37. SSW) * s.o. Varizellen (VZV) Serum VZV IgG/IgM-Ak.-Nachweis * s.o. Lympho-Chorio-Meningitis 441 H . D i a g n o s t ik i n G r a v idi t ä t u n d P e r i n ata l p e r iod e 2. Laboruntersuchungen bei Verdacht auf Risikoschwangerschaft: Risiko Parameter/Diagnostik Bemerkung Ektope Schwangerschaft (EUG) β-hCG, ggf. Progesteron im Verlauf (mind. 2 Proben im Abstand von 2 – 7 Tagen), vaginaler Ultraschall Normal ist in den ersten 7 SSW eine Verdop­pelung der ß-hCG-Werte ca. alle 2 – 2,5 Tage (Positiver Vorhersagewert eines normalen Anstiegs zum Ausschluß einer EUG 94.7 %). Bei der EUG werden in ca. 80% der Fälle entsprechend der SSW zu niedrige ß-HCG-Werte gemessen und es erfolgt ein zu langsamer und geringer Anstieg von ß-hCG. Auch Progesteron für eine Frühgravidität zu niedrig (< 10 ng/ml). Abortus imminens, V.a. Frühabort β-hCG, Progesteron (ggf. Östradiol) im Verlauf, AFP vaginaler Ultraschall Bei V.a. Frühabort sind die ß-hCG-Werte meist zu niedrig, steigen zu langsam an oder fallen bereits ab. Progesteron ebenfalls zu niedrig (< 10 ng/ml), ggf. auch Östradiol niedrig. Niedrige AFP-Werte nach der 10. SSW sprechen für eine irreversible Störung der Gravidität. Beim Abortus imminens ist AFP erhöht bei erniedrigten ß-hCG-Werten. Offener Neuralrohrdefekt (Spina bifida, Anencephalie) AFP in der 16.-21. SSW Erhöhung des AFP-Wertes bzw. des MoM (Multiple of mediane) auf einen Wert > 2,5 (-fach) im mütterlichen Serum (ggf. Ultraschalluntersuchung und AFP-Kontrolle, bei 2. Mal erhöhtem AFP-Wert u. unauffälliger Sonographie ggf. Amniozentese u. Bestimmung von AFP und Acetylcholinesterase im Fruchtwasser). V.a. Plazentainsuffizienz bzw. fetale Gefährdung Fetometrie, Dopplersonographie, Bestimmung der Fuchtwassermenge, CTG, Stresstest, evt. Plazenta­grading Die Bestimmung von Östriol und humanem plazentaren Laktogen (hPL) zur Einschätzung der fetalen Gefährdung ist heute nicht mehr zu empfehlen (Messwerte korrelieren eher mit der Plazentamasse). Kein hPL, Östriol! 442 H . D i a g n o s t ik i n G r a v idi t ä t u n d P e r i n ata l p e r iod e Risiko Schwangerschaftsgestose PPraeklampsie PHELLP-Syndrom Parameter/Diagnostik Ges.-Eiweiß im 24h-Urin, Kreatinin, Harnsäure, GOT, GPT, Blutbild, Gerinnung HELLP zusätzl.: LDH, Bilirubin, ggf. D-Dimere, Fibrinogen, Haptoglobin Fetometrie, Dopplersonographie Diabetes mellitus Typ I, Gestationsdiabetes Glucose, HbA1C (oraler) Glucose-Toleranztest (OGTT) mit 50 g bzw. 75 g Glucose, Urinstatus Fetometrie (ab 30. SSW 10-tägig) Pränatales Screening auf Down-Syndrom P 1. Down-Frühscreening P 2. Triple-Diagnostik Laufende 11. – 14. SSW bzw. voll. 10. – 13. bzw. 11+0 – 13+6 SSW: Freies Beta-HCG, PAPP-A im Serum sonographische Messung der NT (nuchale Transluzenz) Laufende 15. – 21. SSW bzw. voll. 14. – 20. bzw. 14+0 – 19+6 SSW: AFP, ß-hCG, freies Östriol im Serum Bemerkung Symptome: Hypertonie (RR > 140/90 mmHg), Ödeme, Proteinurie PPraeklampsie: Proteinurie > 0.3 g/24h, Harnsäure > 6.0 mg/dl, GOT u. GPT ↑, Thrombozytopenie (> 75 x109 /l) P HELLP-Syndrom zusätzl: Hämoglobin ↓, Thrombozytopenie (< 100 x 109 /l, schwere Fälle < 50 x 109 /l) Hkt > 38% Hämolysezeichen: GPT u. LDH ↑ (2-3fach), Bilirubin ↑, Thrombinzeit ↓, D-Dimere ↑, Fibrinogen <150mg / dl, Haptoglobin ↓ Zur Diagnostik neben Nüchternglucose erst 50 g, ggf. dann 75 g OGTT (siehe Kapitel M „Funktionstests“). Bei Diabetes mellitus Typ I oder Gestationsdiabetes optimale Stoffwechseleinstellung wichtig: HbA1C-Kontrolle alle 4 Wochen (Assoziation zwischen Fehlbildungsrate und HbA1C-Konzentration im 1. Trimester), der HbA1C-Wert sollte im Referenzbereich für Gesunde liegen, Urinstatus alle 2 Wochen Unter Einbeziehung von mütterlichem Alter, SSL, BIP, Gewicht, ethnischer Herkunft, insulinpflichtigem Diabetes, Ein- oder Mehrlingsgravidität erfolgt eine integrierte statistische Auswertung und die Berechnung der Wahrscheinlichkeit für ein Kind mit Down-Syndrom zusammen mit den jeweiligen gemessenen Parametern bzw. zusammen mit der NT beim Down-Frühscreening. P 1. Down-Frühscreening: Detektionsrate für das DownSyndrom 86 % bei einer falsch-positiv-Rate von 5 % P 2. Triple-Diagnostik: Detektionsrate für das Down-Syndrom 69 % bei einer falsch-positiv-Rate von 5 %. Es werden z.T. auch andere Markerkombinationen wie AFP + hCG + freies Östriol + Inhibin A eingesetzt. 443 H . D i a g n o s t i k i n G r a v i d i t ä t u n d P e r i n ata l p e r i o d e Risiko Parameter/Diagnostik Bemerkung Chromosomenanomalien Chromosomenanalyse mittels PChorionzottenbiopsie (9. – 13. SSW) P Amnionzellkultur (ab 14. SSW) nach Amniozentese Bei 3 % der Neugeborenen treten Fehlbildungen und Krankheiten aufgrund genetischer Faktoren auf. Am häufigsten werden Untersuchungen zur Diagnostik von Chromosomenanomalien wie z.B. Down-Syndrom, Klinefelter-Syndrom, YY-Syndrom 47, Triple X 47 und dem Turner-Syndrom durchgeführt. Stoffwechselerkrankungen Biochemische Analytik, PolymeraseKettenreaktion aus Amnionzellkultur Erkennung angeborener Stoffwechselstörungen wie z.B. G-6-PDH-Mangel, Ahornsiruperkrankung, Hypophosphatämie, M. Gaucher, M. Fabry etc. 3. Diagnostik prä- und perinataler Infektionen beim Neugeborenem: Infektion Röteln-Virus 444 Erregernachweis Virusnachweis mittels PCR aus Rachenabstrich, Urin u. Liquor innerhalb 6 – 8 Monaten postnatal. Serologische Diagnostik Nachweis von IgM-Ak. im ersten Lebenshalbjahr; Persistenz von IgGAk. im HAH oder EIA ab 6. Lebensmonat über das 1. Lebensjahr hinaus. Hinweise Zum Ausschluss einer pränatalen Röteln-Infektion reicht ein einmaliger negativer IgM-Ak.-Nachweis zum Geburtszeitpunkt nicht aus, ggfs. Verlaufsbeobachtung der IgG-Ak. H . D i a g n o s t ik i n G r a v idi t ä t u n d P e r i n ata l p e r iod e Infektion Cytomegalie-Virus Erregernachweis Virusnachweis mittels CMVDNA oder Early Antigen im Urin (bzw. Speichel) in den ersten 2 Lebenswochen. Differenzierung zwischen präoder früh- postnataler Infektion (Muttermilch) mit CMV-DNANachweis aus Guthrie-Karte (Einverständnis der Eltern) Early Antigen-Nachweis auch aus Rachenabstrich, respiratorischen Sekreten, CMV- PCR aus EDTABlut, Serum, Liquor. Herpes-simplex-Virus HSV1 und 2 –DNA-Nachweis mittels PCR im Augenabstrich, Rachenabstrich, Bläscheninhalt, EDTA-Blut, Urin,bei neurologischen Symptomen auch aus Liquor. Virusanzucht ebenfalls möglich. Varizella Virusnachweis mittels PCR aus Zoster-Virus Bläscheninhalt u. Liquor oder Anzucht in Zellkultur aus Bläscheninhalt und Rachenabstrich bzw. –sekret. Serologische Diagnostik Hinweise Je nach Infektionszeitpunkt erhöhte oder ansteigende IgMund IgG-Ak. im EIA. Häufigste prä- und perinatale Virusinfektion. Untersucht werden sollten Kinder von Müttern mit CMV-Primärinfektion in der Schwangerschaft und alle Kinder mit auffälligem Neugeborenen - Hörscreening Nachweis von (ansteigenden) IgGund IgM-Ak. mittels EIA erst in der 4. Lebenswoche, auch aus Liquor (gemäß Reiber-Schema). Hauptsächlich peripartale Infektion im Geburtskanal. Nachweis von IgG- und IgM-Ak. in den ersten 4 – 6 Tagen nach Exanthembeginn; nach intrauteriner Infektion häufig IgM-Ak. negativ, Diagnose meist nur durch (über den 6. – 7. Lebensmonat hinaus) per­sistierende IgG-Ak. möglich. Hohes Risiko einer schweren neonatalen Varizelleninfektion bei Ausbruch des mütterlichen Varizellenexanthems 5 Tage vor bis 2 Tage nach der Entbindung. 445 H . D i a g n o s t i k i n G r a v i d i t ä t u n d P e r i n ata l p e r i o d e Infektion Erregernachweis Serologische Diagnostik Hinweise Hepatitis B-Virus Evtl. Virusnachweis mittels PCR. Hauptsächlich peri- oder frühpostnatale Infektion, daher bei Kindern HBs-Ag.positiver Mütter grundsätzlich aktivpassive Simultanimpfung innerhalb 6 h nach Geburt. Humanes Immundefizienz-Virus (HIV 1/2) Parvovirus B 19 (Ringelröteln) Qualitativer und quantitativer Virus-RNA-Nachweis mittels PCR; p24-Antigen-Nachweis. Qualitativer und quantitativer Parvovirus B19 DNA-Nachweis mittels PCR in Fruchtwasser, Gewebsbiopsie und EDTA-Blut (fetal oder postnatal). Direkter Erregernachweis mittels PCR aus Fruchtwasser, Liquor und EDTA-Blut (fetal oder postnatal). Antikörper- und AntigenNachweise: (HBs-Ag., HBe-Ag., Anti-HBc, AntiHBc-IgM, Anti-HBs). Nicht geimpfte peri- oder früh postnatal infizierte Neugeborene werden innerhalb von 3 Monaten HBs-Ag. positiv Ak.-Verlaufskontrolle mittels EIA u. Immunoblot ab dem 18. Lebensmonat. IgM-Ak. in der Regel nur im Fetalblut nachweisbar, bei Neugeborenen Nachweis von persistierenden IgG-Ak. über 6 Monate post partum bis zum vollendeten 2. Lebensjahr. IgM-Ak.-Persistenz nach Erstinfektion ca. 18-24 Monate, mittels IgG-Aviditätsbestimmung bessere Eingrenzung des Infektionszeitpunktes bei Schwangeren möglich. IgM-Ak. im Fetalblut nur in 50 %, postnatal in ca. 70 % der Fälle nachweisbar; vergleichendes IgG/IgM-Profil (Blot) aus mütterl. und Neugeborenen-Serum, Nachweis von persistierenden IgG-Ak. über den 6. Lebensmonat hinaus. Ak.-Nachweis auch im Liquor möglich( gemäß Reiber-Schema) Toxoplasma gondii 446 Die Transmissionsrate Mutter-Kind beträgt ca. 25 – 50 %, am häufigsten ist die perinatale Infektion. Meist Fetopathie. Risiko eines Hydrops fetalis mit intrauterinem Fruchttod ca. 4 – 9 % Frühzeichen: erhöhtes AFP im mütterlichen Serum. Ausschließlich Fetopathie, Embryopathien kommen nicht vor, (hohes Risiko in der 24. – 30. SSW), ggfs. antibiotische Therapie Kongenital infizierte, bei Geburt asymptomatische Kinder weisen vor allem okuläre Spätschäden auf. H . D i a g n o s t ik i n G r a v idi t ä t u n d P e r i n ata l p e r iod e Infektion Erregernachweis Treponema pallidum Direkter Erregernachweis mit(Syphilis, Lues) tels PCR aus Liquor, Abstrichen, Biopsien und EDTA-Blut (fetal oder postnatal). Listeria monocytogenes Direkter Erregernachweis mittels kultureller Anzucht aus Blut, Abstrichen, Urin, Amnionflüssigkeit, Abortmaterial, Lochien, bei Neugeborenen auch aus Ohrabstrich und Liquor. Auch PCR aus Liquor, Stuhl und EDTA-Blut möglich. Kultureller Nachweis aus nicht sterilen Abstrichmaterialien (Rektum, Vagina) nicht sinnvoll, da 5% aller Gesunden Träger sind ! Serologische Diagnostik Hinweise Bei positivem TPPA Test (Ausschluss­ untersuchung) und Bestätigung durch FTA-ABS.-IgG zusätzlicher Nachweis kindlicher IgM-Ak. postnatal mittels FTA-ABS.-IgM u./o. Immunoblot als Hinweis auf Lues connata. Lipoid-Ak.(VDRL, Cardiolipin-KBR) sprechen zusätzlich für aktive, behandlungsbedürftige Infektion. Serologische Diagnostik gegenüber dem direkten Erregernachweis nachrangig, kann aber bei kulturnegativen ZNS-Infektionen positiv sein. Titer über 1:200 oder mehr als zweifacher Titeranstieg in der Widal-Reaktion gegen O- und H-Antigene sind diagnostisch bedeutsam. Häufige Kreuzreaktio­nen mit Entero- und Staphylokok­ken Intrauterine, transplazentare Infektion selten vor dem 4. Gestationsmonat. Serologischer Ausschluss einer Lues connata bei allen Kindern von Müttern mit Syphilisanamnese notwendig, da häufig uncharakteristische Sympto­matik. Therapie der Schwangeren bzw. des Neugeborenen mit Penicillin als Mittel der Wahl. Meist transplazentare Infektion während mütterlicher Bakteriämie im Rahmen einer Erstinfektion. 70-80 % der betroffenen Kinder sind Frühgeborene im 3. Trimenon, 25 % Totgeburten. Therapie der Schwangeren mit Ampicillin, Neugeborene mit Ampicillin u. Gentamicin 447 I . T u mo r m a r k e r 1. Tumormarker, Indikation, weitere erfasste maligne Erkrankungen, Erhöhung bei benignen Erkrankungen und physiologischen Zuständen Tumormarker Indikation 5-Hydroxyindolessigsäure (5-HIES) Karzinoid AFP Hepatozelluläres Karzinom, (Alpha-1-Fetoprotein) Keimzelltumoren (Hoden, Ovar, extragonadal) Alkal. Plazenta-Phosphatase (PLAP) Beta-2-Mikroglobulin Keimzelltumoren, insbesondere Seminome (72%) Lymphoproliferative Erkrankungen wie Multiples Myelom, Non-Hodgkin-Lymphom, Hodgkin-Lymphom, chron. lymphatische Leukämie, AML, CML weitere maligne Erkrankung Magenkarzinom, kolorektales Karzinom, Gallengangs-, Pankreasu. Bronchialkarzinom (oft zusammen mit Lebermetastasen) Hoden- Ovarialtumoren benigne Erkrankung/physiol. Zustände, Bemerkungen P Chron. Intermittierende inkomplette Ileuszu­ stände, peptische Ulcera P bestimmte Nahrungsmittel, Medikamente (s. alphabet. Teil) P Akute u. chron. Hepatitis, alkoholbedingte Hepatitis, Leberzirrhose PRauchen, Schwangerschaft P Niereninsuffizienz, bei Dialysepatienten, tubulointerstitieller Nierenschaden (z.B. bei Schwermetallvergiftung), Erkankungen mit erhöhtem Zellumsatz wie Infektionen (z.B. AIDS, Hepatitis), Autoimmunerkrankungen, Leberzirrhose 449 I. Tumormarker Tumormarker Indikation Beta-HCG (ß-hCG) Trophoblastentumoren (Blasenmole, Chorionkarzinom) Keimzelltumoren (Hoden, Ovar), extragonadale Keimzelltumoren CA 125 Ovarialkarzinom, Zweitmarker beim Pankreaskarzinom (nach CA 19 – 9) CA 15-3 Mammakarzinom (zusammen mit CEA), Zweitmarker beim Ovarialkarzinom (nach CA 125) 450 weitere maligne benigne Erkrankung/physiol. Zustände, Erkrankung Bemerkungen PNiereninsuffizienz Kolon-, Bronchial-, PGravidität, Postmenopause (< 10 mIE/ml), (epitheliales) Ovarial-, Mamma-, Pankreas-, geleHypogonadismus gentlich Dünndarm- und Nierenkarzinom, Hepatom Endometrium-, Bronchial-, Leberzell-, Gallengangs-, Magenkarzinom, kolorektales Karzinom, bei Lebermetastasen, Zervix-, Collum- und Mammakarzinom Endometrium-, Corpus-, Bronchial-, Magen-, Pankreas- und Leberkarzinom P(akute) Adnexitis, Endometriose, Peritonitis, Pankreatitis, Cholelithiasis, Cholezystitis, akute u. chronisch-aktive Hepatitis, Leberzirrhose, Ikterus, Autoimmunerkrankungen, Herz- u. Niereninsuf­fizienz, benigne Adnextumoren, Meigs-Syndrom, Leiomyom, nach Kochenmarks-Transplantation PMenstruation, Gravidität PDialysepflichtige Niereninsuffizienz, HIV-Infektion, chron.-entzündliche Lebererkrankungen, Bronchial-, Pankreas-, Rheumaerkrankungen, Tuberkulose, Mammaerkrankungen (z.B. Myomastopathie, Fibroadenom), benigne Thorax­erkrankungen PGravidität, Stillperiode I . T u mo r m a r k e r Tumormarker Indikation CA 19-9 Pankreaskarzinom, hepatobiliäres Karzinom (Leber-, Gallengangskarzinom), Magenkarzinom, Zweitmarker beim kolorektalen Karzinom (nach CEA) und beim Ovarialkarzinom (nach CA 125) CA 50 Pankreas-, Kolon-, Rektum-, Magen- und Endometrium­ karzinom, Therapie- und Verlaufskontrolle CA 549 Mammakarzinom, (zusammen mit CA 15–3 und CEA CA 72-4 weitere maligne Erkrankung Bronchial-, Mammaund Corpuskarzinom, Lebermetastasen Ovarial-, Endometrium-, Bronchial- und Prostatakarzinom Magenkarzinom als ErstGallengangs-, Ösophamarker (zusammen mit CEA, gus-, Pankreas-, Kolon-, CA19-9), Zweitmarker beim Mamma-, Endometriummuzinösen Ovarialkarzinom u. Zervixkarzinom (zusammen mit CA 125) benigne Erkrankung/physiol. Zustände, Bemerkungen PChole(docho)lithiasis, Cholezystits, Cholangitis, obstr. Ikterus, toxische u. chron. aktive Hepatitis, Leberzirrhose, Leberzellnekrose, Mukoviszidose, aktive oder chronisch-aktive Pankreatitis, Milz-, Leber-, Pankreas u. bronchogene Zysten, multizystisches Mesotheliom des Peritoneums, Lungenfibrose, Divertikulitis, benigne Hydro- u. Pyonephrose PMenstruation, Gravidität PPankreatitis, Leberzirrhose, Colitis ulcerosa PCA 50 ist ein mit dem CA 19-9 verwandter Tumormarker, welcher im Gegensatz zu CA 19–9 auch bei Lewis-a/b-negativen Patienten exprimiert wird und in diesen Fällen bestimmt werden sollte. Eine gleichzeitige Bestimmung von CA 50 und CA 19-9 ist nicht sinnvoll. PLeber-, Lungen-, Prostata- und Ovarialerkrankungen PLeberzirrhose, Pankreatitis, Lungenerkrankungen, rheumatische Erkrankungen, Ovarialerkrankungen, Ovarialzysten, gastrointestinale Erkrankungen 451 I. Tumormarker Tumormarker Calcitonin (CT) CEA (Carcinoembryonales-Antigen) Chromogranin A (CgA) CYFRA 21-1 452 Indikation weitere maligne benigne Erkrankung/physiol. Zustände, Erkrankung Bemerkungen Medulläres SchilddrüNeuroendokrine Tumoren, PNiereninsuffizienz, Hashimoto-Thyreoiditis, Hypergastrinämie, primären senkarzinom, Familienz.B. Karzinoide, InsuliHyperparathyreoidismus screening bei MEN Typ 2, nome, VIPome, kleinzelPGravidität, unter oralen Kontrazeptiva Phäochromozytom lige Bronchialkarzinome Pentzündliche Lebererkrankungen, alkoholische Kolorektales Karzinom, Magen-, Ösophagus-, Leberzirrhose, Pankreatitis, entzündliche ErkranDifferentialdiagnose von Pankreas-, Gallenwegs-, kungen des Gastrointestinaltraktes, z.B. M. Lebertumoren, medulläres Bronchial-, Ovarial- und Crohn, Colitis ulcerosa, Divertikulitis, entzündSchilddrüsenkarzinom, Zervixkarzinom liche Lungenerkrankungen Zweitmarker beim MammaPRaucher haben im Mittel höhere CEA-Werte als karzinom (zusammen mit Nichtraucher (ca. 10 ng/ml bis 20 ng/ml) CA 15–3) Pbeim Phäochromozytom zusammen mit KatechoPhäochromo­zytom, Ganglio­ lamine u. (Nor-) Metanephrine im Urin sowie neurinom, Neuroblastom, ggf. im Plasma, Vanillinmandelsäure, neuroendokriner Tumor Homovanillinsäure und ggf. mit NSE mit/ohne HormonproduktiPbeim Karzinoid zusammen mit 5-HIES u. on (z.B. (Bronchus-) KarziSerotonin und ggf. NSE noid, Gastrinom etc.), kleinPErhöhung von CgA bei Niereninsuffizienz zelliges Bronchialkarzinom Bronchialkarzinom, Zervix-, Ovarial-, Mamma-, PLungenerkrankungen, gynäkologische u. gastrointestinale Erkrankungen, Niereninsuffizienz bevorzugt nicht-kleinPankreas-, Magen-, zelliges BronchialkarziKolon-und Leberkarzinom PGravidität (39./40. SSW), iatrogen (z.B. bei OP, nach Intubation, längerer Überdruckbeatmung), nom, Adenokarzinom, sowie Karzinome im nach massiven Trauma (z.B. Prellungen, Plattenepithelkarzinom, HNO-Bereich Lungenquetschung) Harnblasenkarzinom I . T u mo r m a r k e r Tumormarker Indikation Tumoren des sympathoadrenergen Systems, Neuroblastom, Phäochromozytom M2-PK (Pyruvatkinase Nierenzellkarzinom (a), Typ Tumor M2) Lungenkarzinom (b), Pankreaskarzinom (c), Seminom (d), gastrointestionalen Tumoren (e) (immer zusammen mit den primären/sekundären Markern) zur Verlaufskontrolle - Screening auf gastrointestinale Tumoren im Stuhl (vor allem kolorektales CA) Neopterin hämatologische Neoplasien weitere maligne Erkrankung Homovanillinsäure Lungen- und Prostatakarzinom, gynäkologische und gastrointestinale Tumoren benigne Erkrankung/physiol. Zustände, Bemerkungen PStress, bestimmte Nahrungsmittel und Medikamente (siehe alphabet. Teil) M2-PK u. prim./sek. Marker: (a)M2-PK , CEA, TPA (b)M2-PK, NSE, CYFRA 21-1, CEA (kleinzelliges) M2-PK ,CYFRA 21-1, CEA (Adeno-CA) M2-PK, CYFRA 21-1, SCC, CEA (Plattenepithel-CA) (c)M2-PK, Ca 19-9, CEA (d)M2-PK, β-hCG (e)M2-PK, CA 19-9, CEA P Erhöhungen von M2-PK bei entzündlichen, benignen Prozessen (z.B. M. Crohn etc.) sowie bei Adenomen und Polypen P Infektionen (vor allem HIV, TBC etc.), Autoimmun- und entzündliche Erkrankungen (z.B. rheumatoide Arthritis, SLE, M. Crohn etc.), bei Abstoßungsreaktion und Infektion nach Organtransplantation 453 I. Tumormarker Tumormarker Neuronen-spezifische Enolase, NSE NMP22 (Nuclear Matrix Protein) Progastrin-RP (Pro-GRP) Parathormon-related Peptide (PTHrP) u. mid-C-regional 454 Indikation weitere maligne benigne Erkrankung/physiol. Zustände, Erkrankung Bemerkungen Medulläres Schilddrüsenkar- PLungenerkrankungen, zerebrale Erkrankungen Kleinzelliges Bronchialkarzinom, Karzinome aller Sta(z.B. Meningitis, Hirnischämie,- infarkt, Epilepzinom, neuroendokrinen dien 22% (nicht-pulmonale) sien, Jakob-Creutzfeldt-Erkrankung, SchizoTumoren und APUDOMen Lymphome, Leukämien, bei phrenie etc.), Urämie, bei Gravidität mit fetalen (z.B. Gastrinom, VIPom, primären Gehirntumoren, Neuralrohrdefekten Insulinom, Karzinoid). Hirn­metastasen, malignen Neuroblastom Melanom, Phäochrmozytom im Liquor, Nierenkarzinom, Mammakarzinom, epitheliale u. selten nicht epitheliale Tumoren PFalsch erhöht Werte für NMP22 bei Patienten Harnblasenkarzinom mit Dauerkatheter, bei Nierensteinen und Harnwegsinfektionen (Bitte Spezialgefäß für Spontanurinprobe anfordern!) PHohe Werte bei eingeschränkter Nierenfunktion, kleinzellige V.a. kleinzelliges neuroendokrine Bronchialkarzinom, DD: höhere Werte bei gastrointestinalen (z.B. LeberzirKarzinome (z.B. Prostata, unklarer Lungenrundrhose, Hepatitis etc.), urologischen Erkrankungen u. herde, V.a. tumorindizierte Ösophagus), medulläres bei infektiösen Prozessen, geringe Erhöhungen d. Polyneuropathie, Nachsorge Schildrüsenkarzinom, Werte bei Erkrankungen der Brustdrüse (z.B. Mastivereinzelt hohe Werte u. Therapiekontrolle tis, Mastopathie etc.), der Lunge (z.B. TB, Sarkoidobeim nicht-kleinzelligen kleinzelliger Bronchialse, COPD etc.) u. bei Autoimmunerkrankungen (oh. karzinome Bronchialkarzinom Nierenbeteiligung) PHyperparathyreoidismus Tumorhypercalciämie bei soli- Plattenepithel-, Harnden Tumoren, insbesondere blasen- und ÖsophagusMamma-, Nieren- und kleinkarzinom, bei malignen zelligem Bronchialkarzinom hämatologischen Erkran- Prognostischer Faktor für die gungen (eher untergeordEntwicklung von Knochenme- nete Rolle) tastasen (z.B. Mamma- und Bronchialkarzinom) I . T u mo r m a r k e r Tumormarker Indikation PSA, freies PSA (Prostataspezifisches Antigen) Prostatakarzinom S 100 Protein (S 100) Melanom hohe Tumorspezifität, keine nennenswerten Erhöhungen bei anderen malignen Tumoren, Marker der Neuro­ destruktion im ZNS SCC (Squamous cell carcinoma antigen) Plattenepithelkarzinom von Zervix, Lunge, Ösophagus, Analkanal- und Kopf-Nacken-Karzinom Mamma-, Endometrium-, Corpus-, Ovar-, Vulva- u. Vaginalkarzinom, bei Hautkarzinom, bei Analkarzinom Serotonin Karzinoid (ggf. bei V.a. Foregut- und MidgutKarzinoide Serotonin im plättchenreichen Plasma) Malignome mit hoher Proliferationsrate, Lymphome, Myelome, Leukämien (z.B. ALL, CML) Karzinoid Thymidinkinase weitere maligne Erkrankung benigne Erkrankung/physiol. Zustände, Bemerkungen PProstatahyperplasie, akute Prostatitis akute Leberfunktionsstörungen PErhöhung von PSA nach Manipulationen an der Prostata (z.B. DRU), nach Prostatabiopsie und akutem Harnverhalt. PPSA steigt mit zunehmenden Alter an PErhöhungen bis 2.0 µg/l bei schweren bakteriellen Infekten (z.B. Intensivpatient), deutliche Erhöhungen bei Herzinfarkt, geringe Erhöhungen bei Leberzirrhose und Niereninsuffizienz. PErhöhung auch bei Neurodestruktion und Neurodegeneration, z.B. cerebrale Ischämie oder Blutung, Schädel-Hirn-Trauma, vereinzelt bei der Alzheimer- u. der Jakob-Creutzfeld-Erkrankung, bei multipler Sklerose, psychiatrischen Erkrankungen, beim Guillain-Barre-Syndrom PLeberzirrhose, Pankreatitis, Niereninsuffizienz- u. versagen, chron. Lungenerkrankungen (z.B. chron.-obstruktive Bronchitis, Tuberkulose), gynäkologischen Erkrankungen (z.B. Uterus myomatosus), HNO-Erkrankungen, Hauterkrankungen (z.B. Psoriasis, Ekzemen, Pemphigus) PChron. intermittierende inkomplette Ileuszustände, peptische Ulcera Pbestimmte Nahrungsmittel, Medikamente (siehe alphabet. Teil) PVirusinfektionen (z.B. CMV, EBV etc). PVitamin-B12- u. Folsäuremangel PAnstieg unter Zidovudin-Therapie bei HIV-Infektion 455 I. Tumormarker Tumormarker Indikation Thyreoglobulin (TGB) Verlaufskontrolle des differenzierten Schilddrüsenkarzinoms (follikulär, papillär) nach totaler Schilddrüsenablatio (OP, Radiojodtherapie). Proliferationsmarker bei verschiedenen malignen Tumoren, insbesondere bei diagnostizierten Harnblasen-, Mamma-, Ovarial- und Lungenkarzinom sowie bei gastrointestinalen Karzinomen Phäochromozytom, Neuroblastom TPA (Tissue-Polypeptid-Antigen) Vanillinmandelsäure 456 weitere maligne Erkrankung benigne Erkrankung/physiol. Zustände, Bemerkungen Pvariable TGB-Erhöhungen bei Struma (nodosa), autonomen Adenom und M. Basedow PDestruierende Thyreoiditis (TGB erhöht, Hyperthyreose). PThyreotoxicosis factitia (TGB erniedrigt!). Pankreas-, Leberzell-, Hoden-, Prostata- und Schilddrüsenkarzinom sowie bei HNO-Tumoren Pdekompensierte Leberzirrhose (sehr hohe Werte!), entzündliche Erkrankungen von Leber, Lunge, Gastro­ intestinal- und Urogenitaltrakt, Nieren­insuffizienz, Dialysepatienten, Diabetes mellitus. PTPA ist im 3. Trimenon einer Gravidität sowie ca. 4 – 6 Wochen postoperativ ebenfalls erhöht PTPA sollte immer in Kombination mit den prim./sek. Tumormarkern bestimmt werden PStress, bestimmte Nahrungsmittel und Medikamente (siehe alphabet. Teil) I . T u mo r m a r k e r 2. Tumorerkrankungen und geeignete Tumormarkerkombinationen bzw. typische Metabolite und weitere Marker Tumor Analkarzinom Bronchialkarzinom Pkleinzellig Pnicht-kleinzellig: – Adeno, großzellig – Plattenepithel-CA – Unbekannt Gallengangskarzinom Harnblasenkarzinom Hirntumor, Hirnmetastasen Hodentumoren Hypophysentumor PAdenome (davon ca. 23% endokrin-inaktive Tumoren) Phormon-sezernierende Karzinome Karzinoid geeignete Tumormarker, Metabolite SCC, CEA weitere Marker/Kommentar ProGRP, NSE, CYFRA 21-1, CEA TPA, M2-PK, ACTH, Calcitonin, PTHrP, CgA CYFRA 21-1, CEA CYFRA 21-1, SCC, CEA CYFRA 21-1, NSE, CEA, ProGRP CA 19-9, CEA CYFRA 21-1, NMP22, TPA CEA (Liquor u. Serum) AFP, ß-HCG, PLAP TPA, M2-PK, CA 125 M2-PK Prolaktin (50%), HGH (ca. 22%), ACTH (ca. 5%), TSH (0.4 – 1%), LH u. FSH (ca. 0.3%) meist ACTH, HGH, Prolaktin 5-HIES, Serotonin im Urin, CgA im Serum (bei 80% der Karzinoide) CA 125, AFP CEA, PTHrP NSE, S 100 (Liquor u. Serum) AFP u. ß-hCG immer parallel bestimmen! (siehe auch unter Keimzelltumoren) Ggf. Bestimmung der Zielhormone IGF-I, Cortisol, fT3, fT4, Östradiol, Testosteron und Durchführung von Stimulationstesten (siehe Kapitel M „Funktionstests“) NSE im Serum ist bei 39% der gastrointestinalen Karzinoide erhöht, NSE im Serum (> 12.5 µg/l/) bei 34% der APUDOMen 457 I. Tumormarker Tumor Keimzelltumoren PSeminome (ca 50%) PNichtseminome weitere Marker/Kommentar PLAP, M2-PK, NSE NSE insbesondere beim metastasierenden Seminom (68-73%); ß-hCG (nur ca. 10-22%), (ca. 50%) – Embryonales Karzinom (40%) –P olyembryom (30%) –D ottersacktumoren (5%) – Trophoplastische Tumoren (Chorion-CA, tropho­ blast. Plazenta-TU) – Malignes Teratom – Mischformen Knochentumor (Sarkom, Metastasen) Kolon-Rektumkarzinom Leberzellkarzinom Phepatozelluläres Karzinom Pcholangiozelluläres-/ Adenokarzinom PLebermetastasen 458 geeignete Tumormarker, Metabolite ß-hCG, AFP AFP ß-hCG, AFP ß-hCG, AFP ß-hCG, AFP ß-hCG, AFP ß-hCG, AFP Knochenspezifische alk. Phosphatase bzw. Ostase, Osteocalcin im Serum (Desoxy-)Pyridinoline im Urin CEA, CA 19-9 Empfehlung immer parallele Bestimmung von ß-hCG und AFP! CEA, TPA, PTHrP (prognostischer Faktor für Knochenmetastasen beim Mamma- u. Bronchialkarzinom) TPA, M2-PK im Stuhl, ggf. CA 50 (bei Lewis-a/b-negativen Pat.), evt. CA 72-4, CA 125, AFP AFP, CEA CA 125, ggf. Erythropoetin CA 19-9, CEA CA 15-3 CEA u. Tumormarker 1. Wahl des Primärtumors I . T u mo r m a r k e r Tumor Lymphoproliferative Erkrankungen PAML, CML, CLL geeignete Tumormarker, Metabolite weitere Marker/Kommentar ß2-Mikroglobulin, Thymidinkinase, Neopterin Immunphänotypisierung PHogkin- ß2-Mikroglobulin, Thymidinkinase, Neopterin Immunphänotypisierung PMultiples Myelom/ Plasmozytom Magenkarzinom Paraproteine im Serum u. Urin, freie Leichtketten im Serum, ß2-Mikroglobulin, Thymidinkinase CA 72-4, CA 19-9, CEA Malignome Kopf-Hals-Bereich Mammakarzinom SCC, CEA Malignes Melanom Nebennierenrindentumor PNNR-Karzinom S 100 Cortisol, DHEAS, Aldosteron zusätzlich Vorstufen 17-OH-Progesteron, Androstendion, Desoxycorticosteron ggf. Renin ggf. Renin, freies Cortisol im Urin, Östradiol, Testosteron (bei entsprechender Klinik) PAndrogen/Östrogen Östradiol, Testosteron ggf. Cortisol (z.T. Kosekretion) u. Non-Hodgkin-Lymphome produzierender NNR-Tumor Nebenschilddrüsenkarzinom CA 15-3, CEA, TPA ggf. CA 50 (bei Lewis-a/b-negativen Pat.), M2-PK, evt. AFP, CA 125, CA 15-3 Bei HNO-Tumoren ggf. CYFRA 21.1 CA 549 (kein Vorteil gegenüber CA 15-3), ggf. CA 125, HER-2/neu-Protin, PTHrP PTH 459 I. Tumormarker Tumor Neuroblastom Neuroendokrine Tumoren APUDome PKarzinoide PGastrinom PInsulinom PGlukagonom PVIPom Nierenkarzinom Ösophaguskarzinom Ovarialkarzinom Pepithelial Pmuzinös Pankreaskarzinom Phäochromozytom Prostatakarzinom Schilddrüsenkarzinom Pmedullär (C-Zell-) Ppapillär, follikulär Uteruskarzinom PAdeno-CA (Endometrium) PZervix –CA (Plattenepithel) PChorion-CA/Blasenmole 460 geeignete Tumormarker, Metabolite weitere Marker/Kommentar Vanillinmandelsäure, Homovanillinsäure, Dopamin, Noradrenalin im Urin, (Nor-)Metanephrin im Plasma, NSE u.CgA im Serum NSE u. 5-HIES haben eine bessere Spezifität und CgA eine höhere Sensitiviät u. geringere Spezifität 5-HIES, Serotonin im Urin, CgA im Serum NSE im Serum Gastrin, NSE, CgA Insulin, C-Peptid, NSE Glukagon VIP, NSE CEA, M2-PK, TPA NSE, PTHrP, Erythropoetin CEA, SCC CA 72-4 (Adenokarzinom) CA 125, CA 72-4, CA 15-3 CA 72-4, CA 125, CA 19-9 CA 19-9, CEA, M2-PK Katecholamine u. (Nor-) Metanephrine im Urin sowie ggf. im Plasma Vanillinmandelsäure Homovanillinsäure, CgA Gesamt-PSA, freies PSA, PSA-Ratio CA 19-9, CEA, TPA CA 15-3, CEA, TPA CA 125, CA 50 (bei Lewis-a/b-negativen Pat.) NSE Calcitonin, CEA NSE, ggf. Pentagastrin-Test (siehe Kapitel M „Funktionstests“) CEA, TPA, ggf. Thyreoglobulin nach TSHStimulation (siehe alphabet. Teil) Thyreoglobulin (nur nach vollständiger SD-Ablatio) CA 125, CEA SCC, CEA ß-hCG PAP TPA, CA 19-9 J . A u t o a n t ikö r p e r 1. Indikationen für Autoantikörperbestimmungen (modifiziert nach L. Thomas, Labor und Diagnose, 7. Aufl. 2008) Krankheits­ gruppe Diagnose Nachweishäufigkeit > 50 % (> 90%) Nachweishäufigkeit 30-50 % Nachweishäufigkeit 10-30 % Kollagenosen Systemischer Lupus erythematodes ANA, dsDNS, SS-A/Ro, Nukleosomen ANA, Histone, ANCA, MPO-ANCA ANA, SS-A/Ro ANA, SS-A/Ro Sm, Histon-Ak Ribosomen Medikamenten-induzierter LE Neonataler Lupus erythematodes Subakuter kutaner Lupus erythematodes Sharp-Syndrom, MCTD, Mischkollagenose Systemische Sklerose/Sklerodermie CREST-Syndrom Polymyositis Sklerodermie/PolymyositisÜberlappungssyndrom Dermatomyositis Dermatomyositis/Polymyositis Rheumatoide Arthritis (adult) Primäres Sjögren-Syndrom Systemische Vaskulitis Wegenersche Granulomatose Mikroskopische Polyarteriitis ANA, U1-snRNP ANA Histone SS-B/La SS-B/La, Cardiolipin, Lupusantikoagulanz SS-A/Ro Diffuse Form: Scl-70 (=Topoisomerase-I) CENP (Zentromer), ANA ANA Jo-1 ANA ANA ANA RF, CCP ANA, SS-A/Ro, SS-B/La, RF c-ANCA/Proteinase 3 p-ANCA/Myeloperoxidase Jo-1, Mi-2 Jo-1 ANA, RA33 c-ANCA/Proteinase 3 SS-B/La RNA-Polymerase I, II, III CENP A-F (=Zentromer) M2 PM-Scl-100, Mi-2 PM-Scl-100, Ku Mi-2 Histon Ku ANA ANA 461 J. Autoantikörper Krankheits­ gruppe Diagnose Nachweishäufigkeit > 50 % (> 90%) Muskel­ erkrankungen Myasthenia gravis AchRA Lambert-Eaton-Myasthenie Calciumkanal P/Q, J-Conotoxin MVIIC Inflammatorisch idiopathische Myopathie Gastrointes­ tinale Erkrankun­gen Chron.-atrophische Gastritis Zoeliakie Leber­ erkrankungen Morbus Crohn Colitis ulcerosa Autoimmune Hepatitis Primär biliäre Zirrhose Primär sklerosierende Cholangitis 462 Gewebs-Transglutaminase, Gliadin, EMA ASCA p-ANCA Typ I: SMA, ASGPR, ANCA, Actin Typ I: LKM1 AMA (M2) p-ANCA Nachweishäufigkeit 30-50 % Nachweishäufigkeit 10-30 % Calciumkanal N Ryanodin-Rezeptor, Titin, Rezeptor-Tyrosin­ kinase, Kaliumkanal, Skelettmuskel Calciumkanal L Zytoplasmatische Aminoacyl-tRNASynthetasen: Jo-1, PL-7, PL-12, EJ, OJ PCA/(Parietalzellen) H+/K+-ATPase Intrinsic Faktor Mi-2, SRP ANA SLA/LP LC1 (Lebercytosol-Ag1) ANA SMA, ANA J . A u t o a n t ikö r p e r Krankheits­ gruppe Diagnose Nachweishäufigkeit > 50 % (> 90%) Nachweishäufigkeit 30-50 % Endokrino­ pathie Diabetes mellitus Typ I (Neuerkrankung) Hypothyreote Autoimmunthyreoiditis ICA, GADA IAA, IA-2 TPO (Thyreoidea-Peroxidase-) Ak (=MAK) Thyreoglobulin-Ak (TAK) TPO (Thyreoidea-Peroxidase-) Ak (=MAK) Struma/ Hypothyreose Schilddrüsenhyperplasie (M.Basedow) Neuropathien TRAK (TSH-Rezeptor-Ak) TPO (Thyreoidea-Peroxidase-) Ak (=MAK) Guillain-Barré-Syndrom Miller-Fisher-Syndrom Akute multifokale motorische Neuropathie (MMN) Stiff-Person-Syndrom Nachweishäufigkeit 10-30 % Thyreoglobulin-Ak (=TAK) GM1 GD1a, GalNAc-GD1a, Asialo-GM1 GQ1b GM1 GADA Amphiphysin 1 und 2, IA-2, SMA, ANA 463 J. Autoantikörper 2. Differentialdiagnose systemischer entzündlich-rheumatischer Erkrankungen Basisparameter P Blutsenkung (BSG) P c-reaktives Protein (CRP) P Ak gegen cyclisches citrulliniertes Peptid (CCP) P Blutstatus P Harnsäure P Antistreptolysintiter (ASL) RF (IgM) CCP-Ak HLA-Typ Rheumatoide Arthritis +++ +++ Reaktive Arthritis Morbus Reiter Morbus Bechterew Systemischer Lupus erythematodes (SLE) – – – (+) Medikamenten­ induzierter Lupus erythematodes (+) DRB1*0101 DRB1*0401 DRB1*0404 B 27 B 27 B 27 B8 DR2(DRB1*1501) -DR3 DRB1*1501 DR3 DQ2 – DR4 464 (+) Erweiterte Diagnostik P Eiweißelektrophorese P Urinstatus/Rheumafaktor (RF) P Punktatanalyse P Komplementfaktoren (CH50 etc.) P weitere Akute Phase Proteine (Ferritin, Haptoglobin, Fibrinogen) P Eisen, Kupfer P Alkalische Phosphatase (AP), Calcium, Phosphat P Antistaphylolysin (AST), Antistreptokokken-DNase B Immun­ komplexe Kryoglo­buline AntiStrepto­ kokkenAk Infektions­ serologie ANA (Antinukleäre Ak) Weitere spez. Antikörper: (+) – – + Histon, RA33 – – – + (+) – – – – – + +/– – falsch pos. Lues­reaktion – – – – +++ – – – dsDNS, Sm, Histon, SS-A/Ro, Ribosomen, Nukleosomen +++ Histon, MPO-ANCA J . A u t o a n t ikö r p e r RF (IgM) Systemische Sklerose Sklerodermie/ (+) CREST-Syndrom MCTD/Sharp-Syndrom + Dermatomyositis Polymositis Dermatomyositis Polymyositis Rheumatisches Fieber Sjögren-Syndrom Idiopathische entzündliche Myositis – +++ – CCP-Ak HLA-Typ B8 DR3 DR5 DR1 DR5 DR4 DR11 DR8 DR3 DR4 Immun­ komplexe Kryoglo­buline (+) AntiStrepto­ kokkenAk Infektions­ serologie ANA (Antinukleäre Ak) – – +++ +++ (+) – – +++ DR3 ++ ++ DR3 ++ – DR2/3 B8 (Frauen) – (+) (+) ++ – – ++ – – – – Weitere spez. Antikörper: Scl-70/Topo-I (pulmonale Form), CENP A-F (akrale Form, ACA), RNAP-I–III CENP, M2 SnRNP/U1-RNP SS-A/Ro, SS-B/La Mi-2, Jo-1 PM-Scl-100 Mi-2, Jo-1 Jo-1, Mi-2 – SS-A/Ro, SSB/La, Ku Amino­ acyl-tRNASynthetase, Mi-2, SRP weitere Autoantikörper mit geringerer Nachweishäufigkeit siehe Kapitel K1. 465 J. Autoantikörper 3. Charakteristische Autoantikörper bei Erkrankungen bestimmter Organsysteme Organsystem Herzmuskel Lunge Haut Erkrankung Neonataler Herzblock Postmyokardinfakt-/Kardiotomie(Dressler-) Syndrom Häufig Antikörper gegen SS-A/Ro, SS-B/La Lungenhämorrhagien Pulmorenales Syndrom Goodpasture Syndrom Interstitielle Pneumonie Alveolitis Lungenfibrose Alveolen-Basalmembran Glomerulus-Basalmembran ANCA Histidyl-tRNA-Synthetase (Jo-1) Aminoacyl-tRNA-Synthetasen Topoisomerase I (Scl-70) Angioneurotisches Ödem II Bullöse Dermatosen Medikamenteninduziert Paraneoplastisch C1-Esterase-Inhibitor Epidermale Basalmembran BPAG1 und 2 (Kollagen XII) Desmoplakin I/II Descollin I/II Laminin 5 Epidermale Basalmembran BPAG1 und 2 Transglutaminase-(IgA) Gliadin-(IgA) Bullöses Pemphigoid und Herpes gestationis Dermatitis herpetiformis Duhring Epidermolysis bullosa Pemphigus foliaceus Pemphigus herpetiformis 466 Seltener Antikörper gegen Herzmuskel Epidermale Basalmembran Kollagen VII Stachelzelldesmosomen Desmoglein I Desmoplakin I/II Desmoglein 1 und 3 ANA Zentromer Retikulin J . A u t o a n t ikö r p e r Organsystem Haut (Fortsetzung) Erkrankung Pemphigus, paraneoplastisch Pemphigus vulgaris Schleimhautpemphigoid Urticaria - Vasculitis, hypokomplementämische Häufig Antikörper gegen Desmoplakin I/II, Desmocollin I/II, BPAG 1, Desmoglein 1 und 3 Stachelzelldesmosomen Desmoglein 3 Epidermale Bassalmembran BPAG 1 und 2 C1q Schilddrüse Inplausible T3-/T4-Werte Nebennieren Morbus Addison Steroid-21-Hydroxylase Nebennierenrinde Steroid-17-Hydroxylase Side-chain-cleavage-enzyme Niere und Harnwege Rapid progressive Glomerulonephritis Glomerulus-Basalmembran ANCA ANA Glomerulus Basalmembran C3-Nephritis-Faktor Goodpasture Syndrom Glomerulonephritis, membranoproliferative Nephritis Seltener Antikörper gegen T3/T4 H+/K+-ATPase Steroidhormon-Zellen Thyreoglobulin Tubulus-Basalmembran 467 K . S c h i l dd r ü s e n di a g n o s t ik Diagnose fT3 fT4 TSH basal Euthyreote Struma n n n Subklinische Hypothyreose n n Hypothyreose ⇓/n ⇓ Hypothalamisch-hypophysäre Hypothyreose Autoimmunthyreoiditis (Hashimoto) Subakute Thyreoiditis (lymphozytär) ⇓/n ⇓ (⇑) 4-10 µIU/ml ⇑ > 10 (20) µIU/ml ⇓ n/⇓ n/⇓ ⇑ n/⇑ n/⇑ (⇓) ⇑/(n) ⇑/n ⇓/(⇓) < 0.1 – 0.5 µIU/ml Non-thyroidal-illness (NTI), Low-T3-Syndrom Subklinische Hyperthyreose ⇓ n/⇓ n n Hyperthyreose (M. Basedow) Autonomie (uni-/noduläre Struma) ⇑ ⇑ ⇑ n Subakute Thyreoiditis TSH n. TRH n Klinische Schild­drüsen­funktion n ⇑ n/⇓ ⇑ ⇓ ⇓ ⇓ ⇑ n/⇓ n/⇓ (⇓) n/⇑ milde Hyperthyreose für wenige Monate ⇑/n 1-6 Monate Hyperthyreose, vorübergehend (2-8 Mo.) Hypothyreose, dann Euthyreose n(?) (⇓) < 0.4 µIU/ml ⇓ < 0.1 µIU/ml (⇓) < 0.4 µIU/ml ⇓ n/⇑ ⇓ ⇑ ⇓ n/(⇑) Autoantikörper­diagnostik MAK(TPO-Ak) 10-15% MAK (TPO-Ak.) 50-80% , TAK 10-20% MAK (TPO-Ak.) 80%, TAK 10-20% MAK (TPO-Ak.) > 90%, TAK 60-80%,TRAK 15-33% MAK (TPO-Ak) u. TAK ca. 60% (eher niedrig) TRAK 85-95%, TAK 12-30% MAK (TPO-Ak) 45-80% 469 K. Schilddrüsendiagnostik Diagnose fT3 fT4 TSH basal ⇑ ⇑ (⇑)/⇑ ⇑ ⇑ n/⇑ 1 – 20 µIU/ml ⇓/n/⇑ n/⇓ n/⇓ ⇑/n(⇓) Jod-Mangel n/(⇑) ⇓ Jodhaltige Kontrastmittel Gravidität: 1. Trimenon 2. u. 3. Trimenon Hyperemesis gravidarum (⇓) ⇑ n/(⇓) ⇑ n/(⇑) n/⇓ ⇑/(n) ⇑ ⇑ n bzw.⇑ versus adult ⇓/(⇓) < 0.1 – 0.5 µIU/ml n/(⇑) /⇑ 6 – 150 µIU/ml n n/(⇓) n/(⇑) (⇓) 0.2 – 0.5 µIU/ml (⇓) 0.1 – 0.4 µIU/ml n/⇑ <15- 20 µIU/ml (< 30 Tage) (⇓) 0.1 – 0.5 µIU/ml (⇑)/⇑ 5 – 30 µIU/ml TSH-produzierendes Adenom Schilddrüsenhormonresistenz (hypophysär, peripher, generalisiert) Thyreotoxikose Blasenmole Neugeborene ⇑ Glukokortikoide (hochdosiert) ⇓ n bzw. ⇑ versus adult n NNR-Insuffizienz n/⇓ n 470 TSH n. TRH (⇓) ⇑ Klinische Schild­drüsen­funktion ⇑ n/⇓ n n/(⇑) n/(⇓) n/(⇑) ⇑ Innerhalb der ersten 24 h abrupter TSH–Anstieg durch Kältereiz, dann Abfall. n n Autoantikörper­diagnostik K . S c h i l dd r ü s e n di a g n o s t ik Diagnose Akute Psychose, Depression Psychiatrische Erkrankung fT3 fT4 TSH basal n/ (⇑ od. ⇓) n/(⇑) n/⇓ n (⇓)/n/(⇑) 0.4 – 10 µIU/ml (⇓)/n/(⇑) 0.4 – 10 µIU/ml TSH n. TRH Klinische Schild­drüsen­funktion n Autoantikörper­diagnostik n * Quelle: in Anlehnung an Williams Textbook of Endokrinology 10th Ed. 2002; L. Thomas, „Labor und Diagnose“, 7. Auflage, 2008 TRAK MAK TAK - - - Autoantikörper gegen TSH-Rezeptor Autoantikörper gegen Thyroidea-Mikrosomen bzw. Antikörper gegen Thyroidea-Peroxidase (TPO-Ak.) Autoantikörper gegen Thyreoglobulin 471 L. Gerinnungsuntersuchungen 1. Differentialdiagnose der Blutgerinnungsstörungen Quick aPTT TZ N Thrombozyten N (In-vitro)-Blutungszeit N N N N N N N Path. N N N Path. Path. / N N N N Path. Path. Path. Path. N N N Path. / N N N Path. / N N Path. N N N N Path. Path. N N N Path. Path. Path. N N Path. Path. Path. Path. Path. Interpretation VonWillebrand-Syndrom (vWS), FXIII-Mangel, milde angeborene Koagulopathie, Plasmininhibitormangel, Thrombophilien, Antiphospholipidsyndrom, milde Thrombozytenfunktionsstörung VonWillebrand-Syndrom; angeborene und erworbene Thrombozytenfunktionsstörung, (evtl. Faktor XIII-Mangel) Bernard Soulier Syndrom, vWS Typ 2B, HIT (Heparin-induzierte Thrombopenie) Heparineffekt, evtl. auch durch LMWH und Hirudin HIT, angeb. oder erworbenes vWS, Faktor XI–Mangel F VIII- od. IX-Mangel (Hämophilie A od. B), Einige Konduk­torinnen von Hämoph. A oder B, F XI-, XII-Mangel, Präkal­likrein-, HMWKMangel, vonWillebrandSyndrom, Heparinwirkung, Lupusantikoagulanz, andere erworbene Inhibitoren Vitamin K –Mangel, Cumarintherapie, Leberzellschaden, Normalbefund bei Neugeborenen, isolierter F VII-Mangel bei Frauen mit Menorrhagie Erworbene Verminderung des Prothrombinkomplexes (Faktor II, VII, IX und X), isolierte angeborene Verminderung von F II, V oder X, Vit. K-Mangel, Cumarintherapie, Leberzellschaden, noch Normalbefund bei Neugeborenen Heparinspiegel >1IE/ml Plasma, überlappende Heparin/ Cumarin­ therapie, Dys- und Hypofibrinogenämie (<0.6 g/l), Hyperfibrinolyse, Serum statt Plasma, Monoklonale Gammopathie (Thrombinin­ hibitor), physiologisch bei Neugeborenen Störung der Fibrinbildung u. Thrombozytenfunktion (z. B. disseminierte intravasale Koagulation) 473 L. Gerinnungsuntersuchungen 2. Thrombophilie Die Disposition zu venösen thromboembolischen Erkrankungen ist bei den genetischen Defekten unterschiedlich stark ausgeprägt und erhöht sich bei Kombinationsdefekten: Risikofaktor Heterozygote APC –Resistenz (Faktor V Leiden) Heterozygote Prothrombin-Mutation Heterozygoter Protein C-Defekt Heterozygoter Protein S-Defekt Heterozygoter Antithrombin-Defekt Heterozygote Faktor V Leiden und Prothrombinmutation (Compound –Defekt) Homozygote APC-Resistenz (Faktor V Leiden) Homozygote Prothrombin-Mutation Kombination heterozygoter Protein C- oder S-.Mangel und heterozygoter Faktor V Leiden Homozygoter Protein C-Mangel Homozygoter Protein S-Mangel Homozygoter Antithrombin-Mangel 474 Prävalenz Häufigkeit bei Thrombosepatienten (Erstereignis) 3 – 7 % 20 % Relatives Risiko (erhöhte Thrombose­ neigung verglichen mit Nichtbetroffenen) Ca. 7-fach 2 % 0.2 % 6 % 3 % Ca. 3-fach Ca. 7-fach unbekannt 1 – 2 % Ca. 6-fach 0.02 – 0.17 % - 1 % Ca. 10-fach - Ca. 10 – 50 fach 0.02 – 0.1 % 0.01 % - 2 % Ca. 80-fach Unbekannt - Ca. 50-fach > 50 fach - - - - Neonatale Purpura fulminans, Cerebrale Venenthrombose - - Bestimmte Formen sind nicht lebensfähig Thrombose-Risiko – Kategorie Gering – mäßig! Mäßig! Hoch! Extrem erhöht! L. Gerinnungsuntersuchungen Die funktionellen Gerinnungsteste unterliegen vielen in-vivo- und in-vitro- Einflüssen, so dass der Zeitpunkt der Blutabnahme und die Probenvorbereitung für die Diagnostik entscheidend sind: Risikofaktor APC-Resistenz Labortest Funktioneller Gerinnungstest/ Faktor V Leiden Molekulargene­ tischer Nachweis Prothrombin-Mutation Molekulargene­ tischer Nachweis Protein C - Mangel Funktioneller oder chromogener Test und Immunoassay Protein S - Mangel Funktioneller oder chromogener Test und Immunoassay AntithrombinFunktioneller oder Mangel chromogener Test und Immunoassay Persist. Faktor Funktioneller VIII-Erhöhung Gerinnungstest Homocystein Immunoassay Diagnosezeitpunkt Auch bei frischer Thrombose! Einmaliger Nachweis ausreichend! Auch bei frischer Thrombose! Einmaliger Nachweis ausreichend! Auch bei frischer Thrombose! Einmaliger Nachweis ausreichend! Leberfunktions­ 1 Monat nach Absetzen der störung Antikoagulation 1–2 maliger Nachweis Schwangerschaft, 1 Monat nach Absetzen der Pille Antikoagulation APC-Resistenz 2–3 maliger Nachweis Heparinisierung, 1 Monat nach Absetzen der Leberfunktions­ Antikoagulation störung 2–3 maliger Nachweis Schwangerschaft, 1 Monat nach Absetzen der Antikoagulation 2–3 maliger Nachweis Pille Hämolyse! Auch bei frischer Thrombose Lupusantikoagulanz Antikoagulation Cardiolipin - Ak ß2-Glykoprotein I-Ak D-Dimer Funktionelle Gerinnungstests Immunoassay Immunoassay LatexImmunoassay Test-Interferenz Bei frischer Thrombose, nach Gefäßverschluß zweimaliger Nachweis im Abstand von (6)–12 Wochen; Kontrolle 1 Monat nach Absetzen der Antikoagulation akute EntzünBei V.a.frische Thrombose sowie dungen, chronische ggf. im Verlauf zur Einschätzung Erkankungen, des Rezidivrisikos postoperativ Probenmaterial Tiefgefrorenes Citratplasma oder Frisches Citratblut EDTA-Blut EDTA-Blut Tiefgefrorenes Citratplasma oder Frisches Citratblut Tiefgefrorenes Citratplasma oder Frisches Citratblut Tiefgefrorenes Citratplasma oder Frisches Citratblut Tiefgefrorenes Citratplasma oder Frisches Citratblut EDTA-Plasma (Zentrifugation innerhalb 1h nach Blutentnahme) Frisches Citratblut oder tiefgefrorenes Citratplasma (doppelt zentrifugiert) und Serum Siehe Antiphospholipid­syndrom Tiefgefrorenes Citratplasma oder Frisches Citratblut 475 L. Gerinnungsuntersuchungen 3. Antiphospholipidsyndrom Das Antiphospholipidsyndrom ist vor allem assoziiert mit venösen Phlebothrombosen, habituellen Aborten und Thromboembo­lien cerebraler arterieller Gefäße mit unterschiedlicher neurologischer Symptomatik, insbesondere transitorisch ischämischen Attacken und cerebralem Insult. Hauptmerkmal sind die erhöht nachweisbaren CardiolipinAntikörper, die erstmals bei Patienten mit Systemischem Lupus erythematodes festgestellt wurden und zu falsch positiver Luesserologie sowie paradoxerweise in vitro verlängerter PTT führen. Diese Autoantikörper sind gegen negativ geladene Phospholipide gerichtet, insbesondere gegen ß2-Glykoprotein. Sie sind auch bei anderen autoimmunologischen Erkrankungen wie rheumatoider Arthritis, idiopathischer thrombozytopenischer Purpura, hämolytischen Anämien aber auch Infektionskrankheiten wie Scharlach, Mumps und Hepatitis etc. nachweisbar und können fluktuieren. Verschiedene Studienergebnisse belegen auch eine Korrelation zwischen Prothrombin-Antikörpern und rezidivierenden Aborten. Die Diagnose wird nach den revidierten Sapporo-Kriterien (Journal of Thrombosis and Haemostasis 4: 295 – 306, Sydney 2005) definiert durch die klinische Symptomatik einer Venösen (Phlebo-)Thrombose oder arterieller oder „small vessel“-Thromboembolie (bestätigt durch angiologische, dopplersonographische oder histologische Verfahren) mit vorwiegend cerebraler Symptomatik (mehrere TIA-Episoden, cerebralen Insult, unklaren fokalen neurologischen Störungen) P Schwangerschaftserkrankungen wie habituellen Aborten: ≥ 1 Abort in oder nach der 10. SSW, ≥ 1 Frühgeburt in oder vor der 34.SSW oder ≥ 3 konsekutive Aborte vor der 10. SSW. und pathologischen Laborbefunden wie P zweimalig P P erhöhte Anticardiolipin-Antikörper (IgG oder IgM) im Abstand von mindestens (6)–12 Wochen oder zweimalig erhöhte ß2-Glykoprotein I-Ak (IgG oder IgM) im Abstand von mindestens (6)–12 Wochen zweimalig positiver Lupusantikoagulanztest im Abstand von mindestens (6)–12 Wochen Lupusantikoagulanz-Diagnostik nach den „Guidelines of the International Society on Thrombosis and Hemostasis“ (Thromb Haemost 1995; 74; 1185-90) PVerlängerung eines phospholipidabhängigen Gerinnungstests (Durchführung von mindestens 2 Suchtesten) PNachweis der Inhibitoraktivität im Patientenplasma (keine Korrektur der verlängerten Gerinnungszeit im Plasmatauschversuch) Nachweis der Phospholipidabhängigkeit (Bestätigungsteste mit erhöhtem Phospholipidzusatz zur Korrektur der Gerinnungszeit) Ausschluß eines spezifischen Faktorenmangels oder –inhibitors P oder 476 Benötigtes Probenmaterial: tiefgefrorenes Citratplasma (doppelt zentrifugiert zur Plättchenreduktion < 10/nl) oder frisches Citratblut und Serum (funktionelle Gerinnungstests und Immunoassay), Bestimmung vor allem bei frischem arteriellem oder venösen Gefäßverschluß, Kontrolle nach ca. 6 Wochen. L. Gerinnungsuntersuchungen 4. VonWillebrand–Stufendiagnostik Suchtests (In vitro-) Blutungszeit (PFA) Basistests vWF:Ag (vWF-Antigen) APTT VWF:RCo (Ristocetin Cofaktor) Thrombozytenzahl Faktor VIII-Aktivität Spezialtests RIPA (Ristocetin-induzierte Plättchenaggregation) vWF : VIIIB (FVIII-Bindungsaktivität des vWF) VWF - Multimere VWF: CBA (Collagen-Bindungsaktivität) Klassifikation des vonWillebrand-Syndroms Typ1 Häufigkeit Klinischer Schweregrad Konzentration und Funktion des vWF VWF - Multimere Typ 2A 47% leicht TypM Typ 2N 51 % variabel Proportional ernie­ Funktion ausgeprägter drigt auf erniedrigt als Konzen­tra­ 20 – 50% des tion des vWF-Ag Normalbereiches normal Typ 2B Erhöhte Empfind­lichkeit bzgl. niedriger Ristocetin-Konz. Fehlen oder relative Verminderung der großen und/oder mittelgroßen Multimere Typ 3 < 1% schwer Gestörte Gestörte PlättchenFVIII-Binabhängige dung vWF-Funktion normale Multimere nicht nachweisbar nicht nachweisbar 477 M . F u n k t io n s t e s t s ACTH-Belastungstest (Kurztest) Indikation:a) Verdacht auf Nebennierenrindeninsuffizienz, DD: primäre oder sekundäre Nebennierenrindeninsuffizienz b) Verdacht auf nicht klassisches Adrenogenitales Syndrom (AGS) bzw. late-onset-AGS oder heterozygotes AGS (meist 21-Hydroxylase-Mangel, selten 3-ß-Dehydrogenase- oder 11-ß-Hydroxylase-Mangel oder sehr selten andere Steroid­biosynthesedefekte), DD: schwere Formen von Hirsutismus und Virilisierung Parameter:a) Cortisol (ggf. Aldosteron) im Serum, bei DD: primäre/sekundäre Nebennieren­rinden­insuffizienz ggf. ACTH im EDTA-Plasma (am besten EDTA-Blut zentrifugieren, Plasma abheben und einfrieren, vorher Kühlboxen beim Labor anfordern! Bitte Kunstoffröhrchen verwenden!)b) Cortisol, 17-Hydroxyprogesteron (ggf. Testosteron, DHEAS, 11-Desoxycortico­steron) im Serum. Durchführung :Erste Blutentnahme nüchtern, dann Gabe von 250 µg ACTH (1 Amp. Synacthen) i.v. (Säuglinge bis zu 12 Monaten erhalten 125 µg ACTH) und anschließende Blutentnahme 60 Minuten nach der Injektion. Bei Frauen am besten in der frühen Follikelphase (3.-6. Zyklustag) morgens zw. 8.00 und 10.00 Uhr, Ovulationshemmer sind vorher abzusetzen. Kontraindikation: Addison-Krise, Vorbehandlung mit ACTH oder Sensibilisierung gegen ACTH (z.B. bei BNS-Anfällen unter ACTH-Therapie). Nebenwirkungen: Hungergefühl. Beurteilung:a) Bei einem Anstieg des Cortisols über 20 µg/dl (550 nmol/l) ist eine Nebennieren­rindeninsuffizienz mit hin­ reichender Sicherheit ausgeschlossen, wobei die maximal erreichte Plasmakonzentration und nicht der relative Anstieg entscheidend ist. Bei ungenügendem Anstieg von Cortisol und niedrigen ACTH-Spiegeln liegt eine ­sekundäre oder tertiäre Nebennierenrindeninsuffizienz bzw. eine Störung der Hypothalamus-HypophysenNNR-Achse vor und eine weitere Diagnostik (z.B. CRH-Test, Insulinhypoglykämie-Test, Metopiron-Test) sollte durchgeführt werden. Bei einer primären Nebennierenrindeninsuffizienz ist Cortisol basal erniedrigt oder niedrignormal, ACTH basal erhöht und es erfolgt kein Anstieg von Cortisol nach ACTH-Gabe. Als zusätzliches diagnostisches Kriterium kann Aldosteron untersucht werden, da im Falle einer primären Nebennierenrindeninsuffizienz auch der Anstieg der Aldosteron-Konzentation ausbleibt (ggf. Bestimmung NNR-Auto-Antikörper). Hingegen sich ein ausreichender Anstieg von Aldosteron um mind. 50 ng/l (133 pmol/l) bei der sekundären Nebennierenrinden­ insuffizienz zeigt, da das Renin-Angiotensin-System erhalten ist. b) 21-Hydroxylase-Mangel: Bei der klassischen Form des AGS ist 17-Hydroxyprogesteron basal meist > 10 µg/l ( z.T. > 100 µg/l). Im Fall des nicht klassischen AGS bzw. beim late-onset-AGS sind die 17-Hydroxyprogesteronwerte basal leicht bis deutlich erhöht sowie nach ACTH-Gabe > 10 µg/l (6 –12% der erwachsenen Frauen mit Hirsutismus). Bei den heterozygoten Formen des AGS liegen die 17-Hydroxyprogesteronwerte basal meist im Normbereich und der Anstieg des 17-Hydroxyprogesterons ist nach ACTH-Gabe > 2.6 µg/l (2.6 ng/ml) bzw. erfolgt um das 3-fache und mehr. 479 M. Funktionstests Der Quotient aus 17-Hydroxyprogesteron und 11- Desoxycorticosteron liegt bei den heterozygoten Formen im Erwachsenenalter nach Stimulation mit ACTH > 12. 3-ß-Hydroxysteroid-Dehydrogenase-Mangel: Basale Erhöhung von 17-alpha-Hydroxypregnenolon und überschießender Anstieg des Wertes nach ACTH-Gabe sowie moderater Anstieg des 17-Hydroxyprogesteronwertes und Anstieg von DHEAS, wobei die basalen DHEAS-Werte ebenfalls erhöht sind. 11-ß-Hydroxylase-Mangel: Erhöhung von 11-Desoxycorticosteron und 11-Desoxycortisol sowie nach ACTH-Gabe Anstieg der Parameter. Aldosteron-Suppressionstest (Kochsalzbelastungstest) Indikation:DD: Hyperaldosteronismus, DD: Nachweis eines Aldosteron-produzierenden Nebennierenadenoms Parameter:Aldosteron im Serum, Renin (EDTA-Blut ungekühlt!), Natrium, Kalium Durchführung:Nach Bettruhe ab Mitternacht erste Blutentnahme nüchtern zwischen 7.00 und 9.00 Uhr, Gabe von 2000 ml 0.9%-ige NaCL-Lösung per infusionem über 4 Stunden, danach zweite Blutentnahme. Kontrolle von Blutdruck u. Puls stündlich bei guter linksventrikulärer Funktion, bei unklarer linksventrikulärer Funktion halbstündliche Kontrollen. Achtung: Vor dem Test Bestimmung von Natrium, Kalium, Kreatinin, kleines Blutbild, ggf. Echokardiographie zur Einschätzung der linksventrikulären Funktion sowie Ausgleich einer evtl. vorhandenen Hypokaliämie. Einhaltung einer Normalkost mit 100 – 150 mmol Natrium (3 – 4.5 g Kochsalz) pro die. Störende Medikamente z.B. Betablocker, Diuretika und ACE-Hemmer sollten, falls medizinisch vertretbar, mindestens 1-2 Wochen vorher abgesetzt werden. Spironolacton (u.a. kaliumsparende Diuretika) sowie Amilorid sollten bereits 6 Wochen vor dem Test abgesetzt werden. Hingegen Alpha-Blocker, Calciumkanalblocker und Vasodilatoren zur Blutdrucksenkung eingesetzt werden können. Störenden Einfluß haben auch Antiphlogistika (z.B. Aspirin, Ibuprofen, Indomethacin), Aminoglykosid-Antibiotika, Antazida wie Carbenoxolon, Herzglykoside, Heparin, Kortikosteroide, Lakritze in größeren Mengen, Laxantien, Lithium und Ovulationshemmer, weshalb ein Absetzen der Präparate ca. 1 Woche vorher sinnvoll ist. Bei Frauen empfiehlt sich eine Durchführung des Testes in der ersten Zyklushälfte. Kontraindikation: schwere Hypertonie, Herzinsuffizien, Hypervolämie, entgleister arterieller Hypertonus Beurteilung:Normal ist ein Abfall der Aldosteronkonzentration auf ca. < 50 % der Basalwerte bei einem im Normbereich liegenden basalen Wert. Im Fall eines sekundären Hyperaldosteronismus (z.B. renovaskuläre Hypertonie bzw. bei Natriumretention) erfolgt bei basal erhöhten Werten von Aldosteron und Renin ebenfalls ein deutlicher Abfall der Aldosteronkonzentration sowie eine Normalisierung des Reninwertes. Bei Vorliegen eines Aldosteron produzierenden Nebennierenadenoms (Conn-Syndrom) bleibt dieser Abfall aus bzw. bleibt die Aldosteronkonzentration erhöht bei niedrigen oder niedrig-normalen Reninwerten. Liegen die Aldosteronkonzentration nach der Belastung > 100 ng/l spricht dies für einen primären Hyperaldosteronismus. Bei Aldosteronkonzentration < 50 ng/l nach Bela480 M . F u n k t io n s t e s t s stung kann hingegen ein primärer Hyperaldosteronismus mit hoher Wahrscheinlichkeit ausgeschlossen werden. Im Graubereich bei Aldosteronkonzentration nach Belastung (> 50 – 99 ng/l) ist eine weitere Diagnostik erforderlich. Bei erniedrigten basalen Reninwerten ist der Test nicht sinnvoll. Aldosteron-Orthostase-Test Indikation:DD: Hyperaldosteronismus, DD: Nebennierenhyperplasie/Aldosteron-produzierendes Nebennierenadenom Parameter:Aldosteron im Serum, Renin im EDTA-Blut (ungekühlt!), fakultativ 18-Hydroxycorticosteron (18-OHB) im Serum Durchführung:Ab Mitternacht Bettruhe und erste Blutentnahme um 8.00 Uhr zur Bestimmung von Aldosteron, Renin und fakultativ 18-Hydroxycorticosteron. Danach sollte der Patient 2 - 4 Stunden herumlaufen oder stehen (Orthostase), anschließend erfolgt eine zweite Blutentnahme im Sitzen. Achtung: Einhaltung einer Normalkost mit 100 – 150 mmol Natrium (3 – 4.5 g Kochsalz) pro die. Störende Medikamente z.B. Betablocker, Diuretika, ACE-Hemmer, Renin-Inhibitoren und AT-Antagonisten sollten, falls medizinisch vertretbar, mindestens 1-2 Wochen vorher abgesetzt werden. Bei Spironolacton, Eplerenon und Drospirenon ist eine Pause von > 2 – 4 Wochen nötig. Störenden Einfluß haben auch Antiphlogistika (z.B. Aspirin, Ibuprofen, Indomethacin), Aminoglykosid-Antibiotika, Antazida wie Carbenoxolon, Herzglykoside, Heparin, Kortikosteroide, Lakritze in größeren Mengen, Laxantien, Lithium und Ovulationshemmer, weshalb ein Absetzen der Präparate ca. 1 Woche vorher sinnvoll ist. Bei Frauen empfiehlt sich eine Durchführung des Testes in der ersten Zyklushälfte. Beurteilung:Beim Gesunden Anstieg von Renin und Aldosteron auf ca. 150 – 310 % des Basalwertes nach Bettruhe, 18- Hydroxycorticosteron steigt ebenfalls an (ca. 50 – 200 %). Renin ist bei allen Formen des primären Hyperaldosteronismus supprimiert und steigt durch die Orthostase nur leicht oder gar nicht an. Beim idiopathischen Hyperaldosteronismus (Nebennierenhyperplasie ) sind Aldosteron und 18-Hydroxycorticosteron basal hochnormal oder leicht erhöht und zeigen nach Orthostase einen deutlichen Anstieg, wobei Aldosteron um etwa ein Drittel ansteigt und der maximale 18-0HB-Wert noch unter 1000 ng/l liegen sollte. Beim Aldosteron produzierenden Nebennierenadenom (Conn-Syndrom) sind Aldosteron und 18-Hydroxycorticosteron basal bereits z.T. deutlich erhöht und fallen nach Orthostase ab oder bleiben unverändert hoch, wobei der 18-OHB-Wert größer als 1000 ng/l ist. Eine hohe Spezifität für ein Adenom besteht bei einem Abfall des Aldosteronwertes > 100 ng/l. Im Falle einer makronodulären Nebennierenhyperplasie mit Hypoaldosteronismus sowie bei dem glukokortikoid-supprimierbaren Hyperaldosteronismus verhalten sich Aldosteron und 18-Hydroxycorticosteron ähnlich wie beim Aldosteron produzierenden Nebennierenadenom (Conn-Syndrom). Beim sekundären Hypoaldosteronismus (z.B. Glukokortokoid supprimierbarer Aldosteronismus, apparenter Mineralokortikoidexzess, Liddle-Syndrom, adrenogenitales Syndrom etc.) sind Renin und Aldosteron basal gering erniedrigt oder niedrig normal und steigen nach Orthostase nicht oder subnormal an. 481 M. Funktionstests Arginin-Cl-Test (Wachstumshormon-Stimulationstest) Indikation:V.a. Wachstumshormonmangel (z.B. Hypophyseninsuffizienz) bzw. Minderwuchs bei Kindern Parameter:Human-growth-hormon (HGH) bzw. Somatotropes Hormon (STH) im Serum Durchführung:Erste Blutentnahme nüchtern, dann Gabe von Arginin-Hydrochlorid-Lösung (0.5 g/kg Körpergewicht, Maximaldosis 30g) 1:10 verdünnt mit physiologischer Kochsalzlösung ca. 30 min. über einen Verweilkatheter als Infusion. Blutentnahmen – 30, 0, 30, 45, 60, 90 und 120 min. nach Beginn der Infusion. Kontraindikation: Schwere Leber- und Nierenerkrankungen und/oder Azidose Nebenwirkungen: Späthypoglykämie (vor allem b. dystrophen Kindern, unterernährten Erwachsenen), Verstärkung einer Azidose, selten Erbrechen Beurteilung:Normal ist eine HGH-Konzentrationen 30- 60 min. nach Infusion > 10 ng/ml. Sind die Werte nach Infusion < 5 ng/ ml liegt ein schwerer HGH-Mangel vor. Liegen die HGH-Werte im Bereich 5 – 10 ng/ml so kann ein partieller HGHMangel bestehen. Calcitonin-Stimulationstest bzw. Pentagastrin-Stimulationstest Indikation:V.a. medulläres Schilddrüsenkarzinom sowie zur Nachsorge und Verlaufskontrolle (nicht mehr zum Familien-Screening bei V.a. MEN-2 (Multiple endokrine Neoplasie Typ 2) oder beim familiären medullären Schilddrüsenkarzinom!) Parameter:Calcitonin im Serum (Probe gerinnen lassen und innerhalb von 30 min. zentrifugieren, Serum abheben und tiefgefroren einsenden, Kühlboxen vorher anfordern!) Durchführung:Erste Blutentnahme nüchtern, Gabe von 0.5 µg Pentagastrin/kg Körpergewicht i.v., weitere Blutentnahmen nach 2 und 5 min. (Pentagastrin ist derzeit nur über die internationale Apotheke erhältlich.). Beurteilung:Der Referenzbereich für die basalen Werte ist bei Frauen < 5 ng/l (pg/ml), für Männer < 8,4 ng/l (pg/ml) sowie für Calcitonin nach Stimulation mit Pentagastrin nach 2 min für Frauen < 26,2 ng/l (pg/ml) und für Männer < 37,8 ng/l (pg/ml) entsprechend der 95% Perzentile (Calcitonin-Assay, Immulite 2000, Fa. Siemens, siehe Doyle et. al „Potency and Tolerance of Calcitonin Stimulation with High Dose Calcium Versus Pentagastrin in Normal Adults, J Clin Endocrinol Metab, Aug 2009, 94 (8):2970-2974). Patienten mit medullärem Schilddrüsenkarzinom zeigen nach Pentagastrin-Gabe einen stärkeren Calcitonin-Anstieg als Normalpersonen, wobei die Endkonzentrationen meist > 100 ng/l (pg/ml) liegen. Bei basalen Werten von >100 ng/l (pg/ml) besteht auch ohne Stimulation der Verdacht auf ein medulläres Schilddrüsenkarzinom. Bei klinisch manifesten medullärem Schilddrüsenkarzinom sind die CalcitoninWerte oft 10 – 10000fach erhöht. Postoperativ normale basale Calcitoninwerte, welche sich nicht durch Pentagastrin stimulieren lassen, sprechen für eine Heilung des Patienten. Erneut erhöhte Calcitoninwerte bzw. erneute Stimulierbarkeit von Calcitonin bei den (jährlichen) Verlaufskontrollen sprechen für ein Rezidiv bzw. eine Metastasierung. 482 M . F u n k t io n s t e s t s Beim Familien-Screening bei V.a. MEN-2 oder beim familiären medullären Schilddrüsenkarzinom wird heute anstatt des Calcitonin-Testes eine molekular­genetische Untersuchung auf Mutation im RET-Protoonkogen (Sensitivität von 98 %) empfohlen. Diese molekulargenetische Untersuchung sollte auch bei Vorliegen eines Phäochromozytoms ohne Neurofibromatose I oder von Hippel-Lindau-Erkrankung durchgeführt werden (50 % der MEN 2-Patienten entwickeln ein Phäochromozytom). Captopril-Stimulationstest Indikation:DD: Hyperaldosteronismus, DD: Aldosteron-produzierendes Nebennierenadenom (Conn-Syndrom)/sekundärer Hyperaldosteronismus, V.a. Nierenarterienstenose Parameter:Aldosteron im Serum, Renin im EDTA-Blut (ungekühlt!) Durchführung:Ab Mitternacht Bettruhe und erste Blutentnahme nüchtern zwischen 7.00 und 9.00 Uhr in liegender Körperhaltung, bei ambulanter Durchführung nach mind. 90 min. Ruhepause, Gabe von 25 mg Captopril (z.B. Lopirin) oral, zweite Blutentnahme zur Aldosteron- und Reninbestimmung nach 120 min. in liegender Haltung (regelmäßige Blutdruckkontrolle ca. alle 15 min). Achtung: Einhaltung einer Normalkost mit 100 – 150 mmol Natrium (3 – 4.5 g Kochsalz) pro die. Störende Medikamente z.B. Beta-Blocker, Diuretika, ACE-Hemmer, Spironolacton (u.a. kaliumsparende Diuretika) sollten, falls medizinisch vertretbar, mindestens 2 Wochen vorher abgesetzt werden. Störenden Einfluß haben auch andere Antihypertensiva (z.B. Calciumantagonisten, Clonidin etc.), Beta-Blocker (z.B. Atenolol, Carvedilol, Propanolol etc.), Antiphlogistika (z.B. Aspirin, Ibuprofen, Indomethacin), Aminoglykosid-Antibiotika, Antazida wie Carbenoxolon, Herzglykoside, Heparin, Kortikosteroide, Lakritze in größeren Mengen, Laxantien, Lithium und Ovulationshemmer, weshalb ein Absetzen der Präparate ca. 1 Woche vorher sinnvoll ist. Bei Frauen empfiehlt sich eine Durchführung des Testes in der ersten Zyklushälfte. Beurteilung:Beim Gesunden keine Änderung der Reninkonzentration und leichter Abfall der Aldosteronwerte auf Werte < 150 ng/l (400 pmol/l). Beim sekundären Hyperaldosteronismus fällt der Aldosteronspiegel ähnlich wie bei Gesunden deutlich ab. Im Falle eines Aldosteron-produzierendes Nebennierenadenoms (Conn-Syndrom) hingegen erfolgt kein Abfall oder nur ein subnormaler Abfall des Aldosterons (meist nicht unter 150 ng/l). Der Reninwert steigt bei der Nierenarterienstenose nach Captopril um das dreifache des Basalwertes bzw. auf mehr als 200 % des Ausgangswertes an. Bei der essentiellen Hypertonie zeigt sich ein normaler Aldosteronabfall und kein deutlicher Anstieg der Reninkonzentration (< 150 %). Anmerkung: Die Wertigkeit dieses Testes wird von verschiedenen Autoren unterschiedlich beurteilt. 483 M. Funktionstests Clomifen-Test Indikation:Subklassifizierung von Amenorrhoen bei positivem Gestagentest, Überprüfung der hypothalamisch-hypophysären Funktion Parameter:Östradiol, LH, FSH und Progesteron im Serum Durchführung:Einnahme von 100 mg Clomifen pro die (z. B. 2 Tabl. Pergotime tgl.) vom 5. bis zum 9. Tag nach einer Gestageninduzierten Blutung, Blutentnahmen am 3., 12. (LH, Östradiol) und am 21. Zyklustag (Östradiol, Pro­gesteron) sowie zusätzliche Follikulometrie. Beurteilung:Östradiolanstieg und Follikelwachstum spricht für eine geringfügige hypothalamisch-hypophysäre Störung und eine ausreichende Stimulation der Ovarien. Clonidintest-Suppressions-Test Indikation:V.a. Phäochromozytom, DD: Grenzwertig hohe bzw. erhöhte Plasmakatecholamin- oder Plasmametanephrinkonzentrationen (d.h. Erhöhungen bis etwa zum Doppelten des oberen Referenzwertes) Parameter:Adrenalin, Noradrenalin, Dopamin im EGTA-Plasma, Nor- u. Metanephrin im EDTA-Plasma, Serum tiefgefroren (siehe Hinweise zur Präanalytik im alphabet. Teil) Durchführung:Erste Blutentnahme nüchtern nach ca. 12 Stunden Nahrungskarenz und Bettruhe nach 24 Uhr. Legen einer Verweilkanüle 30 min. vor der von Gabe von 0,3 mg Clonidin oral, anschließend Blutentnahme nach 180 min zur Bestimmung der Plasmakatecholamine und –metanephrine, Blutdruck- und Pulskontrolle alle 30 min. während der Untersuchung. Der Patient sollte während des gesamten Tests liegen. Achtung: Antihypertensive Therapie mindestens 48 Std., am besten 7 Tage vor Testbeginn absetzen (siehe Hinweise im alphabet. Teil) und unbedingt Streß vor und während der Untersuchung vermeiden. Bei intolerablen Blutdruckwerten systolisch > 180 mm Hg und diastolisch > 110 mm Hg ggf. weitere Gabe von langwirksamen Calciumantagonisten. Kontraindikation: Hypotension, Hypovolämie, Bradycardie, aktuelle Beta-Blockertherapie Beurteilung:Normal ist ein Absinken der Plasmakatecholamin- und Plasmametanephrinkonzentrationen in den Referenzbereich bzw. ein Abfall der Werte um > 40 %. Deutlich erhöhte Basalwerte und eine fehlende Suppression der Plasmakatecholamin- und Plasmametanephrinkonzentrationen nach Clonidin sprechen für ein Phäochromozytom. Der Clonidintest ist nur bei basal erhöhten Werten verwertbar (Treffsicherheit von > 95%). 484 M . F u n k t io n s t e s t s Cortisol-Tagesprofil Indikation: Diagnose des Cushing-Syndroms Parameter:Cortisol im Serum Durchführung:Blutentnahmen für die Cortisolbestimmung um 8.00, 12.00, 18.00 und 24.00 Uhr, alternativ Speichelproben Beurteilung:Normalwerte im Serum vor 10 Uhr: 3,7 – 19,4 µg/dl, nach 17 Uhr: 2-,9 – 17, 3 µg/dl (laborinterner Referenzbereich); Cortisolwert im Serum < 5 µg/dl (*< 3 ug/dl) um 24 Uhr, Cortisol im Speichel < 0,1 µg/dl. Eine aufgehobene zirkadiane Rhythmik und Cortisolwerte > 5 µg/dl (*> 3 ug/dl) um 24 Uhr sprechen für ein CushingSyndrom und eine weitere Diagnostik mittels Dexamethason-Hemmtest, CRH-Test sowie ggfs. Bestimmung des freien Cortisols im 24h-Sammelurin und des ACTH-Spiegels im EDTA-Blut sollte erfolgen. Anmerkung: Der Cortisolspiegel und auch der nächtliche Cortisolnadir können durch starken psychischen oder physischen Streß (z. B. OP, starke Schmerzen), nach Nahrungsaufnahme (Cortisolanstieg 1 h postprandial im Mittel ca. 90 % mittags und ca. 50 % abends), bei schweren Allgemeinerkrankung, Infektionen, Diabetes mellitus, Adipositas, Anorexia nervosa, endogener Depression, Alkoholismus sowie unter Östrogeneinfluß (z.B. orale Kontrazeptiva, Substitution, Gravidität) zu hoch liegen. Die Konzentrationen an freiem Cortisol im 24h-Sammelurin oder im Speichel sind jedoch normal. * lt. Müller O A, Cushing-Syndrom, Rationelle Diagnostik und Therapie in Endokrinologie, Diabetologie und Stoffwechsel, Herausgeber Deutsche Gesellschaft für Endokrinologie, Redaktion Lehnert H, Georg Thieme Verlag Stuttgart 2009 (3. Auflage): 24 - 28 Corticotropin-Releasing-Hormon (CRH)-Test Indikation:Differentialdiagnose des Cushing-Syndroms, V.a. Hypophysenvorderlappen-Insuffizienz (z.B. nach Beendigung einer Glukokortikoidtherapie), DD: sekundäre und tertiäre Nebennierenrindeninsuffizienz Parameter:ACTH im EDTA-Plasma (am besten EDTA-Blut zentrifugieren, Plasma abheben und einfrieren, vorher Kühlboxen beim Labor anfordern! Bitte Kunststoffröhrchen verwenden!), Cortisol im Serum Durchführung:Legen eines Verweilkatheters, Blutentnahme am ruhenden nüchternen Patienten nach einer Ruhepause von 2 h, langsame Injektion von 100 µg humanem CRH (durch Verweilkanüle) oder 1 µg/kg Körpergewicht (bei Kindern, wobei der Test für Kinder nicht offiziell zugelassen ist!), Blutentnahme 15, 30, 45, 60 und 90 min nach Injektion. Nebenwirkungen: Die meisten Patienten entwickeln nach CRH-Gabe ein Hitzegefühl mit Flush, auch ein leichter Blutdruckabfall und Geschmacksmissempfindungen sind möglich. 485 M. Funktionstests Anmerkung: Die Testdurchführung ist nicht standardisiert, wobei jedoch eine Durchführung nach entsprechender Ruhepause (2 h) am Nachmittag oder Abend günstiger ist, da ACTH und Cortisol zu diesem Zeitpunkt niedriger sind und der zu erwartende Anstieg nach CRH-Gabe deutlicher ausfällt. Der Test kann auch im Rahmen eines kombinierten Releasing-Hormon-Tests (CRH, GHRH, GnRH, TRH) durchgeführt werden. Beurteilung:Beim Gesunden zeigt ACTH nach CRH-Gabe einen deutlichen Anstieg um mindestens 50 % und Cortisol im Serum steigt meist um > 7 µg/dl (200 nmol/l) an. Ein fehlender Anstieg von ACTH und Cortisol bei normalen bis extrem niedrigen Basalwerten spricht für einen hypophysären ACTH-Mangel (sekundäre Nebennierenrinden­insuffizienz). Ein geringer Anstieg von ACTH bei normalen oder niedrigen basalen Werten für ACTH und Cortisol schließt eine Hypophyseninsuffizienz nicht aus, ggf. sollte in diesem Fall ein Metopiron-Test durchgeführt werden. Bei der terti­ ären oder hypothalamischen Nebennierenrindeninsuffizienz zeigt sich nach CRH-Gabe eine gute Stimulierbarkeit der ACTH-Sekretion, wobei die Stimulierbarkeit des Cortisols abhängig ist vom Grad der Nebennieren-Atrophie und der Insulin-Hypoglykämietest negativ ausfällt (kein Anstieg von ACTH und Cortisol). Beim hypophysären CushingSyndrom mit meßbaren oder erhöhten basalen ACTH-Spiegel sollte bei deutlicher Cortisol-Stimulierbarkeit ein signifikanter Anstieg der ACTH-Konzentration um mindestens 35 % über den Ausgangswert erfolgen. Auch ein deutlicher Anstieg der Cortisolkonzentration (> 14-20 %) bei basal normal oder erhöhten Cortisolwerten, gilt in neueren Studien als gutes Kriterium für das Vorliegen eines zentralen Cushing-Syndroms. Bei etwa 10% der Fälle erfolgt jedoch kein Anstieg von ACTH nach CRH-Gabe und zur weiteren Abklärung kommt die Durchführung eines kombinierten CRH-/Vasopressin-Testes zusammen mit einem Dexamethason-Kurztest (8 mg) in Frage (diagnostische Sicherheit dann 100 %). Eine fehlende Stimulierbarkeit von ACTH und Cortisol nach CRH-Gabe bei basal erhöhten oder hoch normalen ACTH-Spiegeln spricht für ein ektopes ACTH-Syndrom (DD: fehlender Anstieg auch beim zentralen Cushing-Syndrom z.B. bei Makroadenom.) Bei basal und nach CRH-Gabe nicht messbaren ACTH-Spiegeln und gleichzeitig nicht stimulierbarem Cortisol liegt ein adrenales Cushing-Syndrom vor (Tumor oder bilaterale mikrooder makronoduläre Nebennierenrinden-Hyperplasie). Desferoxamintest Indikation:V.a. Hämochromatose, Hämosiderose Parameter:Eisen im Sammelurin Durchführung:Morgens Blase entleeren und Urin verwerfen, Gabe von 500 mg Desferoxamin (Desferal) i.m., 6 Stunden Sammelurin (Dauer bitte angeben), ca. 10 ml Urin aus der Sammelmenge einsenden (Angabe der Sammelmenge!) Beurteilung:Physiologisch ist eine Ausscheidung 500 - 1000 µg /6 h (1 mg/6 h). Werte zwischen 4000 – 6000 µg/6 h (4 – 6 mg/6h) weisen auf eine Hämochromatose hin, Werte > 10000 µg/6 h (> 10 mg/6 h) sprechen eindeutig für eine Hämochromatose. Bei einer Hämosiderose liegen die Werte meist im Bereich 1000 – 2000 µg/6 h (1 – 2 mg/6 h). 486 M . F u n k t io n s t e s t s Dexamethasonhemmtest (Kurztest mit niedriger Dosis / hoher Dosis) Indikation:(Differential-)Diagnose des Cushing-Syndroms Parameter:Cortisol im Serum Durchführung:Erste Blutentnahme nüchtern um 8.00 Uhr, dann Gabe von (1-) 2 mg (bzw. 8 mg) Dexamethason um 23.00 Uhr und zweite Blutentnahme am nächsten Morgen 8.00 Uhr nüchtern. Beurteilung: Kurztest mit niedriger Dosierung (2 mg): Der Plasmacortisolspiegel ist bei Gesunden nach Gabe von 2 mg Dexamethason supprimiert auf Werte < 3 µg/dl bzw. < 83 nmol/l (< 1,8 µg/dl bzw. < 50 nmol/l*) und schließt ein Cushing-Syndrom mit hoher Wahrscheinlichkeit aus. Beim endogenen Cushing-Syndrom liegen die Werte > 3 µg/dl bzw. > 83 nmol/l (> 1,8 µg/dl bzw. > 50 nmol/l*). Bei einer hohen Sensitivität von 98% hat dieser Test jedoch eine eingeschränkten Spezifität, da in bis zu 15% der Fälle falsch-positive Ergebnisse auftreten z.B. bei Patienten mit Adipositas, schweren Begleiterkrankungen, Anorexia nervosa, schweren Depressionen und Angstzuständen, Alkoholismus, chronischem Nierenversagen, erhöhten Östrogenwerten (Gravidität, orale Kontrazeptiva, Östrogensubstitution) und bei Einnahme von Phenytoin, Barbituraten und anderen Antikonvulsiva. Aufgrunddessen sollte der niedrigdosierte Dexamethason-Kurztest nicht als alleiniges Kriterium zur Diagnose eines Hypercortisolismus herangezogen werden und zusätzlich z.B. eine Bestimmung von Cortisol um 24 Uhr (in Serum oder Speichel) und/oder die Bestimmung des freien Cortisols im 24h-Sammelurin erfolgen. Bei fehlender Suppression sollte zur weiteren Differentialdiagnostik ein Dexamethosen-Test mit hoher Dosierung (8 mg) durchgeführt werden. Kurztest mit hoher Dosierung (8 mg): Eine Suppression der Cortisolkonzentration auf < 50 % des Ausgangswertes zeigt sich in der Mehrzahl der Fälle bei einem zentralen Cushing-Syndrom. Zeigt sich eine ungenügende Suppression nach 8 mg Dexamethason und besteht weiterhin der Verdacht auf ein zentrales Cushing-Syndrom, sollte der Test mit höheren Dosen (z.B. 12 mg/max. 32 mg im Einzelfall) wiederholt werden. Beim adrenalen Cushing-Syndrom (autonomer Nebennierenrindentumor) tritt jedoch keine Suppression auf, bei ektoper ACTH-Produktion ist eine Suppression < 50% sehr selten. In etwa 20 % der Fälle gelingt eine sichere Differenzierung zwischen zentralem Cushing-Syndrom und ektoper ACTH-Produktion auch mittels hochdosiertem Dexamethason-Suppressions-Test nicht, jedoch nach kombinierter Durchführung eines DexamethasonCRH-Tests fast immer. Zur weiteren Abklärung bzw. zur Differenzierung zwischen hypophysärem Cushing-Syndrom und ektoper ACTH-Sekretion sollte bei fehlender Suppression im hochdosiertem Dexamethason-Test und nicht ausreichender Stimulation von ACTH und Cortisol nach CRH eine bilaterale Katheterisierung des Sinus petrosus inferior mit gleichzeitiger CRH-Stimulation zur Bestimmung von ACTH bilateral aus dem Sinus petrosus inferior und einer peripheren Vene erfolgen. Anmerkung: Die Langzeitteste mit Dexamethason bieten im Vergleich zu den Kurzzeittesten keine Vorteile. * lt. Mönig et al., Dynamische Funktionstests in der Endokrinologie, Rationelle Diagnostik und Therapie in Endokrinologie, Diabetologie und Stoffwechsel, Herausgeber Deutsche Gesellschaft für Endokrinologie, Redaktion Lehnert H, Georg Thieme Verlag Stuttgart 2009 (3. Auflage): 488 – 533 487 M. Funktionstests Durstversuch (Zwei-Stufen-Test) Indikation:Indikation Differentialdiagnose des zentralen Diabetes insipidus, DD: Polydipsie und bei bestätigter Polyurie (Urinausscheidung > 30 ml/kg/Körpergewicht/Tag und nach Ausschluß eines Diabetes mellitus, einer Hyperkalziämie, Hypokaliämie, einer polyurischen Nierenerkrankung oder einer medikamenteninduzierten Polyurie (z.B. Lithium) Parameter:Serum- und Urinosmolalität, Natrium im Serum, fakultativ Antidiuretisches Hormon (ADH) im EDTA-Plasma (ggfs. 8.00, 12.00, 16.00 Uhr) (EDTA-Blut möglichst nach ca. 30 min. zentrifugieren, EDTA-Plasma einfrieren und Transport in Spezialkühlboxen zum Labor!). Die Durchführung des Tests sollte unter stationären Bedingungen erfolgen. Durchführung:Die Durchführung des Testes sollte unter stationären Bedingungen erfolgen. 1.) Beginn morgens um 6.00 Uhr mit Bestimmung des Körpergewichtes, Blutentnahme und Urinprobe zur Bestimmung von Serum- und Urinosmolalität sowie von Natrium. Danach 12-stündige Durstphase und 2-stündige Kontrollen der Urinosmolalität, der Harnmenge, des Körpergewichts sowie stündlich von Blutdruck und Puls. Am Ende des Durstversuches erneute Bestimmung von Serum-und Urinosmolalität, Natrium und fakultativ von ADH sowie nochmalige Messung der Harnmenge, des Körpergewichts sowie von Blutdruck und Puls. Achtung: Abbruch des Testes bei Verlust von mehr als 3 – 5% des Ausgangskörpergewichtes, Anstieg Serumnatrium auf Werte von 145-148 mmol/l, sowie bei Hypotonie und/oder Exsikkose bzw. unerträglichem Durst und/oder Tachycardie, Fieber. 2.) Bei pathologischem Testergebnis bzw. um 16.00 Uhr zur weiteren differentialdiagnostischen Abklärung Gabe von exogenem Desmopressin (4 ug i.v. oder 10 µg intranasal, z.B. Minirin) und erneute Bestimmung der Serum- und Urinosmolalität sowie fakultativ von ADH im EDTA-Plasma bzw. Weiterführung des Testablaufes für 3 – 4 Stunden (zweite Stufe). Kontraindikation: Serumnatrium > 148 mmol/l bzw. erhöhte Serum-Osmolalität, Dehydration. (Bei Kindern Urinvolumen deutlich > 2ml/ KG/h!) Beurteilung:Normalpersonen konzentrieren beim Durstversuch den Urin auf ca. 900 – 1200 mosmol/kg und die Serumosmolalität ist < 295 mosmol/kg. Bei Patienten mit psychogener/primärer Polydipsie ist das maximale Urinkonzentrationsvermögen eingeschränkt auf 450 – ca. 700 mosmol/kg. Nach Gabe von Desmopressin am Endes des Durstversuches erfolgt bei Normalpersonen und Patienten mit psychogener Polydipsie kein weiterer Anstieg der Urinosmolalität. Beim kompletten zentralen Diabetes insipidus liegt die Urinosmolalität meist < 250 mosmol/kg, die Serumosmolalität ist > 295 mosmol/kg und nach Desmopressin-Gabe steigt die Urinosmolalität signifikant um > 30 mosmol/kg/h an bzw. es erfolgt ein mittlerer Anstieg von 183% auf eine Urinosmolalität von 445-600 mosmol/kg. Beweisend für einen zentralen Diabetes insipidus sind niedrige ADH-Konzentrationen am Ende des Durstversuches bei einer Serumosmolalität von > 300 mosmol/kg. Beim partiellen zentralen Diabetes insipidus erfolgt in Stufe 1 ein geringer Anstieg der Urinosmolalität mit steigender Serumosmolalität sowie nach Desmopressin-Gabe ein stärkerer Anstieg um > 9 - < 50% auf mittlere Werte von 550 – 800 mosmol/kg. Im Falle eines renalen Diabetes insipidus findet sich ebenfalls eine Serumosmolalität von > 295 mosmol/kg, meist nur ein Anstieg der Urinosmolalität um < 10 mosmol/h oder gar keiner beim Durstversuch und nach Desmopressingabe findet sich kein weiterer Anstieg der Urinosmolalität. 488 M . F u n k t io n s t e s t s Eisenresorptionstest Indikation:Überprüfung der intestinalen Resorption bei Eisenmangelanämie Parameter:Eisen im Serum Durchführung:Erste Blutentnahme nüchtern, dann orale Gabe von 200 mg zweiwertigem Eisen (z.B. 2 Kps. Ferro sanol duodenal) und weitere Blutentnahmen nach 2 und 4 Stunden. Beurteilung:Normal ist ein Anstieg des Eisenspiegels um 30 – 40% des Ausgangswertes. Bei Eisenmangelanämie und intakter intestinaler Resorption Anstieg der Serumeisen-Konzentration von niedrigen Ausgangswerten auf > 200 µg/dl (36 µmol/l) nach 2 - 4 Stunden. Bei Vorliegen einer Resorptionstörung und bei Infekt- oder Tumoranämie erfolgt kein oder nur ein geringer Anstieg der Eisenkonzentration ausgehend von geringen Ausgangswerten. Hohe Ausgangswerte und ein ebenfalls geringer Anstieg der Eisenkonzentration finden sich bei Hämochromatose und hämolytischen Anämien. Fludrocortisontest Indikation:DD: Hyperaldosteronismus/ Aldosteron produzierendes Nebennierenadenom (Conn-Syndrom) Parameter:Aldosteron im Serum Durchführung:Erste Blutentnahme nach ausreichend Bettruhe (mind. ab 24 Uhr) zur Bestimmung des basalen Aldosteronwertes. Danach über 4 Tage alle 6 h Gabe von 4 x 0.1 mg Fludrocortison (Astonin H) und am 5. Tag Blutentnahme morgens (7.00 – 9.00 Uhr) zur Bestimmung von Aldosteron. Achtung: Einhaltung einer Normalkost mit 100 – 150 mmol Natrium (3 – 4.5 g Kochsalz) pro die. Störende Medikamente z.B. Beta-Blocker, Diuretika, ACE-Hemmer, Spironolacton (u.a. kaliumsparende Diuretika) sollten, falls medizinisch vertretbar, mindestens 2 Wochen vorher abgesetzt werden. Störenden Einfluß haben auch andere Antihypertensiva (z.B. Calciumantagonisten, Clonidin etc.), Beta-Blocker (z.B. Atenolol, Carvedilol, Propanolol etc.), Antiphlogistika (z.B. Aspirin, Ibuprofen, Indomethacin), Aminoglykosid-Antibiotika, Antazida wie Carbenoxolon, Herzglykoside, Heparin, Kortikosteroide, Lakritze in größeren Mengen, Laxantien, Lithium und Ovulationshemmer, weshalb ein Absetzen der Präparate ca. 1 Woche vorher sinnvoll ist. Bei Frauen empfiehlt sich eine Durchführung des Testes in der ersten Zyklushälfte. Beurteilung:Beim Gesunden erfolgt ein Abfall des Aldosteronwertes auf < 50% des Basalwerte, ebenso beim glukokortikoidsupprimierbaren Hyperaldosteronismus. Im Falle eines primären Hyperaldosteronismus zeigt sich kein Abfall der Aldosteron­konzentration, der Aldostronwert liegt meist oberhalb von 50 mg/l. 489 M. Funktionstests Fruktosebelastung Indikation:Fruktosemalabsorption Parameter:H2 - (Wasserstoff -) Konzentration in der Ausatemluft (Durchführung z.B. in unserer Sprechstunde) und Glukose im NaF-Blut (die Fruktose - Messung ist aufgrund des hepatischen Stoffwechsels im Rahmen des Fruktosemalabsorptionstestes häufig nicht aussagekräftig und wird daher routinemäßig nicht mehr durchgeführt). Durchführung:Erste Blutentnahme und Atemprobe nüchtern, dann orale Gabe von 25 g Fruktose (in ca. 300 ml Wasser oder Tee); anschließend weitere Atemproben nach 15, 30, 60, 90 und 120 min. Beurteilung:Normal sind H2-Atemwerte < 20 ppm. Bei Fruktosemalabsorption H2-Werte nach 30 min >20 ppm, frühere H2 – Anstiege und erhöhte Nüchtern - H2-Werte können z.B. eine bakterielle Überwucherung des Dünndarms bzw. eine verkürzte Magen-Zökum-Transit–Zeit anzeigen. Die Glucosebestimmungen dienen dem Ausschluss von Hypoglykämien. Aufgrund gefährlicher Hypoglykämien bei hereditärer Fruktoseintoleranz führen wir den Test nur nach Anamnese, Aufklärungsgespräch und Indikationsstellung des behandelnden Arztes durch. Besteht der V.a. hereditäre Fruktoseintoleranz , sollte statt der Fruktosebelastung besser der Fruktose-Aldolase-B-Gentest im EDTA-Blut durchgeführt werden. Bei nachgewiesener hereditärer Fruktoseintoleranz ist die Fruktosebelastung kontraindiziert. Gastrin-Stimulation (Sekretin-Provokationstest) Indikation: V.a. Gastrinom (Zollinger-Ellison-Syndrom), Erhöhte Nüchterngastrinwerte (> 60 bis ≥ 1000 ng/l) DD: G-ZellHyperplasie, Achlorhydrie (atrophisches Gastritis, pernizöse Anämie), Niereninsuffizienz (Kreatintin > 3.4 mg/dl (300 µmol/l), Z.n. Magenresektion, Helicobacter pylori-Infektion. Parameter: Gastrin im Serum, Proben gerinnen lassen u. innerhalb von 30 min. zentrifugieren, Serum abheben und einfrieren (Kühlboxen im Labor anfordern!) Durchführung:Abnahme von zwei basalen Blutproben nüchtern nach mind. 12 h Nahrungskarenz im Abstand von 15 min (- 15, 0), dann Gabe von 2 IE Sekretin/kg Körpergewicht i.v. (z.B. Secrelux), weitere Blutentnahmen nach 2, 5, 10, 15 und 30 Minuten Achtung: Antacida, Anticholinergica, H2-Rezeptorantagonisten mind. 24 h und Protonenpumpenhemmer mind. 5 (-7) Tage vorher absetzen!. Cave: Glukokortikoide, Östrogene, Gestagene, Opiate und Anticholinergika können die Wirkung des Sekretins im Test abschwächen. Nebenwirkungen: Während des Testes können Hitzewallungen, Übelkeit, Bauchschmerzen und Schwindel auftreten. Kontraindikation: Akute Pankreatitis oder akuter Schub einer chronischen Pankreatitis! 490 M . F u n k t io n s t e s t s Beurteilung:Normal ist ist ein geringer oder fehlender Anstieg von Gastrin nach Stimulation sowie anschließend ein Abfall der Werte. Bei einem Gastrinom kommt es nach Sekretin-Gabe zu einem Gastrin-Anstieg um mehr als 200 ng/l (pg/ml) (Differenz basaler Gastrinwert zu stimulierten Gastrinkonzentrationen.) nach etwa 2-10 min bzw. zu einem Anstieg der Gastrinkonzentrationen auf mehr als 100 % des Ausgangswertes. Der Test fällt in ca. 10% der Fälle falsch-negativ aus bzw. es kommt nicht zu einem entsprechenden Anstieg trotz Gastrinom. Bei negativem Ausgang des Testes zur weiteren Differentialdiagnostik ggf. Säuresekretionsanalyse (DD: siehe Indikation). GH-RH-Stimulationstest Indikation:V.a. (partielle) Hypophyseninsuffizienz, DD: hypothalamisch oder hypophysär bedingter Mangel an Wachstumshormon (HGH, STH). Hinweis: Der GH-RH-Test kann nicht zur primären Diagnostik des Wachstumshormonmangels angewendet werden (siehe unter Wachstumshormon-Stimulationsteste). Der GH-RH-Test wird auch im Rahmen des globalen Hypophysen-Stimulationstestes angewendet (siehe dort). Parameter:Human-growth-hormone (HGH) bzw. somatotropes Hormon (STH) im Serum Durchführung:Morgens nüchtern nach mind. 12 h Nahrungskarenz legen eines venösen Zuganges. nach mind. 1 h Ruhezeit erste Blutentnahme (= – 15 min.) und zweite Blutentnahme (= 0 min.). Gabe von 1 µg GHRH/kg Körpergewicht (Erwachsene 100 µg) als Bolus i.v., weitere Blutentnahmen nach 15, 30, 60, 90 und ggf. 120 min.. Nebenwirkungen: Kurzfristige Flush-Symptomatik (ca. 14% d. Patienten), Blässe, eigenartiger Geschmack im Mund, Kopfschmerzen, Übelkeit und selten Überempfindlichkeitsreaktionen. Beurteilung:Normal ist ein Anstieg von HGH auf Werte > 10 ng/ml (> 15 ng/ml*). Bei einem fehlenden Anstieg von HGH bzw. HGH-Werten nach Stimulation < 5 bzw 10 ng/ml (< 15 ng/ml*) liegt eine hypophysäre Störung vor. Beim Erwachsenen sollten zum Nachweis eines isolierten HGH-Mangels jeweils zwei Provokationsteste durchgeführt werden. Liegen gleichzeitig weitere Ausfälle von Hypophysenhormonen vor, wird die Durchführung von nur einem Provokationstest als ausreichend empfohlen (lt. Konsensusrichtlinien der Growth Hormone Research Society). Erfolgt nach GH-RHStimulation ein Anstieg von HGH auf Werte > 10 ng/ml (> 15 ng/ml*) oder höher oder erfolgt ein subnormaler Anstieg von HGH mit einem späten Maximum, so spricht dies für eine hypothalamische Störung bzw. Insuffizienz. * lt. Mönig et al., Dynamische Funktionstests in der Endokrinologie, Rationelle Diagnostik und Therapie in Endokrinologie, Diabetologie und Stoffwechsel, Herausgeber Deutsche Gesellschaft für Endokrinologie, Redaktion Lehnert H, Georg Thieme Verlag Stuttgart 2009 (3. Auflage): 488 – 533 Anmerkung: Bei einer hypothalamischer Störung während der längere Zeit keine Stimulation der Hypophyse mit GH-RH erfolgte, kann es trotz intakter Hypophysenfunktion zu einer ungenügenden Sekretion von HGH nach GH-RH 491 M. Funktionstests kommen. In diesem Fall sollte der GH-RH-Test erst nach mehrfacher Gabe von GH-RH 1 µg/kg Körpergewicht s.c. über z.B. 5 Tage durchgeführt werden. In einzelnen Fällen wird bei gesunden Erwachsenen kein adäquater HGH-Anstieg nach GH-RH beobachtet. Glukagon-Test Indikation:V.a. Insulinom Parameter:Glucose im Kapillarblut, Insulin und C-Peptid im hämolysefreien Serum (auch EDTA- oder Heparinplasma, innerhalb von 30 min. Zentrifugation der Probe, Serum bzw. Plasma abheben, bei Insulin möglichst gekühlter Transport (4–8 °C), besser tiefgefroren, vorher Kühlboxen im Labor anfordern!) Durchführung:Der Patient sollte sich 3 Tage kohlenhydratreich ernähren. Erste Blutentnahme nach 8 Stunden Nahrungskarenz, anschließend Gabe von 1 mg Glukagon i.v. verdünnt in 10 ml physiologischer NaCl-Lösung und nach 1, 5, 10, 15 und 30 min. Blutentnahmen zur Bestimmung der oben genannten Parameter. Beurteilung:Normal ist ein Anstieg von Insulin bis 200 mU/l und von C-Peptid auf Werte zw. 2.7 – 5.7 µg/l nach Glukagongabe. Bei Patienten mit einem Insulinom liegen die Insulin-Werte über 200 mU/l und der maximale Anstieg von C-Peptid liegt > 2.5 µg/l nach Glukagongabe. Wählt man als Kriterium einen Insulingipfel > 130 mU/l oder nach nächtlichem Fasten von > 100 mU/l gegenüber dem Basalwert, beträgt die diagnostische Sensitivität des Testes 50-80% für ein Insulinom. Fehlerquellen: Falsch-negative Ergebnisse bei Einnahme von Hydrochlorothiazid, Diphenylhydantoin und Diazoxid. Falsch-positive Ergebnisse bei Einnahme von Tolbutamid und Aminphyllin sowie bei Adipositas. Anmerkung: Test nach neueren Erkenntnissen obsolet. Zur Diagnose wird ein oraler Glukose-Toleranztest mit Messung von Glucose und Insulin sowie ein Hungerversuch (Messung von Glucose, Insulin und ggf. C-Peptid) empfohlen (siehe unter „Hungerversuch“). 492 M . F u n k t io n s t e s t s Glucose-H2-Atemtest Indikation:V.a. bakterielle Fehlbesiedlung des Dünndarms / verkürzte Magen-Zökum-Transitzeit. Abklärung unklarer Diarrhoen, Meteorismus, Flatulenz, Übelkeit, postprandiales Völlegefühl. Der Glucose-H2-Atemtest kann ggfs. auch kurzfristig nach Antibiotikatherapie, Koloskopie oder einer anderen Untersuchung mit Darmlavage durchgeführt werden. Parameter :H2-(Wasserstoff)-Konzentration in der Ausatemluft (Durchführung z.B. in unserer Sprechstunde) und Glucose im NaF-Blut Durchführung :Erste Blutentnahme und Atemprobe nüchtern, dann orale Gabe von 50 g Glucose (Kinder erhalten 1g/kg Körper­ gewicht, maximal 25g) in ca. 300 ml Wasser oder Tee; anschließend weitere Atemproben nach 15, 30, 60, 90 und 120 min sowie Glucosemessungen nach 60 und 120 min. Beurteilung :Normal sind H2-Atemwerte < 20 ppm. Frühe H2-Anstiege < 30 min und erhöhte Nüchtern - H2-Werte können z.B. eine bakterielle Überwucherung des Dünndarms bzw. eine verkürzte Magen-Zökum-Transit – Zeit anzeigen. Die Glucosebestimmungen dienen der Plausibilitätskontrolle. Häufig tritt nach chronischer Pankreatitis mit exokriner Pankreasinsuffizienz postoperativ eine bakterielle Fehlbesiedlung des Dünndarms auf, die z.B. antibiotisch therapiert werden kann. (Oraler) Glucose-Toleranztest (OGTT) Indikation:Klinischer Verdacht auf gestörte Glucosetoleranz oder gestörte Nüchternglucose bzw. IFG (Impaired Fasting Glucose, venöses Plasma ≥ 100 und < 126 mg/dl vorrangig (kapilläres Vollblut ≥ 90 und < 110 mg/dl), V.a. Diabetes mellitus, Personen ≥ 45 Jahre mit einem Body Mass Index (BMI) von ≥ 25 kg/m 2 und Personen ≥ 45 Jahre mit einem Body Mass Index (BMI) von ≤ 25 kg/m 2 mit zusätzlichen Risikofaktoren, bei V.a. Gesta­tionsdiabetes (siehe unten). Parameter:Glucose im NaF-Blut bzw. venösem Plasma (kapilläres Vollblut nur bedingt verwenden) Durchführung:Erste Blutentnahme morgens nüchtern beim sitzenden oder liegenden Patienten nach mind. 10 - 16 Stunden Nahrungskarenz (kein Alkohol und kein Rauchen vor dem Test, kein Rauchen während des Testes), orale Gabe von 75 g Glucose in ca. 250 - 300 ml Wasser oder Tee (Kinder erhalten 1,75 g/kg Körpergewicht (max. 75 g) in einem Zeitraum von ca. 3 – 5 min., weitere Blutentnahme nach 60 und 120 min. (Der 60-Minutenwert ist nicht obligatorisch). Achtung: Voraussetzung für eine verlässliche Aussage des oralen Glucose-Toleranztestes ist vor Testbeginn eine ausreichende Zufuhr von Kohlenhydraten (> 150 g pro die) sowie eine normale körperliche Aktivität (z. B. kein Z.n. Bettlägerig­keit oder nach übermäßiger körperlicher Anstrengung). Weiterhin sollten störende Medikamente sofern möglich abgesetzt werden und ein Abstand von mindestens drei Tagen zur Menstruation eingehalten werden. Störfaktoren, die die Glucosetoleranz beeinflussen können: Medikamente wie Epinephrin, Glukokortikoide, hormonelle Kontrazeptiva, Laxantien, nicht-steroidale Antirheumatika, Nikotinsäure, Nitrazepam, Phenothiazine, Phenazetin, Saluretika (insbesondere Thiazide), Schilddrüsenhormone; besondere Umstände wie Hungerzustand und 493 M. Funktionstests lange Bettlägerigkeit, Schwangerschaft, starker Stress (z. B. OP, Tauma etc.), Erkrankungen wie Magen-Darm-Erkrankungen, Z.n. Magenresektion, metabolische Azidose (Urämie), Hypokaliämie, Hypomagnesiämie, Hyperlipidämie, akute oder chronische Lebererkrankungen, hochgradige Herzinsuffizienz, Hyperthyreose. Beurteilung:Beurteilung der Glucosewerte: Glucose nüchtern, normal Impaired Fasting Glucose (IFG) bzw. gestörte Glucosetoleranz Diagnose Diabetes, wenn Glukose nüchtern Impaired Glucose Tolerance (IGT), wenn 2.Std.-Wert OGTT Diagnose Diabetes, wenn 2-Std.-Wert OGTT Venöses Plasma (NaF) mg/dl (mmol/l) < 100 (5.6) > 100 (5.6) < 126 (7.0) > 126 (7.0) > 140 (7.8) < 200 (11.1) > 200 (11.1) Kapilläres Vollblut mg/dl (mmol/l) < 90 (5.0) > 90 (5.0) < 110 (6.1) > 110 (6.1) > 140 (7.8) < 200 (11.1) > 200 (11.1) (lt. AWMF-Leitlinien-Register, Nr. 057/002K bzw. Kerner W, Brückel J, Definition, Klassifikation und Diagnostik des Diabetes mellitus, Diabetologie 2008; 3 Suppl 2: S. 131-133, ADA-Bericht 1997 in Diabetes Care;7:1183-97, Alberti et. al. in Diabet Med 1998;15:539-53 und WHO 1985) Achtung! Neue Empfehlung Diabetes Risiko Test primär mit HbA1c-Wert: Laut Literatur kann bei einen HbA1c-Wertes ≥ 6.5% die Diagnose Diabetes mellitus mit ausreichender Spezifität gestellt werden. Bei einem HbA1c-Wert < 5.7% kann ein Diabetes mellitus mit ausreichender Sensitivität ausgeschlossen werden. Bei einem HbA1c-Wert im Bereich von 5.7 – 6.4% sollte zusätzlich der OGTT mit 75 g unter Verwendung von Na-F-Blut bzw. venösem Plasma durchgeführt werden. Sofern die Nüchternglucosewerte zw. 100-125 mg/dl und/oder der 2-Std.-Wert im Bereich 140-199 mg/dl liegt, sollte in einem Jahr ein neuer Diabetes Risiko Test erfolgen. Eine Aufklärung über das Diabetesrisiko und eine „Lifestyle-Intervention“ empfehlen sich. Der HbA1cWert kann nicht zur Diabetesdiagnose eingesetzt werden, wenn mit einer Verfälschung der Werte zu rechnen ist (z.B. Hämoglobinstrukturvarianten, bei erhöhter oder erniedrigter Lebensdauer der Erythrozyten (wie hämolytische Anämie, Eisenmangelanämie, Leber- u. Nierenerkrankungen), Urämie, Dauertherapie mit Acetylsalicylsäure, Ascorninsäure, Vitamin E, Gravidität). 494 (lt. Kerner W, Brückel J, Definition, Klassifikation und Diagnostik des Diabetes mellitus, Diabetologie 2010; 5: S. 109-112.) M . F u n k t io n s t e s t s (Oraler) Glucose-50g-Screening-Test in der Gravidität (24. – 28 SSW) bzw. zusätzlicher OGTT mit 75 g (Two-Step-Verfahren) Nach den neuesten Veröffentlichungen bzw. Richtlinien zum Gestationsdiabetes (GDM)* sollte bei Vorliegen von Risikofaktoren (z.B. Alter ≥ 45 Jahre, BMI ≥ 30 kg/m2 präkonzeptionell, körperliche Inaktivität, Eltern oder Geschwister mit Diabetes mellitus, Angehörige einer ethnischen Risikopopulation (Asiatinnen, Lateinamerikanerinen, AfroAmerikanerinnen, Araberinnen, Türkinnen), Geburt eines Kindes ≥ 4500 g, GDM in der Vorgeschichte, arterielle Hypertonie (RR ≥ 140/90 mmHg) bzw. unter Therapie derselben, Dyslipidämie präkonzeptionell (HDL < 35 und/oder Triglyceride > 250 mg/dl), PCO-Syndrom, Prädiabetes (IFG, IGT, HbA1c ≥ 5.7 %) bei früherem Test, klinische Zustände welche mit Insulinresistenz assoziiert sind (z.B. Acanthosis nigricans), anamnestisch KHK, pAVK, cerebral-arterielle Durchblutungsstörung, Einnahme kontrainsulinärer Medikamente (z.B. Glukokortikoide) bei der Erstvorstellung vor der 24. SSW bereits ein GDM ausgeschlossen werden. Danach wird generell bei allen Schwangeren entweder gleich ein OGTT mit 75 g durchgeführt oder zunächst ein OGTT mit 50 g und bei Bedarf (Kriterien siehe weiter unten) im Anschluß ein OGTT mit 75 oder 100 g durchgeführt. Indikation:Klinischer Verdacht auf Gestationsdiabetes und/oder erhöhtes Risiko für Diabetes mellitus, sowie generell bei allen Schwangeren in der 24. – 28. SSW. Parameter:Glucose im NaF-Blut bzw. venösem Plasma Durchführung:Die Testdurchführung ist unabhängig vom Tageszeitpunkt und der letzten Mahlzeit. Die Patientin erhält oral 50 g Glucose in ca. 200 ml Wasser oder Tee in einem Zeitraum von ca. 3 – 5 min., danach Blutentnahmen nach 60 und 120 min. Anmerkung: Die Patientin sollte während der Testdurchführung am besten sitzen und nicht rauchen. Beurteilung: Sofern die Glucosewerte im venösen Plasma nach 60 min. > 135 mg/dl liegen, sollte ein oraler Glucose-Toleranztest mit 75 g Glucose über 2 Stunden angeschlossen werden und zuvor die Nüchternglucose bestimmt werden. (*Quelle: Gestationsdiabetes mellitus (GDM), Evidenzbasierte Leitlinie zu Diagnostik, Therapie u. Nachsorge der Deutschen Diabetes-Gesellschaft (DDG) und der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) S3-Leitlinie (AWMF-Leitlinie 057/008), Herausgeber DDG: M.Kellerer, S.Matthaei; Herausgeber DGGG: R.Kreienberg; Autoren: H.Kleinwechter, U.Schäfer-Graf, C.Bührer, I.Hoesli, F.Kainer, A.Kautzky-Willer, B.Pawlowski, K.Schunck, T.Somville, M.Sorger, Erstveröffentlichung 08/2011) (Oraler) Glucose-Toleranztest (OGTT) mit 75 g in der Gravidität (24. – 28. SSW) Indikation:Positiver bzw. pathologischer OGTT mit 50 g, klinischer Verdacht auf Gestationsdiabetes bzw. im 1. Trimenon bei besonders gefährdeten Frauen (Alter ≥ 45 Jahre, Adipositas, arterielle Hypertonie, Gestationsdiabetes in vorheriger 495 M. Funktionstests Gravidität, Typ 2 Diabetes mellitus bei Verwandten 1. Grades, Z.n. Geburt eines Kindes ≥ 4500 g, Z.n. Abort etc., siehe auch Risikofaktoren unter „oraler Glucose-50g-Screening-Test in der Gravidität “). Generell bei allen Schwangeren in der 24.-28. SSW. Parameter:Glucose im NaF-Blut bzw. venösem Plasma Durchführung:Erste Blutentnahme morgens nüchtern beim sitzenden Patienten nach mind. 8 Stunden Nahrungskarenz, orale Gabe von 75 g Glucose in ca. 250 - 300 ml Wasser oder Tee in einem Zeitraum von ca. 3 – 5 min., weitere Blutentnahme nach 60 und 120 min (kein Alkohol und kein Rauchen vor dem Test, kein Rauchen während des Testes!) Anmerkung: Vorraussetzung für eine verlässliche Aussage des OGTT ist vor Testbeginn eine ausreichende Zufuhr von Kohlehydraten (> 150 g pro die) sowie ein Testbeginn nach 6.00 und vor 9.00 Uhr morgens. Während des Tests muss die Schwangere nahe dem Testlabor sitzen, darf nicht liegen oder sich unnötig bewegen und es sollen keine anderen Untersuchungen in dieser Zeit durchgeführt werden. Standardbedingungen: Keine außergewöhnliche körperliche Belastung, normale, individuelle Ess- und Trinkgewohnheiten, Keine akute Erkrankung/Fieber/Hyperemesis/ärztlich verordnete Bettruhe. Keine Einnahme oder parenterale Applikation kontrainsulinärer Medikation am Morgen vor dem Test (z.B. Cortisol, L-Thyroxin, ß-Mimetika, Progesteron). Nach Induktion der fetalen Lungenreife mit Betamethason wegen drohender Frühgeburt müssen mindesten 5 Tage nach der letzten Injektion vergangen und die Schwangere zumindest teilmobilisiert sein, bevor der oGTT angesetzt wird. Keine Voroperation am oberen Magen-Darm-Trakt (z.B. bariatrische Chirurgie mit ablativ-malabsorptiven Verfahren), hier kommen als Alternative der i.v.-GTT beim Diabetologen oder BlutglukoseEinzelmessungen, besonders nüchtern, zum Einsatz. Keine außergewöhnliche körperliche Belastung. Beurteilung:Ein Gestationsdiabetes liegt vor, bei Erreichen oder Überschreiten von mindestens einem der drei Grenzwerte im venösen Plasma. Pathologische Glucosewerte : Glucose nüchtern Wert nach 60 min. Wert nach 120 min. Venöses Plasma (NaF) mg/dl (mmol/l) > 92 (5.1) > 180 (10.0) > 153 (8.5) (lt. Kerner W, Brückel J, Definition, Klassifikation und Diagnostik des Diabetes mellitus, Diabetologie 2010; 5: S. 109-112; Gestationsdiabetes mellitus (GDM), Evidenzbasierte Leitlinie zu Diagnostik, Therapie u. Nachsorge der Deutschen Diabetes-Gesellschaft (DDG) und der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) S3-Leitlinie (AWMF-Leitlinie 057/008), Herausgeber DDG: M.Kellerer, S.Matthaei; Herausgeber DGGG: R.Kreienberg; Autoren: H.Kleinwechter, U.Schäfer-Graf, C.Bührer, I.Hoesli, F.Kainer, A.Kautzky-Willer, B.Pawlowski, K.Schunck, T.Somville, M.Sorger, Erstveröffentlichung 08/2011) 496 M . F u n k t io n s t e s t s hCG-Test (Leydigzell-Funktions-Test) Indikation:Differentialdiagnose Anorchie oder Kryptorchismus durch Überprüfung der endokrinen Kapazität der Testes. Differentialdiagnose von primärem und sekundärem männlichem Hypogonadismus. Parameter:Testosteron im Serum Durchführung:Erste Blutentnahme zwischen 8.00 und 10.00 Uhr morgens, anschließend i.m.-Gabe von 5000 IE hCG (z.B. Choragon, Predalon, Pregnesin, Primogyl) sowie bei Kindern 5000 IE hCG/m2 Körperoberfläche (max. 5000 IE) und erneute Blutentnahmen nach 48 und/oder 72 Std. Beurteilung:Normal ist ein 1.5-2.5-facher Anstieg über basal bei Männern bis zum ca. 60. Lebensjahr bzw. ein Anstieg auf Werte > 9 ng/ml. Im Kindesalter vor Pubertätsbeginn sollten die Werte auf > 1 ng/ml (3.5 nmol/l) ansteigen. Beim Kryptorchismus bzw. beim primären Hypogonadismus erniedrigter Anstieg bei bereits vorher messbaren Testosteronkonzentrationen (Wert nach HCG-Gabe < 1 ng/ml). Erhöhter Anstieg beim sekundären Hypogonadismus sowie völlig fehlender Anstieg bei Anorchie. Helicobacter-Atemtest Indikation:V.a. Helicobacter-Besiedlung bei chronischer Gastritis Typ B, Ulcus ventriculi, Ulcus duodeni, Erfolgskontrolle ca. 4-6 Wochen nach Eradikationstherapie. Parameter:C13-/C12-Kohlendioxid - Differenz (Delta - Wert) in der Ausatemluft (Röhrchen durch unseren Materialversand erhältlich). Durchführung:Zwei Röhrchen werden für den Ausgangswert (Nullwert) mit Atemluft wie folgt befüllt: Verschlußkappe aufschrauben, einen Trinkhalm bis auf den Grund des Röhrchens stecken, normal einatmen, die Luft ca. 5 - 10 sec. anhalten, durch den Trinkhalm ausatmen und dabei den Trinkhalm langsam nach oben aus dem Röhrchen herausziehen. Röhrchen verschließen. Wiederholung der Prozedur mit dem 2. Röhrchen. Das C13-Harnstoff-haltige Pulver (ca. 75mg) durch Zugabe kalter Flüssigkeit (Apfel- oder Orangensaft) auflösen: die Lösung muß vollständig getrunken werden, ggfs. den Bodensatz durch Nachfüllen der Flüssigkeit auflösen und ebenfalls trinken. 30 min nach Einnahme der C13-Harnstoff nochmals 2 Röhrchen mit Atemluft befüllen Beurteilung:Normal: < 5 Promille Schwach positiv: 5-8 Promille Leicht positiv: 8-12 Promille Mittelgradig positiv: 12-16 Promille Stark positiv: >16 Promille 497 M. Funktionstests Hungerversuch Indikation:V.a. Insulinom Parameter:Glucose im NaF- oder Kapillarblut, Insulin und C-Peptid im hämolysefreien Serum (auch EDTA- oder Heparinplasma, innerhalb von 30 min. Zentrifugation der Probe, Serum bzw. Plasma abheben, möglichst gekühlter Transport (4–8 °C), besser tiefgefroren, vorher Kühlboxen im Labor anfordern!), ggf. Proinsulin (tiefgefroren) Durchführung:Beginn des Testes in der Regel mit der letzten Nahrungsaufnahme. Blutentnahmen für die Glucosebestimmung zu Beginn nüchtern sowie tagsüber alle 2 Stunden und nachts alle 4 Stunden bis zum Abfall der Glucosewerte ≤ 60 mg/ dl, dann Verkürzung des Blutentnahmeintervalles auf eine 1 h und Blutentnahme für Glucose, Insulin, C-Peptid (ggf. Proinsulin). Beendigung des Hungerversuches bei Glucosewerten < 40 mg/dl im Kapillarblut bzw. bei Glucosewerten ≤ 45 mg/dl im NaF-Blut bzw. bei Anzeichen einer Hypoglykämie. Am Ende des Testes nochmals Blutentnahme zur Bestimmung von Glucose, Insulin, C-Peptid (ggf. Proinsulin). Anschließend Gabe von 1 mg Glukagon i.v. und Bestimmung der Glucose im NaF-Blut nach 10, 20 und 30 min.. Achtung: Durchführung des Testes nur unter stationären Bedingungen und bei sofortiger Möglichkeit einer Infusion mit 20 % Glucose-Lösung! Absetzen aller nicht dringend erforderlichen Medikamente vor Testbeginn! Nahrungskarenz für ca. 48 – 72 Stunden, wobei der Patient sich in den wachen Stunden bewegen kann und Kalorien- und Koffein-freie Getränke erlaubt sind. Beurteilung:Bei Gesunden sollten die Glucosewerte nach 72 h nicht unter < 40 mg/dl im Kapillarblut bzw. nicht unter ≤ 45 mg/ dl im NaF-Blut abfallen. Der Insulinspiegel fällt auf sehr niedrige Werte < 6 mU/l, die C-Peptid-Werte fallen ebenfalls auf Werte < 0.7 µg/l ab, der Insulin-Glucose-Quotient bleibt konstant bzw. sinkt nach 24 Stunden auf Werte < 0.25 ab. Bei Patienten mit Insulinom liegen die Glucosespiegel nach 72 h i.d.R. < 40 mg/dl im Kapillarblut bzw. ≤ 45 mg/ dl im NaF-Blut mit entsprechenden klinischen Symptomen bei deutlichem Anstieg des Insulininspiegels auf Werte > 6 mU/l und des C-Peptidwerts auf Werte > 0.7 µg/l) sowie Anstieg des Insulin-Glucose-Quotienten auf Werte > 0.33. Die Mehrheit der Insulinom-Patienten haben Insulinwerte von 6 – 70 mU/l, wobei etwa 10% der Insulinompatienten mit einer Hypoglykämie Insulinwerte < 6 mU/l hatten Bei Insulinom-Patienten tritt eine Hypoglykämie zu 98% der Fälle innerhalb von 72 h ein. Die diagnostische Sicherheit des Hungerversuches wird durch die zusätzliche Glukagongabe und den folgenden Verlauf der Glucosewerte noch erhöht. Bei normalen Patienten ohne einen Hyperinsulinismus sind nach 72 h die Glykogenreserven der Leber erschöpft und nach Glukagongabe erfolgt kein signifikanter Anstieg der Glucosewerte. Steigen jedoch die Glucosewerte nach Glykagongabe um 25 mgg/dl an, spricht dies für einen pathologischen Hyperinsulinismus. Bei faktieller Insulinzufuhr sind die C-Peptid-Werte niedrig, hingegen bei Einnahme von Sulfonylharnstoffen die C-Peptid-Werte und der Insulinspiegel erhöht sind, so dass sich ggf. ein Nachweis dieser Substanzen im Serum empfiehlt. 498 M . F u n k t io n s t e s t s Fehlerqellen: Falsch-positive Ergebnisse beim Insulin-Glucose-Quotienten ergeben sich bei Patienten mit Insulinresistenz, so dass hier die Absolutwerte Berück­sichtigung finden. Weiterhin zu beachten ist, dass Frauen in den zweiten 24 Stun­den Glucosespiegel < 40 mg/dl haben können, ohne dass ein Insulinom vorliegt. (Globaler) Hypophysenstimulationstest mit Releasing-Hormonen Indikation:V.a. partielle oder komplette Hypophysenvorderlappeninsuffizienz verschiedenster Genese (entzündliche, degenerative Prozesse, Tumore, angeborene Störungen, Sheehan-Syndrom, Z.n. neurochirugischen Eingriff) Parameter:Cortisol, LH, FSH, Prolaktin, STH im Serum, ACTH im EDTA-Plasma (am besten EDTA-Blut zentrifugieren, Plasma abheben und einfrieren, vorher Kühlboxen beim Labor anfordern! Bitte Kunststoffröhrchen verwenden!) Durchführung:Morgens, nüchtern, zunächst Legen eines sicheren venösen Zugangs und vor Injektion erste Blutentnahme für die basalen Werte, dann Gabe von je 100 µg CRH, GHRH, LHRH und 200 µg TRH nacheinander i.v. und nach 15, 30, 60 und 90 erneute Blutentnahmen. Bestimmung von Prolaktin, LH, FSH und TSH nur zu den Zeitpunkten 0 und 30 min. Die Bestimmung von HGH sollte in allen Proben erfolgen. Kontraindikation: Überfunktion der Hypophyse, große Hypophysentumoren (Tumornekrose?), instabile Angina pectoris, frischer Myokardinfarkt, schwere obstruktive Atemwegserkrankung (jeweils für TRH-Stimulation) Nebenwirkungen: Flushsymptomatik, Harndrang, hämorrhagische Infarzierung von Hypophysenadenomen (jeweils auf TRH selten). Anmerkung: Bei V.a. Nebenniereninsuffizienz nach Ende des Testes Gabe von 30 mg Hydrocortison. Beurteilung:Diagnose von kompletten und partiellen HVL-Insuffizienzen unter Berücksichtigung der peripheren Hormonwerte ggf. auch Prüfung einzelner Funktionen. Beurteilung ACTH und Cortisol siehe unter CRH-Test, LH und FSH siehe unter LH-RH-Test, TSH siehe unter TRH-Stimulationstest, Prolaktin siehe unter Prolaktin-Stimulationstest (TRH-Test), HGH bzw. STH siehe unter GH-RH-Test. Fehlerqellen: Bei Adipositas kann der HGH-Anstieg abgeschwächt sein. Bei einer Hyperthyreose unter thyreostatischer Therapie kann TSH nach TRH noch bis zu 6 Monaten nach Therapiebeginn nicht stimulierbar sein. Bei Einnahme von Kontrazeptiva oder unter Testosteronsubstitution ist ein verminderter LH-/FSH-Anstieg zu erwarten. Insulinhypoglykämie-Test Indikation:Überprüfung der Hypophysenvorderlappenfunktion bezüglich der HGH-, ACTH- (Cortisol-) und Prolaktin-Sekretion unter Einschluss der Hypothalamusfunktion, DD: hypothalamische oder hypophysäre Ursache für eine HVL-Insuffizienz, V.a. auf HGH-Mangel bzw. Minderwuchs (Goldstandard). 499 M. Funktionstests Parameter:Human growth hormone (HGH, STH), Cortisol und Prolaktin im Serum, ACTH im EDTA-Blut (am besten EDTA-Blut zentrifugieren, Plasma abheben und einfrieren, vorher Kühlboxen beim Labor anfordern! Bitte Kunststoffröhrchen verwenden!), Glucose im NaF-Blut oder im kapillären Vollblut, bei V.a. HGH-Mangel nur HGH allein ausreichend. Durchführung:Morgens, nüchtern Legen eines sicheren venösen Zuganges, erste Blutentnahme bei 0 min., danach Injektion von 0.1 – 0.15 IE/kg Körpergewicht (bei Kindern 0.05 IE/kg Körpergewicht) Normalinsulin bzw. Altinsulin (Dosierung abhängig vom zuvor bestimmten Glucosewert bzw. ggf. höhere Dosis bei Akromegalie, Adipositas oder Cushing-Syndrom z.B. 0.2 – 0.3 IE/kg Körpergewicht.) und anschließend weitere Blutentnahmen im Abstand von 30 min. für 2 h oder nach 15, 30, 45, 90 u. 120 min., unmittelbar anschließend orale Nahrungsaufnahme und weitere Beobachtung des Patienten für ca. 1 Stunde. Der Test ist nur aussagekräftig, wenn die Glucosewerte < 40 mg/dl (< 2.2 mmol/l) liegen bzw. wenn die Glucosekonzentration auf 50 % des Ausgangswertes absinkt. Achtung!: Durchführung des Testes unter ärztlicher Aufsicht am liegenden Patienten, am besten unter stationären Bedingungen und bei sofortiger Möglichkeit einer Infusion mit 50 ml einer 20 % Glucose-Lösung oder einer Gabe von Glukagon! Innerhalb der ersten 5 – 30 min. nach Insulingabe treten häufig eine leichte Übelkeit, Blässe, Schwitzen oder sogar eine leichte Benommenheit auf. Bei Auftreten von neuroglykopenischen Symptomen wie Verwirrtheit und Desorientierung Abbruch des Testes und Gabe einer 20 %igen Glucoselösung. Unter Umständen unmittelbar vor der Glucoseinjektion noch Blutentnahme zur Bestimmung der Hormone. In Abhängigkeit vom klinischen Zustand des Patienten kann der Test ggf. nach Glucosegabe zu Ende geführt werden. Kontraindikation: Der Test ist bei zerebralem Anfallsleiden, koronarer Herzerkrankung, Vitium cordis, Herzrhythmusstörungen, bei Neugeborenen, Säuglingen und Kleinkindern < 4 Jahre und im Alter > 65 Jahre kontraindiziert. Beurteilung:Bei Gesunden gilt ein Anstieg des Cortisolspiegel um > 8 µg/dl (> 200 nmol/l) und ein maximaler Cortisolswert > 20 µg/dl (550 nmol/l) bzw. der Anstieg des Cortisolspiegel um mindestens 50 % als normal. Auch beim ACTH sollte ein Anstieg der Werte um mindestens 50 % bzw. auf Werte > 150 ng/l erfolgen. Die HGH-Konzentration sollten zum Ausschluß einers hypophysären HGH-Mangels im Kindesalter nach 30-45 min. auf Werte > 10 ng/ml ansteigen, wobei HGH-Werte > 20 ng/ml einen Mangel absolut ausschließen. HGH-Werte von 5 – 9 ng/ml weisen auf eine partiellen, HGH-Werte < 5 ng/ml auf einen kompletten HGH-Mangel hin. Bei Erwachsenen hat keine gesunde Person im Insulinhypoglykämie-Test einen HGH-Gipfelwert von < 5 ng/ml und ein HGH-Anstieg ≤ 3 ng/ml gilt als sicherer Nachweis eines schweren HGH-Mangels. Zusammen spricht ein fehlender Anstieg von HGH und ACTH für eine hypothalamische Schädigung, wenn nach Gabe von Relasing-Hormonen im Hypophysen­stimulationstest ein Anstieg der Hormone erfolgt. Bei primär oder gleichzeitig bestehender hypophysärer Schädigung bleibt auch dieser Hormonanstieg aus. 500 M . F u n k t io n s t e s t s Kochsalzinfusionstest Indikation:DD: psychogene Polydipsie, partieller zentraler Diabetes insipidus, partieller nephrogener Diabetes insipidus (sog. Goldstandard der DD Polydipsie/Polyurie auch Hickey-Hare-Test gennannt). Parameter:Serumosmolalität und ggf. Natrium im Serum, Antidiuretisches Hormon (ADH) im EDTA-Blut (EDTA-Blut möglichst nach ca. 30 min. zentrifugieren, EDTA-Plasma einfrieren und Transport in Spezialkühlboxen zum Labor!) Durchführung:Infusion einer 5%igen Kochsalzlösung (0.06 ml/kg/min.) über 2 Stunden, Blutentnahmen zum Zeitpunkt 0, 30, 60, 90, 120 min. Nebenwirkungen: Während des Testes können Kopfschmerzen, Schwindelgefühle und Benommenheit auftreten. Kontraindikation: Dehydration und/oder Natriumwerte > 150 - 155 nmol/l bzw. Abbruch des Testes! Beurteilung:Normaler Anstieg der ADH-Konzentration auf 3 – 8 ng/l (basal 0.3 – 0.8 ng/l) bei Gesunden und bei psychogener Polydipsie. Beim zentralen Diabetes insipidus erfolgt trotz einer Serumosmolalität > 295 mosmol/kg kein Anstieg der ADH-Konzentration sowie beim partiellen Diabetes insipidus ein subnormaler oder verzögerter Anstieg von ADH. Im Falle eines nephrogenen Diabetes insipidus ist die Serumosmolalität (> 295 mosmol/kg) basal bereits erhöht, ADH ebenfalls bereits basal erhöht und es erfolgt ein weiterer deutlicher bis überschießender Anstieg von ADH nach NaCl-Infusion. Kreatinin-Clearance Indikation:Nierenfunktionseinschränkungen z.B. bei Hypertonie, Diabetes, Gicht, Nierensteinen, chronischer Nierenanamnese. Pathologische Werte auch bei normalem Serumkreatinin möglich. Parameter:Kreatinin im Serum und Sammelurin Durchführung:Sammeln des Urins über 24-h z.B. von 7.00 bis 7.00 Uhr, Blutentnahme idealerweise zu Beginn und zum Ende der Sammelperiode zur Mittelwertbildung. Beurteilung:Feststellung einer reduzierten Kreatinin-Clearance mit Hilfe der Clearanceformel (Ergebnis wird berechnet), altersund geschlechtsabhängige Normwerte siehe Befundbericht. Laktose-Belastung, Laktosetoleranztest Indikation:V.a. Laktosemalabsorption durch primären oder sekundären Laktasemangel Parameter:Glucose im NaF-Blut oder Kapillarblut, H2-Konzentration in der Ausatemluft Durchführung: Erste Blutentnahme und Atemprobe nüchtern, dann orale Gabe von 50 g Laktose (in 300 ml Wasser oder Tee), bei Kindern 2 g/kg Körpergewicht maximal 50 g, anschließend weitere Blutentnahmen und Atemproben nach 15, 30, 60, 90 und 120 min. 501 M. Funktionstests Beurteilung:Normal sind H2-Atemwerte < 20 ppm und ein Glucose-Anstieg im venösen Vollblut > 20 mg/dl (im Kapillarblut > 25 mg/dl) bezogen auf den Ausgangswert. Treten H2-Atemwerte >20 ppm nach 30 min und später auf , bestehen gastrointestinale Symptome und fehlt ein Blutglucoseanstieg, so besteht sehr wahrscheinlich eine Laktoseintoleranz. (Bei v.a. primäre Laktoseintoleranz kann auch der Laktase-Gen-Test im EDTA-Blut durchgeführt werden) LH-RH-Test (GnRH-Test) Indikation:V.a. Hypogonadismus und Ovarialinsuffizienz; DD: zwischen niedrig normalen und pathologischen FSH- und LH-Werten, DD: hypophysärer oder hypothalamischer Hypogonadismus, DD: Pseudopubertas praecox (gonadotropinunabhängige bzw. periphere PP) oder Pubertas praecox vera (gonadotropinabhängig bzw. zentrale PP) oder praemature Pubarche, DD: konstitutionelle Pubertas tarda bzw. Entwicklungsverzögerung (KEV) und idiopathischer hypogonadotroper Hypogona­dismus, Einsatz im Rahmen eines (globalen) Hypophysenstimulationstests bei V.a. (partielle) Hypophyseninsuffizienz. Parameter:LH, FSH im Serum Durchführung:Zunächst Blutentnahme, dann Gabe von 100 µg LH-RH i.v. (z.B. LHRH-Ferring, Relefact LHRH 0.1) bei Erwachsenen (bei Frauen können auch 25 µg eingesetzt werden), weitere Blutentnahmen nach 30 bei Frauen und nach 45 oder 60 min. bei Männern. Bei Kindern werden 60 µg/m2 Körperoberfläche bzw. mindestens 25 µg und maximal 100 µg LHRH injiziert und es erfolgt nur eine weitere Blutentnahme nach 30 min.. Im Falle eines länger bestehenden hypothalamisch bedingten Hypogonadismus ggf. Testwiederholung nach 36-stündiger pulsatiler Applikation von LHRH (5 µg alle 90 min. von 18 Uhr bis 6.00 Uhr am übernächsten Tag). Beurteilung:Bei Frauen ist für LH ein Anstieg auf > 2-8-fache Werte (Anstieg der LH-Konzentrationen in Abhängigkeit von der Zyklusphase und Androgenstatus z.B. überschießender LH-Anstieg bei Hyperandrogenämie) und bei FSH auf Werte > 2-3fach normal. Männer zeigen einen 1.5-f bis 3-fachen Anstieg bei LH und bei FSH oft nur einen geringen Anstieg bis auf 1.5-fach erhöhte Basalwerte. Ein völliges Fehlen eines Anstieg nach Vorbehandlung mittels pulsatiler LHRH-Applikation beweist eine hypophysäre Insuffizienz. Bei hypothalamischen Hypogonadismus zeigt sich nach der pulsatilen Vorbehandlung mit LH-RH ein Anstieg der Gonadotropine. Bei Kindern ist der Anstieg von LH abhängig vom chronologischen Alter und vom Pubertätsstadium, wobei ein LH/ FSH-Quotient < 1 bei den stimulierten Werten normal ist bzw. einem praepubertärem Zustand entspricht. Ein LH/ FSH-Quotient > 1 (entspricht dem Quotienten bei Erwachsenen) findet sich bei der zentralen Pubertas praecox, nicht jedoch bei der Pseudopubertas praecox und der praematuren Pubarche. Bei konstitutioneller Pubertas tarda bzw. Entwicklungsverzögerung (KEV) ist ein LH/FSH-Anstieg nachweisbar, hingegen beim idiopathischen hypogonadotropen Hypogonadismus ein LH/FSH-Anstieg ausbleibt und eine Testwiederholung nach pulsatiler LHRH-Gabe durchgeführt werden sollte. 502 M . F u n k t io n s t e s t s Metopiron-Kurztest Indikation:V.a. sekundäre/tertiäre Nebennierenrindeninsuffizienz bei Erkrankungen der Hypophyse und/oder des Hypothalamus Parameter:11-Desoxycortisol und Cortisol im Serum, ACTH im ACTH-Plasma (am besten EDTA-Blut zentrifugieren, Plasma abheben und einfrieren, vorher Kühlboxen beim Labor anfordern! Bitte Kunststoffröhrchen verwenden!) Durchführung:Um 23.00 oder 24.00 Uhr Einnahme von 30 mg Metopiron/kg Körpergewicht (in Kapseln à 250 mg/maximal 2 g) zusammen mit einer kleinen Mahlzeit (z.B. 1 Glas Milch und 1 Scheibe Brot) und am nächsten Morgen Blutentnahme um 8.00 Uhr. Achtung: Durchführung am besten nur unter stationären Bedingungen, da bei Patienten mit niedrigen basalen Cortisolwerten eine akute NNR-Insuffizienz auftreten kann. Kontraindikationen: Neugeborene, Säuglinge, Kleinkinder (Hypoglykämierisiko!) Beurteilung:Ein Anstieg des 11-Desoxycortisols von sehr niedrigen Werten (< 1 ug/l bzw. 1 –2 nmol/l) auf Werte > 70 ug/l (180 nmol/l), ein Abfall des Cortisols auf Werte < 8 ug/dl und ein Anstieg von ACTH > 200 ng/l nach Metopiron-Gabe ist normal. Ein subnormaler Anstieg von 11-Desoxycortisol spricht für eine primäre oder sekundäre Nebenniereninsuffizienz (Differenzierung nicht möglich), ein normaler bis übermäßger Anstieg (>220-fach) für ein zentrales CushingSyndrom und ein ausbleibender Anstieg für einen autonomen NNR-Tumor oder eine ektope ACTH-Produktion. Die gemeinsame Bestimmung von 11-Desoxycortisol, Cortisol und ACTH erlaubt eine sichere Bewertung von hypothalamisch-hypophysären Störungen der Hypophysen-NNR-Achse. Der Metopiron-Test entspricht in seiner Wertigkeit dem Insulinhypoglykämie-Test, wobei für den Patienten weniger Nebenwirkungen und Risiken bestehen. Fehlerqellen: Vortäuschung eines zentralen Cushing-Syndroms durch vermehrte Bildung von 11-Desoxycortisol nach Metopiron-Gabe bei großen hormonaktiven NNR-Tumoren. Unter Einnahme von Medikamenten, die zu einer Enzyminduktion in der Leber führen (z.B. Phenytoin, Carbamazepin, Phenobarbital, Rifampicin etc.) kommt es durch eine Beschleunigung des Metopiron-Metabolismus zu einer unzureichenden Hemmung der 11ß-Hydroxylase. Diese Medikamente sollten vor dem Test abgesetzt werden. Falls nicht möglich, weist bei diesen Patienten ein morgendlicher Cortisolwert < 10 µg/dl dennoch auf eine ausreichende Suppression durch Metopiron und somit auf einen auswertbaren Test hin. Auch bei ca. 4% der Gesunden führt ein beschleunigter Metopironabbau zu falsch negativen Testergebnissen, erkennbar am unzureichenden Abfall von Cortisol (Cortisol > 7,5 ug/dl). 503 M. Funktionstests Prolaktin-Stimulationstests (Metoclopramid, TRH) Indikation:V.a. latente Hyperprolaktinämie (meist nur nächtliche Prolaktinerhöhung bei noch normalen Tagesspiegeln von Prolaktin), welche bei Frauen zu Zyklusstörungen wie Oligomenorrhoe, zu Anovulation, Corpus luteum-Insuffizienz und Infertiltität führen kann, wiederholte Messung von leicht erhöhten Prolaktinspiegeln (20 – 30 ng/ml bzw. 424 – 636 mIE/l) nach Auschluß einer latenten Hypothyreose und bei unauffälliger Medikamentenanamnese (keine Therapie mit prolaktin­freisetzenden Medikamenten wie Neuroleptika, Antidepressiva, Antihypertonika, Östrogene etc.). Parameter:Prolaktin im Serum 1. Metoclopramid-Test (Paspertin-Test): Durchführung:Blutentnahme nüchtern 2 – 4 h nach dem Aufstehen bzw. zwischen 8.00 und 10.00 Uhr für den basalen Prolaktinspiegel, Gabe von 10 mg Metoclopramid (MCP, Paspertin) i.v., 2. Blutentnahme nach 30 min. (ggf. auch nach 45 u. 60 min.). Bei Frauen sollte der Test in der frühen Follikelphase (3.-6. Zyklustag) oder in der Mitte der Lutealphase (20.-22. Zyklustag) durchgeführt werden. Nebenwirkungen: Müdigkeit (cave: Fahrtüchtigkeit!), Kopfschmerzen, Schwindel, Diarrhoe, allergische Reaktion. Beurteilung:Normal ist ein basaler Prolaktinspiegel < 20 ng/ml (424 mIU/l) sowie ein Anstieg von Prolaktin auf einen Wert < 200 ng/ml (< 4240 mIU/l) in der Follikelphase (Lutealphase < 424 ng/ml bzw. 9000 mIU/l) nach Metoclopramid. Bei normalem basalen Prolaktinspiegel und erhöhtem Anstieg von Prolaktin nach Metoclopramid liegt eine latente Hyperprolaktinämie vor. Ist der basale als auch der stimulierte Prolaktinspiegel erhöht, liegt eine manifeste Hyperprolaktinämie vor. Anmerkung: Die Relevanz einer durch den Metoclopramid-Test entdeckten latenten Hyperprolaktinämie ist heute umstritten. Auch spielt die Bedeutung dieses Testes heute in der gynäkologischen Endokrinologie eine eher untergeordnete Rolle. 2. TRH-Test: Durchführung:Blutentnahme nüchtern 2 – 4 h nach dem Aufstehen bzw. zwischen 8.00 und 10.00 Uhr für den basalen Prolaktinspiegel, Gabe 200 µg TRH (z.B. TRH Ferring, Antepan, Relefact TRH 200), 2. Blutentnahme nach 30 min. (ggf. auch nach 45 u. 60 min.). Bei Frauen sollte der Test in der frühen Follikelphase (3.-6. Zyklustag) oder in der Mitte der Lutealphase (20.-22. Zyklustag) durchgeführt werden. Kontraindikation und Nebenwirkungen: siehe unter TRH-Stimulations-Test. Beurteilung:Normal ist ein basaler Prolaktinspiegel < 20 ng/ml (424 mIU/l) sowie ein Anstieg von Prolaktin auf Werte zwischen 100 - 200 ng/ml (2120 - 4240 mIU/l) nach TRH-Gabe. Bei normalem basalen Prolaktinspiegel und erhöhtem Anstieg von Prolaktin nach Metoclopramid liegt eine latente Hyperprolaktinämie vor. Ist der basale als auch der stimulierte Prolaktinspiegel erhöht, liegt eine manifeste Hyperprolaktinämie vor. 504 M . F u n k t io n s t e s t s Quecksilber-Mobilisationstest (DMPS-Mobilisations-Test) Indikation:V.a. Quecksilberbelastung durch Amalgam Parameter:Kupfer und Quecksilber im Spontanurin Durchführung:Gabe von 10 mg DMPS (Dimaval)/kg Körpergewicht als Kapsel oral oder 3 mg DMPS/kg Körpergewicht i.v., anschließend sollte der Patient 150 ml Flüssigkeit oral aufnehmen, gewinnen von 10-20 ml Spontanurin nach 30-45 min. nach Gabe von DMPS i.v. bzw. nach 2 h nach oraler Gabe von DMPS. Kontraindikation: Eingeschränkte Nierenfunktion (Kreatinin im Serum > 2.5 mg/d). Nebenwirkungen: Nach i.v.-Injektion von Dimaval kann es bei ca. 1 % der Patienten zu einer flüchtigen Hautreaktion kommen. Cave: vegetativ sehr labile Patienten können einen Kollaps erleiden. Beurteilung:Eine Quecksilberausscheidung > 50 µg/g Kreatinin spricht für eine Quecksilber­belastung durch Amalgam. Bei geringer Quecksilberausscheidung < 50 µg/g Kreatinin und stark erhöhten Kupferwerten (> 2500 µg/g Kreatinin) ist ein erneuter DMPS-Test zu empfehlen (zur weiteren Mobilisation der Quecksilberdepots). TRH-Stimulationstest Indikation:V.a. hypophysäre oder hypothalamische Störung (DD: sekundäre und tertiäre Hypothyreose), bei Patienten mit einer „non-thyroidal illnes (NTI) und gleichzeitigem Verdacht auf eine Schilddrüsenerkrankung, (Test zur Stimulation von Prolaktin siehe unter Prolaktin-Stimulationstest, TRH-Test). Parameter:TSH im Serum Durchführung:Erste Blutentnahme nüchtern, dann Gabe von 200 µg (400 µg) TRH i.v. bei Erwachsenen (bei Kindern 7 ug/kg Körpergewicht) in 2 min und 2. Blutentnahme nach 30 min (nur bei Erwachsenen alternativ nasale Applikation von 2 mg TRH und Blutentnahme nach 30 min bis zu 2 Std. oder orale Gabe von 40 mg TRH und Blutentnahme nach 3-4 Std.). Zur Differenzierung zwischen hypophysärer (sekundärer) und hypothalamischer (tertiärer) Hypothyreose sind weitere Blutentnahmen nach 60, 90 und 120 min. erforderlich (bei tertiärer Hypothyreose TSH-Maximun verzögert erst nach 90 -120 min.). Kontraindikation: schwere Überempfindlichkeitsreaktion bei vorheriger TRH-Gabe, instabile Angina pectoris, erhöhte Krampfbereitschaft, ausgeprägte Bronchialobstruktion, akuter Herzinfarkt, bekanntes Hypophysenmakroadenom. Nebenwirkungen: > 10% Wärme-Hitzegefühl, Übelkeit bis Erbrechen, Harndrang, milde Kopfschmerzen, Benommenheit, Mißempfindungen (Abdominal- u. Beckenorgane), < 1% Engegefühl in der Brust, Mißempfindungen an den Extremitäten, Geschmacksstörung, Mundtrockenheit, Hungergefühl, Puls- und Blutdruckanstieg. 505 M. Funktionstests Beurteilung: Normal ist ein TSH-Wert von 2-25 µIU/ml (nach oraler Gabe bis 30 µIU/ml). Sofern auch die peripheren Schilddrüsenhormone im Normbereich liegen, ist eine Funktionsstörung des Regelkreises Hypophyse/Schilddrüse ausgeschlossen. Eine fehlende TSH-Antwort (< 2 µIU/ml) bei erniedrigten T4- und T3-Werten kann auf eine sekundäre bzw. hypophysär bedingte Hypothyreose hinweisen. Im Falle einer hypophysären Störung ist der TSH-Anstieg bei großen Hypophsentumoren oft erniedrigt oder niedrig normal. Eine Ausnahme können supraselläre Tumoren darstellen, hier kann der TSH-Anstieg nach TRH gelegentlich normal oder sogar erhöht sein. Bei Vorliegen einer hypothalamischen Störung zeigt sich ein Anstieg von TSH, der jedoch verzögert sein kann. Eine fehlende TSH-Antwort und normale T4und T3-Werte bei klinischer Euthyreose könnten für eine Störung des Regelkreises Hypophyse/Schilddrüse bei beg. thyreoidaler Autonomie oder bei Frühform eines M. Basedow sprechen (DD: Therapie mit Schilddrüsenhormonen). Erhöhte T4- und T3-Werte bei fehlender TSH-Antwort sind ein Hinweis auf eine klinisch manifeste Hyperthyreose (DD: Therapie mit Schilddrüsenhormonen). Ein TSH-Anstieg > 25 µIU/ml (nach oraler Gabe bis 30 µIU/ml) bei erniedrigten T4-und T3-Werten zeigt eine manifeste Hypothyreose an. Normale T4- und T3-Werte bei einer überschießenden TSH-Antwort könnten ein Hinweis auf eine latente Hypothyreose, eine Jodverwertungsstörung, auf einen extremen Jodmangel oder eine Frühform der chronischen Thyreoiditis sein. Fehlerquellen: Bei jeder Beurteilung müssen auch folgende extrathyroidale Faktoren berücksichtigt werden: – Unter Östrogenzufuhr zeigt sich eine veränderte TSH-Antwort. – Eine verminderte TSH-Anwort kann vorliegen beim Cushing-Syndrom, unter Glukokortikoidtherapie, bei einem Wachstumshormonexzess, bei Hyper­calzämie, bei totalem Fasten, bei schweren extrathyreoidalen Erkrankungen, bei psychiatrischen Kankheiten, unter der Gabe von Schilddrüsenhormonen und unter verschiedenen Medikamenten wie Dopamin oder Psychopharmaka. – Eine verstärkte TSH-Antwort kann vorliegen beim M. Addison, bei einem Mangel von Wachstumshormon oder unter Einnahme von Metoclopramid. Wachstumshormon-Hemmtest (HGH, STH) mittels (oralem) Glucose-Toleranztest (OGTT) mit 75 g Indikation:V.a. HGH-Exzess bzw. Akromegalie, Hochwuchs im Kindesalter Parameter:Human-growth-hormone (HGH) bzw. somatotropes Hormon (STH) im Serum Durchführung:Wie OGTT mit 75 g Glucose: Erste Blutentnahme morgens nüchtern beim sitzenden oder liegenden Patienten nach mind. 10 - 16 Stunden Nahrungskarenz (kein Alkohol und kein Rauchen vor dem Test, kein Rauchen während des Testes), orale Gabe von 75 g Glucose in ca. 250 - 300 ml Wasser oder Tee (Kinder erhalten 1,75 g/kg Körpergewicht (max. 75 g) in einem Zeitraum von ca. 3 – 5 min., weitere Blutentnahme nach 30, 60, 90 und 120 min. (ggf. bis zu 3h). 506 M . F u n k t io n s t e s t s Achtung: Voraussetzung für eine verlässliche Aussage des oralen Glucose-Toleranztestes ist vor Testbeginn eine ausreichende Zufuhr von Kohlenhydraten (> 150 g pro die) sowie eine normale körperliche Aktivität (z. B. kein Z.n. Bettlägerigkeit oder nach übermäßiger körperlicher Anstrengung). Weiterhin sollten störende Medikamente sofern möglich abgesetzt werden und ein Abstand von mindestens drei Tagen zur Menstruation eingehalten werden. Weitere Störfaktoren siehe unter (oraler) Glucose-Toleranztest (OGTT). Beurteilung:Mit ansteigenden Blutglucosewerten erfolgt eine Suppression des HGH-Spiegels. Zum Ausschluß einer Akromegalie sollte der HGH-Spiegel zu einem beliebigen Zeitpunkt nach Glucoseeinnahme auf einen Wert < 1 ng/ml supprimiert werden (bei ultrasensitiven Testen < 0.3 ng/ml). Eine fehlende Suppression oder ein paradoxer Anstieg von HGH zusammen mit einem erhöhtem IGF-I-Wert spricht für eine Akromegalie. Bei Akromegalie unter Somatostatinanaloga sollte zum Nachweis einer „biochemischen Heilung“ HGH nach Glucosegabe bzw. OGTT < 1 ng/ml liegen und der IGF-I-wert normalisiert sein. Eine Akromegalie kann ausgeschlossen werden, wenn eine Zufalls-HGH-Bestimmung bei < 0.4 ng/ml liegt und der IGF-I-Wert für Alter und Geschlecht im Normbereich liegt. Fehlerquellen: Ungenügende oder. fehlende Suppression und/oder paradoxer Anstieg von HGH im OGTT bei Lebererkrankungen, Niereninsuffizienz, Diabetes mellitus, Fehlernährung, Anorexie, Gravidität, Streß und Östrogentherapie. Die Sensitivität des Testes liegt bei etwa 90%. Wachstumshormon-Stimulationstest (HGH-, STH-Stimulationstest) Indikation:V.a. HGH-Mangel bzw. Minderwuchs im Kindesalter, V.a. (partielle) Hypophyseninsuffizienz Parameter:Human-growth-hormone (HGH) bzw. ­somatotropes Hormon (STH) im Serum Der Goldstandard für eine Stimulation von HGH ist der Insulinhyopglykämie-Test (Einzelheiten siehe dort). GH-RHStimulationstest und Arginin-Cl-Test siehe dort. Weitere Provokationsteste zur Stimulation von HGH sind z.B. GHRH+Arginin-Test, Clonidin-Test, Test nach körperlicher Belastung: Prinzip: GHRH+Arginin-Test: GHRH stimuliert die HGH-Sekretion aus der Hypophyse, während Arginin gleichzeitig die Somatostatin-Sekretion hemmt, welche normalerweise eine Hemmung der HGH-Sekretion bewirkt. Der GHRH+ArgininTest gilt als dem Insulinhypoglykämie-Test diagnostisch gleichwertig! Durchführung:Blutentnahme am Patienten nach mind. 12 h Nahrungskarenz am besten morgens zw. 8.00-9.00 Uhr, Gabe von 1 µg GHRH/kg Körpergewicht als Bolus i.v. und von 0.5 g Arginin/kg Körpergewicht (max. 30 g) in 500 ml 0.9%-NaCLLösung über 30 min., weitere Blutentnahmen 15, 30, 45, 60 und 90 min. nach Bolusgabe von GHRH . Nebenwirkungen: Bei ca. 20% der Patienten treten (kurze) Gesichtsrötungen sog. Flushs auf,häufig bei älteren Kindern. 507 M. Funktionstests Kontraindiaktion: Entgleister Diabetis mellitus Anmerkung: Bei einer hypothalamischen Störung, während der längere Zeit keine Stimulation der Hypophyse mit GHRH erfolgte, kann es trotz intakter Hypophysenfunktion zu einer ungenügenden Sekretion von HGH nach GH-RH kommen. In diesem Fall sollte der GH-RH-Test erst nach mehrfacher Gabe von GH-RH 1 µg/kg Körpergewicht s.c. über z.B. 5 Tage durchgeführt werden (ansonsten falsch-positver Test). Beurteilung : Achtung: für Erwachsene gelten andere Cut-off-Werte als für Kinder (siehe unter Beurteilung am Ende): BMI < 25 kg/m2: 11 ng/ml BMI 25-30 kg/m2: 8 ng/ml BMI > 30 kg/m2: 4 ng/ml Ein HGH-Anstieg unter diese Cut-off-Werte spricht für einen hypophysären HGH-Mangel. Bei einem Anstieg von HGH auf Werte im Bereich 11-16.5 ng/ml kann ein partieller HGH-Mangel vorliegen. Prinzip: Clonidin-Test: Katecholaminerge Substanz, welche die HGH-Sekretion der Hypophyse stimuliert. Durchführung:Blutentnahme am Patienten nach mind. 12 h Nahrungskarenz am besten morgens, Gabe von 0.075 mg/m2 Körperoberfläche Clonidin (Catapresan) oral, weitere Blutentnahmen nach 30, 60, 90, 120 und ggf. nach 150 und 180 min. Der Patient sollte während und nach dem Test unter Beobachtung stehen. Nebenwirkung: Somnolenz und Müdigkeit, in 2-3% der Fälle Hypoglykämien. Ein Blutdruckabfall ist erst ab einer Dosis vom 0.15 mg/m2 Körperoberfläche zu erwarten. Anmerkung: Der Test sollte über 3 h durchgeführt werden, da die HGH-Stimulation individuell sehr unterschiedlich sein kann. Prinzip: Test nach körperlicher Belastung: Durch körperliche Belastung erschöpfen sich die Kohlenhydrat-und Glykogenreserven, nach ca. 20-30 min. erfolgt daher eine vermehrte Sekretion von HGH und mittels Lipolyse werden Fettsäuren zur Verbrennung bereitgestellt Durchführung:Blutentnahme am Patienten nach mind. 12 h Nahrungskarenz am besten morgens, anschließemd körperliche Belastung für 10 min. auf dem Fahrradergometer (1-2 W/kg KG), durch Treppensteigen oder andere kontrollierbare Anstrengungen. Nach einer Ruhepause von 20 min. erneute Blutentnahme. Der Test sollte unter Beobachtung durchgeführt werden Kontraindikation: Evtl. Herzinsuffizienz und Vitium cordis Nebenwirkungen: Selten Erschöpfung, Kollaps . Anmerkung: Der Test ergibt in 70 – 90 % der Fälle eine klare und zuverlässige Ausssage bei seltenem Auftreten von Nebenwirkungen. Aufgrund der längeren Dauer des Testes wird dieser seltener durchgeführt. Cave: Bei Kindern mit konstitutioneller Entwickungsverzögerung zeigt sich in ca. 30 % der Fälle ein ungenügender HGH-Anstieg. 508 M . F u n k t io n s t e s t s Beurteilung:Normal ist ein Anstieg von HGH auf Werte > 10 ng/ml, wobei ein Anstieg auf HGH-Werte > 20 ng/ml einen HGHMangel ausschließt. Bei HGH-Mangel liegen die HGH-Werte nach Stimulation < 5 ng/ml. HGH-Werte zwischen 5 – 9 ng/ml weisen auf einen partiellen Mangel an HGH hin. Zum sicheren Nachweis eines HGH-Mangels bei V.a. Minderwuchs, sollten zur Diagnosesicherung die HGH-Werte in zwei Provokationstesten < 10 ng/ml liegen. Beim Erwachsenen sollten zum Nachweis eines isolierten HGH-Mangels jeweils zwei Provokationsteste durchgeführt werden. Liegen gleichzeitig weitere Ausfälle von Hypophysenhormonen vor, wird die Durchführung von nur einem Stimulationstest als ausreichend empfohlen (lt. Konsensusrichtlinien der Growth Hormone Research Society). (D-) Xylose-Toleranztest Indikation:V.a. Malabsorptionssyndrom, V.a. Störung der funktionellen Integrität des oberen Dünndarmes. Parameter:quantitative D-Xyloseausscheidung im 5-h-Sammelurin, D-Xylose im NaF-Blut (Serum) Durchführung:Der nüchterne Patient trinkt nach Blasenentleerung 25 g D-Xylose in 300 ml Wasser (und zusätzlich 300 ml Wasser oder Tee zur ausreichenden Diurese). Anschließend beginnt die 5-stündige Sammelperiode des Urins und es werden nach 15, 60 und 120 min. Blutproben entnommen. Nebenwirkungen: Symptome der Kohlenhydratintoleranz wie Blähungen, Diarrhoe, Flatulenz und Nausea. Beurteilung:Normal liegen die Werte für D-Xylose vor Belastung im Urin < 30 mg/d und nach D-Xylose-Gabe sollten mehr als 16 % ausgeschieden werden. Im Serum und NaF-Blut ist ein D-Xylose-Wert < 0.1 mg/dl nüchtern normal und nach D-Xylose-Belastung sollten die Werte nach 15 min > 10 und nach 1 h > 20 mg/dl und 2 h > 30 mg/dl liegen. Eine ungenügende D-Xylose-Ausscheidung im Urin bzw. ein ungenügender Anstieg der D-Xylose im Serum spricht für eine Erkrankung des Duodenums/Jejunums, wobei ein normaler Test eine intestinale Malabsorption nicht ausschließt. Der D-Xylose-Test kann eine Kohlenhydratresorptionsstörung (Monosaccaride) im proximalen Dünndarm erfassen (nicht detektiert werden primäre Kohlenhydratintoleranzen, z.B. Lactase- oder Saccharase-IsomaltaseMangel) und dient der Abgrenzung pankreasbedingter Maldigestion. Bei einer chronischen Pankreatitis ist der D-Xylose-Test normal. Ein pathologischer D-Xylose-Test und eine Steatorrhoe weisen auf eine Malabsorption hin, wobei die häufigste Ursache die einheimische Sprue (Zöliakie) darstellt. Seltenere Erkrankungen mit pathologischem D-Xylose-Test sind Amyloidose, Z.n. Dünndarmresektion, Bypassoperation, intestinales Lymphom, Sklerodermie, Strahlenenteritis, M. Whipple, Dermatitis herpetiformis, Karzinoid-Syndrom, Zollinger-Ellison-Syndrom, Malabsorption bei Mucosaschädigung durch Pharmaka wie Neomycin. Bei einem pathologischen D-Xylose-Test zusammen mit einer erhöhten Stuhlfettausscheidung und einer auffälligen Zottenmorphologie sollte an eine bakterielle Überbesiedlung des Dünndarmes gedacht werden. Fehlerquellen: Der D-Xylose-Test wird falsch-positiv durch unvollständige Urinsammlung, bei inkompletter Blasenentleerung, bei Erbrechen, Alkoholzufuhr oder Nahrungsaufnahme während des Testes, bei Niereninsuffizienz, Aszites, 509 M. Funktionstests Hypothyreose, perniziöser Anämie, Cholestase, mangelnder Hydration, vermindertem effektivem Zirkulationsvolumen, gestörter Magen-Darmpassage, bakterieller Überbesiedlung des Dünndarmes, bei Einnahme von Aspirin, Phenformin und Indometacin. Der D-Xylose-Test fällt falsch-negativ aus bei chron. Alkoholabusus und bei Leberzirrhose mit Aszites. 510 N. Index Alle Untersuchungsverfahren in alphabetischer Ordnung finden Sie in Kapitel D. Der nachfolgende Index bezieht sich auf zusätzliche Informationen der übrigen Kapitel. A Abortus imminens 442 Abstrichtupfer 19 Abszefl, bartholinischer 29 ACTH-Belastungstest 479 Adeno-CA 460 Adenoviren 439 Adrenogenitales Syndrom (AGS) 479 AFP 449 Akromegalie 506 Aldosteron-Orthostase-Test 481 Aldosteron-produzierendes Nebennierenadenom 480, 481, 483, 489 Aldosteron-Suppressionstest (Kochsalzbelastungstest) 480 Alkal. Plazenta-Phosphatase 449 Alpha-1-Fetoprotein 449 Amenorrhoe 484 AML 459 Anaerobier 20, 26 Anaerobierinfektionen 23 Analkarzinom 457 Androgen/Östrogen produzierender NNR-Tumor 459 Antiphospholipidsyndrom 476 475 Antithrombin-Mangel 474, 475 APC-Resistenz 474, 475 APUDome 460 Arginin-Cl-Test 482, 507 Arthritis 464 atypische Mykobakterien 24 Autoantikörper, Indikationen für Bestimmung 461 Autoimmune Hepatitis 462 Autoimmunthyreoiditis 469 Autonomie der Schilddrüse 469 B BACTEC 20, 31 Bakteriämie 22 Bartholinischer Abszefl 29 Baumpollen 421 Bechterew-Erkrankung 464 Beta-2-Mikroglobulin 449 Beta-HCG 450 Blasenmole 460, 470 Blasenpunktionsurin 26 Blutentnahme 13 Blutgerinnungsstörungen 473 Blutkultur 19, 29 Bronchialkarzinom 457 Bronchialsekret 22 Bronchoskopiematerial 22 Bürstenbiopsie 23 C CA 15-3 450 CA 19-9 451 CA 50 451 CA 72-4 451 CA 125 450 CA 549 451 Calcitonin 452 Calcitonin-Stimulationstest 482 Campylobacter 20 Candida spp., Antigennachweis 30 Captopril-Stimulationstest 483 Carcinoembryonales-Antigen 452 Cardiolipin - AK 475 CEA 452 Cerealien und Mehle 424 CgA 452 Chlamydien 20 Chlamydien-Diagnostik 27 cholangiozelluläres Adeno-CA 458 Cholera 28 Chorion-CA 458, 460 Chromogranin A 452 Chromosomenanomalien 444 CLL 459 Clomifen-Test 484 Clonidintest 484 Clonidin-Test 508 Clostridium difficile 20 CML 459 511 N. Index Colitis ulcerosa 462 Collagenbindungs-Aktivität 477 Conn-Syndrom 483, 489 Corticotropin-Releasing-Hormon-Test (CRH-Test) 485 Cortisol -Tagesprofil 485 Coxsackie-Viren 439 CREST-Syndrom 461, 465 Cryptosporidien 20 CT 452 Cushing-Syndrom 485 CYFRA 21-1 452 Cytomegalie-Virus 439 E ECHO-Viren 439 Eisenmangelanämie 489 Eisenresorptionstest 489 Ektope Schwangerschaft 442 Embryonales Karzinom 458 Endokarditis 22 Endokrinopathie 463 Enterobius vermicularis 24 Epiglottis 21 Epithelien 422 Epstein-Barr-Virus 439 Euthyreote Struma 469 D Dauerkatheterträger 26 Dermatomykosen 29 Dermatomyositis 461, 465 Desferoxamintest 486 Dexamethasonhemmtest 487 Diabetes insipidus 501 Diabetes mellitus 493, 495 Diabetes mellitus Typ I 463 Diphtherie 28 Direktnachweis, Chlamydien 27 Direktnachweise 20 DMPS-Mobilisations-Test 505 Down-Frühscreening 443 Durstversuch (Zwei-Stufen-Test) 488 D-Xyloseausscheidung 509 F Faktor V Leiden 474, 475 familiären medullären Schilddrüsenkarzinom 482 Federn 422 Fische und Meeresfrüchte 424 fl-hCG 450 Fleisch 423 Fludrocortisontest 489 freies PSA 455 Frühabort 442 Fruktose-Belastung 490 FSME-Virus 439 Fungämie 22, 30 512 G Gallengangskarzinom 457 Gardnerella 21 Gardnerella vaginalis 20 Gastrinom 460 Gastrin-Stimulation 490 Gastritis, chron.-atrophisch 462 Gastrointestinale Erkrankungen 462 Gelenkpunktat 29 Gemüse 423 Gerinnungsstatus 13 Gesamteiweifl 26 Gestationsdiabetes 443, 495 Gewürze 425 GHRH+Arginin-Test 507 GH-RH-Stimulationstest 491, 507 Glucose-Toleranztest 493 Glucose-Toleranztest (50g,SSW) 495 Glucose-Toleranztest (75g,SSW) 495 Glukagonom 460 Glukagon-Test 492 GnRH-Test 502 Gonokokken 20 Gonokokken-Direktnachweis 27 Gonokokken-Endokarditis 29 Gonorrhoe 28 Gräser- u. Getreidepollen 421 Gruppenallergene, spezif. IgE-Ak. 427 H Haare 29, 422 Haarmykose 29 Harnblasenkarzinom 457 Hashimoto-Thyreoiditis 469 Haut 29 Hautmykose 29 Hautpilze 20 hCG-Test 497 Hefen, spez. IgE-Antikörper 426 N. Index HELLP-Syndrom 443 Heparin-Induzierte-ThrombozytopenieDiagnostik 13 Hepatitis-A-Virus(HAV) 439 Hepatitis-B-Virus(HBV) 439 hepatozelluläres Karzinom 458 Herpes simplex 20 Herpes-simplex-Virus 439 HGH-Exzess 506 HGH-Mangel 499, 507 Hühnerei 423 5-HIES 449 Hirnmetatstasen 457 Hirntumor 457 HIV(Human immunodeficiency-virus 439 Hämochromatose 486 Hämosiderose 486 Hodentumoren 457 Hogkin- u. Non-Hodgkin-Lymphome 459 Homocystein 475 Homovanillinsäure 453 Hungerversuch 498 Hyperaldosteronismus 480, 481, 483, 489 Hyperprolaktinämie 504 5-Hydroxyindolessigsäure 449 Hyperthyreose 469, 506 Hypogonadismus 502 Hypophysenadenom 457 Hypophyseninsuffizienz 503, 507 Hypophysenstimulationstest (global) 499 Hypophysentumor 457 Hypophysenvorderlappeninsuffizienz 485, 499 Hypothalamisch-hypophysäre Hypothyreose 469 hypothalamisch-hypophysären Funktion 484 Hypothyreose 463, 469, 506 Hypothyreote Autoimmunthyreoiditis 463 I IgE-Ak., spezifische 421 Infektionen, Respirationstrakt 30 Infektlokalisationen viraler Erkrankungen 439 Inflammatorisch idiopathische Myopathie 462 Influenza-Viren 439 Insekten 422 Insulinhypoglykämie -Test 499 Insulinom 460, 492, 498 J Jod-Mangel 470 K Karzinoid 457, 460 Kathetersepsis 23 Katheterurin 25 Keimzelltumoren 458 Knochenmetastasen 458 Knochentumor 458 Kochsalzinfusionstest 501 Kollagenosen 461 Kolon-Rektumkarzinom 458 konstitutionelle Pubertas tarda 502 Kreatinin-Clearance 501 Kristallnachweis 26 Kräuter- u. Blumenpollen 421 L Laktasemangel 501 Laktosemalabsorption 501 Laktosetoleranztest 501 Lambert-Eaton-Myasthenie 462 LCM-Virus 439 Lebererkrankungen 462 Lebermetastasen 458 Leberzellkarzinom 458 LH-RH-Test 502 Liquor 32 Low-T3-Syndrom 469 Lumbalpunktion 23 Lupusantikoagulanz 475 Lymphoproliferative Erkrankungen 459 M M2-PK 453 Magenkarzinom 459 Magennüchternsekret 31 Malabsorptionssyndrom 509 Malaria 29 Maldigestion 509 Malignes Melanom 459 Malignes Teratom 458 Malignome Kopf-Hals-Bereich 459 Mammakarzinom 459 Masern-Virus 439 M. Basedow 463, 469 MCTD 461 Medikamente 422 513 N. Index medulläres Schilddrüsenkarzinom 482 Membranen 28 MEN-2 (Multiple endokrine Neoplasie Typ 2) 482 Meningitis, eitrige 23 Meningokokken 23 Menstrualblut 32 Metoclopramid-Test 504 Metopiron-Kurztest 503 Milben 422 Milch und Milchprodukte 423 Minderwuchs 482, 499, 507 Mittelstrahlurin 25 Morbus Crohn 462 Morgensputum 24 Morgenurin 25, 32 MSU (Mittelstrahlurin 25 Multimere 477 Multiples Myelom 459 Mumps-Virus 439 Muskelerkrankungen 462 Myasthenia gravis 462 Mycoplasma pneumoniae 30 Mycoplasmen 21 Mykoplasmen 20, 30 Myositis 465 N Nagelmykose 30 Nahrungsmittel 423 Nasopharyngealabstrich 31 Nebennierenrindeninsuffizienz 479, 485, 503 514 Nebennierenrindentumor 459 Nebenschilddrüsenkarzinom 459 Nebnnierenhyperplasie 481 Neopterin 453 Neuralrohrdefekt 442 Neuroblastom 460 Neuroendokrine Tumoren 460 Neuronen-spezifische Enolase 454 Neuropathien 463 Nägel 29 Nierenarterienstenose 483 Nierenfunktionseinschränkung 501 Nierenkarzinom 460 NMP22 454 NNR-Karzinom 459 Non-thyroidal-illness-Syndrom 469 Norwalk-Virus (Noro-Virus) 439 NSE 454 Nüsse und Ölsaaten 425 Nuclear Matrix Protein 454 O Obst 424 Ösophaguskarzinom 460 OP.-Material 26 Oropharyngealflora 23 Osteosarkom 458 Otitis media 21 Otomykose 21 Ovarialinsuffizienz 502 Ovarialkarzinom 460 Oxyuren 24 P Pankreaskarzinom 460 Parainfluenza-Virus 439 Parasiten 20 Parathormon-related Peptide 454 Paratyphus 24 Paspertin-Test 504 Pentagastrin-Stimulationstest 482 Peritonealpunktat 26 Persist. Faktor VIII-Erhöhung 475 Pertussis 20, 31 Phäochromozytom 460 PLAP 449 Plasmodien 29 Plasmozytom 459 Plazentainsuffizienz 442 Pleurapunktat 26 Pneumonie 23 Polio-Viren 439 Polydipsie 501 Polymositis 465 Polymyositis 461 Polyurie 488, 501 Präanalytik 9 Praeklampsie 443 praemature Pubarche 502 Pränatales Screening auf Down-Syndrom 443 Probenentnahme 9 Prolaktin-Stimulationstests 504 Prostatakarzinom 460 Prostataspezifisches Antigen 455 Prostatitis 26 N. Index Protein C-Defekt 474 Protein C-Mangel 474, 475 Protein S-Defekt 474 Protein S-Mangel 474, 475 Prothrombin-Mutation 474, 475 Prozesse, geschlossene 26 Prozesse, offene 27 PSA 455 Pseudopubertas praecox 502 PTHrP 454 Pubertas praecox vera 502 Punktat 26 Pyruvatkinase Typ Tumor M2 453 Q Quecksilberbelastung 505 Quecksilber-Mobilisationstest 505 R Reiter-Syndrom 464 Rektalabstrich 24, 29 Rektalabstriche 24 Respirationstrakts, Infektionen 30 Respiratory-syncytial-Virus(RSV) 439 Rheumatoide Arthritis 461 Ringer-Laktat-Lösung 22 Ristocetin-Cofaktor 477 Rota-Viren 439 Röteln-Virus 439 S S 100 455 S 100 Protein 455 Sammelurin 12 SCC 455 Schilddrüsenhormon-Resistenz 470 Schilddrüsenkarzinom 460 Schimmelpilze, spez.IgE-Antikörper 426 Schleimhautmykosen 30 Schwangerschaftsgestose 443 Sekretin-Provokationstest 490 sekundärer Hyperaldosteronismus 483 Seminome 458 Sepsis 23, 30 Serotonin 455 Sharp-Syndrom 461, 465 Sheehan-Syndrom 499 Shigellen 24 Sjögren-Syndrom 461 Sklerodermie 461, 465 SLE 461 Soor 30 Sproflpilze 20, 21 Sproflpilzsepsis 30 Sprue 509 Sputum 19, 31 Sputumgewinnung 24 Squamous cell carcinoma antigen 455 Stadium catarrhale 31 Stadium convulsivum 31 Stoffwechselerkrankungen 444 Stuhl 19, 24, 32 Subakute Thyreoiditis (lymphozytär) 469 Subklinische Hyperthyreose 469 Subklinische Hypothyreose 469 Systemischer Lupus erythematodes, SLE 464 Systemische Sklerose 461, 465 Systemische Vaskulitis 461 System. Lupus erythematodes 461 T TGB 456 Thrombophilie 474 Thrombose-Diagnostik 13 Thrombozyten-Funktionstest 13 Thymidinkinase 455 Thyreoglobulin 456 Thyreotoxikose 470 Tissue-Polypeptid-Antigen 456 Titerverläufe, Beurteilung 440 TPA 456 Trachealsekret 22 Trachealtubus 23 Transportmedium 19 TRH-Belastungstest 505 TRH-Test 504 Triple-Diagnostik 443 Trophoplastische Tumoren 458 TSH-produzierendes Adenom 470 Typhus 24 U Ureaplasmen 30 Urethralabstrich 21 Urethritis 26 Urin 25 Urinuntersuchung, mykologische 30 Urogenitalinfektionen 30 Uteruskarzinom 460 515 N. Index V Vanillinmandelsäure 456 Varizella-Zoster-Virus 439 Versandmaterial 9 VIPom 460 vonWillebrand - Syndroms 477 W Wachstumshormonmangel 482 (Wachstumshormon-Stimulationstest) 482 Wegenersche Granulomatose 461 Willebrand 477 Wundsekret 26 X Xylose-Toleranztest 509 516 Z Zervixabstrich 27, 29 Zervix-CA 460 Zirrhose, primär biliär 462 Zöliakie 509 Zoeliakie 462 Zytologie-Bürste 27 LAGEPLAN So finden Sie uns ... Unsere Praxis ist sehr verkehrsgünstig gelegen Sie erreichen uns mit dem Auto über die Hildesheimer Straße, folgen Sie einfach dem Wegweiser zum TÜV oder mit den Straßenbahnlinien 1, 2 oder 8, Haltestelle Bothmerstraße und einem kurzen Fußweg von ca. 250m entlang der Garkenburgstraße (siehe Lageplan) Probenannahme: Montag bis Freitag Samstag Praxiszeiten: von 7:30 - 18:00 Uhr von 11:00 - 12:30 Uhr Montag bis Donnerstag von 8:00 - 9:30 Uhr Medizinisches Labor Hannover Postfach 725 · 30007 Hannover · Am TÜV 6 · 30519 Hannover Tel. 0511.85622-0 · Fax 0511.85622-710 · [email protected] 517