Einblicke in die Peptidchemie der Bachem
Werbung

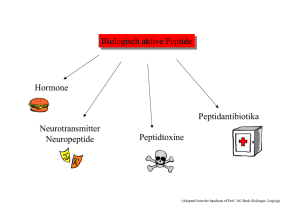
WELCOME TO THE WORLD OF PEPTIDES Einblicke in die Peptidchemie der Bachem Einblicke in die Peptidchemie EINE EINFÜHRUNG IN DIE WELT DER AMINOSÄUREN UND PEPTIDE präsentiert von Monika Mergler, Ph.D., Bachem AG Inhaltsverzeichnis 1. Die Geschäftsfelder der Bachem 03 2. Was sind Peptide? 06 3. Was sind Aminosäuren? 07 4. Herstellung von Peptiden 14 5. Analyse von Aminosäuren und Peptiden 24 6. Modifizierung von Peptiden 26 Abkürzungsverzeichnis ADS Analytical Datasheet, auch als Certificate of Analysis (CofA) bezeichnet API Active Pharmaceutical Ingredient (Wirkstoff in Medikamenten) CCD Counter Current Distribution (Gegenstromverteilung, Reinigungsmethode) DC, TLC Dünnschichtchromatographie (thin layer chromatography, Analysenmethode) DMF Dimethylformamid (bei der SPPS verwendetes Lösungsmittel) GMP Good Manufacturing Practice („Gute Herstellungspraxis“, Richtlinien zur Qualitätssicherung bei der Herstellung z.B. von pharmazeutischen Wirkstoffen) HPLC High Performance Liquid Chromatography (Analysen- und Reinigungsmethode) MS. Massenspektrometrie (Analysenmethode) NCE New Chemical Entity (noch nicht zugelassener Wirkstoff) NMP N-Methylpyrrolidon (bei der SPPS verwendetes Lösungsmittel) QCRF Quality Control Release Form RSLC Rapid Separation Liquid Chromatography (Analysenmethode) SPPS Solid-phase Peptide Synthesis (Festphasen-Peptidsynthese) Symbole für chemische Elemente * C Kohlenstoff H Wasserstoff N Stickstoff O Sauerstoff S Schwefel Um nicht ständig aktualisieren zu müssen, soll hier auf konkrete Zahlen verzichtet werden. Die aktuellen Angaben (Anzahl Produkte, Umsatz etc.) kann man z.B. im Geschäftsbericht oder auf der Bachem Homepage www.bachem.com finden. ** GMP = Good Manufacturing Practice, Produktionsrichtlinien, die der Qualitätssicherung dienen. An diese Richtlinien muss man sich bei der Herstellung von Substanzen, die am Menschen eingesetzt werden, halten. Ihre Einhaltung wird regelmässig von spezialisierten Behörden (wie Swissmedic in der Schweiz, FDA in den USA) kontrolliert. Unter diese Produktionsrichtlinien fallen u.a. Wirkstoffe in Medikamenten, Bestandteile von Kosmetika und Zusatzstoffe in Lebensmitteln. 2 Die Geschäftsfelder der Bachem Die Kerngeschäfte der Bachem sind die Vertragsherstellung von pharmazeutischen Wirkstoffen, insbesondere Generika, und die Synthese und der Verkauf von Aminosäurederivaten, Peptiden und Feinchemikalien*. Bachem produziert sowohl Peptide als auch “kleine Moleküle” (small molecule APIs) als Wirkstoffe für die Pharmaindustrie unter GMP-Bedingungen**. Die Geschäftsfelder der Bachem sind: Forschungchemikalien Katalogprodukte, ab Lager Diese Aminosäurederivate, Peptide und weitere Chemikalien werden NICHT unter GMP-Bedingungen hergestellt und dürfen nur für Labor- und Forschungszwecke eingesetzt werden. Sie dürfen nicht am Menschen verwendet werden. Custom Synthesis Auftragssynthesen, exklusiv für einen Kunden Meistens Peptide, die in Mengen von wenigen Milligramm bis zu einigen Gramm hergestellt werden. Auf Wunsch können die Produkte unter GMP-Bedingungen synthetisiert werden. Generic Active Pharmaceutical Ingredients (Generic APIs) Pharmazeutisch aktive Verbindungen Substanzen, die als Wirkstoffe in Medikamenten eingesetzt werden, MÜSSEN unter GMP-Bedingungen hergestellt werden. Sie werden in Grossmengen verkauft. • • • • • more than 7500 products available online peptides, amino acids, inhibitors, substrates fast & easy ordering @ shop.bachem.com bulk quantities according to your needs excellent customer and technical support De ve l op m en t ch ar ct ng ra ri nt ctu Co ufa n Ma process development, optimization and validation comprehensive analytical services supply of cGMP material for all clinical phases sterile fill & finish for clinical trials (Clinalfa®) cGMP-manufacturing of APIs for commercial supply se peptide and small molecule generics supply of commercial quantities reputation for sustained quality & supply high-demand APIs available from stock close and long term partnerships Co m Su me pp rci ly al CATALOG PRODUCTS • • • • • Re GENERIC APIs NCEs • • • • • New Chemical Entities (NCEs) Auftragssynthesen NCEs sind patentierte Peptide oder organische Verbindungen, die die Bachem exklusiv für den Patentinhaber oder einen Lizenznehmer herstellt. Bei NCEs ist schon während der ersten Synthese in kleinem Massstab zu bedenken, dass sich das Produkt als pharmazeutisch wirksam erweisen kann und daher in grösseren Mengen und evtl. unter GMP-Bedingungen hergestellt werden muss. Die Bachem strebt eine langfristige Partnerschaft mit solchen Kunden an. Diese geht von anfänglichen Synthesen von NCEs im Labormassstab über die Herstellung von grösseren Mengen unter GMP-Bedingungen für die klinischen Phasen bis zur Herstellung des Wirkstoffs für das zugelassene Medikament im Grossmassstab. CUSTOM SYNTHESIS • • • • • from discovery stages to early clinical candidates strong focus on quality and timely execution development of synthetic routes for scale up best industry practice highly motivated and experienced team Abb. 1: Das Bachem 360º Geschäftsmodell. 3 Einblicke in die Peptidchemie Generic Active Pharmaceutical Ingredients (Generic APIs) Generika sind Wirkstoffe bzw. Medikamente, deren Patentschutz abgelaufen ist. Medikament = „formulierter“ Wirkstoff: Je nach Art der Verabreichung (als Tablette, als Injektion etc.) werden diverse nicht-aktive Hilfsstoffe zum eigentlichen Wirkstoff gemischt. Dieser Prozess wird als Formulierung bezeichnet, er kann unabhängig vom Wirkstoffpatent geschützt werden. Durch geeignete Formulierung kann z.B. erreicht werden, dass der Wirkstoff nur langsam freigesetzt wird (Depotformulierungen), als Nasenspray angewendet oder über die Haut aufgenommen wird. Die Entwicklung und Patentierung neuer Formulierungen von generischen Wirkstoffen bietet den Wirkstoffherstellern gute, langfristige Absatzmöglichkeiten. Die Entdeckung weiterer pharmakologischer Aktivitäten kann zu zusätzlichen Indikationen für ein Generikum führen und damit den Bedarf an Wirkstoff erhöhen. Auch in einem solchen Fall können Patente (Anwendungspatente) erteilt werden. Generika werden auch zur Diagnose von Krankheiten (d.h. als Diagnostika) eingesetzt. Ein weiterer Markt mit grossem Potential ist die Verwendung von Generika in der Veterinärmedizin. Tabelle 1: Beispiele einiger peptidischer APIs der Bachem und deren Indikationen 4 Peptid Indikation Calcitonin Osteoporose Deslorelin Fruchtbarkeitskontrolle (Veterinärmedizin) Desmopressin Diabetes insipidus Glucagon Unterzuckerung bei Diabetes Goserelin Krebs Gonadorelin Reproduktionsmedizin Leuprolid Krebs Octreotid Akromegalie Secretin Diagnostik (Bauchspeicheldrüse) Triptorelin Krebs Wegen der immensen Bedeutung der APIs für den Umsatz der Bachem wird das Angebot ständig angepasst. Der Patentschutz eines Wirkstoffs läuft meistens nach 18 Jahren aus. Ist ein peptidischer Wirkstoff für die Bachem von Interesse, muss die Firma schon Jahre vorher mit der Syntheseentwicklung beginnen. Ein Verkauf des Peptids in kleinen Mengen für Forschungs- und Entwicklungszwecke ist schon vor Ablauf des Patents möglich (Bolar Exemption). Einige peptidische APIs der Bachem und ihre Indikation sind in Tabelle 1 gelistet. Die Strukturen von Calcitonin, Glucagon, Gonadorelin (GnRH oder LHRH), und Secretin entsprechen denen der natürlichen, körpereigenen Peptidhormone, die anderen in der Tabelle aufgeführten Produkte sind modifizierte natürliche Peptide. Durch Veränderungen in der Struktur werden sie im Organismus langsamer abgebaut als körpereigene Peptide. Triptorelin wird in zwei Salzformen angeboten, Acetat und Pamoat. Das Pamoat wird langsamer freigesetzt und daher in Depotformulierungen verwendet. Die von der Bachem angebotenen small molecule APIs werden von unserer Zweigniederlassung in Vionnaz hergestellt (ausser Antazolin). Beispiele dafür sind Propofol, das zur Einleitung einer Allgemeinanästhesie oder Sedierung von beatmeten Erwachsenen während der Intensivbehandlung verwendet wird, oder Zonisamid als Zusatztherapeutikum bei partiellen Epilepsien. Interessenten können sich über die angebotenen peptidischen und nicht-peptidischen Generic APIs auf der Homepage der Bachem (www.bachem.com) informieren, unseren Generikakatalog herunterladen und eine Offerte anfordern. Unter der Marke Clinalfa® bietet die Bachem Peptide für klinische Studien und Fertigformulierungen von Peptiden als zusätzlichen Service an. Es sind zwei Produktlinien erhältlich. Clinalfa® basic Produkte sind sterile gefriergetrocknete oder flüssige Fertigformulierungen für den ausschliesslichen Einsatz in genehmigten klinischen Studien. Sie werden gemäss den Anforderungen und relevanten Richtlinien der Aufsichtsbehörden hergestellt und frei- gegeben und sind ab Lager erhältlich. Unter Clinalfa® plus bieten wir die Formulierung nach Kundenwünschen als zusätzlichen Service zur Auftragsherstellung von peptidischen Wirkstoffen an. Abb. 2: Clinalfa®-Logo. Forschungschemikalien „Katalogprodukte“ Diese Produkte werden in verschiedenen Packgrössen oder in grösserer Menge (Minibulk und Bulk) ab Lager verkauft. Die meisten werden bei der BUK in Grossbritannien oder in Bubendorf hergestellt. Die Katalogprodukte decken einen breiten Kundenkreis ab. Die Produkte im Hauptkatalog sind in drei durch unterschiedliche Farben markierte Kategorien (gelb-blaurot) aufgeteilt: Der gelbe Teil des Hauptkatalogs enthält Aminosäurederivate und Produkte zur Synthese von Peptiden, wendet sich also primär an Chemiker. Der blaue Teil ist der bei weitem umfangreichste des Katalogs. In ihm sind die angebotenen Peptide aufgelistet, er wendet sich vor allem an die biologische und medizinische Forschung. Der rote Teil enthält Biochemikalien, die keine Aminosäurederivate oder Peptide sind. Auch dieser Teil wendet sich an die biologische und medizinische Forschung. Diese Aufteilung in 3 Produktkategorien (Aminosäurederivate und Produkte für die Peptidsynthese / Peptide / nicht-peptidische Biochemikalien) findet sich auch im Onlineshop (ohne Farbcodierung). Das Kataloggeschäft ist auch wichtig für die Akquirierung von Kunden für unsere weiteren Angebote, z.B. Auftragssynthesen. Es erlaubt auf einfache Weise, den potentiellen Kunden die hohe Produktqualität und den guten Service der Bachem zu zeigen. Abb. 3: Einstiegsseite des BachemOnlineshops. 5 Einblicke in die Peptidchemie Was sind Peptide ? Peptide sind kleine Proteine. Peptide und Proteine sind Makromoleküle, d.h. lange Moleküle aus kleinen Untereinheiten. Man könnte sie sich als Perlenketten aus verschieden geformten Perlen vorstellen. Die “Perlen” sind die 20 proteinogenen Aminosäuren (Aminosäuren, die in der Zelle zum Aufbau von Peptiden und Proteinen verwendet werden). Sie werden in beliebiger Kombination verknüpft, d.h. die Anzahl der Kombinationsmöglichkeiten ist praktisch unendlich. Dabei können die Aminosäuren in beliebiger Häufigkeit verwendet werden, so findet sich beispielsweise im Protein Kollagen Glycin (Gly) an jeder dritten Position der Kette: ...-Xaa (meistens Pro (L-Prolin))-Yaa-Gly-... Peptide und Proteine unterscheiden sich nur durch ihre Länge: Proteine > 100 Aminosäuren Peptide 2-100 Aminosäuren Unser Körper besteht, abgesehen vom Wasser, zum grössten Teil aus Proteinen. Trotz des gleichen Aufbauprinzips haben sie die unterschiedlichsten Funktionen (siehe Tabelle 2). Proteine sind auch ein lebenswichtiger Bestandteil unserer Ernährung! Wie ist diese Vielfalt möglich? Durch Variation der Aminosäurebausteine können Makromoleküle mit den unterschiedlichsten Eigenschaften „gebaut“ werden! Biologisch aktive Peptide sind z.B. Hormone oder Toxine (s.S. 23). Ein grosser Teil unserer Hormone sind Peptide von recht unterschiedlicher Länge: TRH (Thyreotropin-releasing hormone), ein Tripeptid (es besteht aus 3 Aminosäuren). LHRH (oder GnRH, Gonadotropin-releasing hormone), ein Peptid aus 10 Aminosäuren (Decapeptid). Calcitonin besteht aus 32 Aminosäuren. pTH (Parathormon), mit seinen 84 Aminosäuren fast schon ein Protein. Insulin besteht aus 2 Peptidketten, einer aus 30 Aminosäuren und einer aus 21, die miteinander durch Disulfidbrücken (s. S. 23) verknüpft sind. Generell werden Peptidhormone von spezialisierten Zellen produziert, ins Blut abgegeben und zum Zielorgan transportiert. Die Zellen, die stimuliert werden sollen, haben Rezeptoren, die die Hormone erkennen und spezifisch binden. Diese Rezeptoren sind spezialisierte Proteine, die in der Zellmembran eingelagert sind. Die Bindung des Hormons wirkt als Signal für die Zelle und der gewünschte Effekt wird ausgelöst. Kurze Peptide • 2 Aminosäuren = Dipeptid • 3 Aminosäuren = Tripeptid • 4 Aminosäuren = Tetrapeptid • 5 Aminosäuren = Pentapeptid etc. • wenige Aminosäuren = Oligopeptid Tabelle 2: Körpereigene Proteine und deren Funktionen 6 Beispiele Vorkommen der Proteine Anforderungen/Funktion Myosin, Actin Muskelgewebe flexible Moleküle, kontrahierbar Kollagen (das häufigste Protein im Körper) Bindegewebe, Sehnen, Haut formstabile Moleküle, zugfest Hämoglobin, Albumin Blut Transportermoleküle, löslich Verdauungsenzym Trypsin im Dünndarm (Trypsin ist eine sog. Protease, spaltet Peptide und Proteine) Gesamter Organismus Enzyme = Katalysatoren Hormon Thyreotropin (TSH) (stimuliert die Schilddrüse) Gesamter Organismus Hormone = Botenstoffe Antikörper (Immunoglobuline) Blut Immunabwehr Mit den 20 Aminosäuren, die im Peptid mehrfach vorkommen können, sind auch schon bei kurzen Peptiden viele Kombinationen möglich, z.B. ca. 3.2 Millionen verschiedene Pentapeptide! Selbst Dipeptide können schon biologisch aktiv sein: Leu-Trp und weitere Dipeptide wirken blutdrucksenkend Ac-Asp-Glu (NAAG) ist ein wichtiger Neurotransmitter, eine Substanz, die die Signalübertragung zwischen den Nervenzellen vermittelt. Die im Körper vorkommenden Peptide werden gewöhnlich durch enzymatische Spaltung von Proteinen erhalten. Proteine der Zelle aufgebaut werden. Sie unterscheiden sich nur in der Seitenkette R. Daneben findet man in der Natur - frei, als Stoffwechselprodukte oder in Peptiden/ Proteinen eingebaut - noch viele andere α-Aminosäuren, z.B. L-Hydroxyprolin (Hyp) im Kollagen oder L-Ornithin (Orn) frei imHarn. Weitere α-Aminosäuren, z.B. L-Norleucin (Nle), sind bisher nur durch chemische Synthese erhalten worden. Bei der Bachem bezeichnet man nichtproteinogene Aminosäuren wie Hyp und Nle als „unusual amino acids“, da man sie nicht pauschal „unnatürliche Aminosäuren“ nennen kann (wie es manche anderen Firmen tun). Was sind Aminosäuren ? Aminosäuren (ob proteinogen oder nicht) können biologisch aktiv sein, z.B. L-Tryptophan, L-Glutaminsäure. Aufbau einer α-Aminosäure An ein zentrales Kohlenstoffatom (dem α-CAtom) sind vier verschiedene Substituenten* gebunden: • die Säuregruppe (Carbonsäuregruppe = Carboxylgruppe, COOH, bei der Bachem kurz als -OH geschrieben) • eine basische Gruppe (Aminogruppe, NH2, kurz H-) • die Seitenkette (R, kann stark variieren, bestimmt so die Eigenschaften des Peptids!) • ein Wasserstoffatom (H) Das α-C-Atom trägt demnach 4 Gruppen mit unterschiedlichen chemischen Eigenschaften, was im Folgenden eine sehr grosse Rolle spielt (Abb. 4). H NH2 C R COOH Abb. 4: α-Aminosäure, das α-C-Atoms mit den vier verschiedenen Substituenten. Wie schon erwähnt, gibt es 20 verschiedene “proteinogene” Aminosäuren, aus denen die Die Seitenkette R • kann ein Wasserstoff-Atom sein: Glycin, die einfachste α-Aminosäure • kann eine zusätzliche Säuregruppe (COOH) tragen: Asparaginsäure, Glutaminsäure, oder eine veränderte Säuregruppe sein (ein Amid, CONH2): Asparagin, Glutamin • kann eine zusätzliche basische Gruppe tragen: Arginin (stark basisch), Lysin, Histidin (schwach basisch) • kann eine polare Gruppe tragen: Serin, Threonin • kann ein Kohlenwasserstoff (unpolar) sein: Alanin (R = Methyl), Phenylalanin (R = Benzyl), Valin (R = Isopropyl) • kann Schwefel enthalten: Cystein, Methionin Neben den α-Aminosäuren, aus denen Peptide und Proteine aufgebaut sind, hat die Bachem noch viele andere Aminosäuren im Angebot, auch solche, bei denen die Aminogruppe an ein anderes Kohlenstoffatom gebunden ist. L- und D-Aminosäuren Die vier verschiedene Substituenten des α-Kohlenstoffatom sind nicht in einer Ebene angeordnet, sondern sitzen an den * Substituenten sind Atome oder Atomgruppen, die an Stelle von einem Wasserstoffatom an ein zentrales Kohlenstoffatom (bei α-Aminosäuren das α-C) gebunden sind. 7 Einblicke in die Peptidchemie Tabelle 3: Die für Aminosäuren wichtigen funktionellen Gruppen Bezeichnung Struktur Bezeichnung Struktur Aminogruppe NH2 Carboxygruppe COOH Hydroxylgruppe OH Amidgruppe (Carboxamidgruppe) CONH2 Thiol- oder Mercaptogruppe (im Cystein) SH Guanidinogruppe (im Arginin) NH-C(=NH)-NH2 vier Ecken eines Tetraeders, in dessen Mitte das α-C-Atom sitzt (Abb. 5): Abb. 5: Anordnung der Substituenten um das α-Kohlenstoffatom (grau). Daher sind 2 Formen der Aminosäuremoleküle möglich, die sich wie Bild und Spiegelbild verhalten und als Stereoisomere oder Enantiomere bezeichnet werden: In ihren physikalischen Eigenschaften unterscheiden sich die beiden Enantiomeren nicht, ausser dass sie in Lösung die Ebene des polarisierten Lichts drehen. Verbindun- Gly) sind L-Enantiomere (L steht für laevus, lat. links), z.B. L-Alanin. Ihre „Spiegelbilder“, die D-Aminosäuren, treten in der Natur viel seltener auf. D steht für dexter (lat. rechts). Um es noch einmal zu betonen, L oder D bezeichnet die Anordnung der vier verschiedenen Substituenten am α-C-Atom, d.h. das jeweilige Enantiomer (vgl. Abb. 6). Man kann nicht von der Bezeichnung L- oder D- auf den Drehsinn schliessen. Bei L-Aminosäuren kann er positiv oder negativ sein (s.u.), bei den entsprechenden D-Aminosäuren ist er immer entgegengesetzt gerichtet. Die Drehwerte findet man häufig als [α] auf den ADS/QCRF (s. S. 24) von Aminosäuren und ihren Derivaten angegeben, da sie charakteristisch für die jeweilige Verbindung sind. Auch bei Peptiden werden oft Drehwerte gemessen. Abb. 6: Absolute Konfiguration der L- und D-Isomere von Aminosäuren. gen, die das tun, bezeichnet man als “optisch aktiv”. Die optische Aktivität ist in der Natur sehr weit verbreitet. Ausser Glycin (R = H, Bild und Spiegelbild identisch) zeigen alle proteinogenen Aminosäuren dieses Phänomen. Auch Zucker drehen das Licht, was man benutzt, um die Konzentration von Zuckerlösungen zu bestimmen, ebenso die DNA und ihre Bausteine. Alle proteinogenen Aminosäuren (ausser 8 Einige Beispiele: L-Alanin: + 14.3° D-Alanin: -13.9° L-Tryptophan: - 31.8° D-Tryptophan: + 30.7° (die Abweichungen liegen im Genauigkeitsbereich der Methode) Eine 1:1 Mischung der beiden Enantiomeren bezeichnet man als Racemat. Die Drehungen von L- und D-Form kompensieren sich. Tabelle 4: Kürzel der proteinogenen Aminosäuren (L-Form, ausser Gly) Name im Peptid* Alanin 3-letter 1-letter Name im Peptid 3-letter 1-letter alanyl Ala A Leucin leucyl Leu L Arginin arginyl Arg R Lysin lysyl Lys K Asparagin asparaginyl Asn Asparaginsäure aspartyl Asp N Methionin methionyl Met M D Phenylalanin phenylalanyl Phe F Cystein cysteyl Cys C Prolin prolyl Pro P Glutamin glutaminyl Gln Q Serin seryl Ser S Glutaminsäure glutamyl Glu E Threonin threonyl Thr T Glycin glycyl Gly G Tryptophan tryptophyl Trp W Histidin histidyl His H Tyrosin tyrosinyl Tyr Y Isoleucin isoleucyl Ile I Valin valyl Val V * s.Tab. 5 auf S. 15 In der Bachem-Schreibweise wird die LForm wegen ihrer grossen Bedeutung nicht explizit bezeichnet (z.B. L-Alanin = H-AlaOH). Bezeichnet werden nur das D-Enantiomer (D-Alanin = H-D-Ala-OH) und das Racemat, das mit DL gekennzeichnet wird. Schreibweisen für Aminosäuren Schreibt man bei einer Aminosäure den Namen aus, bezeichnet man auch die enantiomere Form: L-Alanin und D-Alanin. Beim Racemat wird, wie in der organischen Chemie üblich, das DL gewöhnlich weggelassen. Um Aminosäurederivate und Peptide darzustellen, benutzt man den DreibuchstabenCode (3-letter code, meistens die ersten 3 Buchstaben des Namens). Daneben gibt es den Einbuchstaben-Code (1-letter code), den man vor allem für längere Peptide und Proteine bevorzugt. Beispiele: L-Alanin → Ala, L-Ala, H-Ala-OH (3-letter); A (1-letter) L-Arginin → Arg, L-Arg, H-Arg-OH (3-letter); R (1-letter) Bachem-Schreibweise: H-Ala-OH, H-Arg-OH Die Schreibweise bedeutet, dass es die L-Form ist und dass die Amino- und die Carboxylgruppe frei sind!. Die Kürzel der 20 proteinogenen Aminosäuren sind in Tabelle 4 zusammengefasst. Englische Aminosäure-Bezeichnungen: Ausser beim Tryptophan wird ein -e angehängt, z.B. alanine, valine. Asparaginsäure = aspartic acid Glutaminsäure = glutamic acid Der Einbuchstaben-Code wird nur für die 20 proteinogenen Aminosäuren verwendet, für D-Aminosäuren schreibt man oft den Kleinbuchstaben, z.B. f = D-Phe. Dagegen gibt es für viele der nicht-proteinogenen Aminosäuren auch einen verbindlichen Dreibuchstaben-Code, z.B. Hyp (L-trans-Hydroxyprolin), Nle (L-Norleucin), Orn (L-Ornithin). Nicht alle literaturüblichen Kürzel werden auch bei der Bachem benutzt. Bei manchen Aminosäuren wird bei der Bachem der ausgeschriebene Name gebraucht, z.B. L-Thiazolidine-4-carboxylic acid (sonst Thz). Kurze Porträts der 20 proteinogenen Aminosäuren Ein Organismus, z.B. der menschliche, muss alle 20 proteinogenen Aminosäuren zur Verfügung haben, um Proteine synthetisieren zu können. Sie müssen alle in L-Form vorliegen (ausser Gly). Man unterscheidet zwischen essentiellen und nicht-essentiellen Aminosäuren. Nicht-essentielle Aminosäuren kann der Körper selbst herstellen, essentielle nicht, sie müssen also mit der Nahrung zugeführt werden. Man kann die Aminosäuren auch nach der Seitenkette (s.S.7), die ihre Eigenschaften bestimmt, unterteilen. Es gibt saure, basische, polare und unpolare Aminosäuren, in der “Periodic Chart of Amino Acids” 9 Einblicke in die Peptidchemie (s.S.13) werden sie durch verschiedene Farben unterschieden. Die Eigenschaften von Peptiden und Proteinen werden von den Seitenketten der Aminosäuren, aus denen sie aufgebaut sind, bestimmt. in Spargeln entdeckt. Asn ist eine polare Aminosäure. In Peptiden und Proteinen ist Asn relativ labil. Asparaginsäure (Asp, D) Glycin (Gly, G) ist die einfachste Aminosäure und eine der in Peptiden/Proteinen am häufigsten vorkommenden. Gly ist nicht-essentiell. Seinem süssen Geschmack verdankt Glycin seinen Namen. Alanin (Ala, A) ist eine saure Aminosäure, weil sie in der Seitenkette eine weitere Säuregruppe enthält. Diese bleibt erhalten, wenn Asp in ein Peptid eingebaut wird. Asparaginsäure wurde in Spargeln entdeckt, was ihr zu ihrem Namen verholfen hat. Für Säugetiere ist Asp nicht-essentiell. Cystein (Cys, C) ist die einfachste optisch aktive Aminosäure und die zweithäufigste in Proteinen. Die abgebildete L-Form dieser nicht-essentiellen Aminosäure wird vom Körper in Proteine eingebaut, doch findet sich in der Natur auch D-Alanin recht häufig in Peptiden. Alanin wird zu den unpolaren Aminosäuren gezählt. Arginin (Arg, R) ist eine stark basische Aminosäure. Die stickstoffhaltige Guanidinogruppe in der Seitenkette ist eine derartig starke Base, dass sie praktisch mit jeder Säure ein Salz bildet. Seinen Namen hat Arginin bekommen, weil es als Silbersalz isoliert worden ist. Arg ist halb-essentiell (der Körper kann es zwar produzieren, aber oft in zu geringer Menge). Arg-haltige Peptide sind sehr polar und leicht wasserlöslich Asparagin (Asn, N) ist eigentlich ein Derivat der Asparaginsäure (das Amid) und wie diese wurde Asn 10 ist zwar eine seltene Aminosäure, aber äusserst wichtig für die Struktur von Peptiden und Proteinen. Das nicht-essentielle Cys enthält Schwefel in der Seitenkette, als leicht saure Thiolgruppe. Thiolgruppen lassen sich leicht unter Ausbildung einer Disulfidbindung oxidieren. Aus zwei Cysteinmolekülen erhält man ein Cystin (Cyt)-Molekül. Bei Peptiden, die ein Cys erhalten, werden zwei Ketten miteinander verknüpft. Sind 2 Cys im Peptid, kann ein Ring entstehen, wie wir später noch sehen werden. Glutamin (Gln, Q) ist eigentlich ein Derivat (das Amid) der Glutaminsäure. Glutamin ist eine polare Aminosäure, die in freier Form in grossen Mengen im menschlichen Körper vorkommt. Glutamin am Beginn einer Peptidkette bildet spontan oder mit Hilfe eines Enzyms Pyroglutaminsäure. Glutaminsäure (Glu, E) leukos) Blättchen, in denen es kristallisiert. Beim Isoleucin sind weitere Stereoisomere möglich (allo-Ile). Lysin (Lys, K) ist eine saure Aminosäure. Glu ist nichtessentiell. Die Salze der Glutaminsäure heissen Glutamate, das Natriumsalz (Monosodiumglutamate, MSG) ist bekannt und berüchtigt als Geschmacksverstärker. Glu hat grosse physiologische Bedeutung in unserem Nervensystem als Neurotransmitter. Glutaminsäure bildet viel weniger leicht Pyroglutaminsäure als Glutamin. Histidin (His, H) ist eine schwach basische, polare, für Menschen essentielle Aminosäure. Der Name leitet sich von „histos“ (griech. Gewebe) ab. Der Imidazolring, den sie in der Seitenkette trägt, enthält 2 Stickstoffatome. Imidazole katalysieren viele Reaktionen, daher ist His (in Kombination mit Cys, Ser oder Thr) oft im aktiven Zentrum von Enzymen zu finden. Leucin (Leu, L) und Isoleucin (Ile, I) ist eine basische Aminosäure, die in ihrer Seitenkette eine zweite Aminogruppe trägt, eine α,ε-Diaminosäure. Lysin ist essentiell. Methionin (Met, M) ist, wie Cystein, eine schwefelhaltige Aminosäure. Der Schwefel liegt als Methylthioether vor, worauf der Name anspielt , „Me-thio“. Thioether sind oxidationsempfindlich, was beim Umgang mit Met-haltigen Peptiden zu beachten ist. Diese essentielle Aminosäure zählt zu den unpolaren Aminosäuren. Phenylalanin (Phe, F) ist eine essentielle, unpolare Aminosäure. Sie zählt, neben His, Tyr (das als Phenylalaninderivat betrachtet werden kann) und Trp zu den aromatischen Aminosäuren. Prolin (Pro, P) sind isomere α-Aminosäuren. Isomere Verbindungen haben die gleiche Summenformel und das gleiche Molekulargewicht, aber sie unterscheiden sich in der Struktur. Beides sind unpolare Moleküle. Leu und Ile sind für den Menschen essentiell. Der Name Leucin rührt von den weissen (griech: ist die einzige cyclische proteinogen Aminosäure, ein Ring aus 5 Atomen, der α-Aminogruppe und α-C enthält. Pro ist unpolar und nicht essentiell. Wegen seiner speziellen Struktur hat Pro einen immensen 11 Einblicke in die Peptidchemie Einfluss auf die räumliche Struktur von Peptiden und Proteinen. Serin (Ser, S) ist dank der Hydroxylgruppe in der Seitenkette eine polare Aminosäure. Der Name dieser nicht-essentiellen Aminosäure leitet sich von der Seide (lat. sericum) ab Threonin (Thr, T) enthält wie Serin eine Hydroxylgruppe in der Seitenkette, ist jedoch eine essentielle Aminosäure. Threonin enthält wie Isoleucin ein zweites asymmetrisches KohlenstoffAtom mit vier verschiedenen Substituenten, womit weitere Stereoisomere möglich sind (allo-Thr). Tryptophan (Trp, W) ist eine unpolare, essentielle Aminosäure, ein Indolderivat. Die freie Aminosäure wirkt antidepressiv, sie ist eine Vorstufe vom Serotonin. Tryptophan fluoresziert im UVBereich (308-350 nm). Tyrosin (Tyr, T) ist, da es im Organismus aus Phenylalanin gebildet werden kann, eine nicht-essentielle Aminosäure. Die relativ unpolare Aminosäure wurde zuerst aus Käse (griech. tyros) isoliert. Valin (Val, V) ist eine unpolare essentielle Aminosäure. 12 Aminosäurederivate Generell versteht man in der organischen Chemie unter Derivaten Abkömmlinge einer Verbindung. Ein Derivat einer Aminosäure wird erhalten durch Modifikation (chemische Veränderung) der Aminogruppe und/oder der Carboxylgruppe und/oder der Seitenkette. Wenn diese Modifikation unter Bedingungen wieder rückgängig gemacht werden kann, die die Aminosäure nicht verändern, kann sie als Schutzgruppe dienen. Solche Derivate sind als Bausteine für die Peptidsynthese geeignet. Stammverbindung Derivat H-Ala-OH → Ac-Ala-OH (Aminogruppe blockiert) → H-Ala-NH2 (Carboxygruppe blockiert) → Fmoc-Ala-OH (Aminogruppe blockiert) → Jedoch kann Fmoc selektiv unter milden Bedingungen abgespalten werden, ist also eine für die Peptidsynthese geeignete Schutzgruppe. 13 131.18 113.16 C6H13NO2 I 146.19 128.17 C6H14N2O2 K 174.20 156.19 C6H14N4O2 R 155.16 137.14 C6H9N3O2 H Isoleucine Ile Lysine Lys Arginine Arg Histidine His 204.23 186.21 C11H12N2O2 W 131.18 113.16 C6H13NO2 L Phe Tryptophan Trp Leucine Leu Phenylalanine 165.19 147.18 C9H11NO2 F 115.13 97.12 C5H9NO2 P Met Alanine Ala Proline Pro Methionine 149.21 131.20 C5H11NO2S M 89.09 71.08 C3H7NO2 A 117.15 99.13 C5H11NO2 V 132.12 114.10 C4H8N2O3 N 121.16 103.14 C3H7NO2S C Valine Val Asparagine Asn Cysteine Cys Serine Ser Glycine Gly 105.09 87.08 C3H7NO3 E Serine Chemical Name Chemical Structure 3-Letter Amino Acid Code Threonine Thr Ser 119.12 101.10 C4H9NO3 T Glu Glutamic Acid 147.13 129.11 C5H9NO4 © Copyright by Global Marketing Bachem Group. Reproduction forbidden without permission Molecular Formula M r – H20 Relative Molecular Mass S Tyrosine Tyr Glutamine Gln 1-Letter Amino Acid Code 181.19 163.17 C9H11NO3 Y 146.15 128.13 C5H10N2O3 Q Periodic Chart of Amino Acids Acidic Polar, uncharged Non-polar (hydrophobic) Basic 105.09 87.08 C3H7NO3 S 75.07 57.05 C2H5NO2 G Asp Aspartic Acid 133.10 115.09 C4H7NO4 D Einblicke in die Peptidchemie Herstellung von Peptiden Wie synthetisiert man ein Peptid? Warum eigentlich Peptide synthetisieren? Kann es die Natur nicht besser? Die chemische Synthese hat Vorteile: • Beliebiger Massstab möglich • Bei kürzeren Peptiden einfacher als biologische Methoden • BSE/TSE-frei und zusätzliche Möglichkeiten: • Veränderung der Aminosäuresequenz bekannter Peptide • Modifikation von Peptiden (s.S.26) Dipeptide, daneben könnenTri- und längere Peptide entstehen: H-Ala-Ala-OH H-Ala-OH + H-Phe-OH H-Ala-Phe-OH H-Phe-Ala-OH H-Phe-Phe-OH Um wirklich nur das gewünschte Dipeptid H-Ala-Phe-OH und keine Mischung zu erhalten, braucht es 2 Schutzgruppen. Sie dürfen unter den Bedingungen der Kupplungsreaktion nicht abgespalten werden, aber leicht in einem separaten Schritt nach der Kupplung. Die Aminogruppe von Alanin muss blockiert werden: H-Ala-OH → X-Ala-OH ZIEL: Die Natur verbessern, d.h. die biologische Aktivität des Peptids zu modifizieren: • Erhöhung der erwünschten Aktivität (biologisch aktive Peptide zeigen gewöhnlich mehrere Aktivitäten) • Optimierung der Stabilität „nicht besser, aber länger“ (Peptide können nicht oral eingenommen werden und werden im Körper schnell abgebaut, was nicht günstig für ein Medikament ist) • Minimierung von Nebenwirkungen • Aufklärung von Struktur-Wirkungsbeziehungen • Synthese von Peptiden, die es in der Natur nicht gibt u.v.m. Synthese eines Dipeptids aus zwei verschiedenen Aminosäuren Beispiel: L-Alanyl-L-phenylalanin (H-Ala-Phe-OH) H-Ala-OH + H-Phe-OH H-Ala-Phe-OH + H2O Zwei Aminosäuren reagieren miteinander zum Dipeptid unter Abspaltung von Wasser. Das tun sie nicht spontan, man muss sie aktivieren, damit die Reaktion stattfindet. Für diesen Zweck hat man die sogenannten Kupplungsreagenzien entwickelt. Sie erzeugen reaktivere Derivate der Aminosäure, und entfernen das Wasser aus dem System. Doch wenn man einfach ein Kupplungsreagenz zu einer Lösung von Alanin und Phenylalanin gibt, resultiert eine Mischung der 4 möglichen 14 und die Säuregruppe vom Phenylalanin: H-Phe-OH → H-Phe-OY Jetzt kann nur noch die Säuregruppe des Alanins mit der Aminogruppe des Phenylalanins reagieren: X-Ala-OH + H-Phe-OY → nur X-Ala-Phe-OY Zum Schluss werden die Schutzgruppen entfernt: X-Ala-Phe-OY → H-Ala-Phe-OH d.h. X und Y werden unter den gleichen Bedingungen abgespalten. Jetzt wählen wir X und Y so, dass X unter Bedingungen abgespalten wird, unter denen OY erhalten bleibt: X-Ala-Phe-OY Abspaltung X H-Ala-Phe-OY Kupplung X-Leu-OH X-Leu-Ala-Phe-OY Abspaltung X, Kupplung X-Gly-OH X-Gly-Leu-Ala-Phe-OY Abspaltung X, Abspaltung Y H-Gly-Leu-Ala-Phe-OH, das gewünschte Peptid So kann man ein Peptid beliebig verlängern. X nennt man temporäre Schutzgruppe, denn sie wird nur für den Kupplungsschritt gebraucht. Y ist eine permanente Schutzgruppe. Sie muss so stabil sein, dass sie sämtliche Kupplungsund X-Abspaltungsschritte aushält. Trotzdem muss man sie im letzten Schritt abspalten können, ohne dass das Peptid beschädigt wird. Ein Peptid hat immer zwei sich unterscheidende Endgruppen, und damit eine “Richtung”. Die endständige Aminogruppe eines Peptids bezeichnet man als N-Terminus, die endständige Carboxylgruppe als C-Terminus. Bei der chemischen Synthese wird das Peptid vom C-Terminus ausgehend in Richtung N-Terminus aufgebaut, daher muss die endständige Carboxylgruppe während der ganzen Synthese geschützt sein. Unabhängig von der verwendeten Schreibweise beginnt man bei der Darstellung einer Peptidsequenz am N-Terminus, s. Tabelle 5. Tabelle 5: Schreibweisen für Peptide Schreibweise Erklärung H-Gly-Leu-AlaPhe-OH Bachem-Schreibweise, hier sind N- und CTerminus leicht zu erkennen, beide sind „frei“, nicht modifiziert Gly-Leu-AlaPhe Endgruppen werden nur explizit angegeben, wenn sie nicht frei sind GLAF 1-letter code, Endgruppen werden nur explizit angegeben, wenn sie nicht frei sind Glycyl-Lleucyl-L-alanyl-L-phenylalanine “ausgeschrieben”, vor allem bei kürzeren Peptiden üblich Aminoschutzgruppen In Tabelle 6 sind die bei der Bachem gebräuchlichsten Schutzgruppen für die α-Aminogruppe zusammengestellt. Sie werden mit unterschiedlichen Methoden abgespalten. Beispiele für Nα-geschützte Aminosäurederivate: Z-Leu-OH Boc-Ala-OH Fmoc-Phe-OH Viele Boc- oder Z-Aminosäurederivate werden als DCHA- oder CHA-Salze ((Di)cyclohexylammonium-Salze) angeboten. Salzbildung verbessert die Lagerstabilität bei säureempfindlichen Derivaten, denn auch eine Aminosäure ist eine Säure, stärker als Essigsäure!. Manche Bocoder Z-Derivate sind Öle, sie lassen sich nur als Salz in fester, kristalliner Form erhalten. Feste Produkte lassen sich viel leichter handhaben als Öle, z.B. beim Abwägen. Benzyloxycarbonyl (Z oder Cbz) ist übrigens die älteste brauchbare Nα-Schutzgruppe für Aminosäuren (Bergmann & Zervas 1932). Die Entwicklung von Z brachte den Beginn der modernen Peptidsynthese, daher auch die Abkürzung Z zu Ehren von Leonidas Zervas. Die Z-Gruppe wird heute noch häufig zum Schutz der Aminogruppe, auch in der organischen Synthese, benutzt. Schutzgruppen für Carboxylgruppen Im Gegensatz zur α-Aminogruppe muss die endständige Säuregruppe während der ganzen Peptidsynthese geschützt sein. Die gebräuchlichsten Schutzgruppen sind in Tabelle 7 zusammengestellt. Beispiele für Ester von Aminosäuren: H-Ala-OtBu · HCl H-Val-OMe · HCl H-Glu(OBzl)-OBzl · p-tosylate Ester von Aminosäuren sind nur in Form ihrer Salze mit starken Säuren wie Salzsäure (Hydrochloride) oder p-Toluolsulfonsäure (p-Tosylate) lagerstabil. Diese Salze sind auch leichter in kristalliner Form zu erhalten als die freien Aminosäureester. Die Wahl der Amino- und Carboxylschutzgruppe hängt auch von der Synthesemethode ab. Die beiden wichtigsten Methoden werden im nächsten Kapitel vorgestellt. Bei der Festphasensynthese (SPPS) ist die C-terminale Schutzgruppe ein unlösliches Polymer. Seitenkettenschutzgruppen Die Vielfältigkeit der Seitenketten der Aminosäuren und ihre grosse Bedeutung für die Eigenschaften der Peptide wurde schon erwähnt. Während der Peptidsynthese müssen manche Seitenkettengruppen permanent geschützt werden. Schauen wir uns die 20 proteinogenen Aminosäuren genauer an: 15 Einblicke in die Peptidchemie Tabelle 6: Gebräuchliche temporäre Aminoschutzgruppen Abk. Chemische Bezeichnung Spaltreagenz Fmoc 9-Fluorenylmethoxycarbonyl Piperidin Boc t-Butoxycarbonyl Trifluoressigsäure Z Benzyloxycarbonyl katalytische Hydrierung Wasserstoff / Palladium Tabelle 7: Gebräuchliche permanente Säureschutzgruppen für den C-Terminus und die Seitenketten von Asp und Glu Abk. Chemische Bezeichnung Spaltreagenz OtBu t-Butylester Trifluoressigsäure OBzl Benzylester katalytische Hydrierung Wasserstoff / Palladium OMe Methylester Basen Tabelle 8: Beispiele für Aminosäurederivate aus dem Katalog Derivat Verwendung Fmoc-Arg(Pbf)-OH Standardderivat von Arginin für die Fmoc SPPS, muss aktiviert werden Fmoc-Asn(Trt)-OPfp Standardderivat für die Fmoc-SPPS, schon aktiviert ("Aktivester"), kann direkt eingesetzt werden Z-Glu(OtBu)-OSu Derivat für die Lösungssynthese, schon aktiviert Boc-Ser(tBu)-OH NUR für N-terminales Serin! Nα- und Seitenkettenschutz werden unter den gleichen Bedingungen abgespalten Tabelle 9: Gebräuchliche Seitenkettenschutzgruppen 16 Aminosäure Schutzgruppe Hauptsächliche Verwendung Arg Pbf, Pmc Fmoc-SPPS Arg (Salzbildung) Lösungssynthese Asp, Glu OtBu Fmoc-SPPS, Lösungssynthese Asp, Glu OBzl Lösungssynthese Asn, Gln Trt, Mtt Fmoc-SPPS Cys Trt Fmoc-SPPS, Lösungssynthese Cys Acm SPPS, Lösungssynthese His Trt Fmoc-SPPS Lys Boc Fmoc-SPPS, Lösungssynthese Lys Z Lösungssynthese Ser tBu Fmoc-SPPS, Lösungssynthese Ser Bzl Lösungssynthese Thr, Tyr tBu Fmoc-SPPS Trp Boc Fmoc-SPPS Tabelle 10: Bedeutung der Abkürzungen für die Seitenkettenschutzgruppen Abkürzung Bedeutung Hauptsächliche Verwendung Acm Acetamidomethyl Cys, Fmoc-SPPS, Lösungssynthese Boc t-Butyloxycarbonyl Lys & Trp, Fmoc-SPPS tBu t-Butyl Ser, Thr & Tyr, Fmoc-SPPS Bzl Benzyl Ser (Thr, Tyr) Lösungssynthese OtBu t-Butyl ester Asp & Glu, Fmoc-SPPS OBzl Benzyl ester Asp & Glu, Lösungssynthese Pbf 2,2,4,6,7-Pentamethyldihydrobenzofuran-5-sulfonyl Arg, Fmoc-SPPS Pmc 2,2,5,7,8-Pentamethylchroman-6-sulfonyl Arg, Fmoc-SPPS Trt Trityl (Triphenylmethyl) Cys, His, Asn & Gln, Fmoc-SPPS Z Benzyloxycarbonyl Lys, Lösungssynthese Tabelle 11: Methodenvergleich Lösungssynthese versus SPPS Lösungssynthese Festphasensynthese (SPPS) Reaktionen in Lösung Gel (gequollenes unlösliches Polymer) Batchgrösse beliebig (vor allem gross) beliebig (auch sehr klein) Schnelligkeit der Synthese langsam schnell Automatisierung schwierig zu realisieren halbautomatisch oder kommerziell erhältliche Vollautomaten Synthesestrategie meistens konvergent* meistens stufenweise temporäre Schutzgrupppe meistens Boc oder Z Fmoc (Fmoc-SPPS), Boc (Boc-SPPS) Reaktionsmedium Seitenkettenschutz Minimum Maximum Materialverbrauch (Aminosäurederivate) mässig hoch Optimierung möglich möglich Reinigung + Analyse von Zwischenstufen üblich nicht möglich Endreinigung relativ einfach aufwendig * konvergente Synthese von längeren Peptiden: Zuerst werden mehrere Teilstücke synthetisiert, die am Schluss zum Endprodukt zusammengesetzt werden. Konvergent geht es etwas schneller als stufenweise, denn man kann gleichzeitg mehrere Fragmente aufbauen. Auch die Kombination „SPPS der geschützten Fragmente, danach Kupplung in Lösung“ ist möglich (z.B. Synthese von Enfuvirtid). Ala, Leu und Phe haben Seitenketten, die unter den Bedingungen der Peptidsynthese nicht reagieren. Ebenso Ile, Pro und Val. Andere Seitenkettenfunktionen können während der Peptidsynthese modifiziert werden, wenn man sie nicht blockiert. Die Carboxylgruppen von Asp und Glu und die Aminogruppe von Lys können an der Kupplung teilnehmen. Es ensteht ein Peptid mit einer fal- schen Verknüpfung oder ein verzweigtes Peptid. Andere Nebenreaktionen gibt es mit den Seitenkettenfunktionen von Cys Ser, Thr, Tyr Arg His Asn, Gln Trp Met (Schutz nur in Sonderfällen) 17 Einblicke in die Peptidchemie Die Seitenkettenfunktionen von Lysin und Cystein müssen während des Peptidaufbaus permanent blockiert sein, bei den anderen hängt es von der Peptidsequenz und der Synthesemethode ab, ob man dauerhaft schützt oder auf eine Schutzgruppe verzichten kann. Die gebräuchlichsten Seitenkettenschutzgruppen sind in Tabelle 9 zusammengestellt, in Tabelle 10 sind die Abkürzungen erklärt. Bei Lösungssynthesen müssen die Seitenketten von Asn, Gln, His, Thr, Trp, und Tyr nicht unbedingt geschützt werden. Beim Arg kann die Salzbildung mit einer starken Säure wie HCl genügen. Die Lösungssynthese stellt auch nicht ganz so hohe Ansprüche an die Stabilität von Schutzgruppen wie die SPPS. Generell gilt: Aminosäurederivate für die Peptidsynthese sollten möglichst feinkristallin (keine amorphe Masse oder Öl) und gut löslich sein. Die FmocDerivate sollten sich gut und schnell in DMF (oder NMP) lösen, besonders wichtig ist dieser Punkt bei der vollautomatisierten Fmoc-SPPS. Methoden der Peptidsynthese Wie schon erwähnt, gibt es 2 Standardmethoden der Peptidsynthese: • Festphasensynthese (Solid-Phase Peptide Synthesis, SPPS) • Lösungssynthese („Klassische Peptidsynthese“) Gemeinsamkeiten und Unterschiede der beiden Methoden sind in Tabelle 9 zusammengefasst. Die meisten Peptide, die die Bachem anbietet oder als Auftragssynthese herstellt, werden per SPPS synthetisiert. Die Lösungssynthese wird noch gewählt für die Synthese von einem Teil unserer peptidischen Generika, von sehr kurzen Peptiden (z.B. Dipeptide) und von am C-Terminus modifizierten Peptiden. Die wesentliche Vorteile der Festphasensynthese gegenüber der Lösungssynthese sind ihre Schnelligkeit und Automatisierbarkeit. Allerdings gilt: Je grösser der Ansatz, umso langsamer läuft die SPPS, da die „Handarbeit“ zunimmt. Kleine und mittlere Peptidmengen können in vollautomatischen “Synthesizern” hergestellt werden (Abb. 7). Sehr grosse Mengen (mehrere kg Rohpeptid) werden in Halbautomaten (nur noch die Waschprogramme laufen automatisch) oder manuell produziert. Die Automatisierung ist möglich, weil das Peptid stufenweise vom C-Terminus bis zum N-Terminus aufgebaut wird. Man kuppelt eine Aminosäure nach der anderen. Vier Schritte wiederholen sich dabei immer wieder: Abb. 7: Synthesizer, Vollautomaten für die Festphasen-Peptidsynthese. Das linke Bild zeigt Reaktoren, in denen gerade eine Synthese läuft. 18 Tabelle 12: Schutzgruppen für die Fmoc-SPPS Gruppe Schutzgruppe Spaltreagenz N Fmoc Piperidin Seitenketten Boc, tBu, OtBu, Trifluoressigsäure Trt, Pbf (spaltet auch vom Harz) α Stabil gegen Trifluoressigsäure Piperidin 1. Abspalten der temporären Schutzgruppe 2. Auswaschen 3. Kuppeln der nächsten geschützten Aminosäure 4. Auswaschen Ein Nachteil der SPPS ist, dass erst am Ende der Synthese, nachAbspaltung des Peptids vom Harz, gereinigt werden kann. Das bedeutet auch, dass während der Synthese am Harz kein Fehler (z.B. Kuppeln der falschen Aminosäure) passieren darf! Die Konsequenzen sind viel schlimmer als bei Fehlern bei Lösungssynthesen, bei denen man zuerst Teilsequenzen aufbaut und diese am Ende zusammensetzt (s.S. 17 und 21). Als Trägermaterial (Harz) wird bei der SPPS meistens vernetztes Polystyrol verwendet. Dieses erhält man in Form von feinen Kügelchen. Bei der Bachem wird als Trägermaterial nur mit 1% Divinylbenzol vernetztes Polystyrol (polystyrene-co-1% divinylbenzene) verwendet bzw. angeboten. Es stehen zwei Korngrössen zur Auswahl: 200 - 400 mesh = 38 - 75 mm 100 - 200 mesh = 75 - 150 mm (mesh: die bei der Polymerisation erzeugten Kügelchen werden durch Aussieben in Fraktionen einer gewissen Korngrösse aufgetrennt) Die Polystyrol-Kügelchen sind dank der Vernetzung zwar in keinem Lösungsmittel löslich, aber in manchen quellen sie auf zu einem Gel (s. Abb. 8). Erwünscht ist eine gute Quellung in Dimethylformamid (DMF) oder N-Methylpyrrolidon (NMP), den Standardlösungsmitteln der SPPS. Je besser die Quellung, desto gelartiger die Kugeln, umso schneller laufen die Reaktionen am Harz. Man unterscheidet nach der Art der temporären Nα-Schutzgruppe zwischen Fmocund Boc-SPPS, ein Wechsel Fmoc <-> Boc während der Synthese ist nicht möglich. Boc- und Fmoc-SPPS unterscheiden sich auch in der Auswahl der Seitenkettenschutzgruppen. Wegen ihrer immensen Bedeutung für die Bachem soll hier nur die Fmoc-SPPS näher besprochen werden. Sie hat sich gegenüber der billigeren Boc-SPPS wegen der milderen Reaktionsbedingungen und der daher besseren Qualität des Rohpeptides nicht nur bei der Bachem durchgesetzt. Wang-Harz (4-Alkoxybenzyl alcohol resin) und 2-Chlortrityl-Harz (2-chlorotrityl chloride resin) sind die gebräuchlichsten Harze Abb. 8: Gequollene Harzkügelchen unter dem Mikroskop. Abb. 9: Unvollständige Kupplung. Die Farbe zeigt nicht umgesetzte Aminogruppen an. 19 Einblicke in die Peptidchemie Fmoc-Ser(tBu)-Wang-Resin 1. Piperidin/DMF 2. Waschritte Abspaltung Fmoc Piperidin muss komplett entfernt werden H-Ser(tBu)-Wang-Resin 3. Fmoc-Asp(OtBu)-OH TBTU/DIPEA/DMF 4. Waschschritte werden im Überschuss eingesetzt koplettes Auswaschen der Kupplungsreagentien Fmoc-Asp(OtBu)-Ser(tBu)-Wang-Resin 1. und 2. wie oben H-Asp(OtBu)-Ser(tBu)-Wang-Resin 3. Fmoc-Gly-OH TBTU/DIPEA/DMF 4. Waschschritte Fmoc-Gly-Asp(OtBu)-Ser(tBu)-Wang-Resin 1. und 2. wie oben 3. Fmoc-Arg(Pbf)-OH TBTU/DIPEA/DMF 4. Waschschritte Fmoc-Arg(Pbf)-Gly-Asp(OtBu)-Ser(tBu)-Wang-Resin 1. und 2. wie oben 3. Fmoc-Asp(OtBu)-OH TBTU/DIPEA/DMF 4. Waschschritte Fmoc-Asp(OtBu)-Arg(Pbf)-Gly-Asp(OtBu)-Ser(tBu)-Wang-Resin 1. und 2. wie oben 3. Acetanhydrid/Pyridin/DMF 4. Waschschritte Ac-Asp(OtBu)-Arg(Pbf)-Gly-Asp(OtBu)-Ser(tBu)-Wang-Resin Endspaltung 95% TFA H-Asp-Arg-Gly-Asp-Ser-OH Rohpeptid Abb. 10: Synthese von H-3528 Ac-Asp-Arg-Gly-Asp-Ser-OH (Ac-DRGDS). TBTU (Q-1665) ist ein gebräuchliches Kupplungsreagenz. Um die Fmoc-Aminosäure mit TBTU zu aktivieren, muss man noch eine äquivalente Menge Base (DIPEA, Diisopropylethylamin) dazugeben. 20 für die Fmoc-SPPS von Peptiden mit freiem C-Terminus. Das Beladen des Harzes mit der carboxyterminalen Fmoc-Aminosäure ist nicht so einfach, daher bietet die Bachem eine grosse Auswahl von beladenen Harzen an. Man spaltet die Fmoc-Gruppe ab (nur bei Wang-Harz) und kuppelt die nächste Fmoc-Aminosäure. Die Vollständigkeit der Kupplung wird mit Farbtests bestimmt (positiv: freie Aminogruppen werden “angefärbt”; negativ: farblos, da es keine freien Aminogruppen mehr gibt). Abb. 9 zeigt, wie der Test bei einer unvollständigen Kupplung unter dem Mikroskop aussieht. Da das Peptid am Schluss der Synthese mit Trifluoressigsäure vom Harz gespalten wird, müssen auch die Seitenkettenschutzgruppen gegen diese Säure labil sein. Die verwendeten Schutzgruppen sind in Tabelle 12 zusammengefasst. Abb. 10 gibt ein Beispiel für eine SPPS eines sogenannten RGD-Peptides . Möchte man ein C-terminales Peptidamid synthetisieren, braucht man ein anderes Harz als im Beispiel, z.B. Ramage-Harz D-2200 oder Rink amide AM-resin D-1675. Nach Abspaltung von Fmoc vom Harz kup- pelt man die C-terminale Fmoc-Aminosäure drauf und verfährt weiter wie oben beschrieben. Harze wie 2-Chlorotrityl-Harz oder SASRIN erlauben es, auch vollgeschützte Peptidfragmente zu synthetisieren. Lösungssynthese Eine Lösungssynthese muss sorgfältig geplant werden. Für die Fmoc-SPPS gibt es Standardprotokolle, nach denen die Synthese der meisten Peptide gelingt (wenn auch die Qualität des Rohpeptids schlecht sein kann), für die Lösungssynthese nicht. Nicht nur bei den möglichen Schutzgruppenkombinationen, sondern auch bei den Kupplungsmethoden, verwendeten Lösungsmitteln und Aufarbeitungsmethoden herrscht bei der Lösungssynthese die grössere Vielfalt. Nicht jede denkbare Schutzgruppenkombination funktioniert. Hat man sich auf eine α-Aminoschutzgruppe (Z, Boc, Fmoc...) festgelegt, hat man damit auch die Auswahl an Seitenkettenschutzgruppen stark eingeschränkt, vor allem, wenn man sie alle in einem Schritt am Ende der Synthese abspalten möchte. Die Schutzgruppenkombination Fmoc/tBu Boc-Ala-OH + H-Ala-Pro-OBzl 1. Kupplung mit DCC (ein Kupplungsreagenz) 2. Entfernung von Bzl (Hydrierung) Boc-Ala-Ala-Pro-OH 1. Kupplung mit DCC/Base 2. Abspaltung von Boc (mit Salzsäure) + H-Arg-pNA . 2 HCl (die Salzbildung wirkt auch als Seitenkettenschutz) H-Ala-Ala-Pro-Arg-pNA · HCl Reaktion mit Bernsteinsäureanhydrid Suc-Ala-Ala-Pro-Arg-pNA (wird als Acetat verkauft) Abb. 11: Synthese von L-1720 Suc-Ala-Ala-Pro-Arg-pNA in Lösung. 21 Einblicke in die Peptidchemie Tabelle 13: Schutzgruppen für die Lösungssynthese Gruppe Schutzgruppe Spaltreagenz Stabil gegen N Boc Trifluoressigsäure katalytische Hydrierung Seitenketten evtl. C-terminal Bzl, OBzl, Z katalytische Hydrierung Trifluoressigsäure* Nα Z katalytische Hydrierung Trifluoressigsäure* Seitenketten evtl. C-terminal tBu, OtBu, Boc Trifluoressigsäure katalytische Hydrierung C-terminal OMe** Basen TFA, katal. Hydrierung α * nicht absolut stabil gegen Trifluoressigsäure, aber genügend stabil für die Lösungssynthese. der C-terminale Methylester wird häufig bei mittleren Fragmenten eingesetzt. Bei Behandlung mit der Base Hydrazinhydrat erhält man aus dem Methylester das Hydrazid ( …-XaaOMe → …Xaa-NHNH2). Dieses Derivat kann man „aktivieren“ (als Azid) und auf ein anderes Fragment mit freiem N-Terminus kuppeln (“Azidkupplung”). ** ist besonders effizient und beliebt in der SPPS, weil man die Gruppen selektiv und in beliebiger Reihenfolge abspalten kann. Eine vergleichbare Kombination in der Lösungssynthese ist Boc/Bzl bzw. Z/tBu, wie in Tabelle 13 zusammengefasst. Ein Beispiel für eine Lösungssynthese von einem am C-Terminus modifizierten Peptid, ein sogenanntes Peptidsubstrat, findet sich in Abb. 11. Das Beispiel zeigt auch den Nutzen des Baukastenprinzips: Das Fragment Boc-Ala-Ala-Pro-OH wird auch in der Synthese von anderen Substraten wie L-1180 (Boc-Ala-Ala-Pro-Ala-pNA) und Inhibitoren wie N-1280 (MeOSuc-AlaAla-Pro-Ala-chloromethylketone) verwendet. Alle Zwischenstufen werden isoliert, charakterisiert und falls nötig gereinigt. Dies kostet natürlich viel Zeit. Man kann aber häufig benötigte Fragmente in grösseren Mengen auf Vorrat synthetisie- ren und somit wieder Zeit sparen. Peptide, die in Lösung synthetisiert worden sind, werden oft per Gegenstromverteilung (Counter-Current Distribution, CCD) gereinigt. Mit dieser Methode kann man sehr grosse Mengen aufs Mal reinigen, sie dient aber meistens nur der Vorreinigung. Im Beispiel wurde Boc als temporäre NαSchutzgruppe verwendet. Generell werden in der Lösungssynthese für den temporären Schutz Boc oder Z eingesetzt. Anstelle von einem Kupplungsreagenz werden oft auch reaktive “Aktivester” von geschützten Aminosäuren verwendet. In der Lösungssynthese werden gerne Hydroxysuccinimid-ester eingesetzt (Bachem: OSu, Abb. 12). Reinigung des Rohprodukts Die Reiningung des Rohpeptids durch präparative HPLC kann bei schlechter Qualität sehr aufwendig werden. Speziell bei grossen Peptidmengen kann sich die Reinigung Boc-Ala-OSu + H-Glu(OBzl)-OBzl Boc-Ala-Glu(OBzl)-OBzl nicht wasserlöslich, löslich in organischen Lösungsmitteln EXTRAKTION + HOSu gut wasserlöslich Abspaltung von Boc... Abb. 12: Lösungssynthese, Kupplung mit Aktivester. 22 als Engpass erweisen. Sowohl bei der CCD als auch bei der präp. HPLC erhält man das gereinigte Peptid als Lösung. Das Lösungsmittel wird auf schonende Weise durch Gefriertrocknung (Lyophilisation) entfernt und man erhält gewöhnlich ein feines, weisses Pulver. Wasser lässt sich praktisch nie komplett entfernen, ist aber weder nötig noch sinnvoll. Enthält ein Peptid basische Gruppen (NTerminus, Arg, Lys, His), bindet es Trifluoressigsäure (per Fmoc-SPPS erhaltene Peptide) oder Essigsäure als Salz. Diese lässt sich nicht entfernen. Mit wenigen Ausnahmen liegen unsere Katalogpeptide als Trifluoroacetate oder Acetate vor. Disulfidbrücken Viele Peptide im Katalog haben den Zusatz „Disulfide bond“ im Namen. Eine solche Bindung wird durch die Oxidation der Thiolgruppen von zwei Cysteinen in der Peptidkette gebildet. Bei der SPPS wird diese Oxidation nach der Spaltung vom Harz, bei der auch das Trt vom Cys abgespalten wird, durchgeführt. Acm-Gruppen werden bei gleichzeitiger Oxidation zur Disulfidbrücke mit Iod abgespalten. Ein Peptid kann mehrere Disulfidbrücken enthalten. Disulfidbrücken und die korrekte Verknüpfung der Cysteinpaare (falls es mehrere Brücken sind) sind äusserst wichtig für die biologische Aktivität eines Peptids. Peptide liegen nicht als langgestreckte Ketten vor, sie bilden dreidimensionale Strukturen, die durch Disulfidbindungen stabilisiert werden. Abb. 13 und 14 zeigen Beispiele. • Eine Disulfidbrücke enthalten: z.B. Calcitonin, Somatostatin, Vasopressin, Oxytocin (natürliche Peptidhormone); Octreotide, Desmopressin (Hormonanaloge, APIs) • Mehrere Disulfidbrücken finden sich in z.B. in Endothelin (2), Conotoxin (3) GaTx1, Hepcidin-25 (4) (Peptidhormone und Toxine) • Zwei Peptidketten, durch Disulfidbrücken verbunden: Insulin, Relaxine (Peptidhormone) Abb. 13: omega-Conotoxin MVIIA. Quelle: PDB 1OMG Kohno, T., Kim, J. I., Kobayashi, K., Kodera, Y., Maeda, T. and Sato, K. Three-dimensional structure in solution of the calcium channel blocker omega-conotoxin MVIIA. Biochemistry 34, 10256-10265 (1995) Abb. 14: Humanes Relaxin (ein Hormon, hat eine ähnliche Struktur wie Insulin). Quelle: PDB 6RLX Eigenbrot, C., Randal, M., Quan, C., Burnier, J., O‘Connell, L., Rinderknecht, E. and Kossiakoff, A. A. X-ray structure of human relaxin at 1.5 A. Comparison to insulin and implications for receptor binding determinants. J. Mol. Biol. 221, 15-21 (1991) 23 Einblicke in die Peptidchemie Abb. 15: QCRF und ADS von Fmoc-Phe-OSu. einem Aminosäurederivat. Abb. 16: QCRF und ADS von Octreotid, einem Peptid, das von der Bachem auch als pharmazeutischer Wirkstoff hergestellt wird. Analyse von Aminosäuren und Peptiden Nach SPPS, Reinigung und Lyophilisation hat man ein weisses Pulver erhalten. Dieses muss jetzt in der Analytik (Quality Control, QC) genauer untersucht werden, um Antworten auf folgende Fragen zu finden: • Ist es überhaupt das gewünschte Produkt? • Wie sauber ist das Produkt? • Welche Nebenprodukte enthält es? • Wie hoch ist der Produktgehalt? Unseren QC-Abteilungen steht ein grosses Arsenal an Geräten und Methoden zur Ana- 24 lyse unserer Produkte zur Verfügung. Die Wahl der analytischen Methoden hängt auch davon ab, um was für ein Produkt es sich handelt: Eine Aminosäure, ein sehr kurzes Peptid oder ein Peptid. Manche Analysen werden auch extern durchgeführt. Identität Ist es das gewünschte Produkt? Dann entspricht ein gemessener Wert der Literaturangabe oder dem Wert der mit einer Referenz erhalten wurde. Abb. 17: Spezifikationen für das von der Bachem angebotene Triptorelin Pamoat. GENERIC APIs TRIPTORELIN ACETATE DMF H-4075-GMP, 4008442 Water content by Karl Fischer titration ≤ 7.0% Acetic acid content by HPLC 3.0 - 8.0% Assay by HPLC 95.0 - 105.0% (water- and acetic acid-free substance) Related substances by HPLC ≤ 0.5% D-Ser4-Triptorelin ≤ 0.5% D-Tyr5-Triptorelin and Triptorelin free acid (combined peak) ≤ 0.5% D-Leu7-Triptorelin ≤ 0.5% each individual unknown report each individual unknown ≥ 0.10% ≤ 1.5% total Heavy metals by ICP-MS ≤ 1 mg/kg palladium Residual organic solvents by GC ≤ 880 mg/kg DMF ≤ 5000 mg/kg n-butanol Bacterial endotoxins (Ph. Eur. 2.6.14, USP <85>) ≤ 10 IU/mg Microbial limit test (Ph. Eur. 2.6.12, USP <61>) Total aerobic microbial count (TAMC) Total yeasts and moulds count (TYMC) ≤ 103 CFU/g (0.5 g tested) ≤ 102 CFU/g (0.5 g tested) Further Information Triptorelin Acetate is a synthetic decapeptide LHRH agonist. Continuous administration results in a sustained decrease of luteinizing hormone (LH) and follicle-stimulating hormone (FSH) secretion followed by a marked reduction of testicular and ovarian steroidogenesis. The suppressive effect on gonadal steroid concentrations is indicated for the treatment of hormone-dependent prostate cancer, endometriosis, central precocious puberty, and assisted conception. Amino acid sequence Pyr-His-Trp-Ser-Tyr-D-Trp-Leu-Arg-Pro-Gly-NH2, acetate salt International non-proprietary names Triptorelin Acetate (USAN) Triptorelin (INN; BAN) (D-Trp6)-LHRH, acetate salt Molecular formula, relative molecular mass C64H82N18O13 · C2H4O2 1311.5 (net) + 60.1 (acetate) = 1371.6 (1) CAS-Number [140194-24-7] Bachem regulatory documentation Drug Master File (CTD) Additional solubility information 1% in water: clear, colorless solution 5% in water: clear, colorless solution 1% in 1% acetic acid: clear, colorless solution 5% in 1% acetic acid: clear, colorless solution 1% in PBS-buffer pH 7.2: not soluble 5% in PBS-buffer pH 7.2: not soluble Handling and storage The product remains stable for at least 36 months when stored at ≤ -15°C or 2-8°C. Prolonged exposure to elevated temperatures (> 25°C) and light should be avoided. Active substance Triptorelin Acetate is a synthetic decapeptide analog of luteinizing hormone-releasing hormone (LHRH or GnRH) with a higher potency than the naturally occurring LHRH. Continuous administration of Triptorelin Acetate results, after a short initial stimulation, in a sustained decrease in luteinizing hormone (LH) and follicle-stimulating hormone (FSH) secretion with a consequent reduction of ovarian and testicular steroidogenesis. These effects are usually reversible after cessation of therapy. Fields of application Tests Specifications Appearance white to off-white powder Appearance of solution clear, colorless to slightly colored solution in water (10 mg/ml) Identification by TLC complies Identification by HPLC complies Identification by amino acid analysis Arg 0.9 - 1.1 Glx 0.9 - 1.1 Gly 0.9 - 1.1 Specific optical rotation [α]D20 (1% in 1% acetic acid) = - 69.0 ± 3.0° (corrected for net assay) His 0.9 - 1.1 Leu 0.9 - 1.1 Pro 0.9 - 1.1 Ser 0.7 - 1.0 Trp detected Tyr 0.9 - 1.1 (1) Triptorelin Acetate exists essentially as the monoacetate equivalent to 4.4% acetic acid. The acetic acid is mainly bound to the arginine residue and, to a lesser degree, bound to the histidine residue. Its level depends on the final freeze-drying process. Zur Feststellung der Identität dienen: • Schmelzpunkt • Optischer Drehwert [a] (vgl. S.8) • Der Rf-Wert wird mit Dünnschichtchromatographie (DC oder TLC) bestimmt: Rf-Wert = Quotient Laufstrecke des Substanzflecks/Laufmittelfront. Er hängt vom Laufmittel ab (Rf immer <1) • Koelution mit Referenz (DC): Mischung Produkt mit Referenz gibt einen Fleck (und nicht zwei) • Das Molekulargewicht wird per Massenspektrometrie bestimmt. • Die chemische Zusammensetzung der Verbindung wird per Elementaranalyse bestimmt: Man bestimmt den Gehalt an Kohlenstoff, Wasserstoff und Stickstoff und vergleicht diesen mit den Werten, die sich aus der Summenformel CxHyNzOwSv.. berechnen lassen. Sauerstoff wird nur ausnahmsweise bestimmt. Im Haus kann auch Schwefel bestimmt werden. • Spektroskopische Methoden: IR-, NMR-, UV-Spektroskopie, bei Aminosäurederivaten (keine Standardmethoden!) • Koelution mit Referenz (analytische HPLC): Hauptsächlich bei Peptiden. • Aminosäurezusammensetzung: Aminosäureanalyse (AAA), das Peptid wird mit starker Säure in die einzelnen Treatment of prostate carcinoma Administration of Triptorelin Acetate leads to suppression of gonadotropins and a subsequent fall in peripheral circulating levels of testosterone and dihydrotestosterone in male. In hormonedependent prostate carcinoma, a tumor remission or retardation of tumor progression is frequently observed after treatment with Triptorelin Acetate. This is accompanied by an improvement of function and objective symptoms. Management of endometriosis Continued administration of Triptorelin Acetate suppresses estrogen secretion which results in a shrinking of the uterine and ectopic endometrial tissue and in the relief from the symptoms of abdominal pain, dysmenorrhoea, and menorrhagia. Treatment of central precocious puberty Triptorelin Acetate reduces the premature stimulation of gonadotropin secretion in children with central precocious puberty and allows normal physiological growth and development. Normal pubertal development is resumed after discontinuation of Triptorelin Acetate therapy. Aminosäuren gespalten, die resultierende Mischung wird chromatographisch aufgetrennt und die Aminosäuren quantifiziert. Die Korrektheit der Aminosäuresequenz lässt sich mit dieser Methode nicht überprüfen. Reinheit Die Reinheit wird bestimmt per: • Dünnschichtchromatographie (DC), bei Aminosäurederivaten, sehr kurzen Peptiden, Biochemikalien: Die DC ist eine oft unterschätzte Methode! Man kann auch Referenzmaterial von potentiellen Verunreinigungen, z.B. die Edukte, mitlaufen lassen und hat eine grosse Auswahl an Detektionsmethoden. • Analytische Hochdruckflüssigkeitschromatographie (analytische HPLC oder die schnellere Variante RSLC): Standardmethode bei Peptiden • “Optische Reinheit”: Gehalt am falschen Enantiomer, (s.S. 7). Ein wichtiger Wert bei Aminosäurederivaten und beladenen Harzen. Produktgehalt Neben während der Synthese entstandenen Verunreinigungen enthalten unsere Produkte oft auch geringe Mengen Restlösungsmittel und/oder Wasser. Peptide enthalten meistens auch Trifluoressigsäure oder Essigsäure, die fest als Salz gebunden 25 Einblicke in die Peptidchemie ist. Diese Verbindungen werden mit den Methoden, mit denen man die Reinheit des gewünschten Produkts bestimmt, nicht erfasst. Um z.B. einen Reaktionsansatz zu berechnen, müssen Parameter wie der Wassergehalt bekannt sein. • Wassergehalt: Bestimmung mit KarlFischer-Titration (KF-Titration). • Restlösungsmittel: Bestimmung per Gaschromatographie. • Essigsäuregehalt: Mit HPLC oder Ionenchromatographie. • Rest-TFA, bei unseren API-Peptiden, die als Acetat verkauft werden: per Ionenchromatographie • Titration mit Säure- oder Basenlösungen: Bei Produkten, die Basen oder Säuren sind. • Halogenidbestimmung: Der Chlorid- oder Bromidgehalt kann bei Produkten, die als die entsprechenden Salze verkauft werden, per Titration mit Silbernitratlösung bestimmt werden. • Stickstoffgehalt (aus Elementaranayse): Dieser ist bei Peptiden ein Mass für den Peptidgehalt. Die Ergebnisse der Analysen werden auf dem QCRF (Quality Control Release Form), welches nur für den internen Gebrauch bestimmt ist, hinterlegt. Eine Auswahl der erhaltenen Ergebnisse findet sich auf dem ADS (Analytical Data Sheet) das den Kunden, die das Produkt kaufen, zur Verfügung steht (s. Abb. 15 und 16). Bei GMP-Produkten kommen auch noch mikrobiologische Analysen dazu, die bei der Bachem in einem spezialisierten Labor durchgeführt werden (s.Abb. 17) Bei vielen unserer Generika sind die durchzuführenden Analysen durch die Europäische Pharmakopöe* vorgeschrieben. Das Pharm. Eur. im Namen bedeutet, dass die Wirkstoffe den Spezifikationen der Pharmakopöe entsprechen. z.B. Deslorelin High Acetate Pharm. Eur. * Modifizierung von Peptiden Die Modifikation eines Peptides bedeutet eine bleibende chemische Veränderung des Moleküls, im Gegensatz zu den Schutzgruppen, die nach der Synthese wieder abgespalten werden. Peptide können auf verschiedenste Weise modifiziert werden. Auch in der Natur findet man eine grosse Anzahl von Peptid/Proteinmodifikationen. Einige sind wichtig für die Bioaktivität oder die Funktion des Moleküls (z.B. Pro im Kollagen wird enzymatisch zu Hydroxyprolin oxidiert; Seitenketten-Phosphorylierung von Ser, Thr oder Tyr), andere sind “unerwünscht”, sogar Indikatoren für pathologische Prozesse. Modifikationen wie N-terminale Acetylierung oder Pyroglutaminbildung und C-terminale Amidierung dienen auch in der Natur zur Stabilisierung von Peptiden. “Blockierte” Peptide werden weniger schnell enzymatisch abgebaut. Natürliche Peptidhormone sind häufig an den Endgruppen modifiziert, z.B. Gonadorelin, TRH. Die C-terminale Amidgruppe wird durch enzymatischen Abbau von einem Glycinrest erhalten, ein anderes Enzym katalysiert die Zyklisierung von Gln zu Pyr: H-Gln-Xaa-Yaa-…-Zaa-Gly-OH → Pyr-Xaa-Yaa-…-Zaa-NH2 Da die Oxidation von Methionin (s.S.11) in Peptiden häufig zur Deaktivierung führt, werden biologisch aktive Peptide durch den Ersatz von Met durch das analog gebaute, aber nicht oxidierbare Norleucin (Nle) stabilisiert. Chemische Modifikationen erlauben auch, die räumliche Struktur eines Peptids zu fixieren oder zu verändern. Bei der chemischen Synthese von Peptiden hat man viele Möglichkeiten zur Modifizierung. Der N-Terminus lässt sich am einfachsten verändern. Es braucht nur einen zusätzlichen Schritt bei der SPPS. Wichtige N-terminale Modifikationen: • Acetylierung Eine Pharmakopöe (Arzneimittelbuch) ist eine Zusammenstellung anerkannter pharmazeutischer Regeln über die Qualität, Prüfung, Lagerung und Bezeichnung von Arzneimitteln und die bei ihrer Herstellung und Prüfung verwendeten Stoffe, Materialien und Methoden. In der Schweiz gilt die Europäische Pharmakopöe. 26 • Biotinylierung - Biotin (= Vitamin B7) (Im Katalog lassen sich viele Beispiele für acetylierte und biotinylierte Peptide finden.) Biotinylierte Peptide binden spezifisch an das Protein Avidin. • “Fluorophore” - Mca, Abz, FITC (Die modifizierten Peptide fluoreszieren und sind in geringsten Mengen detektierbar.) Auch die Seitenketten von Cys und Lys lassen sich leicht modifizieren, hierfür finden sich einige Beispiele im Katalog. H-Lys(biotinyl)-Lys-Glu-Asp-Val-Val-AbuCys-Ser-Abu-Ser-Tyr-Lys-Lys-NH2 (M-2130) Das “Rückgrat” des Peptids lässt sich durch Einbau von speziellen Aminosäuren verändern: • D-Aminosäuren • N-Methyl-Aminosäuren • Nicht-proteinogene Aminosäuren (“unusual amino acids”) • Ersatz der Peptidbindung durch andere Bindungen (z.B. “reduzierte Peptide“) • Ringschluss, z.B. Disulfidbrücke (s.S.23) Peptidamide, die wichtigste Modifikation der endständigen Carboxylgruppe, sind leicht zugänglich per SPPS. Man synthetisiert sie auf einem der speziell dafür entwickelten Harze wie “Ramage-Harz” (D-2200). Für andere C-terminale Modifikationen braucht es viel Aufwand. Ein Beispiel für Modifikationen: natürliches Peptid Leu-Enkephalin (H-2740) H-Tyr-Gly-Gly-Phe-Leu-OH leicht modifiziert (3,5-Dibromo-Tyr1)-Leu-Enkephalin (H-2575) H-3,5-Dibromo-Tyr-Gly-Gly-Phe-Leu-OH Leu-Enkephalin amide (H-2745) H-Tyr-Gly-Gly-Phe-Leu-NH2 stark modifiziert DAMGO (H-2535) H-Tyr-D-Ala-Gly-N-Me-Phe-glycinol (D-Pen2,p-chloro-Phe4,D-Pen5)-Enkephalin (H-8875) H-Tyr-D-Pen-Gly-p-chloro-Phe-D-Pen-OH 2011158 Bachem AG, Hauptsitz in Bubendorf (Schweiz). Marketing & Sales Contact Bachem AG Tel. +41 61 935 2323 [email protected] Americas Bachem Americas, Inc. Tel. +1 888 422 2436 [email protected] Visit our website www.bachem. com or shop online shop.bachem.com All information is compiled to the best of our knowledge. We cannot be made liable for any possible errors or misprints. Some products may be restricted in certain countries. www.bachem. com shop.bachem.com Published by Global Marketing, Bachem Group, July 2014 Europe, Africa, Middle East and Asia Pacific: