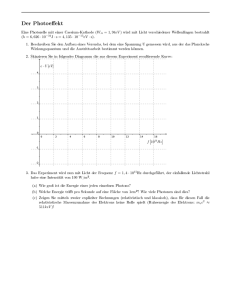
Waerme und statistische Mechanik Temperatur: neue Groesse in
Werbung

Waerme und statistische Mechanik Temperatur: neue Groesse in der Zustandsgleichung z.B. p V=n R T 1. HS: dQ = dU - dW = dU + p dV Waermemenge (Uebergangsgroesse) ∆Q = Innere Energie ∆U = Waermeenergie ist mechanische Energie der atomaren Teilchen Aber: ungeordnet, statistisch -- verteilt auf viele Teilchen Fragen: werfe Cu Block aus dem Fenster– wird er dabei waermer? er trifft hart auf dem Boden auf und bleibt liegen – ist er jetzt waermer? welche Temperatur hat ein CO2 Molekuel? welches T hat ein Urankern (A=238) ? Elementare Herleitung der statistischen Relationen fuer die Waerme Gasatome (z.B. Ar) schwirren in einem Volume Nur elastische Stoesse == ideales Gas V bei Temperatur T [K] herum. p 1. Atome treffen auf eine Wand und werden reflektiert px Impulsuebertrag auf die Wand: ∆px= 2 px f(vx)dvx 2. Zahl der Stoesse/s = n vx A ½ Flaeche A Nur die Haelfte fliegt nach rechts A n vx• 1 s 3. Kaft auf Flaeche A: F = Impuls/Zeit = Stoesse/s * Impulsuebertrag/Stoss F = n vx A ½ n 2 px = 2 n ½ m vx2A = ∫ 2/3 n ½ m v2 A f(v)dv 4. Druck auf die Wand: p=F/A: 2/3nn ½ <Em >2 = 2/3 n Ekin p = 2/3 kinv Grundbeziehungen der statistischen Mechanik Druck: p = 2/3 n <Ekin> P V = 2/3 nV <Ekin> = ν R T Vergleich mit Gasgleichung nV = Zahl der Atome = ν NA <Ekin> = 3/2 R/NA T = 3/2 k T T = 2/3 <Ekin>/k Temperatur ist ein Mass fuer die mittlere ungeordnete kinetische Energie eines Atoms! U = < Ekin(Gasvolumen)> + <Epot(Gasvolumen)> ≈ < Ekin(Gasvolumen)> = ν NA <Ekin>= ν NAk 3/2 T Ideales Gas = ν 3/2 R T Innere Energie ist die totale ungeordnete mechanische Energie In idealen Gasen ist die potentielle Energie Null Wie messe ich die absolute Temperatur ? Messe mittlere kinetische Energie eines Atoms in einem idealen Gas Ist Ekin=o T= 0 (absoluter Nullpunkt) Gasthermometer mit idealem Gas p= 2/3 n <Ekin> T = p * V/(ν R) (messe p bei festem Volumen V, definiere T= 273 K bei schmelzendem Eis) Welches Gas nehmen wir? Was ist ideal Wann ist He kein ideales Gas mehr? Van der Waals: Binnendruck (p-a/V2) (V-b) = ν RT Eigenvolumen Fluessigkeit: V≈b Beispiel: Temperaturmessung von kalten Gasen Dichtewverteilung einer Na Gaswolke In einer Magnetooptischen Falle Durchmesser der Woke ca. 2 mm ~ 100000 Atome Hoehe der Potentialmulde ~B Schalte B- Feld aus Wolke faellt im freien Fall nach unten und expandieret dabei lateral in x-Richtung Grund der thermischen Geschwindigkeit vx der Atome Messe die breite der Wolke waehrend der Fallzeit Ergebnis: vx ≈ 6 mm/s Schaetzen sie die Temperatur der Na –Wolke ab! k= 1.38 E-23 J/K mu= 1.65 E-27 kg Na: Atomgewicht = 22 mu T = m vx2 /k = 95 nK Zustandsgleichung und Kreisprozesse 1. HS: Energieerhaltung dQ=dU - dW 2. Hauptsatz: nicht alle energetisch moeglichen Prozesse treten auf! dS = dQ/T >= 0 fuer abgeschlossenen Systeme (Entropie nimmt zu) Oder Wirkungsgrad einer zyklisch laufenden Waermekraftmaschine ist maximal η <= (T1-T2)/T1 (Ingenieure) Spezifische Waermen: CV (Mol) = dU/T = 3/2 R (fuer ideales Gas) Cp (Mol) = dQ/T = 5/2 R (fuer ideales Gas) Allgemeiner bei Gasen: 3/2 f/2 konstantes Volumen (dQ=dU) konstanter Druck (f= Zahl der Freiheitsgrade ) ∆U = cV (T2-T1) bei jedem Prozess, der die Temperatur von T1 nach T2 aendert Prozesse im p-V Diagramm: p p V =ν R T T1 Evaluiere ∆ Q = ∆U - ∆W fuer jeden Prozess, der von 1 2 fuehrt T2 V 1. Isotherme Expansion T2=T1! ∆U = ? ∆W = - ∫ p dV = ? ∆ Q = ∆U - ∆W ∆S = ? 2. adiabatisch: ∆ Q = 0! ∆W = - ∆U ∆U= ? 3. isobare Expansion p=const.