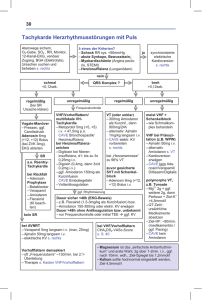
Differenzierte therapeutische Optionen für die häufigste
Werbung

óó Original- und Übersichtsarbeiten Vorhofflimmern Differenzierte therapeutische Optionen für die häufigste Rhythmusstörung PATRICK SCHAUERTE, OBEIDA RADA, EROL SAYGILI, KARL MISCHKE1 Abstract óó Die multimodale Therapie der chronischen Volkserkrankung Vorhofflimmern (VHF) stellt eine Herausforderung an den Arzt dar. Wichtigstes Ziel ist die Verhinderung von Thromboembolien. Hierzu ist eine sorgfältige Analyse der thromboembolischen Risikofaktoren notwendig, die regelmäßig wiederholt werden sollte. Die Entscheidung zur Frequenz- vs. Rhythmuskontrolle ist abhängig von der subjektiven Symptomatik des Patienten. Derzeit gibt es keine sicheren Hinweise für eine prognostische Überlegenheit der Aufrechterhaltung des Sinusrhythmus. Interventionelle Verfahren der Katheterablation ermöglichen bei hochsymptomatischen Patienten eine effiziente Verbesserung der Lebensqualität. Eine individuelle Risiko-Nutzen-Analyse sollte jedoch erfolgen. Die Behandlung von Begleiterkrankungen wie arterieller Hypertonie und Herzinsuffizienz sowie Diabetes mellitus ist wesentlicher Bestandteil einer differenzierten VHF-Therapie. Unabhängig davon scheint die antifibrotische Therapie mit ACE-Hemmern oder AT1-Antagonisten bei VHF günstig den Progress der Erkrankung zu beeinflussen. óó Schlüsselwörter Vorhofflimmern ó Ablation ó Antikoaglulation óó 1Medizinische Klinik I, Universität Aachen 66 óóóó VHF ist die bei „eitem häufigste Rhythmusstörung. Etwa 2,3 Mio. Amerikaner sind an VHF erkrankt [1, 2], während man in Deutschland von etwa 1 Mio. Betroffenen ausgehen kann. Die Anzahl der Menschen mit VHF wird in den Vereinigten Staaten bis zum Jahr 2050 voraussichtlich auf über 10 Mio.ansteigen [3]. VHF tritt vor allem mit zunehmendem Lebensalter auf. Während vor dem 40. Lebensjahr weniger als 1% der Bevölkerung von dieser Rhythmusstörung betroffen sind, sind es im Alter von 55—65 Jahren schon 3—4% und bei den > 80 Jahre alten Menschen > 10% [2, 4]. Darüber hinaus tritt VHF bei Patienten mit struktureller Herzerkrankung sowie arterieller Hypertonie oder Diabetes mellitus gehäuft auf [2]. Mehr als 50% aller VHF-Episoden bleiben asymptomatisch [5, 6]. Auf der anderen Seite leiden gerade jüngere Patienten mit paroxysmalem VHF häufig an innerer Unruhe und Leistungsschwäche. Abb. 1 verdeutlicht die aufgrund der wechselnden Zykluslänge bei VHF z.T. stark variierenden Blutdruckamplituden, die zur Symptomatik bei VHF beitragen können. Die Sterblichkeit von Menschen mit VHF ist im Vergleich zur Normalbevölkerung etwa doppelt so hoch und liegt in kontrollierten Studien zwischen 1,6—4,2% pro Jahr [7]. Die Ursachen liegen v.a. in einem erhöhten thromboembolischen Risiko sowie weiteren kardiovaskulären Komplikationen wie z.B. einer Verschlechterung der linksventrikulären Pumpfunktion bis hin zu einer Tachykardiomyopathie [8—10]. Unter prognostischen Aspekten (Gesamtsterblichkeit) konnte bisher keine größere randomisierte Studie einen Vorteil der Rhythmuskontrolle gegenüber der Frequenzkontrolle belegen [10—14]. Dies gilt unabhängig davon, welche Begleiterkrankungen, z.B. Herzinsuffizienz, vorliegen [15]. Einschränkend gilt aber bei allen Untersuchungen zu berücksichtigen, dass die geringe Zahl tatsächlich im Sinusrhythmus befindlicher Patienten in der Rhythmuskontrollgruppe, die häufig vorzeitige Beendigung der Antikoagulation bei Erhalt des Sinusrhythmus sowie die proarhythmische Wirkung von v.a. Klasse-I-Antiarrhythmika das Ergebnis der Rhythmuskontrollgruppe negativ beeinflusst haben. Erste Hinweise auf einen derartigen Zusammenhang konnten auch in einer retrospektiven Subanalyse gefunden werden, die nachwies, dass bei den Patienten, die tatsächlich im Sinusrhythmus blieben, das Mortalitätsrisiko signifikant gesenkt werden konnte [16]. CARDIO VASC 2009 | 3 © Urban & Vogel Original- und Übersichtsarbeiten óó Tabelle 1 Wichtige Begriffsbestimmungen unter therapeutischen Aspekten Chronisch paroxysmales VHF: intermittierende Episoden (≤ 7 Tage) Chronisch persistierendes VHF: anhaltende Episoden (> 7 Tage) Permanentes VHF*: keine Kardioversion mehr möglich oder erwünscht Antikoagulation: Therapie mit Vitamin-K-Antagonisten Antithrombozytäre Therapie: ASS 100 mg, in Einzelfällen Clopidogrel 75 mg Rhythmuskontrolle: Versuch, den Sinusrhythmus aufrechtzuhalten Frequenzkontrolle: Belassen des VHF, Kontrolle der Kammerfrequenz durch Modulation der atrioventrikulären Überleitung sind kritisch, da hier eine Blutung begünstigende, aber bislang unbekannte Erkrankungen (z.B. Kolonpolypen, Gastritiden) demaskiert werden können. Darüber hinaus tragen aber auch die z.T. erheblichen INR-Schwankungen in der Einstellungsphase zum erhöhten Blutungsrisko bei. Bei alten Patienten ist daher ein vorsichtiger Beginn der Antikoagulation unter engmaschigen INRKontrollen mit angestrebten INR-Zielwerten von 2—2,5 sinnvoll. Dabei sollte besonderer Wert auf eine engmaschige Blutdruckkontrolle gelegt werden. *Aufgrund der Effizienz der Ablation auch als langjährig persistierendes VHF bezeichnet Die Studien zur Frequenz- vs. Rhythmuskontrolle haben v.a. gezeigt, dass aus prognostischer Sicht die Abschätzung des thromboembolischen Risikos und der daraus abgeleiteten notwendigen antithrombozytären oder Antikoagulationstherapie vorrangig ist. In einem zweiten Schritt ist dann die Frequenzkontrolle zunächst die Therapie der ersten Wahl. Bei ungenügender Frequenzkontrolle oder nicht akzeptabler individueller Lebensqualität und Belastbarkeit des Patienten sollte eine Rhythmuskontrolle durchgeführt werden (vgl. auch Abb. 3). Im Folgenden wird kurz auf die drei zentralen therapeutischen Strategien (siehe auch Tab. 1) bei der Behandlung des VHF eingegangen. Verhinderung von thromboembolischen Komplikationen Da dem therapeutischen Nutzen einer antithrombozytären oder Antikoagulationstherapie das Risiko zum Teil schwerer Blutungskomplikationen gegenübersteht, muss für jeden Patienten eine individuelle Nutzen-Risiko-Abwägung erfolgen. Ein im klinischen Alltag einfach zu implementierender Risikoscore bei nicht valvulärem VHF ist der CHADS2-Score [9], dessen Kriterien und die daraus abgeleiteten Therapieempfehlungen in Tab. 2 und Tab. 3 dargestellt sind. Im Folgenden sind kurz einige Erläuterungen zur antithrombozytären bzw. Antikoagulationstherapie bei Patientengruppen dargelegt, die ein deutlich erhöhtes Blutungsrisiko aufweisen. Hierzu zählen u.a. Patienten mit Blutungskomplikationen in der Vorgeschichte und Menschen höheren Lebensalters [17]. Darüber hinaus wird kurz auf die Antikoagulation im Umfeld einer Kardioversion eingegangen. Antikoagulation bei VHF im hohen Lebensalter Patienten jenseits des 80. Lebensjahres weisen ein erheblich höheres Blutungsrisiko unter Antikoagulation auf [18]. Zu den Faktoren, die insbesondere im hohen Alter Blutungen begünstigen, zählen überhöhte INR-Werte (> 4,0), ein CHADS2-Score von mindestens 3 und ein erst kürzlich zurückliegender Beginn der Antikoagulanzientherapie [18]. Vor allem die ersten 90 Tage nach Initiierung einer Therapie mit Vitamin-K-Antagonisten CARDIO VASC 2009 | 3 © Urban & Vogel Antikoagulation bei VHF und KHK Anspruchsvoll ist die Wahl der antithrombozytären und Antikoagulationstherapie bei Patienten mit begleitender koronarer Herzerkrankung (KHK). Hier liegen derzeit keine gesicherten Daten vor, sodass die Empfehlungen lediglich auf Expertenmeinungen beruhen. In die Empfehlungen gehen zwei Erkenntnisse ein: Eine Therapie mit Aspirin und Clopidogrel bei VHF und erhöhtem thromboembolischem Risiko ist einer Therapie mit Vitamin-K-Antagonisten hinsichtlich der Verhinderung thromboembolischer Ereignisse unterlegen [19]. Eine Dreifachtherapie mit Aspirin + Clopidogrel + Vitamin-K-Antagonisten wiederum erhöht das Blutungsrisiko erheblich, sodass eine Anwendung nicht regelhaft erfolgen sollte [20]. Im Einzelnen sehen die Empfehlungen wie folgt aus [9, 21]: Bei einem CHADS2-Score ≤ 1, kann die jeweils zur Therapie der KHK notwendige Hemmung der Thrombozytenaggregation mit Asprin und/oder Clopidogrel entsprechend des jeweiligen Behandlungsstatus (Stentimplantation, Koronarsyndrom, [N]STEMI) erfolgen. Liegt der CHADS2-Score > 1 wird bei stabiler KHK eine alleinige Therapie mit einem Vitamin-K-Antagonisten empfohlen, da durch zusätzliche Aspiringabe das Blutungsrisiko erhöht wird, ohne dass eine Senkung der kardiovaskulären Ereignisrate erzielt wird. Wenn bei einem CHADS2-Score > 1 eine Stentimplantation notwendig ist, sollte ein unbeschichteter Stent implantiert werden und für vier Wochen eine Thrombozytenaggregationshemmung bevorzugt mit Clopidogrel [9], alternativ mit Aspirin [21], und eine Therapie mit Vitamin-K-Antagonisten erfolgen. Nach vier Wochen empfiehlt sich dann bei stabiler KHK die alleinige Antikoagulation. Sollte die Implantation eines beschichteten Stents notwendig sein, wird die Therapie mit Clopidogrel oder Aspirin und einem Vitamin-K-Antagonisten für 6—12 Monate vorgeschlagen. Eine dreifache Therapie mit Aspirin + Clopidogrel + Vitamin-K-Antagonisten sollte nur bei Notwendigkeit der Verhinderung koronarer Ereignisse bei speziellen Einzelbefunden mit hohem Stent-Thromboserisiko erfolgen. Hier sind dann engmaschige INR-Kontrollen (bevorzugt 2—2,5) sowie Blutdruckkontrollen angeraten [22]. 67 óó Original- und Übersichtsarbeiten Abb. 1 Tafel A zeigt die arterielle Blutdruckkurve eines Patienten zu Beginn einer VHFAblation. Die schnelle und irreguläre Kammeraktion führt zu stark wechselnden Blutdruckamplituden. Tafel B: gleicher Patient im Sinusrhythmus nach VHF-Ablation. Perioperative Antikoagulation bei VHF Perioperativ kann bei niedrigem und moderatem thromboembolischem Risikoprofil abhängig vom operativen Blutungsrisiko bis zu einer Woche die Therapie mit Vitamin-K-Antagonisten ausgesetzt werden. Bei hohem thromboembolischemRisiko ist eine überlappende Gabe zum Beispiel von niedermolekularem Heparin notwendig [9]. Antikoagulation vor/nach Kardioversion Vor einer Kardioversion sollte entweder für drei bis vier Wochen eine effektive (INR 2—3) Antikoagulation erfolgen, um etwaige Thromben aufzulösen, oder ein Thrombenauschluss via trans-ösophagealer Echokardiografie (TEE) erfolgen [9]. Nach medikamentöser oder elektrischer Kardioversion sollte für drei bis vier Wochen eine Antikoagulation erfolgen. Dies beruht darauf, dass sich selbst bei vorherigem Ausschluss von Vorhofthromben im TEE aufgrund der verminderten Vorhofkontraktilität in den ersten Tagen nach Kardioversion Tabelle 2 CHADS2-Score zur Abschätzung des thromboembolischen Risikos CHADS2-Score 0 % Insult/Jahr 2 1 3 2 3 4 5 6 4 6 9 12 18 Tab. 2 CHADS2-Score zur Abschätzung des thromboembolischen Risikos bei nicht valvulärem VHF. Sollten Patienten mit VHF zusätzliche thromboembolische Risikofaktoren aufweisen, wird diesen jeweils ein Punktwert (Score) zugeordnet, wobei mehrere Punktwerte sich addieren (linke Tabelle). Die Gesamtpunktzahl zeigt das jährliche thromboembolische Risiko an (rechte Tabelle). (modifiziert nach [9]). CHADS2: Chronische Herzinsuffizienz = 1; Hypertonie = 1; Alter > 75 J. = 1; Diabetes mellitus = 1; Schlaganfall/Embolie/TIA = 2 68 Thromben bilden können. Diese können bei wiedergewonnener atrialer Pumpkraft im Sinusrhythmus als Embolus aus dem Vorhof weggeschwemmt werden. Insbesondere kurzfristig vor, während und nach einer Kardioversion kann die subkutane Gabe von niedermolekularen Heparinen (z.B. Enoxaparin) in gewichtsadaptierter Dosis das therapeutische Handeln vereinfachen [23]. Hierbei sollte insbesondere bei Nierenfunktionsstörung und Adipositas jedoch die Anti-Faktor-Xa-Aktivität überwacht werden. Frequenzkontrolle Nach den Europäischen Richtlinien wird eine adäquate Frequenzkontrolle dann erzielt, wenn die Herzfrequenz in Ruhe nicht 80/min und unter moderater Belastung (z.B. Äquivalent eines 6-Minuten-Gehtestes) nicht 110/min regelhaft überschreitet [9]. Darüber hinaus kann auch das fehlende Überschreiten der altersentsprechenden Maximalfrequenz um über 110% als Kriterium hinzugezogen werden [10]. Zur Überprüfung der Güte der Frequenzkontrolle eignet sich besonders das häusliche Langzeit-EKG unter Abbildung der alltäglichen Belastungsszenarien sowie ein Belastungs-EKG. Pharmakologische Therapieansätze Es ist häufig schwierig, bei der Kammerfrequenzkontrolle einen Mittelweg zwischen effektiver Frequenzbegrenzung und Vermeidung von kritischen Bradykardien zu wahren. Hierbei sollte berücksichtigt werden, dass gelegentliche Tachykardien kürzerer Dauer bei asymptomatischen Patienten durchaus akzeptabel sein können. Auf der anderen Seite müssen asymptomatische (v.a. nächtliche) Bradykardien von 2—3 s Dauer nicht regelhaft zu einer Reduktion der negativ dromotropen Medikation führen, wenn dadurch eine suffiziente Frequenzkontrolle aufgegeben wird. Die Zahl und Wahl der Präparate mit negativ dromotroper Wirkung orientiert sich an den Zielen der Frequenzkontrolle und der Komorbidität der Patienten. Betarezeptoren-Blocker Insbesondere die kardioselektiven Blocker sind als Medikamente der ersten Wahl zu betrachten. Ihr Vorteil liegt v.a. in der Begrenzung der Kammerfrequenz bei körperlicher Belastung. Nachteile sind Hypotonie und mögliche Impotenz bei jüngeren Patienten. Bei Patienten mit Herzinsuffizienz sind Betablocker ebenfalls zu bevorzugen. Allerdings muss beach- CARDIO VASC 2009 | 3 © Urban & Vogel Original- und Übersichtsarbeiten óó Tab. 3 Thromboembolische Risikofaktoren bei VHF und daraus abgeleitete Therapieempfehlungen. Die CHADS2-Kriterien sind in rot dargestellt und umfassen im Wesentlichen die moderaten und hohen thromboembolischen Risiken (modifiziert nach [9]). Tabelle 3 Thromboembolische Risikofaktoren bei Vorhofflimmern und daraus abgeleitete Therapieempfehlungen Schwach/nicht valid. Risikofaktor Moderater Risikofaktor Hochrisikofaktor Alter 65–74 Alter ≥ 75 Hirninsult, TIA KHK Hypertonie Embolie Hyperthyreose CHF: Herzinsuffizienz (EF < 35%) Mitralstenose Weibl. Geschlecht Diabetes mellitus Klappenersatz Kein Risiko CHADS2 = 0 ASS 100–325 mg/die 1 moderater Risikofaktor CHADS2 = 1 ASS 100–325 mg/die tet werden, dass insbesondere oder nicht valid. Risikofaktoren oder Marcumar (INR 2–3) in der Aufsättigungsphase die Dosis behutsam gesteigert wird, ≥ 2 moderate Risikofaktoren CHADS2 ≥ 2 Marcumar (INR 2–3) da die initial negative inotrope ≥ 1 Hochrisikofaktor Marcumar (INR 2–3) Wirkung die Herzinsuffizienz vorübergehend verschlechtern bei VHF eingesetzt werden. Erhebliche Nebenwirkungen von kann. Eine synergistische Wirkung der ß-Blocker kann auch Amiodaron in der Langzeittherapie (u.a. Hyper-/Hypothyreose, bei Vorliegen einer KHK und/oder einer arteriellen Hypertonie Hornhauteinlagerungen, Photosensibilisierung und Lungenerzielt werden. fibrose) sollten aber zu einer sorgfältigen Abwägung des Einsatzes führen. Kalziumantagonisten Verapamil und Diltiazem, zwei Nicht-Dihydropyridin-Kalziumantagonisten, eignen sich ebenfalls zur Kammerfrequenzkontrolle. Aufgrund der Gefahr höhergradiger Leitungsblockaden sollten sie nicht regelhaft mit Betablockern kombiniert werden. Ihre vasodilatatorische Komponente kann zu arterieller Hypotension führen. Die negativ inotrope Wirkung macht sie zudem für die Therapie bei fortgeschrittenen Stadien der Herzinsuffizienz weniger geeignet. Digitalispräparate Digitalispäparate weisen eine schwächere negativ dromotrope Wirkung auf als Betablocker oder Kalziumantagonisten, haben jedoch den Vorteil, dass sie nicht den Blutdruck durch periphere Vasodilatation senken. Daher macht ihr Einsatz besonders bei Herzinsuffizienz Sinn. Die Kammerfrequenzsenkung bei erhöhter sympathischer Aktivierung, z.B. bei körperlicher Belastung, ist allerdings gering, sodass sie für jüngere, herzgesunde Patienten weniger geeignet sind [24]. Es gilt, die überwiegend renale (Digoxin) bzw. hepatische Elimination (Digitoxin) zu berücksichtigen. Klasse-III-Antiarrhythmika Sotalol weist Betablocker-Wirkung und eine Klasse-III-Wirkung auf. Zu berücksichtigen ist, dass die Betablocker Wirkung bei niedrigeren Plasmaspiegeln eintritt als die Klasse-III-Wirkung. Darüber hinaus sind gravierende Nebenwirkungen, v.a. polymorphe ventrikuläre Tachykardien, zu befürchten, die insbesondere bei Frauen und eingeschränkter Nierenfunktion gehäuft auftreten. Regelmäßige QT-Dauer-Bestimmungen sind notwendig. Daher sollte Sotalol nicht als reiner Betablocker wahrgenommen und nicht zur Frequenzkontrolle eingesetzt werden. Bei Neigung zur arteriellen Hypotonie bzw. therapierefraktären Tachykardie kann auch Amiodaron aufgrund seiner negativ dromotropen Wirkung zur Kammerfrequenzkontrolle CARDIO VASC 2009 | 3 © Urban & Vogel Abb. 2 Ablation von Vorhofflimmern. 24-jähriger Patient mit dilatativer Kardiomyopathie und chronisch paroxysmalem VHF seit 2001. Im Rahmen von tachykarden Episoden kam es rezidivierend zu inadäquaten Schockabgaben des sekundärpräventiven implantierten Cardioverter-Defibrillators (ICD). Die Abbildung zeigt die dreidimensionale Darstellung der Anatomie des linken Vorhofs von dorsokranial mit einem magnetischen Katheter-Navigationsverfahren. Die septalen Pulmonalvenen sind als grüne, die lateralen Venen als rote Röhren dargestellt. Jede Ablationsläsion ist als roter Punkt abgebildet. Zunächst wurden die Pulmonalvenenmündungen und ein Teil des angrenzenden Vorhofs (Pulmonalvenen-Antrum) elektrisch isoliert. Zusätzlich wurde eine Dachlinie angebracht, die beide Areale verbindet. 69 óó Original- und Übersichtsarbeiten Abbildung 3 Rhythmuskontrolle Keine/minimale Herzerkrankung Arterielle Hypertonie Koronare Herzerkrankung Herzinsuffizienz (Sotalol) Amiodaron Ausgeprägte LV-Hypertrophie Nein Flecainid Propafenon Sotalol Amiodaron Ablation Ja Flecainid Propafenon Sotalol Amiodaron Ablation Amiodaron Ablation Amiodaron Ablation Ablation Abb. 3 Behandlungspfad zur Rhythmuskontrolle (modifiziert nach [9]). Abhängig von Begleiterkrankungen wird auf der ersten Stufe ein differenzierter pharmakologischer Behandlungsversuch unternommen. Bei Ineffizienz steht als zweite Therapieoption eine Amiodarontherapie oder die Katheterablation zur Verfügung. Mit Ausnahme der Patientengruppe mit Herzinsuffizienz kann bei den anderen Patienten zukünftig eine Therapie mit Dronedarone erwogen werden. Mit Dronedaron als Wirkstoff wird Mitte 2009 ein Präparat zur Verfügung stehen, das vom Wirkungsmechanismus dem Amiodaron in vielen Belangen entspricht, jedoch nicht die Nebenwirkungen von Amiodaron aufweist. Erste Studien zur Frequenzkontrolle bei VHF zeigen eine gute Wirksamkeit mit einer Reduktion der Kammerfrequenz um 10—20 Schläge/min in Ruhe und unter Belastung [25]. Hierbei sind jedoch Einschränkungen bei der Herz- und Niereninsuffizienz zu beachten (vgl. Abschnitt Rhythmuskontrolle). Insgesamt kann mit einer Monotherapie nur bei ca. der Hälfte der Patienten eine adäquate Frequenzkontrolle erreicht werden [11], sodass häufig eine Kombinationstherapie erforderlich ist. Selbst unter Kombination dreier Medikamente mit negativ dromotroper Wirkung konnte eine adäquate Frequenzkontrolle letztlich allerdings nur bei ca. 80% der Patienten erreicht werden [10]. Die tatsächliche Erfolgsrate im klinischen Alltag kann als deutlich geringer erwartet werden. Im Einzelfall können daher weitere Therapieoptionen erwogen werden. Katheterablation zur Kammerfrequenzkontrolle Bei der AV-Knoten-Modulation kann mithilfe einer Katheterverödung die Refraktärzeit des AV-Knotens verlängert und die Kammerfrequenz gesenkt werden. Die Methode hat zurzeit nur einen geringen Stellenwert, da die Frequenzkontrolle unter Belastung unzureichend ist [26, 27]. Die His-Bündel-Ablation mit vorheriger/anschließender Implantation eines VVI-Schrittmachers ist mit geringem prozeduralem Aufwand und wenigen Komplikationen verbunden [28]. Nachteil dieser Methode ist die permanente Schrittmacherabhängigkeit des Patienten. Die His-Bündel-Ablation kann im Einzelfall dann sinnvoll werden, wenn der Verdacht besteht, 70 dass durch länger andauerndes tachykardes VHF eine Tachykardiomyopathie entstehen könnte oder eine vorbestehende Herzschwäche verstärkt wird [29]. Da durch die rechtsventrikuläre Schrittmacherstimulation mit Linksschenkelblock-Morphologie die Pumpfunktion langfristig beeinträchtigt werden kann, sollte die prophylaktische Implantation eines biventrikulären Schrittmachersystems nach His-Bündel-Ablation bei einer vorbestehenden Ejektionsfraktion unter 35% erwogen werden [30]. Körperliches Training Regelmäßiges körperliches Training erhöht den Vagotonus und übt so negativ dromotrope Wirkungen auf den AV-Knoten aus. Ein regelmäßiges moderates Training zweimal pro Woche kann bei älteren Patienten mit VHF zu einer mittleren Senkung der Kammerfrequenz im Langzeit-EKG um 12% führen [31]. Auch im Belastungs-EKG sank auf jeder Belastungsstufe die Herzfrequenz nach viermonatigem Training um ca. 10% [31]. Daher kann körperliches Training als kostengünstige und effiziente Option zur Kammerfrequenzkontrolle bei VHF im Einzelfall erwogen werden. Rhythmuskontrolle Eine Rhythmuskontrolle dient in erster Linie der Verbesserung der Lebensqualität und Belastbarkeit, da bislang kein prognostischer Vorteil für eine Rhythmuskontrolle nachgewiesen werden konnte. Daher sollte insbesondere bei asymptomatischen Patienten nicht regelhaft eine Rhythmuskontrolle erfolgen. Ausnahme bildet das erstmalig aufgetretene VHF, bei dem die weitere Dynamik des Auftretens von Rezidiven noch nicht vorhersehbar ist. CARDIO VASC 2009 | 3 © Urban & Vogel Original- und Übersichtsarbeiten óó Abbildung 4 Paroxysmales VHF Persistierendes VHF Permanentes VHF Abb. 4 Differenziertes Behandlungskonzept von VHF. Einschätzung thromboembolisches Risikoprofil (z.B. CHADS2) Versuch der Frequenzkontrolle wurde bei ihrem Einsatz zur VHF Rezidivprophyla(Klasse-I-AA) xe bei Patienten mit koro· Antiarrh. Dauertherapie (Betablocker/Klasse I-AA/ narer Herzerkrankung (β-Blocker/Klasse-I-AA/Amiodaron) Amiodaron) eine erhöhte Mortalität · (AT-1-RB/ACEI) · (AT-1-RB/ACEI) beobachtet [39]. Daher kommen Klasse-I-Antiarrhythmika bei Vorliegen Ablation einer organischen Herzerkrankung zur VHF-Rezidivprophylaxe nicht zum Pharmakologische Therapie Einsatz. (die häufig zuvor ineffizient war) Im Allgemeinen sollte bei erstmaligem Auftreten von VHF und Unkenntnis Ablation Rezidiv häufig Vorhofflattern/ektope Tachykardien/Reentry-Tachykardien über die weitere Dynamik der Rezidivhäufigkeit nicht regelhaft eine antiarrhythmische Rezidivprophylaxe initiiert werden. Ist sie jeVHF einer Dauer < 48 h kardiovertiert in > 50% der Fälle doch geplant, kann mit steigender Effizienz nach sorgfältiger spontan [32]. Daher kann bei moderat symptomatischen PatiAnalyse der Komorbidität eine Therapie mit einem Betablocker, enten mit neu aufgetretenem VHF < 48 h unter Kontrolle der Klasse-I- oder Klasse-III-Antiarrhythmikum eingeleitet werden Kammerfrequenz und Heparinisierung zunächst zugewartet [40]. werden. Allerdings ist aufgrund häufig asymptomatischer VHF Die breite Anwendung von Amiodaron zur RezidivprophyPhasen manchmal der exakte Beginn des VHF nicht sicher laxe wird allerdings durch die zum Teil schweren extrakardiabestimmbar. len Nebenwirkungen begrenzt (siehe Abschnitt FrequenzkontDigitalispräparate kardiovertieren nicht [33]. Bei fehlender rolle). Proarrhythmien sind unter Amiodaron selten, während Spontankardioversion ist eine elektrische Kardioversion unter unter Sotalol in bis zu 5% der Fälle über QT-Verlängerungen tiefer Sedierung oder Kurznarkose schnell, einfach und effiziund polymorphe ventrikuläre Tachykardien berichtet wird ent [34]. Dabei bietet eine pharmakologische Kardioversion [41]. den Vorteil, dass keine Kurznarkose erforderlich ist. Da jedoch Ein neues Klasse-III-Antiarrhythmikum, Dronedaron, konnalle antiarrhythmischen Medikamente eine — wenn auch unte in placebokontrollierten Studien die Rezidivrate bei paroxysterschiedlich stark ausgeprägte — proarrhythmische Kompomalem VHF signifikant senken [42]. Dabei traten keine der nente aufweisen, sollte bei ihrem Einsatz das Risiko einer unter Amiodaron bekannten Nebenwirkungen auf. Vergleichende ventrikulären Proarrhythmie bedacht werden und der KardiStudien zur Wirksamkeit liegen noch nicht vor. Zunächst wird oversionversuch mit einem mehrstündigen Monitoring unter der Einsatz der Substanz bei herzinsuffizienten Patienten allerEKG-Kontrolle einhergehen. Die orale oder intravenöse Gabe dings noch kritisch zu betrachten sein, da eine erhöhte Sterbvon Klasse-Ia -, Klasse-Ic - oder Klasse-III–Antiarrhythmika lichkeit in den ersten zwei Monaten nach der Therapieeinleitung kann bei 60—90% der Patienten einen Sinusrhythmus wiederbeobachtet wurde. Diese war durch eine Verschlechterung der herstellen, wenn die VHF-Dauer unter 48 h liegt. Bei längerer Herzinsuffizienz bedingt. Hierbei spielten u.a. steigende NieVHF-Dauer ist nur noch mit einer Effizienz von 15—30% der renretentionswerte mit nachfolgendem Absetzen oder ReduktiFälle zu rechnen [35—38]. on der Dosis von ACE-Hemmern oder AT-Rezeptorantagonisten Die Wahrscheinlichkeit, mit einem Antiarrhythmikum VHF eine Rolle [43]. zu kardiovertieren, ist geringer, als mit demselben Medikament Neben der pharmakologischen antiarrhythmischen Therapie, eine effiziente Rezidivprophylaxe durchzuführen. Daher kann die insbesondere die elektrischen Determinanten der Rhythauch bei fehlender pharmakologischer Kardioversion das zuvor musstörung behandeln, sollte die Behandlung der begleitenden ineffiziente Antiarrhythmikum zur Rezidivprophylaxe appliund z.T. das VHF begünstigenden Erkrankungen wie v.a. arteziert werden. Hierbei ist jedoch immer zu berücksichtigen, rieller Hypertonie, Herzinsuffizienz und Diabetes mellitus nicht dass viele Antiarrhythmika potenziell proarrhythmisch sind. vernachlässigt werden. Obschon keine Monokausalität zwischen Dies trifft im Besonderen auf Klasse-I-Antiarrhythmika zu. So · Antiarrh. Bedarfstherapie CARDIO VASC 2009 | 3 © Urban & Vogel · TEE + Kardioversion · Antiarrh. Dauertherapie 71 óó Original- und Übersichtsarbeiten diesen Erkrankungen und dem Auftreten von VHF besteht, kann auf eine Kontrolle dieser Erkrankungen, die alle das atriale Substrat von VHF beeinflussen, nicht verzichtet werden. Eine zentrale Rolle spielt hier die atriale Fibrose. Diese tritt zum einen bei VHF selbst auf als auch bei den genannten Erkrankungen [44, 45]. Die inselartige Bildung von elektrisch isolierenden Narben im Vorhof begünstigt dabei das Auftreten von elektrischen Kreiserregungen. So konnte in retrospektiven und ersten prospektiven Untersuchungen nachgewiesen werden, dass eine Therapie mit ACE-Hemmern oder AT1-Rezeptor-Antagonisten das Auftreten von VHF vermindert [46, 47]. Weitere prospektive Studien werden derzeit hierzu im Kompetenznetzwerk VHF durchgeführt [48]. Grundsätzlich ist die Beurteilung der Rezidivhäufigkeit bei VHF aufgrund der vielen asymptomatischen Episoden und unterschiedlichen Monitoring-Verfahren schwierig. In zwei Untersuchungen wurde daher während einer antiarrhythmischen Rezidivprophylaxe täglich telemetrisch mindestens ein EKG abgeleitet, sodass die erfassten Rezidivraten der klinischen Realität sehr nahe kommen. Bemerkenswert war dabei, dass ca. 50—70% aller VHF-Rezidive asymptomatisch waren [5, 6]. Katheterablation zur Rhythmuskontrolle Der Ablation kommt als Therapieoption bei VHF zunehmende Bedeutung zu. Inzwischen kann sie bereits nach einem gescheiterten pharmakologischen antiarrhythmischen Therapieversuch erwogen werden (Abb. 2) [9]. Die Ablationsstrategien, die im Laufe der Zeit entwickelt wurden, orientieren sich in erster Linie an der hervorragenden Bedeutung des linken Vorhofs für die Entstehung und Aufrechterhaltung von VHF. Hierbei sind Ablationen der VHF auslösenden atrialen Extrasystolen v.a. aus den Pulmonalvenen der Grundbestandteil jeder VHF-Ablation (Triggerelimination). Insbesondere bei chronisch persistierendem und permanentem VHF spielt zusätzlich das atriale Substrat für Kreiserregungen (z.B. Fibrose) eine wichtige pathophysiologische Rolle, sodass ggf. erweiterte Ablationen dieses VHF-Substrats im linken Vorhof vorgenommen werden müssen (atriale Substratmodifikation) [49]. Hierbei kommen dreidimensionale Mappingsysteme zur Anwendung. Unter Einbezug mehrfacher Ablationsprozeduren und verschiedener Formen des VHF (paroxysmal, persistierend, permanent) liegt Sinusrhythmus ein Jahr nach Ablation von VHF in etwa 76% der Fälle vor, wobei bei 24% ein zuvor ineffektives Antiarrhythmikum zur Aufrechterhaltung des Sinusrhythmus benötigt wurde [53]. Mitunter sind jedoch wiederholte Ablationen notwendig, um einen ausreichenden klinischen Erfolg zu erzielen. Der hohen Effizienz der Ablation stehen relevante Komplikationsraten von bis zu 6% gegenüber, die eine sorgfältige Auswahl der Patienten sowie die Durchführung in Zentren mit ausreichender Erfahrung notwendig machen [53]. Frühe VHF-Rezidive treten in den ersten zwei bis drei Monaten nach einer Ablation in bis zu 45% der Fälle auf und sollten in der Regel zunächst konservativ behandelt werden, da in einigen Fällen bei längerer Nachbeobachtung keine weiteren Arrhythmien auftreten [9]. Hierbei scheinen eine Erholung der Pulmonalvenenleitung und/oder inflammato- 72 rische Prozesse nach Hochfrequenzstromablation eine Rolle zu spielen. Insbesondere bei chronisch persistierendem VHF kann jedoch im Einzelfall versucht werden, bei VHF-Rezidiven nach Erstablation mit Antiarrhythmika, die vor der Ablation nicht mehr effizient waren, erfolgreich den Sinusrhythmus aufrechtzuerhalten (Hybridansatz). Rezidive nach VHF-Ablationen können durch atypisches linksatriales Vorhofflattern oder ektope atriale Tachykardien bedingt sein, die häufig regelmäßig und schnell auf die Kammern übergeleitet werden. Diese Tachykardien sind pharmakologisch schwer zu behandeln. Da es sich um umschriebene Pathologien im linken oder rechten Vorhof handelt und die Entstehung einer Tachykardiomyopathie durch die anhaltend hohen Frequenzen begünstigt wird, sollte in refraktären Fällen eine gezielte Ablation erfolgen. Erste Analysen zur vergleichenden Effizienz einer Ablation oder pharmakologischen antiarrhythmischen Rhythmuskontrolle bei VHF weisen auf eine tendenzielle Überlegenheit der Ablation hin [54, 55]. Angesichts der noch begrenzten Fallzahl und der Beschränkung auf hoch spezialisierte Zentren können diese Ergebnisse derzeit nicht verallgemeinert werden. Abb. 5 fasst in Modifikation die derzeit empfohlene Behandlungsstrategie zur Rhythmuskontrolle bei VHF zusammen [9]. Zusammenfassung Die multimodale Therapie der chronischen Volkserkrankung VHF stellt eine Herausforderung an den Arzt dar. Abb. 4 fasst grafisch ein Behandlungskonzept zusammen. Wichtigstes Ziel ist die Verhinderung von Thromboembolien. Hierzu ist eine sorgfältige Analyse der thromboembolischen Risikofaktoren notwendig, die regelmäßig wiederholt werden sollte. Die Entscheidung zur Frequenz- vs. Rhythmuskontrolle ist abhängig von der subjektiven Symptomatik des Patienten. Derzeit gibt es keine sicheren Hinweise für eine prognostische Überlegenheit der Aufrechterhaltung des Sinusrhythmus. Interventionelle Verfahren der Katheterablation ermöglichen bei hochsymptomatischen Patienten eine effiziente Verbesserung der Lebensqualität. Eine individuelle Risiko-Nutzen-Analyse sollte jedoch erfolgen. Die Behandlung von Begleiterkrankungen wie arterielle Hypertonie und Herzinsuffizienz sowie Diabetes mellitus ist wesentlicher Bestandteil einer differenzierten VHF-Therapie. Unabhängig davon scheint die antifibrotische Therapie mit ACE-Hemmern oder AT1-Antagonisten bei VHF den Progress der Erkrankung günstig zu beeinflussen. Literatur unter www.cardiovasc.de Korrespondenzanschrift: Prof. Dr. med. Patrick Schauerte Medizinische Klinik I Kardiologische Abteilung Pauwelstrasse 30 D-52074 Aachen E-Mail: [email protected] CARDIO VASC 2009 | 3 © Urban & Vogel