Stabilität der Vergärung - ETI
Werbung

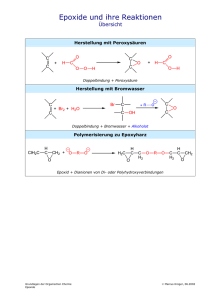
EINFLÜSSE AUF DIE STABILITÄT DER VERGÄRUNG Landesumwelt Brandenburg – Fachtagung Biogas 23.10.2008 Dipl.-Ing. Helmut Muche MUCHE Kläranlagenbau GmbH – Trifte 85 – 32657 Lemgo – Germany Fon +49 5261 77080-0 - Fax +49 5261 77080-50 - Mail [email protected] www.muche-ka.de Übersicht 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. Was ist Stabilität? Welche Faktoren beeinflussen die Stabilität? Abbau Substrate Abbau : Stärke Abbau : Proteine Abbau : Fette Methanogenese Dissoziation Essigsäure Puffersysteme Henderson-Hasselbalch-Gleichung Dissoziation Ammoniak Hemmung – Essigsäure Hemmung – Ammoniak Beispiel Zusammenfassung Was ist Stabilität ? Was ist Stabilität? - Störungsfreier Betrieb - Optimaler Gasertrag - Maximale Ausnutzung der Substrate Gasproduktion V Optimaler Punkt Limitierung Hemmung c Konzentration Welche Faktoren beeinflussen die Stabilität? Eigenschaften der Substrate Substrat hoch komplex Konzentration der Substrate CO2Gas CH4 ↑↓ H2S Endprodukte Mikronährstoffe Konzentration Gärrest Substrat-Abbau „Black-Box“ Bakterien - Zusammensetzung - Menge Gifte Zwischenprodukte Konzentration Abbau Abbauwege Zeitachse CH4 + CO2 + H2O Sekunden bis Minuten Minuten bis Tage Methanogenese Acetat Propionat Butyrat Acetogenese CO2 + H2 Minuten bis Tage CO2 + H2 Acetat Ethanol Acidogenese Monomere Kohlenhydrate Stunden bis Tage Valeriat Aminosäuren Langkettige Fettsäuren Hydrolyse Polymere Kohlenhydrate Fett Proteine Anorganische Stoffe Zusammengesetzte, partikuläre Substrate Pind et al: Monitoring and Control of Anaerobic Reactors 2003 Substrate KOHLENHYDRATE Kohlenhydrate sind hochpolymere Zucker (Polysaccharide) Kohlenhydrate sind Speicherstoffe in Pflanzen wie Stärke und Zucker Kohlenhydrate bilden auch die Gerüstsubstanzen Hemicellulose und Cellulose in Pflanzen Substrate PROTEINE Copolymere Stoffe, die in sehr unterschiedlichen Arten aus 20 Aminosäuren aufgebaut sind und ein hohes Molekulargewicht haben. Proteine enthalten neben Kohlen- und Wasserstoff immer Stickstoff und auch Schwefel. Proteine kommen in Pflanzen und in tierischem Material vor. Substrate FETTE Triglyceride der Fettsäuren Fette kommen in Pflanzen und Tieren vor Fette kommen flüssig, halbfest und fest vor ► Fette lösen sich nicht in Wasser Abbau: Stärke Aufbau von Stärke - Hüllsubstanz der Stärkekörner : Amylopektin Molekulargewicht Amylopektin CH2 OH CH2 OH O H H H H O OH H : ca. 400.000 CH2 OH O H H H O OH H O H OH H HO H OH H OH H OH O CH2 OH O H H O OH H H OH CH2 CH2 OH H H O O H OH H H OH H H O CH2 OH O H OH H H OH H H O O H OH H H CH2 OH OH H H O O H OH H H CH2 OH OH H H O O H OH H H OH O Abbau: Stärke Aufbau von Stärke - Kernsubstanz der Stärkekörner : Amylose Molekulargewicht Amylose CH2OH CH2OH O H H OH H H H O CH2OH O H OH H : ca. 50.000 – 160.000 H H O CH2OH O H OH H H H O CH2OH O H OH H H H O CH2OH O H OH H H H O O H OH H HO H OH H OH H OH H OH H OH H OH Eigenschaften von Stärke : - in kaltem Wasser unlöslich - in heißem Wasser Aufquellen zu Stärkekleister durch das Amylopektin - Amylose löst sich kolloidal O Abbau: Stärke Stärke Amylose ~ 27 % Amylopektin ~ 73 % Enzymatische Spaltung durch Amylase Spaltung durch Amylase (C6 H10O5 ) n n HO 2 2 n C H O 2 12 22 11 Amylase Maltose Enzymatische Spaltung durch α-Glucosidase Spaltung durch Maltase Glu cos idase C12 H 22O11 H 2O 2C6 H12O6 Glucose Essigsäure Methan Kohlendioxid CH2 OH H H CH2 OH O H OH H H H O CH2 OH O H + OH H HO OH H OH H OH H2 O O OH H Maltase H OH H 2 HO H H OH Biogas Maltose D-Glucose Abbau: Stärke Glucose Maltose Glucose Bakterien, die am anaeroben Abbau von Stärke beteiligt sind: Exoenzym H2 Exoenzym Bakterie Glucose Essigsäure Saccharolytische Clostridien - Clostridium butyricum - Clostridium acetobutylicum - Clostridium cellulosae-dissolvens Optimaler pH-Bereich: 5,3 – 6,7 Abbau: Proteine Hydrolyse Hydrolyse durch Proteasen (Exoenzyme) Saure Proteasen: pH 1 – 5, z.B. Pepsin durch bakterielle Proteasen Metalloproteasen: pH 7 – 8, z.B. Thermolysin Alkalische Proteasen, Serinproteasen pH 9 – 11, z.B. Trypsin Protein Weizenkleber, Casein, Gelatine Thioproteasen: pH 4 – 8, z.B. Papain, Ficin Peptidasen Oligopeptide Dipeptide, Aminosäuren C H3 N C C O H O O O H3 N C C O H CH3 H L-Alanin L-Glycin H3 N C O H C H3 C CH3 L-Valin Abbau: Proteine Abbau von Proteinen – Stöchiometrie Protein C13H25O7N3S1 + 9 H2O → 6,5 CH4 + 3,5 CO2 + H2S + 3 NH4+ + 3 HCO3Hydrolyse durch Proteasen Desaminierung und Decarboxylierung von Alanin Oligopeptide O C Spaltung durch Peptidasen H3 N O C H + 2 H2 O CH3 COOH + CO2 + NH3 + 2 H2 CH3 ∆ G0 = + 7,5 kJ / Reaktion Dipeptide, Aminosäuren Bakterien, die an der anaeroben Fermentation von Aminosäuren beteiligt sind Desaminierung Essigsäure Methan Ammoniak Kohlendioxid Biogas Optimaler pH-Bereich: 7,0 Aminosäuren Alanin Arganin Glutamat Glycin Lysin Bakterien Clostridium propionicium Clostridium spp. Streptococcus spp. Clostridium tetanomorphium Peptostreptococcus micros Clostridium sticklandii Gerardi 2003 Abbau: Fette Neutralfette Fettsäuren Lipasen Glykolipide Hexosen C12-24, gesättigt einfach ungesättigt Glycerin -Galaktose -Glucose -Inosit β-Oxidation Gärung Gärung Acetat Wasserstoff Wasser Fettsäuren Phospolipasen Phospholipide Cholin Aminoethanol Alkohole Ammonium Phosphat Abbau: Fette Glycerin O H C O O C H H3 C O C H H3 C C O + 3 H2 O C O C H EsterH bindung H3 C Fettsäuren Tristearin Lipase O H Lipase H O C H H O C H H O C H H C H3 C O H O H O H O C + H3 C O C H3 C Glycerin Hydrolyse von Triglyceriden durch Lipase Stearinsäure Lipase produzierende Bakterien Pseudomonas cepacia Pseudomonas fluorescens Pseudomonas species Abbau: Fette H H O C H _ _ 4 H O C H H O C H + 2 HCO3 7 CH3 COO + + 5 H + 4 H2O H Glycerin Glycerinabbau zum Acetat - Gärung durch Acetobacterium sp. Madigan 2006 Abbau: Fette 1. Stearinsäure CH3(CH2)16COOH + 2 H2O → CH3(CH2)14COOH + CH3COOH + 2 H2 2. Palmitinsäure CH (CH ) COOH + 2 H O → CH (CH ) COOH + CH COOH + 2 H 3 2 14 2 3 2 12 3 2 3. Myristinsäure CH3(CH2)12COOH + 2 H2O → CH3(CH2)10COOH + CH3COOH + 2 H2 4. Laurinsäure CH3(CH2)10COOH + 2 H2O → CH3(CH2)8COOH + CH3COOH + 2 H2 5. Caprinsäure CH3(CH2)8COOH + 2 H2O → CH3(CH2)6COOH + CH3COOH + 2 H2 6. Caprylsäure CH3(CH2)6COOH + 2 H2O → CH3(CH2)4COOH + CH3COOH + 2 H2 7. Capronsäure CH3(CH2)4COOH + 2 H2O → CH3(CH2)2COOH + CH3COOH + 2 H2 8. Buttersäure CH3(CH2)2COOH + 2 H2O → 2 CH3COOH + 2 H2 Gesamtreaktion CH3(CH2)16COOH + 16 H2O → 9 CH3COOH + 16 H2 β-Oxidation von Fettsäuren Die β – Oxidation läuft bei Prokaryonten im Cytoplasma ab Methanogenese Bildung von Methan aus der Reduktion von Kohlendioxid ∆ G0 = - 135,6 kJ CH4 H2O CO2 CO2 + 4 H2 → CH4 + 2 H2O H2 Spaltung von Essigsäure - Decarboxylierung ∆ G0 = - 31 kJ CH4 CO2 CH3COOH → CH4 + CO2 CH3COOH CH3COO H+ Die Methanbakterien nehmen die Essigsäure nur in undissoziierter Form auf! Optimaler pH-Bereich: 6,8 - 7,5 Methanogenese Einfluss der Essigsäure auf die Stabilität der anaeroben Vergärung Zielkonflikt Essigsäure bzw. Acetat ist als Vorprodukt für die Methanbildung notwendig Eine erhöhte Konzentration an undissoziierter Essigsäure führt zu Störungen und zum Zusammenbruch der anaeroben Vergärung Ein niedriger pH-Wert begünstigt ein Anstieg der Säurekonzentration Einfluss niedriger pH-Werte auf die Methanproduktion pH Methanproduktion [l / Tag] Inhibitionsfaktor pH 7 = 100 % Undissoziierte Essigsäure [mg/l] 7,0 6,30 100,0 3 6,0 0,30 4,8 30 5,5 0,185 2,9 91 5,0 0,036 0,6 240 Duarte,A.C.; Anderson,G.K. 1982 Methanogenese CH4 CO2 NH3 CH3COOH → CH4 + CO2 CH3COOH CH3COO NH4+ H+ Die Methanbakterien nehmen die Essigsäure nur in undissoziierter Form auf. Ist die Konzentration der undissoziierten Substanzen, z.B. Essigsäure und Ammoniak, zu hoch, erfolgt eine Schädigung der Zellwand, die Methanbildung kommt zum Erliegen! Dissoziation Essigsäure CH3COO¯ + H CH3COOH Essigsäure undissoziiert Essigsäure dissoziiert = Acetat Bei dem pH-Wert von 4,76 liegen 50 % als Essigsäure und 50 % als Acetat vor. Dieser Wert wird als pK-Wert bezeichnet. DISSOZIATION ESSIGSÄURE 100 Bei pH-Werten über 7 liegt fast nur das Acetat vor. 90 80 70 60 pK Mol.% 50 40 30 20 10 0 1 2 3 4 5 6 7 Acetat pH 8 9 Essigsäure 10 11 12 13 14 Puffersysteme CO2Gas CH4 ↑↓ H2S C13H25O7N3S1 + 9 H2O → 6,5 CH4 + 3,5 CO2 + H2S + 3 NH4+ + 3 HCO3 ¯ Bei pH > 6,7: [NH4+] = [HCO3-] + [CH3COO-] bei [CH3COO-] = ~ 0 [NH4+] = [HCO3-] Proteinabbau CO2 + H2O H2CO3 H+ + HCO3¯ Kohlensäure-Puffer NH3 + H2O NH4+ + OH¯ NH3 + CO2 + H2O NH4+ + HCO3¯ Ammoniak-Puffer Kohlensäure-Puffer HCO3-/CO2 Wirksamkeitsbereich : pH 6,0 – 6,6 Ammoniak-Puffer NH3/NH4+ Wirksamkeitsbereich : pH ≥ 7,7 Die Konzentration des Ammoniums wird von der Konzentration des Karbonats begrenzt! Henderson-Hasselbalch-Gleichung Mit der Henderson-Hasselbalchen Gleichung kann eine Beziehung zwischen der Dissoziationskonstante, den Konzentrationen und dem pH-Wert hergestellt werden: pH pK log cA c HA Da der Ammoniumgehalt im Faulschlamm proportional dem Hydrogenkarbonatgehalt ist [NH4+] = [HCO3¯ ], kann der Ammoniumgehalt aus dem CO2-Gehalt des Gases bestimmt werden: pH pK s,C log Temperaturabhängigkeit von pKs,N p Ks,N A T B C*T HCO 3 CO 2 pK s,N log NH 3 NH 4 Henderson-Hasselbalch-Gleichung Die Sättigungskonzentration von CO2 ergibt sich mit Hilfe des Henry-Koeffizienten und des CO2-Partialdruckes zu: CO2 KH ,CO2 * pCO2 KH ,CO2 *( p pH2O ) * cCO2 Durch Umstellen der Gleichung bei bekanntem pH-Wert kann der NH4+ und der NH3-Gehalt bestimmt werden: pH pK s,C log NH 4 CO2 pK s,N log NH 3 NH 4 [ ] [ ] [ ] [ + log NH4 = pH - pKs,C + log CO2 + log NH3 = pH - pKs ,N+ log NH4 ] Dissoziation Ammoniak DISSOZIATION AMMONIAK 100 90 80 70 60 Mol.% 50 pKS 40 30 20 10 0 1 2 3 4 5 6 7 pH Ammoniak 8 9 Ammonium 10 11 12 13 Hemmung - Essigsäure I 1 SI 1 KI I = Inhibitionsfunktion [-] SI = Konzentration der inhibierenden Komponente [mg/l] KI = Inhibitionsparameter (50%-Hemmung) [mg/l] Hemmung = 100 – (I *100) [%] Hemmung der anaeroben Methangärung durch Essigsäure 60 Hemmung [%] 50 40 30 20 10 0 0.0 5.0 10.0 Essigsäure [mg/l] 15.0 Essigsäure Siegrist et al: Mathematical model for meso- and thermophilic anaerobic sewage sludge digestion 2002 20.0 Hemmung - Ammoniak I I = Inhibitionsfunktion [-] SI = Konzentration der inhibierenden Komponente [mg/l] KI = Inhibitionsparameter (50%-Hemmung) [mg/l] K I2 K I2 S I2 Hemmung = 100 – (I *100) [%] pH Hemmung [%] Hemmung der anaeroben Methangärung durch Ammoniak NH4 NH3 kg/m³ kg/m³ 60 7,0 1,020 0,005 50 7,1 1,284 0,008 7,2 1,616 0,013 7,3 2,035 0,020 7,4 2,562 0,032 20 7,5 3,225 0,051 10 7,6 4,060 0,081 0 7,7 5,112 0,129 7,8 6,435 0,205 7,9 8,101 0,324 8,0 10,199 0,514 40 Ammoniak 30 0 50 100 150 200 Ammoniak [mg/l] Siegrist et al: Mathematical model for meso- and thermophilic anaerobic sewage sludge digestion 2002 250 Beispiel Essigsäure als Zwischenprodukt der Biogasentstehung CH3COOH → CH4 + CO2 1 kg Biogas = 1 kg Essigsäure Beispiel 2,5 MW Biogasanlage erzeugt 1.200 m³ Biogas/Stunde = 28.800 m³/Tag oder 37.500 kg Biogas/Tag = 37.500 kg Essigsäure/Tag Faulraumvolumen: 10.000 m³ Faulraumbelastung: 3,75 kg CH3COOH/m³*Tag 0,156 kg CH3COOH/m³*Stunde Hemmung Definitionen Limitierung Die optimalen Konzentrationen sind nicht erreicht Hemmung Überschreitung von optimalen Konzentrationen Relative Wachstumsrate Substratüberschusshemmung Substratmoleküle liegen in zu hoher Konzentration vor und schädigen die Zelle oder binden an falscher Stelle am Enzym μ Nährstofferschöpfung Limitierung durch Erschöpfung des Nährstoffes Limitierung Hemmung Konzentration Zusammenfassung Zusammenfassung Das Zwischenprodukt „Essigsäure“ ist notwendige Vorstufe für die Methanbildung. Bei zu hoher Konzentration an undissozierter Essigsäure erfolgt eine Schädigung der Bakterien. Das Endprodukt „Ammoniak“ führt bei zu hoher Konzentration an undissoziiertem Ammoniak ebenfalls zu einer Schädigung der Bakterien. Die Schädigung der Bakterien beeinträchtigt die Methanbildung und führt zu einer Instabilität. Der Grad der Instabilität, die „Hemmung“ kann quantitativ bestimmt werden. Zusammenfassung Abbau von Kohlenhydraten Schnelle Bildung von Säure Durch Mangel an Stickstoff kann kein Puffersystem entstehen Abfall des pH-Wertes – Gefahr der Übersäuerung Abbau von Fetten Bildung von Säure Durch Mangel an Stickstoff kann kein Puffersystem entstehen Abfall des pH-Wertes – Gefahr der Übersäuerung Abbau von Proteinen Als Endprodukt des Abbaus entsteht Ammonium / Ammoniak Anstieg des pH-Wertes – Gefahr der Hemmung durch undissoziiertes Ammoniak Vielen Dank für Ihre Aufmerksamkeit !