Frage 3 - mySchool
Werbung

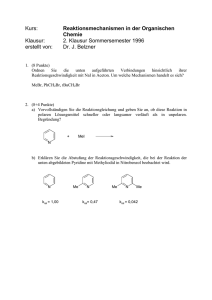
Klassenarbeit III,1: Chemie 12GE Praktikum I) Speisessig enthält reine Essigsäure (CH3COOH). Man gibt zu 15ml Speisessig etwas Phenolphtalein. Nachdem man 24,3ml Natronlauge mit der Konzentration 1mol/l zu dem Speisessig dazugegeben hat, schlägt der Indikator nach rosa um. a) Berechne die Stoffmengenkonzentration von Speisessig. b) Der Hersteller gibt folgende Gehaltsangabe an: „Ein Liter Speisessig enthält 97,2g reine Essigsäure“. Ist diese Aussage korrekt? Begründe. (3+3=6) II) Man möchte gerne aus Essigsäure und Ethanol Ethansäureethylester herstellen. CH3COOH(l) + CH3CH2OH(l) H2O(l) + CH3COOCH2CH3(l) a) Berechne das Volumen an Essigsäure, welches einer Stoffmenge von 0,25mol Essigsäure entsprecht. b) Warum muss man zu dem Gemenge aus Essigsäure und Ethanol zwei-drei Tropfen konzentrierte Schwefelsäure geben? c) Welche Rolle spielt der Rückflusskühler beim Erwärmen des Gemenges? d) Ist folgende Aussage korrekt? Begründe. Kc = n(Ester)n(Wasser) / n(Alkohol)n(Säure) Angabe: (Essigsäure) = 1,05g/ml (3+2+2+2+9) Frage 1 Wie kann man die Ausbeute an Ammoniak NH3 vergrössern? (was muss man unternehmen, um folgendes Gleichgewicht nach rechts zu verschieben?) N2(g) + 3H2(g) 2NH3(g) Untersuche hierfür folgende Faktoren. Begründe jeweils. a) Stoffmengenänderung b) Volumenveränderung und c) Temperaturveränderung. Angabe: fHm(NH3) = -42,5kJ/mol (4+3+3=10) Frage 2 Beschreibe folgendes chemische Gleichgewicht: A + B C a) mit Hilfe der Kinetik (Zeichnen eines Diagrammes ist erforderlich) b) mit Hilfe der Energetik (Zeichnen eines Diagrammes ist NICHT erforderlich) (5+3=8) Frage 3 a) Man gibt zu destilliertem Wasser etwas Bromthymolblau. Der Indikator schlägt nach grün um. Wenn man nun etwas Kohlendioxid in das destillierte Wasser leitet, so schlägt der Indikator nach gelb um. Erkläre diese Beobachtung, indem du Kohlendioxidgas und Wasser anschreibst. die Reaktionsgleichung zwischen b) Was bedeutet der Begriff „Umkehrbarer Vorgang (Reaktion)“? Ist die unter a) geschilderte Reaktion ein umkehrbarer Vorgang? Begründe kurz. Angabe: In einer Säure In einer Base In neutraler Lösung gelb blau grün Farbe Bromthymolblau (4+4=8) Frage 4 Gegeben sei folgende Reaktion: H2(g) + I2(g) 2HI(g) / rH = -10,4kJ Bei 393K weist Kc einen Zahlenwert von 60 auf. Man gibt bei 298K in einen 500ml Rundkolben ganz genau 2mol Wasserstoff und 1mol Iod. Der Rundkolben wird verschlossen und auf 393K erhitzt. I) Berechne die Konzentrationen aller Stoffe, nachdem sich ein chemisches Gleichgewicht bei 393K eingestellt hat. II) Folgende Veränderungen werden durchgeführt, nachdem ein Gleichgewicht bei 393K erreicht worden ist: a) 1g Wasserstoffgas und 1g Ioddampf werden in den Rundkolben eingespritzt (man nimmt an, dass T und das Gesamtvolumen bei diesem Vorgang unverändert bleiben): i) ii) Verändert sich der Zahlenwert der Gleichgewichtskonstanten? Nimmt die die Konzentration an Iodwasserstoff zu? Erkläre. b) Der Rundkolben wird auf 500K erwärmt (man nimmt an, dass das Gesamtvolumen beim Erwärmen unverändert bleibt): i) ii) Verändert sich der Zahlenwert der Gleichgewichtskonstanten? Wenn ja, wird der Zahlenwert grösser oder kleiner als 60? Begründe. (10+1+2+1+5=19)