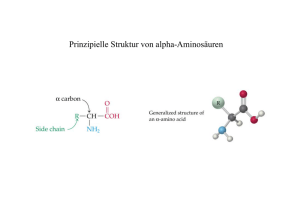
BIOCHEMIE FÜR SPORTLER
Werbung

BIOCHEMIE FÜR SPORTLER Biochemie für Sportler I Praktische Biochemie für Bodybuilder In den letzten Jahren nimmt die "Verwissenschaftlichung" des Fitness- und Bodybuildingsports zunehmen überhand. Gibt es auf der einen Seite (fast schon antiquierte) Vertreter, deren obersten Credo sinngemäß mit "Don't Overanalyze It!" zusammengefasst werden kann, stellen das andere Extrem (junge) Trainierende dar, die kleinste Fakten bis ins Details sezieren und im schlimmsten Fall aufgrund dieser Scheuklappen die wirklich wichtigen Dinge außer Acht lassen. Dazwischen bewegt sich ein Gemisch an BroScience, Halbwissen, sozialisierten Verhaltensweisen und anderen Ausprägungen. – Zeit damit aufzuräumen! BroScience is NoScience Mit dem Artikel ► Don't Overanalyze It! hatte Thomas Koch bereits vor inzwischen 4 Jahren den Nerv der Zeit getroffen und absolut richtig darauf hingewiesen, dass viele (junge) Trainierende sich von den eigentlich wichtigen Dingen ablenken ließen. Auf der anderen Seite würden Wettkampfbodybuilder noch heute Soja-Protein in sich hineinschütten, welches eines der ersten Supplemente, wie wir es heute verstehen, darstellte. Erst genauere Beschäftigungen mit der Thematik brachte Jahre später weitere Eiweißpulver auf den Bildschirm und damit den Supplementemarkt. Das man also immer etwas dazu lernen kann, steht außer Frage. Fragwürdig sind dagegen so manche Erklärungsversuche, die im allgemeinen Sprachgebrauch in die BroScience Schublade gepackt werden. Neue Erkenntnisse erschüttern die Fitnesswelt? Aus diesem Grund war in den letzten Jahre zunehmend eine neue Entwicklung zu beobachten. Die Zahl der deutschsprachigen Autoren, die sich regelmäßig im Internet mit Fakten und Mythen rund um Bodybuilding und Fitness auseinandersetzen, ist überschaubar. Ein gewisser Teil dieser Autoren versucht wiederum schon seit einigen Jahren mit gehobenem Anspruch Wissen darzustellen und die eigene Leserschaft zu informieren. Das Problem, das dabei oftmals entsteht: Viele Konsumenten können die dargestellten Informationen nicht korrekt einordnen. Beispiel: Nur weil eine Studie bestätigt, dass ein Wassertropfen nass macht, benötigt man für ein Vollbad eine unglaublich große Menge Wassertropfen. Die eigentliche Aussage ist also relativ nichtssagend. ...und an dieser Stelle soll die kommende Artikelreihe ansetzen. Praktische Biochemie für Bodybuilder ...richtet sich an jeden Sportinteressierten, der Abläufe im Körper genauer begreifen und sich damit selbst eine Meinung bilden können möchte. Die Artikelreihe orientiert sich in den grundlegenden ersten Teilen am Buch Biochemie des Menschen von Horn, das nicht nur unter Medizinstudenten beliebt ist, wobei weitere Fachliteratur herangezogen wird. Seite 2 von 34 Der Anspruch dieser Artikelreihe ist es, das Wissen so detailliert wie nötig und so unkompliziert wie möglich darzustellen. Die praktische Anwendung steht dabei im Vordergrund, so dass es in den kommenden Artikeln immer wieder kleine Hinweise auf die Bodybuilding- und Fitness-Welt geben wird. Beispielsweise mag es den Mediziner interessieren, warum Hitze die Eiweißstruktur von Bakterien und Viren verändert, für den Hobby-Pumper wird in diesem Zusammenhang interessanter sein, dass sein Whey-Protein, das er zum Backen nahm, noch die gleiche Wirkung erzielen wird. Warum und wieso wird in einem späteren Artikel anschaulich dargestellt, wenn der Leser es nicht bereits selbst weiß. Um die Qualität des Inhalts darüber hinaus sicherzustellen, werden die Artikel im Vorfeld noch einmal extern inhaltlich reviewed, bevor es zu einer Veröffentlichung kommt. Der Anspruch der Artikelreihe ist also nicht mehr und nicht weniger als biochemische Kenntnisse über den menschlichen Körper verständlich und von Grund auf darzustellen und mit Bodybuilding und Fitness in Zusammenhang zu bringen. Während andere Autoren vollmundig versprechen, dass ihr Inhalt möglicherweise die gesamte Denkweise der Leserschaft auf den Kopf stellen könnte, möchte ich in erster Linie zum Denken anregen. Wer auf der Suche nach Antworten ist, muss lernen, die richtigen Fragen zu stellen. Biochemie für Sportler II Chemie – It's Science, bitch! BroScience is NoScience! – Wer mit diesem Anspruch eine Artikelreihe rund um die Biochemie beginnt, kommt nicht darum herum, zumindest ein paar wenige Grundlagen der Chemie zu wiederholen, um so einen gemeinsamen Wissensstand herzustellen. Bevor wir in den kommenden Wochen also das Thema Kohlenhydrate betrachten werden, müssen wir erst einmal überhaupt klären, welches Regelwerk der Biochemie zu Grunde liegt. Dieses Regelwerk nennt sich Chemie – and it's science, bitch! Einführung zur (Bio-)Chemie Nachdem im Teil 1 bereits einführend dargestellt wurde, wohin die Reise mit dieser Reihe gehen soll, noch einmal der explizite Hinweis: Die folgenden Darstellungen sind – soweit möglich – bewusst simplifiziert worden, ohne inkorrekt zu sein. Das bedeutet, dass das Wissen, was hier dargestellt wird, für Bodybuilder und Fitnesssportler genügen wird. Wer dagegen für seine nächste Chemieklausur büffelt, sollte lieber bei entsprechender Fachliteratur bleiben. Nachdem dies noch einmal zur Sicherheit geklärt wurde, können wir in das eigentliche Thema einsteigen. Die Weiten der Chemie. Die einführenden Artikel zur Chemie orientieren sich dabei in erster Linie an Horn, da andere Biochemiebücher das Wissen, was hier noch einmal dargestellt wird, als vorhanden voraussetzen. Wer sich also eine der genannten Quellen zulegen will, wird vor allem zu Beginn mit Horn gut eingedeckt sein. Nun aber genug der Vorworte. Seite 3 von 34 Chemische Bindungen – Echten Zusammenhalt gibt es nicht nur unter FitnessBros Jeder, der einmal Chemie in der Schule hatte, wird so ziemlich in den ersten Stunden erfahren haben, dass es so etwas wie ein Periodensystem gibt. Meist in einer bunten Tafel dargestellt und inzwischen hip genug, dass es selbst auf Duschvorhänge gedruckt wird. Die verschiedenen Elemente, die existieren, sind darauf in acht Hauptgruppen sortiert. Es existieren darüber hinaus noch weitere 10 Nebengruppen, die uns jedoch im Rahmen dieses Artikels nicht weiter interessieren sollen. Welcher Hauptgruppe ein Element zugeordnet ist, hängt wiederum von der Zahl der Außenelektronen eines Atoms ab, und damit stecken wir schon mittendrin: Jedes Element besteht aus einem Atomkern mit den positiv geladenen Protonen, um die herum sich die Elektronen sammeln. Verbildlicht ähnlich der Planeten um die Sonne, jedoch im Gegensatz dazu nicht für die Unendlichkeit geschaffen. So wie manch Sportler das strenge Bedürfnis nach Brusttraining am Montag hat, besitzen auch die Atome zwei grundlegende Bedürfnisse. Abgesehen von Helium, das auf der ersten Schale bereits mit zwei Elektronen vollständig ist, können alle weiteren Schalen, die wie Zwiebelhäute übereinander lagern, bis zu 8 Elektronen aufnehmen. Das strebt auch jedes Atom an, was als sogenannte Oktettregel festgeschrieben ist. Das zweite Grundbedürfnis betrifft die Elektronen, die schwer allein sein können und somit immer Paarweise auf der Außenschale angeordnet sein wollen. Atome einer ungeraden Hauptgruppe besitzen also immer einen Lonely Ranger, der einen Kumpanen sucht. In Anlehnung an Horn lassen sich die Elemente somit im folgenden vereinfachten Periodensystem darstellen. Von links nach rechts sind die Hauptgruppen aufgeführt. Von oben nach unten die Schalenanzahl. H, wie Wasserstoff, hat also nur eine Schale und ein Außenelektron. P, wie Phosphor, …. genau, drei Schalen, wobei auf der ersten 2 Elektronen, auf der zweiten 8 Elektronen und auf der dritten Schale 5 Elektronen zu finden sind. Wir sind uns bis zu diesem Punkt hoffentlich einig: Biochemie muss gar nicht so schwer sein und es gibt keinen Grund, dem Ganzen skeptisch gegenüber zu treten. 1 8 H 2 3 4 5 6 7 He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Ga Ge As Se Br Kr I Xe H = Wasserstoff | C= Kohlenstoff | N = Stickstoff | O = Sauerstoff | P = Phosphor | S = Schwefel Die sechs rot markierten Elemente stellen die Grundlage für die gesamte Artikelreihe und damit die biochemischen Prozesse im Körper dar. Vor allem Wasserstoff (H), Sauerstoff (O), Kohlenstoff (C) und Stickstoff (N) sind von großer Bedeutung im menschlichen Körper. Seite 4 von 34 Muss ich mir das alles merken? Keine Angst, es muss nichts auswendig gelernt werden. Das Ganze wird an entsprechender Stelle noch einmal so weit wie nötig erläutert. Diese Informationen sind also in erster Linie für den Hinterkopf. Was die Menge der Elemente im menschlichen Körper angeht, findet man genauso unterschiedliche Angaben, wie in der prozentualen Verteilung. Löffler gibt 25 chemische Elemente an, Menche spricht dagegen von 26 Elementen. Darüber hinaus führt Löffler Bor (B) in seiner Liste auf. Dieses erwähnt Mensche nicht, zählt dafür aber Arsen (As) und Nickel (Ni) hinzu. – Der Grund liegt darin, dass einige Spurenelemente zwar über die Nahrung aufgenommen werden und im Körper nachweisbar sind, täglicher Bedarf oder gar Mangelerscheinungen bisher jedoch nicht bekannt sind. Des Weiteren sind in der Literatur durchaus unterschiedliche Angaben zur Menge der einzelnen Elemente im Körper vorhanden, was jedoch für die weiteren Ausführungen nicht weiter wichtig ist. Wie bereits erwähnt wurde, haben die Elemente der ungeraden Hauptgruppen mindestens einen unruhigen Vertreter mit an Bord, der nicht länger allein sein will. Wenn ihr Zeichnung in Büchern oder im Netz findet, wird dies immer mit Strichen und Punkten dargestellt. Ein Punkt steht dabei für ein freies Elektron der Außenschale, ein Strich für ein Elektronenpaar in der Außenschale. Verbinden sich nun zwei Atome, so wie in der Abbildung zwei Chlor-Atome, so entsteht zwischen den Atomen eine Verbindung zwischen den freien Elektronen. Unsere ChlorAtome sind entspannt und führen eine offene Beziehung, wie man es neumodern bezeichnen würde. Jeder zählt das "neue" Elektron des anderen für sich, so dass beide eine volle Außenschale besitzen. Das andere Atome weniger entspannt an die Sache herangehen und das Chlor eine radikale Bitch sein kann, wenn man sie alleine lässt, könnt ihr weiter unten nachlesen. Und wenn sie nicht gestorben sind... ...dann Leben sie noch heute in einer Welt des Kohlenstoffs, der Grundlage allen Lebens. Kohlenstoff – Der Baustein allen Lebens? Zumindest dessen, wie wir uns es vorstellen. Astrobiologen nutzen im Zusammenhang mit dieser Überschrift gerne den Begriff Kohlenstoffchauvinismus, der als Denkanstoß kritisiert, dass auf anderen Planeten möglicherweise durchaus Leben ohne Kohlenstoffverbindungen denkbar ist. – Ohne Frage ist das eine Diskussion auf einer für die Praxis unbedeutenden Meta-Ebene, aber soll doch eines zeigen: Kohlenstoff ist das wichtigste Atom in der organischen Welt. Schon einfache Kohlenstoffverbindungen sind relativ stabil, was uns als Information zunächst genügen soll. Dieser kleine Einschub sollte nur noch einmal die Bedeutung dieses Atoms verdeutlichen. Seite 5 von 34 Halt dich fest, halt an deiner Liebe fest... ...besang der Stuttgarter Freundeskreis einst. Nicht der mit den bunten Pullovern. Der mit dem Lockenkopf als Frontmann. Und auch Atome halten einander fest, denn wie beschrieben, sind 8 Elektronen auf der Außenbahn für Atome das, was wir unter einer (romantischen) Beziehung verstehen würden. Die erste ist nicht immer für die Ewigkeit, aber man neigt doch dazu, möglichst schnell wieder eine neue einzugehen. Ähnlich, wie wir Menschen nicht unbedingt immer sofort an Heirat und Kinder in die Welt setzen denken, gehen auch Atome starke Bindungen (Hauptvalenzen) und schwache Bindungen (Nebenvalenzen) ein. Schauen wir uns genauer an. Hauptvalenzen Die starken Bindungen sind in Atombindungen und Ionenbindungen unterteilt. Die Chlor-Abbildung oben zeigt uns eine reine Atombindung. Beide Atome haben gleichberechtigten Besitz am Elektron des anderen. Diese offene Beziehung, wie wir es weiter oben salopp betitelten, ist das eine Extrem. Das andere Extrem ist die Ionenbindung, bei der das eine Atom so vereinnahmend ist, dass es die kompletten Elektronen der Außenschale des anderen Atoms an sich zieht. Salz, also Natriumchlorid (NaCl), wäre so ein Beispiel. Das Chlor Atom reißt die Herrschaft über das äußerste Natrium-Elektron an sich, weshalb ihr auch die Darstellung Na+Cl- sicherlich schon einmal gesehen habt. Dies sind die zwei Extreme einer Skala, zwischen der es eine Vielzahl an Abstufungen gibt, was schließlich als polare Atombindung bezeichnet wird und am häufigsten in der Biochemie anzutreffen ist. Und was zum Geier soll das einen Bodybuilder interessieren? Aufgepasst! Energie – das woraus die Kalorientierchen, die deine Hose enger machen, bestehen . Die beschriebenen Bindungen haben eine gewisse Stärke, wobei die Stärke ausdrückt, wie viel Energie benötigt wird, um diese Verbindungen aufzubrechen. Das bedeutet auf der anderen Seite, dass die Atome entsprechend Energie zur Verfügung stellen, wenn sie sich zu den entsprechenden Molekülen vereinen. Als Richtgröße werden für eine Atombindung 400 kJ/mol angegeben. Ist erst einmal nicht viel, aber mühsam ernährt sich das Eichhörnchen. Freie Radikale – Einstieg in die Bodybuildinggeisterbahn Der zweite Aspekt, der im Zusammenhang mit reinen Atombindungen von Interesse sein sollte, sind die freien Radikale. Diese Dinger, die inzwischen in jede anständige Bodybuildinggeisterbahn gehören und vor denen jeder warnt, aber kaum einer so richtig weiß, was sie überhaupt sind. Wenn eine reine Atombindung getrennt wird, sind unsere Atome gar nicht mehr so entspannt, wie noch zu ihrer Zeit in der offenen Beziehung. Beide gönnen dem anderen nichts und holen sich ihr Elektron wieder zurück. Wenn dies nun bei Atomen geschieht, Seite 6 von 34 die nicht alle ihre Außenelektronen paarweise zusammenfügen können, haben wir es mit freien Radikalen zu tun. Diese sind zwar neutral geladen, da so viele Elektronen in den Schalen wie Protonen (positive Ladung) im Kern des Atoms vorhanden sind, allerdings sind die getrennten Atome sehr reaktionsfreudig. Das ungepaarte Elektron sucht den nächsten Seelenverwandten. Kleine triebgesteuerte Arschlöcher, die nicht allein sein wollen und dabei über Leichen gehen. Kein Bro-Code. Kein Tabu der Ex-Freundin. Alles was bei drei nicht auf dem Baum ist, wird für eine erneute Bindung genutzt, um die Außenschale voll zu bekommen. Und was auf dem Baum ist, wird zur Not runtergeschüttelt. Freie Radikale sind also sehr reaktionsfreudig, weshalb sie Zellen und DNA schädigen können und für Krebs verantwortlich gemacht werden. Aber auch Atomverbindungen können zu einem freien Radikal werden. Stickstoffmonooxid (NO) verbindet Stickstoff (N) und Sauerstoff (O) über eine Doppelbindung. Wie wir in der Tabelle weiter oben jedoch erkennen, hat Stickstoff damit ein freies Elektron übrig, so dass diese Verbindung ebenfalls äußerst reaktionsfreudig ist. Interessant ist, dass Gerontologen (Wissenschaftler, die sich mit der Alterung auseinandersetzen – denn bei aller Angstmacherei, sind es immer noch die Alten, die stärker mit Krebs zu kämpfen haben, als jüngere Menschen) die Theorie der freien Radikale anfangs ablehnten und als parawissenschaftlich abtaten. Das nur als kleiner gedanklicher Ausflug. Wissenschaft ist immer in Bewegung und DIE eine wissenschaftliche Wahrheit gibt es nicht, wie auch bereits die unterschiedlichen Elemente-Angaben weiter oben zeigten. Darüber hinaus sind freie Radikale auch nicht gänzlich zu verteufeln, wie wir uns in späteren Artikeln noch einmal genauer anschauen werden. Das heißt nicht, dass gemäß dem "Don't Overanalyze It"-Prinzip einfacher weiterhin stumpf trainiert und gegessen werden sollte, sondern einfach, dass nicht jedes kleinste Studienergebnis überinterpretiert werden darf. Aber dies wird sicherlich im Rahmen der Reihe noch das ein oder andere Mal thematisiert und würde an dieser Stelle zu weit führen. Nebenvalenzen – schwache Bindungen Es existieren vier wichtige Nebenvalenzen: Wasserstoffbrückenbindungen Van-der-Waals-Bindungen hydrophobe Wechselwirkungen ionische Wechselwirkungen wobei vor allem Wasserstoffbrückenbindungen eine wichtige Rolle für die Stabilisierung von Eiweißmolekülen spielen. Wie bereits angesprochen, gibt es polare Atombindungen. Das bedeutet, dass ein Molekül zwar an und für sich neutral ist, innerhalb dieses Moleküls aber kleine Ladungen existieren, die etwa 5 bis 10 % der Stärke einer Atombindung ausmachen. Ein gutes Beispiel hierfür ist Wasser, also H2O. Das Sauerstoffatom (O) zieht das Elektron der WasserstoffSeite 7 von 34 atome (H) stärker an. Zwischen dem negativ geladenen Sauerstoffanteil und dem positiv geladenen Wasserstoffanteil eines weiteren Wassermoleküls bildet sich nun solche eine Wasserstoffbrücke. Wasserstoffbrücken können sich bei der Anwesenheit der sogenannten funktionellen Gruppen OH und NH bilden, die im nächsten Teil thematisiert werden. Die weiteren Nebenbindungen sollen an dieser Stelle (noch) nicht weiter erläutert werden. Auch Nebenvalenzen haben einen gewissen Energiewert, wobei dieser von 5 bis 40 kJ/mol deutlich geringer ist als der Energiewert von Atombindungen. Ionenbindungen befinden sich mit 200 kJ/mol in einem Bereich dazwischen, wobei diese Information auch erst einmal der Vollständigkeit wegen aufgeführt werden soll. Zusammenfassung Ok, das war für den ein oder anderen vielleicht schon ein harter Einstieg. Was sollten wir also aus diesem ersten Teil mitnehmen? Atome versuchen 8 Elektronen auf der Außenbahn zu haben. Wasserstoff (H), Sauerstoff (O), Kohlenstoff (C) und Stickstoff (N) sind für die kommenden Teile von großer Bedeutung. Atome können sich auf unterschiedlichen Arten verbinden, die entsprechend unterschiedlich viel Energie beim Einsetzen der Verbindung freisetzen. Alles Weitere wird in den kommenden Teilen bei Bedarf immer noch einmal knapp erläutert oder mit Hinweis auf diesen Artikel verlinkt. Biochemie für Sportler III Chemie – Funktionelle Gruppen Willkommen zum dritten Teil der Serie Biochemie für Bodybuilder. Dieser Teil ist den funktionellen Gruppen gewidmet, die quasi der kleine, aber feine Unterschied in den Molekülen darstellen. Wie im vorherigen Teil soll das Ganze wieder möglichst einfach dargestellt werden. Um eine bisschen Wissenschaftskram kommen wir aber dennoch nicht herum. It's still Sciene! Was sind funktionelle Gruppen überhaupt? Wir befinden uns nun bereits auf der Molekül-Ebene, also dem Zusammenschluss mehrerer Atome. Innerhalb dieses Zusammenschluss bildet eine funktionelle Gruppe quasi eine kleine Gang, die den Ton angibt. Wird eine funktionelle Gruppe gegen eine andere getauscht, ändert sich die thematische Ausrichtung also die chemischen Eigenschaften) des Moleküls vollständig. – Das klingt noch alles etwas schwammig, sollte am Ende dieses Artikels jedoch eindeutiger geworden sein. Es gibt eine Vielzahl an verschiedenen funktionellen Gruppen, die wir uns in drei Kategorien anschauen wollen: - sauerstoffhaltige funktionelle Gruppen Seite 8 von 34 - schwefelhaltige funktionelle Gruppen stickstoffhaltige funktionelle Gruppen Wir haben also das erste Wiedersehen mit den im zweiten Teil genannten wichtigen Elementen. Schauen wir uns das Ganze genauer an. Wichtige sauerstoffhaltige funktionelle Gruppen Sauerstoff wird oftmals mit dem Begriff Oxidation in Verbindung gebracht, wobei das nicht ganz so einfach ist. Oxidation ist der chemische Ausdruck für die Abgabe von Elektronen. Das läuft in der Natur in der Regel unter dem Einfluss von Sauerstoff ab, muss allerdings nicht zwangsläufig so sein. Es gibt also zwei wesentliche Abläufe, bei denen man von der Oxidation spricht: Hinzufügen eines elektronegativen Atoms (wie zum Beispiel Sauerstoff – O) oder Wegnahme eines Wasserstoffes (H), welches nur ein Elektron und ein Proton besitzt. Läuft eine Stoffumwandlung mit mehreren Oxidationsschritten ab, spricht man von der Oxidationsstraße. So wie beim Gewichtheben dem Jerk erst einmal ein Clean vorausgehen muss, gibt es auch in der Chemie Zwischenschritte, die gemacht werden müssen, um vom Anfang zum Ende zu kommen. Ist das nicht etwas kompliziert? Das mag auf den ersten Blick alles etwas stark verkompliziert klingen und der ein oder andere fragt sich vielleicht an dieser Stelle, wofür das zu Nutze sein soll. Das Bewusstwerden dieser Abläufe ist jedoch immens wichtig, um einfache Vorgänge im Körper zu verstehen. Also durchhalten, auch am Ende dieses Teils wird noch einmal das Wichtigste zusammengefasst. Die Alkohol-Gruppe Die erste funktionelle Gruppe, die wir kennenlernen, ist die Hydroxy-Gruppe (-OH) auch als Alkohol-Gruppe bekannt. – Eine ältere Bezeichnung lautet Hydroxyl-Gruppe. Wenn ihr dieser begegnet, ist ebenfalls die Alkohol-Gruppe gemeint. Alkohole spielen nicht nur bei abendlichen Zusammentreffen am Ende der Woche eine Rolle, sondern sollten vielen Trainierenden aus LowCarb-Produkten bekannt sein, in denen sogenannten mehrwertige Alkohole (auch bekannt als Zuckeralkohole) enthalten sind. Die Wertigkeit besagt etwas über die Anzahl der OH-Gruppen, die in dem jeweiligen Molekül gebunden sind. Glycerin ist solch ein Zuckeralkohol, der korrekt eigentlich Glycerol betitelt werden müsste, da Moleküle mit der OH-Gruppe immer die Endung -ol erhalten. Wer es noch genauer möchte, nutzt den korrekten Fachterminus Propan-1,2,3-triol, der wiederum auch gleich die wichtigsten Punkte zusammenfasst. IUPAC: Die einheitliche Benennung chemischer Elemente Um international eine eindeutige Darstellung von chemischen Stoffen zu gewährleisten, wurden die Richtlinien der IUPAC (International Union of Pure and Applied Chemistry) vereinbart. Das Prinzip soll am bereits genannten Propan-1,2,3-triol veranschaulicht werden: Seite 9 von 34 Die Zahlen 1, 2 und 3 stehen hierbei, wie an der Formel zu erkennen ist, für das C-Atom, an dem eine OH-Gruppe gebunden ist. Die Endung -triol zeigt uns, dass insgesamt 3 OH-Gruppen in dem Molekül gebunden wurden. Propan wiederum ist das eigentliche chemische Molekül, das durch die Oxidation verändert wurde und lediglich H-Atome an die drei C-Atome gebunden hatte. Diese wurde nun im Rahmen der Oxidation gegen die OH-Gruppen getauscht. Eigentlich also ganz einfach. Die Carbonyl-Gruppe Wie oben bereits angeführt, gibt es auf der Oxidationsstraße eine Reihe von Etappen, die nach und nach begangen werden können. Darüber hinaus wissen wir aus Teil 2, dass Sauerstoff bis zu zwei Bindungen eingehen kann. Mit der OH-Gruppe ist dies zum einen zum Wasserstoff und zum anderen eine Einfachbindung zum Kohlenstoff-(C), Stickstoff(N) oder Schwefelatom (S) im jeweiligen Molekül. – In unserem Beispiel also den CAtomen "in der Mitte des Moleküls". Neben der Wertigkeit eines Alkohols unterscheidet man zwischen primären, sekundären und tertiären Alkoholen. Während die Wertigkeit etwas über die Anzahl der OH-Gruppen aussagt, besagt die Zuordnung primär, sekundär und tertiär wie viele weitere C-Atome neben der OH-Gruppe mit dem C-Atom verbunden sind. Klingt etwas verwirrend, wird aber mit der Zeichnung weiter unten verdeutlicht. Dort ist mit 1-Propanol ein primärer und mit 2-Propanol ein sekundärer Alkohol abgebildet. Bei 1-Propanol hat das auf dem Bild linke C-Atom nur eine Verbindung zu einem weiteren C-Atom sowie zu zwei H-Atomen. Bei 2-Propanol ist die OH-Gruppe am mittleren C-Atom angeschlossen und das C-Atom hat rechts und links eine Verbindung zu einem C-Atom und ist somit sekundär. Hydroxy zu Carbonyl: Nur ein H-Atom entfernt Die Carbonyl-Gruppe entsteht nun, wenn das C-Atom und die OH-Gruppe jeweils ein Wasserstoffatom frei lassen. Aus der Einfachbindung zwischen dem C-Atom und dem O-Atom (der ursprünglichen OH-Gruppe) entsteht nun eine Doppelbindung. Das Thema "allein sein" hatten wir in diesem Zusammenhang ausführlich im zweiten Teil. Geschieht dies mit einem primären Alkohol, entsteht ein Aldehyd und die Endung des Moleküls wechselt von -ol auf al. Wandelt sich ein sekundärer Alkohol, entsteht ein Keton und die Endung des Moleküls verändert sich von -ol auf -on. Diese Stoffe spielen bei der aus LowCarb-Diäten bekannten Ketose eine Hauptrolle, sollen nun aber noch nicht weiter beleuchtet werden. Seite 10 von 34 Die Grafik verdeutlicht, was bisher beschrieben wurde am Beispiel von Propanol, das zuvor aus dem Gas Propan entstand. Die blauen Pfeile stellen die "Oxidation" dar und die orangen Pfeile die "Reduktion", denn diese Abläufe können natürlich in beide Richtungen verlaufen. Das Keton Propanon kann nun nicht weiter oxidiert werden, da die Carbonyl-Gruppe (CO in der Mitte) nur noch Verbindungen zu weiteren C-Atomen besitzt. Ketone sind also eine Sackgasse in der Oxidationsstraße, für ein Aldehyd geht es jedoch weiter. Die Carboxy-Gruppe Bei der Oxidation der Aldehyde entsteht Carbonsäure und die Endung wandelt sich von -al zu -säure. – Früher wurde diese Gruppe (COOH) als Carboxyl-Gruppe bezeichnet. Beide Begriffe meinen also dasselbe. Damit ist die Oxidationsstraße in dieser einfachen Form beendet. Unser Körper baut jedoch organische Stoffe bis zu den Stufen CO2 und H2O ab, was in späteren Teilen noch von Bedeutung sein wird. Um dies erreichen zu können, müssen die Moleküle nun aber aufgebrochen werden, was schließlich Energie freisetzt. Wie würde das Aufbrechen ablaufen? Im Fall der Carbonsäuren wird – verbildlicht gesprochen – das H-Atom der OH-Gruppe am Molekül zurückgelassen, während das äußerste Kohlenstoffatom mit den zwei Sauerstoffatomen durchbrennt, wie in der unteren Grafik zu erkennen ist. Es entsteht, wie angesprochen, CO2 und damit Energie. Reaktionen der genannten funktionellen Gruppen untereinander Wie angesprochen, entsteht bei der weiteren Oxidation und damit dem Aufbruch des Moleküls Kohlendioxid. Reagieren jedoch die sauerstoffhaltigen funktionellen Gruppe untereinander, wird Wasser (H2O) freigesetzt. Das bedeutet, das eine Molekül gibt ein äußeres H-Atom ab, während das andere Molekül eine OH-Gruppe gehen lässt. Das kann jetzt etwas viel an Informationen sein, deshalb erst einmal nur zur begrifflichen Seite 11 von 34 Einordnung, welche hen: Alkohol Alkohol Säure Stoffe bei der Reaktion verschiedener funktioneller Gruppe entste+ + + Alkohol Säure Säure → → → Ether Ester Säureanhydrid Wir haben damit wichtige chemische Verbindungen in eine gewisse Ordnung zueinander gebracht, die in folgenden Teilen noch von Bedeutung sein werden und an dieser Stelle noch nicht weiter erläutert werden sollen. Wichtige schwefelhaltige funktionelle Gruppen Wie in Teil 2 zu erkennen war, sind Sauerstoff (O) und Schwefel (S) auf eine gewisse Weise verwandt. Beide besitzen 6 Elektronen in der Außenschale. Statt der Hydroxy-Gruppe (-OH) gibt es hier die Thiol- bzw. Sulfhydryl-Gruppe (SH), weshalb Moleküle mit dieser funktionellen Gruppe auch als Thiolalkohol bezeichnet werden. Wie das Molekül 1-Propanthiol aussieht, sollte sich daher jeder anhand von 1-Propanol selbst herleiten können. Nomen est omen ist in der Chemie also eine absolut angebrachte Bemerkung. Das Thiol-Molekül kann folgende Thiol + Thiol Thiol + Alkohol Thiol + Säure Reaktionen durchlaufen: → Disulfid (unter der Abspaltung von zwei Wasserstoffatomen) → Thioether (unter der Abspaltung von H2O) → Thioester (unter der Abspaltung von H2O) Dies an dieser Stelle nur, damit wir die Begrifflichkeiten schon einmal eingeordnet haben. Durchhalten, eine Gruppe sollten wir uns noch anschauen. Wichtige stickstoffhaltige funktionelle Gruppen Stickstoffe spielen vor allem, wenn es um Protein geht, eine bedeutende Rolle. Hier sind die funktionellen Gruppen Amin und Amid von besonderer Bedeutung. Amino-Gruppen Amino-Gruppen NH2, NH und N werden von Ammoniak (NH3) abgeleitet, wobei das Stickstoff-Atom (N) für jedes Wasserstoffatom, dass es abgibt, eine Verbindung mit einem Kohlenstoff-Atom eingeht. Ein primäres Amin hat somit eine Verbindung zu zwei Wasserstoff-Atomen und einem Kohlenstoff-Atom. Sekundäre und tertiäre geben entsprechend ein weiteres Wasserstoff-Atom ab, um in die Verbindung mit KohlenstoffAtomen zu gehen. Im Gegensatz zu den Alkoholen kann Stickstoff sein freies Elektronenpaar nun jedoch aufbrechen, eine vierte Kohlenstoff-Atom-Verbindung eingehen und damit ein quartäres Ammonium-Ion werden, dass aufgrund der Überzahl an Protonen im Stickstoffkern positiv geladen ist, wie in der Abbildung zu erkennen. Primäre Amino-Gruppen sind vor allem bei Aminosäuren von Bedeutung. Wer bis hierhin aufmerksam gelesen hat, kann sich nun vielleicht bereits denken wie die kleinste Aminosäure Glycin aufgebaut ist. Der Wortteil Amino verrät uns, dass eine (in diesem Fall primäre) NH2-Verbindung Teil Seite 12 von 34 des Moleküls ist, und der Teil Säure, dass eine Carboxy-Gruppe (COOH) im Molekül zu finden sein wird. Eigentlich doch ziemlich cool, oder? Aber was hat das mit Amid-Gruppen zu tun? Amid-Gruppe (CO-NH) Amid-Bindungen spielen eine große Rolle bei der Bildung von Peptiden, die wiederum Protein bilden. Wer schon einmal von hydrolysiertem Protein gelesen hat, sollte hier genauer aufpassen. Amide entstehen, wenn eine Amino-Gruppe (NH2, NH und N) mit einer Säure-Gruppe (Carboxy-Gruppe) reagiert. Wie wir festgestellt haben, besitzt jede Aminosäure diese beiden Gruppen, so dass zwei Aminosäuren gemeinsam die ersten beiden Perlen einer Kette darstellen können. Die Verbindung dieser Kette ist die Amid-Gruppe, die bei der Aminosäuren-Kette als Peptidbindung bezeichnet wird (im Bild blau eingezeichnet). Die zwei Glycin-Aminosäuren gingen also die Peptidbindung ein, wobei Wasser entstand. Das Peptid wiederum besitzt, wie farblich noch einmal verdeutlicht wurde, weiterhin eine Amino- und eine Carboxy-Gruppe, so dass weitere Peptidbindung eingegangen werden können. In der Grafik sehen wir ein Dipeptid, mit einer weiteren Aminosäuren sprächen wir von einem Tripeptid. Die Bezeichnungen sagen uns also erneut einiges über die Struktur des Stoffes, den wir vor uns haben, aus. Bei weniger als 10 Aminosäuren spricht man von Oligopeptiden, wohingegen eine Anzahl über 10 Aminosäuren sogenannte Polypeptide bilden. Ab 100 Aminosäuren wird eine Peptidverbindung als Protein definiert. Diese ganzen Erläuterungen sind also kein Selbstzweck, sondern stellen durchaus das Grundlagenwissen dar, wenn man gewisse Supplemente oder Ernährungsvorgänge überhaupt erst verstehen will. Das angesprochen hydrolysierte Proteinpulver ist ein Produkt, bei dem Protein (mit Hilfe von Enzymen) in Peptidbindungen zerkleinert wurden, wovon Hersteller eine schnellere Aufnahme des Körpers versprechen. Inwieweit dies in der Praxis von Bedeutung ist, kann sich jeder anhand der hier aufgeführten Darstellungen selbst überlegen. Seite 13 von 34 Zusammenfassung Was sollten wir also aus diesem zweiten Teil mitnehmen? die funktionelle Gruppe ist ausschlaggebend für Namen eines Moleküls über die Oxidationsstraße werden Stoffe in mehreren Schritten umgewandelt schwefelhaltige funktionelle Gruppen reagieren ähnlich wie sauerstoffhaltige funktionelle Gruppen Aminosäuren enthalten immer eine Amino- und eine Säure-(also korrekt betitelt Carboxy)Gruppe die Amino- und Säure-Gruppen können miteinander reagieren, so dass aus Aminosäuren Peptide entstehen, die wiederum ab einer gewissen Länge ein Protein bilden Weitere Aspekte, die durchaus den chemischen Grundlagen zuzuordnen wären, werden wir uns bei Bedarf in späteren Artikeln anschauen. Biochemie für Sportler IV Biochemische Einführung Kohlenhydrate Nachdem wir uns in den ersten Artikeln mit chemischen Grundlagen herumgeschlagen haben und abschließend in Teil 3 das Prinzip von Aminosäuren, Peptiden und Eiweiß aufschlüsselten, soll es in diesem Teil erst einmal mit Kohlenhydraten weitergehen. Im Gegensatz zu Eiweiß und Fetten existieren keine essentiellen Kohlenhydrate, was jedoch nicht bedeutet, dass der Körper diese nicht benötigt. Allein unser Gehirn verbraucht tagtäglich ca. 120 Gramm Kohlenhydrate. Unabhängig von der Intelligenz des Einzelnen. – Schauen wir uns diesen Stoff also genauer an. Was sind Kohlenhydrate? Kohlenhydrate werden vor allem von Pflanzen im Rahmen der Photosynthese (in riesigen Mengen) hergestellt und machen somit den überwiegenden Anteil der Biomasse der Erde aus. Grund genug also, mit diesem Energieträger zu beginnen, schließlich hat sich mit der Glykobiologie bereits ein eigener wissenschaftlicher Strang herausgebildet. Während der Volksmund noch zwischen guten und schlechten Kohlenhydraten zu unterscheiden versucht, kennen die meisten Trainierenden vermutlich die Dreiteilung in Mono, Di- und Polysaccharide. Dies würde uns jedoch noch nicht weiterhelfen, wenn wir Kohlenhydrate systematisch in unserer bisherigen Erkenntnisse einbinden wollen. Daher zunächst etwas genauer: Kohlenhydrate = Kohlenstoff + Wasser Ein Kohlenhydrat besteht immer aus Kohlenstoff (C) und Wasser (H2O), so dass Kohlenhydrate chemisch allgemein mit Cn(H2O)n dargestellt werden können. Das für den menschlichen Körper bedeutendste Kohlenhydrat ist die allseits bekannte Glukose, die chemisch als C6H12O6 oder gemäß unserer Vereinfachung mit C6(H2O)6 veranschaulicht werden kann. In Teil 3 wurde die Oxidation von Alkoholen zu Aldehyden oder Ketonen dargestellt, womit wir bereits das Prinzip von Kohlenhydraten im chemischen Sinn kennengelernt hatten. Seite 14 von 34 Kohlenhydrate stellen immer Aldehyde oder Ketone von Polyalkoholen dar. In Teil 3 lernten wir ebenfalls, dass die Wertigkeit eines Alkohols etwas über die Anzahl der OH-Gruppen im Molekül aussagt. Wer genau aufgepasst hat, kann sich bereits denken, dass wir mindestens drei OH-Gruppen benötigen, um von einem Polyalkohol zu sprechen. Der chemisch betrachtet einfachste Vertreter der Polyalkohole ist somit Glycerin. Wie das Aldehyd und das Keton jeweils heißen, wird jeder, der in Teil 3 aufgepasst hat, bereits selbst wissen: Glyceral und Glyceron stellen die beiden einfachsten Zucker in der Chemie dar. Zucker: eine neue Endung Wie wir in Teil 3 bereits festgestellt haben, sind chemische Stoffe an der jeweiligen Endung zu erkennen. Für Zucker gilt die Endung -ose, so dass grundsätzlich von Aldosen und Ketosen gesprochen wird. An dieser Stelle sein zudem noch die Präfixe D- oder L- erläutert, die dem ein oder anderen vielleicht schon einmal begegnet sind: Das zweite C-Atom in Glyceral wird als Chiralitätszentrum bezeichnet. Je nachdem, ob die OH-Gruppe hier rechts (lat. Dexter) oder links (lat. laevus) angeordnet ist, ist es die D- oder L-Form des Kohlenhydrats. Für die Praxis ist dies jedoch weniger von Bedeutung, da Kohlenhydrate in der Regel in der D-Form vorliegen. Beim Thema Aminosäuren und Protein spielt dieses dagegen eine bedeutendere Rolle. Das Prinzip ist aber auch dort dasselbe. Wenn man also auf seinem Whey einen Haufen von L-Aminosäuren findet, besagt dies lediglich etwas über die Anordnung der Atome am Chiralitätszentrum aus. Ok, genug verwirrt. Kommen wir zu der (den meisten vertrauten) Dreiteilung. Monosaccharide Das Wort Saccharid hat seinen Ursprung im griechischen Begriff sakkharon, was übersetzt Zucker bedeutet. Saccharid ist also nur ein Synonym für Zucker. Je nachdem, wie viele C-Atome im Monosaccharid vorliegen, werden Triosen, Tetrosen, Pentosen, Hexosen und so weiter in der Anzahl der C(H2O)-Bausteine unterschieden. Da im Stoffwechsel in der Regel Pentosen (5 C-Atome) und Hexosen (6-C-Atome) die größte Rolle spielen, soll dies nicht weiter aufgeschlüsselt werden. Seite 15 von 34 An dieser Stelle ein kleiner Hinweis: Fischer-Projektion Wir haben in Teil 3 bereits festgestellt, dass in der Chemie Bezeichnungen international standardisiert sind. Ähnlich verhält es sich auch mit der Darstellung von Kohlenhydraten und auch anderen Substanzen mit Chiralitätszentrum. Bei diesen wird die sogenannte Fischer-Projektion genutzt, die vorgibt, dass die Moleküle in einer Linie von oben nach unten dargestellt werden und die am stärksten oxidierten (siehe Teil 3) C-Atome immer oben stehen. Nun werden die C-Atome von oben nach unten durchgezählt, so dass die bereits in Teil 3 genutzten Nummerierungen nun klarer sein sollten. Kohlenhydrate liegen jedoch praktisch nie in einer länglichen Kette vor, sondern verbinden ihre beiden Enden in Lösungen (und somit auch innerhalb der Zelle). Als Ergebnis werden viele sicherlich schon entsprechende Waben als grafische Darstellung gesehen haben. Diese Verbindung wird Halbacetal genannt. Während wir bisher bereits die Abkürzungen D- und L- kennengelernt haben, kommen im Rahmen der Halbacetal-Bildung noch die Buchstaben α- und β- hinzu. Dies sagt etwas über die räumliche Anordnung der Hydroxyl-Gruppe (OH) aus, was an dieser Stelle jedoch nicht unnötig detailliert dargestellt werden soll. Wichtige Zucker, die man schon einmal gehört haben sollte, sind: die Hexosen: - Glukose - Galaktose - Fruktose die Pentosen: - Ribose - Desoxyribose Die folgende Tabelle ist eine kleine Übersicht, wo diese am häufigsten Vorkommen: Seite 16 von 34 Fruktose Während Fett lange Zeit als Sündenbock für die gesundheitliche Entwicklung der westlichen Bevölkerung verantwortlich gemacht wurde, ist Fruktose nicht erst seit kurzem auf einem guten Weg, diese Position einzunehmen. Zu viel Fruktose in der Ernährung über Maissirup in verarbeiteten Lebensmitteln wird bei nicht wenigen Trainierenden inzwischen in einem Atemzug mit ungewünschtem Körperfett genannt. In der Konsequenz verirrt sich der ein oder andere in der Kohlenhydratzusammensetzung seiner Gummibärchen, wenn es darum geht, ob diese nach dem Training konsumiert werden dürfen. – Zugegeben, hier werden gerade die Themen ungewünschtes Fett und erwünschter Insulinausstoß vermischt, jedoch ist Fruktose an und für sich nicht das kohlenhydratisierte Übel. Ganz im Gegenteil stellt dieses Kohlenhydrat beispielsweise den Energielieferant für Spermien dar. Wer nicht nur mit Platzpatronen schießen will, sollte Fruktose also nicht gänzlich aus dem Ernährungsplan streichen. Fruktose, die je nach Stoffwechsellage vom Körper sofort in Glukose umgewandelt wird, ist wie Glukose ein 6er-Zucker, bildet jedoch in der Regel einen 5er-Ring. Je nachdem wird daher auch der Begriff Fruktofuranose für den 5er-Ring und Fruktopyranose für den 6er-Ring genutzt. In der Praxis kann dies am Honig erläutert werden: Dieser enthält β-D-Fruktopyranose, welche eine der süßesten bekannten chemischen Verbindungen ist. Erhitzt man β-DFruktopyranose entsteht β-D-Fruktofuranose, welche nicht annähernd so süß ist. Deswegen ist Teig, der mit Honig gesüßt wird, nach dem Backvorgang auch oftmals geschmacklich weniger süß. Grüße an Team Paleo. Reaktion von Monosacchariden im menschlichen Körper Zuckermoleküle sind bereits relativ komplex im Vergleich zu einzelnen Atomen. Entsprechend kann sich der Leser vermutlich denken, dass es eine Reihe an Reaktionen gibt, die ein Zuckermolekül durchlaufen kann. Für den menschlichen Körper sind vor allem zwei Abläufe von Bedeutung: Redoxreaktion und Anlagerungen an Amino-Gruppen, wobei wir uns an dieser Stelle zunächst nur die aus Teil 3bekannte Redoxreaktion (Reduktion und Oxidation) anschauen werden. Wir erinnern uns: Während die Oxidation der chemische Ausdruck für die Abgabe von Elektronen ist, stellt die Reduktion die entgegengesetzte Reaktion dar. Bei der Reduktion des ersten C-Atoms in Glukose bzw. des zweiten C-Atoms in Fruktose entsteht der Zuckeralkohol Sorbit – auch Sorbitol genannt. Die Endung -ol weist, wie wir gelernt haben, auf einen Alkohol und damit die Carbonyl-Gruppe hin. Auf diese Art und Weise kann unser Körper aus Fruktose Glukose herstellen, wie die Grafik noch einmal verdeutlicht. Seite 17 von 34 Würde das erste C-Atom von Glukose dagegen eine Oxidation durchlaufen, würde ein OAtom hinzugefügt werden und wir erhalten die funktionelle Gruppe COOH, also CarboxyGruppe. Es würde Glukonsäure entstehen. Diese spielt vor allem bei Ausscheidungs- und Entgiftungsvorgängen der Leber eine Rolle. Zucker ist also keineswegs schlecht oder ähnliches. Einen gewissen Teil benötigt der menschliche Körper daher selbst in der sogenannten Ketose, wobei eine 0-Gramm-Kohlenhydrat-Diät in der Praxis sowieso undenkbar ist, wenn man sich nicht lediglich von Eiklar und Butter ernährt. Selbst dann wäre man aber streng genommen nicht bei Zero Carbs. Sollte man die Kohlenhydrate jedoch (dauerhaft) auf nahezu 0 herunterschrauben, wandelt der Körper glycogene Aminosäuren zu Kohlenhydraten, was jedoch relativ aufwändig ist, weshalb einige Autoren Kohlenhydrate als semi-essentiell bezeichnen. Aber dazu in einem späteren Artikel mehr. Disaccharide Die für den Menschen wichtigsten Disaccharide sind: - Saccharose - Laktose - Maltose Disaccharide sind über die sogenannte O-glykosidische Bindung über ein Sauerstoffatom verbunden, wie in der Grafik am Beispiel von Saccharose = Glukose + Fruktose zu erkennen ist. Saccharose wird in Pflanzen als Transportform der Kohlenhydrate und als lösliche Kohlenhydrat-Reserve genutzt. Laktose, oder auch Milchzucker, ist dagegen ein Disaccharid aus Glukose und Galaktose. Während Muttermilch bis zu 7,5 % Laktose enthält, sind es in herkömmlicher Kuhmilch ca. 4,5 %. Das dritte, wichtige Disaccharid ist Maltose, welches aus zwei Glukose-Molekülen besteht. In diesem Zusammenhang begegnen wir (erneut) den Begriffen reduzierend und nichtreduzierend. Das bedeutet, dass bei einem reduzierenden Zucker eine freie CarbonylGruppe (OH) existiert, die weiter oxidiert werden kann. Ob ein Zucker reduzierend oder nichtreduzierend ist, hängt davon ab, an welchem CAtom die Verbindung zwischen den Molekülen eingegangen wird. Saccharose zählt zu den nichtreduzierenden Zuckern. Maltose und Laktose sind dagegen reduzierende Zucker. Seite 18 von 34 Polysaccharide Polysaccharide stellen Kohlenhydratketten aus mindestens 10 bis 20 (je nach Autor) Kohlenhydraten dar und haben die Endung -an. Diese können noch nach - Homoglykane … und … - Heteroglykane lediglich eine Sorte von Monosacchariden verschiedene Sorten von Monosacchariden unterteilt werden, wobei wir Heteroglykane in diesem Artikel zunächst nicht weiter betrachten wollen. Homoglykane In der menschlichen Ernährung spielen vor allem 3 Homoglykane eine Rolle: - Glykogen: die tierische Form der Glukosespeicherung im Körper - Stärke: die pflanzliche Form der Glukospeicherung - Zellulose: ebenfalls eine Glukosekette, die allerdings vom Menschen nicht gespaltet werden kann. In diesem Zusammenhang (mal wieder) der Hinweis auf die von Veganern viel zitierten Gorillas: Vegane Gorillas und Zellulose Während der menschliche Körper für Disaccharide unabhängig von ihrer Verknüpfung die zur Spaltung notwendigen Enzyme im Darm besitzt, gilt dies nicht für Zellulose. Gorillas (und auch andere Tiere wie Elefanten) besitzen hingegen nicht nur eine andere Darmstruktur, sondern auch andere Darmbakterien, die die Zellulose für diese Tiere aufspalten. Gleichzeitig sind die Darmbakterien Proteinlieferant, wodurch diese Tiere letztendlich ihre (große) Masse aufbauen. Wenn man also keinen extrem verkürzten Dünndarm und einen sprichwörtlich tierischen Dickdarm besitzt, sollte man damit Aufhören sich aufgrund der Lebensmittelauswahl mit einem Silberrücken zu vergleichen. Das zeigt letztlich nur, dass man ziemlich im Nebel steht. Für Menschen dient Zellulose daher in erster Linie als Ballaststoff, wobei die Bedeutung unterschiedlich kritisch in der Literatur gesehen wird. Dazu vielleicht in einem späteren Teil mehr. Darüber hinaus der Vollständigkeit wegen noch der Hinweis, dass es im Jahr 2010 eine Untersuchung an Kindern in Burkina Faso gab. Diese haben traditionell eine deutlich ballaststoffreichere Ernährung und die Forscher konnten bei den afrikanischen Kindern eine andere Darmflora feststellen, als bei europäischen Kindern. Dieses Thema vielleicht in einem späteren Artikel noch einmal genauer. Kurzer Ausblick: Der Blutzucker In unserem Blut herrscht immer ein gewisser Blutzuckerspiegel. Würde dieser zu groß werden, spräche man von der Hyperglykämie, wird dieser zu niedrig, heißt dies Hypoglykämie. Beides ist potentiell gesundheitsschädigend, so dass der Normalwert für Glykose zwischen 70 und 110 mg / dl liegt. Bodybuilder und Nierenversagen Ein interessanter Punkt ist in diesem Zusammenhang die Arbeit der Niere. Auch diese bearbeitet Glukose, wobei der Zucker zunächst filtriert und dann wieder rückresorbiert wird. Ist nun jedoch zu viel Glukose im Blut, weil Insulin nicht mehr so wirkt, wie es soll, Seite 19 von 34 hat die Niere Probleme die Rückresorption schnell genug durchzuführen. Diese Schwelle liegt bei 180 mg / dl Glukose im Blut. Aus diesem Grund ist Glukose im Urin unter normalen Umständen entweder ein Anzeichen für Diabetes oder Nierenversagen. Auf biochemische Einzelexperimente im (Hobby-)Bodybuilding soll an dieser Stelle nicht weiter eingegangen werden. Im Rahmen der Kohlenhydratverstoffwechselung wird uns dies in einem späteren Teil erneut begegnen. Zusammenfassung Dies war zunächst ein grundlegender Einstieg zum Thema Kohlenhydrate, der bereits auf den ein oder anderen Punkt in Teil 3hingewiesen hat, aber gleichzeitig auch bereits etwas in die Zukunft blicken ließ. Was sollten wir aus diesem Teil mitnehmen? Kohlenhydrate sind in Monosaccharide, Disaccharide und Polysaccharide zu unterteilen. Die Anordnung der OH-Gruppe sorgt für die Präfixe α- oder β- sowie D- oder L-. Kohlenhydrate sind generell nicht essentiell, werden vom Körper aber im Zweifelsfall hergestellt. Der gesunde Mensch hat immer einen Blutzuckerspiegel zwischen 70 und 110 mg / dl. Zellulose kann vom menschlichen Körper (aufgrund der Darmstruktur i.d.R.) nicht verwertet werden und dient als Ballaststoff. Wie immer wird in Zukunft bei Bedarf auf diesen Artikel hingewiesen. Biochemie für Sportler V Lipide: Mehr als nur Fett Nachdem wir uns in Teil 4 mit den Kohlenhydraten auseinandergesetzt hatten, werden wir uns im vorliegenden Teil Lipide genauer anschauen, zu denen der Energieträger Fett zählt. Doch Lipide umfassen eine weitaus größere Bandbreite an Stoffen in unserem Körper. Ob Testosteron oder Vitamin D: Die Gruppe der Lipide ist ein weites Feld! Was sind Lipide? Die Gruppe der Lipide ist eine heterogene Ansammlung an Stoffen, die allesamt aus der Ausgangssubstanz Acetyl-Coenzym A kurz Acetyl-CoA synthetisiert werden, wenn sie im Körper als Stoffwechselprodukt entstehen. Trotz der großen Unterschiede der einzelnen Lipide umfasst diese Gruppe generell folgende Eigenschaften: - schlechte Löslichkeit in Wasser gute Löslichkeit in unpolaren Lösungsmitteln wie Chloroform oder Ether Darüber hinaus übernehmen Lipide eine Vielzahl an Funktion im Körper wie: - Brennstoff - Baustoff - Isolator - Hormon - Gallensäure - Vitamin Seite 20 von 34 Einteilung der Lipide Im Rahmen unserer Artikelreihe werden wir Fettsäuren Glycerin Sphingosin Isopren unterscheiden. Fettsäuren sind nichts anderes als Carbonsäuren, die wir bereits in Teil 3 kennengelernt hatten. Diese besitzen, wie wir uns erinnern, die funktionelle Gruppe COOH, welche den hydrophilen (wasserliebenden) Teil der Fettsäure ausmachen. An dieser funktionellen Gruppe hängt nun ein Schwanz an CH-Gruppen, der den lipophilen (fettliebenden) Teil darstellt. Glycerin ist ein dreiwertiger Alkohol, den wir bereits in Teil 4 grafisch dargestellt hatten. Sphingosin ist ein zweiwertiger Aminoalkohol, der vor allem für das Nervensystem von Bedeutung ist und Isopren ist schließlich die Grundstruktur vieler wichtiger funktioneller Lipide wie Steroidhormone, Gallensäure oder auch fettlösliche Vitamine. Schauen wir uns also die einzelnen Gruppen etwas genauer an. Fettsäuren: Fett schwimmt oben Schon als Kinder lernten wir schlechte Witze, in denen sich der Gast über Fettaugen in der Suppe beschwerte, die ihn beobachten würden. Aber warum schwimmt Fett immer oben? Aufgepasst: Fettsäuren gehören zu den amphiphilen (sinngemäß: auf beiden Seiten liebenden) Substanzen. Das bedeutet, wenn man sich eine Fettsäure wie in Stäbchen vorstellt, dass dieses an dem einen Ende lipophil und am anderen Ende hydrophil ist. Es besitzt also ein fettlösliches und ein wasserlösliches Ende. Ist der Durchmesser des lipophilen Endes größer als der des hydrophilen, wie in der Grafik dargestellt, so bildet sich auf der Wasseroberfläche ein Film, bei dem das lipophile Ende herausragt. Ganz nebenbei verringert sich auch die Oberflächenspannung durch das Herausragen der liphophilen Enden. Jesus hätte also ein echtes Problem gehabt, wenn man genügend Speiseöl ins Wasser gekippt hätte. Dieses Prinzip ist essentiell für den menschlichen Körper, da unsere Zellwände zum größten Teil aus Lipid-Vereinigungen oder besser gesagt aus einer Lipiddoppelschicht bestehen. Seite 21 von 34 Dadurch, dass sowohl nach außen als auch innen ein lipophiles Ende abgrenzt, werden mir nicht zum Blob und kriechen über den Erdball, sondern haben eine relativ feste Struktur. Flüssigkeit, die innerhalb der Zellen ist, kommt also nicht ohne weiteres rein und anders herum. – Dass unsere Zelle natürlich diverse Pforten besitzt, damit ein Stoffaustausch stattfinden kann, sollte jedem Leser klar sein. Fettsäuren: Wie sind diese aufgebaut? Wir haben bereits gelernt, dass Fettsäuren nichts anderes als spezielle Carbonsäuren sind. Als weiteres Merkmal muss ergänzt werden, dass ab einer Anzahl an vier CAtomen von einer Fettsäure gesprochen wird. Ameisensäure (1 C Atom), Essigsäure (2 C Atome) und Propionsäure (3 C Atome) erfüllen somit generell auch die bisherigen Kriterien, aber erst ab Buttersäure (4 C Atome) sprechen wir von Fettsäuren! Je länger die Kette an C-Atomen ist, desto größer ist der lipophile Anteil innerhalb der Fettsäure und damit auch der lipophile Charakter. In diesem Zusammenhang trifft das beliebte Bodybuildersprichwort Viel hilft viel! tatsächlich einmal zu. In Teil 3hatten wir mit den Richtlinien der IUPAC das Prinzip der Durchnummerierung kennengelernt. Dieses wird auch bei Fettsäuren angewandt, wobei es hier zwei gebräuchliche Benennungen gibt. Neben der bereits bekannten Nummerierung, die am C-Atom der COOH-Gruppe beginnt, gibt es ebenfalls die Bezeichnung mit griechischen Buchstaben, die dann jedoch erst am zweiten C-Atom ihren Anfang nimmt. Für Bodybuilder ist besonders die β-Oxidation von Interesse, die auf diese Bezeichnung zurückzuführen ist. Am β-C-Atom setzt der Abbau von Fettsäuren an, der in Zukunft noch thematisiert wird. Aus dem allgemeinen Sprachgebrauch werden die meisten bereits die Begriffe - gesättigte Fettsäure - ungesättigte Fettsäure - essentielle Fettsäure kennen. Diese wollen wir uns als nächstes genauer anschauen. Gesättigte Fettsäuren Das Prinzip der Fettsäuren haben wir kennengelernt. Die CH-Gruppen sind letztendlich der Grundstein für die allseits bekannte Aufteilung von Fetten. Wenn jedes C-Atom durch eine Einfachverbindung verknüpft ist, spricht man von gesättigten Fettsäuren Das Prinzip der Sättigung und Bindungen zwischen Atomen haben wir ausführlich in Teil 2 der Serie dargestellt. In der Literatur werden gesättigte Fettsäuren ganz einfach durch eine Zick-Zack-Linie Seite 22 von 34 dargestellt, wie hier am Beispiel von Stearinsäure. Jeder Zacken steht entspricht einem C-Atom, das jeweils 2 H-Atome gebunden hat. Ungesättigte Fettsäuren Bei ungesättigten Fettsäuren gibt es entsprechend eine Veränderung in der CH-Gruppe. Man spricht von einer ungesättigten Fettsäure, wenn neben Einfachbindungen auch Doppelbindungen zwischen den C-Atomen existieren. Pro Doppelbindung fehlen also zwei H-Atomen, die die jeweils beteiligten C-Atome nicht mehr an sich binden. Je nach Anzahl dieser Doppelbindungen führt dies zur Unterteilung zwischen - einfach ungesättigten Fettsäuren (z.B. Ölsäure) - mehrfach ungesättigten Fettsäuren (z.B. Linolensäure). Transfette In diesem Zusammenhang sind die sogenannten Transfette anzusprechen: Wenn eine Fettsäure eine Doppelbindung eingeht, kann sich die räumliche Struktur ändern. Aus der Zick-Zack-Linie wird eine Trapezform, was als cis-Doppelbindung (lat. cis = diesseits) bezeichnet wird. Die für den Menschen wichtigen ungesättigten Fettsäuren besitzen allesamt diese cis-Bindung, wie hier am Beispiel der Ölsäure noch einmal grafisch dargestellt. Behält das Molkekül jedoch seine Zick-Zack-Linie, wird dies als trans-Form bezeichnet (lat. trans = gegenüber). Im Beispiel ist die trans-Fettsäure Elaidinsäure zu sehen, die in kleinen Mengen auch in Milchfett vorhanden ist. Transfettsäuren sind also keinesfalls eine Erfindung der Fastfood-Industrie. Je nachdem, wie die Doppelbindung in der Fettsäure vorliegt, spricht man von einer isolierten oder konjugierten Doppelbindung. Diese Bezeichnung gibt darüber Auskunft, wie die anschließenden Bindungen aussehen. Das bedeutet: Isolierte Doppelbindungen sind durch mindestens zwei Einfachbindungen getrennt. Es liegt also mindestens 1 C Atom dazwischen, das nur Einzelbindungen hat. In den beiden Grafiken sind also eine isolierte cis-Doppelbindung und eine isolierte transDoppelbindung zu sehen. Konjugierte Doppelbindungen besagen dagegen, dass Einzel- und Doppelbindung sich abwechseln. Die folgende Grafik zeigt entsprechend konjugierte trans-Doppelbindungen. Die Fettsäuren in unserem Körper besitzen immer isolierte (cis-)Doppelbindungen! Seite 23 von 34 Die Anzahl der C-Atome und Anzahl der Doppelbindungen beeinflusst schließlich die Konsistenz von Lipiden. Für den menschlichen Körper sind vier ungesättigte Fettsäuren von besonderer Bedeutung: (cis-∆9-)Ölsäure (cis-∆9, 12-)Linolsäure (cis-∆9, 12, 15-)Linolensäure (cis-∆5, 8, 11, 14-)Archidonsäure Ölsäure haben wir bereits weiter oben kennengelernt. Wie in der Grafik noch einmal verdeutlicht, ist die cis-Doppelbindung zwischen dem 9. und 10. C-Atom, was entsprechend mit ∆ (Delta) und der jeweiligen Zahl dargestellt wird. Omega-Fettsäuren In diesem Zusammenhang wird das Prinzip der Omega-Fettsäuren deutlich. Diese stellen eine alternative Namensgebung dar, bei der die C-Atome von hinten abgezählt werden. Omega (ω) ist der letzte Buchstabe des griechischen Alphabets und entsprechend ω das letzte C-Atom des Fettes. Ölsäure ist also, wenn man in der Grafik durchzählt, eine Omega-9-Fettsäure. In der Praxis wird jedoch immer wieder das Verhältnis von Omega-6 zu Omega-3 thematisiert, wobei wir in der westlichen Ernährung in der Regel zu wenig Omega-3-Fette konsumieren. Wie sich der Leser nun vielleicht bereits denken kann, stellen Omega-3-Fette ungesättigte Fette mit einer Doppelbindung an am drittletzten C-Atom dar. Eine letzte Bezeichnung ist schließlich die Aufschlüsselung nach C-Atomen und Doppelbindung. Buttersäure als gesättigte Fettsäure mit 4 C-Atomen wird entsprechend auch mit 4:0 bezeichnet. Die folgende Tabelle fast dies noch einmal übersichtlich zusammen. Essenzielle Fettsäuren Bereits in Teil 4 haben wir im Zusammenhang mit Kohlenhydraten von (semi)essentiellen Nährstoffen gesprochen. Doch während der Körper selbst bei einer Zero- Seite 24 von 34 Carbs-Diet die (trotz Ketose wenigen) benötigten Kohlenhydrate herstellt, existieren zwei essenzielle Fettsäuren, die der Körper nicht selbstständig herstellen kann. Bei den essentiellen Fettsäuren handelt es sich um Linolsäure und Linolensäure, die für unsere Zellmembranen notwendig sind. Da unser Körper ∆9-Bindungen in den Zellmembranen nicht selbst einbauen kann, muss er diese Fettsäuren über die Nahrung aufnehmen. Aus Linolensäure kann der Körper Archidonsäure herstellen, weshalb diese als halbessenziell betitelt wird. Ölsäure wiederum kann aus Stearinsäure vom Körper reproduziert werden. Beide Vorgänge finden im endoplasmatischen Retikulum (ER) statt. Faustformel für Fettsäuren Je kürzer die Fettsäuren sind oder je mehr Doppelbindungen die Fettsäuren enthalten, desto flüssiger ist das Fett auch bei niedrigen Temperaturen. Das bedeutet, ein Fett, das bei Raumtemperatur flüssig ist, hat eher kurze Fettsäuren bzw. Doppelbindungen in den Fettsäuren. Aus diesem Grund ist die Butter grasgefütterter Rinder weicher als andere Butter, da die Fettsäurestruktur eine andere ist. – Rein theoretisch. Weichmacher-Diskussionen, die durch die Medien gingen, wollen wir an dieser Stelle nicht vertiefen. Nach diesem Prinzip wird aber auch klar, warum die Fettsäurestruktur von (Tiefsee)Fisch durch ungesättigte Fettsäuren geprägt ist: Wäre der Anteil an gesättigten Fetten größer, hätten wir im kalten Wasser überspitzt beschrieben unbewegliche, steife Fisch. Glycerin-Derivate Die meisten Lipide im menschlichen liegen als Ester-Verbindung vor. Wer in Teil 3 aufgepasst hat, erinnert sich, dass dies Verbindungen aus Alkohol und einer Säure sind. Während wir Fettsäuren in diesem Teil bereits systematisch durchgearbeitet haben, ist uns der Zuckeralkohol Glycerin noch aus Teil 3 bekannt. Die Verbindung von Glycerin mit 3 Fettsäuren wird als Triacylglyceride (TAG) bezeichnet und ist das, was wir im allgemeinen Sprachgebrauch als (Körper-)Fett bezeichnen. Je nachdem welche Fettsäuren an das Glycerin-Molekül verestert werden, sind die unterschiedlichsten Kombinationen für ein TAG denkbar. Da ein TAG extrem lipophil ist, speichert dieses im Gegensatz zu Kohlenhydraten kaum Wasser und ist entsprechend eine platzsparende Energiereserve für den Körper. Daneben dient Fett im Körper aber auch als Baufett (Augenhöhle oder Fußsohle) oder auch Organfett. Das Phänomen der Wanderniere, das zum Beispiel bei Magersucht auftreten kann, beschreibt einen Zustand, bei dem so viel Organfett abgebaut wurde, dass die Nieren schließlich nicht länger gestützt werden. Neben diesen Glycerolipiden sind Phosphoglycerolipide (auch Glycerophosphatide genant) im menschlichen Körper von großer Bedeutung, weshalb dieser ebenfalls kurz angesprochen werden sollen. Phosphoglycerolipide Phosphoglycerolipide klingen zunächst etwas kompliziert, sind für den menschlichen Körper aber von großer Bedeutung (für die Zellmembran) und haben eine generelle Ähnlichkeit zu den gerade noch besprochenen TAG. Im Gegensatz zum Fett hängt bei Phosphoglycerolipide am dritten C-Atom des Glycerins ein Phosphatrest anstatt einer Fettsäure, der Phosphatidsäure betitelt wird. Dieser wiederum kann in der Regel in vier Gruppen (polare Reste) unterteilt werden: Seite 25 von 34 Serin (Aminosäure) im Phosphatidyl-Serin Ethanolamin (Aminoalkohol) im Phosphatidyl-Ethanolamin Inositol (Zuckeralkohol) im Phosphatidyl-Inositol Cholin (Aminoalkohol) im Phosphatidyl-Cholin Der Vertreter Phosphatidyl-Cholin hat bekanntermaßen in den letzten Monaten eine steigende Aufmerksamkeit in Kraftsportkreisen erlangt, da sich einige Trainierende neue Muskelzuwächse davon erhoffen. Grafisch kann man sich den Aufbau eines Glycerophosphatid wie folgt vorstellen. Das Phosphatidyl-Cholin ist, wie angesprochen, der austauschbare polare Rest in dieser Grafik. Während wir Sphingosin an dieser Stelle auslassen, ist Isopren für viele Leser sicherlich deutlich interessanter, da dies die Grundlage für Steroide darstellt. Isopren-Derivate Bevor wir aber kurz zu den ominösen Steroiden kommen, sollte zunächst geklärt werden, was ein Isopren ist. Isopren ist korrekt als 2-Methylbuta-1,3-dien zu betiteln. Das klingt auf den ersten Blick wieder kompliziert, aber in Teil 3 wurde uns bereits klar, dass uns dies in erster Linie als Hinweis auf die Struktur dient, die wir in der Grafik bereits sehen: Butane sind eine Stoffgruppe, die die Summerformel C4H10 haben aufgrund der Doppelbindungen am ersten und vierten C-Atom, wie in der Grafik zu erkennen, enthält das Molekül die Endung -en, da wir zwei Doppelbindungen haben –dieen die Doppelbindung sind am ersten und dritten C-Atom, also -1,3-dien am zweiten C-Atom befindet sich eine Methyl-Gruppe (CH3), daher 2-Methyl. Wie ihr seht, ist das Ganze also wieder einmal selbsterklärend. Isopren-Derivat: Terpene Terpene sind die Aneinanderreihung mehrere Isoprene. Die den meisten bekannteste Form sind wohl die fettlöslichen Vitamine, also Vitamin A Vitamin E Vitamin K und das Ex-Vitamin D, dem es ein bisschen wie Pluto geht. Erst gehörte es dazu, dann doch wieder nicht. Heutzutage gilt Vitamin D als Hormon und wird in einem späteren Teil noch einmal genauer thematisiert, denn Vitamin D aus der Nahrung ist etwas anderes als Vitamin D in unserem Körper, was uns an dieser Stelle aber noch nicht weiter interessieren soll. Seite 26 von 34 Isopren-Derivat: Steroide Bei dem Wort Steroide denken viele Trainierende oftmals an Spritzen und exogene Testosteronzufuhr. Das ist in der Form jedoch nicht korrekt, da die Stoffe der Steroide deutlich mehr umfasst! Das Grundgerüst aller Steroide ist Steran. Ein anderer Begriff, den man in der Literatur findet, ist Gonan. Dabei handelt es sich um ein Steran, dessen B-C und C-D Ringe trans-ständig verbunden sind. Auf diesem Molekül bauen schließlich Cholesterin (bzw. in neuere Literatur auch Cholestarol betitelt) und damit Steroidhormone auf, was an dieser Stelle aber noch nicht weiter vertieft werden soll. Zusammenfassung Dieser Teil stellte einen grundlegenden Einstieg in das Thema Lipide dar. Was sollten wir aus diesem Teil mitnehmen? Fette bestehen aus einer Glycerin-Basis sowie verschiedenen Fettsäuren. Fettsäuren mit dem Begriff Omega im Namen, geben Auskunft darüber, an welcher Stelle die letzte Doppelbindung einer Fettsäure zu finden ist. Je kürzer die Fettsäure ist oder je mehr Doppelbindungen enthalten sind, desto niedriger ist der Schmelzpunkt des Tricylglycerids. Wie immer wird in Zukunft bei Bedarf auf diesen Artikel hingewiesen. Teil VI Protein: Aminosäuren und so, Alter! Nachdem wir in Teil 4 die Kohlenhydrate und in Teil 5 die Fette (biochemisch) kennengelernt hatten, schließen wir die drei Hauptenergielieferanten des menschlichen Körpers nun mit dem Protein sowie den Aminosäuren ab. Waren Kohlenhydrate noch nicht bzw. semi-essentiell und lediglich wenige Fettsäuren tatsächlich lebensnotwendig für den menschlichen Körper, so sind Aminosäuren an einer Vielzahl an Prozessen im Körper beteiligt, die weit über einen dicken Bizeps hinausgehen. Die (proteinogenen) Aminosäuren Steigen wir also gleich in das Thema ein: Das menschliche Protein ist nichts anderes, als eine Aneinanderreihung von einzelne Aminosäuren. Man kann sich dies entweder mit einer Perlenkette, die ein bestimmtes Muster hat, oder aber auch einer Reihe von LegoBausteinen, die eine bestimmte Reihenfolge besitzt, vorstellen. Welche Verbildlichung man auch immer nutzt: Protein besteht aus den bekannten 20 proteinogenen Aminosäuren. Nein, halt 21. Äh, 22! – Ja was denn nun? Je nachdem, wo nachgelesen wird, wird man die Zahl 20, 21 oder 22 genannt bekommen. Das ist auf den ersten Blick ein wenig verwirrend und sorgt teilweise für rumgenerSeite 27 von 34 de, dass Person X darauf aufmerksam macht, Person Y hätte die falsche Zahl genannt. Generell sind alle drei Angaben korrekt. Noch einmal von vorne: Der Mensch benötigt 20 verschiedene Aminosäuren, um körpereigenes Protein zu bilden. Die 21. Aminosäure Selenocystein spielt bei der Proteinsynthese im menschlichen Körper ebenfalls eine Rolle. Pyrrolysin ist wiederum für andere Spezies von Bedeutung, aber ist der Grund, dass manchmal die Zahl 22 auftaucht. Darüber hinaus gibt es rund 300 weitere Aminosäuren, die ebenfalls von Bedeutung sind, allerdings nicht für den Aufbau von Muskelmasse herangezogen werden. Vor nicht langer Zeit gab es daher beispielsweise Diskussionen um ein Proteinpulver, bei dem die Aminosäure Taurin hinzugefügt wurde. Dadurch wurde der vermeintliche Eiweißanteil im Pulver nach oben geschraubt, während im Endeffekt weniger proteinogene Aminosäuren im Pulver vorhanden waren, auf die es eigentlich beim Kauf ankommt. In Teil 3 lernten wir die kleinste Aminosäure Glycin kennen und verstanden damit streng genommen auch bereits die Struktur von Aminosäuren, denn diese bestehen immer aus einer Carboxy-Gruppe (COOH) einer Amino-Gruppe (NH2, NH oder N) einem Wasserstoffatom (H) und einem spezifischen Rest, der bei jeder Aminosäure anders ist. Im Fall von Glycin war dies ein weiteres Wasserstoffatom. Wie wir darüber hinaus bereits bei den Kohlenhydraten in Teil 4 lernten, gibt es auch bei den Aminosäuren (bis auf Glycerin) ein Chiralitätszentrum, so dass D- und L-Formen von Aminosäuren existieren. Da unser Körper nur L-Aminosäuren verwerten kann, ist auf Supplementen entsprechend immer L-[Aminosäure einfügen] zu finden. Ist dieser Buchstabe nicht aufgeführt, ist allerdings dasselbe gemeint. L-Glutamin ist also beim Kauf von Produkten dasselbe wie Glutamin. Einteilung der Aminosäuren In Bodybuildingkreisen wird oftmals zwischen essentiellen und nicht-essentiellen Aminosäuren unterschieden. Dies wollen wir aber erst in einem zweiten Schritt tun, da es biochemisch geschickter ist zwischen - unpolaren - polar, aber ungeladenen und - geladenen Aminosäuren zu differenzieren. Ohne uns hier in Details zu verlieren, wollen wir uns die dritte Gruppe anschauen. Es gibt fünf geladene Aminosäuren, die wiederum in zwei saure (Glutaminsäure und Asparaginsäure) sowie drei basische (Lysin, Arginin, Histidin) unterschieden werden. Das einzeln als Pulver erwerbbare L-Glutamin ist somit ein Amid (siehe Teil 3) der Glutaminsäure. Aus der basischen Aminosäure Arginin wiederum wird das unter (Achtung, Wortspiel) Pumpern heißt ersehnte Molekül NO gebildet, dass allerdings auch eine Reihe an anderen positiven Einflüssen im menschlichen Körper ausüben kann. Seite 28 von 34 Essentielle Aminosäuren Wie bereits zu Beginn des Artikels angesprochen, gibt es eine Reihe an essentiellen Aminosäuren, ohne die kein Mensch leben könnte. Dabei handelt es sich um die 8 Vertreter: - Valin - Leucin - Isoleucin - Phenylalanin - Tryptophan - Lysin - Methionin - Threonin die entsprechend in EAA-Supplementen enthalten sind. In einem Teil der jüngeren Literatur wird darüber hinaus Histidin inzwischen ebenfalls zu den essentiellen Aminosäuren gezählt. Alle anderen proteinogenen Aminosäuren zählen generell zu den nicht essentiellen. Das bedeutet, diese sind zwar für die Bildung von Protein notwendig, können bei vorherrschendem Mangel jedoch vom Körper selbst gebildet werden. Bedingt und Semi-Essentiell Daneben gibt es noch weitere Unterteilungen. Die Aminosäuren Arginin, Tyrosin und Cystein haben bei Schwangerschaften und Wachstum eine große Bedeutung, so dass diese als bedingt essentiell eingeordnet werden. Tyrosin und Cystein können darüber hinaus nur unter der Verwendung von essentiellen Aminosäuren (Phenylanin bzw. Methionin) gebildet werden und gelten daher als semiessentiell. Aber auch Asparagin, Glutamin, Serin und Prolin können einen erhöhten Bedarf aufweisen, wobei die Angaben in der Literatur hier auseinandergehen. Der pK-Wert: Säure-Basen-Haushalt Jede Aminosäuren besitzt, namensgebend, eine Amino- sowie eine Carboxy-Gruppe, wie weiter oben auch bereits angesprochen wurde. Je nach Umgebung, in der sich die Aminosäure befindet, kann es passieren, dass die Amino-Gruppe ein zusätzliches Wasserstoffatom aufnimmt, während die Carboxy-Gruppe ein Wasserstoffatom abgibt, wie in der Grafik zu sehen ist. In Teil 2 hatten wir bereits Ionenverbindungen kennengelernt. Ionisierbare Gruppen haben immer das Bestreben ein Proton abzugeben oder aufzunehmen. Dieser Wert wird als Säure- oder Basenstärke betitelt, wobei für uns lediglich die Säurestärke, kurz der pKSWert, von Interesse sein soll. Der pKS-Wert eines Moleküls gibt den pH-Wert an, bei dem die eine Hälfte der Moleküle protoniert ist (in der Abbildung rechts) und die andere Hälfte noch deprotoniert ist (in der Abbildung links). Das bedeutet also, dass jeweils 50 % der Gesamtmenge dieser Moleküle in der einen oder anderen Form bei pH-Wert X vorliegen. Weiter soll diese Thematik heute an dieser Stelle nicht vertieft werden. Mehr als nur eine Aminosäure: Peptide und Proteine In Teil 3 wurde bereits dargestellt, dass aus zwei Aminosäuren, wenn diese eine Peptidbindung eingehen, unter der Abspaltung von Wasser ein Peptid entsteht. Seite 29 von 34 Sind diese Peptidketten schließlich lang genug, spricht man von einem Protein, wobei es allein menschlichen Körper rund 50.000 verschiedene Proteine gibt, die wiederum zum Teil neben Aminosäuren weitere Bestandteile enthalten. Darüber hinaus finden in unserem Körper ständig auf- und abbauende Prozesse statt, so dass ein Erwachsener täglich ca. 300 Gramm Protein neu synthetisiert. – Also weit mehr, als über die Nahrung eigentlich zugeführt wird, da der Körper die abgebauten Aminosäuren recycelt. Über die Nahrung müssen wir lediglich den Verlust ausgleichen, was bei einem Überschuss schließlich in der bekannten positiven Stickstoffbilanz mündet. Die gegenseitige Bindung von Aminosäuren benötigt Energie, was im Umkehrschluss bedeutet, dass die Spaltung von Proteinen und Peptiden sich positiv auf die Kalorienbilanz auswirkt. Darüber hinaus wird bei der Trennung der einzelnen Aminosäuren Wasser benötigt, so dass dieser Vorgang als Hydrolyse bezeichnet wird, die wiederum durch die Enzyme Peptidasen gesteuert wird. Spätestens jetzt sollte der Begriff hydrolysiertes Whey nachvollziehbar sein, der nichts anderes aussagt, als dass Proteine in diesem Supplement bereits gespalten vorliegen. Das sind an dieser Stelle eine Reihe an Informationen, die in späteren Teilen noch von Bedeutung sein werden. Diese Aminosäuren-Ketten können nun in vier verschiedenen Strukturen vorliegen, die aufeinander aufbauen: Die Primärstruktur stellt nichts anderes als die Reihenfolge der Aminosäuren dar und ist die Grundlage für die... ...Sekundärstruktur. Diese kann sich als α-Helix oder β-Faltblatt darstellen, wobei einzelne Abschnitte der Aminosäurenverbindung unterschiedliche sekundäre Strukturen aufweisen kann. Darüber hinaus kann man noch Kehren und Schleifen unterscheiden, wobei uns dies nicht weiter verwirren soll. Aufbauend auf die sekundäre Struktur entsteht schließlich die Tertiärstruktur, die dem dreidimensionalen Gebilde entspricht. Schließen sich diese mehrere tertiäre Strukturen zusammen, spricht man letztendlich von einer Quartärstruktur. Durch Hitzeeinwirkung (Denaturierung) kann die dreidimensionale Struktur verloren gehen, womit die biologische Funktion auch nicht mehr aufrechterhalten werden kann. Das bedeutet Erhitzen tötet somit Bakterien ab, ändert jedoch nichts an der AminosäurenZusammensetzung. Ob man sein Proteinpulver also zum Backen von Eierkuchen nutzt oder als Shake trinkt, ändert nichts an dessen Wirkung. Genauso wie rohes Fleisch von der Aminosäurenstruktur her nichts anderes als die gebratene Variante darstellt. Es sollte jedoch beachtet werden, dass ab einer Temperatur von ca. 140 Grad einzelne Seite 30 von 34 Aminosäuren mit Zucker-Molekülen reagieren. Durch diese sogenannte MaillardReaktion kann sich der Protein-Gehalt des Endprodukts um bis zu 20 % verringern. Für die Leser dieses Artikels ist dies aber nur dahingehend interessant, dass die MaillardReaktion unterm Strich für typisches Aroma und Geschmack bei gerösteten oder gebratenen Lebensmitteln verantwortlich ist. Dies soll uns an grundlegenden Informationen zum Thema Protein auch genügen. Da wir in den vorherigen Teilen gut vorgearbeitet hatten, fiel dieser Teil spürbar kürzer aus. Zusammenfassung Dieser Teil stellte einen grundlegenden Einstieg in das Thema Aminosäuren dar. Was sollten wir aus diesem Teil mitnehmen? Es gibt proteinbildene Aminosäuren, die in essentiell und nicht-essentiell untergliedert werden können. Die Aminosäurenstruktur eines Proteins ist fest vorgegeben. Fehlt eine Aminosäure, kann das Protein nicht gebildet werden. Erhitzen verändert (generell) nichts an der Aminosäuren-Zusammensetzung eines Protein. Wie immer wird in Zukunft bei Bedarf auf diesen Artikel hingewiesen. Biochemie für Sportler VII Nahrungsaufnahme: Der grundlegende Ablauf im Körper Nachdem wir in den vorherigen Teilen die Energieträger Kohlenhydrate, Fette und Proteine im biochemischen Sinne kennenlernten, wollen wir uns in den nächsten Teilen mit der Verstoffwechselung im menschlichen Körper auseinandersetzen. Bevor wir jedoch mit den Kohlenhydraten beginnen, sollten wir zunächst noch einmal klären, was mit unserer Nahrung beim Essen passiert, bevor wir wieder stärker in die Biochemie einsteigen. Der Verdauungstrakt: Der Weg ist das Ziel Damit der Mensch Nährstoffe überhaupt verwerten kann, müssen diese zunächst exogen über die Nahrung zugeführt und zerkleinert werden. Dabei unterscheidet man zwischen einer mechanischen und chemischen Verdauung, damit die einzelnen Bestandteile über die Schleimhäute des Verdauungstrakts dem Körper zugeführt werden können. Während wir uns Nahrung immer oben hineinschieben ist das, was am Ende der Verdauung übrig bleibt, wortwörtlich für den Arsch. Schauen wir uns also an, was auf dieser langen Reise mit dem Essen geschieht: Der Mundraum: Einmal "Ah!" sagen Seite 31 von 34 Wenn wir Lebensmittel zu uns nehmen, beginnt bereits im Mundraum die Verdauung. Hier wird die Nahrung mittels der Zähne geschnitten (Auf- und Abbewegung des Kiefers) und gemahlen (Bewegungen des Kiefers auf horizontaler Ebene). Dies stellt die erste Form der mechanischen Verdauung dar. Darüber hinaus wird im Mundraum bekanntermaßen Speichel gebildet. Dieser besteht zu etwa 99,5 % aus Wasser und sorgt dafür, dass die Nahrung zu einem Brei vermischt wird, der im Folgenden leichter durch den Verdauungstrakt gelangen kann. Des Weiteren finden erste antimikrobielle und chemische Verdauungsvorgänge im Mundraum statt. Mit dem Speichel wird das Enyzm Ptyalin freigesetzt, dass eine spaltende Wirkung auf Kohlenhydrate ausübt. Damit dieses Enzym jedoch wirksam werden kann, ist ein gewisser Kaudruck erforderlich. In Teil 4 hatten wir uns ausführlich mit der Struktur der Kohlenhydrate beschäftigt und wissen, dass diese unterschiedliche Kettenlängen haben können. Das Enzym Ptyalin wirkt lediglich auf die Polysaccharide Amylose, Amylopektin und Glycogen, das mit Tierfleisch aufgenommen wird, ein und spaltet diese zu Maltose, Maltotriose und Grenzdextrine. Dieses Phänomen wird dem ein oder anderen aus dem Biologieunterricht noch bekannt sein, wenn das Lehrpersonal dazu aufforderte, Brot so lange zu kauen, bis dieses irgendwann süß schmecken würde. – In der Praxis ist dies alles andere als einfach, da mit fortschreitenden Kaufprozess immer mehr Speichel freigesetzt wird und die Nahrung schon fast von allein in die Speiseröhre rutscht bzw. durch die Zunge geschoben wird. Die in Teil 5 kennengelernten (Nahrungs-)Fette können durch den Kauvorgang zwar in der Oberfläche vergrößert werden, jedoch spielt die Fettverdauung im Mund quantitativ keine Rolle. Proteine werden im Mundraum wiederum gar nicht verdaut. Es gibt also keinen Grund auf seinem Postworkout-Shake noch herumzukauen. Von der Speiseröhre führt der Weg des Nahrungsbreis schließlich in den Magen. Der Magen: Zwischenstation vor der Absorption Der Magen ist ein 1,5 Liter großer sackartiger Hohlraum, in dem der Nahrungsbrei zum Teil weiter verdaut wird. Der Magen besteht aus verschiedenen Abschnitten, wie in der Grafik systematisch dargestellt ist, die unterschiedliche Aufgaben im Rahmen der Verdauung erfüllen: Im Fundus kann sich im Rahmen der Nahrungsaufnahme verschluckte Luft ansammeln. Der Korpus ist der voluminöseste Abschnitt des Magens. Das Antrum stellt den Vorraum des Pförtners dar, bei dem es sich wiederum um den Pylorus handelt. Dieser ist der Übergang zum Dünndarm. Seite 32 von 34 In Fundus und Korpus befinden sich drei verschiedene Zellarten, die Salzsäure herstellen (Belegzellen), Enzyme zur Protein- und in geringem Maße Fett-Spaltung herstellen (Hauptzellen) und Nebenzellen, die den Magen vor der eigenen Salzsäure schützen. Im Antrum und im Pylorus existieren noch die sogenannten G-Zellen, die das Hormon Gastrin bilden, welches die Magenbeweglichkeit steigert und Fundus und Korpus zur Säure- und Enzymbildung anregt. Wenn der Magen sich also füllt und die Nahrung bis ans Ende des Magens rutscht, wird die Verdauung angeregt. Kohlenhydrate werden im Magen nur mit Hilfe der Enzyme aus dem Speichel weiter verdaut. Wer also zu schnell die Nahrung herunterschluckt, schleust seine Kohlenhydrate mehr oder weniger unverändert in den Dünndarm. Ebenso wird Fett im Magen, wie schon angedeutet, kaum verdaut. Bleiben also nur noch Proteine. Aufgrund des geringen pH-Wertes des Magensafts von 1 bis 2 werden Eiweiße im Nahrungsbrei angegriffen. Dies sorgt dafür, dass vor allem Bakterien und Viren, die bekanntermaßen aus Protein bestehen, im Magen abgetötet werden. Die Struktur der Proteine wird also zerstört, wie wir in Teil 6 gelernt hatten. Darüber hinaus spalten die Pepsin-Enzyme Protein in Polypeptide, die eine Länge von 10 bis 100 Aminosäuren aufweisen. Wie lange die Nahrung im Magen verweilt, ist sehr unterschiedlich, da der Pylorus tatsächlich wie ein Pförtner fungiert und immer nur kleine Teile des Speisebreis in den Darm abgibt. Je nach Zusammensetzung der Nahrung rechnet man zwischen 2 und 7 Stunden Verweildauer im Magen, wobei die Faustformel gilt: Desto mehr Fett im Nahrungsbrei ist, desto länger verweilt dieser im Magen. Je nach Kauleistung haben wir nun also eine Vermengung an relativ kurzkettigen Kohlenhydraten, Polypeptiden von einer Länge bis zu 100 Aminosäuren und fast noch unverdauten Fetten. Weiter geht es im Dünndarm. Der Dünndarm: Mehr als 5 Meter, die uns vom Gorilla unterscheiden Der Dünndarm ist in drei Abschnitte unterteilt: den an den Magen anschließenden Zwölffingerdarm, an den Gallengang und Ausführungsgang der Bauchspeicheldrüse anschließen, den Leerdarm und den Krummdarm und mündet schließlich an den Dickdarm. Über die Dünndarmzotten werden die Nährstoffe des Nahrungsbreis aus dem Dünndarm in den Körper überführt. Was genau mit den drei Energieträgern passiert, schauen wir uns in späteren Artikeln genauer an. Für heute nehmen wir zunächst nur mit: Kohlenhydrate werden im Dünndarm in Monosaccharide zerlegt und resorbiert. Fette werden im Zwölffinger- und im Leerdarm verdaut und vom Körper aufgenommen. Protein wird im Dünndarm in Aminosäuren, Di- und Tripeptide zerteilt und resorbiert. Alles, was hier nicht verdaut wurde, kann vom Körper praktisch auch nicht mehr aufgenommen werden. Der Dickdarm: Aussteigen, wer keine Fahrkarte hat Im Gegensatz zum Dünndarm ist der menschliche Dickdarm gerade einmal ca. 3 Meter lang, hat jedoch einen namensgebenden beträchtlich größeren Durchmesser. Seite 33 von 34 Die Hauptaufgabe des Dickdarms liegt darin, Wasser und Elektrolyte zurückzuführen, die im Rahmen der Verdauung dem Nahrungsbrei zugeführt wurden. Eine Nährstoffaufnahme, wie im Dünndarm, erfolgt also aufgrund nicht vorhandener Zotten generell nicht mehr. Allerdings ist der Dickdarm voll mit zahlreichen Bakterien, die unverdauliche Nahrungsreste durch Gärungs- und Fäulungsprozesse weiter abbauen. Die dabei entstehenden kurzkettigen, gesättigten Fette dienen unter anderem dem Darm sowie den dort lebenden Bakterien als Nährstoff. Ein sehr geringer Teil wird schließlich auch der Leber zur Energiegewinnung zugeführt. Unverdaulich umfasst dabei alle Kohlenhydratstrukturen, die im Dünndarm nicht in Monosaccharide umgewandelt wurden! Also nicht nur Ballaststoffe im eigentlichen Sinn, sondern auch beispielsweise Lactose bei einer entsprechenden Unverträglichkeit. Je nachdem, wie Bakterien und Kohlenhydrate sich zusammensetzen, kann es zu entsprechenden Stuhlproblemen oder Flatulenz kommen. Was am Ende übrig bleibt, übergeben wir in regelmäßigen Ritualen dem Porzellangott. Zusammenfassung Dieser Teil stellte einen grundlegenden Einstieg in das Thema der Nahrungsaufnahme dar. Was sollten wir aus diesem Teil mitnehmen? Kohlenhydrate, Eiweiß und Fette werden auf dem Weg zum bzw. im Dünndarm in Einzelteile zerlegt. Die Nährstoffe, die der Körper im Dünndarm nicht aufnahm, werden dem Körper in der Regel nicht zugeführt. Wie immer wird in Zukunft bei Bedarf auf diesen Artikel hingewiesen. Im nächsten Artikel wird wieder die biochemische Lupe herausgeholt und wir schauen uns die Verstoffwechselung von Kohlenhydraten im Detail an. Seite 34 von 34