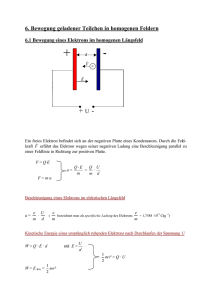
Experimentalphysik 2 für Maschinenwesen
Werbung

Skript zur Vorlesung Experimentalphysik 2 für Maschinenwesen Sommersemester 2009 Prof. Dr. Peter Müller-Buschbaum Technische Universität München Physik Department E 13 2 Experimentalphysik 2 für Maschinenwesen Zeit und Ort: Mo, 10:15 - 11:15, MW 2001 und MW1801 Literatur Paul A. Tipler, Gene Mosca, Dietrich Pelte, Physik für Wissenschaftler und Ingenieure, 2. Aufl. Spektrum Akademischer Verlag 2006, ISBN 3-8274-1164-5 (78 Euro) Ekbert Hering, Rolf Martin, Martin Stohrer, Physik für Ingenieure, 10. Aufl. Springer Verlag 2007, ISBN-10: 3540718559 (44,95 Euro) Frank L. Pedrotti, Leno S. Pedrotti, Werner Bausch, Hartmut Schmidt, Optik für Ingenieure: Grundlagen, 4. Aufl. Springer Verlag 2007, ISBN-10: 3540734716 (74,95 Euro) Übungen Übung 1: Mo 14:00 - 16:00, Raum MW 1250: Tilo Hoppe Übung 2: Mo 15:00 - 17:00, Raum MW 2001: Robert Meier Übung 3: Mo 15:00 - 17:00, Raum MW 0350: Matthias Ruderer Übung 4: Mi 11:00 - 12:00, Raum MW 1801: Matthias Ruderer Übung 5: Fr 10:00 - 12:00, Raum CH 21010: Tilo Hoppe Übung 6: Fr 12:00 - 14:00, Raum MW 1801: Wolfgang Schmid - jede Woche ein Blatt mit Aufgaben Blatt zum Download im Internet Besprechung der Aufgaben in der darauffolgenden Woche Übungsaufgaben als Training für die Klausur und Verständnis Sprechstunden Koordinatorsprechstunde: Di 17:00 - 18:30, Raum PH 3734 Dozentensprechstunde: nach Vereinbarung, Raum PH 3278 Internetseiten http://www.e13.physik.tu-muenchen.de/Muellerb/index.php http://av.ph.tum.de/ c °Lehrstuhl E13, TUM, 2008 3 Klausur im Anschluss an die Vorlesungszeit - weitere Informationen später (nicht-programmierbarer Taschenrechner) c °Lehrstuhl E13, TUM, 2008 Inhaltsverzeichnis 6 Relativitätstheorie 6.1 Spezielle Relativitätstheorie . . . . . . . . 6.1.1 Lorentz-Transformation . . . . . . 6.1.2 Vereinigung von Raum und Zeit zur 6.1.3 Äquivalenz von Masse und Energie 6.1.4 Lichtgeschwindigkeit als Grenze . . 6.2 Allgemeine Relativitätstheorie . . . . . . . 6.2.1 Global Positioning System (GPS) . . . . . . . . . . . . . Raumzeit . . . . . . . . . . . . . . . . . . . . . . . . 7 Atomphysik 7.1 Die Teilchennatur des Lichts . . . . . . . . . . 7.1.1 Äußerer photoelektrischer Effekt . . . . 7.1.2 Innerer photoelektrischer Effekt . . . . 7.1.3 Compton Streuung . . . . . . . . . . . 7.2 Atommodelle . . . . . . . . . . . . . . . . . . 7.2.1 Thomsonsches Atommodell . . . . . . 7.2.2 Rutherfordsches Atommodell . . . . . 7.2.3 Bohrsches Atommodell . . . . . . . . . 7.2.4 Anregung eines Atoms durch Stöße . . 7.2.5 Sommerfeldsches Atommodell . . . . . 7.2.6 Orbitalmodell . . . . . . . . . . . . . . 7.3 Quantentheorie der Atome . . . . . . . . . . . 7.3.1 Heisenbergsche Unschärferelation . . . 7.3.2 Wellenfunktion . . . . . . . . . . . . . 7.3.3 Schrödingergleichung . . . . . . . . . . 7.3.4 Wellenmechanik des Wasserstoffatoms 7.3.5 Spin-Bahn Wechselwirkung . . . . . . 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 2 3 5 5 6 7 10 . . . . . . . . . . . . . . . . . 11 11 12 15 17 20 21 22 23 29 30 34 36 36 37 37 39 39 Kapitel 6 Relativitätstheorie Die Relativitätstheorie besteht aus zwei physikalischen Theorien, der 1905 veröffentlichten speziellen Relativitätstheorie und der 1916 abgeschlossenen allgemeinen Relativitätstheorie. Die spezielle Relativitätstheorie beschreibt das Verhalten von Raum und Zeit aus der Sicht von Beobachtern, die sich relativ zueinander bewegen, und die damit verbundenen Phänomene. Darauf aufbauend führt die allgemeine Relativitätstheorie die Gravitation auf eine Krümmung von Raum und Zeit zurück, die unter anderem durch die beteiligten Massen verursacht wird. 6.1 Spezielle Relativitätstheorie Es gibt zwei grundlegende Axiome der Relativitätstheorie: • Prinzip von der Konstanz der Lichtgeschwindigkeit: Die Geschwindigkeit des Lichts ist unabhängig vom Bewegungszustand der Lichtquelle. • Relativitätsprinzip: Physikalischen Gesetze haben für alle Beobachter, die sich mit konstanter Geschwindigkeit bewegen, das heißt keiner Beschleunigung unterliegen, dieselbe Gestalt (Inertialsystem). Abbildung 6.1: links: Beide Beobachter messen für die Geschwindigkeit des Lichtes denselben Zahlenwert, obwohl der Linke sich bewegt. rechts: Für ein fliegendes Flugzeug ist, in guter Näherung, die Erde ein Inertialsystem, obwohl die Erde nicht ruht. Aus diesen Axiomen kann alles Weitere hergeleitet werden. Das Relativitätsprinzip gilt auch für die klassische Mechanik. Aus ihm folgt unmittelbar, dass es keine Möglichkeit 2 6.1. SPEZIELLE RELATIVITÄTSTHEORIE 3 gibt, eine absolute Geschwindigkeit eines Beobachters im Raum zu ermitteln und damit ein absolut ruhendes Bezugssystem zu definieren. 6.1.1 Lorentz-Transformation Die Lorentz-Transformationen verbinden in der speziellen Relativitätstheorie die Zeit- und Ortskoordinaten, mit denen verschiedene Beobachter angeben, wann und wo Ereignisse stattfinden. Dabei handelt es sich um gradlinig gleichförmig bewegte Beobachter, deren Relativgeschwindigkeit kleiner als die Lichtgeschwindigkeit ist, und um Koordinaten, in denen kräftefreie Teilchen gerade Weltlinien durchlaufen. Bei Lorentz-Transformationen bleibt die Lichtgeschwindigkeit c unverändert. Abbildung 6.2: Veranschaulichung von ruhendem und bewegtem Bezugssystem. Ist ein gleichförmig bewegter Beobachter mit Geschwindigkeit v in x-Richtung gegenüber einem anderen Beobachter bewegt, so hängen die Koordinaten (x0 , y 0 , z 0 , t0 ), die er einem Ereignis zuschreibt, durch die Lorentz-Transformation mit den Koordinaten (x, y, z, t) zusammen, die der andere Beobachter für dasselbe Ereignis verwendet. Unter der üblichen Annahme, dass zur Zeit t = t0 = 0 die Ursprünge O und O0 der Bezugssysteme zusammenfallen, lauten ihre Gleichungen: x−vt x0 = q , v2 1 − c2 y0 = y , z0 = z , t − v2 x t0 = q c 2 1 − vc2 (6.1) t0 + v2 x0 t= q c . 2 1 − vc2 (6.2) und für die Rücktransformation x0 + v t 0 x= q , 2 1 − vc2 y = y0 , z = z0 , Eine vereinfachte Schreibweise ergibt sich mit dem Lorentzfaktor 1 γ=p 1 − β2 und der Relativgeschwindigkeit β = v/c. c °Lehrstuhl E13, TUM, 2008 (6.3) 6.1. SPEZIELLE RELATIVITÄTSTHEORIE 4 Abbildung 6.3: Lorentzfaktor für verschiedene Relativgeschwindigkeiten β zwischen 0 und 0.999 c. Im klassischen Limit v << c geht β → 0 und γ → 1. Hingegen ist im anderen Grenzfall v → c und damit β → 1 und γ → ∞. Die Folge der Lorentz-Transformation sind Zeitdilatation und Längenkontraktion durch relative Bewegung. Zeitdehnung (Zeitdilatation) Befindet sich ein Beobachter im Zustand der gleichförmigen Bewegung bzw. ruht er in einem Inertialsystem, geht nach der speziellen Relativitätstheorie jede relativ zu ihm bewegte Uhr aus seiner Sicht langsamer. Die Zeitdilatation in einem Inertialsystem, welches sich relativ mit einer konstanten Geschwindigkeit v bewegt, ist ∆t0 = γ ∆t (6.4) wobei ∆t die Zeitdifferenz im ruhenden und ∆t0 die Zeitdifferenz im bewegten Inertialsystem sind. Gemäß der nach dem Relativitätsprinzip geforderten Symmetrie der Zeitdilatation gilt: Jeder sieht die Uhr des jeweils anderen langsamer gehen. Längenkontraktion Für einen Beobachter erscheinen Objekte um so kürzer, je schneller sie sich relativ zu ihm bewegen. Es sei l die Länge des Objekts, die der ruhende Beobachter misst, v ist die Geschwindigkeit des Objekts, c ist die Lichtgeschwindigkeit, l0 ist die Länge des Objekts, die der mit dem Objekt bewegte Beobachter misst, dann gilt l0 = l γ . (6.5) Bewegte Objekte erweisen sich im Vergleich zum Ruhezustand in Bewegungsrichtung als verkürzt. c °Lehrstuhl E13, TUM, 2008 6.1. SPEZIELLE RELATIVITÄTSTHEORIE 6.1.2 5 Vereinigung von Raum und Zeit zur Raumzeit Bei Ereignissen ist wie bei Verabredungen wichtig, wann und wo sie stattfinden. Diese Angaben sind in einem Spaltenvektor zusammengefasst. Aus gewöhnlichen Vektoren im dreidimensionalen Raum werden dabei sogenannte Vierervektoren. Der Orts-Zeit Vektor r ist also zusammengesetzt aus dem bisher bekannten dreidimensionalen Ortsverktor ~r und einer vierten Komponente, die die Zeit beschreibt x µ ¶ y ~r r= = (6.6) z . ict ict Entsprechend berechnet sich der Betrag zu |r| = x2 + y 2 + z 2 − c2 t2 . (6.7) Somit folgt zum Beispiel aus der Annahme |p| = 0 die Bedingung für eine Kugelwelle x2 + y 2 + z 2 = c2 t2 . 6.1.3 (6.8) Äquivalenz von Masse und Energie Einem System mit der Masse m lässt sich auch im unbewegten Zustand eine Energie E zuordnen, und zwar nach E0 = m0 c2 . (6.9) wobei c die Geschwindigkeit des Lichtes ist. Als Vierervektoren ergibt sich der Impuls-Energie Vektor zu p x ¶ µ py p~ p= = pz . iE/c iE/c (6.10) Entsprechend berechnet sich der Betrag zu |p| = p2x + p2y + p2z − E2 E2 2 = p ~ − . c2 c2 (6.11) Somit folgt zum Beispiel aus der Annahme |r| = −m20 c2 der allgemeine Zusammenhang zwischen Ruhemasse m0 , Impuls und Energie für ein relativistisches Teilchen q E = p2 c2 + m20 c4 . (6.12) Ein Körper mit der Ruhemasse m0 , der sich mit der Geschwindigkeit v relativ zu einem Inertialsystem bewegt, erfährt einen relativistischen Massenzuwachs Mrel (v) = q m0 1− c °Lehrstuhl E13, TUM, 2008 v2 c2 . (6.13) 6.1. SPEZIELLE RELATIVITÄTSTHEORIE 6 Diese rechnerische Masse hängt also von der Geschwindigkeit ab und ist nicht auf einer Waage messbar. Entsprechend ist die Energie eines solchen Teilchens m0 c2 E(v) = Mrel (v) c = q = γ m0 c2 . 2 1 − vc2 2 (6.14) Jede Energiezufuhr ist also mit einem Massenanstieg verknüpft. 6.1.4 Lichtgeschwindigkeit als Grenze Kein Objekt und keine Information kann sich schneller bewegen als das Licht im Vakuum. Nähert sich die Geschwindigkeit eines materiellen Objektes der Lichtgeschwindigkeit, so wächst der Energieaufwand für eine weitere Beschleunigung immer stärker an, weil die kinetische Energie mit wachsender Geschwindigkeit immer steiler ansteigt. Zum Erreichen der Lichtgeschwindigkeit müsste unendlich viel Energie aufgebracht werden. Aufgrund der Relativität der Gleichzeitigkeit können Relativgeschwindigkeiten nicht einfach addiert werden, wie es bei den geringen Geschwindigkeiten des Alltags noch sehr genau zutrifft. Stattdessen ergibt sich für die Gesamtgeschwindigkeit die Formel von zwei relativ zueinander mit v1 und v2 bewegten Objekten vges = v1 + v2 v1 v2 1+ 2 c . (6.15) Geschwindigkeitstransformation Differenzieren wir die Gleichungen der Lorentz-Transformation, so können wir berechnen, wie sich die Geschwindigkeiten beim Übergang von einem Bezugssystem zu einem anderen transformieren. In einem System S 0 , das sich mit der Geschwindigkeit v entlang der x-Richtung relativ zum System S bewegt, laufe ein Punkt mit der Geschwindigkeit u0 . Seine Geschwindigkeit im System S ergibt sich gemäß der Lorentz-Transformation zu dx = γ dx0 + γ v dt0 , dy = dy 0 , dz = dz 0 (6.16) und v dx0 . c2 Für die Geschwindigkeitskomponente in x-Richtung gilt also dt = γ dt0 + γ ux = dx γ dx0 + γ v dt0 = . dt γ dt0 + γ cv2 dx0 (6.17) (6.18) Mit u0x = dx0 /dt0 vereinfacht sich dieser Ausdruck zu ux = c °Lehrstuhl E13, TUM, 2008 u0x + v . 1 + cv2 u0x (6.19) 6.2. ALLGEMEINE RELATIVITÄTSTHEORIE 7 Entsprechend ergibt sich für die y- und z-Komponente uy = und uz = ¡ u0y γ 1+ v c2 u0x ¢ u0z ¡ ¢ . γ 1 + cv2 u0x (6.20) (6.21) Für kleine Systemgeschwindigkeiten (v ¿ c) geht auch dieser Satz von Gleichungen in die klassische Form über. 6.2 Allgemeine Relativitätstheorie Es wird die Wechselwirkung zwischen Materie (einschließlich Feldern) einerseits und Raum und Zeit andererseits beschrieben. Sie deutet Gravitation als geometrische Eigenschaft des gekrümmten vierdimensionalen Raum-Zeit-Kontinuums. Abbildung 6.4: Die Allgemeine Relativitätstheorie erklärt die Gravitation dadurch, dass Ansammlungen von Masse und Energie die Raumzeit krümmen. Das führt dazu, dass Massen Licht ähnlich wie eine Sammellinse ablenken: Sie krümmen Lichtstrahlen zu sich hin. Es gibt zwei grundlegende Grenzfälle: • Für hinreichend kleine Gebiete des Raum-Zeit-Kontinuums geht die allgemeine Relativitätstheorie in die spezielle Relativitätstheorie über. • Für hinreichend kleine Massendichten und Geschwindigkeiten enthält die allgemeine Relativitätstheorie das Newtonschen Gravitationsgesetz als Grenzfall. Die Grundlage der allgemeinen Relativitätstheorie ist das Äquivalenzprinzip: Ein homogenes Gravitationsfeld ist zu einem gleichmäßig beschleunigtem Bezugssystem völlig äquivalent. c °Lehrstuhl E13, TUM, 2008 6.2. ALLGEMEINE RELATIVITÄTSTHEORIE 8 Betrachten wir zum Beispiel eine Raumkapsel, die sich weit weg von jeglicher Materie befindet und einer gleichförmigen Beschleunigung a unterliegt (siehe Abbildung 6.5 links). Im Inneren dieser Kapsel kann kein mechanisches Experiment durchgeführt werden, das einen Hinweis darauf liefern würde, ob die Kapsel im leeren Raum beschleunigt wird oder in einem gleichförmigen Gravitationsfeld mit aG = −a ruht. Abbildung 6.5: Ergebnisse von Experimenten in einem gleichmäßig beschleunigten Bezugssystem (links) lassen sich nicht von denen in einem gleichförmigen Gravitationsfeld (rechts) unterscheiden. Aus der Mechanik ist uns dies bereits als die Äquivalenz von träger und schwerer Masse bekannt. Es galt: • Die träge Masse mt widersetzt sich der Beschleunigung und die Kraft ist F = mt a. • Die schwere Masse ms ist verantwortlich für die Gravitationskraft (Gewichtskraft) Fg = ms g mit g = 9.81 m/s2 . Für das Beispiel des freien Falls liefert die Beobachtung, dass dieser im Vakuum unabhängig von der Masse ist, also a = −g gilt, die Beziehung ms = mt (6.22) Die erste Schlussfolgerung aus dem Äquivalenzprinzip, die experimentell überprüft wurde ist die Ablenkung von Licht in einem Gravitationsfeld. In einem Raumgebiet ohne Gravitation bewegt sich der Lichtstrahl geradlinig mit der Lichtgeschwindigkeit c. Das Äquivalenzprinzip sagt uns, dass ein solches Raumgebiet ohne Gravitationsfeld nur in einer Kapsel gibt, die sich im freien Fall befindet. Betrachten wir also eine Kapsel, die relativ zu einem Bezugssystem im freien Fall beschleunigt wird und einen Lichtstrahl, der in diese Kapsel eintritt (siehe Abbildung 6.6). Da die Kapsel beschleunigt wird, vergrößert sich die c °Lehrstuhl E13, TUM, 2008 6.2. ALLGEMEINE RELATIVITÄTSTHEORIE 9 Abbildung 6.6: links: Lichtstrahl, der sich geradlinig durch eine Kapsel bewegt, die relativ zu einem Bezugssystem im freien Fall gleichmäßig beschleunigt ist. Eingezeichnet sind Positionen des Lichtstrahls zu gleich weit auseinander liegenden Zeitpunkten t1 , t2 , t3 und t4 . (rechts): Im Bezugssystem der Kapsel bewegt sich der Lichstrahl entlang einer parabolischen Bahn. zurückgelegte Distanz in jedem gleich großen Zeitintervall. Aus Sicht eines Beobachters im Inneren der Kapsel beschreibt das Licht daher eine Parabel. Nach dem Äquivalenzprinzip gibt es jedoch keine Möglichkeit zwischen der beschleunigten Kapsel und einer Kapsel, die in einem gleichförmigen Gravitationsfeld ruht, zu unterscheiden. Also wird Licht genau wie ein massebehafteter Körper in einem Gravitationsfeld beschleunigt. In der Nähe der Erdoberfläche wird das Licht entsprechend eine Beschleunigung von 9.81 m/s2 erfahren. Auf Grund der hohen Lichtgeschwindigkeit ist dieser Effekt jedoch schwer zu beobachten. Die Ablenkung von Licht eines weit entfernten Sterns durch die Sonne konnte im Jahr 1919 nachgewiesen werden. Abbildung 6.7: links: Die stark übertrieben dargestellte Ablenkung von einem Lichtstrahl durch das Gravitationsfeld der Sonne. rechts: Schwarzes Loch. Beispiel: Die allgemeine Relativitätstheorie sagt voraus, dass ein äußerst kompakter Körper das Raum-Zeit-Kontinuum so stark krümmt, dass sich eine Raumregion bildet, aus c °Lehrstuhl E13, TUM, 2008 6.2. ALLGEMEINE RELATIVITÄTSTHEORIE 10 der kein Licht und damit auch keine Materie mehr entkommen kann. Ein solches Objekt wird als schwarzes Loch bezeichnet. 6.2.1 Global Positioning System (GPS) Ein Global Positioning System, (deutsch: Globales Positionsbestimmungssystem) (GPS) dient zur weltweiten Positionsbestimmung und Zeitmessung. Es basiert auf Satelliten, die ständig ihre sich ändernde Position und die genaue Uhrzeit ausstrahlen. Aus deren Signallaufzeit können GPS-Empfänger dann ihre eigene Position und Geschwindigkeit berechnen. Da in der Praxis GPS-Empfänger keine Uhr haben, die genau genug ist, um die Laufzeiten korrekt messen zu können, werden vier statt drei Satelliten benötigt. Die die Genauigkeit des SPS (Standard Positioning Service), der für jedermann verfügbar ist, beträgt ca. 15 m. Eine Erhöhung der Genauigkeit (0.01 - 5 m) kann durch Einsatz von DGPS (DifferentialGPS) erreicht werden. Die Zeit, die die Atomuhren auf den GPS-Satelliten anzeigen, unterliegt den Effekten der relativistischen Zeitdilatation. Dabei hängt nach der allgemeinen Relativitätstheorie die Ganggeschwindigkeit einer Uhr vom Ort im Gravitationsfeld ab und nach der speziellen auch von ihrer Geschwindigkeit. Das höhere Gravitationspotenzial in der Satellitenbahn lässt die Zeit schneller vergehen, die Bahnbewegung der Satelliten relativ zu einem ruhenden Beobachter auf der Erde verzögert sie. In einer Flughöhe von ca. 3000 km heben sich beide Effekte gerade auf. In der GPS-Satellitenbahn überwiegt der gravitative Effekt um mehr als das 6-fache. Auf den Satelliten geht damit die Zeit vor. Abbildung 6.8: 24 Satelliten kreisen ständig in Bahnen mit einen Abstand von ca. 20000 Kilometer um den Mittelpunkt der Erde. Der relative Gangunterschied (∆t/t) zu einer irdischen Uhr liegt zwar bei nur 4.4 · 10−10 , er ist jedoch deutlich größer als die relative Ganggenauigkeit von Cäsium-Rubidium Atomuhren, die besser als 10−14 sind. c °Lehrstuhl E13, TUM, 2008 Kapitel 7 Atomphysik Die Atomphysik beschäftigt sich mit dem Aufbau der Atome aus Atomkern und Elektronenhülle und der Wechselwirkung der Atome und Ionen mit anderen Atomen oder Ionen, mit Festkörpern, mit elektromagnetischer Strahlung, mit elektrischen und magnetischen Feldern. Sie untersucht die Verteilung der Elektronen auf die quantenmechanischen Energieniveaus und beschreibt damit die beobachteten Spektrallinien der Atome, den Aufbau des Periodensystems der Elemente und die Grundlagen für das Verständnis der chemischen Bindung. 7.1 Die Teilchennatur des Lichts Im Rahmen des Welle-Teilchen Dualismus von Licht wird die Ausbreitung von Licht (Beugung, Interferenz) durch die Welleneigenschaften erklärt und der Austausch von Energie zwischen Licht und Materie ist durch Teilcheneigenschaften beschrieben. Bisher haben wir im wesentlichen die Welleneigenschaften betrachtet. Abbildung 7.1: Beleuchteter Doppelspalt, links: Einzelne Lichtteilchen treffen an isolierten Orten auf den Detektor (heller Punkt). rechts: Gemittelt über eine große Anzahl ergibt sich das Beugungsmuster des Doppelspalts. So entsteht bei Beleuchtung eines Doppelspalts das in Kapitel 4.7 besprochene Beugungsmuster. Betrachten wir jedoch einzelne Lichtteilchen, so können diese irgendwo (im 11 7.1. DIE TEILCHENNATUR DES LICHTS 12 Bereich der später in einer quantenmechanischen Beschreibung verständlichen Wahrscheinlichkeitswelle) auf dem Detektor auftreffen. Es ist nicht wirklich vorhersehbar, wo genau das sein wird. Erst eine sehr große Anzahl (Kollektiv) von Lichtteilchen, die den Doppelspalt passiert haben, ergibt das Beugungsmuster bzw. die Helligkeitsverteilung auf dem Detektor. 7.1.1 Äußerer photoelektrischer Effekt Ausgehend von Max Plancks Postulat von der Energiequantisierung konnte Albert Einstein im Jahr 1905 den photoelektrischen Effekt erklären (im Lichtquantenmodell) und erhielt hierfür 1921 den Nobelpreis in Physik. Unter dem äußeren photoelektrischen Effekt, versteht man das Freisetzen von Elektronen aus einer Metalloberfläche, die von elektromagnetischer Strahlung (zum Beispiel Licht oder UV-Strahlung) getroffen wird. Versuch 3350: Photoeffekt: Selenphotoelement Ein Selen-Scheibenphotoelement wird an ein Spannungsmessgerät angeschlossen. Bei verdunkeltem Hörsaal zündet man vor dem Element ein Streichholz an und zeigt den Ausschlag am Spannungsmessgerät. → Die Bestrahlung mit Licht setzt Ladungsträger aus dem Metall frei. Abbildung 7.2: Bei Bestrahlung mit kurzwelligem Licht werden aus der Oberfläche eines Metalls Elektronen herausgelöst. Versuch 3345: Photoeffekt: Zinkplatte und UV-Anteil Eine (frisch abgeschmirgelte) Zinkplatte wird auf das Blättchenelektrometer gesteckt und mit der Influenzmaschine aufgeladen. Bestrahlt man sie nun mit ultraviolettem Licht aus einer Quecksilberdampflampe (Kolben mit Öffnung), dann entlädt sich das Elektrometer nur dann, wenn die Ladung negativ war. Im anderen Fall bleibt der Elektrometerausschlag erhalten. Nach diesem Vorversuch zur Ermittlung der Ladungsart zeigen wir, dass die Entladung durch einen unsichtbaren Strahlungsanteil verursacht wird, den man mit einer Glasscheibe zurückhalten kann. Das Elektrometer nach Bennet wird in optischer Abbildung gezeigt. → Es werden negativ geladene Ladungsträger (Elektronen) freigesetzt. → Es gibt eine Grenzfreuqnz für den Effekt. c °Lehrstuhl E13, TUM, 2008 7.1. DIE TEILCHENNATUR DES LICHTS 13 Insgesamt lässt sich für den photoelektrischen Effekt beobachten: • Die Menge der ausgelösten Elektronen ist proportional zur Bestrahlungsstärke. • Die kinetische Energie der freiwerdenden Elektronen hängt von der Frequenz (und damit von der Farbe) des Lichtes ab, aber nicht von dessen Intensität. • Die Freisetzung der Elektronen beginnt sofort bei Einfall des Lichtes. • Bei einer Erhöhung der Frequenz des einfallenden Lichtes steigt die kinetische Energie der freiwerdenden Elektronen. • Der Effekt tritt erst unterhalb einer bestimmten Wellenlänge λG (bzw. ab einer bestimmten Frequenz fG ) auf. Diese ist materialspezifisch, siehe Fundamentalabsorption. Bis auf die erste Beobachtung stehen alle gefundenen Zusammenhänge im Widerspruch zur klassischen Vorstellung von Licht als Wellenerscheinung. Die Energie einer Welle hängt nämlich allein von deren Amplitude, nicht jedoch von ihrer Frequenz ab. Somit müsste mit steigender Intensität auch die kinetische Energie der Elektronen zunehmen und auch bei niedrigen Intensitäten dürfte der Effekt nur verzögert auftreten, da die Energie der Welle über einen längeren Zeitraum auf das Elektron übertragen werden würde. Der Zusammenhang zwischen Frequenz und kinetischer Energie bzw. dem Auftreten des Effekts überhaupt ist mit der Wellentheorie ebenfalls nicht vereinbar. Versuch 3355: Photoeffekt: Bestimmung von h Man erzeugt mit einer Quecksilberhochdrucklampe (Kolben mit Öffnung) und einem Geradsichtprisma ein gut zugängliches Linienspektrum, dessen Einzelfrequenzen genau bekannt sind. Mit diesen Frequenzen wird nacheinander eine Photozelle (Kalium- Vakuumzelle mit Platin - Anode) bestrahlt und die Bremsspannung gemessen, die den Photostrom gerade zu Null macht. Trägt man diese Spannungen gegen die zugehörigen Frequenzen graphisch auf, so erhält man eine Gerade, deren Steigung dem Planck´schen Wirkungsquantum entspricht. Der Photostrom wird über den Gleichstrom-Messverstärker gemessen. Vor Beginn der Meßreihe muss gelegentlich die Photozelle ausgeheizt werden (2 sec. lang mit 2V / 1A). Während des Versuchs muss man dafür sorgen, dass nur das Licht der fraglichen Linie in die Photozelle gelangt (Vorsicht: Neonröhren der allgemeinen Beleuchtung!). Vor dem Versuch muss die Zelle lichtdicht abgedeckt werden. Ein Vorbereitetes Diagramm auf Klarsichtfolie steht zur Verfügung, in das die Messwerte eingetragen werden können. Folgende Linien des Quecksilbers werden für den Versuch benutzt: Farbe Wellenlänge (nm) Frequenz (1014 / sec.) Gelb Grün Blau Violett UV 577.6 546 435 405 366 5.2 5.5 6.9 7.4 8.2 c °Lehrstuhl E13, TUM, 2008 7.1. DIE TEILCHENNATUR DES LICHTS 14 Wir messen die kinetische Energie Ekin der herausgeschlagenen Elektronen in Abhängigkeit von der Frequenz f des Lichtes. Es ergibt sich die in Abbildung 7.3 gezeigte Kurve (der Teil unter der x-Achse ist extrapoliert), dort werden keine Elektronen herausgeschlagen. Abbildung 7.3: Wie von Einstein in seiner photoelektrischen Gleichung postuliert liegen die Messpunkte der kinetischen Energie der herausgeschlagenen Elektronen in Abhängigkeit von der Frequenz des eingestrahlten Lichts f auf einer Gerade mit der Steigung h. Eine Energiebetrachtung liefert Ekin = ELicht − WA . (7.1) Wie Abbildung 7.3 zeigt, besteht ein linearer Zusammenhang und die Photonenenergie ist ELicht = h f . (7.2) Die Steigung ergibt sich zu h= 6.626·10−34 Js. Diese Konstante wird Plancksches Wirkungsquantum h genannt. Sie ist, unabhängig vom Material, eine universelle Naturkonstante. Da die Austrittsarbeit der Elektronen WA nicht von der Frequenz des Lichtes abhängt, gilt −WA ∼ −1.95 eV. Es gibt eine Grenzfrequenz fG , unter der keine Elektronen herausgeschlagen werden, egal wie stark die Lichtintensität ist: WA . (7.3) h Für Schwermetalle ist also kein Photoeffekt mehr möglich, da die Austrittsarbeit der Elektronen WA zu groß ist. Ekin = 0 → ELicht = WA → fG = Das Photon Einsteinsche Deutung des Photoeffekts: Die Lichtenergie ist gequantelt. Nicht die gesamte Energie des Lichtes spielt für die Emission von Elektronen eine Rolle, sondern nur Lichtpakete der Energiemenge h f , die sogenannten Photonen. Das Photon hat hierbei die Energie ELicht , die von der Wellenlänge λ bzw. der Frequenz f der Lichtwelle abhängen ELicht = h f = c °Lehrstuhl E13, TUM, 2008 hc λ . (7.4) 7.1. DIE TEILCHENNATUR DES LICHTS 15 Hierbei bezeichnen c = 2.998 · 108 m/s die (Vakuum-)Lichtgeschwindigkeit. Der Impuls p eines Photons beträgt damit E hf h p= = = . (7.5) c c λ Die Ruhemasse eines Photons wird zu Null angenommen. Das Photon ist ein Elementarteilchen. 7.1.2 Innerer photoelektrischer Effekt Im Gegensatz zum äußeren photoelektrischer Effekt werden beim innerer photoelektrischer Effekt die Elektronen bei Bestrahlung mit kurzwelligem Licht nicht herausgelöst, sondern in einen energetisch höheren Zustand versetzt. Die Abbildung 7.4 zeigt dies im Energieschema, für den Übergang zwischen dem tieferen Energieniveau E2 und dem höheren Energieniveau E1 , wobei E1 − E2 = h f (7.6) erfüllt ist. Ein Elektron wird von einem tieferen Energiezustand durch die Aufnahme der Energie eines Photons h f auf ein höheres Energieniveau angehoben. Abbildung 7.4: Der Prozess der Photoabsorption ist im Energieschema dargestellt. links: vor der Absorption, Mitte: während der Absorption und rechts: nach der Absortption. Materialien, die einen inneren photoelektrischen Effekt zeigen sind zum Beispiel Halbleiter. Photonen, deren Energie größer ist als die Energielücke Eg im Halbleiter, können ihre Energie an Valenzelektronen abgeben und damit im Halbleiter Elektronen-Loch-Paare erzeugen. Ein Loch (Defektelektron) entsteht dort, wo vor der Photoabsorption das Elektron war. Anwendung: Photovoltaischer Effekt Im photovoltaischen Effekt wird der innere photoelektrische Effekt, der durch Photoabsorption Elektronen-Loch-Paare erzeugt, mit einem (inneren) elektrischen Feld, was diese Elektronen-Loch-Paare trennt, kombiniert. Durch das elektrische Feld werden die Elektronen und die Löcher in entgegengesetzte Richtung bewegt und ein Stromfluss entsteht. Ein Teil der Ladungsträger rekombiniert auf dem Weg durch das Material und geht in Wärme verloren, der übrige Strom (Photostrom) kann direkt von einem Verbraucher benutzt werden. Auf diesem Prinzip basieren die heute benutzen Solarzellen (siehe Abbildung 7.6). Typisch für alle Solarzellentypen ist, dass immer Gleichspannung bzw. Gleichstrom erzeugt wird. c °Lehrstuhl E13, TUM, 2008 7.1. DIE TEILCHENNATUR DES LICHTS 16 Abbildung 7.5: Darstellung des photovoltaischen Effekts für halbleitende Materialien im Energieschema. Solarzellen bestehen aus mehreren dünnen Schichten aus Halbleitermaterialien. Weltweit wird für die Solarzellenherstellung fast immer (zu 98 %) auf Silizium als Basismaterial zurückgegriffen. Eine Anzahl von kristallinen oder Dünnschicht-Solarzellen miteinander zu größeren Einheiten verschaltet und witterungsbeständig verpackt wird Solarmodul genannt. Als Verpackungsmaterial kommen auf der Vorderseite meist Glas, teilweise Kunststofffolien zum Einsatz. Für die Rückseite werden häufig Kunststofffolien, aber auch Gläser verwendet. Die Solarzellen befinden sich dazwischen in einem transparenten Material eingebettet, das gleichzeitig das Modul als Ganzes zusammenhält. Abbildung 7.6: links: Schematische Darstellung des Aufbaus einer Solarzelle unter Sonneneinstrahlung, rechts: Schema eines Solarmoduls. Der Wirkungsgrad für reale Solarmodule liegt zwischen 14 - 17 % für monokristallines Silizium und zwischen 5 - 7 % für amorphes Silizium. Mit größtem technischen und finanziellen Aufwand bei Siliziumzellen im Labor sind Wirkungsgrade knapp über 28 % möglich. Versuch 3357: Modellauto mit Solarzellenantrieb Der Motor eines Modellautos wird über sechs am Heck angebrachte Solarzellen angetrieben, indem man sie mit einer starken Lichtquelle (Fotolampe oder Spot) beleuchtet. Die Geschwindigkeit bleibt jedoch trotz hoher Energiezufuhr relativ klein. Es bewältigt auch nur kleine Steigungen. c °Lehrstuhl E13, TUM, 2008 7.1. DIE TEILCHENNATUR DES LICHTS 17 Grundsätzlich lassen sich zwei photovoltaische Anlagetypen zur Nutzung der Sonnenenergie voneinander unterscheiden: Inselsysteme oder netzunabhängige Systeme und netzgekoppelte oder netzparallele Systeme. Inselsysteme sind unabhängig vom Stromnetz und werden bei Bedarf durch eine andere Stromquelle, z.B. einen Dieselgenerator unterstützt. Bekannt sind die Einsatzmöglichkeiten für Uhren, Taschenrechner oder Parkscheinautomaten. Inselsysteme haben aber auch dort Sinn, wo die nächste Stromquelle sehr weit entfernt ist. In Deutschland werden überwiegend netzgekoppelte Photovoltaik-Anlagen, also mit Anschluss an das Stromnetz, installiert. Überschüssig produzierter Strom wird in das Netz eingespeist, deckt die eigene Produktion den Bedarf nicht, so wird zusätzlich Strom aus dem Netz aufgenommen. 7.1.3 Compton Streuung Die Teilchennatur des Lichts, also die Vorstellung, dass es aus Photonen besteht, spiel auch für die Erklärung des Compton Effekts die zentrale Rolle. Der Compton Effekt beschreibt die Streuung von elektromagnetischer Strahlung, also zum Beispiel Licht, an Elektronen. Im Teilchenbild wird diese Streuung als Stoß behandelt. Der Impuls des Photons mit Frequenz f ist p= E hf = c c und mit folgt p= h . λ f 1 = c λ (7.7) (7.8) Abbildung 7.7: Streuung von elektromagnetischer Strahlung an einem (ruhenden) Elektron. Wie bei der Betrachtung von Stößen in der Mechanik werden Impuls- und Energieerhaltung angewendet. Vor dem Stoß hat das Photon den Impuls p~γ und nach dem Stoß den Impuls p~γ 0 . Das Elektron ruht vor dem Stoß und hat nach dem Stoß den Impuls p~e . Somit gilt nach der Impulserhaltung p~i = p~f (7.9) p~γ = p~γ 0 + p~e c °Lehrstuhl E13, TUM, 2008 (7.10) 7.1. DIE TEILCHENNATUR DES LICHTS also 18 p~e = p~γ − p~γ 0 (7.11) und nach Bildung des Skalarproduktes auf jeder Seite 0 p2e = p2γ + p2γ − 2 pγ p0γ cos(θ) . (7.12) Der Streuwinkel zwischen einfallendem und gestreutem Photon gemäß Abbildung 7.7 ist θ. Weil die kinetisch Energie des Elektrons nach dem Stoß einen merklichen Anteil seiner Ruheenergie ausmachen kann, ist der relativistische Ausdruck für den Zusammenhang zwischen Energie des Elektrons Ee und seinem Impuls pe anzusetzen (siehe Gleichung 6.12): p (7.13) Ee = p2e c2 + (me c2 )2 . Darin ist me = 9.109 ·10−31 kg die Ruhemasse des Elektrons. Aus der Energieerhaltung Ei = Ef folgt also pγ c + me c2 = p0γ c + (7.14) p p2e c2 + (me c2 )2 (7.15) mit der Ruheenergie des Elektrons Ee,0 = me c2 . (7.16) Abbildung 7.8: Versuchsaufbau bei Experiment zur Comptonstreuung mit der 60 keV Linie von Ameritium, links: direkt eingestrahlte Referenzspektrum, rechts: an einem halbkreisförmig gebogenen Aluminiumblech unter 90o reflektierte Strahlung. Versuch 3360: Compton-Effekt mit 60 keV-Photonen (aus Am 241) Das Gammaspektrum von Ameritium 241 enthält eine Linie bei 26.35 keV und eine Linie bei 59.54 keV. Letztere eignet sich besonders gut zur Demonstration des ComptonEffekts. Das Spektrum wird mit einem Impulshöhenanalysator (Vielkanal) aufgenommen. Als Detektor dient ein NaJ-Kristalldetektor. Wir nehmen zunächst das direkt eingestrahlte Referenzspektrum auf und speichern es. Dann reflektieren wir die Strahlung an einem halbkreisförmig - gebogenen Aluminiumblech (Thaleskreis) unter 90◦ in den Detektor. Dieses c °Lehrstuhl E13, TUM, 2008 7.1. DIE TEILCHENNATUR DES LICHTS 19 Spektrum wird mit dem Vielkanal analysiert, wobei man auf dem Bildschirm das bereits gespeicherte Referenzspektrum überlagern kann. Man sieht auf diese Weise unmittelbar, wie das neue Spektrum der gestreuten Strahlung neben den Originallinien herauswächst. Die Abweichung der Linienmaxima lässt sich direkt als Energiedifferenz ablesen, die mit dem theoretischen Wert sehr gut übereinstimmt. Die Wellenlänge der 60 keV Linie beträgt 0.0204 nm, die Comptonverschiebung bei 90o ist 0.0024 nm. Wir erwarten als eine Wellenlängen- oder Energieverschiebung von 12 Prozent. Dieser Wert wird auch im Versuch erreicht. Die Messzeit für das Referenzspektrum beträgt 90 sec, während für die Messzeit des Streuspektrums 300 sec benötigt werden. Relativistisches Elektron Bei einem ruhenden Teilchen sind Masse m0 und Energie E0 äquivalent, das heißt, bis auf einen konstanten Faktor gleich E0 = m0 c2 . (7.17) Die Ruheenergie des Elektrons ist Ee,0 = 511 keV. Ein Elektronenvolt ist die Energie, die ein Teilchen mit der Ladung 1 e (Elementarladung) erhält, wenn es die Spannung von 1 V im Vakuum durchläuft und es dadurch beschleunigt wird und somit kinetische Energie gewinnt. Entsprechend ist Elektronenvolt eine Energieeinheit, die günstig ist für Elementarteilchen und es gilt: 1 eV = 1.602·10−19 J . Die Energie E(v) eines Teilchens der Masse m > 0, das sich mit Geschwindigkeit v < c bewegt, ist eine Funktion der Geschwindigkeit E(v) = 2 qm c 2 1− v2 . (7.18) c Streuung von Photon an Elektron Eliminieren von p2e aus den Gleichung 7.12 und 7.15 ergibt 1 1 1 = [1 − cos(θ)] . − 0 pγ pγ me c (7.19) Einsetzen des Photonenimpulses p = h/λ ergibt schließlich die Änderung der Photonenwellenlänge durch den Stoß mit dem ruhenden Elektron λγ 0 − λγ = h [1 − cos(θ)] . me c (7.20) Durch den Stoß nimmt die Wellenlänge also zu, da die Energie des Photons wegen des Rückstosses des Elektrons abnimmt. Die Zunahme hängt also nicht von der Wellenlänge des einfallenden Photons ab. Die maximale Zunahme der Wellenlänge ist bei einem Stoß unter θ = 90o möglich. Diese maximale Zunahme wird Compton Wellenlänge genannt λCompton = c °Lehrstuhl E13, TUM, 2008 h = 2.43 · 10−12 m . me c (7.21) 7.2. ATOMMODELLE 20 Der Compton-Effekt wird erst bei Photonen merklich, deren Wellenlänge nicht zu groß gegenüber der Compton-Wellenlänge ist, das heißt, wenn die Energie des Photons nicht zu klein gegenüber der Ruheenergie des Elektrons von etwa 511 keV ist. Dies ist bei Röntgenoder Gammastrahlung der Fall. Anwendung: Sicherheitsscanner zur Personenkontrolle Im Bereich der Flugsicherung wurden Scanner-Geräte entwickelt, welche die ComptonRückstreuung (engl. Backscatter) von Röntgenstrahlung an Oberflächen nutzen. Diese werden zur Zeit in den USA getestet. Die schwachen Röntgenstrahlen mit 3 microREM durchdringen zwar die Kleidung, nicht aber das Fleisch. So kann alles, was aus Plastik und Metall unter der Kleidung versteckt worden ist, gesehen werden, einschließlich des nackten Körpers. 7.2 Atommodelle Auf Dalton geht die Atomhypothese (1803) zurück: • Materie besteht aus kleinsten kugelförmigen Teilchen oder Atomen. • Diese Atome sind unteilbar und können weder geschaffen noch zerstört werden. • Alle Atome eines chemischen Elements sind untereinander gleich. Atome unterscheiden sich nur in der Masse von Atomen anderer Elemente. • Diese Atome können chemische Bindungen eingehen und aus diesen auch wieder gelöst werden. • Das Teilchen einer Verbindung wird aus einer bestimmten, stets gleichen Anzahl von Atomen der Elemente gebildet, aus denen die Verbindung besteht. Mit der Annahme von Atomen als feste Kugeln können viele Beobachtungen aus der Thermodynamik erklärt werden. Gegenargument für diese Theorie ist unter anderem das elektrische Aufladen von Materie (Atomen), welches die Teilbarkeit der Atome voraussetzt. Versuch 2000: Reibungselektrizität Ein Braun´sches Elektrometer wird mit einem Plexiglas- bzw. Hartgummistab aufgeladen, den man an Seide bzw. Katzenfell gerieben hat. Die Ladung wird jeweils am Elektrometer abgestreift. Ein Körper, mit einer Gesamtladung Null (von beiden Ladungsarten gleich viel), ist nach außen hin elektrisch neutral. Es gibt also 2 Arten von Ladungen. Wir unterscheiden diese mit dem Vorzeichen (+/−). Dabei bedeutet positiv geladen Elektronenmangel und negativ geladen Elektronenüberschuss. Diese Ladungen sind also stets an Masseteilchen gebunden. c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 7.2.1 21 Thomsonsches Atommodell 1903 von Joseph John Thomson entwickeltes Modell, nach dem das Atom aus gleichmäßig verteilter Masse und positiver Ladung besteht, in denen sich die Elektronen bewegen. Aufgrund der Anordnung der Elektronen in der Masse, vergleichbar mit Rosinen in einem Kuchen, wird es auch Rosinenkuchenmodell genannt. Abbildung 7.9: Veranschaulichung eines Atoms nach dem Thomsonschen Atommodell: Elektronen sind grün und der positive Hintergrund rot gezeigt. Problem: Im Wasserstoffatom befindet sich nur ein Elektron. Wird dieses angeregt, führt es harmonische Schwingungen durch den Mittelpunkt des Atoms aus und sendet dadurch Licht aus. Dies erlaubt im krassen Gegensatz zum Experiment jedoch nur eine Spektrallinie und nicht das beobachtete Linienspektrum mit vielen Spektrallinien. Der Rutherfordsche Streuversuch (1909) zeigte, dass die positive Ladung in einem Atomkern vereinigt ist und widerlegte das Thomsonsche Atommodell. Es wird die Streuung von Helium-4-Atomkernen, Alphateilchen genannt, welche aus zwei Protonen und zwei Neutronen bestehen, untersucht (siehe Abbildung 7.10). Abbildung 7.10: links: Versuchsanordnung zur Streuung von Alphateilchen an dünnen Metallfolien wie zum Beispiel einer Goldfolie, rechts: beobachtete Ablenkung der alpha-Teilchen an den Goldatomen der Goldfolie c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 22 Versuch 3361: Rutherfordstreuung Die Versuchsapparatur von Leybold besteht aus einer zylindrischen Vakuumkammer, in der die Streuung von Alphateilchen (241Am) an dünnen Metallfolien einfach demonstriert werden kann. In der Kammer befindet sich ein integrierter Halbleiterdetektor mit einer Silizium-Fotodiode, in deren Sperrschicht Alphateilchen absorbiert werden. Außerdem ist die Kammer mit einem drehbaren Folienhalter mit Winkelskala ausgestattet. Der Halbleiterdetektor ist über einen Diskriminator-Vorverstärker an einen Digitalzähler angeschlossen. In den Folienhalter werden eine Goldfolie und ein Spalt eingesetzt und die Kammer anschließend lichtdicht abgedeckt. Nach dem Abpumpen der Rutherfordkammer werden die Zählraten für verschiedene Winkel gemessen. Erwartungsgemäß durchdringt der allergrößte Teil der Alphateilchen die Folie ungehindert. Im Thomsonschen Atommodell ist unverständlich, dass wenige Teilchen (ca. 1 von 8.000) beim Durchfliegen der Metallschicht stark abgelenkt und einzelne sogar zurückgestreut werden, als ob sie auf ein massives Zentrum im Inneren der Atome gestoßen wären. Dieses massive Zentrum im Inneren des Atoms bezeichnete Rutherford als Atomkern. 7.2.2 Rutherfordsches Atommodell 1911 von Ernest Rutherford aufgestelltes Modell, nach dem das Atom einen Atomkern enthält, der die positive Ladung und ein Großteil der Masse vereinigt. Der Atomkern ist von Elektronen umgeben, wobei die Gesamtanzahl der Elektronen pro Atom genau der Kernladungszahl entspricht, um die Neutralität der Atome zu berücksichtigen. Über die räumliche Verteilung der Elektronen gibt es keine weiteren Annahamen. Abbildung 7.11: Veranschaulichung eines Atoms nach dem Rutherfordschen Atommodell: Elektronen sind grün und der positive Atomkern rot gezeigt. Problem: Emission und Absorption von Energiequanten kann mit dem Modell von Rutherford nicht erklärt werden. Die experimentell beobachteten Spektrallinien diverser Gase sind in diesem Modell nicht verständlich. Versuch 3335: Gitterspektrum von Quecksilber Das Linienspektrum von Hg wird mit einem Gitterspektrograph in verkürzter Bauweise gezeigt. Wir benutzen Gitter verschiedener Strichzahl, um das Auftreten der zweiten c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 23 Beugungsordnung zu zeigen. Die nullte Ordnung (weiß) muss wegen der hohen Intensität mit einem schwarzen Papierstreifen ausgeblendet werden. 7.2.3 Bohrsches Atommodell In dem 1913 von Niels Bohr aufgestellten Modell besteht das Atom aus einem positiv geladenen Kern und negativ geladenen Elektronen, die diesen auf diskreten konzentrischen Bahnen umkreisen (ähnlich den Planeten eines Sonnensystems). Abbildung 7.12: Veranschaulichung eines Atoms nach dem Bohrsches Atommodell: Beispiel der Elektronenanordnung des Barium Atoms mit 56 Elektronen. Problem: Wird eine Ladung, also das Elektron, auf einer Kreisbahn bewegt, so führt dies zur Abstrahlung von elektromagnetischen Wellen und damit zu einem Energieverlust. Anstelle der Kreisbahn entsteht somit eine Spiralbahn des Elektrons, die auf den Kern gerichtet ist. Die Lebensdauer wäre nur von der Größenordnung 10−14 s. Dies widerspricht der Stabilität der Atome. Um stabile Atome zu beschreiben, in denen Elektronen auf konzentrischen Bahnen um den Kern kreisen, löste sich Bohr mit seinen Postulaten teilweise von der Gültigkeit der klassischen Mechanik. Bohrsche Postulate 1. Bohrsches Postulat: Strahlungslose Umlaufbahnen Das Elektron kann sich strahlungslos nur auf bestimmten, kreisförmigen Umlaufbahnen (bzw. stationären Zuständen) bewegen. 2. Bohrsches Postulat: Photonenfrequenz und Energieerhaltung Der Radius der Elektronenbahn ändert sich nicht kontinuierlich, sondern sprunghaft. Bei diesem Quantensprung wird elektromagnetische Strahlung abgegeben (oder aufgenommen). Wenn E1 die Energie des Ausgangszustands und E2 die Energie des Zielzustands ist, dann wird ein Lichtquant emittiert mit der Frequenz f= c °Lehrstuhl E13, TUM, 2008 E1 − E2 h (7.22) 7.2. ATOMMODELLE 24 der ausgesandten Strahlung. 3. Bohrsches Postulat: Quantisierter Drehimpuls Elektronenbahnen sind nur stabil, wenn der Bahndrehimpuls L des Elektrons ein ganzzahliges Vielfaches des reduzierten planckschen Wirkungsquantums ~ = h/(2π)= 1.055·10−34 Js ist L = mvr = n~ . (7.23) Energie einer kreisförmigen Umlaufbahn Wir betrachten ein Elektron mit der Ladung q1 = −e, das auf einer Kreisbahn mit dem Radius r eine positive Ladung q2 = +Ze umrundet. Die Ausdehnung des Kerns sei vernachlässigt. Abbildung 7.13: Bohrsches Modell für eine kreisförmige Umlaufbahn des Elektrons um einen Atomkern. Die potentielle Energie ist dann Epot = 1 q1 q2 1 Z e2 =− . 4 π ε0 r 4 π ε0 r (7.24) Hierbei ist die Influenzkonstante ε0 = 8.85 × 10−12 C2 /(Nm2 ). Die elektrische Anziehungskraft (Coulomb Gesetz) ist die Zentripetalkraft, die das Elektron auf seiner Umlaufbahn hält, mit m v2 1 Z e2 FZ = − = FC = − . (7.25) r 4 π ε0 r 2 Entsprechend ist die kinetische Energie Ekin = m v2 1 Z e2 = 2 4 π ε0 2 r (7.26) und folglich der Betrag der potentiellen Energie doppelt so groß wie die kinetische Energie Epot = −2 Ekin . (7.27) Die Gesamtenergie ist also Eges = Epot + Ekin = − c °Lehrstuhl E13, TUM, 2008 1 Z e2 . 4 π ε0 2 r (7.28) 7.2. ATOMMODELLE 25 Zur Berechnung des Radius der Elektronenumlaufbahn gehen wir vom dritten Bohrschen Postulat L = m v r = n ~ aus und setzten v= n~ mr (7.29) in das Kräftegleichgewicht (Gleichung 7.25) ein: n 2 ~2 1 Z e2 1 Z e2 → . mv = = 4 π ε0 r m r2 4 π ε0 r 2 (7.30) Es folgt die Bedingung für den Radius r = n2 4 π ε0 ~2 m Z e2 (7.31) und mit dem Bohrschen Radius a0 = 4 π ε 0 ~2 ∼ 0.0529nm m e2 (7.32) schliesslich r= n2 a0 Z . (7.33) Der Bohrschen Radius ist also der Radius des Wasserstoffatoms (Z = 1) im sogenannten tiefsten Zustand. Energieniveaus im Bohrschen Atommodell Setzten wir die Bedingung für den Radius (Gleichung 7.31) in die Gesamtenergie einer kreisförmigen Umlaufbahn ein (Gleichung 7.28), so folgt En = − 1 m Z 2 e4 (4 π ε0 )2 2 n2 ~2 oder En = −Z 2 R n2 (7.34) (7.35) mit der Rydbergkonstante R= m e4 1 1 e2 1 = ∼ 13.6eV (4 π ε0 )2 2 ~2 2 4 π ε 0 a0 (7.36) Gemäß dem zweiten Bohrschen Postulat gilt somit für den Übergang zwischen zwei dieser Energieniveaus ¸ · E1 − E2 Z 2R 1 1 f12 = = − . (7.37) h h n22 n21 c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 26 Das Wasserstoffatom im Bohrschen Atommodell Ein Elektron umkreist einen einfach positiv geladenen Kern mit Z = 1. Die gesamte Energie des Elektrons im Wasserstoffatom hängt also gemäß Gleichung 7.35 vom Radius seiner kreisförmigen Umlaufbahn ab. Die Werte sind quantisiert, da es nur diskrete Umlaufbahnen mit n = 1, 2, 3, ... gibt, und es gilt En = − R . n2 (7.38) Abbildung 7.14: links: Bohrsches Modell für Wasserstoffatom, rechts: entsprechende Energieniveaus im sogenannten Termschema. Im Grundzustand, dem tiefsten energetischen Zustand, des Wasserstoffatoms ist n = 1 und damit E1 = −R = −13.6eV . (7.39) Durch die 1/n2 -Abhängigkeit liegen angeregte Zustände immer dichter (siehe Abbildung 7.14). Für den Grenzfall n → ∞ geht die Energie gegen null. Wird ein Elektron aus dem Atom entfern, so spricht man von Ionisierung. Die dazu aufzubringende Energie ist die Ionisationsenergie. Vom Grundzustand aus gerecht hat das Wasserstoffatom die Ionisationsenergie von 13.6 eV. Dies ist sozusagen die Bindungsenergie des Elektrons im Wasserstoffatom. Versuch 3396: Wasserstoffspektrum Über eine Hochspannung von 6 kV betreiben wir eine H2 gefüllte Geisslerröhre. Durch Ionisation entsteht in der Röhre ein Gasgemisch aus H, H+ und H+ 2 . Das entsprechende Spektrum wird über einen Prismenspektrographen dargestellt. c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 27 Abbildung 7.15: Linienspektrum des Wasserstoffatoms mit Zuordnung zu den entsprechenden Serien auf Wellenlängenskala. Weil die Energien quantisiert sind, kann die Frequenz der Strahlung, die ein Wasserstoffatom emittiert oder absorbiert, nur bestimmt Werte haben. Es entsteht ein Linienspektrum und die möglichen Übergänge zwischen zwei Energiezuständen En und Em erfüllen · ¸ En − Em R 1 1 fnm = = − . (7.40) h h m2 n2 Abbildung 7.16: Die Energieniveaus des Wasserstoffatoms. Die senkrechten Pfeile deuten einige Übergänge der entsprechenden Serien zum Linienspektrum an. Die Anregung eines Atoms geschieht zum Beispiel durch Absorption von Photonen oder durch Stöße mit Elektronen. c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 28 Die entsprechenden Serien sind • Lyman-Serie n = 1, m = 2, 3, 4, ... • Balmer-Serie n = 2, m = 3, 4, 5, ... • Paschen-Serie n = 3, m = 4, 5, 6, ... • Brackett-Serie n = 4, m = 5, 6, 7, ... • Pfund-Serie n = 5, m = 6, 7, 8, ... Das einfach ionisierte Heliumatom Betrachten wir ein einfach ionisiertes Heliumatom im Rahmen des Bohrschen Atommodells. Durch die einfache Ionisation ist eines der beiden Elektronen vom Heliumatom entfernt und es entspricht somit dem Wasserstoffatom, jedoch mit Z = 2. Im Linienspektrum sollte folglich jedes zweite Niveau von He+ mit dem von Wasserstoff zusammenfallen (siehe Abbildung 7.17). Tatsächlich werden aber geringe Abweichungen gemessen. Abbildung 7.17: links: Schema für den erwarteten Zusammenfall von Linien im einfachen Bohrschen Atommodell für den Vergleich von H und He+ . rechts: Bohrsches Modell für ionisiertes Heliumatom mit Korrektur im Zweikörperproblem. Ursache ist, dass nicht nur die Elektronen eine Bewegung auf einer Kreisbahn ausführen, sondern zudem auch der Atomkern eine (kleine) kreisförmige Bewegung erfährt. Beide, Elektron und Atomkern, bewegen sich um ihren gemeinsamen Massenmittelpunkt. Dies entspricht dem klassischen Zweikörperproblem. Wir führen eine sogenannte reduzierte Masse µ= mM m+M (7.41) ein, wobei m die Masse des Elektrons und M die Masse des Atomkerns ist. In der gesamten Betrachtung ist nun m gegen µ zu ersetzten und es folgt eine Korrektur an die Rydbergkonstante R . (7.42) Rµ = m 1+ M c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 29 Für schwere Kerne M → ∞ folgt Rµ → R. Diese leichte Massenabhängigkeit hat zur Folge, dass die Spektrallinien von H und He+ nicht zusammenfallen können. 7.2.4 Anregung eines Atoms durch Stöße Die Methode des Franck-Hertz-Versuchs, die Anregung des Atoms auf ein höheres Energieniveau statt mit Licht durch einen unelastischen Stoß mit Elektronen zu realisieren, ermöglichte eine eindrucksvolle Bestätigung des Bohrschen Atommodells. Wir schreiben dies als A + e → A∗ + e0 . (7.43) Versuch 3410: Frack-Hertz Versuch Kernstück der Apparatur ist eine quecksilbergefüllte Triode, die zur Einstellung des Quecksilber-Dampfdrucks in einem regulierbaren Heizofen steckt (Thermostatschalter auf 6 bis 7 stellen; 180 o C - 200 o C). Ein Betriebsgerät erzeugt die nötigen regelbaren Spannungen. Der Anodenstrom wird in Abhängigkeit von der Beschleunigungsspannung, zwischen Glühkathode und Gitter gemessen. Er zeigt charakteristische Maxima und Minima im Abstand von jeweils 4.9 Volt. Das Betriebsgerät liefert eine mit 50 Hz oszillierende Beschleunigungsspannung, deren Maximalwert einstellbar ist. Man legt sie an den x-Eingang eines Oszillographen, während am y-Eingang die Spannung liegt, die der Anodenstrom an einem Arbeitswiderstand erzeugt. Man erhält auf diese Weise direkt die typische FranckHertz-Kurve, ohne sie punktweise ausmessen zu müssen. Das Oszillographenbild wird über die Fernsehanlage gezeigt. Elektronen werden von der Kathode zum Gitter beschleunigt, nehmen kinetische Energie auf und müssen dann gegen eine Spannung anlaufen, um zur Anode zu gelangen. Wenn die Energie ausreicht, tragen sie zu einem Strom I bei. Wenn die Energie ausreicht, um ein Hg-Atom anzuregen (4.9 eV), verlieren die Elektronen ihre kinetische Energie. Abbildung 7.18: links: Schema für den Aufbau des Franck-Hertz-Versuch, rechts: StromSpannungs-Charakteristik. Der durch den Stoß angeregte Zustand des Atoms ist instabil und es fällt unter Emission eines Lichtquants kurze Zeit später zurück in den Grundzustand. Das von den Quecksilberatomen emittierte Licht (der Energie 4.9 eV) ist mit einer Wellenlänge von 253 nm c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 30 allerdings im ultravioletten Bereich und damit nicht sichtbar. Mit steigender Spannung: • Zunächst gelangen immer mehr Elektronen zur Anode • Bei U=4.9 V verlieren Elektronen ihre Energie in Gitternähe durch inelastischen Stoß und gelangen nicht zur Anode • Vorgang wiederholt sich, bis 2 Stöße möglich werden, einer auf halbem Weg, der andere in Gitternähe, usw. 7.2.5 Sommerfeldsches Atommodell Das 1916 von Arnold Sommerfeld vorgeschlagene Atommodell stellt eine Verfeinerung des Bohrschen Atommodells dar. Es wird angenommen, dass sich die Elektronen um den Atomkern auf Bahnen bewegen, die sich aus den Bewegungsgleichungen der klassischen Mechanik ergeben. Quantentheoretische Prinzipien werden durch zusätzliche Quantisierungsbedingungen (Bohr-Sommerfeld-Quantisierung) eingeführt. Diese Quantisierungsbedingungen führen dazu, dass nur eine kleine Teilmenge der Bahnen, die nach der klassischen Mechanik möglich wären, erlaubt sind. Als Folge davon können auch die mit der Bahnbewegung verbundenen Erhaltungsgrößen (Energie, Drehimpuls) nicht mehr beliebige, sondern nur noch bestimmte, diskrete Werte annehmen. Diese sind also gequantelt. Während im Modell von Bohr die möglichen Bahnen des Elektrons Kreise um den Atomkern sind, führt Sommerfeld allgemeinere Ellipsenbahnen ein, der Kreis kommt noch als Spezialfall der Ellipse vor. Der Kern befindet sich nach diesem Modell in einem der Brennpunkte einer Bahnellipse, so dass sich eine geometrische Konfiguration wie bei den Planetenbahnen nach den Keplerschen Gesetzen ergibt. Eine Ellipse kann nicht mehr wie ein Kreis durch einen Parameter (Radius) beschrieben werden, sondern dazu benötigt man zwei (z. B. große und kleine Halbachse). Deshalb sind bei Ellipsenbahnen auch zwei Quantenzahlen notwendig, um den Bahnparameter und damit den Zustand des Atoms zu beschreiben: • Die Hauptquantenzahl n wird aus dem Bohrschen Modell übernommen, ist aber nicht mehr mit einem bestimmten Drehimpuls verbunden, sondern gibt nur noch das Energieniveau an. • Die Neben- oder (Bahn-)Drehimpulsquantenzahl l hat einen Wertebereich, der von der Hauptquantenzahl n abhängt, in dem sich das Atom befindet. l kann als Werte natürliche Zahlen von 0 bis n − 1 annehmen. Diese beiden Quantenzahlen reichen, um eine Ellipse in der Ebene zu beschreiben. Um die Lage der Ellipsenebene im dreidimensionalen Raum zu kennzeichnen, wird noch eine dritte Quantenzahl benötigt: • Die magnetische Quantenzahl m hat einen Wertebereich, der von der Nebenquantenzahl l abhängt. m kann die Werte −l, ..., −1, 0, 1, ..., +l annehmen. c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 31 Nebenquantenzahl In der geometrischen Betrachtung wird jede erlaubte Kreisbahn im Bohrschen Modell, welche durch die Hauptquantenzahl n charakterisiert ist, durch ein System von Ellipsen ersetzt. Die Zahl der Ellipsen pro Hauptquantenzahl ist gleich n. Jede Ellipse entspricht genau einem Drehimpuls. Für den Betrag des Bahndrehimpulses L im Sommerfeldschen Atommodell gilt L = (l + 1) ~ . (7.44) Mit der Drehimpulsquantenzahl l werden die Ellipsen des Systems so durchnummeriert, dass l = 0 die am meisten gestreckte Ellipse (größte numerische Exzentrizität) und l = n−1 ein Kreis, welcher der bohrschen Bahn entspricht, ist. Die große Halbachse einer Ellipse ist gleich dem Radius der Kreisbahn im Bohr-Modell (siehe Abbildung 7.19). Abbildung 7.19: Elektronenbahnen für Wasserstoff im Sommerfeldsches Atommodell für n = 1, 2, 3. Die Skalenwerte sind in Ångström angegeben. Magnetische Quantenzahl ~ st , Das sich um den Atomkern bewegende Elektron erzeugt ein statisches Magnetfeld B dessen Richtung (Feldvektor) senkrecht auf der Bahnellipse steht und parallel zum Bahn~ verläuft. Bringt man das Atom in ein äußeres Magnetfeld B ~ ext , dann drehimpulsvektor L richtet sich die Bahn des Elektrons so aus, dass sein Feldvektor bzw. Bahndrehimpulsvektor ~ B ~ ext ) einschließen, mit dem des äußeren Feldes nur bestimmte diskrete Winkel φm ≡ ∠(L, die durch die magnetische Quantenzahl beschrieben sind. Für einen vorgegebenen Bahn~ gilt drehimpuls L L cos φm = m ~ (7.45) und mit Gleichung 7.44 eingesetzt folgt für die möglichen eingeschlossenen Winkel bei vorgegebener Nebenquantenzahl l: cos φm = m . l+1 (7.46) Da sich m im Wertebereich von −l, ..., 0, ...l bewegt, ist der Kosinus immer kleiner 1 bzw. bleibt der Betrag des eingeschlossenen Winkels kleiner als ein rechter Winkel. c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 32 Abbildung 7.20: links: Skizze zum Drehimpuls bei einem um den Atomkern bewegten Elektron. rechts: Magnetische Quantenzahlen für die Nebenquantenzahl l = 1 und die zugehörige Bewegung eines Elektrons im externen Magnetfeld. Die Wechselwirkung des Magnetfeldes mit dem magnetischen Moment des Atoms, die vom Bahndrehimpuls des Elektrons erzeugt wird, ist nur im Sommerfeldschen Atommodell zu erklären. Als Zeeman-Effekt bezeichnet man das mehrfache Aufspalten von Spektrallinien, wenn sich die emittierende Materie in einem schwachen externen Magnetfeld befindet. Versuch 3406: Zeeman - Effekt Eine Cadmium-Lampe steht im Zentrum eines starken Magneten mit durchbohrten Polschuhen. Der Magnet wird durch ein Heinzinger Netzgerät mit 20 V, max. 4 A versorgt. Über eine Sammellinse (fest eingebaut), und einen roten Farbfilter wird ein Fabry-PerotEtalon beleuchtet. Mit der Fernsehkamera (Entfernung unendlich) mit Teleobjektiv lassen sich sehr lichtstarke Interferenzringe beobachten. Beobachtet man durch die Polschuhbohrung, longitudinal zum Feld des Magneten, die Cadmiumlampe so sieht man im Etalon konzentrische Kreise. Beim Zuschalten des Feldes spalten sich diese Ringe in je zwei neue Ringe (symmetrisch zur Lage des Ringes ohne Feld) auf. Bei der Messung transversal zum Magnetfeld erfolgt nach angelegtem Magnetfeld eine Aufspaltung in drei Ringe. Mit einem zwischengeschaltetem Polfilter kann man, je nach Stellung des Filters entweder den Mittelring oder die beiden Außenringe ausblenden. Da zu einem festen Wert der Hauptquantenzahl n verschiedene Werte der Nebenquantenzahl l und der magnetischen Quantenzahl m gehören, ist die Energie entartet. Das Einschalten des äußeren Magnetfelds hebt diese Entartung auf und die Energieniveaus spalten auf (siehe Abbildung 7.21). Die potentielle Energie in einem Magnetfeld ist ~ Epot = −µ~l · B (7.47) mit dem magnetischen Moment des umlaufenden Elektrons µ~l = − c °Lehrstuhl E13, TUM, 2008 e ~ L . 2 me (7.48) 7.2. ATOMMODELLE 33 l=2 µB B0 e− (2) (3) (1) B0 (2) (3) B0 = 0 ml +2 +1 0 −1 −2 B0 , 0 Abbildung 7.21: links: Klassische Erklärung der Aufspaltung. rechts: Zeeman-Effekt ohne SpinBerücksichtigung beim l = 2-Energieniveau. Es folgt Epot = e ~ ~ L·B 2me (7.49) ~ orientiert ist, ist wegen und unter der Annahme, das das äußere Magnetfeld parallel zu L der Quantisierung des Drehimpulses (Lz = m~) die Zeemanaufspaltung Epot = e~ m B = m µB B , 2me (7.50) wobei m die magnetische Quantenzahl und µB das Bohrsche Magneton ist. Diese Energiedifferenz hebt die (2l + 1)-fache Entartung der Energieeigenwerte En im Magnetfeld auf. Die Energieniveaus innerhalb des Atoms erfüllen nun also mit Gleichung 7.35 En = −Z 2 R + m µB B n2 . (7.51) Dies ist in Abbildung 7.21 für das l = 2-Energieniveau veranschaulicht. Abbildung 7.22: Elektronenübergänge unter Lichtemission im Cadmium-Atom führen zur Zeemanaufspaltung. Die möglichen Übergänge werden durch eine Auswahlregel bestimmt. Insgesamt sind nicht alle möglichen Übergänge erlaubt. Eine Auswahlregel ∆m = −1, 0, 1 beschreibt die möglichen Übergänge. c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 7.2.6 34 Orbitalmodell Das Atom besteht aus einem Kern, der von Orbitalen umgeben ist. Die Form der Orbitale ist durch die räumliche Aufenthaltswahrscheinlichkeit der Elektronen gegeben. Im strengen Sinn ist ein Orbital eine Lösung der Schrödingergleichung. Orbitale werden anhand der vier Quantenzahlen n, l, m und s klassifiziert: • Hauptquantenzahl n = 1, 2, 3, ... • Neben- oder (Bahn-)Drehimpulsquantenzahl l = 0, 1, 2, ...n − 1 • Magnetquantenzahl m = 0, ±1, ±2, ... ± l • Spinquantenzahl s = ±1/2 Die Orbitale zu den verschiedenen Zahlen l haben charakteristische (grobe) Formen, die auch bei höheren n-Werten qualitativ erhalten bleiben. Form der Orbitale Tabelle 7.1: Zuordnung der Orbitale Name s-Orbital p-Orbital d-Orbital f-Orbital ausgeschrieben sharp principal diffuse fundamental Wert von l 0 1 2 3 Aussehen radialsymmetrisch hantelförmig in den drei Raumachsen gekreuzte Doppelhantel rosettenförmig Abbildung 7.23: Grafische Veranschaulichung der s-, p- und d-Orbitale, wobei die verschiedenen Vorzeichen der Wellenfunktion durch hell und dunkel dargestellt sind. Die höheren s-Orbitale besitzen Knotenebenen, insgesamt sind sie kugelförmig und die Aufenthaltswahrscheinlichkeit verschiebt sich weiter vom Kern weg. c °Lehrstuhl E13, TUM, 2008 7.2. ATOMMODELLE 35 Abbildung 7.24: Grafische Veranschaulichung der s-Orbitale, für die Hauptquantenzahlen n =1,2 und 3. Quantisierungsbedingungen 1) Die Hauptquantenzahl n beschreibt das Hauptenergieniveau, welches ein Elektron besitzt. Sie beschreibt einen Bereich, in dem die Aufenthaltswahrscheinlichkeit eines Elektrons sehr hoch ist. Je größer n wird, desto weiter entfernt vom Atomkern bewegt sich das Elektron und so geringer ist seine Bindungsenergie. Die maximale Anzahl der Elektronen in einer Schale ergibt sich als 2n2 . Es gilt En = −Z 2 R n2 . (7.52) 2) Die Nebenquantenzahl (Bahndrehimpulsquantenzahl) l beschreibt den Bahndrehimpuls des Elektrons p |L| = ~ l(l + 1) . (7.53) und damit die Form des Orbitals. 3) Die Magnetquantenzahl m beschreibt die räumliche Ausrichtung, die das Orbital bezüglich eines äußeren Magnetfeldes einnimmt. Die resultierenden Orbitale sind energetisch gleich, nur wenn von außen ein Magnetfeld angelegt wird, lassen sie sich unterscheiden. Für die Projektion des Drehimpulsvektors auf die Richtung des Magnetfeldes gilt Lz = ~ m . (7.54) 4) Die Spinquantenzahl s gibt die Rotationsrichtung (rechts herum oder links herum) also den Spin an. Sie wird mit den Werten +1/2 oder −1/2 beziehungsweise den Symbolen ↑ oder ↓ angegeben. Auswahlregeln Elektronische Übergänge der Elektronen in den Orbitalen geschehen vornehmlich durch elektrische Dipolstrahlung. Für Einelektronenübergänge gelten folgende Auswahlregeln: ∆l = ±1 , ∆m = 0, ±1 , ∆s = 0 c °Lehrstuhl E13, TUM, 2008 . (7.55) 7.3. QUANTENTHEORIE DER ATOME 7.3 36 Quantentheorie der Atome Die räumliche und zeitliche Entwicklung des Zustands eines Quantensystems wird durch die Schrödingergleichung beschrieben. Ihre Lösungen werden Wellenfunktionen genannt. Die Wellenfunktion beschreibt den quantenmechanischen Zustand im Ortsraum und bestimmt eine Aufenthaltswahrscheinlichkeit. Im Unterschied zur Klassischen Physik ist eine exakte Aussage über den Aufenthaltsort ~r eines Teilchens im Allgemeinen nicht möglich (Heisenbergsche Unschärferelation). 7.3.1 Heisenbergsche Unschärferelation Zwei Messgrößen eines Teilchens sind nicht immer gleichzeitig beliebig genau bestimmbar. Das bekannteste Beispiel für ein Paar solcher Messgrößen sind Ort x und Impuls p und es gilt ∆x∆p & h . (7.56) Mit dem Impuls h h 2π = = ~k λ 2π λ (7.57) ∆x∆k & 2π (7.58) ∆ω∆t & 2π (7.59) E = ~ω = hf (7.60) ∆E∆t & h (7.61) p= folgt und nach Fouriertransformation was sich mit der Energie zu umformen läßt. Abbildung 7.25: Materiewelle als Wellenpaket Die Abbildung 7.25 zeigt eine Materiewelle als Wellenpaket. Der Mittelpunkt des Wellenpakets befindet sich zur Zeit t = 0 bei x = 0. Die Größe ∆x ist die Paketbreite auf c °Lehrstuhl E13, TUM, 2008 7.3. QUANTENTHEORIE DER ATOME 37 halber Höhe der maximalen Elongation bei x = 0 und stellt ein Maß für die Unschärfe des Ortes des Teilchens dar. Die Wellenlänge λ errechnet sich nach der de Broglie-Gleichung λ= 7.3.2 h . p (7.62) Wellenfunktion Ausgehend von der Existenz des Quantenteilchens muss es sich (zu jeder Zeit) irgendwo aufhalten, weshalb dessen Wellenfunktion ψ die Normierungsbedingung Z (7.63) ψψ ∗ dV = 1 Raum erfüllen muss. Dies führt zur Wahrscheinlichkeit dP , das Teilchen am Ort ~r = (x, y, z) im Volumenelement dV = dx dy dz anzutreffen dP (x, y, z) = ψψ ∗ dV . (7.64) Als Orbital bezeichnen wir den Aufenthaltsraum, in dem sich das betrachtete Elektron eines Atoms mit ca. 90 % Wahrscheinlichkeit aufhält. Abbildung 7.26: Aufenthaltswahrscheinlichkeiten für 1s, 2s und 2pz Orbitale. 7.3.3 Schrödingergleichung Die Schrödingergleichung beschreibt allgemein die zeitliche Veränderung eines quantenmechanischen Zustands. Sie zeichnet den Hamiltonoperator H als denjenigen aus, der die Dynamik des Systems bestimmt. Allgemein ist Hψ = Eψ . (7.65) Betrachten wir zunächst nur eine Dimension (nur Bewegung entlang der x-Achse) und die zeitunabhängige Form, so ist der Hamiltonoperator H=− c °Lehrstuhl E13, TUM, 2008 ~2 d2 + V (x) . 2m dx2 (7.66) 7.3. QUANTENTHEORIE DER ATOME 38 Für ein freies Teilchen ist das Potential V (x) = 0 und es folgt ~2 d2 − ψ(x) = E ψ(x) . 2m dx2 Mit E = Ekin = (7.67) p2 h2 ~2 k 2 m v2 = = = 2 2m 2mλ2 2m (7.68) ergibt sich die Bewegungsgleichung k 2 ψ(x) + d2 ψ(x) = 0 . dx2 (7.69) Die allgemeine Lösung ist ψ(x) = A exp(i k x) + B exp(−i k x) (7.70) mit den Koeffizienten A und B. Für einen harmonischen Oszillator ist zum Beispiel das Potential gegeben durch V (x) = k x2 . 2 (7.71) Verallgemeinerungen a) Verallgemeinern wir von der zeitunabhängigen zu zeitabhängigen Schrödingergleichung, so wird aus Gleichung 7.65 µ ¶ ~2 ∂ 2 ∂ − + V (x, t) ψ(x, t) = i ~ ψ(x, t) . 2 2m ∂x ∂t (7.72) Mit ψ(x) als Lösung der zeitunabhängigen Schrödingergleichung folgt als allgemeine Lösung µ Et ψ(x, t) = ψ(x) exp(−i ω t) = ψ(x) exp −i ~ ¶ . (7.73) Entsprechend ergibt sich für das freie Teilchen ψ(x, t) = A exp(i [k x − ω t]) + B exp(−i [k x + ω t]) (7.74) was je nach Koeffizienten A und B einer nach rechts oder links laufenden Welle entspricht. b) Verallgemeinert auf drei Dimensionen folgt schließlich aus Gleichung 7.65 ¶ µ ∂ ~2 ∆ + V (~r, t) ψ(~r, t) = i~ ψ(~r, t) . − 2m ∂t c °Lehrstuhl E13, TUM, 2008 (7.75) 7.3. QUANTENTHEORIE DER ATOME 7.3.4 39 Wellenmechanik des Wasserstoffatoms Im Wasserstoffatom wirkt das Potential einer Zentralkraft (siehe Gleichung 7.24) 1 Z e2 . 4 π ε0 r Eingesetzt in Gleichung 7.65 ergibt sich die zugehörige Schrödingergleichung µ ¶ ~2 2 1 Z e2 − ∇ − ψ(r) = E ψ(r) . 2m 4 π ε0 r V (r) = − (7.76) (7.77) Um der Kugelsymmetrie des Problems gerecht zu werden, gehen wir von den karthesischen Koordinaten in Kugelkoordinaten über, was einen Separationsansatz ψ(r, Θ, φ) = R(r) Y (Θ, φ) (7.78) erlaubt. Dies führt nach einer längeren Rechnung zu Gleichungen, die die Energie, den Bahndrehimpuls und die Orientierung des Bahndrehimpulses beschreiben und die entsprechenden Quantisierungsbedingungen darstellen: 1) Energie (Hauptquantenzahl n): H ψn l m = − R ψn l m n2 (7.79) 2) Bahndrehimpuls (Nebenquantenzahl l): L2 ψn l m = l(l + 1) ~2 ψn l m (7.80) 3) Orientierung des Bahndrehimpuls (magnetische Quantenzahl m): Lz ψn l m = m ~ ψn l m (7.81) In dieser Beschreibung ist also der Spin des Elektrons noch nicht enthalten. Entsprechend wird ψn l m nur durch die drei Quantenzahlen n, l und m beschrieben. 7.3.5 Spin-Bahn Wechselwirkung Die Eigenschaften des Elektrons sind beschrieben durch • Spinquantenzahl s = 1/2 • innerer Drehimpuls (Spin) S = p s(s + 1) ~ • magnetische Spinquantenzahl ms = ±1/2 Das magnetische Moment des Elektrons ist ~ e ~ S S = −gs µB (7.82) 2me ~ mit dem so genannten G-Faktor gs = 2.0024 und dem Bohrschen Magneton (Magneton e~ des Elektrons) µB = 2m = 9.274 · 10−24 J/T. e Um den Spin des Elektron zu berücksichtigen, wird also die Wellenfunktion des Elektrons im H-Atom um den Spinanteil χms ergänzt, die nur 2 Werte annimmt ~µs = −gs ψn l m ms = Rn l Ylm χms . c °Lehrstuhl E13, TUM, 2008 (7.83) 7.3. QUANTENTHEORIE DER ATOME 40 Abbildung 7.27: Der Spin kann als Rotation des Elektrons um die eigene Achse aufgefasst werden (links), wobei das Elektron allerdings punktförmig ist! Im Magnetfeld kann sich der Spin in zwei Positionen ausrichten (rechts). Dann bewirkt das Drehmoment eine Präzessionsbewegung. Stern-Gerlach Experiment Ein Strahl aus wasserstoffähnlichen Atomen spaltet in einem Magnetfeldgradienten in zwei nach der magnetischen Spinquantenzahl getrennte Strahlen auf. Abbildung 7.28: Ein Magnetfeldgradient bewirkt die Aufspaltung eines Atomstrahls in zwei nach der magnetischen Spinquantenzahl getrennte Strahlen auf. Diese Aufspaltung resultiert aus der Kraft Fz , die auf das magnetische Moment wirkt Fz = −µz dB e ms ~ dB = gs . dz me dz (7.84) Dies führt zur Ablenkung des Strahls in Abhängigkeit von der magnetischen Spinquantenzahl ms . Im Magnetfeld erzeugt das magnetische Momente ein Drehmoment, das wie beim Kreisel zu einer Präzessionsbewegung mit der Larmor-Frequenz ωL führt. Analog zur Mechanik eines Kreisels ist ~ pB µs B 2gs p~ × B = = = B . (7.85) ωL = Lz L S ~ c °Lehrstuhl E13, TUM, 2008 7.3. QUANTENTHEORIE DER ATOME 41 LS-Kopplung Der Gesamtdrehimpuls des Elektrons setzt sich aus einem Spin- und einem Bahnanteil vektoriell zusammen. Es gilt ~ +S ~ . J~ = L (7.86) Damit gelten für den Gesamtdrehimpuls des Elektrons die quantenmechanischen Eigenschaften: p J = j(j + 1) ~ (7.87) und Jz = m J ~ (7.88) mit −j ≤ mJ ≤ j. Beim H-Atom kann die Gesamtspinquantenzahl j je nach Kopplung zwei Werte annehmen: • parallel: j = l + 1/2 • antiparallel: j = l − 1/2 Die Zustände sind 2j+1-fach entartet. Abbildung 7.29: Beispiel der LS-Kopplung für l = 1. mit s = 1/2 ergibt sich bei paralleler Ausrichtung der Spins j = 3/2 (links) und bei antiparalleler Ausrichtung j = 1/2 (rechts). Es können nur gleichzeitig scharf gemessen werden: • Bahndrehimpuls L2 = l(l + 1)~2 • Gesamtdrehimpuls J 2 = j(j + 1)~2 • Projektion des Gesamtdrehimpulses Jz = mJ ~ Nicht scharf messbar sind die • Projektion des Bahndrehimpulses ml • Projektion des Spins ms Für Übergänge muss gelten: ∆l = ±1, ∆j = 0, ±1, ∆mj = 0, ±1. ∆j = 0 (Spinflip) ist unwahrscheinlicher. c °Lehrstuhl E13, TUM, 2008 7.3. QUANTENTHEORIE DER ATOME 42 Abbildung 7.30: Die Präzession des Gesamtspins durch LS-Kopplung (links) und die aus der Projektion des Gesamtdrehimpulses J folgende Messgröße mJ (rechts). Elektronenspinresonanz (ESR) Für eine Probe mit permanentem magnetischem Moment spalten sich die entarteten Energiezustände in ein Magnetfeld auf. Diese Aufspaltung ist in erster Näherung proportional zum angelegten Magnetfeld B und EZee = gS µB mJ B (7.89) mJ ist dabei die magnetische Quantenzahl. Jedes magnetische Energieniveau besitzt deshalb den Abstand ∆E = gS µB B vom nächsten benachbarten Zustand (äquidistante Aufspaltung). Für Übergängen zwischen Niveaus unterschiedlicher Hauptquantenzahl (δn = 1) wird dies als Zeeman-Effekt bezeichnet (siehe Abschnitt zuvor). Es sind jedoch auch Übergänge zwischen Niveaus gleicher Hauptquantenzahl beobachtbar, was als Elektronenspinresonanz (abgekürzt ESR) bezeichnet wird. Diese magnetisch Dipolar-Übergänge zwischen benachbarten Niveaus erfüllen ∆mJ = ±1. In der Praxis wird die zu untersuchende Probe in einem veränderlichen Magnetfeld mit einer Mikrowelle fester Frequenz bestrahlt. Das aufgezeichnete Absorptionsspektrum erlaubt Rückschlüsse auf die magnetische Umgebung der magnetische Momente. Die ESR wird heutzutage hauptsächlich zur Analyse von Kristallstrukturen und chemischen Reaktionen eingesetzt. Versuch 3407: Elektronen-Spin-Resonanz Das Gerät besteht aus einem Betriebsgerät und einem mit einem Drehkondensator abstimmbaren Parallelschwingkreis extrem hoher Güte. Die Anordnung arbeitet nach dem Prinzip der magnetischen Resonanz. Eine Probesubstanz (Diphenylpicrylhydrazyl) mit einem ortsgebundenen, ungepaarten Elektron dient als Absorber für HF-Quanten genau definierter Energie (f = 146 MHz) , die von einem quarzstabilisierten Oszillator im Betriebsgerät erzeugt werden. Der Absorbtionsmechanismus ist das Umklappen des Elektronenspins von einer Einstellung im Magnetfeld in einer andere. Die Differenz beider Einstellungen und damit die benötigte Quantenenergie hängt von der Stärke des Magnetfeldes ab, dem die Probe ausgesetzt wird. Diese Feldstärke ist die Versuchvariable. Sie wird c °Lehrstuhl E13, TUM, 2008 7.3. QUANTENTHEORIE DER ATOME 43 von einem Helmholtz-Spulenpaar erzeugt, zunächst von Hand möglichst genau eingestellt und dann mit einem überlagerten Magnetfeld von 50 Hz moduliert, so dass man auf dem Schirm des Oszillographen (Fernsehanlage) eine Resonanzkurve erzeugen kann. Gemessen wird dabei Diagonalstrom einer Brücke, deren einer Zweig den auf die Resonanzfrequenz abgestimmten Parallelschwingkreis enthält . Die Probe befindet sich in der Spule dieses Schwingkreises, so dass sich beim Eintreten der Resonanz der Wechselstromwiderstand der Brücke ändert. In der vorher stromlosen Diagonale fließt dabei ein Strom, der im Betriebsgerät gleichgerichtet und verstärkt wird und dem Oszillographen als y- Signal zugeführt wird. Das x- Signal oszilliert wie die Magnetfeldstärke mit Netzfrequenz und kann mit einer Phasenschieber auch phasenrichtig eingestellt werden. Durchführung des Versuches: Der Kreis wird abgestimmt (vor der Vorlesung) und die Resonanzkurve gezeigt. Dann nimmt man die Probe aus der Spule, die Resonanz verschwindet. Bei der paramagnetischen Resonanz ergibt sich die Resonanzbedingung h f = g S µB B . (7.90) Für ein Magnetfeld um 0.35 T liegt die Resonanzfrequenz im sogenannten X-Band zwischen 9 und 10 GHz. Abbildung 7.31: links: Zum Nachweis der Resonanz wird die Flussdichte des Magnetfelds linear um die Resonanz variiert und die Variation der absorbierten Energie mit Bo als Signal eines sog. ESR-Spektrometers aufgezeichnet. rechts: Beispiel eines Oszilloskopbildes. Versuch 3408: Modellversuch zur Elektronenspinresonanz Eine luftgelagerte Kunststoffkugel mit einer Magnetachse (Bohrung mit eingelassenem Permanentmagnet) dient als Modellelektron. Sie wird zwischen zwei Spulen mit Eisenkern gestellt, die ein konstantes Magnetfeld erzeugen. Man bringt die Kugel durch Kippen der Luftkissenpfanne zum Rotieren und lenkt sie dann mit einem Permanentmagneten etwas c °Lehrstuhl E13, TUM, 2008 7.3. QUANTENTHEORIE DER ATOME 44 aus ihrer stabilen Rotationsachse ab. Sie präzediert jetzt um die Feldachse des konstanten Magnetfeldes. Wenn man nun den Permanentmagnet senkrecht zu dieser Richtung mit einer geeigneten Frequenz der rotierenden Kugel nähert und wieder entfernt, so schaukelt sich die Präzessionsbewegung der Kugel bis zum Umklappen auf. Abbildung 7.32: Aufbau des Modellversuchs zur ERS. LS- Nomenklatur Für ein einzelnes Elektron haben wir die 4 Quantenzahlen n, l, m und j zur vollständigen Beschreibung. In der LS- Nomenklatur werden diese zu nlj (7.91) angeordnet. So bezeichnen wir zum Beispiel ein Elektron mit n = 3, l = 1 und j = 1/2 mit 3p1/2 . Allgemein ist die Nomenklatur in Tabelle 7.2 aufgeführt. Tabelle 7.2: LS- Nomenklatur l j lj c °Lehrstuhl E13, TUM, 2008 0 1/2 s1/2 1 1/2 p1/2 3/2 p3/2 2 3/2 d3/2 5/2 d5/2 7.3. QUANTENTHEORIE DER ATOME 45 Abbildung 7.33: Zusammenfassung der Energieniveaus für ein Elektron gemäß der Einteilung nach Hauptquantenzahlen n, unter zusätzlicher Berücksichtigung der Nebenquantenzahl l, bei Aufspaltung im Magnetfeld (Zeemann-Effekt) und unter Berücksichtigung der LS- Kopplung (von links nach rechts, durch vertikale gestrichelte Linien getrennt). c °Lehrstuhl E13, TUM, 2008