Chemische Thermodynamik
Werbung

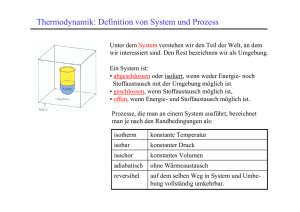
Thermodynamik Wärmelehre Prof. Dr. Sabine Prys Inhalte • • • • • • • • • Thermodynamische Größen Teilchenmodell Thermodynamisches System Thermodynamik der Gase Die Hauptsätze der Thermodynamik Chemische Thermodynamik Reaktionskinetik Energiewirtschaft Thermodynamik der Verbrennung 1 Warum wird der Kaffee kalt ? „ offenes “ System www.brownhen.com/ 2002_09_08_backhen.html Asymmetrie in der Natur • Heiße Körper kühlen sich ab, – Kalte Körper erhitzen sich nicht spontan • Eine Münze fällt aus der Hand auf den Boden, – ein Münze am Boden dagegen bleibt liegen Die Energieumwandlung hat eine Richtung 2 Historisches • Nicolas Leonard Sadi Carnot (1796 – 1832); Theorie der Wärme; Dampfmaschinen. • James Prescott Joule (1818 – 1889); Beziehung zwischen Wärme und Arbeit • William Thomson, Lord Kelvin (1824 – 1907); Grundlagen der klassischen Thermodynamik • Rudolf Gottlieb, Clausius (1822 – 1888); Zusammenhang zwischen Wärme und Materieteilchen • Ludwig Boltzmann (1844 – 1906); Grundlagen der statistischen Thermodynamik Themen der Wärmelehre Gasgesetze Verbrennung = chemische Reaktion Wärmefreisetzung • Stationäre Verbrennungsprozesse – Strömungsmechanik laminarer Strömung – Chemische Thermodynamik, Wärme durch Stoffumwandlung • Instationäre Verbrennungsprozesse – Strömungsmechanik turbulenter Strömung – Zündung, Löschung Elektrolytische Prozesse Reaktionskinetik 3 Chemische Thermodynamik Chemische Reaktion = Stoffumsatz + Energieumsatz + Entropieänderung • Aussage, ob eine ins Auge gefasste chemische Umsetzung freiwillig überhaupt möglich ist, – welche Ausbeuten hierbei zu erwarten sind, – welchen Einfluss Temperatur, Druck, eingesetzte Mengen auf den Reaktionsablauf haben, – wie stark sich das Reaktionsgemisch erwärmt oder abkühlt, ausdehnt oder zusammenzieht, – wie viel Energie ein chemischer Prozess benötigt oder umgekehrt zu liefern vermag und – vieles mehr. 1 Thermodynamische Größen Chemische Reaktion: Stoffgrößen Stoffmasse Molmasse Stoffmenge Stoffdichte Konzentration Molenbruch: m M n = m/M = m/V c xi = ni/ni A+B C+D Einheit [kg] [kg/mol] [mol] [kg/m3] [mol/m3] Energiegrößen [J] 3 Kinetische Energie = /2 kT, Innere Energie U, Arbeit W, Enthalpie, Entropie, … 4 1.1 Differenzen und Summen Formalismen • Differenz Differenzenquotient Steigung einer Geraden • Differential Differentialquotient Steigung einer Kurventangenten • Summe • Endzustand – Ausgangszustand E E2 E1 S y y2 y1 x x2 x1 • Unendliche kleine Größe dE lim E y' E 0 dy dx • Addition kleiner Größen n x1 x2 x3 ...xn xi i 1 • Addition unendlich kleiner Größen n • Integral n dx lim x i 1 x 0 i 1 i 1.2 Das Mol Die nach Amedeo Avogadro benannte AVOGADRO-Zahl oder AVOGADRO-Konstante ist definiert als die Anzahl der Atome in 12 g des Kohlenstoff-Isotops 12C. Sie ist gleich der Anzahl von Atomen oder Molekülen in einer Stoffmenge von einem Mol und hat den Zahlenwert Ein Mol eines Stoffes enthält stets NA = NL = 6,0221415(10) 1023 mol − 1 Molekulargewicht, angegeben in Gramm = 1 Mol 1 Mol He = 4,003 g 1 Mol N2 = 14,007 x 2 = 28,014 g 1 Mol NaCl = 22,990 + 35,453 = 58,443 g http://physics.nist.gov/cuu/Constants/index.html 5 1.2.1 Mol-Definition LOSCHMIDTsche Zahl = 1/AVOGADRO-Konstante 12 g C 6,0221367 . 1023 C-Atome NL 12 6,022 1023 12u g 1 6,022 1023 g 1 C 1 u http://physics.nist.gov/cuu/Constants/index.html 1.3 Dichte • Unter der Dichte eines Stoffes versteht man das Verhältnis von Masse m zu Volumen V m V 6 1.4 Druck p F A Druck = Kraft / Fläche Pascal: Pa = N/m2 = kg/m s2 1bar = 100 000 Pa ~ atmosphärischer Luftdruck Normaldruck Standarddruck p = 1 atm = 101,325 kPa = 1013,25 mbar p = 1 atm = 101,325 kPa = 1013,25 mbar http://www.ebgymhollabrunn.ac.at/ipin/ph-druck.htm http://cicum92.cup.uni-muenchen.de/puchinger/glossar/glossarB2.html 1.5 Temperatur Die Temperatur ist ein Maß für die thermische Bewegung kleinster Teilchen (Atome / Moleküle). Die Bewegung dieser Teilchen kann heutzutage auch mit dem Mikroskop sichtbar gemacht werden. Temperatur: skalare Größe aber Wärmefluß: vektorielle Größe Temperaturmessung durch: • Längen- oder Volumenausdehnungsmessung • Wechsel charakteristischer Zustände: z.B. Schmelzpunkte, Erstarrungspunkte, Siedepunkte • Änderung von charakteristischen Eigenschaften z.B. Änderungen von Transparenz, Reflexion, Farbe, elektrischem Widerstand, Strahlungsemission, Elastizitätsmodul 7 1.5.1 Temperatur [°C] Empirische Temperaturskala • Celsius – Eispunkt von Wasser T=0°C – Kochpunkt T=100°C – 100 Intervalle http://www.astro.uu.se/history/Celsius_eng.html 1.5.2 Temperatur [F] Empirische Temperaturskala • Fahrenheit – Temperatur einer Eis/Wasser/Salmiak Mischung Nullpunkt = -17.8 °C – Bluttemperatur eines gesunden Mannes Referenzpunkt = 36.6 °C – 98 Intervalle TF = 9/5TC + 32 [°F] bzw. TC = 5/9 (TF - 32) [°C] www.spacesciencegroup.org/ lessons/default.asp... 8 1.5.3 Temperatur [K] Thermodynamische Temperaturskala – Stoffunabhängig ! p.V ~ T – T[K] = 273.15 + T[°C] http://www.ptb.de/de/wegweiser/einheiten/si/kelvin.html http://www.chem.gla.ac.uk/~laurence/Chirality.htm 1.6 Arbeit & Energie Arbeit = Kraft x Weg [N.m] = [J] • Wenn man an einem Körper Arbeit verrichtet, vergrößert man seinen Energiegehalt • Energie ist also "gespeicherte Arbeit" • Diese "gespeicherte Arbeit" kann wieder abgegeben werden 9 1.6.1 Teilchenbewegung Kohärente Teilchenbewegung Arbeit Inkohärente Teilchenbewegung Energie 1. Wärme lässt sich in Arbeit umwandeln 2. Die vollständige Umwandlung gelingt nur am absoluten Nullpunkt 3. Der absolute Nullpunkt ist aber nicht erreichbar 1.6.2 Energie Energie ist die Fähigkeit Arbeit zu verrichten Wärme abzugeben Strahlung auszusenden... Energieeinheiten: Wh, J, eV, cal, .... Energieformen: Bewegungsenergie (kinetische Energie) Lageenergie (potentielle Energie) Wärmeenergie Strahlungsenergie Chemische Energie ... 10 1.6.3 Energieformen • • • • • • • Deformationsenergie Reibungsenergie Elektrische Energie Potentielle Energie Kinetische Energie Chemische Energie .... 1.6.4 Potentielle Energie Potentielle Energie Energie der Lage Epot = m.g.h Epot = Energie der Lage m = Masse des gehobenen Körpers g = Erdbeschleunigung h= Höhe, in der sich der Körper befindet. Energie der Form EForm = ½ .k.x2 EForm = Energie der Form k = Federkonstante x = Längenänderung 11 1.6.5 Kinetische Energie Kinetische Energie Die kinetische Energie eines Teilchens ist so groß wie die an ihm verrichtete Beschleunigungsarbeit: Ekin = ½ m.v2 Ekin = kinetische Energie m = Masse v = Geschwindigkeit 1.6.6 Energieeinheiten 1 t SKE = Brennwert 1 t Steinkohle = 29,3 GJ 12 1.6.6.1 Definition eV und J • 1 Elektronenvolt ist die Energie, die ein Teilchen mit der Ladung 1 e (Elementarladung) erhält, wenn es die Spannung von 1 V durchläuft • Ein Joule ist gleich der Arbeit, die verrichtet wird, wenn eine Masse von 1 kg über eine Strecke von 1 m mit 1 m/(s²) beschleunigt wird 1 eV = 1,602 176 462(63) · 10-19 J http://de.wikipedia.org 1.6.6.2 Definition cal • Eine Kalorie ist physikalisch definiert als Wärmemenge, die bei normalen atmosphärischen Druck von 1013 hPa benötigt wird, um 1 Gramm Wasser von 14,5 °C auf 15,5 °C zu erwärmen. Für den Betrag von 1 cal gibt es unterschiedliche Konventionen, beispielsweise die Wärmemenge von 4 °C auf 5 °C oder die durchschnittliche Wärmemenge pro Grad im Bereich von 0 °C bis 100 °C. 1 cal (international) 1 cal (thermochemisch) 1 cal (14.5–15.5°C) = 4,1868 J; 1 J = 0,23885 cal = 4,1840 J; 1 J = 0,23901 cal = 4,1858 J; 1 J = 0,23890 cal http://de.wikipedia.org 13 1.6.6.3 Nährwertkalorien Der Nährwert von Lebensmitteln beträgt in Kilokalorien: 1 Gramm Kohlenhydrate = 4,1 kcal 1 Gramm Eiweiß = 4,1 kcal 1 Gramm Fett = 9,3 kcal http://de.wikipedia.org 1.6.7 Leistungseinheiten Leistung = Arbeit / Zeit = Energie pro Zeit 14 1.7 Zustandsgrößen Makroskopisch messbare thermodynamische Grundgrößen : Druck p, Temperatur T, Volumen V intensiven Größen (Qualitätsgrößen) unabhängig von der Stoffmenge ! • Druck • Temperatur • chemisches Potential • elektrische Spannung extensive Größen (Quantitätsgrößen) proportional zur Stoffmenge ! • Masse, Teilchenzahl • Gewicht, Volumen • Ladung • Magnetisierung • Energie • Entropie 2 Teilchenmodell 15 2.1 Teilchenbewegung Geordnete Teilchenbewegung – ungeordnete Teilchenbewegung http://www.ifdn.tu-bs.de/physikdidaktik/metzger/preview/index.html 2.2 Teilcheneigenschaften Atomare Masseneinheit u u = 1/12 mC-12 12C = 1,66 * 10-27 kg Relative Atommasse A Ar= mA/u mA = Atommasse Relative Molekülmasse M Mr = mM /u mM = Molekülmasse Atomdurchmesser d 10-10 bis 5 * 10-10 m 16 3 Thermodynamisches System Umgebung Systemgrenze System System: (Materiemenge) makroskopische Eigenschaften von Umgebung abgegrenzt Zustandsvariable (p,T,V) Zustandsgleichungen Umgebung: (Reservoir) Austausch mit System von extensiven Größen (hier Wärme) ohne Änderung entsprechender intensiver Größe (hier Temperatur) 3.1 Verschiedene Systeme offene Systeme Energieaustausch Materieaustausch geschlossene Systeme Umgebung Systemgrenze System Energieaustausch kein Materieaustausch abgeschlossene Systeme kein Energieaustausch kein Materieaustausch 17 3.2 Systemzustand Zustandsgrößen sind makroskopisch (beobachtbare) Größen Extensive Zustandsgrößen sind proportional zur Stoffmenge (z.B; Volumen, Energie) Intensive Zustandsgrößen sind unabhängig von der Stoffmenge (z.B. Druck, Temperatur) Thermodynamisches Gleichgewicht 3.3 Zustandsgröße „Innere Energie“ U Energiegehalt • Als innere Energie U bezeichnet man den in einem Medium gebundenen Energiebetrag – kinetische Energie der Gasmoleküle – potentielle Energie (Anziehungs-/Abstoßungskräfte) in Festkörpern – jede Energie, die nicht durch Bewegung des Körpers als Ganzes verändert werden kann • Die innere Energie ist eine Zustandsgröße 18 3.3.1 Innere Energie 1 Energiegehalt: Wärmemenge + Volumenarbeit • Thermische Energie des Systems – – – – Ungeordnete Teilchenbewegung Kinetische Energie der Teilchen Ekin = 3/2 k.T Wärmemenge Q = n.Cm.T Q = n.Cm.T = N.Ekin • Volumenarbeit – Gasexpansion: – Gaskompression: W = -p.V W = p.V Bei konstantem Volumen gilt: U = Q 3.3.2 Innere Energie 2 Additive Größe Gesamtsystem System 1 System 2 Für Systeme aus einem Stoff "i" in einer Phase gilt: Ui ~ ni U: Innere Energie = extensive Zustandsgröße ! U = U1 + U2 n = n1 + n2 U = U(T,V,n) V = V1 + V2 19 3.3.3 „Arbeit“ am System • Aufheizen • Energietransport infolge einer Temperaturdifferenz ! Gesamtsystem, abgeschlossen System 1 T1 Q U1 System 2 T2 Q U1Endzustand U1Anfangszustand U 2 mmmm U Q W T2 > T1 Wel W: elektrische Arbeit Wel Volumenarbeit p.V 3.3.4 Innere Energie 3 Wegunabhängige Größe • Die Änderung der inneren Energie hängt nur von der relativen Lage des End- und Anfangszustandes ab, nicht aber vom Weg ! p U Q W U 0 U2 U1 U1 Q+W V U2 20 3.4 Zustandsgröße Enthalpie H Wärmetönung • Bei konstantem Druck entspricht die Enthalpie der Wärmemenge des Systems H U p V H U p V V p p const Volumenzunahme H U pV Q pV pV H Q • Bei isobaren chemischen Reaktionen beschreibt die Reaktionsenthalpie den Wärmeumsatz der chemischen Reaktion chemische Thermodynamik 3.5 Zustandsgröße Entropie S „Unordnung“ Zustandsgröße (wegunabhängig) Verursacht durch BROWNsche Molekularbewegung & Raumerfüllungsprinzip • Maß für die Irreversibilität eines Vorganges Maßeinheit [J/K] für ein adiabatisches, abgeschlossenes System, (ideales Gas) gilt: • Reversibler Prozess : S = const • Irreversibler Prozess: S > 0 2 Qrev Qrev dU p dV dS S S 2 S1 T T T 1 • Wärmezufuhr pro Temperatur = reduzierte Wärme 21 3.5.1 Entropiezunahme Einstellung eines thermischen Gleichgewichts E1,S1 T>0 E1,S2, T = 0 Selbstlaufender (asymmetrischer) Prozess 3.5.2 Entropieabnahme • Die Entropie ist Null in einem idealen Kristall bei 0 K 22 3.5.3 BOLTZMANNs Gesetz Die Entropie eines Systems ist um so höher, je größer die Wahrscheinlichkeit ist, mit welcher der Zustand des Systems realisiert werden kann: S k ln w S k ln P k P W = Boltzmann Konstante = Wahrscheinlichkeit eines Systemzustandes = Wahrscheinlichkeitsverhältnis zweier Systemzustände 3.5.4 Übung: keine Entropieänderung Wie groß ist die adiabatische Änderung (Q = 0) der Entropie wenn eine Volumenarbeit in Form einer Expansion von 1 m3 zu 2 m3 für 1 Mol He bei 20 ° C , p = 1000 Pa geleistet werden soll ? S U pV Q pV pV Q T T T S 0 1000 10001 0 293,15 23 3.5.5 Übung: Entropiezunahme Wie groß ist die Änderung der Entropie bei konstantem Volumen, aber Zunahme der Wärmemenge für 1 Mol He bei 20 ° C , p = 1000 Pa und Q = 1000 J ? S U pV Q pV pV Q T T T S 1000 J 3,41 293,15 K 3.5.6 Energiequalität Brennstoffe der Menschheit Entstehungszeit des Energiespeichers Energiespeicher Lebenszeit eines Menschen Lebensalter der Menschheit Lebensalter des Universums Zeitspanne seit Big Bang Holz Kohle, Erdöl Uran* H Umwandlung von Wärme in Arbeit führt zur Vermehrung der Entropie * Uran ist die schwere Asche verloschener Sterne 24 Wiederholung 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Wie wird ein thermodynamisches System definiert ? Was versteht man unter innerer Energie ? Was sind die Eigenheiten einer Zustandsgröße ? Geben Sie Beispiele für Zustandsgrößen ! Was versteht man unter Volumenarbeit ? Welche physikalische Dimension hat Arbeit ? Was versteht man unter Enthalpie ? Wie berechnet man eine Enthalpieänderung ? Was versteht man unter Entropie ? Wie berechnet man eine Entropieänderung ? 3.6 Wärme • Resultiert aus kinetischer und potenzieller Energie der Teilchen Q T S [J ] • Übertragung von Wärme – mit einer Temperaturänderung verbunden – mit Phasenübergang verbunden – von einem System auf ein anderes erfolgt stets in Richtung zur geringeren Temperatur. • Wärme ist keine Zustandsgröße ! 25 3.6.1 Wärmemenge Q = Wärmeenergie Q Ekin 1 3 m v 2 kT 2 2 Gleichverteilungssatz: Die mittlere thermische Energie eines Gases der Temperatur T ist für jede Variable, die quadratisch in die Energie eingeht, 1/2 kT v 2 v x2 v y2 v z2 k 1.380658 10 23 J K Ekin = kinetische Energie, m = (Teilchen)masse v = (Teilchen)geschwindigkeit, k=Boltzmannkonstante 3.7 Freie Energie F Als freie Energie F bezeichnet man den Teil der Energie eines Systems, der in Arbeit umsetzbar ist. Nutzarbeit eines thermodynamischen Systems F U T S F U T S = freie Energie = innere Energie = Kelvin Temperatur = Entropie 26 3.8 Freie Enthalpie G • Die freie Enthalpie G (GIBBS Energie) ist ein Maß für die Triebkraft eines (chemischen) Prozesses G H T S U p V T S G U S V = freie Enthalpie = innere Energie = Entropie = Volumen H T p = Enthalpie = Kelvin Temperatur = Druck • Das (chemische) Gleichgewicht ist erreicht, wenn die freie Enthalpie ihr Minimum erreicht hat 3.8.1 Reaktionsrichtung Die freie Enthalpie gibt an, ob Reaktionen spontan ablaufen: endergonische Reaktion G > 0 Reaktion läuft nicht freiwillig ab Gleichgewicht G = 0 Reaktionsstillstand exergonische Reaktion G < 0 Reaktion läuft freiwillig ab 27 3.9 Spezifische Wärmekapazität "spezifische Wärme„ ist jene Energiemenge, die man benötigt, um 1 kg eines Stoffes um 1° C zu erwärmen Q C T c m T Q C c m T Einheit: C cm Wärmemenge Wärmekapazität [J / K] spezifische Wärmekapazität Masse des Körpers Temperaturdifferenz [c] = 1 J.kg-1.K-1 3.10.1 Wärmekapazitäten Stoffe Spezifische Wärmekapazitäten diverser Materialien: Quelle: http://de.wikibooks.org Stoff Gold Kupfer Aluminium Eisen Beton Fensterglas Holz Benzol Glyzerin Maschinenöl Quecksilber Wasser (20°C) Wasserdampf (100°C) Luft c [J/Kkg] 130 381 896 439 880 840 1700 1738 2428 1675 139 4186 1891 1005 (718) 28 3.10.2 Übung: im Saloon Ein Cowboy schießt mit seiner Pistole eine Bleikugel von 1 g mit einer Geschossgeschwindigkeit von 200 m/s in eine Holzwand. Die Kugel bleibt ohne Verformung dort stecken. Wie warm wird die Kugel, wenn die Wärmekapazität von Blei c = 0,13 J/(g.K) beträgt ? 1 m v 2 c m T 2 1 Q 1 200 2 20 J 2 20 Q T 153,85 K 154 K c m 0,13 1 Q Hängt die Temperaturerhöhung von der Masse der Bleikugel ab ? 3.10.3 Übung: Eistee oder TeeEis Zu 3 Liter Tee mit einer Temperatur von 20°C sollen 0,5 kg Eis mit einer Temperatur von -10°C hinzugegeben werden. Welche Temperatur stellt sich ein ? cH2O(l) = cw = 4,18 J/(g.K); cH2O(s) = cE = 2,1 J/(g.K) Schmelzenergie: Es = 333 kJ/kg Tee von 20°C auf 0°C abkühlen: Eis von -10°C auf 0°C erwärmen: Eis zum Schmelzen zu bringen: QE + EE = 177 kJ QT = mw . cw . T = 3000 . 4,18 . 20 = 250,8 kJ QE = mE . cE . T = 500 . 2,1 . 10 = 10,5 kJ EE = mE . EE = 0,5 . 333 = 166,5 kJ Energie für Abkühlung des Tees = Energie zum Aufwärmen + Schmelzen des Eises: T-273,15 = Tc 177 kJ + 0,5 .cw . (T-273,15) = 3000 . cw . (295,15 – T) 177 + 2,09 . Tc = 12,54 (20 - Tc) 250,08 - 177 = (12,54 + 2,09) Tc Tc = 73,8 / 14,63 = 5,04 °C kein Tee-Eis 29 3.10.4 Molare Wärmekapazität (spezifische Wärmekapazität) Q C T c m T C T Q C T c n M T n Cm T (molare Wärmekapazität) T Q C c Cm m M n Temperaturdifferenz Wärmemenge Wärmekapazität spezifische Wärmekapazität molare Wärmekapazität Masse des Körpers Atomgewicht Molzahl n m M 3.10.5 Wärmekapazität Gase 1 • cp • cV Spezifische Wärmekapazität bei konstantem Druck • Cmp • CmV Molare Wärmekapazität bei konstantem Druck Adiabatenexponent : Spezifische Wärmekapazität bei konstantem Volumen Molare Wärmekapazität bei konstantem Volumen c p Cm p cV CmV 30 3.10.6 Wärmekapazität Gase 2 U Q W Q p V n Cm T p V n Cm T n R T Expansion ! pV = nRT p const. (p 0) ( I ) U n Cm p T n R T V const. (V 0) ( II ) U n CmV T p V n CmV T I II : n Cm p T n R T n CmV T 0 n(Cm p CmV R ) T 0 Cm p CmV R 3.10.7 Wärmekapazität Gase 3 1. Für alle Gase gilt: cp Cmp > > cV CmV 2. Die Differenz der molaren Wärmekapazitäten ist für alle Gase gleich. 3. Der Adiabatenexponent ist von der Zahl der Atome im Molekül abhängig. c p Cm p cV CmV 31 3.10.8 Wärmekapazität Gase 4 Wärmekapazitäten einiger Gase bei T=298 K M [g/mol] cp [J/Kkg] cmp [J/Kkg] cmV [J/Kkg] O2 31,9988 0,91738 29,35505914 21,04105914 1,3951322 H2 H2O (g) H2O (l) He Ne Ar Kr Xe F2 HF Cl2 HCl Quelle: 2,0159 18,0153 18,0153 4,0026 20,179 39,948 83,8 131,29 37,9968 20,0063 70,906 36,461 14,298 1,8638 4,179 5,1931 1,0299 0,5203 0,09922 0,1583 0,8238 1,4562 0,4782 0,7987 28,8233382 33,57691614 75,2859387 20,78590206 20,7823521 20,7849444 8,314636 20,783207 31,30176384 29,13317406 33,9072492 29,1214007 20,5093382 25,26291614 66,9719387 12,47190206 12,4683521 12,4709444 0,000636 12,469207 22,98776384 20,81917406 25,5932492 20,8074007 1,405376318 1,329098983 1,124141546 1,666618448 1,666808246 1,666669639 13073,32704 1,666762529 1,361670672 1,399343412 1,324851289 1,399569371 Stoff Ahrendts, J.: Kabelac, S.; Technische Thermodynamik; Springer‐Vieweg Verlag 2014 Wiederholung 4 Zustandsgrößen • Innere Energie: U = Q + W U = TS + pV • Freie Energie F = U – TS • Enthalpie: H = U + pV • Freie Enthalpie G = H - TS 32 4 Thermodynamik der Gase • Festkörperthermodynamik • Thermodynamik von Flüssigkeiten • Thermodynamik der Gase – ohne chemische Stoffumwandlung – Mit Kräften zwischen den Teilchen • Thermodynamik der idealen Gase – ohne chemische Stoffumwandlung – Ohne Kräften zwischen den Teilchen – Einatomige Gase 4.1 Gesetz von AVOGADRO 1 A.Avogadro (1776-1856): Gleiche Rauminhalte unterschiedlicher Gase enthalten bei gleichem Druck und gleicher Temperatur stets die gleiche Anzahl von Molekülen http://www.anisn.it/scienza/avogadro/avogadro.htm 33 4.2 Gesetz von AVOGADRO 2 AVOGADRO-Konstante: NA= 6,022 . 1023 Teilchen pro Mol n = Stoffmenge in mol N = Teilchenzahl n = N/NA [mol] Alle Gase haben unter Normalbedingungen dasselbe molare Volumen Vmol = 22,415 m3/kmol, allgemein gilt: Vmol = V/n 4.2.1 Teilchengemisch Luft Zusammensetzung der wasserdampffreien Atmosphäre Bestandteil Stickstoff Sauerstoff Argon Neon Helium Krypton Xenon Luft Molmasse 28,020 32,000 39,940 20,180 4,003 83,800 131,300 28,970 Volumen % 78,090 20,950 9,300E‐01 1,821E‐03 5,240E‐04 1,140E‐04 8,700E‐06 Massen % 75,730 23,140 1,280E+00 1,050E‐03 7,240E‐05 3,300E‐04 3,900E‐05 Spurengase CO2, CH4, H2, O3, N2O, NH3, etc.. Quelle: Roeder, W; Wagner, T.; Physik unserer Umwelt ‐ Die Atmosphäre; 4. Auflage; Springer Verlag 2011 34 4.2.2 Eigenschaften von Luft • Gasgemisch • Hauptbestandteile N2 und O2 – zweiatomige Moleküle haben Bewegungsfreiheitsgrade • Schwingungen • Rotieren um verschiedene Achsen • Wechselwirkungen zwischen den Teilchen • Ursache der Verflüssigung 4.3 Gashaltige Systeme Gas gr. Chaos Gasteilchen • Teilchenbewegungen – Schwingungen – Rotationen – BROWN‘sche Bewegungen z.B. N2, O2 Ein Gas erfüllt stets den gesamten zur Verfügung stehenden Raum http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 35 4.4 BROWNsche Molekularbewegung • BROWN: „Reporter-Teilchen“ in einem Gas führen eine nach Geschwindigkeit und Richtung dauernd wechselnde Bewegung aus • PERRIN: Stöße der Gasmoleküle auf das Teilchen verursachen diese Bewegung, sie ist um so lebhafter je kleiner das Teilchen ist (Translationen, Rotationen) http://www.fh-muenchen.de/home/fb/fb06/labors/lab_didaktik/w-5-2.htm 4.5 Bewegungsfreiheitsgrade Anregung von Freiheitsgraden = Energiespeicherung ! • Teilchenbewegungen – Translationen – Rotationen – Schwingungen • räumliches n-atomigen Molekül: – Translationsfreiheitsgrade – Rotationsfreiheitsgrade – Schwingungsfreiheitsgrade 3n 3 3 3n-6 • lineares n-atomiges Molekül – Translationsfreiheitsgrade – Rotationsfreiheitsgrade – Schwingungsfreiheitsgrade 3n-1 3 2 3n-5 36 4.6 Teilchenwechselwirkungen • Kurzer Abstand: abstoßende Kräfte • Großer Abstand: anziehende Kräfte • Einfaches Gasmodell: Ideale und reale Gase http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 4.7 Ideale Gase z.B. N2, H2, O2, He, Ne,.... V groß, p klein • • • • • • Das System besteht nur aus einer Teilchensorte Es ist ein System aus sehr, sehr vielen Teilchen Die Teilchen haben kein Eigenvolumen; es sind Punktmassen Zwischen den Teilchen wirken keine Molekularkräfte Die Teilchen befinden sich in ständiger Bewegung Alle Stöße der Teilchen sind elastisch 37 4.7.1 Gaskompression (p.V) Gesetz von Boyle / Mariotte • Geschlossenes System • Wärmebad • Druck wird erhöht • Temperatur wird abgeführt • Isotherme Kompression 1 V p V const. p~ http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 4.7.2 Gasexpansion (-p.V) Gesetz von Gay-Lussac • Geschlossenes System • Wärmebad • Wärmebad wird erhitzt • System wird erwärmt • Volumen nimmt zu • Isobare Erwärmung V ~T V const. T http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 38 4.7.3 Historisches • Mariotte, Edme (1620 - 1684) • Boyle, Robert (1627 – 1691) • Gay-Lussac, Joseph Louis (1778 - 1850) Robert Boyle http://library.mtroyal.ca/subguides/physics.htm http://www.patrimoine.polytechnique.fr/collectionhomme/GayLussac.html 4.7.4.2 Das Gesetz von BOYLE MARIOTTE O2 T = 273.15 K p [atm] V [L] pV [L*atm] 1.50 3.0185 4.53 2.00 2.2639 4.53 2.50 1.8111 4.53 O2 T = 293.15 K p [atm] V [L] pV [L*atm] 1.50 3.2395 4.86 2.00 2.4297 4.86 2.50 1.9437 4.86 p~ 1 V p V const. 39 4.7.4.3 Das Gesetz von GAYLUSSAC VT Diagramm 2.3000 V [L] y = 5.1421E-03x + 1.0965E-04 1.8000 V ~T 1.3000 V const. T y = 3.8067E-03x + 9.3518E-05 0.8000 200.00 250.00 300.00 350.00 400.00 450.00 T [K] CO2 O2 Linear (CO2) Linear (O2) 4.7.5 Der absolute Nullpunkt T[K] = 273.15 + T[°C] Es muss einen absoluten Nullpunkt geben ! Kelvin-Skala: Basis für eine stofftunabhängige Temperaturdefinition http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 40 4.7.6 Konstante Mengen Gesetz von Gay-Lussac (isobar) Gesetz von Boyle / Mariotte (isotherm) 1 V p V const. p~ V ~T V const. T p V const. T 4.7.7 „Ideales“ Gasgesetz p V n R T p V n R T = Gasdruck [Pa] = [N/m2] = Volumen [m3] = Molzahl = Gaskonstante = KELVIN Temperatur Allgemeine Gaskonstante: R = 8,3145 J.K-1.mol-1 41 4.7.8 Dimension pV p V n R T J N m 3 mol K 2 mol K m Nm J pV hat die Dimension einer Energie ! Volumenänderung eines Systems entspricht Volumenarbeit W W = pV 4.7.9 Die BOLTZMANN Konstante k 8.314510 R J 1.380658 1023 23 N A 6.0221367 10 K R = allgemeine Gaskonstante NA = AVOGADRO Konstante Die BOLTZMANN Konstante beschreibt die Energie, die einem Teilchen zugeführt werden muss, damit eine Temperaturerhöhung um 1 K bewirkt wird ! 42 4.7.10 pV Diagramm eines idealen Gases Isothermen 3.10E-05 p [Pa] 2.10E-05 1.10E-05 1.00E-06 1.00E-05 1.00E+09 2.00E+09 3.00E+09 4.00E+09 5.00E+09 V [m3] T= 500 273.16 100 K 4.7.11 Normbedingungen Normalbedingungen: Normaldruck p = 1 atm = 101,325 kPa = 1013,25 mbar Normaltemperatur T = 0°C = 273.15 K Standardbedingungen: Standarddruck p = 1 atm = 101,325 kPa = 1013,25 mbar Standardtemperatur T = 25°C = 298.15 K 43 4.7.12 Übung • Wie groß ist das Volumen von einem Mol eines idealen Gases ? – Unter Normbedingungen nRT p 1 8.314510 273.15 0.02241 m3 V 101325 pV nRT V – Unter Standardbedingungen V 1 8.314510 298.15 0.02447 m3 101325 4.8 Reale Gase Nahe dem Verflüssigungspunkt eines Gases sind Eigenvolumen und Teilchenwechselwirkungen nicht mehr zu vernachlässigen http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 44 4.8.1 „Reales“ Gasgesetz a n2 p 2 V n b n R T V a Binnendruck b Kovolumen a b [l2.kPa/mol2] [l/mol] 422.4200 136.7600 3.4440 141.8000 140.8100 24.7170 0.0370 0.0320 0.0240 0.0390 0.0390 0.0270 Gas Ammoniak Argon Helium Luft Stickstoff Wasserstoff 4.8.2 Isothermen CO2 Isothermen T > 304 K superkritischer Bereich T < 304 K Bereich der Verflüssigung http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 45 4.8.3 Der kritische Bereich http://www.tu-bs.de/institute/fachdidnat/physikdidaktik/metzger/preview/html/gase.html 4.8.4 Zustandsgleichungen Ek = 3/2.k.T kinetische Energie • Ek mittlere kinetische Energie eines Gasmoleküls. k Boltzmannkonstante (k = 1,38.10-23 J.K-1) T absolute Temperatur U = 3/2.N.k.T kalorische Zustandsgleichung • U Innere Energie N Anzahl der Teilchen k Boltzmannkonstante T absolute Temperatur 46 4.8.5 „Arbeit“ am System 2 System: eingeschlossenes Gas p Druck auf Kolbenfläche K Kraft auf Umgebung dV < 0 (Expansion) • System gibt Arbeit an die Umgebung ab • Negatives Vorzeichen dV > 0 (Kompression) • Zufuhr von Arbeit an das System • Positives Vorzeichen 4.8.6 Volumenarbeit U Q W V V1 V2 0 W p V Kompression V V1 V2 0 W p V Expansion 47 4.8.7 Übung: Innere Energie Wie groß ist die innere Energie bei einem Mol He bei 20°C ? U 3 N k T 2 N 6,023 10 23 k 1.380658 10 23 J K T 293,15 K 3 6,023 10 23 1,38110 23 293,15 3657,528 J 2 U 3,7 kJ U 4.8.8 Übung: Änderung der inneren Energie Wie ist die Änderung der inneren Energie, wenn bei einem Mol He bei 20 ° C und Q = 0 das Volumen von einem m3 auf 2 m3 expandiert wird und wenn der Druck 1000 Pa beträgt? Adiabatisch Expansion: Q = 0 W = -p.V U Q W 0 pV V 1 m 3 p 1000 Pa U 1 1000 Nm 1000 J 1 kJ 48 4.8.9 POISSONsche Gleichung Adiabatische Kompression p V const = O2 p [atm] 1.50 2.00 2.50 O2 p [atm] 1.50 2.00 2.50 V [l] 3.0185 2.2639 1.8111 1.4 V 4.70 3.14 2.30 Adiabatenexponent pV [l*atm] 8.28 8.28 8.28 T = 273.15 K V [l] pV [l*atm] 3.0185 4.53 2.2639 4.53 1.8111 4.53 4.8.10 Polytrope Zustandsänderungen • Reale Zustandsänderungen finden zwischen den Extremen Isotherme und Adiabate statt • Polytropengleichung: – – – – Isotherme: Adiabate, reversibel: Isobare: Isochore: p V x const x=1 x= x=0 x= 49 4.8.11 Isotherme und Adiabate O2 Adiabaten und Isothermen 3.00 V [l] 2.50 2.00 1.50 pV = const pVκ = const 1.00 1.4000 1.9000 2.4000 2.9000 3.4000 3.9000 4.4000 4.9000 p [atm] Isotherme 273.15 K Adiabate 4.9 Kreisprozesse Maschine: zyklischer Arbeitsprozess, pV-Diagramm Ideale Maschine: keine Reibungsverluste http://www.physik.uni-muenchen.de/didaktik/U_materialien/leifiphysik/web_ph09/umwelt_technik/08dampfm/dampfmasch.htm 50 4.9.1 Isochorer Prozess eines idealen Gases p W12 0 Q12 CmV (T2 T1 ) Wärmezufuhr führt nur zur Erhöhung von U ! 2 1 V Langsame Zustandsänderung, Volumenänderungsarbeit ist Null ! 4.9.2 Isobare Volumenarbeit eines idealen Gases p W12 p (V2 V1 ) Q12 Cm p (T2 T1 ) Wärmezufuhr führt zur Expansionsarbeit und Erhöhung von U ! 1 2 W12 V Langsame Zustandsänderung, Volumenänderungsarbeit entspricht Fläche unter der Kurve ! 51 4.9.3 Isotherme Volumenarbeit eines idealen Gases p V2 W12 p (V ) dV n R T ln V1 V2 V1 dU Q W 0 W12 Q12 Gesammte Kompressionsarbeit kann in Wärme umgewandelt werden ! 2 1 W12 V Langsame Zustandsänderung, Volumenänderungsarbeit entspricht Fläche unter der Kurve ! 4.9.4 Adiabatische Volumenarbeit eines idealen Gases V2 W12 p (V ) dV p V1 W12 n CmV (T2 T1 ) p V const. 2 Volumenänderung bei reversibler adiabatischer Kompression führt nur zur Erhöhung von U ! 1 W12 V Reversible Änderung, d.h. keine Reibung Sehr schnelle Zustandsänderung, Volumenänderungsarbeit entspricht Fläche unter der Kurve ! 52 4.9.5 Der CARNOTsche Kreisprozess 4 reversible Schritte Isotherme Kompression von A B Adiabatische Kompression von B C Isotherme Expansion von C D Adiabatische Expansion von D A C p Q1 Gewinnung von Arbeit ! W = Q1 - Q2 D B A Prinzip der Wärmekraftmaschine ! Umgekehrtes Prinzip der Kältemaschine ! Q2 V 4.9.6 Nutzarbeit Abgegebene Volumenänderungsarbeit = Gesamtfläche p 1 Nutzarbeit 2 Zugeführte Volumenänderungsarbeit V Rechtsläufiger Prozess • Zustandsänderungen werden im pV-Diagramm im Uhrzeigersinn durchlaufen • Das System gibt mehr Arbeit ab, als zugeführt wurde • Die je Zyklus abgegebene Nutzarbeit stammt aus der Differenz von zu- und abgeführter Wärme Rechtsläufiger Prozess W W p dV dU 0 dQ dW 0 Linksläufiger Prozess • Zustandsänderungen werden im pV-Diagramm gegen Uhrzeigersinn durchlaufen 53 4.9.7 Rechts- und linksläufige Prozesse Rechtsläufig Linksläufig • Kraftmaschinen • Arbeitsmaschinen • • Wärmeaufnahme bei hohen T Wärmeabgabe bei tiefen T • • Wärmeaufnahme bei tiefen T Wärmeabgabe bei hohen T • Differenz von Zu- und Abwärme = mechanische Nutzarbeit • Differenz von Ab- und Zuwärme = zugeführte mechanische Arbeit • Wirkungsgrad: • Leistungszahl: • • Kältemaschine Wärmepumpe • • th Verbrennungsmotor Wärmekraftmaschine W Qzu . Q Q zu f zu W P 4.10 Thermodynamische Maschinen Kolbenmaschinen Strömungsmaschinen • • Verbrennungsmotoren – Seiliger-Prozess – Otto-Prozess – Diesel-Prozess Offene Gasturbine – Joule-Prozeß • Geschlossene Gasturbine – Ericson-Prozeß • Heißluftmotoren – Stirling-Prozess • Dampfkraftanlagen – Rankine-Prozeß 54 4.10.3 Entwicklung des Wirkungsgrads 4.10.4 Kohlekraftwerk = 0,38 http://www.hamburger-bildungsserver.de/welcome.phtml?unten=/klima/energie/enk-32.html 55 4.10.5 Kernkraftwerk (SWR) = 0,34 http://www.hamburger-bildungsserver.de/welcome.phtml?unten=/klima/energie/enk-32.html 4.10.7 Kältemaschine • Kältemittel: – Flüssigkeiten, die nur durch Druckverminderung zum Sieden gebracht werden können: – Frigen – Ammoniak (NH3) Kompressor Kondensator Verdampfer Q ab Q zu Hochdruck Niederdruck Drosselventil • Joule Thomson-Effekt: – Zur Überwindung zwischenmolarer Anziehungskräfte wird innere Energie verbraucht (Abkühlung bei Drosselung) 56 4.10.7.1 Kältemittel leicht kondensierbare Gase: Kältemittel Symbol Wasser Ammoniak Dichlordifluormethan Chlortrifluormethan Chlordifluormethan H2O NH3 CCl2F2 CClF3 CHClF2 R718 R 717 R 12 R 13 R 22 [ °C ] Schmp 0,0 -77,9 -158,0 -181,0 -160,0 Sdp. Bereich 100,0 -33,3 -30,0 -81,5 -40,8 >0 - 65 ... - 50 ... -100 ... - 70 ... +10 +20 -60 +20 5 Die Hauptsätze der Thermodynamik „Erfahrungssätze“ • Grundprinzipien in der (chemischen) Energetik • Voraussagen von (chemischen) Reaktionen • Unterscheidung zwischen vier Hauptsätzen – – – – 0. Hauptsatz 1. Hauptsatz 2. Hauptsatz 3. Hauptsatz (Gleichgewichtsprinzip) (Energieerhaltungsprinzip) (Entropiezunahmeprinzip) (Unerreichbarkeitsprinzip) 57 5.1 0. Hauptsatz Thermodynamik Gleichgewichtsprinzip • Prinzip von Fowler • Für jedes thermodynamische System existiert eine Zustandsgröße, die Temperatur genannt wird. Ihre Gleichheit ist die notwendige Voraussetzung für das thermische Gleichgewicht zweier Systeme oder zweier Teile des gleichen Systems. Die Temperatur ist eine skalare Größe. Zwei Systeme, die sich im thermischen Gleichgewicht mit einem dritten System befinden, sind auch untereinander im thermischen Gleichgewicht, haben also die gleiche Temperatur. 5.2 1. Hauptsatz der Thermodynamik Energieerhaltungsprinzip • Die Energie eines abgeschlossenen Systems bleibt erhalten. Dies gilt für alle Formen der Energie, seine Wärme kann sich aber ändern ! • U = const. • ∆U = δQ + δW • Es gibt keine periodisch arbeitende Maschine, die Arbeit leistet, ohne andere Energie aufzunehmen es gibt kein Perpetuum Mobile 1. Art * *Alter Erfahrungssatz: bereits 1775 beschloss die französische Akademie der Wissenschaften derartige Vorschläge von Erfindern nicht mehr zu prüfen ! 58 5.2.1 Perpetuum Mobile (1) • PERPETUUM MOBILE. liefert Energie in unbegrenzten Mengen. • Perpetuum Mobile, lat. = dauernd beweglich. • einmal in Gang gesetzt, ganz von selbst weiterlaufen und dabei fortwährend Arbeit verrichten 5.2.2 Perpetuum Mobile (2) Enzyklopädie Naturwissenschaft und Technik von 1981 : • • "Perpetuum mobile erster Art. Unter einem Perpetuum mobile erster Art versteht man eine Vorrichtung, deren Teile nicht nur dauernd in Bewegung bleiben, sondern die sogar dauernd Arbeit zu leisten vermag, ohne daß von außen Energie (z.B. in Form von Wärme) zugeführt wird, ohne daß sich aber auch der physikalische oder chemische Zustand der an der Vorrichtung beteiligten Stoffe mit der Zeit ändert. Ein Perpetuum mobile erster Art gibt es nicht. Es würde im Widerspruch zum ersten Hauptsatz der Thermodynamik stehen." (4.Bd. S.3236, re.Sp.) "Perpetuum mobile zweiter Art. Unter einem Perpetuum mobile zweiter Art versteht man eine periodisch arbeitende Maschine, die nichts anderes tut, als Wärme in mechanische (oder eine andere) Arbeit zu verwandeln. Ein Perpetuum Mobile zweiter Art gibt es nicht. Es würde im Widerspruch zum zweiten Hauptsatz der Thermodynamik stehen." (4.Bd. S.3236, re.Sp.) 59 5.3 2. Hauptsatz der Thermodynamik Entropiezunahmeprinzip • Der zweite Hauptsatz der Thermodynamik ist ein Wahrscheinlichkeitssatz: Ein System geht von unwahrscheinlichen zu wahrscheinlichen Zuständen über • In einem abgeschlossenen System nimmt die Entropie bei irreversiblen (realen von selbst ablaufenden) Vorgängen immer zu. • Wärme geht nicht von selbst von einem kalten auf einen warmen Körper über • Es gibt keinen Vorgang der nichts weiter bewirkt als die Abkühlung eines Wärmereservoirs und Erzeugung von äquivalenter mechanischer Arbeit • Ein höherer thermischer Wirkungsgrad als der des Carnot-Prozesses ist nicht möglich • Es gibt kein Perpetuum Mobile 2. Art 5.4 3. Hauptsatz der Thermodynamik Unerreichbarkeitsprinzip Nernst Theorem Für alle reinen Stoffe gilt am absoluten Nullpunkt: T 0 S k ln 1 S 0 Für reine Stoffe herrscht am Nullpunkt absolute Ordnung Der absolute Temperaturnullpunkt lässt sich nie erreichen !!! 60 5.5 Übung zu den Hauptsätzen Die Hauptsätze der Thermodynamik beschreiben und regeln die 4 Zustandsgrößen: Innere Energie U Enthalpie H Freie Enthalpie G Entropie S Diskutieren Sie und ordnen Sie diese Größen den jeweiligen Hauptsätzen zu ! 6 Chemische Thermodynamik • Thermodynamische Einkomponenten Systeme – Gasvolumina, z.B. ideale Gase • Thermodynamische Mehrkomponenten Systeme – Chemische Reaktionen, z.B. Verbrennungen 61 6.1 Chemische Reaktionen Überblick • Reaktionsenergie – Endotherme Reaktion – Exotherme Reaktion • Reaktionsrichtung – Endergonische Reaktion – Exergonische Reaktion H > 0 H < 0 nimmt Wärme auf gibt Wärme ab G > 0 G < 0 unfreiwillig freiwillig • Umkehrbarkeit von Reaktionen – Reversible Reaktion: A+B z.B. Säure-Base Gleichgewichte – Irreversible Reaktion A+B z.B. Verbrennungsreaktionen C+D C+D 6.1.1 Schreibweisen Für chemische Reaktionen Eine chemische Reaktion 1 A1 ... j A j k Ak ... n An reduziert sich zu A 0 i i i Produkte : i 0 Edukte : i 0 62 6.2 Reaktionsenthalpien Reaktionswärme Aus dem 1. Hauptsatz folgt für Reaktionen bei V=const dU Q W Q pdV Q Aus der Definition der Enthalpie folgt für Reaktionen bei p= const dH dU pdV Vdp dU pdV Somit gilt: H R i H i U R i U i i i 6.2.1 Endotherme Reaktion Endotherm Eine Reaktion mit der Enthalpieänderung: H298 >0 e.g. H 298 89kJ C(s) 2S (s) CS2 (l ) E Aktivierungsenergie + H t 63 6.2.1.1 Reduktion von SiO2 Herstellung von Rohsilizium im Industriemaßstab endotherm Elektrischer Ofen mit Kohleelektroden K Si 2 CO HR 695kJ / mol SiO2 2 C 2100 14 kWh / kg Si !!! (Rohsilizium, Reinheitsgrad 98 %) Herstellung von Rohsilizium im Labormaßstab exotherm SiO2 2 Mg Si 2 MgO HR 342kJ / mol http://www.chemiedidaktik.uni-wuppertal.de 6.2.2 Exotherme Reaktion Exotherm Eine Reaktion mit der Enthalpieänderung :H298 < 0 e.g. H 298 96,3kJ Fe(s) S (s) FeS(s) E Aktivierungsenergie - H t 64 6.2.2.1 SiHCl3 Synthese Siemens-Verfahren: Oxidation von Silizium zu SiHCl3 K Si 3 HCl 600 SiHCl3 H2 H298 218kJ 6.3 Standardbildungsenthalpie Definition Definition: reine Elemente im stabilen Zustand haben bei T = 298 K und p = 1 bar eine Standardbildungsenthalpie von 0 [kJ/mol] Beispiel: ½ O2 (g) O (g) HR = H0f,298 = 249,2 kJ/mol 65 6.3.1 Standardbildungsenthalpien Daten aus J. Warnatz et. al. Verbrennung 6.3.2 Beispiele Für Standardbildungsenthalpien Wie groß sind die Standardbildungsenthalpien bei folgenden Reaktionen: (a) C +O2 CO2 (Graphit) (b) 2C + O2 2 CO (Graphit) (c) (d) CO2 + C CO2 + C 2 CO 2 CO (C gas) (Graphit) Sind diese Reaktionen endotherm oder exotherm ? ? ? 66 6.3.3 Bildungsenthalpien bei beliebigen Temperaturen Aus dem 1. Hauptsatz folgt: für V const dU Q CV dT T U T U 298 K C V dT 298 K für p const dH Q C p dT T C H T H 298 K p dT 298 K 6.3.3.1 Beispiele Bei kleinen Temperaturunterschieden T2 – T1 gilt näherungsweise: HT2 = HT1 + Cp(T2 – T1) Bei größeren Temperaturunterschieden T2 – T1 gilt näherungsweise: C p0 a b T c T 2 T H T0 H 0 C p dT 0 1 1 H T0 H 0 a T b T 2 c 2 T 67 6.3.3.2 Beispiele für Cp0 O2 CO CO2 CH4 H2O [kJ/mol] Cp0 = 29,96 + 4,18 . 10-3 . T – 1,67 . 10+5 . T-2 Cp0 = 28,41 + 4,10 . 10-3 . T – 0,46 . 10+5 . T-2 Cp0 = 44,22 + 8,79 . 10-3 . T – 8,62 . 10+5 . T-2 Cp0 = 23,64 + 47,86 . 10-3 . T – 1,92 . 10+5 . T-2 Cp0 = 30,54 + 10,29 . 10-3 . T Quelle: G.M. Barrow Physikalische Chemie – Bohmann Vieweg Verlag 6.3.3.3 Übungsfrage Die Standardbildungsenthalpie H0298 für die Bildung von Methan nach: CGraphit + 2 H2,Gas CH4, Gas beträgt -74,85 kJ Wie groß ist die Reaktionsenthalpie bei 1000 K ? ? 68 6.3.3.4 Lösung H T0 (CH 4 ) H 00 (CH 4 ) 47,78 T 18,28 10 3 T 2 5,61 10 5 1 T 0 (CH 4 ) 47,78 298 18,28 10 3 2982 5,61 10 5 H 00 (CH 4 ) H 298 H 00 (CH 4 ) 74850 47,78 298 18,28 10 3 2982 5,61 10 5 60350 J 1 298 1 298 überprüfen H T0 (CH 4 ) 60350 47,78 T 18,28 10 3 T 2 5,61 10 5 1 T 6.4 Enthalpien von Vielkomponentensystemen • • • • • • • • • • • • • Reaktionsenthalpie Bildungsenthalpie Verbrennungsenthalpie Wasserstoffbildungsenthalpie Zerfallsenthalpie Neutralisierungsenthalpie Lösungsenthalpie Hydratationsenthalpie Schmelzenthalpie Verdampfungsenthalpie Sublimationsenthalpie Gitterenthalpie ….. H U p V 69 6.5 Innere Energie bei chemischen Reaktionen • Innere Energie eines thermodynamischen Einkomponentensystems U Ekin Epot U Ekin Epot Q W T U Q W U TS pV innere Energie kinetische Energie potentielle Energie Wärmemenge Arbeit Temperatur • Innere Energie eines thermodynamischen Mehrkomponentensystems dU TS pV µi Ni S P V Ni µi G i µi U Ni G µi Ni i Entropie Druck Volumen Komponente i chemisches Potential Freie Enthalpie 6.5.1 GIBBSsche undamentalgleichung Das chemische Potential lässt sich aus den Zustandsgrößen U, H, F und G ermitteln dU TS pV µi Ni i U n i S ,V ,n F ni T ,V ,n H n i S , p ,n i i j i G ni T , p,n j i j j 70 6.6 Chemisches Potential • Das chemische Potential µi eines Stoffes i in einem Gemisch ist eine intensive Zustandsgröße, die das Potential des Stoffes (Triebkraft) charakterisiert – mit anderen Stoffen zu reagieren (chemische Reaktion) – in eine andere Phase zu wechseln (Phasenumwandlung) – sich räumlich umzuverteilen (Diffusion) • Es wird beschrieben durch die partielle Ableitung der freien Enthalpie nach der Stoffmenge ni G i ni p ,T ,n J mol j 6.6.1 Chemisches Standardpotential a µ i µi0 RT ln i a0 µ µ0 R T ai a0 = = = = = = chemisches Potential chemisches Standardpotential Gaskonstante Kelvin Temperatur Ionenaktivität Reaktionsprodukt Ionenaktivität Reaktionsedukt Chemisches Potential µi: Energieänderung des Systems wenn eine Komponente i hinzukommt, bei konstanter Entropie und konstantem Volumen 71 6.6.2 Reaktionsgleichgewicht Im thermodynamischen Reaktionsgleichgewicht gilt: µEdukte = µProdukte bzw. iµi = 0 Reversible Prozesse erreichen einen Punkt, wo die Reaktionsgeschwindigkeiten in beide Richtungen gleich sind, so dass das System eine statische Zusammensetzung zu haben scheint 6.6.3 Thermodynamisches Gleichgewicht • die freie Enthalpie G ein weist ein Minimum auf G = 0 • Im Gleichgewicht ist die Summe der chemischen Potenziale der Reaktanden gleich der der Produkte: iµi = 0 • Die Gleichgewichtskonstante G wird gegeben durch das Massenwirkungsgesetz: G = G298 + RT . lnK = 0 G298 = - RT . lnK 72 6.6.3.1 Massenwirkungsgesetz k cCaq dDaq k aAaq bBaq k [C]c [D]d K k [ A]a [B]b Chemisches Gleichgewicht: K gibt an wie viele Eduktmoleküle auf wie viele Produktmoleküle kommen. Gleichgewichtskonstante K, Temperaturabhängig Folge des chemischen Gleichgewichts: auftretende Konzentrationen sind nicht unabhängig voneinander 6.6.4 Chemisches Potential an Elektroden G µb nb T , p ,n j G nb nj T p = = = = = Freie Enthalpie Mole Reaktand b Mole Reaktand j Kelvin Temperatur Druck n+ nµb µ+ µ- = Mole der Kationen = Mole der Anionen = chemisches Potential Reaktand b = chemisches Potential der Kationen = chemisches Potential der Anionen G G dG dn dn µ µ n T , p , n j n T , p ,n j 73 6.6.5 Nutzarbeit Wmax G RT ln K z n F E U I t Wmax G R T K z n F E U I t = = = = = = = = = = = = Nutzarbeit Freie Enthalpie Gaskonstante Kelvin Temperatur Gleichgewichtskonstante Ionenladung Molzahl Faradaykonstante galvanisches Zellpotential Spannung Strom Zeit 6.7 Chemische Reaktionen & Entropie Chemische Reaktion = Stoffumsatz + Energieumsatz + Entropieänderung G = H - TS Entropieänderung durch: Änderung des Aggregatzustandes (Bewegungsfreiheitsgrade) Zunahme der Teilchenzahl durch Reaktion Qreversibel Qirreversibel S T T für Q 0 (abgeschlossenes System) : S S reversibel 0 S irreversibel 0 74 6.7.1 Der Tripelpunkt von Wasser Entropiezunahme mit T 104 • Homogenes Phasendiagramm H2O Kritischer Punkt 102 Flüssig • Tripelpunkt – 3 Phasen koexistent – 6.11 . 10-3 bar – 273.16 K 100 Fest 10-2 Tripelpunkt • Kritischer Punkt – Dichte Wasserdampf = Dichte Wasser 10-4 Dampfförmig 10-6 -100 0 100 200 300 400 T [°C] 6.7.2 Reaktionsentropie 3. Hauptsatz lim S 0 T 0 Standardentropie : S 0 bei Standarddruck Reaktionsentropie : S R i S i i Die Standardentropie einer chemischen Verbindung tritt auf, wenn man 1 mol dieser Verbindung aus den Elementen im Standardzustand (25 °C; 1,013 bar; stabilste Form) darstellt. Die Standard-Entropie eines Elements oder einer Verbindung ist stets positiv. 75 6.7.3 Beispiele • Wie groß sind die Reaktionsentropien bei folgenden Reaktionen: Tabelle (a) CGraphit + O2 (b) 2CGraphit + O2 (c) CO2 + CGraphit CO2 2 CO ?? 2 CO • Sind diese Reaktionen reversibel oder irreversibel ? 6.8 Richtung von Redoxreaktionen G H T S H S Vorwärtsrichtung Exotherm H < 0 Zunahme S > 0 G < 0 Exotherm H < 0 Abnahme Endotherm H > 0 Zunahme S > 0 Endotherm H > 0 Abnahme S < 0 S < 0 freiwillig if |TS| < |H| freiwillig if TS > H G > 0 freiwillig unfreiwillig 76 6.8.1 Beispiele G H T S 6 C (s) + 3 H2 (g) C6H6 (l) G298 = + 124 kJ C6H6 (l) 6 C (s) + 3 H2 (g) G298 = - 124 kJ 4 NH3 (g) + 5 O2 (g) 4 NO (g) + 6 H2O G298 = - 959,42 kJ 7 Reaktionsgeschwindigkeit • Abbaukinetik 1. Ordnung A B C D dA k [ A] dt • Abbaukinetik 2. Ordnung 2A B C D dA k [ A]2 dt 77 8 Energiewirtschaft Wie viel Energie verbrauchen wir ? Wie viel Energie erzeugen wir ? Wo kommt die Energie her ? Wie lange noch ? Wo bleibt die Energie ? 8.1 Prognose Stromerzeugung D In Deutschland in [%] 60 50 40 1995 2000 2020 30 20 534.9 Mrd. kWh 564.5 Mrd. kWh 631.1 Mrd. kWh 10 0 a. u. e st fe fe of st nn re B 1995 181 e iv at er en eg R ue Ne ft ra rk se as W ft ra nk er K as G l Ö le oh K 6/16/2014 2000 2020 Quelle: Siemens‐Berechnungen, 1997 78 8.2 Prognose Stromerzeugung W weltweit in [%] 40 35 1995 2000 2020 30 25 20 13 260 Mrd. kWh 15 350 Mrd. kWh 22 700 Mrd. kWh 15 10 5 0 Ko hl e Ö l u. a. fe st e G as Ke Ne W as ue rn se kr R af rk eg t ra en ft er at iv e Br en ns to ff e 1995 2000 2020 Quelle: Siemens, Prognosen des Weltenergierates, 1997 8.3 Prognose Primärenergieverbrauch D In Deutschland 45 40 1995 488 Mio. t SKE 2000 501 Mio. t SKE 2020 494 Mio. t SKE 35 30 25 20 15 10 5 0 Ko hl e 6/16/2014 Ö l u. a. fe st e Ne Ke W as ue rn se kr R af rk eg t ra en ft er at iv e G as Br en ns to ffe 1995 2000 183 2020 Quelle: Siemens‐Berechnungen, 1997 79 8.4 Prognose Primärenergieverbrauch W weltweit 35 1995 14.0 Mrd. t SKE 2000 14.8 Mrd. t SKE 2020 19.5 Mrd. t SKE 30 25 20 15 10 5 0 Ko hl e Ö l u. a. fe st e Ne Ke W as ue rn se kr R af rk eg t ra en ft er at iv e G as Br en ns to ffe 1995 6/16/2014 2000 184 2020 Quelle: Siemens‐Berechnungen, 1997 8.5 Entwicklung des weltweiten Primärenergieverbrauchs Mrd. t SKE 28 24 20 16 Quelle: Siemens‐Berechnungen, 1997 In den nächsten 50 Jahren wird die Menschheit mehr als das Doppelte an Energie benötigen, als sie bisher insgesammt verbraucht hat ! 12 8 4 0 6/16/2014 185 1940 1880 1900 1920 1960 1980 2000 2020 2050 80 8.6 Energiereserven an fossilen Brennstoffen Rohstoff Gesamtreserve Erdöl Kohle Erdgas % ~17 ~72 ~11 % Weltenergiebedarf Mrd. t SKE 196 845 134 ~40 ~35 ~22 Weltenergieverbrauch 1988 geschätzter Bedarf 2020 ~ 1 ~16,5 - 19 Mrd t SKE Mrd t SKE Sichergewinnbare Reserven an fossilen Brennstoffen Vorhandene Ressourcen: ~ 1 175 ~12 430 Mrd t SKE Mrd t SKE Quelle: Informationskreis Kernenergie 8.7 Energiesparen... ... beim Heizen bringts am meisten • • • • • • Räume nur bei Bedarf heizen Räume nicht überheizen Nachts Rollläden schließen kurz und gründlich lüften Heizkörper entlüften Verbesserte Wärmedämmung der Außenwände / Isolierungen • Moderne Heizungen mit Thermostatventilen • Wärmepumpen http://grenzendeswachstums.de/ 81 Übungsfragen 1 1. Was versteht man unter Wärme 2. Welche Einheiten kann Energie haben ? 3. Was ist die physikalische Dimension des Produktes aus Druck und Volumen p.V 4. Was versteht man unter einem geschlossenen System 5. Was bedeutet der Begriff isotherm ? 6. Was bedeutet der Begriff isobar ? 7. Was bedeutet der Begriff isochor ? 8. Was versteht man unter der inneren Energie eines Systems ? 9. Wie gross ist die innere Energie eines Systems aus 1,7 mol Helium bei 77 K ? 10. Was für Temperaturdefinitionen kennen Sie ? Erläutern Sie sie ! 11. Welcher Zusammenhang besteht zwischen Energie und Temperatur ? 12. Was ist ein Mol ? 13. Welche physikalische Dimension hat die universelle Gaskonstante R ? Übungsfragen 2 14. Welcher Zusammenhang besteht zwischen der Gaskonstante R und der Boltzmannkonstante k ? 15. Wie lautet das Gesetz von Boyle / Mariotte ? 16. Wie lautet das Gesetz von Gay-Lussac ? 17. Welches Gesetz kann man finden, wenn man beide Gleichungen vereint ? 18. Was versteht man unter einem idealen Gas ? 19. Wie groß ist die innere Innere Energie von 1 Mol He bei Normbedingungen ? 20. Was ist das Kennzeichen eines realen Gases ? 21. Ist Kohlendioxid, das Treibhausgas, ein ideales Gas ? Begründung ! 22. Welche Volumenarbeiten kennen Sie ? Formeln ! 23. Was versteht man unter Wärmekapazität ! 28. Zeichnen und erläutern Sie das Diagramm zum Carnot-Prozess ! 29. Was versteht man unter Nutzarbeit beim Kreisprozess ? 82 Übungsfragen 3 30. Was passiert wenn man den Carnot-Prozess in gegenläufiger Richtung beschreitet ? 31. Was versteht man unter dem Wirkungsgrad einer Wärmekraftmaschine ? 32. Was ist der Joule-Thomson-Effekt ? 33. Was versteht man unter Enthalpie 34. Was ist die freie Energie 35. Was ist Entropie ? Welche physikalische Einheit hat sie ? 36. Wie ist die Entropie mit der Wahrscheinlichkeit von Zuständen verknüpft ? 37. Wie lauteten die Hauptsätze der Thermodynamik ? Z.B. je 2 Formulierungen 38. Was ist ein Perpetuum Mobile ? 39. Welchen Energiebedarf hat der Mensch zum physischen Existenzminimum ? 40. Was versteht man unter t SKE ? Definition ! 41. Nennen Sie drei Möglichkeiten zur Energieeinsparung ! Referenzen • Ahrendts, J.: Kabelac, S.; Technische Thermodynamik; SpringerVieweg Verlag 2014 • Roeder, W; Wagner, T.; Physik unserer Umwelt - Die Atmosphäre; 4. Auflage; Springer Verlag 2011 • J. Warnatz, U. Maas, R.W. Dibble - Verbrennung: PhysikalischChemische Grundlagen; Springer Verlag 2001 • Atkins; Physik; • Atkins; Wärme und Bewegung; Spektrum Verlag • Dobrinski - Krakau – Vogel; Physik für Ingenieure • Hering - Martin - Stohrer ; Physik für Ingenieure; Springer Verlag 83 @ CURS Information Server designed by S. Prys 2014 84