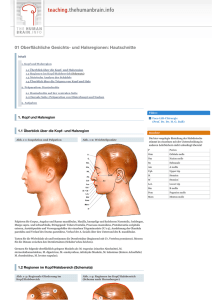
Vergleich der mikroskopischen Anatomie der Haut - Ti
Werbung

Tierärztliche Hochschule Hannover Vergleich der mikroskopischen Anatomie der Haut und Hautanhangsorgane des Hausmeerschweinchens (Cavia aperea f. porcellus) und des Ansells Kleingraumulls (Fukomys anselli) unter Berücksichtigung ihrer Anpassung an unterschiedliche Lebensräume INAUGURAL – DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin - Doctor medicinae veterinariae ( Dr. med. vet. ) vorgelegt von Filiz Hesselmann Essen Hannover 2010 Wissenschaftliche Betreuung: 1. Univ.-Prof. Dr. med. vet. H. Hackbarth, Institut für Tierschutz und Verhalten (Heim-, Labortiere und Pferde), Stiftung Tierärztliche Hochschule Hannover 2. PD Dr. rer. nat. G. Hilken, Zentrales Tierlaboratorium des Universitätsklinikums Duisburg-Essen 1. Gutachter: Univ.-Prof. Dr. med. vet. H. Hackbarth 2. Gutachter: Univ.-Prof. Dr. med. vet. M. Hewicker-Trautwein Tag der mündlichen Prüfung: 18.02.2010 Mama, Chris und Annelie I Inhaltsverzeichnis 1. Einleitung...............................................................................................................................1 2. Biologie von Cavia aperea f. porcellus……………………………………………………..3 2.1 Systematik.............................................................................................................................3 2.2 Habitat...................................................................................................................................4 2.3 Morphologie und Sinnesbiologie..........................................................................................6 2.4 Sozial- und Paarungssystem bei Cavia aperea f. porcellus, Reproduktionsbiologie...........8 3. Biologie von Fukomys anselli.............................................................................................11 3.1 Systematik...........................................................................................................................11 3.2 Habitat.................................................................................................................................12 3.3 Morphologie und Sinnesbiologie........................................................................................16 3.4 Sozial- und Paarungssystem bei Fukomys sp., Reproduktionsbiologie..............................18 4. Das Integumentum commune der Säugetiere..................................................................20 4.1 Hautschichten..................................................................................................................... 20 4.1.1Epidermis..........................................................................................................................20 4.1.2 Dermis..............................................................................................................................22 4.1.3 Hypodermis......................................................................................................................22 4.2 Spezifische Einrichtungen der Haut....................................................................................23 4.2.1 Hautanhangsorgane..........................................................................................................23 4.2.2 Haarzyklus.......................................................................................................................27 4.2.3 Hautdrüsen.......................................................................................................................29 4.2.3.1 Apokrine Schlauchdrüsen, Glandulae tubuliformes apocrinae. ...................................29 4.2.3.2 Talgdrüsen, Glandulae sebaceae...................................................................................29 5. Material und Methoden......................................................................................................31 5.1 Versuchstiere…………………………………………………………………………...…31 5.1.1 Cavia aperea f. porcellus…………………………………………………………….…31 5.1.2 Fukomys anselli................................................................................................................31 5.2 Vorbereitung zur Probenentnahme.....................................................................................32 5.3 Probenentnahme..................................................................................................................32 II 5.4 Einbettung...........................................................................................................................33 5.5 Schneidetechnik..................................................................................................................34 5.6 Histologische Färbungen.....................................................................................................34 5.6.1 Hämatoxylin-Eosin (H.E.) Färbung.................................................................................34 5.6.2 Toluidinblau-Färbung nach Richardson et al...................................................................35 5.6.3 Trichromatische Bindegewebsfärbung nach Masson-Goldner........................................35 5.6.4 Orceinfärbung nach Zaenzer-Unna..................................................................................37 5.7 Messungen am Integument.................................................................................................37 5.7.1 Messungen an Sagittalschnitten.......................................................................................37 5.7.2 Messungen an Horizontalschnitten..................................................................................37 5.8 Mikroskopie und Fotografie................................................................................................38 5.9 Statistische Auswertung......................................................................................................38 6. Ergebnisse............................................................................................................................39 6.1 Epidermis...................................................................................................................….....39 6.1.1 Cavia aperea f. porcellus............................................................................................….39 6.1.2 Fukomys anselli................................................................................................................41 6.2 Dermis und Hypodermis.....................................................................................................44 6.2.1 Cavia aperea f. porcellus...........................................................................................…..44 6.2.2 Fukomys anselli........................................................................................................…....47 6.3 Haarfollikel..........................................................................................................…...........50 6.3.1 Cavia aperea f. porcellus………………………………………………………….……50 6.3.2 Fukomys anselli…………………………………………………………………………54 6.4 Haarfollikeldichte…………………………………………………....................…………57 6.4.1 Cavia aperea f. porcellus………………………………………….……………………57 6.4.2 Fukomys anselli...............................................................................................................57 6.5 Größe und Anordnung der Haargruppen............................................................................59 6.5.1 Cavia aperea f. porcellus………………………………………………………….……59 6.5.2 Fukomys anselli………………………………………………………….…………...…65 6.6 Haarbalgmuskel…………………………………………………………………..………70 6.6.1 Cavia aperea f. porcellus………………………………………………………….……70 6.6.2 Fukomys anselli…………………………………………………………………………70 III 6.7 Hautdrüsen……………………………………………………………………………..…70 6.7.1 Cavia aperea f. porcellus…………………………………………………………….…70 6.7.2 Fukomys anselli…………………………………………………………………………72 6.8 Haarkleid……………………………………………………………………………….…72 6.8.1 Cavia aperea f. porcellus…………………………………………………………….…72 6.8.2 Fukomys anselli......................................................................................…......................74 7. Diskussion............................................................................................................................79 7.1 Epidermis............................................................................................................................81 7.2 Dermis und Hypodermis.....................................................................................................86 7.3 Haarfollikel.........................................................................................................................91 7.4 Haarfollikeldichte...............................................................................................................92 7.5 Größe und Anordnung der Haargruppen............................................................................93 7.6 Haarbalgmuskel..................................................................................................................97 7.7 Hautdrüsen..........................................................................................................................97 7.8 Haarkleid.............................................................................................................................98 7.9 Allgemeine Bezüge zum Lebensraum................................................................................99 8. Zusammenfassung.............................................................................................................102 9. Summary............................................................................................................................104 10. Literaturverzeichnis........................................................................................................106 11. Anhang.............................................................................................................................123 12. Danksagung.....................................................................................................................126 1 1. Einleitung Weltweit werden heute rund 5.500 rezente Säugetierarten unterschieden, welche mehr unterschiedliche Klimazonen und Lebensräume besetzt haben, als jedes andere Vertebratentaxa (Sokolov 1982). Dabei zeigen die Arten mannigfaltige Anpassungen an ihren jeweiligen, speziellen Lebensraum, das Habitat. Betrachtet man die Morphologie der Säugetiere, so ist die äußere Haut das flächen- und gewichtsmäßig größte Organ (Meyer 1998). Sie steht in direktem Kontakt zur Umwelt, so dass sich Hauteigenschaften in ihrer Struktur und Funktion als Adaption an den Lebensraum verändern können (Sokolov 1982). Aufgrund dessen ist laut Hildebrand (1988) und Daly & Buffenstein (1998) die Morphologie der Haut sogar ein besserer Indikator für das Habitat und die Lebensweise eines Tieres als die Phylogenie. Im Rahmen dieser Arbeit wird das Integumentum commune zweier Nagetiere (Rodentia), dem epigäisch lebenden Hausmeerschweinchen und dem subterran lebenden Ansells Kleingraumull, miteinander verglichen. Das Hausmeerschweinchen stammt vom Wildmeerschweinchen Cavia aperea ab (Hückinghaus 1961; Gade 1967; Rood 1972; Weir 1974b; Nachtsheim & Stengel 1977; Herre & Röhrs 1990; Benecke 1994; Künzl & Sachser 1999; Sachser et al. 2004). Cavia aperea ist bis heute in weiten Teilen Südamerikas beheimatet (Nowak 1991) und bewohnt dort eine Vielzahl von Habitaten mit steinigem und gebirgigem Gelände bis hin zu Waldrändern, Sümpfen und offenem Weideland (Grzimek 1975; Sutherland & Festing 1987; Nowak 1991; Noonan 1994). Das Hausmeerschweinchen (Cavia aperea f. porcellus) wurde vor 3000-6000 Jahren domestiziert und ist heute sowohl als beliebtes Haustier als auch als gängiges Labortier weltweit verbreitet (Hückinghaus 1961; Gade 1967; Hyams 1972; Wing 1977; Herre & Röhrs 1990; Benecke 1994; Sachser et al. 2004). Die Haut und Haare des Hausmeerschweinchens waren in der Vergangenheit bereits Bestandteil einiger Untersuchungen. Graumulle sind subterran lebende Nagetiere, welche zur Familie der Sandgräber (Bathyergidae) gehören und endemisch im subsaharischen Afrika beheimatet sind (Faulkes et al. 1997; Ingram et al. 2004). Dort bewohnen sie selbst angelegte, unterirdische Gangsysteme (Jarvis & Bennett 1991; Scharff 1998). Der unterirdische Lebensraum ist klimatisch gesehen deutlich stabiler als der epigäische Lebensraum, da seine Bewohner einer Vielzahl von 2 Einflüssen, wie starken Temperaturschwankungen, unterschiedlichen Witterungen und Sonnenstrahlung nicht ausgesetzt sind. Jedoch zeichnet sich der subterrane Lebensraum durch eine Vielzahl von mikroklimatischen Besonderheiten aus, die eine starke physiologische und morphologische Angepasstheit seiner Bewohner notwendig macht. Studien der Haut und Hautanhangsorgane einiger Graumullarten legen nahe, dass dieses Organsystem einige spezielle Strukturen aufweist, die als Anpassung an ihren Lebensraum interpretiert werden können. Jedoch liegt bislang keine detaillierte Untersuchung des Integumentum commune von Fukomys anselli vor. Ziel der Arbeit ist es, erstmals die Haut- und Anhangsorgane von Fukomys anselli umfassend zu untersuchen, um die Befunde mit dem Integumentum commune von Cavia aperea f. porcellus zu vergleichen. Hierbei soll die Frage geklärt werden, ob sich signifikante Unterschiede in der Struktur und Beschaffenheit zeigen, welche als Adaption an den jeweiligen Lebensraum interpretiert werden können. Neben einem interspezifischen Vergleich der beiden Tierarten werden darüber hinaus die Ergebnisse mit bereits publizierten Untersuchungen über das Meerschweinchen und der Haut weiterer Säugetierarten verglichen. 3 2. Biologie von Cavia aperea f. porcellus 2.1 Systematik Zoologisch systematisch gehören Meerschweinchen zur Familie der Caviidae und zur Ordnung der Nagetiere (Rodentia). Ihr Verbreitungsgebiet erstreckt sich seit ihrem Auftreten im mittleren Miozän bis heute auf weite Teile Südamerikas (Nowak 1991). Den Meerschweinchen werden laut derzeit gültiger Systematik drei Unterfamilien zugeordnet: Die Caviinae mit den Gattungen Microcavia, Galea und Cavia, die Dolichotinae mit der Gattung Dolichotis und die Hydrochoerinae mit den Gattungen Hydrochoerus und Kerodon. Der Gattung Microcavia und der Gattung Galea werden drei Spezies zugeordnet, der Gattung Cavia die sechs folgenden Spezies: C. aperea, C. tschudii, C. porcellus, C. fulgida, C. magna und C. intermedia (Wilson & Reeder 2005). Cavia aperea kommt in Kolumbien, Ecuador, Venezuela, Guyanas, Brasilien, nördlichem Argentinien, Uruguay und Paraguay vor und Cavia tschudii in Peru, dem südlichem Bolivien, nordwestlichen Argentinien und nördlichem Chile. Cavia fulgida ist im östlichen, Cavia intermedia im südlichen Brasilien und Cavia magna im südlichen Brasilien und Uruguay beheimatet. Cavia porcellus existiert möglicherweise verwildert im nördlichen Südamerika (Wilson & Reeder 2005). Anatomische und morphologische Studien belegen, dass das Wildmeerschweinchen Cavia aperea als die Stammform des Hausmeerschweinchens (Cavia aperea f. porcellus) gilt (Hückinghaus 1961; Gade 1967; Rood 1972; Weir 1974b; Nachtsheim & Stengel 1977; Herre & Röhrs 1990; Benecke 1994; Künzl & Sachser 1999; Sachser et al. 2004). Dieses Ergebnis kann zum einen aus Vergleichen von Schädel und Zähnen beider Spezies und zum zweiten aus der Tatsache gezogen werden, dass Kreuzungen von Cavia aperea und Cavia aperea f. porcellus fruchtbare Nachkommen erzeugen (Künzl & Sachser 1999; Sachser et al. 2004). Jedoch wird laut neuerer Systematik sowohl von Nowak (1991) als auch von Wilson & Reeder (2005), wie schon weiter oben beschrieben, das Hausmeerschweinchen Cavia porcellus nicht mehr als Unterart von Cavia aperea, sondern als eigenständige Spezies 4 aufgeführt. Da das Hausmeerschweinchen eindeutig domestiziert ist, stellt sich die Frage nach der Stammart. Als diese gilt bislang Cavia aperea. Da diese Frage offensichtlich nicht abschließend geklärt ist, wird in dieser Arbeit an der gängigen Nomenklatur Cavia aperea f. porcellus festgehalten. Abb. 1: Cavia aperea f. porcellus (Dunkin Hartley, Charles River, Foto Christine Krüger, Zentrales Tierlabor, Universitätsklinikum Essen). 2.2 Habitat des wildlebenden Meerschweinchens, Domestikation Die Spezies Cavia aperea hat von den Caviiden die weiteste Verbreitung. Diese erstreckt sich vom südlichen Kolumbien über Brasilien bis nach Argentinien (Rood 1972). Die Tiere leben dort in den grasreichen Hochebenen und Buschsteppen der Anden in Höhenlagen bis zu 4200 m (Raebiger 1933; Bielefeld 1977; Schmidt 1985). Dort bewohnen sie eine Vielzahl von Bodentypen von steinigem und bergigem Gelände bis hin zu Waldrändern, Sümpfen und offenem Weideland (Grzimek 1975; Sutherland & Festing 1987; Nowak 1991; Noonan 1994). Das bevorzugte Habitat von Cavia aperea umfasst zwei 5 Vegetationszonen: Einer Fläche mit hoher, dichter Vegetation, in welcher die Tiere vor Angriffen von Predatoren geschützt sind und einer angrenzenden, lichteren Ebene mit geringer Vegetation, in welcher sie auf Futtersuche gehen (Rood 1972; Cassini 1991; Cassini & Galante 1992; Guichón & Cassini 1998; Sachser et al. 2004; Asher et al. 2008). Obwohl sie terrestrische Lebewesen sind, wird berichtet, dass sie bei Überflutung mehrere Kilometer weit schwimmen können (Nowak 1991). Meerschweinchen scheinen in freier Wildbahn, sofern ihre Wohnstätten nicht zerstört worden sind, dauerhaft ihre Habitate zu bewohnen (Rood 1972; Sachser et al. 2004), wobei sie immer wieder die gleichen, labyrinthartig verzweigten Pfade zwischen Futter- und Ruhestellen nutzen (Hamel 1990). Es wurde berichtet, dass sie sowohl eigene Bauten graben als auch leerstehende Höhlen anderer Tiere bewohnen. Jedoch fand Rood (1972) bei Studien in OstArgentinien heraus, dass C. aperea keine eigenständig Bauten gräbt, sondern unter geschichtetem Unterholz und Erdklumpen Unterschlupf sucht (Nowak 1991). Wildmeerschweinchen sind überwiegend crepusculare Tiere. Dies bedeutet, dass sie vor allem in der Morgen- und Abenddämmerung aktiv sind und sich in dieser Zeit auf Nahrungssuche begeben (Sachser et al. 2004), während sie tagsüber in Höhlen Schutz suchen (Sutherland & Festing 1987; Noonan 1994). Nur gelegentlich sind sie bei kühlem Wetter auch tagsüber aktiv (Nowak 1991). Hausmeerschweinchen zeigen hingegen keinen ausgeprägten Tag-Nacht-Rhythmus mehr. Vielmehr folgen sie in ihrer Aktivität einem ultradianen Rhythmus, was bedeutet, dass sich alternierende Ruhe- und Aktivitätsphasen von je zwei bis drei Stunden unabhängig von einer Tag-Nacht-Periodik abwechseln (Sachser et al. 1992; Sachser et al. 2004). Meerschweinchen ernähren sich in der freien Wildbahn von frischer grüner Vegetation und wilden Früchten. Man nimmt an, dass diese Futterauswahl mit der Tatsache zusammenhängt, dass sie auf eine externe Zufuhr von Vitamin C aus der Nahrung angewiesen sind (Smallwood 1992; Noonan 1994). 6 Cavia aperea f. porcellus sind ausgesprochen gutmütige Tiere, welche vor 3000-6000 Jahren domestiziert wurden und heute sowohl als beliebte Haustiere als auch als gängige Labortiere in der biomedizinischen Forschung weltweit verbreitet sind (Hückinghaus 1961; Gade 1967; Hyams 1972; Wing 1977; Herre & Röhrs 1990; Benecke 1994; Sachser et al. 2004). Bei den Inkas waren sie wichtige Fleischlieferanten und wurden darüber hinaus gelegentlich zu religiösen und medizinischen Zwecken genutzt. Noch heute dienen sie in der ländlichen Bevölkerung Südamerikas als wichtige Fleischquelle (Gade 1967; Hyams 1972; Weir 1974b; Wing 1977; Clutton-Brock 1989; Herre & Röhrs 1990; Benecke 1994; Sachser et al. 2004). Mitte des 16 Jahrhunderts entdeckten die Spanier diese bereits von den Inkas domestizierten Tiere, nutzen sie als Fleischvorrat auf den langen Seereisen und brachten sie so nach Europa, wo sie schnell zu beliebten Haustieren wurden (Gade 1967; Hyams 1972; Clutton-Brock 1989; Hamel 1990; Benecke 1994; Sachser et al. 2004). 2.3 Morphologie und Sinnesbiologie Die Folgen der Domestikation vom Wild- zum Hausmeerschweinchen sind in der Morphologie deutlich erkennbar. Hausmeerschweinchen haben ein um 28 % (weibliche Neonate) und 62 % (männliche Neonate) erhöhtes Geburtsgewicht gegenüber der Wildform. Dieser Gewichtsunterschied ist auch bei den adulten Tieren deutlich erkennbar. Das Durchschnittsgewicht von Cavia aperea liegt bei 550 - 700 g KGW, das von Cavia aperea f. porcellus bei etwa 800 - 1000 g KGW (Rood 1972). Diese Zunahme des Gewichtes ist nicht überraschend, wenn man sich überlegt, dass die domestizierten Tiere als Fleischlieferanten gezüchtet wurden (Sachser et al. 2004). Neugeborene Wild- und Hausmeerschweinchen sind Nestflüchter, welche wie kleine, adulte Tiere aussehen und vom ersten Tag an laufen können. Ihre Augen sind geöffnet, sie sind voll behaart und ihre Zähne bereits voll entwickelt (Rood 1972; Nowak 1991; Sachser et al. 2004). Im Alter von acht bis zwölf Monaten sind sie ausgewachsen (Sachser et al. 2004) und können als Labor- und Haustier sieben bis acht Jahre alt werden (Harkness & Wagner 1989; Terril & Clemons 1998; Gabrisch & Zwart 2008). Die Körperlänge adulter Männchen kann bis zu 30 cm betragen (Sutherland & Festing 1987; Sachser et al. 2004). 7 Sowohl Wild- als auch Hausmeerschweinchen haben einen gedrungenen Körperbau ohne Taille, relativ kurze Beine, vier Zehen an den Vorder- und drei Zehen an den Hinterbeinen. Alle Zehen besitzen scharfe Krallen (Nowak 1991). Das Wildmeerschweinchen ist schlanker und graziler gebaut, Kopf und Schnauze sind schmaler und länglicher und die Ohren kleiner als bei Cavia aperea f. porcellus (Stahnke 1987). Das Fell des Wildmeerschweinchens ist ziemlich rau und lang und mit einem Kamm im Nacken (Nowak 1991). Alle Wildarten zeigen eine agoutifarbene Rückenbehaarung und eine weniger behaarte Unterseite (Rood 1972; Wagner & Manning 1976). Hausmeerschweinchen sind seit über 40 Jahren von Hobbyzüchtern auf ihre Fellunterschiede hin selektiert worden (Müller-Haye 1981; Noonan 1994). Es gibt eine weite Spannbreite an Haarkleidtypen von glattem und kurzem, glattem und langem und kurzem und rauem Fell bis hin zu Rosettenformen (Nowak 1991). Bei den Labormeerschweinchen ist die Dunkin-Hartley-Linie der English short-haired Guinea-Pigs am weitesten verbreitet (Sutherland & Festing 1987; Noonan 1994). Auch in ihrer Fellfarbe gibt es eine breite Varianz von ein- bis mehrfarbigen Tieren bis hin zu speziellen Farbzüchtungen wie Dalmatiner-, Schildpatt- und BrindleMeerschweinchen sowie vielen weiteren Varianten (Lauer 2003). Taktile Haare, welche typische Sinushaare sind, befinden sich beim Meerschweinchen auf der seitlichen Nasenfläche, wo sie fünf oder sechs Reihen bilden, im Augenbereich und im seitlichen Gesichtsfeld (Breazile & Brown 1976). Meerschweinchen meiden extreme Helligkeit und bevorzugen gedämpfte Lichtumgebungen (Smallwood 1992; Noonan 1994). Das Sehvermögen von Cavia aperea f. porcellus ist durch zwei verschiedene Typen von Zapfen in der Retina gekennzeichnet, welche vor allem in Bereichen von 429 bis 529 nm sensibel sind. Dies deutet darauf hin, dass die Retina grundsätzlich für Farbsehen konzipiert ist. Dies wird durch Verhaltensstudien bestätigt, welche zeigen, dass Meerschweinchen ein zweifarbiges Sehvermögen aufweisen (Jacobs & Deegan 1994; Sachser et al. 2004). Im Vergleich zum Sehvermögen scheint das Hörvermögen von Cavia aperea f. porcellus vor allem in hohen Frequenzbereichen besser ausgebildet zu sein als beim Menschen. Obwohl 8 ihre größte Sensibilität in Bereichen von 500 bis 8,000 Hertz liegt, können sie auch Laute in einem weit höheren Frequenzbereich zwischen 125 bis 32,000 Hertz wahrnehmen (Harper 1976; Sachser et al. 2004). Das gut ausgebildete Hörvermögen ist wichtig, da die Tiere in der freien Wildbahn untereinander durch ständige Stimmfühlungslaute in Verbindung bleiben. Bei drohender Gefahr werden Warnrufe ausgestoßen und die Tiere suchen entweder in Höhlen oder Gestrüpp Zuflucht oder verfallen in eine Schreckstarre (Hamel 1990). Innerhalb dieser Lautäußerungen kann man aufgeregtes Quietschen, ängstliches „Chirpen“ und erschrockenes Zähneklappern differenzieren (Nowak 1991). Auch beim domestizierten Meerschweinchen können ähnliche Lautäußerungen differenziert werden. So signalisiert der sogenannte „distress-call“, ein hohes Pfeifen, bei jugendlichen Tieren Angst oder Aufregung. Dieser Laut kann innerhalb einer Rufperiode mehrfach wiederholt werden und wird besonders häufig ausgestoßen, wenn jugendliche Tiere von ihren Müttern getrennt werden. Ein zusätzlicher Stressindikator bei Heim- oder Labortieren kann ein häufig wiederholtes Chirpen sein, welches bis zu 10-15 min lang wiederholt werden kann und in Situationen ausgestoßen wird, in denen sich die Tiere unwohl fühlen (Rood 1972; Sachser et al. 2004). Die olfaktorische Wahrnehmung spielt beim Meerschweinchen eine bedeutende Rolle im Sozialverhalten. So werden die Umgebung und die Weibchen durch männliche Tiere mit Hilfe von Analdrüsensekret markiert. Und Jungtiere können zwischen dem Urin der stillenden Mutter und dem eines unbekannten, laktierenden Weibchens unterscheiden (Jäckel & Trillmich 2003; Sachser et al. 2004). 2.4 Sozial- und Paarungssystem bei Cavia aperea f. porcellus, Reproduktionsbiologie Wildlebende Meerschweinchen leben in Sippenverbänden von vier bis 20 Tieren. Diese setzen sich stets aus einem Männchen, mehreren Weibchen und einigen Jungtieren zusammen. Das Sozialverhalten der wildlebenden Spezies ist deutlich aggressiver als das ihrer domestizierten Artgenossen. Häufig kommt es, vor allem bei Rangkämpfen zwischen männlichen Tieren, zu stärkeren Verletzungen, die tödlich enden können. Gruppenfremde Tiere werden in der Regel nicht akzeptiert (Rood 1972). Domestizierte Meerschweinchen sind demgegenüber deutlich weniger aggressiv und zeigen ein harmonischeres Sozialverhalten 9 gegenüber Artgenossen (Künzl & Sachser 1999; Künzl et al. 2003; Sachser et al. 2004). Werden adulte Weibchen in eine Aufzuchtkolonie aus einem adulten Männchen und mehreren adulten Weibchen gebracht, so werden sie friedfertig in die Gruppe integriert. Die Integration von Männchen in bestehende Gruppen ist schon deutlich schwieriger. Demgegenüber ist es fast unmöglich mehrere adulte Männchen der Wildform gemeinsam mit Weibchen zu halten (Sachser 1998; Sachser et al. 2004). Studien von Rood (1972) zeigen, dass sowohl Cavia aperea als auch Cavia aperea f. porcellus in Gefangenschaft das ganze Jahr reproduktiv sind, mit maximalen Geburtsraten im Frühling. Die Weibchen sind polyöstrisch und werfen bis zu fünf Mal pro Jahr. Obwohl auch wildlebende Cavia aperea unter günstigen Bedingungen theoretisch das ganze Jahr über Nachkommen zeugen können, reproduzierten sie in mehreren Wintern keine Nachkommen (Rood 1972; Nowak 1991). Der Zyklus des Weibchens beträgt ca. 20,5 Tage bei Cavia aperea und 16,5 Tage bei Cavia aperea f. porcellus (Asdell 1964; Weir 1974a; Nowak 1991). Unter semi-natürlichen und Laborbedingungen sind adulte Männchen des Wildmeerschweinchens in der Gegenwart von Weibchen hochgradig inkompatibel, wohingegen sich die weiblichen Tiere in eine geradlinige Hierarchie einordnen. Dieser Konkurrenzkampf unter den Männchen bewirkt ein polygynisches Paarungssystem (Sachser et al. 1999; Sachser et al. 2004). Immer wenn ein Weibchen in den Östrus kommt, ist somit grundsätzlich nur ein befruchtungsfähiges Männchen anwesend. Dieses paart sich mit mehreren Weibchen, wohingegen die Weibchen sich immer nur mit einem Männchen verpaaren (Sachser 1998; Sachser et al. 2004). Dieses polygynische Sozial- und Paarungssystem wird mit durch das Verhalten der Weibchen hervorgerufen, welche klare Vorlieben für ein einzelnes Männchen als Sozial- und Paarungspartner zeigen (Hohoff 2002; Sachser et al. 2004). Die Tragzeit beträgt in der Regel 56-74 Tage mit einer durchschnittlichen Dauer von ca. 62 Tagen bei Cavia aperea und 68 Tagen bei Cavia aperea f. porcellus. Durchschnittlich werden 2,3 (Cavia aperea) und 4 (Cavia aperea f. porcellus) Junge geboren (Weir 1974a; Nowak 1991). Die jungen Nestflüchter nehmen vom ersten Tag an neben der Muttermilch feste Nahrung und Wasser auf. Die Laktationsperiode beträgt zwei bis drei Wochen. Männliche 10 Meerschweinchen werden mit zwei bis drei Monaten geschlechtsreif, Weibchen mit weniger als einem Monat (Sachser et al. 2004). 11 3. Biologie von Fukomys anselli 3.1 Systematik Graumulle sind subterrane Nagetiere (Ordnung: Rodentia), welche zur Familie der Sandgräber (Bathyergidae) gehören und endemisch im subsaharischen Afrika beheimatet sind. Die Bathyergidae bilden ein Monophylum, das heißt alle Subtaxa stammen von einer Stammart ab (Faulkes et al. 1997; Ingram et al. 2004). Die Ursprünge der Bathyergidae liegen in Ostafrika. Untersuchungen der mitochondrialen rRNA-Sequenzen zeigten, dass die Aufsplitterungen der Ursprungspopulation vor ca. 40-48 Millionen Jahren begann und zur Bildung mehrerer Gattungen führte. Die Verbreitung dieser Gattungen erstreckt sich heute über Zentral- bis nach Südafrika (Faulkes et al. 2004). Abbildung 2 zeigt das heutige Verbreitungsgebiet der Bathyerigidae. Nach neueren Untersuchungen werden 6 Gattungen unterschieden: Bathyergus, Heterocephalus, Georychus, Heliophobius, Cryptomys und Fukomys (Kock et al. 2006). Während die Gattungen Heterocephalus, Georychus und Heliophobus monotypisch sind und aus jeweils einer Spezies bestehen, enthält die Gattung Bathyergus zwei Arten. Die Gattung Cryptomys beinhaltete bis 2004 elf anerkannte Spezies sowie mehrere Subspezies. Diese Sammelgattung zeichnete sich somit sowohl durch eine weiträumige geographische Verbreitung, als auch durch eine große morphologische und genetische Vielfalt aus. Eine Vielzahl von Untersuchungen legte nahe, dass Cryptomys sich in zwei divergierende Linien entwickelt hatte. Daher wurden Empfehlungen laut, sie in zwei separate Gattungen zu unterteilen (Nevo et al. 1987; Honeycutt et al. 1991; Faulkes et al. 1997; Faulkes et al. 2004; Ingram et al. 2004). Bereits 2004 wurden anhand von genetischen Analysen zwei neue Gattungen, Cryptomys und Coetomys, differenziert (Ingram et al. 2004). Da der Name Coetomys jedoch aus nomenklatorischen Gründen keinen Bestand hatte, wurde die Gattung in den heute geltenden Namen Fukomys umbenannt (Kock et al. 2006). Der Gattung Cryptomys gehören aktuell mindestens 6 Spezies an (Kock et al. 2006). Zur neuen Gattung Fukomys werden derzeit mindestens 12 Arten und einige Unterarten gestellt. Bis heute steht die wissenschaftliche Beschreibung einiger Arten aus. Die am häufigsten untersuchten Arten sind 12 F. damarensis, F. anselli und F. mechowii (Ingram et al. 2004). In dieser Arbeit wird die Haut von Fukomys anselli untersucht. Die Gattung Heterocephalus ist in Ostafrika, Heliophobus im Osten und Südosten Afrikas verbreitet. Bathyergus und Georychus sind auf die süd- bis südwestliche Küste Afrikas beschränkt (Ingram et al. 2004). Während Vertreter der Gattung Cryptomys in Südafrika, Mosambique und im Süden Simbabwes verbreitet sind, ist Fukomys über das restliche Gebiet südlich der Sahara weit verbreitet. Fukomys anselli wurde in weiten Teilen linksseitig des Kafue Flusses in Sambia nachgewiesen (Van Daele et al. 2004). Abb. 2: Verbreitungsgebiet der subterranen Nagetiere. Die afrikanische Gattung Fukomys ist südlich der Sahara beheimatet (nach Begall et al. 2007a). 3.2 Habitat Sandgräber bewohnen aufgrund ihrer weiten Verbreitung eine Vielfalt an Bodentypen und leben in verschiedenen Klimaregionen (Jarvis & Bennett 1991). Die Bodentypen variieren 13 zwischen einfachem Sand bis hin zu feinem Lehm (Faulkes et al. 2004). Während das Vorkommen der Gattungen Bathyergus, Georychus und Heliophobus auf gemäßigte Regionen beschränkt ist, in denen mehr als 400 mm Niederschlag jährlich fällt, kommen die übrigen Gattungen sowohl in feuchten, als auch in wasserarmen Regionen vor. So werden Gebiete mit weniger als 200 mm jährlichem Niederschlag besiedelt, in denen Regen nur noch sporadisch fällt bzw. unvorhersehbar ist (Faulkes et al. 2004). Typische Habitate von Fukomys anselli sind Felder, Gärten, Savannenbuschland und andere Grünflächen (Burda et al. 1999). Sandgräber ernähren sich hauptsächlich herbivor von unterirdischen Pflanzenteilen, wie Wurzeln, Knollen und Zwiebeln, scheinen jedoch auch Invertebraten wie Anneliden oder Käfer zu fressen (Burda & Kawalika 1993; Faulkes et al. 2004). Graumulle sind obligat subterrane Nagetiere, welche selbst angelegte, unterirdische Gangsysteme bewohnen. Diese sind komplex unterteilt in oberflächliche Gänge zur Futtersuche und tiefere Gänge mit Nestern, Toiletten- und Futterkammern (Jarvis & Bennett 1991; Scharff 1998). Die horizontalen Gangsysteme erstrecken sich über verschiedene Boden- und Vegetationstypen und dienen vor allem der Nahrungsversorgung. Die vertikalen Gangsysteme erstrecken sich über verschiedene Tiefen und dienen der Thermoregulation, dem Schutz vor Feinden und der Kanalisation des Wassers im Falle einer Überschwemmung (Burda et al. 2007). Die Bauten von Fukomys anselli sind mit einem terminalen Nest und einem Haupttunnel von 200 m Länge und mehr linear angeordnet. Die Hauptachse ist meistens annähernd in Richtung Süden orientiert (Burda et al. 1990b). Obwohl sie als strikt unterirdisch bezeichnet werden, lassen sich bei allen Graumullarten hin und wieder Oberflächenaktivitäten nachweisen, welche meist auf überflutete Gangsysteme, aber auch auf die Suche von Futter und Nestmaterial sowie die Abwanderung von Einzeltieren aus der elterlichen Kolonie zurückzuführen sind (Scharff 1998). Die subterrane Lebensweise weist Vorteile auf. Dieses Habitat bietet seinen Bewohnern zum einen Schutz vor Raubtieren, vor allem in sensiblen Phasen (Schlafen, Reproduktion) und eine weitgehende Abschirmung vor oberirdischen Klimaschwankungen. Jedoch zeichnet es sich auch durch eine Vielzahl von mikroklimatischen Besonderheiten aus, was eine starke physiologische und morphologische Anpassung seiner Bewohner notwendig macht. Mikroklimatisch betrachtet ist die subterrane Umwelt wesentlich stabiler als der epigäische Lebensraum. Es kommen 14 vergleichsweise moderate, saisonale und tagesperiodisch bedingte Temperaturschwankungen vor. Darüber hinaus herrscht aufgrund des geschlossenen Systems eine hohe Luftfeuchtigkeit und vor allem bei Bauten aus schweren, kompakten Erdtypen eine geringe Gasventilation (Jarvis & Bennett 1991; Nevo 1999; Burda et al. 2007). Die meiste Zeit verbringen Mulle in ihren Nestkammern. Für diese wählen sie daher Bauabschnitte aus, welche nahe an ihrem eigenen Temperaturoptimum liegen, oder sie müssen sich an die vorherrschenden Temperaturen anpassen. Fukomys anselli legt seine Nester bevorzugt in Bodentiefen mit einer Temperatur von 26-28°C an (Burda et al. 2007). Die Körperwärme der Tiere liegt bei ca. 36,1 °C (Marhold & Nagel 1995). Fukomys anselli ist ein guter Thermoregulator, welcher eine konstante Körpertemperatur über eine weite Spanne von Umgebungstemperaturen aufrechterhalten kann (homoiotherm). Nacktmulle sind im Vergleich dazu eher poikilotherm, da ihre Körpertemperatur abhängig von der Umgebungstemperatur ist (Daly & Buffenstein 1998). Abb. 3: Fukomys anselli im Gangsystem (Foto Prof. Dr. H. Burda, Allgemeine Zoologie, Universität Duisburg-Essen). Aufgrund der hohen relativen Luftfeuchtigkeit (93%) herrscht im unterirdischen Tunnelsystem ein geringes Dampfdruckgefälle, was einerseits die Verdunstungskühlung und die Konvektion behindert und andererseits den Wasserverlust über die Atmung herabsetzt. Der verminderte Wasserverlust stellt zum einen einen Vorteil für die Tiere dar, da Mulle 15 Wasser nur über die Nahrung aufnehmen, zum anderen aber auch einen Nachteil, da die Tiere der Gefahr der Überhitzung und des thermischen Stresses ausgesetzt sind (Burda 2003). Untersuchungen bei den sozial lebenden Fukomys mechowii und der solitär lebenden Art Heliophobus argenteocinereus deuten darauf hin, dass sich soziale Spezies gegen Unterkühlung durch Aneinanderkuscheln schützen. Ferner wird durch Zunahme an Körpergewicht und Felldichte der Wärmeverlust vermindert. Desweiteren scheinen weitreichende endogene, thermogenetische Mechanismen zu existieren, welche es den Tieren ermöglichen, Wärme zu bilden und somit ihre Körpertemperatur in kälteren Bereichen aufrecht zu erhalten (nonshivering thermogenesis = NST). Umgekehrt kann in Phasen erhöhter Stoffwechselleistung, v.a. beim Graben, Wärme abgegeben werden. Hierfür wird von den Tieren die Leitfähigkeit ihrer Körper genutzt, indem sie beim Liegen in kühleren Bereichen Wärme an den Boden abgeben. So wurde in einer thermographischen Studie u.a. von Fukomys mechowii festgestellt, dass in erster Linie der ventrale Bereich durch seine moderaten Außentemperaturen verbunden mit seiner großen Oberfläche und der vergleichsweise dünnen Behaarung der hauptsächliche Körperabschnitt ist, über den Wärme abgegeben werden kann (Sumbera et al. 2007). Die Luftzirkulation und der Gasaustausch in den Gangsystemen wird durch mehrere Faktoren beeinflusst: Durch die Porosität und Qualität der Erde, die Windstärke, die Bewegungen der Bewohner, den Austausch der Wärme innerhalb der Gangsysteme durch Temperaturschwankungen, die Tiefe und allgemeine Architektur der Gänge und durch vorhandene Öffnungen und Hügel (Kennerly 1964; Wilson & Kilgore 1978). Neuere Studien in verschlossenen Bauten von Fukomys damarensis, Georychus capensis und Heliophobius argenteocinereus bestätigen jedoch die lange Zeit vorherrschende Vermutung nicht, dass in diesen der Sauerstoffgehalt der Luft sehr gering und der CO2-Gehalt sehr hoch sein müssen. Tatsächlich weichen die Gaskonzentrationen nicht signifikant von denen unter überirdischen Bedingungen ab (Roper et al. 2001; Sumbera et al. 2004). Hingegen wurde jedoch in Bauten von Spalax ehrenbergi (Blindmaus, Muroidea) in schweren Erdtypen und in Regenzeiten sehr niedrige Sauerstoff- ( bis 7,2%) und hohe Kohlendioxidgehalte (6,1 %) nachgewiesen (Shams et al. 2005). Somit beeinflusst nicht nur die Dichte und Beschaffenheit des Baumaterials in den Gangsystemen, sondern auch das Vorhandensein von Regen oder Überschwemmungen 16 die Luftbeschaffenheit, indem die Flüssigkeit Erdporen verstopfen kann (Kennerly 1964; Arieli 1979; Shams et al. 2005). 3.3 Morphologie und Sinnesbiologie Morphologisch sind Mulle hervorragend an ihren Lebensraum angepasst. So können Graumulle innerhalb ihrer Bauten genauso schnell vorwärts wie rückwärts laufen, als auch auf der Stelle wenden. Das durchschnittliche Körpergewicht von adulten Fukomys anselli liegt bei knapp 80 (Weibchen) - 100g (Männchen) (Begall & Burda 1998; Scharff 1998). Sie besitzen zylindrische, walzenförmige Körper und einen kräftigen, gedrungenen Kopf. Die Extremitäten und der Schwanz sind relativ kurz. Das Fell ist kurz, graubraun und ohne Strich und kann daher in den unterirdischen Gängen problemlos in beide Richtungen gestreift werden. Gleichzeitig sind das Bindegewebe der Haut und das Fell sehr flexibel und nachgiebig (Nevo 1999; Stein 2000). Bei Untersuchungen von Nacktmullen wurden über 40 taktile Haare - ähnlich den Vibrissen im Gesicht - auf jeder Seite des Körpers gefunden, welche in einem bestimmten gitterartigen Muster vom Kopf bis zum Schwanz orientiert sind. Schon die Bewegung eines einzelnen Haares ruft eine sehr genaue Orientierung der Schnauze in Richtung des Reizes hervor (Crish et al. 2003). Genauere Vergleiche dieser taktilen Körperhaarfollikel der Nacktmulle mit Gesichtsvibrissen der Ratte und einer behaarten Mullart wurden durchgeführt. Sie zeigten, dass diese Haare zwar ähnlich wie die Leithaare behaarter Spezies groß und gut innerviert, ihre Follikel jedoch kleiner als bei echten Vibrissen sind und ihnen vibrissentypische, ausgefeilte Blutsinus-Komplexe fehlen (Park et al. 2003). 17 Abb. 4: Fukomys anselli, Detailstudie (Foto Prof. Dr. H. Burda, Allgemeine Zoologie, Universität Duisburg-Essen). Graumulle gehören zu den zahngrabenden, subterranen Säugern. Das Eindringen von Erde in den Mundraum wird verhindert, indem die Tiere die hinter den Schneidezähnen liegenden Lippen verschließen (Stein 2000). Die Augen von Fukomys anselli haben einen durchschnittlichen Durchmesser von 2 mm und liegen lateral im breiten Kopf (Nemec et al. 2004). Qualitativ ist das visuelle System ähnlich organisiert wie das von sehenden Säugetieren. Der säugetiertypische Grundbauplan der Retina findet sich auch bei den subterranen Säugern. Entgegen älterer Annahmen geht man heute davon aus, dass Ansells Kleingraumulle grundlegende Sehfähigkeiten beibehalten haben. Jedoch ist die Anzahl der Zapfen, welche im langwelligen Licht sensibel sind und das dichromatische Farbsehen ermöglichen, stark reduziert. Weiterhin ist die genaue Funktionstüchtigkeit der Augen unklar, denn trotz relativ gut entwickelter Augen sind die visuellen Zentren im Gehirn reduziert. Neuere Ergebnisse zeigen, dass Bathyergidae weißes Licht von Dunkelheit unterscheiden können. Die Tiere können daher durch Raubtiere eröffnete Gänge erkennen und verschließen diese wieder, wie es bei Fukomys anselli und Heliophobus argenteocinereus beobachtet worden ist (Nemec et al. 2004; Peichl et al. 2004; Wegner et al. 2006; Nemec et al. 2007). Im 18 Gegensatz zur früheren Annahme, dass subterrane Säuger ein verkümmertes Hörvermögen haben, stehen ein strukturell fortschrittlich spezialisiertes Mittel- und Innenohr sowie ein großes Repertoire an Lautäußerungen vor allem im niederfrequenten Bereich (Credner et al. 1997; Begall et al. 2007a; Lange et al. 2007). Jüngste Untersuchungen zeigen, dass sich in den unterirdischen Bauten von Fukomys sp. niederfrequente Laute (200-800 Hz) und niedrigere Frequenzen am besten ausbreiten und dass ihre Amplitude in bestimmten Frequenzen (bei 200, 400 und 800 Hz) stark vergrößert ist, ähnlich eines Stethoskops. Somit sind Stimmgebung, Hören und Ohrentwicklungen von Fukomys sp. als Folge einer echten Adaption genau an den Ausbreitungscharakter der Frequenzen innerhalb der Bauten angepasst. Gleichzeitig scheint die geringe Sensibilität für höhere und niedrigere Frequenzen die Tiere vor Überstimulation zu schützen (Credner et al. 1997; Begall et al. 2007a; Lange et al. 2007). Um sich in der dunklen und monotonen unterirdischen Umgebung räumlich zu orientieren, nutzt Fukomys anselli, wie auch viele andere Tiere (Schildkröten, Vögel etc.) erdmagnetische Felder als Kompass (Burda et al. 1990b). Darüber hinaus ist die Existenz von selbstentwickelten, reflektierenden, seismischen Wellen bei Spalax ehrenbergi beschrieben. Diese niederfrequenten Wellen (250-300 Hz) werden abgegeben, während eine Umleitung zur Umgehung eines Hindernisses gegraben wird, so dass anhand der reflektierenden Amplitude genaue Angaben zu Größe, Dichte und Entfernung des Hindernisses bestimmt werden können. Weiter können die Tiere durch Ertasten der niederfrequenten Wellen mit den Pfoten die Richtung der Vibration bestimmen. Histologisch wurden lamellenartige, korpuskuläre Mechanorezeptoren in der unbehaarten Haut der Pfoten nachgewiesen (Kimchi et al. 2005). 3.4 Sozial- und Paarungssystem bei Fukomys sp., Reproduktionsbiologie Fukomys anselli lebt in stabilen Familienverbänden. Daten zur Familiengröße im Freiland liegen kaum vor, jedoch gibt es Hinweise, dass die Kolonie mehr als 40 Tiere umfassen kann (Burda & Kawalika 1993). Eine definierte Fortpflanzungsperiode existiert nicht, die Jungtiere werden im Freiland das ganze Jahr über geboren (Scharff 1998). Die Familienstruktur von F. anselli wird als eusozial beschrieben. Eusozialität wird durch folgende Kriterien definiert: Reproduktiver Altruismus (welcher Auftteilung in Reproduktion und Arbeit inclusive kooperativer alloparentaler Jungaufzucht beinhaltet), Überlappen erwachsener Generationen 19 und permanente, für viele Individuen lebenslange Philopatrie (Burda et al. 2000). Dies bedeutet lebenslange Monogynie des züchtenden Weibchens verbunden mit einer langanhaltenden Paarbindung über mehr als eine Aufzuchtperiode. In einer Kolonie leben also nur ein reproduktives Weibchen, in der Regel ein reproduktives Männchen, einige nicht reproduktive Helfer und der Nachwuchs (subdominante Tiere). Diese bleiben bei sambischen Graumullen durchschnittlich 31 Monate in der elterlichen Kolonie. Sie sind für diese Zeit hinsichtlich ihres Wachstums und Reproduktionsverhaltens möglicherweise durch Pheromone gehemmt, wobei die effektivste Hemmung offenbar vom dominanten sich fortpflanzenden Weibchen, v.a. während der Laktation, ausgeübt wird (Burda 1990c; Burda et al. 2000). Die Weibchen tragen im Durchschnitt 14 Wochen, die Laktationsperiode beträgt 12 Wochen. In der Regel gebären die Weibchen zweimal jährlich bis zu zwei Tiere, was bei einer Mortalität von 30% drei Jungtieren im Jahr pro Paar entspricht (Burda 1989; Burda 1990c). Aufsehen erregend war der Befund, dass die sich vermehrenden Tiere annähernd doppelt so lange leben wie ihre Verwandten, welche keine Nachkommen zeugen. Dabei wurden in Laborstudien keine Unterschiede zwischen den männlichen und weiblichen Tieren nachgewiesen. Das älteste bekannte reproduktive Männchen war bis zum Zeitpunkt des Ende der Studie 20 Jahre, das älteste reproduktive Weibchen 15 Jahre alt. Im Gegensatz dazu starben alle Helfertiere („non-breeders“) vor ihrem achten Geburtstag (Dammann & Burda 2006). 20 4. Das Integumentum commune der Säugetiere Die äußere Haut ist das flächen- und gewichtsmäßig größte Organ der Säugetiere (Meyer 1998). Als allgemeine Körperdecke bildet sie die äußere Grenzfläche, welche den Organismus zum einen von der Umwelt abschirmt und zum anderen zu dieser eine breite Kontaktfläche schafft. Dabei erfüllt sie eine Vielzahl von Aufgaben. Sie bildet ein Schutzorgan gegenüber mechanischen, thermischen, chemischen sowie biologischen Einflüssen und bewahrt den Organismus vor Austrocknung. Darüber hinaus reguliert die Haut durch Hämodynamik und Vaskularisation den Wärme- und Wasserhaushalt des Körpers. Sie dient durch Ablagerung von Fett in das Unterhautgewebe als Energiespeicher und macht als Sinnesorgan und als immunologische Grenzschicht gegenüber der Umwelt das enge funktionelle Zusammenwirken von Nervensystem und Immunsystem deutlich (Liebich 1999). Trotz eines gemeinsamen Bauplans zeigen sich innerhalb verschiedener Säugetiergruppen und einzelner Individuen morphologische Unterschiede im Aufbau der Haut. So schwankt zum Beispiel die Dicke der gesamten Haut, aber auch einzelner Hautschichten zum Teil beträchtlich (Adam 1964). 4.1 Hautschichten Die äußere Haut wird von außen nach innen in Epidermis (Oberhaut), Dermis (Corium) und Hypodermis (Subcutis) eingeteilt (Meyer 1998). 4.1.1 Epidermis Die Epidermis ist ektodermalen Ursprungs. Ihr Bau variiert zwischen den einzelnen Säugetierarten nur unwesentlich (Meyer 1998; Weyrauch & Smollich 1998). Sie besteht aus einem mehrschichtigen Plattenepithel, das entsprechend der mechanischen Belastung unterschiedlich stark verhornt (Liebich 1999). Die Oberhaut ist aus den Strata basale, spinosum, granulosum, lucidum und corneum aufgebaut (Meyer 1998; Weyrauch & Smollich 1998). Untereinheiten bilden das Stratum profundum (bestehend aus Str. basale,- spinosumund granulosum) und das Stratum superficiale (bestehend aus Str. lucidum- und corneum). Das einlagige Stratum basale steht als Keimschicht im Dienste der zyklischen Erneuerung der 21 Keratinozyten. Es liegt mit seinen iso- bis hochprismatischen Zellen der Basalmembran eng an und ist mit dieser durch Hemidesmosomen fest verbunden, wodurch eine stabile Verankerung der Epidermis mit dem Corium erfolgt. Überwiegend im Stratum basale erfolgt durch mitotische Zellteilungen die Neubildung der Keratinozyten. Diese Epithelzellen keratinisieren im ein- bis mehrlagigen Stratum spinosum. Die Zellen dieses Stratum sind überwiegend polygonal mit runden Kernen; erst am Übergang zum Stratum granulosum flachen sie sich ab. Seinen Namen erhält das Stratum spinosum durch seine typischen Zellfortsätze, mit denen es über Desmosomen mit den Fortsätzen der Nachbarzellen verbunden ist (Stachelzellschicht). Zusammen werden Stratum basale und das Stratum spinosum als Stratum germinativum bezeichnet (Liebich 1999). Die Mitoseraten des Stratum basale und des Stratum spinosum variieren in den verschiedenen Teilen des Körpers und sind besonders hoch in Bereichen, in denen Zellerneuerung stattfinden (Sokolov 1982). Das Stratum granulosum umfasst mehrere Lagen flacher, rhomboider Zellen. Ihr Zytoplasma enthält zahlreiche Granula, die Keratohyalingranula (Geneser 1990). In einer hohen Epidermis tritt zwischen dem Stratum corneum und dem Stratum granulosum das Stratum lucidum auf, eine Schicht aus stark abgeplatteten, unvollständig verhornten Zellen (Künzel 1990). Die Zellen dieser Schicht sind im Absterben begriffen oder bereits tot (Adam 1964). Bei den Haussäugerarten ist ein Stratum lucidum im Bereich der allgemeinen Körperdecke nicht ausgebildet (Meyer et al. 1978a; Meyer 1998). Die äußerste Schicht der Epidermis ist das Stratum corneum. Seine lamellenartig angeordneten und stark abgeplatteten, zellkernlosen Epithelzellen liegen zunächst eng beieinander und bilden eine solide oberflächliche Schutzschicht, welche daher auch als Stratum corneum conjunctum bezeichnet wird. Zur freien Oberfläche hin lockert sich das Zellgefüge auf. Die abgestorbenen, verhornten Zellen lösen sich schließlich aus dem Zellverband und gehen als feine Schuppen verloren (Stratum corneum disjunctum) (Creed 1958; Lovell & Getty 1958; Neurand & Schwarz 1969; Schwarz et al. 1979; Schwarz et al. 1981). 22 4.1.2 Dermis Die Dermis (Corium, Lederhaut) ist mesodermalen Ursprungs und bildet die bindegewebige Grundlage der Epidermis (Liebich 1999). Sie ist aus zwei Schichten aufgebaut: Das flache, zell- und gefäßreiche Stratum papillare stellt die Verbindungsschicht zur Epidermis dar, mit der diese in schwach behaarter Haut durch fingerförmige, papillenartige Erhebungen (Papillarkörper) verzahnt ist (Neurand & Schwarz 1969; Kristensen 1975; Meyer et al. 1978a; Schwarz et al. 1979; Schwarz et al. 1981; Liebich 1999). Das lockere Bindegewebe besteht aus einem kollagenfaserigen Maschennetz, welches ein Netzwerk feinerer, elastischer Fasern enthält (Neurand & Schwarz 1969; Meyer et al. 1978b; Schwarz et al. 1981; Liebich 1999). Das Stratum papillare erfüllt mechanische, nutritive, immunologische, kreislaufregulatorische und sensorisch-sensible Aufgaben. Dafür ist es mit einer hohen Anzahl von haarnadelförmig verlaufenden Kapillarschlingen, freien Nervenendigungen und Zellen des spezifischen und unspezifischen Abwehrsystems ausgestattet (Hackländer 1972; Schwarz et al. 1981; Liebich 1999). Darüber hinaus sind hauptsächlich im Stratum papillare Haare, Talg- und Schweißdrüsen (Epidermis-Trias) als Abkömmlinge der Epidermis eingelagert (Liebich 1999). Das Stratum reticulare ist eine faserreiche, zellarme und straffe Bindegewebsschicht. Es besteht aus groben, kollagenen Bindegewebsfasern bzw. –faserbündeln vom Kollagentyp I, welche maschenähnlich verflochten sind und von einem Netz aus elastischen Fasern durchzogen werden. Sie bedingen die eigentliche Festigkeit und Elastizität der Haut (Schwarz et al. 1981; Liebich 1999). Das Stratum reticulare ist relativ arm an Gefäßen. Es wird von vorzugsweise kleineren Arterien und Venen auf dem Weg zu und von den oberflächlichen Hautschichten durchzogen (Schwarz et al. 1981; Liebich 1999) 4.1.3 Hypodermis Auch die Hypodermis (Subcutis, Unterhaut) ist mesodermalen Ursprungs. Sie stellt ein lockeres, unregelmäßig angeordnetes Bindegewebe dar, welches die Haut verschieblich mit Faszien oder Muskulatur verbindet (Liebich 1999). Der obere Anteil der Subcutis weist einen wellenförmigen Charakter auf, welcher durch die unterschiedlich tiefe Einpflanzung der Haare hervorgerufen wird, und erscheint so grob verzahnt mit der Dermis. Er ist reich an Fettgewebe, weshalb er auch als Stratum adiposum subcutis bezeichnet wird (Adam 1964; 23 Neurand & Schwarz 1969; Schwarz & Meyer 1994). Die Fettzellen des Haut-Fettkörpers (Corpus adiposus) zeigen in der Regel eine dünne Zellhaut mit dicht angeschmiegtem Zellkern, der Zellkörper ist groß und mit festem oder halbflüssigem Fett gefüllt. Die Fettzellen dienen neben der Reservestoffspeicherung dem Wärmeschutz und bieten eine mechanische Polsterfunktion (Adam 1964). Sie sind durch Bindegewebssepten, in denen Versorgungsgefäße und Nerven verlaufen, in verschieden große Läppchen unterteilt, welche häufig Haarfollikel und apokrine Drüsen enthalten. Unterhalb und manchmal im Fettkörper selbst findet sich in verschiedenen Regionen des Wirbeltierkörpers eine dünne Lage quergestreifter Muskulatur (Panniculus carnosus oder Musculus cutaneus). Der tiefere Anteil der Subcutis besteht aus faserreichem Bindegewebe mit vielen Kollagenfaserbündeln und wird daher auch als Stratum fibrosum subcutis bezeichnet (Adam 1964; Neurand & Schwarz 1969; Schwarz & Meyer 1994). 4.2 Spezifische Einrichtungen der Haut 4.2.1 Hautanhangsorgane Haare, Talg- und apokrine Drüsen sowie Musculi arrectores pilorum entwickeln sich aus einem gemeinsamen, embryonalen Ursprung, welcher gleichermaßen aus ektodermalen und mesodermalen Anteilen besteht (Pinkus 1971). Das Haarkleid dient dem Temperaturhaushalt, mechanischem Schutz und der Sinneswahrnehmung (Künzel 1990). Es besteht aus Deck- und Wollhaaren, welche sich in ihrem Aufbau sowie in Form, Länge und Dicke unterscheiden. Weitere Unterscheidungen werden aufgrund des äußeren Erscheinungsbildes (in Leithaar, Grannenhaar etc.) häufig vorgenommen, unterliegen aber keiner einheitlichen Definition. Jedoch lassen sich am fetalen Entwicklungsablauf der für die erste Haarbildung verantwortlichen Haarfollikel eindeutig drei Haarfollikelarten darstellen: Die zentralen Primärhaarfollikel stehen einzeln und produzieren das relativ lange, dicke und steife zentrale Primärhaar (Deckhaar). Sie entwickeln sich zuerst und sind innerhalb einer Haarfollikelgruppe die kräftigsten Haarfollikel. Sie verfügen über einen starken Haarbalgmuskel und über beide Hautdrüsenformen und reichen in ihrer Wachstumsphase bis in die Hypodermis hinein. Wenig später werden neben dem zentralen die lateralen Primärhaarfollikel angelegt, welche weniger kräftig sind und nicht so tief in die Haut 24 hineinreichen, jedoch ebenfalls beide Hautdrüsentypen sowie einen Haarbalgmuskel besitzen. Aus ihnen gehen die lateralen Primärhaare (Deckhaare) hervor. Zuletzt kommt es im weiteren Verlauf der fetalen Entwicklung zur Anlage von Sekundärhaarfollikeln. Sie besitzen nur Talgdrüsen und sind die kürzesten und feinsten Haarfollikel. Aus ihnen wachsen die Sekundärhaare (Wollhaare). Innerhalb einer Haarfollikelgruppe bilden die Sekundärhaarfollikel zusammen mit den lateralen Primärhaarfollikeln die Haarfollikelbündel (Schwarz & Meyer 1994). Grundtypen der Lagebeziehungen der Haarfollikel zueinander, wie sie bei allen Säugern zu beobachten sind, werden in Abb. 5 schematisch gezeigt (Militzer 1982). Abb. 5: Anordnungsmuster der Haare (a) im Flach- und (b) Längsschnitt. A: Einzelfollikel. B: Gruppierte Einzelfollikel. C: Einzeln stehende Haarbündel oder Verbundfollikel. D: Gruppierte Haarbündel oder Verbundfollikel. E: Gemischte Haargruppen (nach Militzer 1982). Die weitaus meisten Haare der Säugetiere, besonders die Deckhaare, inserieren schief in der Haut, d.h. sie schließen mit der Hautoberfläche einen mehr oder weniger spitzen Winkel ein. Die Richtung des Einzelhaares wird durch die Größe dieses Winkels und der Richtung, nach der dieser sich öffnet, bestimmt. Sind die eingepflanzten Haare einer Körperstelle zueinander nahezu parallel, so nennt man diese Anordnung den Haarstrich (Niedoba 1917). 25 Die Haare sind säugetierspezifische Bestandteile der Haut (Noback 1951; Schwarz & Meyer 1994). Jedes Einzelhaar wird durch den Haarschaft, Scapus pili, charakterisiert, der die Hautoberfläche überragt und oft eine typisch strukturierte Haarspitze, Apex pili, aufweist. Der Haarschaft setzt sich von außen nach innen aus Haarkutikula (Cuticula pili), Haarrinde (Cortex pili) und Haarmark (Medulla pili) zusammen (Meyer 1998). Die Haarkutikula besteht aus platten, verhornten Zellen, die sich dachziegelartig überlagern und deren freie Ränder zur Haarspitze hinweisen, wodurch an der Haaroberfläche ein häufig speziesspezifisches Kutikulamuster entsteht. Durch diese sich überlappenden Zellen wird einerseits der Schaft in der Kutikula der inneren Wurzelscheide verhakt, deren Zellen in gegenläufiger Richtung geschichtet sind, andererseits nehmen die Kutikulazellen bei ihrer Verschiebung nach distal Zelldebris, Parasiten und Talg mit. Die Haarrinde besteht aus verhornten, spindelförmigen Zellen, die parallel zur Haarlängsachse ausgerichtet sind und mehr oder weniger viel Pigment enthalten. Das Haarmark variiert in seinem Anteil am Haar in Abhängigkeit von Tierart und Haartyp und kann auch fehlen. So sind die Haarspitzen, der kolbennahe Bereich von primären Telogenhaaren sowie Sekundärhaare in der Regel markfrei (Paus et al. 1994; Schwarz & Meyer 1994). Die Haarwurzel ist in ihrer ganzen Ausdehnung von inneren und äußeren epithelialen Wurzelscheiden sowie einer bindegewebigen Wurzelscheide umhüllt. Eine voll ausgebildete Haarwurzel besitzen nur Haare, die noch wachsen. Die Wurzelscheiden bilden zusammen eine morphologisch-funktionelle Einheit, den Haarfollikel, welcher das Haar produziert. Der Haarbulbus, Bulbus pili, bildet eine Verdickung am proximalen Ende des Haarfollikels. In ihm befindet sich die Bulbushöhle, Cavitas bulbi, mit der dermalen Haarpapille, Papilla pili. An der zur Bulbushöhle hin konkaven Bulbusoberfläche liegt die epitheliale Haarmatrix, Matrix pili, welche alle Zellen für Kutikula, Rinde und Mark des Haares sowie für die innere epitheliale Wurzelscheide des Haarfollikels bildet (Schwarz & Meyer 1994; Meyer 1998). Die innere epitheliale Wurzelscheide liegt der Oberfläche des Haares mit einer abgeplatteten, einschichtigen Zelllage an, die als Scheidenkutikula (Cuticula vaginalis) bezeichnet wird. Sie besteht aus verhornten Zellen, die dachziegelartig angeordnet sind und in Richtung des Haarbulbus weisen. Durch ihre Verzahnung mit der Haarkutikula wird das Haar in der Wurzelscheide gehalten. Auf die Scheidenkutikula folgen nach außen ein bis drei Schichten 26 kernhaltiger Zellen (Huxley-Schicht) und eine meist einschichtige, kernlose Zelllage (HenleSchicht). Die äußere, epitheliale Wurzelscheide leitet sich nicht von der Haarmatrix ab, sondern differenziert sich aus den peripheren Zellen jenes Epithelstranges, der im Verlauf der Haarfollikelbildung in Richtung auf die Hypodermis auswächst. Sie stellt die Fortsetzung der Schichten des Stratum germinativum der Epidermis in der Tiefe dar, deren Wandaufbau sie weitgehend beibehält. Die äußere epitheliale Wurzelscheide ist im Bereich des Bulbus einschichtig, im Bereich des restlichen Follikels umfasst sie mehrere Zelllagen. Außen liegt ihr eine Basalmembran an, die die epidermalen Teile des Haarorgans von den bindegewebigen Schichten trennt (Parakkal 1970; De Villez 1986; Schwarz & Meyer 1994; Liebich 1999). Diese ist vor allem in der Telogenphase des Follikels besonders deutlich ausgebildet und wird deshalb auch als Glashaut bezeichnet (Schwarz & Meyer 1994). Die bindegewebige Wurzelscheide baut sich meist aus zwei Schichten auf. Ihre kollagenen Faserbündel formen zwei sich zu einander senkrecht kreuzende Lagen, ein Stratum internum circulare und ein Stratum externum longitudinale (Schwarz & Meyer 1994; Liebich 1999). Der Haarfollikel verfügt über eine reiche Gefäßversorgung, welche proximal bis in die dermale Papille reicht und so zur Ernährung der Matrix beiträgt. Die nervale Versorgung wird durch ein feines Geflecht aus sensorischen und autonomen Nervenfasern gewährleistet, die den Follikel umspinnen und den M. arrector pili und die Gefäße versorgen (Paus et al. 1994). Jeder Primärhaarfollikel weist einen Haarbalgmuskel auf, welcher aus glatter Muskulatur besteht. Dieser M. arrector pili entspringt im subepidermalen Bindegewebe und endet unterhalb der Talgdrüsen in der bindegewebigen Wurzelscheide. Er dient der Aufrechtstellung der Follikel (Meyer et al. 1994; Schwarz & Meyer 1994; Meyer 1998). 27 Abb. 6: Schematische Darstellung des Wandaufbaus eines Haares, der Wurzelscheiden und der anliegenden Bindegewebshüllen mit Haarpapille (nach Liebich 1999). 4.2.2 Haarzyklus Das Haarwachstum ist kein kontinuierlicher Vorgang, sondern verläuft in Aktivitätsschüben, bei denen sich in jedem Follikel in rhythmischer Folge Phasen der Entwicklung, der Funktion, der Involution und der Ruhe wiederholen. Die Ruhephase wird mit dem Haarausfall abgeschlossen (Neurand et al. 1980). Der Haarzyklus wird durch zahlreiche endogene Faktoren wie Rasse, Geschlecht, Alter, Gesundheitszustand und Geschlechtshormonspiegel sowie durch exogene Faktoren wie Temperatur, Ernährung, Licht, Haltung und Pflege beeinflusst. Entscheidende steuernde Bedeutung haben photoperiodische Einflüsse (Tageslänge), wobei besonders jahreszeitliche Temperaturveränderungen modifizierend wirken können. So kann bei Laborratten, welche durch die Domestikation diesen Einflüssen nicht unterliegen, ein gleichmäßiger Haarwechselzyklus über das ganze Jahr hindurch beobachtet werden (Johnson 1972; Meyer et al. 1980; Meyer 1998). 28 Der Haarzyklus lässt sich in drei Phasen einteilen, die Anagen- oder Entwicklungs- und Funktionsphase, die Katagen- oder Involutionsphase und die Telogen- oder Ruhephase. Das Anagen beginnt mit einer sprunghaften Zunahme der mitotischen Aktivität in der Haarmatrix. Ein anagener Haarfollikel reicht vergleichsweise tief in die Haut hinein und ist durch seinen verdickten Abschnitt, den Haarbulbus, charakterisiert. Dieser umfasst glockenförmig die dermale Haarpapille mit den Versorgungseinrichtungen für die Haarmatrix. Nach Abschluss des in seinem Umfang genetisch festgelegten Haarwachstums kommt es am anagenen Haarfollikel im Verlauf einer kurzen Involutionsphase, dem Katagen, zu tiefgreifenden Um- und Abbauvorgängen. Der anagene Haarfollikel wird weitgehend rückgebildet. Nach Abschluss des Katagens erreicht der Haarfollikel das Telogen, die Ruhephase des Haarzyklus. Der Follikel ist jetzt vollständig inaktiv, der verbleibende Zellstrang enthält jedoch den Haarkeim für die folgende Haargeneration. Durch die innige Verflechtung von aufgefaserter Haarrinde und verhornten Anteilen der epithelialen Wurzelscheiden ist der telogene Haarfollikel kolbenartig aufgetrieben, weshalb auch die Bezeichnung Kolbenhaar verwendet wird. Das Telogenhaar verbleibt für einen je nach Haartyp und Tierart unterschiedlich langen Zeitraum in der Haut (Chase 1954; Ryder 1973; Neurand et al. 1980; Schwarz et al. 1991; Schwarz & Meyer 1994). Abb. 7: Haarzyklus am Beispiel eines Primärhaarfollikels: A anagener, B, C katagener, D telogener Haarfollikel (mit Kolbenhaar), E-G telogene Haarfollikel mit wachsendem Haarkeim, »Haarkegel« bzw. neuem anagenen Haarfollikel (nach Schwarz und Meyer 1994). 29 4.2.3 Hautdrüsen Es können zwei Arten von Hautdrüsen, die Schlauchdrüsen und die Talgdrüsen, voneinander unterschieden werden. Die Schlauchdrüsen treten als ekkrine (merokrine) und apokrine Schlauchdrüsen auf, wobei ekkrine Drüsen bei den Haussäugetieren selten und nur an unbehaarten Hautbezirken zu finden sind, wie z.B. den Fußballen der Fleischfresser (Meyer et al. 1990; Weyrauch & Smollich 1998; Liebich 1999). 4.2.3.1 Apokrine Schlauchdrüsen, Glandulae tubuliformes apocrinae Diese sind in ihrem Vorkommen ausschließlich an Primärhaarfollikel gebunden. Sie bestehen aus einem Drüsenendstück und einem Ausführungsgang. Das Drüsenendstück ist als sekretorische Einheit mehr oder weniger stark aufgeknäuelt. Es liegt in Höhe der Haarbulbi, also im Grenzbereich von Dermis und Hypodermis. Seine Wand setzt sich aus einer einfachen Lage iso- bis hochprismatischer Drüsenzellen, einer nicht kontinuierlichen Schicht von Myoepithelzellen, einer Basalmembran und einer dünnen Lamina propria zusammen. Das Zytoplasma der aktiven Zellen ist oft vollständig mit Sekretvesikeln angefüllt, welche durch Abschnürung lumennaher Zytoplasmanteile abgegeben werden (apokrine Sekretion). Der Ausführungsgang verläuft entlang des Haarfollikels durch den Haarbalgmuskel und öffnet sich in der Regel oberhalb der Talgdrüseneinmündung in den Haarkanal. Die Sekrete der apokrinen Schlauchdrüsen dienen in erster Linie der Duftmarkierung (Duftstoffe), sowie der Haut- und Haarpflege und haben darüber hinaus bei einigen Säugetierarten (Rind, Pferd) durch Schweißsekretion eine Bedeutung für die Thermoregulation (Meyer et al. 1978c; Schwarz & Meyer 1994; Meyer 1998; Liebich 1999). 4.2.3.2 Talgdrüsen, Glandulae sebaceae Die säckchenförmigen Talgdrüsen liegen jeweils in direkter Verbindung mit einem Haarfollikel (Primär- wie Sekundärhaarfollikel) bzw. einem Haarfollikelbündel oberflächlich im Stratum reticulare der Lederhaut. Dabei kann jeder Haarfollikel eine bis mehrere Talgdrüsen aufweisen. Durch den Zerfall ihrer Zellen, die von der Drüsenperipherie her laufend nachgebildet werden (holokrine Sekretion) produzieren die Talgdrüsen ein talgartiges, fettiges Sekret (Sebum). Dieses wird über einen kurzen Ausführungsgang in den Haarkanal 30 abgegeben und mischt sich dort mit dem Sekret der apokrin sezernierenden Schlauchdrüsen. Auf der Haut- und Haaroberfläche und zwischen den sich ablösenden Zellschichten des Stratum corneum der Epidermis bildet dieses Sekret einen wirksamen Schutzfilm, der gegen UV-Strahlung schützt, die Elastizität von Haut und Haar erhält und einen wasserabstoßenden Effekt hat (Schwarz et al. 1981; Schwarz & Meyer 1994; Meyer 1998). 31 5. Material und Methoden 5.1 Versuchstiere 5.1.1 Cavia aperea f. porcellus Es wurde in dieser Arbeit die Haut von je fünf weiblichen und fünf männlichen, adulten Meerschweinchen untersucht. Es handelt sich bei den Tieren um Laborzuchten des Stammes Dunkin Hartley (DH, Auszucht), welche von Charles River, Sulzfeld bezogen wurden. Die Tiere werden geschlechtergetrennt zu je drei bis vier Tieren in 760 x 560 x 250 mm großen Käfigen gehalten. Diese Käfige aus EN 130 S Noryl sind mit Einstreu (Rettenmeier, ¾ S) und einer zweiten Ebene ausgestattet, die als Laufgang und Unterschlupf dient (Länge 74,5 cm, Breite 20 cm, Höhe 13 cm). Die Fütterung erfolgt ad libitum mit Haltungsfutter für Meerschweinchen (ssniff MS-H) und Heu. Wasser wird in Tränken ad libitum angeboten. Die Raumtemperatur beträgt 22 ± 1°C, die Luftfeuchtigkeit 55 ± 5% und die Tageslänge 12 Stunden entsprechend einem Tag-Nacht-Rhythmus. 5.1.2 Fukomys anselli Es wurde in dieser Arbeit die Haut von je fünf weiblichen und fünf männlichen, adulten Ansells Kleingraumullen untersucht. Es handelt sich bei den Tieren um Wildfänge aus Sambia und deren Labornachzuchten, welche im Fachbereich Zoologie der Universität Duisburg-Essen (Leitung: Herr Prof. Burda) gehalten und von diesem zur Verfügung gestellt wurden. Kolonien, die in der Tierhaltung der Allgemeinen Zoologie der Universität Duisburg-Essen gehalten werden, bestehen aus 2-20 Tieren. Sie setzen sich aus einem reproduktiven Pärchen (Queen und King) und den Nachkommen zusammen. Die Glasterrarien sind 60 cm tief und 45 cm hoch. In ihrer Breite variieren sie je nach Gruppengröße von 40-250 cm. Sie sind mit einer ca. 10 cm hohen Torfschicht gefüllt, was den Tieren das Graben ermöglicht und gleichzeitig den experimentellen Zugriff nicht erschwert. Als Nestmaterial wird den Tieren Zellstoff zu Verfügung gestellt. Zur Beschäftigung sind Tonröhren, Blumentöpfe und Papprollen vorhanden. Die Futterabgabe erfolgt ad libitum mit werktäglicher Fütterung von Möhren und 32 Kartoffeln und zwei mal wöchentlicher Fütterung von Kopfsalat, Äpfeln und handelsüblicher Kleinnagermischung. Wasser wird nicht angeboten, da die Tiere ihren Wasserhaushalt mit der Nahrung regulieren. Die Raumtemperatur beträgt 21°C ± 4°C und die Luftfeuchtigkeit liegt bei 70-80%. 5.2 Vorbereitung zur Probenentnahme Die Meerschweinchen wurden mit 0,25 mg/kg KM Medetomidin i.m. (Domitor von Pfizer, 1 mg/ml) + 60 mg/kg KM Ketamin i.m. (Ketamin von Ceva, 100 mg/ml) narkotisiert und anschließend mit einer Überdosis Pentobarbital i.c. (Eutha 77 von Essex, 400 mg/ml) euthanasiert. Anschließend wurde das Fell der Tiere in den Bereichen rasiert, in welchen anschließend die Hautproben entnommen wurden. Bei den Ansells Kleingraumullen handelte es sich um verstorbene Tiere, welche bereits in 4%igem Formaldehyd fixiert waren. Angaben bezüglich Alter, Todeszeitpunkt und –ursache, sowie Gewichte lagen nicht vor. Aus Tierschutzgründen konnten keine Tiere dieser seltenen Art speziell für diese Arbeit euthanasiert und fachgerecht perfundiert werden. Daher musste auf das vorliegende Material zurückgegriffen werden. 5.3 Probenentnahme Die Entnahme der 1x1 cm großen Hautproben erfolgte bei beiden Tierarten mittels eines Skalpells an jeweils sechs Körperregionen (Regio colli=1, Regio thoracis vertebralis=2, Regio lumbalis=3, Regio abdominis lateralis=4, Regio umbilicalis=5, Regio pubica=6, Numerierung 1-6 wird in den Tabellen und Diagrammen entsprechend verwendet). Die Proben der zuvor frisch getöteten Meerschweinchen wurden anschließend zunächst auf Pappe aufgespannt und für zwei Wochen in 4,5%iger Formalinlösung (Roti-Histofix, Firma Carl Roth, Karlsruhe) fixiert. 33 Abb. 8: Körperregionen, Nr. 22 entspricht Regio colli, Nr. 40=Regio vertebralis thoracis, Nr. 42=Regio lumbalis, Nr. 33=Regio abdominis lateralis, Nr. 34=Regio umbilicalis, Nr. 38=Regio pubica. Nach Komárek 2000. 5.4 Einbettung Die Proben wurden nach dem Standardverfahren in einer aufsteigenden Alkoholreihe entwässert und in einem Gewebeeinbettautomaten (Shandon Citadel 1000) paraffiniert (vgl. ROMEIS 1989). Anschließend wurden die Präparate in einer Ausgießstation (Shandon Histocentre 3 von Thermo Electron Corporation) ausgerichtet, in Paraffin gegossen und mit einem Spannrähmchen als Halterung für das Schneiden am Mikrotom versehen. Um das Herauslösen der Paraffinblöcke aus der Gießform zu gewährleisten, wurden diese auf der der Ausgießstation zugehörigen Kühlplatte gekühlt. 34 5.5 Schneidetechnik Mit einem manuellen Schlittenmikrotom (Leica RM 2065, Firma Leica, Nussloch) wurden 35 m dicke Sagittalschnitte und 10 m dicke Horizontalschnitte angefertigt, auf Objektträgern fixiert, auf einer Streckbank (Medax Nagel GmbH, Kiel) getrocknet und vor dem Färben für 24 h in einem Wärmeschrank bei 37 °C inkubiert. 5.6 Histologische Färbungen Das Entparaffinieren und Einbringen in Wasser vor dem Färben sowie das Entwässern nach Färben gehen aus den jeweiligen Färbeprotokollen hervor. 5.6.1 Hämatoxylin-Eosin (H.E.) Färbung (Romeis 1989) Es handelt sich hierbei um eine dichromatische Färbung. Durch Hämalaun werden alle sauren beziehungsweise basophilen Stukturen, insbesondere Zellkerne, dunkelblau gefärbt. Durch die Gegenfärbung mit Eosin werden die azidophilen beziehungsweise basischen Strukturen rot gefärbt. Dies führt zu einer rötlichen Färbung des Zytoplasmas und einer Rotfärbung des Kollagens. Die Färbung wurde mit Hilfe einer automatisierten Färbebank von Shandon Linistain (USA) durchgeführt. In Romeis (1989) angegebene Färbezeiten verkürzten sich hierdurch. - Färbeablauf: 2 x 5 min Xylol-Ersatzstoff (Shandon Xylene Substitute, Thermo scientific, United Kingdom) 1 große Küvette 100%iges Ethanol Je 1 kleine Küvette 96%iges und 70%iges Ethanol 1 kleine Küvette fließendes Wasser 1 kleine und eine große Küvette Hämalaunlösung (Mayers Hämalaunlösung Firma Merck) 3 kleine Küvetten fließendes Wasser 1 kleine Küvette 100%iges Ethanol 2 große Küvetten Eosinlösung (10 g Eosin G 1 kleine Küvette fließendes Wasser 1000 ml 70%iges Ethanol 2 ml Eisessig) 35 1 kleine Küvette 96%iges Ethanol 2 große und 1 kleine Küvette 100%iges Ethanol 10 min in Xylol-Ersatzstoff Eindecken mit Shandon Xylene Substitute Mountant 5.6.2 Toluidinblau-Färbung nach Richardson et al. (1960) Hierbei handelt es sich um eine monochromatische Färbung, bei welcher sich das Gewebe unterschiedlich stark blau färbt. - Färbeablauf: 2 x 5 min Xylol-Ersatzstoff je 3 min in 100%igem, 96%igem, 80%igem, 70%igem Ethanol 5 min Aqua dest. 1-2 min Toluidinblaulösung (1 g Toluidinblau O 1 g Natriumtetraborat 0,2 g Paraformaldehyd ad 100 ml Aqua dest.) 1:5 mit Aqua dest. verdünnt spülen in Aqua dest 3 x in 80%igem Ethanol spülen, bis die gewünschte Farbintensität erreicht ist kurz abspülen in 96%igem Ethanol kurz abspülen in 100%igem Ethanol 2 x 5 min Xylol-Ersatzstoff Eindecken mit Shandon Xylene Substitute Mountant 5.6.3 Trichromatische Bindegewebsfärbung nach Masson-Goldner (aus Romeis 1989) Durch diese Färbung werden zum einen Epithel und Bindegewebe und zum zweiten die einzelnen Bindegewebskomponenten unterschiedlich angefärbt und somit gut voneinander differenzierbar. Die Zellkerne werden blauschwarz, Epithel und Hornzellen rot bis gelborange, das Zytoplasma rot, Kollagen grün, Nervenzellen blassgrün und die Muskulatur hellrot gefärbt. . 36 - Färbeablauf: 2 x 10 min Xylol-Ersatzstoff 2 x 10 min 100%igem Ethanol je 5 min in 96%igem, 90%igem, 80%igem und 70%igem Ethanol 5 min Aqua dest. 1 x 2 min in Weigerts Eisenhämatoxylinlösung (Hämatoxylin-Lösung: 1 g Hämatoxylin in 100 ml 96%igem Ethanol lösen und 1 Woche reifen. Eisenchlorid-Lösung: 1,5 g wasserfreies Eisen (III)-chlorid in 100 ml Aqua dest. 1 ml konzentrierte Salzsäure (HCL). Beide Lösungen kurz vor Gebrauch im Verhältnis 1:1 mischen) 10 min in fließendem Wasser auswaschen 5 min Säurefuchsin-Ponceau-Azophloxin-Lösung (Ponceau-Säurefuchsin-Lösung: 0,2 g Ponceau de Xylidine 0,1 g Säurefuchin in 300 ml Aqua dest. lösen. Danach 0,6 ml Eisessig hinzufügen. Azophloxin-Lösung: 0,5 g Azophloxin in 100 ml Aqua dest. lösen. Danach 0,2 ml Eisessig hinzufügen. Beide Lösungen werden im Verhältnis 3:1 gemischt). 2 x kurz in 1%iger Essigsäure abspülen 30 min in Orange G-Differenzierungslösung differenzieren, bis das Bindegewebe völlig entfärbt ist ( 3-5 g Phosphorwolframsäure 2 g Orange G in 100 ml Aqua dest. lösen) 2 x kurz in 1%iger Essigsäure abspülen 5 min. in Lichtgrün gegenfärben (0,1-0,2 g Lichtgrün in 100 ml Aqua dest. lösen. Danach 0,2 ml Eisessig hinzufügen) 1 x kurz in 1%iger Essigsäure abspülen 5 min in 1%iger Essigsäure auswaschen (Färbekörbchen mit Papiertuch abtupfen) kurz in 80%igem Ethanol je 2 x 3 min in 96%igem und 100%igem Ethanol 2 x 3 min Xylol-Ersatzstoff Eindecken mit Shandon Xylene Substitute Mountant 37 5.6.4 Orceinfärbung nach Taenzer-Unna (Unna 1891 aus ROMEIS 1989) Mit dieser Methode werden elastische Fasern rotbraun gefärbt. Entparaffinieren: siehe Toluidinblau, aus 70%igem Alkohol direkt in Orceinlösung - Färbeablauf: 60 min Orceinlösung (1 g Orcein in 100 ml 70%igen Alkohol 1 ml 25%ige HCL) spülen in Aqua dest. 2 min Kernfärbung mit Hämalaun nach Delafield 10 min Bläuen unter fließendem Wasser spülen in 96%igem Ethanol, bis der Hintergrund entfärbt ist 2 min in 100%igem Ethanol 2x 5 min Xylol-Ersatzstoff Eindecken mit Shandon Xylene Substitute 5.7 Messungen am Integument Alle Messungen erfolgten an den histologischen Präparaten mit Hilfe eines speziellen Computerprogramms (Analysis, Version 5.0, Münster, Deutschland) 5.7.1 Messungen an Sagittalschnitten - Dicke der Epidermis und Dermis Pro Tier und Region wurden jeweils 10 Messungen an einem Schnittpräparat durchgeführt, aus welchen der Mittelwert bestimmt wurde. 5.7.2 Messungen an Horizontalschnitten - Anzahl der Haarfollikel pro cm² Es wurden mit Hilfe eines Rasters die Anzahl der Haarfollikel an jeweils drei Stellen eines Schnittpräparates und an insgesamt drei Schnittpräparaten pro Tier und Region gemessen. Hieraus wurde der Mittelwert bestimmt. 38 - Längster und kürzester Durchmesser der Haargruppen, Fläche der Haargruppen Pro Tier und Region wurde jeweils an 10 Haargruppen der längste und kürzeste Durchmesser bestimmt. Hieraus wurde die Fläche der Haargruppen ermittelt. Aus beiden Messungen wurde anschließend der Mittelwert bestimmt. - Anzahl der Haare pro Haargruppe Gleichzeitig mit der Messung der Durchmesser wurde an den jeweiligen Haargruppen die Anzahl der Haare pro Gruppe bestimmt und aus den 10 Messungen pro Tier und Region der Mittelwert bestimmt. 5.8 Mikroskopie und Fotografie Die Hautproben wurden mithilfe eines Lichtmikroskops Leica DMLB und eines Axioskops der Firma Zeiss untersucht. Die Fotos wurden mithilfe einer Canon Powershot A 620 und einer Nikon F5 Digitalkamera angefertigt. 5.9 Statistische Auswertung Es wurde eine statistische Auswertung der Messungen zur Epidermisdicke, Dermisdicke, Fläche der Haargruppen, Anzahl der Haare pro Haargruppe und Follikelzahl- bzw Dichte pro cm² mittels eines Statistikprogramms (SPSS 13.0, SPSS GmbH Software, München) durchgeführt. Zunächst wurden die Daten mit dem Kolmogorov-Smirnov-Anpassungstest auf Normalverteilung überprüft. Da die Daten nicht normalverteilt waren, wurden die weiteren Tests innerhalb einer Art und zwischen den Arten mit dem Mann-Whitney-Test durchgeführt. Hierbei wurde a) innerhalb einer Art ermittelt, ob sich signifikante geschlechtsspezifische Unterschiede ergeben und b) wurden zwischen den Arten jeweils geschlechtergetrennt signifikante Unterschiede ermittelt. Weiterhin wurden die einzelnen Hautregionen miteinander verglichen (Kruskal-Wallis-Test mit anschließendem Tukey-Post-Hoc-Test). Die Korrelationen wurden nach Pearson durchgeführt. 39 6. Ergebnisse 6.1 Epidermis 6.1.1 Cavia aperea f. porcellus Die Epidermis des Hausmeerschweinchens entspricht in den untersuchten Regionen dem bekannten Aufbau der Säugetierepidermis. Sie ist im Mittel beim Weibchen 20,35 - 24,71 µm und beim Männchen 19,95 - 24,98 µm dick (Anhang Tab. 1). Hinsichtlich Geschlecht und Hautregion sind keine signifikanten Unterschiede zu verzeichnen (Abb. 10, Tab. 3 und 5). Das Stratum basale liegt als einschichtige Lage iso- bis hochprismatischer Zellen vor (Abb. 9D). Das Stratum spinosum besteht aus ein bis drei Zelllagen (Abb. 9D). Die Zellkörper haben in den unteren Schichten eine polygonale Form und flachen nach apikal zunehmend ab. In allen Regionen ist ein durchgehendes, ein bis selten zweilagiges Stratum granulosum ausgebildet. Seine Zellen sind flach und besitzen basophile Keratohyalingranula im Zytoplasma (Abb. 9D). Das Stratum corneum lässt sich gut in ein Stratum corneum conjunctum und ein Stratum corneum disjunctum differenzieren (Abb. 9D). An das Stratum granulosum grenzen die flachen, zellkernlosen Zellen des Stratum corneum conjunctum, welche sich dachziegelartig überlappen (Abb. 9D). Das Stratum corneum disjunctum ist in allen untersuchten Hautregionen vorhanden und häufig teilweise von der übrigen Epidermis abgelöst (Fixierungsartefakt). In seiner Ausdehnung erreicht es Dicken bis zur dreifachen Höhe der restlichen Epidermis. Melaningranula wurden in keiner Epidermisschicht nachgewiesen, da es sich bei den untersuchten Tieren um Albinos handelt. Ein Stratum lucidum kann in keiner der untersuchten Hautregionen festgestellt werden. 40 A D E SCD SCC SG SS SB D E SK FG HM SP B SP SR SR F C SP Abb. 9: Übersicht der Hautschichten von Cavia aperea f. porcellus. - A: Übersicht der Hautschichten: Epidermis (E), Dermis (D) und Subkutis (SK) mit Fettgewebe (FG) und Hautmuskel (HM), Sagittalschnitt, die Follikel sind quer geschnitten, HE, 250x, Regio vertebralis thoracis. B: Verteilung der elastischen Fasern im Str. papillare (SP) und Str. reticulare (SR) dermidis (Pfeile), Sagittalschnitt, die Follikel sind quer geschnitten, Orc, 100x, Regio lumbalis. C: Heranziehen der elastischen Fasern an die Basalmembran (Pfeile) und parallele Anordnung der elastischen Fasern (Blockpfeil) im Str. papillare dermidis (SP), Sagittalschnitt, Orc, 400x, Regio colli. D: Übersicht Epidermis: Str. basale (SB), Str. spinosum (SS), Str. granulosum (SG), Str. corneum conjunctum (SCC), Str. corneum disjunctum (SCD), Sagittalschnitt, HE, 400x, Regio colli. E: Übersicht Dermis: Anordnung der kollagenen Fasern im Str. papillare (SP) und Str. reticulare (SR) dermidis, Sagittalschnitt, die Follikel sind quer geschnitten, MG, 100x, Regio vertebralis thoracis. F: Anordnung der elastischen Fasern im Str. papillare dermidis (Pfeile). Die Fasern ziehen an die Haarfollikel heran, Horizontalschnitt, Orc, 100x, Regio vertebralis thoracis. HE: Hämatoxylin-EosinFärbung, MG: Masson-Goldner-Färbung, Orc: Orcein-Färbung 41 Abb. 10 (links): Vergleich der Dicke der vitalen Epidermis in den untersuchten Hautregionen bei weiblichen und männlichen Cavia aperea f. porcellus. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): Keine signifikanten Unterschiede bei Weibchen und bei Männchen. Abb. 11 (rechts): Vergleich der Dicke der vitalen Epidermis in den untersuchten Hautregionen bei weiblichen und männlichen Fukomys anselli. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): Keine signifikanten Unterschiede bei Weibchen; hoch signifikante Unterschiede zwischen R 1 (Regio colli) und R 5, signifikante Unterschiede zwischen R 1 und R 4 und zwischen R 2 und R 4, 5 und Trends zwischen R 1 und R 2, 3 und zwischen R 5 und R 6 bei Männchen. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 6.1.2 Fukomys anselli Die Epidermis des Kleingraumulls weicht in den untersuchten Regionen nicht vom bekannten Aufbau der Säugetierepidermis ab. Sie ist im Mittel beim Weibchen 6,38 - 7,81 µm und beim Männchen 8,05 - 10,79 µm dick (Anhang Tab. 1). Dabei ist im Geschlechtervergleich die Epidermis der männlichen Tiere in der Regio vertebralis thoracis und der Regio lumbalis signifikant dicker (Abb. 11, Tab. 3). Innerhalb der Regionen sind bei den Weibchen keine signifikanten Unterschiede zu verzeichnen, beim Männchen ist die Epidermis der Regio colli und Regio vertebralis thoracis signifikant dicker als die der Regio abdominis lateralis und Regio umbilicalis (Abb. 11, Tab. 5 und 7). 42 AE D D E SCD SCC SG SS SB SP FG SK HM SR B F SP SR SK C EF EF Abb. 12: Übersicht der Hautschichten bei Fukomys anselli. - A: Übersicht der Hautschichten: Epidermis (E), Dermis (D) und Subkutis (SK) mit Hautmuskel (HM) und Fettgewebe (FG); die Haare befinden sich alle im Telogen, Sagittalschnitt, MG, 100x, Regio vertebralis thoracis. B: Anordnung der Haarfollikel in den Hautschichten: lose Deckhaargruppen in der Subkutis (SK), gruppierte Verbunde aus Deck,- und Wollhaaren (Kreis) im Str. retikulare dermidis (SR) und Str. papillare dermidis (SP), Sagittalschnitt, die Follikel sind quer geschnitten, HE, 100x, Regio colli. C: Anordnung der elastischen Fasern (EF) im Str. papillare dermidis und Heranziehen an die gruppierten Verbundfollikel. Compound (kleiner Kreis), Haargruppe (großer Kreis), Horizontalschnitt, Orc, 200x, Regio vertebralis thoracis. D: Übersicht Epidermis: Str. basale (SB), Str. spinosum (SS), Str. granulosum (SG), Str. corneum conjunctum (SCC), Str. corneum disjunctum (SCD), Sagittalschnitt, HE, 1000x, Regio pubica. E: Übersicht Dermis: Anordnung der kollagenen Fasern im Str. papillare (SP) und Str. reticulare dermidis (SR), Sagittalschnitt, HE, 200x, Regio pubica. F: Anordnung der elastischen Fasern (EF) zu einem dichten Filz im Str. reticulare dermidis, Horizontalschnitt, 100x, Orc, Regio colli. HE: Hämatoxylin-EosinFärbung, MG: Masson-Goldner-Färbung, Orc: Orcein-Färbung 43 Die Zellen des einschichtigen Stratum basale sind isoprismatisch (Abb. 12D). Melaningranula können nicht nachgewiesen werden. Ein Stratum spinosum ist als einlagige, selten zweilagige Schicht vorhanden, die Zellen sind isoprismatisch und polygonal, nach oben hin sind sie häufig flach (Abb. 12D). In einigen, lokal begrenzten Bereichen kann ein dünnes, einlagiges Stratum granulosum mit sehr flachen Zellen dokumentiert werden (Abb. 12D). Das Stratum corneum lässt sich beim Mull in zwei Schichten differenzieren. Das Stratum corneum conjunctum ist als dünne Schicht übereinandergelagerter Hornschuppen erkennbar, welche fest mit dem Stratum granulosum verbunden sind. Ein locker strukturiertes Stratum corneum disjunctum ist in den Regel von der restlichen Epidermis abgelöst (Fixierungsartefakt, Abb. 12D). Es erreicht Dicken bis zur 0,5-fachen Höhe der restlichen Epidermis. Ein Stratum lucidum kann in keiner der untersuchten Hautregionen festgestellt werden. Abb. 13 (links): Vergleich der Dicke der vitalen Epidermis bei weiblichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. Abb. 14 (rechts): Vergleich der Dicke der vitalen Epidermis bei männlichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 44 6.2 Dermis und Hypodermis 6.2.1 Cavia aperea f. porcellus Die Dermis des Meerschweinchens ist im Mittel beim Weibchen 651,48 - 1814,21 µm und beim Männchen 772,94 - 2253,07 µm dick (Anhang Tab. 2). Im Geschlechtervergeich ist die Dermis der männlichen Tiere in der Regio colli und Regio abdominis lateralis signifikant dicker (Abb. 16, Tab. 3). Im Regionenvergleich fällt bei beiden Geschlechtern eine signifikant dünnere Dermis der Regio umbilicalis und Regio pubica im Vergleich zu allen weiteren Regionen auf. Weiterhin ist die Dermis der Regio colli bei beiden Geschlechtern signifikant dicker als diejenige aller weiteren Regionen excl. der Regio lumbalis bei den Weibchen. Weitere Unterschiede können der Abb. 16 und Tab. 5 und 6 entnommen werden. Beim Meerschweinchen kann die Dermis in ein oberflächliches Stratum papillare und ein tieferes Stratum reticulare eingeteilt werden. Dabei ist die Grenze zwischen beiden Strata nicht immer ganz deutlich (Abb. 9B, 9E). Ein deutlich ausgebildeter Papillarkörper kann beim Meerschweinchen nicht dokumentiert werden (Abb. 9A, 9B, 9E). Das Stratum papillare des Meerschweinchens ist insgesamt dünner als das Stratum reticulare und reicht in etwa bis zur Talgdrüsenmündung der Haarfollikel. Es setzt sich aus einem lockeren Bindegewebe zusammen, welches zahlreiche Fibrozyten und Fibroblasten enthält. Kollagene Fasern formen ein überwiegend horizontales Maschennetzwerk (Abb. 9B, 9E). Zusätzlich bilden elastische Fasern ein scherengitterartiges, dichtes Netz, welches vorwiegend parallel zur Epidermis ausgerichtet ist und subepidermal mit feinen vertikalen Ausläufern an die Basalmembran heranzieht (Abb. 9B, 9C). Sie umgeben dicht die zahlreichen Haarfollikelgruppen und ziehen zwischen ihnen hindurch an einzelne Haarfollikel heran (Abb. 9F). Das zellarme Stratum reticulare besteht aus einem straffen, bindegewebigen Netzwerk kollagener Faserbündel. Die länglichen Kollagenfasern sind scherengitterartig und hauptsächlich oberflächenparallel angeordnet und deutlich dicker als im Stratum papillare (Abb. 9B, 9E). Dieses kollagene Fasergerüst wird von einzelnen elastischen Fasern durchzogen, welche deutlich weitmaschiger angeordnet sind als im Stratum papillare (Abb. 9B). 45 A D PH E SH TD A T B E V N A C N SR A SK V F N A Abb. 15: Gefäßstrukturen in der Haut von Cavia aperea f. porcellus. - A: Subepidermale Kapillarschlingen (Pfeile), Sagittalschnitt, HE, 400x, Regio colli. B: Versorgungstrias bestehend aus Arterie (A), Vene (V) und Nerv (N), Horizontalschnitt; der Nerv ist längs geschnitten, MG, 400x, Regio lumbalis. C: Arterie (A), Vene (V) und Nerv (N) am Übergang von Subkutis (SK) zu Str. reticulare dermidis (SR), Sagittalschitt, MG, 100x, Regio colli. D: Nach subepidermal ziehende Versorgungsstrukturen bestehend aus Vene und Nerv (Blockpfeil) und zirkulär um den Haarfollikel angeordnete Gefäße (Pfeil) in der Dermis. Gemischte Haargruppen bestehend aus Primärhaar (PH) – und Sekundärhaarfollikeln (SH) mit Talgdrüsen (TD). Haare im Anagen (A) liegen neben telogenen Haarfollikeln (T), die Haarfollikel sind quer angeschnitten, Sagittalschnitt, MG, 100x, Regio vertebralis thoracis. E: Zirkulär um den Haarfollikel angeordnete Gefäße (Pfeil), Horizontalschnitt, MG, 200x, Regio vertebralis thoracis. F: Sich aufzweigende Versorgungsstrukturen am Übergang von Subkutis zu Str. reticulare dermidis (Pfeil), Sagittalschnitt, MG, 200x, Regio lumbalis. HE: Hämatoxylin-Eosin-Färbung, MG: Masson-Goldner-Färbung 46 Während das Stratum papillare beim Meerschweinchen dicht von Haarfollikelgruppen besiedelt ist, die aus größeren Deck- und kleineren Wollhaarfollikeln bestehen, befinden sich im Stratum reticulare ausschließlich große Deckhaarfollikel, welche häufig einzeln oder zu zweit, selten in kleineren Gruppen stehen (Abb. 9A, 9B, 9E). Die Subcutis des Meerschweinchens besteht aus einem lockeren, unregelmäßig angeordneten Bindegewebe, welches in den untersuchten Regionen von zahlreichen Gefäßen und Nervensträngen, Fettgewebe und dem Hautmuskel (M. panniculus carnosus) durchzogen ist. Dabei lässt sich ein zweischichtiger Aufbau erkennen. Das an die Dermis angrenzende Gewebe ist sehr reich an Versorgungsstrukturen und enthält teils große Mengen univakuolären Fettgewebes, weshalb es auch als Stratum adiposum subcutis bezeichnet wird. Darunter befindet sich im gesamten Rumpfbereich beim Meerschweinchen der gut ausgebildete Hautmuskel aus quergestreifter Muskulatur, welcher im Flankenbereich auffallend dick ist (Abb. 9A, 15C). Betrachtet man die Versorungsstrukturen der Dermis beim Meerschweinchen von der Subcutis an beginnend, so finden sich hier v.a. im Stratum adiposum subcutis viele, teils sehr große Gefäßstrukturen und dicke Nervenstränge, die häufig als Versorgungstrias, bestehend aus Nerv, Arterie und Vene angeordnet sind (Abb. 15B, 15C). Auch am Übergang zur Dermis und in tiefen Anteilen des Stratum reticulare dermidis zeigt sich eine deutliche Gefäß,- und Nervversorgung mit zum Teil gut sichtbaren Gefäß,- und Nervaufzweigungen (Abb. 15F). Größere, aber auch zunehmend kleinere Gefäße und kleinere Nerven durchziehen die komplette Dermis epidermiswärts (Abb. 15D). Dabei finden sich häufig größere Gefäße rund um und teils zirkulär an Haarfollikeln (Abb. 15D, 15E). Subepidermal befindet sich ein Netz von kleinen Kapillarschlingen (Abb. 15A). 47 Abb. 16 (links): Vergleich der Dicke der Dermis in den untersuchten Hautregionen bei weiblichen und männlichen Cavia aperea f. porcellus. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf mit Tukey-Post-Hoc-Test): Hochsignifikante Unterschiede zwischen R 5 (Regio umbilicalis) und R 1 ,2, 3, 4, zwischen R 6 und R 1, 2 ,3, 4 und zwischen R 1 und R 2, 4, signifikante Unterschiede zwischen R 3 und R 4 und Trends zwischen R 1 und R 3 bei Weibchen; hochsignifikante Unterschiede zwischen R 5 und R 1, 2, 3, 4, zwischen R 6 und R 1, 2 ,3, 4 und zwischen R 1 und R 2, 3, 4 und signifikante Unterschiede zwischen R 3 und R 2, 4 bei Männchen. Abb. 17 (rechts): Vergleich der Dicke der Dermis in den untersuchten Hautregionen bei weiblichen und männlichen Fukomys anselli. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): Keine Unterschiede bei Weibchen und bei Männchen. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 6.2.2 Fukomys anselli Die Dermis des Kleingraumulls ist im Mittel beim Weibchen 269,43 - 405,54 µm und beim Männchen 268,02 - 407,71 µm dick (Anhang Tab. 2). Hinsichtlich Geschlecht und Hautregion sind keine signifikanten Unterschiede zu verzeichnen (Abb. 17, Tab. 3 und 5). Ein zellreicheres, dünnes Stratum papillare mit vielen Fibrozyten und Fibroblasten lässt sich beim Graumull nur andeutungsweise von einem zellärmeren, prominenteren Stratum reticulare differenzieren (Abb. 12E, 18A). 48 Sowohl Epidermis als auch Dermis sind präparationsbedingt gefältet, ein deutlich ausgebildeter Papillarkörper kann jedoch nicht gefunden werden (Abb. 12A, 12B, 12E). Die kollagenen Fasern sind in der gesamten Dermis vorwiegend horizontal ausgerichtet und sehr strukturiert angeordnet. In oberen Abschnitten sind sie parallelfaseriger, in tieferen Abschnitten sind sie netzförmig angeordnet. Insgesamt sind sie länglich, gewellt und schlank und nehmen an Dicke in die Tiefe gehend nur geringfügig zu (Abb. 12E, 22A). Die elastischen Fasern bilden in den oberen Dermisschichten ein feines Gitternetz (Abb. 12C). Auffallend ist ein sehr prominenter, dichter „Filz“ elastischer Fasern in der tiefen, an die Subcutis angrenzenden Dermis, welcher vorwiegend parallelfaserig um die einzelnen Haarfollikelgruppen angeordnet und deutlich dicker als in oberen Abschnitten ist (Abb. 12F). Beim Graumull finden sich prominente Haarfollikel bereits in der Subcutis (Abb. 12B). Follikel in der anagenen Phase ziehen bis an das Stratum adiposum subcutis heran und sind in den tiefen Abschnitten bereits in Haargruppen angeordnet (Abb. 12B, 12F, 18D, 18F). In der höheren Dermis gruppieren sich zu diesen Haargruppen zusätzlich feinere Haarfollikel (Abb. 12B, 22A). Die Subcutis des Mulles lässt sich in zwei Strata einteilen. Das an die Dermis angrenzende Stratum adiposum subcutis weist eine papilläre Struktur auf und umgibt mit seinem Fettwebe teilweise röhrenförmig die Haarfollikelgruppen (Abb. 12A, 18D). In das darunter gelegene Stratum fibrosum subcutis ist der Hautmuskel eingebettet, welcher in allen untersuchten Regionen sichtbar ist (Abb. 12A, 18A). Auffallend ist ein prominenter Hautmuskel in den dorsalen Rumpfbereichen und dort vor allem im Nackenbereich (Abb. 12a, 12B) im Vergleich zum eher dünnen Hautmuskel in abdominalen Körperregionen (Abb. 18A). Die ventralen Hautabschnitte der Subcutis enthalten weniger Fettgewebe als die dorsalen Hautregionen (Abb. 12A, 12B, 18A). Die Versorgungsstrukturen des Graumulles liegen häufig als Trias aus Arterie, Nerv und Vene zusammen (Abb. 18E). Es finden sich vor allem im Subcutisbereich dicke Nerven und begleitende Gefäße, die häufig oberhalb entlang des Hautmuskels entlangziehen (Abb. 18A, 18B, 18C, 18E). Auch in tieferen Dermisbereichen zeigt sich eine deutliche Gefäß- und Nervversorgung (Abb. 18A). Teils größere, aber auch zunehmend kleinere Gefäßstrukturen und kleinere Nerven durchziehen die komplette Dermis epidermiswärts (Abb. 18A, 18D). 49 A SP D SR SAS VF SRS HM B E A V N HM C F VF HM Abb. 18: Versorgungsstrukturen der Haut bei Fukomys anselli. - A: Gefäße (Doppelpfeil) im Str. retikulare subkutis (SRS) oberhalb des Hautmuskels (HM) und Str. adiposum subkutis (SAS). Ferner nach epidermal ziehende Gefäße im Str. retikulare (Blockpfeil) und Str. papillare (Pfeil) der Dermis, Sagittalschnitt, HE, 100x, Regio umbilicalis. B: Großer Nerv in der Subkutis (Pfeil), Sagittalschnitt, MG, 100x, Regio umbilicalis. C: Sich aufzweigende Gefäße im Str. adiposum subkutis (Pfeil) oberhalb des Hautmuskels (HM), Sagittalschnitt, HE, 200x, Regio umbilicalis. D: Parallel zu den Haarbalgmuskeln (Pfeile) der Verbundfollikel (VF) nach epidermal ziehende Gefäße (Blockpfeil), Sagittalschnitt, HE, 100x, Regio vertebralis thoracis. E: Versorgungstrias aus Arterie (A), Vene (V) und Nerv (N) in der Subkutis oberhalb des Hautmuskels (HM), Horizontalschnitt, MG, 400x, Regio colli. F: Prominente Gefäße (Pfeile) in Nachbarschaft zu Verbundfollikeln (VF), Sagittalschnitt, MG, 100x, Regio vertebralis thoracis. HE: Hämatoxylin-Eosin-Färbung, MG: Masson-Goldner-Färbung 50 Darüber hinaus sind recht prominente Gefäße und Nerven auffällig, welche parallel und häufig entlang von Follikelgruppen epidermiswärts ziehen (Abb. 18D, 18F). Es zeigen sich bei der Untersuchung weiterhin sehr gut durchblutete ventrale Hautabschnitte (Abb. 18A). Abb. 19 (links): Vergleich der Dicke der Dermis bei weiblichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. Abb. 20 (rechts): Vergleich der Dicke der Dermis bei männlichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 6.3 Haarfollikel 6.3.1 Cavia aperea f. porcellus Die Haarfollikel des Hausmeerschweinchens variieren hinsichtlich ihrer Größe und Einsenktiefe je nach Lokalität deutlich. Während große, häufig einzeln oder in kleinen Gruppen stehende Haarfollikel im Stratum reticulare der Dermis zu finden sind, sieht man gemischte, aus kleineren und größeren Haarfollikeln bestehende Gruppen ausschließlich weiter epidermiswärts im Stratum papillare und im hohen, angrenzenden Stratum reticulare (Abb. 9B, 9E). 51 A Hux Hen M R HK ScK äWS bWS B TD C P D E F T A Abb. 21: Der Aufbau des Haarfollikels von Cavia aperea f. porcellus. - A: Aufbau von Haar und Haarfollikel: Großes Bild: Das Haar, bestehend aus Haarmark (M), Haarrinde (R) und Haarkutikula (HK), wird von innen nach außen von der inneren epithelialen Wurzelscheide, bestehend aus Scheidenkutikula (ScK), Henle – und Huxley-Schicht, der äußeren epithelialen Wurzelscheide (äWS) und der bindegewebigen Wurzelscheide (bWS) des Haarfollikels umgeben. Die Blockpfeile zeigen den Beginn der Keratinisierung von Haarmark und Huxley-Schicht, Sagittalschnitt, MG, 400x, Regio colli. Inset: Es sind die länglichen, spindelförmigen Zellkerne von Haarrinde und Huxley-Schicht sichtbar (Pfeile), Sagittalschnitt, HE, 400x, Regio colli. B: Besenförmiges Aussehen des Telogenhaares durch Verankerung von Ausläufern keratinisierter Rindenzellen im Haarfollikel, Sagittalschnitt, MG, 200x, Regio colli. C: Haarbulbus mit Haarpapille (P) und Matrixzellen (Pfeilspitze). Beginn der Keratinisierung von Haarrinde und - kutikula (Pfeil) und Henle-Schicht (Blockpfeil), Sagittalschnitt, MG, 200x, Regio colli. D: Speichenförmige Anordnung der Zellen der äußeren epithelialen Wurzelscheide des Telogenhaarfollikels, Horizontalschnitt, HE, 400x, Regio colli. E: In unterschiedlichen Haarzyklen benachbarter Haarfollikel: Telogener (T) neben anagenen Haarfollikeln (A), Horizontalschnitt, MG, 200x, Regio colli. F: Reduktion der inneren epithelialen Wurzelscheide (Pfeil), Sagittalschnitt, MG, 400x, Regio colli. HE: Hämatoxylin-Eosin-Färbung, MG: Masson-Goldner-Färbung 52 Dabei befindet sich jeder Haarfollikel in einer individuellen, von benachbarten Haarfollikeln unabhängigen Haarzyklusphase, so dass anagene neben katagenen und telogenen Follikeln zu liegen kommen (Abb. 15D, 21E). An dieser Stelle soll der histologische Aufbau des Meerschweinchenhaarfollikels anhand des anagenen Deckhaarfollikels beschrieben werden, da an diesem im Vergleich zum katagenen und telogenen Haarfollikel alle Schichten des Haares und der Wurzelscheiden vorhanden sind. Am Haar selbst lassen sich das Haarmark, die Haarrinde und die Haarkutikula differenzieren (Abb. 21A). Das Haarmark besteht oberhalb des Bulbus aus mehreren, quer zum Haarlängsschnitt angeordneten Zelllagen, welche nach ihrer Verhornung aus einem Verbund zellkernloser Zellen mit großen, luftgefüllten Hohlräumen bestehen (Abb. 21A). Das Haarmark ist beim Meerschweinchen in etwa zwei bis dreimal so stark wie die Haarrinde. Die Haarrinde besteht im Bulbusbereich des anagenen Haares aus Keratinozyten mit großen Kernen. Diese Zellen werden epidermiswärts zunehmend flacher und enthalten immer größere Mengen Keratins (Abb. 21A). Die Haarkutikula liegt der Haarrinde als einschichtige Lage schuppenartiger, flacher Zellen an. In den histologischen Präparaten ist sie in der Regel von der Scheidenkutikula separiert, wodurch diese als dünne Schicht flacher, ebenfalls dachziegelartiger Zellen sichtbar wird (Abb. 21A). Die Huxley-Schicht ist die prominenteste Schicht der inneren epithelialen Wurzelscheide und kann mehrere Lagen dick sein (Abb. 21A). Ihre Zellen laufen parallel zum Haar, die Zellkerne sind langgestreckt und spindelförmig (Abb. 21A Inset). Auf sie folgt eine flache, einlagige Henle-Schicht (Abb. 21A). Die innere epitheliale Wurzelscheide wird im mittleren Bereich der Haarpapille zum ersten Mal sichtbar, proximal ist sie bis zum Bereich unterhalb des Talgdrüsenausführungsganges vorhanden (Abb. 21C, 21F). Im Sagittalschnitt sieht man, dass die Keratinisierung des Haares von der Haarrinde und Haarkutikula aus beginnt. An der inneren epithelialen Wurzelscheide beginnt sie von der Henle-Schicht aus. Weiter epidermiswärts kommt es zur kompletten Verhornung von Haar und innerer epithelialer Wurzelscheide (Abb. 21A, 21C). Im distalen Follikelbereich wird die äußere, epitheliale Wurzelscheide auf mittlerer Höhe des Haarbulbus als ein- bis zweilagige Schicht flacher Zellen das erste Mal sichtbar, in höheren Abschnitten können die Zellen im anagenen Primärhaarfollikel bis zu fünf, im anagenen Sekundärhaarfollikel bis zu drei Lagen dick sein 53 (Abb. 21C,21D). Am Haarschaft gehen sie in die Epidermis über (Abb. 27D). Die Zellen der äußeren epithelialen Wurzelscheide des telogenen Haarfollikels sind hochprismatischer und eher speichenförmig um das Haar angeordnet (Abb. 21D). Die dünne Basalmembran, welche die äußere epitheliale Wurzelscheide von der bindegewebigen Wurzelscheide trennt, ist lichtmikroskopisch nicht sichtbar. Der gesamte Follikel wird von einer bindegewebigen Wurzelscheide aus elastischen und kollagenen Fasern umschlossen (Abb. 21A, 27F). Hierbei lässt sich ein zweischichtiger Aufbau erkennen. Einer inneren Faserschicht, welche zirkulär um den Haarfollikel angeordnet ist, folgt eine äußere Schicht längsorientierter Fasern (Abb. 27C). An Schnitten, die mit Orcein angefärbt wurden, wird sichtbar, dass die elastischen Fasern dicht an den einzelnen Haarfollikel heranziehen, ihn zirkulär umgeben und speichenförmig zwischen die Follikel einer Haargruppe ausstrahlen (Abb. 9F). Gleichzeitig wird die gesamte Haargruppe von elastischem und kollagenem Bindegewebe ummantelt und auf diese Weise von nachbarschaftlichen Haargruppen separiert (Abb. 9F, 27A). Die langgestreckte, schmale dermale Papille des anagenen Haarbulbus besteht aus Fibroblasten und spärlich vorhandenen, feinen kollagenen und elastischen Fasern (Abb. 21C). Sie wird von kleineren Gefäßen durchzogen. Die Matrixzellen sind längliche, quer zur Dermispapille verlaufende Zellen, welche in der Proliferationszone das Haar und die Schichten der inneren epithelialen Wurzelscheide synthetisieren (Abb. 21C). Während sich der anagene Haarfollikel bis in tiefe, an die Subcutis angrenzende Schichten des Stratum reticulare vorschiebt, ist der telogene Follikel in seiner Länge deutlich reduziert und befindet sich im Stratum papillare und hohen Stratum reticulare dermidis (Abb. 21B). Der telogene Haarfollikel besteht in seinem kolbenförmigen Basalteil nur noch aus Rindenzellen. Ausläufer keratinisierter Zellen strahlen in die Zellen der äußeren epithelialen Wurzelscheide ein und verankern das Haar auf diese Weise im Follikel. Sie verleihen der Haarbasis das besenförmige Aussehen (Abb. 21B). Der Zellball, welcher distal die Anlage der dermalen Papille des neuen Haares bildet, ist lichtmikroskopisch kaum nachweisbar. 54 6.3.2 Fukomys anselli Der histologische Aufbau des Haarfollikels des Graumulles wird aus den in Kapitel 5.3.1 genannten Gründen ebenfalls in der anagenen Haarzyklusphase beschrieben. Beim Mull lässt sich das Haar in ein Haarmark, welches oberhalb des Bulbus eine Zelle breit ist, die Haarrinde und die Haarkutikula aus dachziegelartig übereinandergelagerten Zellen unterscheiden (Abb. 22D). Das Haarmark ist in etwa ein bis zweimal so stark wie die Haarrinde. Die Haarrinde besteht im Bulbusbereich aus Keratinozyten, welche einen länglichen Zellkern besitzen und epidermiswärts zunehmend größere Mengen Keratins enthalten. Haarmark und Haarrinde sind stark melaninhaltig (Abb. 21D). Die Haarkutikula liegt der Haarrinde als flache, einschichtige Lage von Zellen an, welche sich dachziegelartig überlappen (Abb. 21D). Am anagenen Haar ist der längliche Haarbulbus sichtbar, welcher die schmale Dermispapille umschließt. Im Bereich der Haarmatrix befindet sich eine Vielzahl von Melanozyten (Abb. 21D Inset). Die innere epitheliale Wurzelscheide, welche am Haarbulbus im mittleren Bereich der Dermispapille das erste Mal sichtbar wird, lässt lichtmikroskopisch nur andeutungsweise einen dreischichtigen Aufbau erkennen. Die Scheidenkutikula wird bei von ihr abgelösten Haaren als dünne Schicht dachziegelartig überlagerter Zellen sichtbar (Abb. 21D). Auf sie folgt eine sehr dünne, einlagige Huxleyschicht mit spindelförmigen Zellkernen, welche parallel zum Haar angeordnet sind. Eine Henle-Schicht ist nicht von der Huxley-Schicht differenzierbar (Abb. 21D). Die äußere epitheliale Wurzelscheide beginnt beim Graumull im oberen Papillenbereich des Bulbus und umschließt das Haar als eine ein- bis zweilagige, an großen Haaren bis zu dreilagige Epithelschicht (Abb. 21D, 21D Inset). Sie wird von einer bindegewebigen Wurzelscheide aus kollagenen und elastischen Fasern umhüllt (Abb. 21C, 21D). Eine Basalmembran, welche die äußere epitheliale Wurzelscheide von der bindegewebigen Wurzelscheide trennt, ist lichtmikroskopisch nicht sichtbar. Den Aufbau der einzelnen Haargruppen kann man am besten beschreiben, wenn man den Verlauf einzelner Haarfollikel von der Tiefe ausgehend betrachtet: Bis in die Subcutis oberhalb des Hautmuskels heranreichend finden sich die Haarfollikel dickerer Haare, welche zu kleinen Haargruppen angeordnet sind. Dabei sind die einzelnen Follikel dicht von der 55 A B E VF C SH PH GH SK D P M R HK ScK iWS äWS bWS Abb. 22: Der Aufbau des Haarfollikels von Fukomys anselli. - A: Anordnung der Haarfollikel von der Subkutis (SK) bis zur Epidermis (E). Primär- (PH) und Sekundärhaarfollikel (SH) gruppieren sich zu Verbundfollikeln (= Compounds, kleiner Kreis). Mehrere dieser Compounds bilden eine Haargruppe (großer Kreis), Sagittalschnitt, die Compounds sind quer geschnitten, MG, 100x, Regio colli. B: Anlagen der dermalen Papille des neuen Haares unterhalb eines Verbundfollikels (VF) mit telogenen Haarfollikeln (Pfeile), Sagittalschnitt, MG, 100x, Regio umbilicalis. C: Guardhair (GH), welches von einzelnen Haarfollikeln und Haarverbunden umgeben ist, Horizontalschnitt, MG, 200x, Regio vertebralis thoracis. D: Aufbau des Haarfollikels. Großes Bild: Haar, bestehend aus Haarmark (M), Haarrinde (R) und Haarkutikula (HK) und Haarfollikel, bestehend aus Scheidenkutikula (ScK), innerer epithelialer Wurzelscheide (iWS), äußerer epithelialer Wurzelscheide (äWS) und bindegewebiger Wurzelscheide (bWS), Sagittalschnitt, HE, 400x, Regio abdominis lateralis. Inset: Haarbulbus mit Haarpapille (P), Sagittalschnitt, MG, 400x, Regio lumbalis. HE: Hämatoxylin-Eosin-Färbung, MG: Masson-Goldner-Färbung 56 bindegewebigen Wurzelscheide und im Bereich der Subcutis von Fettgewebe umhüllt (Abb. 12B, 12F). Desweiteren ist die gesamte Haargruppe durch zirkulär verlaufende Bindegewebssepten von anderen Gruppen separiert (Abb. 22A, 36D). In Sagittalschnitten wird sichtbar, dass weiter oberhalb kleine Wollhaare seitlich an die Deckhaare heranziehen und mit diesen in einem gemeinsamen Haartrichter münden (Abb. 12A, 12B, 22A). Auf dem Horizontalschnitt ist nachzuweisen, dass sich in mittleren Dermisanschnitten neben den einzelnen, dickeren Haarfollikeln kleinere, zusätzliche Follikel befinden, so dass eine Haargruppe in mehrere Haarverbunde, sogenannte Compounds, unterteilt wird. Dieser Compound entspricht einem kolbenförmigen Haartrichter, in welchen mehrere Haarfollikel münden (Abb. 42B). Dabei gehen die Follikelscheiden der einzelnen Haare nach und nach zugrunde, so dass in kurz unter der Epidermis geführten Schnitten im Bereich des Trichterhalses die Haare eng nebeneinander liegen (Abb. 12B, 13B, 22A). Sie sind durch Sebum und desquamierte Epithelzellen miteinander verkittet und münden scherengitterartig an der Hautoberfläche, ohne in eine einheitliche Richtung zu zeigen (Abb. 12A, 36B, 42A). Der Haartrichter selbst ist innen mit verhorntem Epithel ausgekleidet und geht oberflächlich in die Epidermis über (Abb. 12A, 36B). Die bindegewebige Struktur der einzelnen Follikel wird durch ihr enges Aneinanderliegen in mittleren und höheren Dermisabschnitten aufgelöst. Hier wird zum einen der einzelne Compound, zum zweiten die gesamte Haargruppe, dicht von einem bindegewebigen Netz aus kollagenen und elastischen Fasern ummantelt (Abb. 12B, 12C, 22A). Man kann also beim Mull von gruppierten Verbundfollikeln sprechen, da mehrere Compounds zu einer Gruppe zusammengeschlossen sind. Neben dickeren Deck- und dünneren Wollhaaren findet sich gelegentlich ein dritter Haartyp, welcher sich bis in tiefe Subcutisschichten einsenkt. Diese Haare sind deutlich größer als die Deckhaare, stehen einzeln und werden von einzelnen Haaren und Haarverbunden umkreist (Abb. 22C). Sie weisen eine prominente, dreischichtige innere Wurzelscheide, eine bis zu drei Schichten dicke äußere epitheliale Wurzelscheide und eine prominente bindegewebige Wurzelscheide auf (Abb. 22C). Sie können als Leithaare (Guardhairs) definiert werden. 57 Beim Ansells Kleingraumull scheinen sich in den histologischen Schnitten benachbarte Haare in der gleichen Haarzyklusphase zu befinden, innerhalb eines Anschnittes können in verschiedenen Regionen jedoch mehrere Zyklusphasen angetroffen werden (Abb. 12A). Das telogene Haar besteht in seinem kolbenförmigen Basalteil nur noch aus Rindenzellen. Durch Ausläufer keratinisierter Zellen, welche in die äußere epitheliale Wurzelscheide strahlen, erhält die Haarbasis ihr besenförmiges Aussehen (Abb. 12A). Das Haar wird auf diese Weise im Follikel verankert. Weiterhin ist beim telogenen Haar unterhalb der äußeren epithelialen Wurzelscheide häufig ein ballförmiger Zellhaufen als Anlage für die dermale Papille des neuen Haares erkennbar (Abb. 22B). 6.4 Haarfollikeldichte 6.4.1 Cavia aperea f. porcellus Beim Meerschweinchen beträgt die Haardichte im Mittel beim Weibchen 2275,6 - 3166,8 und beim Männchen 2211 - 3075,4 Haarfollikel pro cm² (Anhang Tab. 3). Im Vergleich der Geschlechter sind keine signifikanten Unterschiede zu verzeichnen (Abb. 23, Tab. 3). Im Regionenvergleich fällt bei den Weibchen eine signifikant kleinere Haardichte in der Regio vertebralis thoracis und Regio lumbalis im Vergleich zur Regio umbilicalis und Regio pubica auf. Bei Männchen fällt eine signifikant höhere Haardichte in der Regio colli im Vergleich zur Regio vertebralis thoracis, Regio lumbalis und Regio abdominis lateralis auf. Weitere Unterschiede können der Abb. 23 und Tab. 5 und 6 entnommen werden. 6.4.2 Fukomys anselli Beim Ansells Kleingraumull beträgt die Haardichte im Mittel beim Weibchen 6053 - 17857,8 und beim Männchen 4204,4 - 16800,2 Haarfollikel pro cm² (Anhang Tab. 3). Im Vergleich der Geschlechter sind keine signifikanten Unterschiede zu verzeichnen (Abb. 24, Tab. 3). Im Regionenvergleich fällt sowohl bei den Weibchen als auch bei den Männchen eine signifikant kleinere Haardichte in der Regio pubica und Regio umbilicalis im Vergeich zur Regio colli, Regio vertebralis thoracis und Regio lumbalis auf. Darüber hinaus ist die Haardichte in der Regio colli und Regio vertebralis thoracis bei den Weibchen signifikant größer als die der 58 Regio lumbalis und Regio abdominis lateralis, bei den Männchen als die der Regio abdominis lateralis. Weitere Unterschiede können der Abb. 24 und Tab. 5 und 7 entnommen werden. Abb. 23 (links): Vergleich der Haarfollikel- bzw. Haardichte in den untersuchten Hautregionen bei weiblichen und männlichen Cavia aperea f. porcellus. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): Hochsignifikante Unterschiede zwischen R 2 (Regio vertebralis thoracis) und R 1, 5, 6, signifikante Unterschiede zwischen R 3 und R 5, 6 und Trends zwischen R 1 und R 3 bei Weibchen; hochsignifikante Unterschiede zwischen R 1 und R 2, 4, signifikante Unterschiede zwischen R 1 und R 3 und zwischen R 5 und R 2 ,4 und Trends zwischen R 1 und R 5, 6 bei Männchen. Abb. 24 (rechts): Vergleich der Haarfollikel- bzw. Haardichte in den untersuchten Hautregionen bei weiblichen und männlichen Fukomys anselli. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): Hochsignifikante Unterschiede zwischen R 1 (Regio colli) und R 3, 4, 5, 6, zwischen R 2 und R 4, 5, 6 und zwischen R 3 und R 6, signifikante Unterschiede zwischen R 3 und R 2, 5 und zwischen R 4 und R 6 und Trends zwischen R 4 und R 5 bei Weibchen; hochsignifikante Unterschiede zwischen R 1 und R 3, 4, 5, 6 und zwischen R 2 und R 5,6 , signifikante Unterschiede zwischen R 2 und R 4 und zwischen R 3 und R 5, 6 und Trends zwischen R 4 und R 6 bei Männchen. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 59 Abb. 25 (links): Vergleich der Haarfollikel- bzw. Haardichte bei weiblichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. Abb. 26 (rechts): Vergleich der Haarfollikel- bzw. Haardichte bei männlichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 6.5 Größe und Anordnung der Haargruppen 6.5.1 Cavia aperea f. porcellus Beim Meerschweinchen beträgt die Fläche der Haargruppen im Mittel beim Weibchen 71848 - 231262 µm² und beim Männchen 93079 - 239792 µm² (Anhang Tab. 6). Im Geschlechtervergleich ist die Fläche der Regio abdominis lateralis beim Männchen signifikant größer (Abb. 28, Tab. 3). Im Regionenvergleich ist bei Weibchen und Männchen die Fläche der Haargruppen in der Regio umbilicalis und Regio pubica signifikant kleiner als der übrigen Regionen excl. der Regio lumbalis. Weiterhin ist bei beiden Geschlechtern die Regio colli signifikant größer als die Regio lumbalis. Weitere Unterschiede können der Abb. 28 und Tab. 5 und 6 entnommen werden. 60 A B ZPH LPH SH LPH TD C D E E F R bWS äWS HK ScK M iWS Abb. 27: Haargruppen und Haarbalgmuskel von Cavia aperea f. porcellus. - A: Anordnung der Haargruppen transversal zur Körperachse. Horizontalschnitt, T, 25x, Regio colli. B: Haargruppe aus Primär- (PH) und Sekundärhaarfollikeln (SH) mit Talgdrüsen (TD). Zentraler- (ZPH) und laterale Primärhaarfollikel (LPH) sind in Form eines angedeuteten Dreiecks zueinander angeordnet, Horizontalschnitt, HE, 100x, Regio vertebralis thoracis. C: Haargruppe aus Primär- und Sekundärhaaren. Die zirkuläre Anordnung der kollagenen Fasern der bindegewebigen Wurzelscheide ist sichtbar (Pfeil), Horizontalschnitt, HE, 200x, Regio lumbalis. D: Verlauf des M. arrector pili (Pfeil), Sagittalschnitt, HE, 100x, Regio colli. E: Elastische Aufhängung des Haarbalgmuskels (Pfeil) im St. papillare dermidis unterhalb der Epidermis (E), Sagittalschnitt, Orc, 200x, Regio colli. F: Elastische Aufhängung des Haarbalgmuskels (Pfeil) an der bindegewebigen Wurzelscheide (bWS) des Haarfollikels. Weiterhin sind die äußere epitheliale Wurzelscheide (äWS), die innere epitheliale Wurzelscheide und die Scheidenkutikula (ScK) des Haarfollikels, sowie das Haar mit Mark (M), Rinde (R) und Haarkutikula (HK) sichtbar, Sagittalschnitt, Orc, 400x, Regio colli. HE: HämatoxylinEosin-Färbung, Orc: Orcein-Färbung, T: Toluidinblau-Färbung 61 Die Anzahl der Haarfollikel pro Haargruppe beträgt im Mittel beim Weibchen 6,32 - 9,84 und beim Männchen 6,08 - 10,2 (Tab. 1) . Tab. 1: Mittlere Anzahl der Haarfollikel pro Haargruppe bei Cavia aperea f. porcellus (n=5 pro Geschlecht, Standardabweichungen in Klammern). C. a. porcellus ♀ C. a. porcellus ♂ Regio colli Regio vertebralis thoracis Regio lumbalis Regio abdominalis lateralis Regio umbilicalis Regio pubica 9,52 (±0,82) 7,42 (±0,75) 6,98 (±0,33) 9,84 (±0,45) 7,68 (±0,54) 6,32 (±0,73) 10,2 (±0,22) 7,66 (±0,40) 6,4 (±1,1) 9,1 (±1,18) 7,84 (±0,92) 6,08 (±1,03) Sie unterscheidet sich beim Meerschweinchen zwischen den Geschlechtern nicht signifikant (Abb. 32, Tab. 3). Im Regionenvergleich befindet sich sowohl bei den Weibchen als auch bei den Männchen in der Regio colli eine signifikant höhere Anzahl an Haarfollikeln pro Haargruppe im Vergleich zu allen anderen Regionen excl. der Regio abdominis lateralis. Weiterhin ist bei beiden Geschlechtern die Anzahl der Haarfollikel pro Haargruppe in der Regio pubica signifikant kleiner als in allen weiteren Regionen excl. der Regio lumbalis. Weitere Unterschiede können der Abb. 32 und Tab. 5 und 6 entnommen werden. Korreliert man die Anzahl der Haarfollikel pro Haargruppe mit der Fläche der Haargruppen, so sieht man, dass die Haarfollikelanzahl pro Gruppe bei weiblichen und männlichen Cavia aperea f. porcellus signifikant mit der Größe der Haargruppenfläche steigt (Abb. 37 und 38). Beim Meerschweinchen sind ausschließlich einfache Haargruppen sichtbar. Dabei besteht eine Haargruppe häufig aus einem sehr großen, prominenten Haarfollikel (zentraler Primärhaarfollikel), ein bis drei ebenfalls größeren Follikeln (laterale Primärhaarfollikel) und mehreren kleineren Follikeln (Sekundärhaarfollikel, Abb. 27B). Dabei sind die lateralen Primärhaarfollikel neben dem zentralen Primärhaarfollikel häufig leicht versetzt in Form eines angedeuteten Dreiecks angeordnet (Abb. 27B). Zwischen diesen und dem zentralen Primärhaarfollikel sowie distal der lateralen Primärhaarfollikel befinden sich die Sekundärhaarfollikel (Abb. 27B), so dass die Haargruppen insgesamt länglich erscheinen. 62 Dabei kommen mehrere Haargruppen nebeneinander zu stehen, so dass sie lange Haargruppenlinien bilden, welche transversal zur Körperachse hin orientiert sind. Dies ist anhand der abgetrennten Ecke im histologischen Präparat ersichtlich. Diese zeigt den cranialen, rechten Teil des Hautpräparates bezogen auf die Lage am Tierkörper (Abb. 27A). Es finden sich in den untersuchten Hautregionen in den Bereichen des Nackens und der Flanke die längsten Haargruppen mit bis zu 823 µm, im Schambeinbereich die kürzesten Haargruppen mit bis zu minimal 430 µm (Anhang Tab. 4 und 5). Separiert werden die einzelnen Haargruppen, wie schon bei der Beschreibung der Hautschichten erwähnt, durch ein dichtes Netz aus kollagenen und elastischen Fasern, welche die Haargruppen ummanteln und zwischen einzelne Haarfollikel ziehen (Abb. 9F, 27A, 27C). Abb. 28 (links): Vergleich der Fläche der Haargruppen in den untersuchten Hautregionen bei weiblichen und männlichen Cavia aperea f. porcellus. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): Hochsignifikante Unterschiede zwischen R 6 (Regio pubica) und R 1, 2, 4, zwischen R 5 und R 1, 2, 4 und zwischen R 3 und R 1, signifikante Unterschiede zwischen R 3 und R 2, 6 und zwischen R 1 und R 4 und Trends zwischen R 3 und R 4 bei Weibchen; hochsignifikante Unterschiede zwischen R 6 und R 1, 2, 4, zwischen R 5 und R 1, 2, 4 und zwischen R 3 und R 1, 4, signifikante Unterschiede zwischen R 3 und R 2, 6 und Trends zwischen R 3 und R 5 bei Männchen. Abb. 29 (rechts): Vergleich der Fläche der Haargruppen in den untersuchten Hautregionen bei weiblichen und männlichen Fukomys anselli. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): keine signifikanten Unterschiede bei Weibchen; hochsignifikante Unterschiede zwischen R 5 (Regio umbilicalis) und R 1, 2, 3, signifikante Unterschiede zwischen R 2 und R 6 und Trends zwischen R 2 und R 4 bei Männchen. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 63 Abb. 30 (links): Vergleich der Fläche der Haargruppen bei weiblichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. Abb. 31 (rechts): Vergleich der Fläche der Haargruppen bei männlichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 64 Abb. 32 (links): Vergleich der Anzahl der Haarfollikel pro Haargruppe in den untersuchten Hautregionen bei weiblichen und männlichen Cavia aperea f. porcellus. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): Hochsignifikante Unterschiede zwischen R 1 (Regio colli) und R 2, 3, 5, 6, zwischen R 4 und R 2,3 ,5, 6 und zwischen R 5 und R 6, signifikante Unterschiede zwischen R 2 und R 6 und Trends zwischen R 3 und R 5 bei Weibchen; hochsignifikante Unterschiede zwischen R 1 und R 2, 3, 5, 6, zwischen R 6 und R 2, 4, 5 und zwischen R 3 und R 4, signifikante Unterschiede zwischen R 4 und R 5, 2 und zwischen R 3 und R 2, 5 und Trends zwischen R 1 und R 4 bei Männchen. Abb. 33 (rechts): Vergleich der Anzahl der Haarfollikel pro Haargruppe in den untersuchte Hautregionen bei weiblichen und männlichen Fukomys anselli. Vergleich der Geschlechter (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet; Vergleich der Regionen (Kruskal-Wallis, ggf. mit Tukey-Post-Hoc-Test): Hochsignifikante Unterschiede zwischen R 1 (Regio colli) und R 3, 4, 5, 6, zwischen R 6 und R 2, 3, 4 und zwischen R 2 und R 5 und signifikante Unterschiede zwischen R 5 und R 3, 4 und zwischen R 2 und R 3, 4 bei Weibchen; hochsignifikante Unterschiede zwischen R 1 und R 3, 4, 5, 6, zwischen R 6 und R 2, 3, 4 und zwischen R 5 und R 2, 4, signifikante Unterschiede zwischen R 1 und R 2 und zwischen R 3 und R 5 und Trends zwischen R 2 und R 3 bei Männchen. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 65 Abb. 34 (links): Vergleich der Anzahl der Haarfollikel pro Haargruppe bei weiblichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. Abb. 35 (rechts): Vergleich der Anzahl der Haarfollikel pro Haargruppe bei männlichen Cavia aperea f. porcellus und Fukomys anselli in unterschiedlichen Hautregionen. Vergleich der Arten (Mann-Whitney-U-Test): Signifikante Unterschiede sind gekennzeichnet. ** = hoch signifikant (p < 0,01) * = signifikant (p < 0,05) (*) = Trend (p < 0,1) 6.5.2 Fukomys anselli Beim Ansells Kleingraumull beträgt die Fläche der Haargruppen im Mittel beim Weibchen 17304 - 27946 µm² und beim Männchen 18760 - 37589 µm² (Anhang Tab. 6). Im Geschlechtervergleich sind keine signifikanten Unterschiede zu verzeichnen (Abb. 29, Tab. 3). Im Regionenvergleich sind bei den weiblichen Tieren keine Signifikanzen zu verzeichnen, bei den Männchen fällt eine signifikant kleinere Fläche der Regio umbilicalis im Vergleich zur Regio colli, Regio vertebralis thoracis und Regio lumbalis auf. Weitere Unterschiede können der Abb. 29 und Tab. 5 und 7 entnommen werden. Die Anzahl der Haarfollikel pro Haargruppe beträgt im Mittel beim Weibchen 6,1 - 14,48 und beim Männchen 5,84 - 15,64 (Tab. 2). 66 A VF SK HM B C D E F Abb. 36: Haargruppen und Haarbalgmuskel von Fukomys anselli. - A: Verbundfollikel (VF) mit zugeordnetem M. arector pili (Pfeile) und Talgdrüsen (Blockpfeile), Sagittalschnitt, HE, 100x, Regio lumbalis. B: Verlust einzelner Haarfollikel und Münden der Haare in einem gemeinsamen Epitheltrichter an der Hautoberfläche. Der Pfeil zeigt den gemeinsamen Haarbalgmuskel, Sagittalschnitt, HE, 200x, Regio vertebralis thoracis. C: Elastische Aufhängung des Haarbalgmuskels an der bindegewebigen Wurzelscheide des Haarfollikels (unterer Pfeil) und subepidermal im Str. papillare dermidis (oberer Pfeil), Sagittalschnitt, Orc., 200x, Regio colli. D: Anordnung und Zusammensetzung der zahlreichen Haargruppen in der Regio colli, Horizontalschnitt, MG, 100x. E: Anordnung und Zusammensetzung der vergleichsweise wenigen Haargruppen in der Regio pubica, Horizontalschnitt, MG, 100x. F: Anordnung der Haargruppen transversal zur Körperachse. Horizontalschnitt, T, 25x, Regio vertebralis thoracis. HE: Hämatoxylin-Eosin-Färbung, MG: Masson-Goldner-Färbung, Orc: Orcein-Färbung, T: Toluidinblau-Färbung 67 Tab. 2: Mittlere Anzahl der Haarfollikel pro Haargruppe bei Fukomys anselli (n=5 pro Geschlecht, Standardabweichungen in Klammern). F. anselli ♀ Regio colli 14,48 (±1,43) Regio vertebralis thoracis 13,18 (±2,39) Regio lumbalis 9,94 (±1,62) Regio abdominis lateralis 9,8 (±2,91) Regio umbilicalis 7,14 (±1,80) Regio pubica 6,1 (±1,70) F. anselli ♂ 15,64 (±2,55) 12,38 (±2,30) 9,86 (±2,58) 10,46 (±2,52) 6,42 (±0,98) 5,84 (±0,32) Sie unterscheidet sich beim Ansells Kleingraumull zwischen den Geschlechtern nicht signifikant (Abb. 33, Tab. 3). Im Regionenvergleich fällt bei beiden Geschlechtern eine signifikant kleinere Anzahl an Haarfollikeln pro Haargruppe in der Regio umbilicalis und der Regio pubica im Vergleich zu allen anderen Regionen auf. Weiterhin ist bei beiden Geschlechtern die Anzahl der Haarfollikel pro Haargruppe in der Regio colli signifikant größer als in allen weiteren Regionen excl. der Regio vertebralis thoracis bei den Weibchen. Weitere Unterschiede können der Abb. 33 und Tab. 5 und 7 entnommen werden. Korreliert man die Anzahl der Haarfollikel pro Haargruppe mit der Fläche der Haargruppen, so sieht man, dass die Haarfollikelanzahl pro Gruppe bei weiblichen und männlichen Fukomys anselli signifikant mit der Größe der Haargruppenfläche steigt (Abb. 39 und 40). Beim Ansells Kleingraumull laufen, wie im Kapitel 5.3.2 bereits beschrieben, mehrere Follikel epidermiswärts zusammen und münden in einem gemeinsamen Trichter an der Epidermisoberfläche. Dabei lassen sich größere Haarfollikel, die Primärhaarfollikel, von kleineren Sekundärhaarfollikeln unterscheiden. Mehrere dieser Haarfollikelbündel (Compounds) gruppieren sich zu einer Haargruppe, welche durch ein dichtes Netz aus kollagenen und elastischen Fasern von weiteren Gruppen separiert wird (Abb. 12B, 12C, 22A). Interessant ist bei Fukomys anselli die unterschiedliche Anzahl von Compounds pro Gruppe und die Form der Gruppen in den verschiedenen Hautregionen. Die Haargruppen bestehen im 68 gesamten Rückenbereich häufig aus fünf bis sechs, teilweise aus bis zu acht Compounds. Im Flankenbereich setzt sich eine Gruppe in der Regel aus vier bis sechs Compounds zusammen und im Nabel- und Schambeinbereich findet man überwiegend kleinere Gruppen von durchschnittlich drei Compounds. Auch scheinen die Gruppen im Rücken- und hier vor allem im Nackenbereich insgesamt ovaler und größer zu sein und sind im Vergleich zu den verstreut liegenden, kleinen und eher kugelig wirkenden Gruppen im Nabel- und Schambeinbereich dichter angeordnet (Abb. 22A, 36D, 36E). Die Länge der Haargruppen variiert bei dieser untersuchten Mullart von 165µm im Nabelbereich bis hin zu 228 µm im mittleren Rückenbereich (Anhang Tab. 4 und 5). Da die Kanten der Schnittpräparate im cranialen rechten Bereich bezogen auf die Körperfläche des Tierkörpers entfernt wurden, wird sichtbar, dass die Haargruppen quer zur medianen Körperachse stehen. Dabei sind sie nicht streng linear zueinander angeordnet (Abb. 36F). Wie weiter oben bereits angesprochen, findet sich neben den gruppierten Compounds vereinzelt sehr große, einzeln stehende Haare, welche zirkulär von kleineren, gruppierten Verbundfollikeln umkreist werden (Abb. 22C). Diese konnten in allen untersuchten Hautregionen nachgewiesen werden. 69 Abb. 37 (links): Korrelation von Haarfollikelanzahl pro Haargruppe und Haargruppenfläche bei weiblichen Cavia aperea f. porcellus. p < 0,0001, r = 0,625 Abb. 38 (rechts): Korrelation von Haarfollikelanzahl pro Haargruppen und Fläche der Haargruppen bei männlichen Cavia aperea f. porcellus. p < 0,0001, r = 0,754 Abb. 39 (links): Korrelation von Haarfollikelanzahl pro Haargruppe und Haargruppenfläche bei weiblichen Fukomys anselli. p = 0,034, r = 0,389 Abb. 40 (rechts): Korrelation von Haarfollikelanzahl pro Haargruppen und Haargruppenfläche bei männlichen Fukomys anselli. p = 0,002, r = 0,537 70 6.6 Haarbalgmuskel 6.6.1 Cavia aperea f. porcellus An den Primärhaaren des Meerschweinchens kann der M. arrector pili aus glatter Muskulatur differenziert werden. Er entspringt unterhalb der Talgdrüse an der bindegewebigen Wurzelscheide des Haarfollikels und läuft in einem Winkel von 20° - 30° epidermiswärts, wobei er apikal schmaler wird und unterhalb der Epidermis elastisch im Stratum papillare dermidis aufgehängt ist (Abb. 27D, 27E, 27F). Dabei kann er sich verzweigen (Abb. 27F). 6.6.2 Fukomys anselli Bei Ansells Kleingraumullen ist je ein kräftiger Haarbalgmuskel aus glatter Muskulatur pro Compound auf der Seite ausgebildet, wo der Compound in einem stumpfen Winkel an die Epidermisoberfläche mündet (Abb. 36A, 36B). Dieser entspringt im unteren Drittel des Follikeltrichters, in dem er durch elastische Fasern an der bindegewebigen Wurzelscheide aufgehängt wird. Er zieht in einem Winkel von 40° epidermiswärts, wo er, an elastischen Fasern aufgehängt, im Stratum papillare dermidis ansetzt (Abb. 36A, 36B, 36C). Dabei verzweigt er sich häufig im oberen Bereich (Abb. 36B). 6.7 Hautdrüsen 6.7.1 Cavia aperea f. porcellus Talgdrüsen konnten beim Meerschweinchen in allen untersuchten Hautarealen festgestellt werden. Jedes Haar ist mit ein bis zwei Talgdrüsen ausgestattet. Vereinzelt konnten an Primärhaaren drei, in zwei Fällen bei männlichen Tieren vier Talgdrüsen dargestellt werden (Abb. 41A). In Relation zur Größe der Wollhaare erscheinen die Talgdrüsen ihrer Follikel sehr prominent (Abb. 41B). Die Talgdrüsen des Meerschweinchens sind einlappig, zapfenförmig und liegen radiär um den Haarfollikel herum (Abb. 41C, 41D). Sie sind mit einer Schicht flacher Keimzellen ausgekleidet (Abb. 41C), welche einer lichtmikroskopisch nicht sichtbaren Basalmembran aufliegt. Auf sie folgen die Drüsenzellen, welche zur Mitte der Talgdrüse hin zunehmend größer werden und sie ganz ausfüllen (Abb. 41C). 71 A D HF PH B E HF SH C HK F TD TD äWS Abb. 41: Talgdrüsen von Cavia aperea f. porcellus. - A: Vier Talgdrüsen (Sterne) an einem Primärhaarfollikel (PH) bei einem männlichen Hausmeerschweinchen, Horizontalschnitt, HE, 200x, Regio vertebralis thoracis. B: Sehr prominente Talgdrüsen (Pfeile) an den Sekundärhaarfollikeln (SH), Horizontalschnitt, HE, 400x, Regio lumbalis. C: Längsschnitt einer Talgdrüse (TD) und Mündung in den Haarkanal (HK), Sagittalschnitt, HE, 400x, Regio colli. D: Zirkuläre Anordnung der Talgdrüsen um den Haarfollikel (HF), Horizontalschnitt, HE, 400x, Regio vertebralis thoracis. E: Ausführungsgang (Pfeil) einer Talgdrüse. Die äußere Zellstruktur der Drüsenzellen geht verloren. Sagittalschnitt, der Haarfollikel (HF) ist quer geschnitten, HE, 400x, Regio colli. F: Holokrine Sekretion: Die äußere Struktur der Drüsenzellen geht verloren und sie entleeren ihr Sebum in den Haarkanal, Horizontalschnitt, HE, 400x, Regio lumbalis. HE: Hämatoxylin-Eosin-Färbung 72 Im Bereich des Ausführungsganges geht die äußere Zellstruktur der Drüsenzellen verloren und sie entleeren ihr Sebum mittels holokriner Sekretion über den Ausführungsgang in den Haarkanal (Abb. 41F). Dieser befindet sich im oberen Viertel bis oberen Drittel des Haarfollikels und ist mit einer Lage flacher Epithelzellen ausgekleidet (Abb. 41E). Er mündet in einem Winkel von 20° in den Haarkanal (Abb. 41C). Apokrin sezernierende Schlauchdrüsen konnten in den untersuchten Regionen bei Cavia aperea f. porcellus nicht nachgewiesen werden. 6.7.2 Fukomys anselli Beim Graumull weist jedes Haar mindestens eine Talgdrüse auf , Deckhaare besitzen ein bis zwei Talgdrüsen. Sie sind klein, kugelig und einlappig und münden mit ihrem kurzen Ausführungsgang auf der Hälfte bis im oberen Drittel des Follikels in einem Winkel von 30-40° in den Haarkanal (Abb. 42A, 42A Inset). Um die Haarverbunde herum sind sie zirkulär angeordnet (Abb. 42B, Abb. 42C). Die dünne Keimschicht, welche die Talgdrüse auskleidet, ist lichtmikroskopisch nicht darstellbar. Das Lumen wird von kugeligen Drüsenzellen komplett ausgefüllt, welche ihr Sebum mittels holokriner Sekretion entleeren (Abb. 42A Inset). Apokrin sezernierende Schlauchdrüsen konnten in den untersuchten Regionen bei Fukomys anselli nicht nachgewiesen werden. 6.8 Haarkleid 6.8.1 Cavia aperea f. porcellus In dieser Arbeit wurden die Haut und Haare von Albino- Meerschweinchen des Stammes Dunkin Hartley untersucht. Die Haare sind demnach weißfarben. Die Beschreibung des Haarkleides erfolgt entsprechend der histologischen Untersuchungen in den verschiedenen Hautregionen. In allen untersuchten Regionen ist das Haarkleid gleichmäßig und dicht. Die Haare sind glatt und liegen entsprechend eines nach caudal gerichteten Haarstrichs der Haut flach an. 73 A HK TD B C Abb. 42: Talgdrüsen von Fukomys anselli. - A: Großes Bild: Mündung der Talgdrüse (TD) in den Haarkanal (HK), Sagittalschnitt, HE, 20x, Regio lumbalis. Inset: Kugelige Talgdrüse mit kurzem Ausführungsgang (Pfeil) und holokriner Sekretion (Blockpfeil), Sagittalschnitt, HE, 40x, Regio vertebralis thoracis. B: Haarverbunde (=Compounds, Kreis) aus mehreren Haarfollikeln (Pfeilköpfe) mit zirkulär um die Haarfollikel angeordneten Talgdrüsen (Blockpfeile), Horizontalschnitt, MG, 400x, Regio colli. C: Haargruppe aus mehreren Compounds mit dazugehörigen Talgdrüsen (Pfeilköpfe), Horizontalschnitt, MG, 400x, Regio vertebralis thoracis. HE: Hämatoxylin-EosinFärbung, MG: Masson-Goldner-Färbung 74 Zwar lassen sich längere und gröbere von kürzeren und feineren Haaren unterscheiden, eine Unterwolle ist jedoch nicht sichtbar. Die Haare sind mittelmäßig fest in der Haut verankert und lassen sich manuell gut auszupfen. Im Nacken- und gesamten Rückenbereich sind deutlich längere und gröbere Haare sichtbar als in den restlichen, untersuchten Bereichen. In der Flankenregion werden die Haare erkennbar kürzer und feiner, in der Bauch- und Schambeinregion sind sie kurz und fein. 6.8.2 Fukomys anselli Die Beschreibung der Haare von Fukomys anselli erfolgt entsprechend der histologischen Untersuchungen in den verschiedenen Hautuntersuchungen. Die Haare sitzen beim Ansells Kleingraumull fest in der Haut und sind manuell nicht ohne weiteres auszupfbar. Die Haarfarbe der Tiere erscheint im Rücken- und Flankenbereich insgesamt okkerfarben, bei genauerer Betrachtung der einzelnen Haare fällt auf, dass etwa ein Drittel des Haares zur Haarspitze hin okkerfarben und die restliche Haarbasis dunkelbraun bis schwarz war. Der Haarstrich zeigt in der Körpermedianen nach caudal, zu den Seiten hin nach lateral und in der Flankenregion nach ventral. Insgesamt erscheinen die Haare im Rückenund Flankenbereich länger und dichter im Vergleich zu den kürzeren und feineren Haaren der lichter behaarten Bauchregion. Hier zeigen die Haare im seitlich der Medianen den gleichen zweifarbigen Aufbau, sind jedoch insgesamt heller. Im mittleren Bauchbereich sind sie ausschließlich sandfarben. Der Haarstrich zeigt in der Abdominalregion nach medial. 75 Tab. 3: Darstellung der p-Werte des Mann-Whitney-Tests. Gezeigt wird, ob innerhalb der Arten zwischen den Geschlechtern signifikante Unterschiede in den untersuchten Körperregionen 1-6 sichtbar sind (n= 5 pro Geschlecht). C. a. porcellus ♀/♂ 1 2 3 4 5 6 F. anselli ♀/♂ 1 2 3 4 5 6 Epidermis 0,310 0,095 0,310 0,095 1,000 0,690 Epidermis 0,151 0,008 0,032 0,095 0,690 0,056 Dermis 0,032 0,222 0,095 0,008 0,095 0,222 Dermis 0,310 0,310 0,548 0,841 1,000 1,000 Haardichte /cm² 1,000 0,841 1,000 0,095 0,310 0,095 Haardichte /cm² 0,841 0,310 0,310 0,151 0,095 0,095 Fläche der Gruppen 1,000 0,548 0,841 0,016 1,000 0,421 Fläche der Gruppen 0,151 0,151 0,222 1,000 0,841 0,548 Haare/ Gruppe 0,151 0,548 0,421 0,222 1,000 0,548 Haare/ Gruppe 0,421 0,841 0,841 0,841 0,421 0,841 : hochsignifikant : signifikant Fett: Trend (p < 0,01) (p < 0,05) (p < 0,1) Tab. 4: Darstellung der p-Werte des Mann-Whitney-Tests. Gezeigt wird, ob zwischen den Arten jeweils geschlechtergetrennt signifikante Unterschiede in den untersuchten Körperregionen 1-6 sichtbar sind (n= 5 pro Geschlecht). C. a. porcellus & F. anselli ♀ 1 2 3 4 5 6 Epidermis 0,008 0,008 0,008 0,008 0,008 0,008 Epidermis 0,008 0,008 0,008 0,008 0,008 0,008 Dermis 0,008 0,008 0,008 0,008 0,008 0,032 Dermis 0,008 0,008 0,008 0,008 0,008 0,008 C.a .porcellus & F. anselli ♂ Haardichte/ 0,008 0,008 0,008 0,008 0,008 0,008 Haardichte/ cm² cm² Fläche der 0,008 0,008 0,008 0,008 0,008 0,008 Fläche der Gruppen Gruppen Haare/ 0,008 0,008 0,008 0,421 0,841 0,690 Haare/ Gruppe Gruppe : hochsignifikant : signifikant Fett: Trend (p < 0,01) (p < 0,05) (p < 0,1) 1 2 3 4 5 6 0,008 0,008 0,008 0,008 0,032 0,008 0,008 0,008 0,008 0,008 0,008 0,008 0,008 0,008 0,095 0,421 0,056 0,841 76 Tab. 5: Darstellung der p-Werte des Kruskal-Wallis-Tests. Gezeigt wird, ob bei den untersuchten Tierarten zwischen den verschiedenen Körperregionen 1-6 signifikante Unterschiede vorliegen. Männliche und weibliche Tiere werden getrennt voneinander untersucht (n=5 pro Geschlecht). Cavia a. porcellus ♀ Cavia a. porcellus ♂ F. anselli ♀ F. anselli ♂ Epidermis 0,241 0,232 0,464 0,049 Dermis < 0,0001 <0,0001 0,163 0,312 Haardichte/ cm² 0,035 0,022 < 0,0001 0,001 Fläche d. Haargruppen < 0,0001 0,001 0,170 0,036 Anzahl Haare/ Gruppe < 0,0001 0,001 0,001 0,001 : hochsignifikant : signifikant Fett: Trend (p < 0,01) (p < 0,05) (p < 0,1) 77 Tab. 6: Darstellung der p-Werte des Tukey-Post-Hoc-Tests bei Cavia aperea f. porcellus. Gezeigt wird, ob bei den weiblichen und männlichen Tieren signifikante Unterschiede innerhalb der Körperegionen 1-6 sichtbar sind (n=5 pro Geschlecht). ♀ 2 Keine Unterschiede 4 5 5 0,004 0,077 0,001 0,001 0,001 1 0,180 0,337 0,001 0,001 2 0,027 0,001 0,001 3 0,001 0,001 4 0,194 5 Dermis 4 5 0,008 Dichte/ cm² 2 0,215 0,763 0,689 1 0,372 0,115 0,004 0,003 2 0,474 0,030 0,024 3 0,127 0,106 4 0,921 5 4 5 1 0,071 2 Gruppen 0,057 3 0,001 0,024 0,001 0,001 1 0,033 0,607 0,002 0,001 2 0,094 0,230 0,020 3 0,007 0,001 4 0,219 5 3 4 5 1 0,001 2 0,001 0,428 0,001 0,001 1 0,279 0,001 0,519 0,011 2 0,001 0,091 0,109 3 0,001 0,001 4 0,002 5 3 4 5 : hochsignifikant : signifikant Fett: Trend (p < 0,01) (p < 0,05) (p < 0,1) 2 3 4 5 6 Keine Unterschiede 3 4 1 Haare - ♂ 2 3 der 6 2 2 Fläche 5 1 1 Haare / Gruppe 4 1 3 Epidermis 3 0,001 0,009 0,001 0,001 0,001 0,030 0,974 0,001 0,001 0,028 0,001 0,001 0,001 0,001 0,140 0,001 0,039 0,002 0,284 0,079 0,156 0,896 0,018 0,083 0,196 0,287 0,732 0,024 0,106 0,466 0,154 0,002 0,927 0,001 0,001 0,049 0,130 0,001 0,001 0,001 0,077 0,016 0,001 0,001 0,461 0,001 0,001 0,062 0,001 0,001 0,034 0,017 0,751 0,010 0,001 0,017 0,574 0,034 0,001 0,004 78 Tab. 7: Darstellung der p-Werte des Tukey-Post-Hoc-Tests bei Fukomys anselli. Gezeigt wird, ob bei den weiblichen und männlichen Tieren signifikante Unterschiede innerhalb der Körperregionen 1-6 sichtbar sind (n=5 pro Geschlecht). ♀ ♂ 2 3 4 5 6 1 1 0,078 0,094 0,013 0,007 0,306 2 2 0,158 0,024 0,013 0,455 0,355 0,234 0,492 0,783 0,114 2 Epidermis Dermis Dichte/cm² 6 3 4 5 5 1 1 2 2 Keine Unterschiede 4 5 5 0,785 0,010 0,002 0,001 0,001 1 0,019 0,004 0,001 0,001 2 0,517 0,024 0,006 3 0,093 0,026 4 0,543 5 3 4 5 1 1 2 2 Keine Unterschiede 3 4 5 5 0,323 2 0,002 0,001 0,001 0,001 1 0,019 0,015 0,001 0,001 2 0,914 0,040 0,007 3 0,050 0,008 4 0,428 5 3 4 5 : hochsignifikant : signifikant Fett: Trend (p < 0,01) (p < 0,05) (p < 0,1) Keine Unterschiede 0,128 0,005 0,001 0,001 0,001 0,138 0,035 0,001 0,001 0,490 0,041 0,017 0,156 0,074 0,689 0,780 0,732 0,103 0,003 0,083 0,535 0,060 0,002 0,047 0,191 0,008 0,156 0,133 0,908 3 4 1 0,067 3 4 2 Grupppen 5 4 1 Haar- 4 Keine Unterschiede 3 3 Haare pro Gruppe Fläche der 3 0,163 0,020 0,001 0,001 0,001 0,001 0,067 0,157 0,001 0,001 0,652 0,015 0,005 0,005 0,002 0,663 79 7. Diskussion Im Rahmen der vorliegenden Arbeit sollen die Haut und ihre Anhangsorgane des Hausmeerschweinchens (Cavia aperea f. porcellus) und des Ansells Kleingraumulls (Fukomys anselli) miteinander verglichen werden. Hierbei handelt es sich phylogenetisch um verwandte Arten, da sowohl Meerschweinchen als auch Graumulle Säugetiere sind, welche zu den Nagetieren (Rodentia) gehören (Nowak 1991; Wilson & Reeder 2005). Jedoch ist es wichtig, vorab zu erwähnen, dass es sich bei den untersuchten Cavia aperea f. porcellus um Labortiere handelt, welche systematisch gesehen vom Wildmeerschweinchen abstammende Haustiere sind (Kapitel 2.1 und 4.1.1), wohingegen es sich bei den untersuchten Fukomys anselli um Wildfänge und deren Labornachzuchten handelt, welche systematisch gesehen Wildtiere sind (Kapitel 3.1 und 4.1.2). Da die Haut im Verlauf der Domestikation strukturellen und funktionellen Veränderungen ausgesetzt war (Bosse 1965; Meyer et al. 1978a; Meyer et al. 1978d; Meyer et al. 1980; Herre & Röhrs 1990), erwähnt schon Meyer (1986) in seiner Arbeit über vergleichende Untersuchungen an der Haut von Wildschweinen, Hausschweinen und Kleinschweinen, dass bei der vergleichenden Hautuntersuchung bei der Ergebnisinterpretation eine klare Trennung zwischen Wild-, Haus- und Labortieren durchzuführen ist. Mehrere Autoren weisen auf domestikationsbedingte Veränderungen in Physiologie und Verhalten auch beim Meerschweinchen hin (Stahnke 1987; Sachser 1998; Künzl & Sachser 1999; Sachser et al. 2004). Als Konsequenz wird im Folgenden bei der Diskussion der Ergebnisse berücksichtigt, dass in der vorliegenden Arbeit ein Wildtier mit einem Haus- bzw. Labortier verglichen wird. Ziel dieser Arbeit ist es jedoch, die Frage aufzuwerfen, ob Hautunterschiede beider Tierarten im Hinblick auf Anpassungen an oberirdische bzw. unterirdische Lebensbedingungen interpretiert werden könnten. Da die von der Wildform abstammenden Hausmeerschweinchen weiterhin oberirdisches Leben zeigen, ist bei ihnen folglich ein Vergleich im Hinblick auf diese Fragestellung sinnvoll. Bei den Graumullen wird es etwas schwieriger und es gilt, drei Fragen zu beantworten: - Sind Graumulle, welche als Wildfänge in Gefangenschaft gehalten werden, weiterhin als Wildtiere zu klassifizieren? 80 - Wie verhält es sich mit den in Gefangenschaft gezüchteten Nachkommen? - Kann man eine Interpretation im Bezug auf unterirdisches Leben vornehmen, obwohl die Tiere in Gefangenschaft nicht streng unterirdisch leben? Hinweise gibt die Arbeit von Künzl et al. (2003), welche sich mit der Frage beschäftigt, ob ein Wildtier, welches in Gefangenschaft gehalten und gezüchtet wird, weiterhin ein Wildtier ist. Hierfür wurden domestizierte Meerschweinchen und zwei verschiedene Populationen seiner wilden Stammform miteinander verglichen. Die erste wilde Stammform bestand aus Wildfängen und deren ersten im Labor gezüchteten Nachkommen, die zweite Gruppe aus Labornachzuchten aus der etwa dreißigsten Generation. Beim Vergleich verschiedener Stressparameter im Blut sowie sozialer und umweltangepasster Verhaltensabläufe zeigten sich signifikante Unterschiede zwischen den Wildfängen beider Generationen und den Hausmeerschweinchen. Es ließen sich jedoch keinerlei Unterschiede innerhalb der beiden Wildform-Populationen festgestellen. Aufgrund dieser Befunde wurde die Hypothese aufgestellt, dass zeitlich gesehen eine deutlich längere, künstliche Selektion durch den Menschen notwendig ist, um domestikationsbedingte Veränderungen bei Wildtieren herbeizuführen. Wendet man diese Ergebnisse auf die Haut der Graumulle an, welche in dieser Arbeit untersucht wurde, so kann man davon ausgehen, dass sie der Haut der in freier Wildbahn und streng unterirdisch lebenden Tieren entspricht. Eine weitere Problematik bei der Auswertung der Ergebnisse ist, dass bei den zum Teil wildgefangenen Graumullen unterschiedlichen Alters im Vergleich zu den Meerschweinchen keine standardisierten Versuchsbedingungen eingehalten werden konnten, wie sie für die Labortiere gefordert werden (Ohnacker 1960; Militzer 1982; Uhr 1984). So zeigten verschiedene Untersuchungen an der Oberhaut von Nagetieren, dass Faktoren wie Alter (Wada 1978), Sexualzyklus (Ebling 1957) und Stressverursacher wie Nahrungsmangel (Bullough & Laurence 1961) die Ausbildung der Epidermis in unterschiedlicher Weise beeinflussen können (Uhr 1984). Ein sinnvoller Vergleich in dieser Arbeit ist dennoch aus zwei Gründen möglich. Zwar können innerhalb der Wildformen vergleichsweise größere Abweichungen bestehen, jedoch geht es in dieser Arbeit bei der Beurteilung der Hautmessungen innerhalb einer Art um die Fragestellung, ob sich signifikante Unterschiede 81 zwischen den untersuchten Regionen eines Tieres zeigen. Dies bedeutet, dass auch wenn eine größere Variabilität der Messwerte auftreten sollte, beispielsweise eine Hautdicke bei einem Großteil der Tiere in der untersuchten Region dennoch vergleichsweise dicker oder dünner sein muss, um in der Gesamtauswertung signifikant unterschiedlich zu einer anderen Region zu sein. Was den Vergleich zwischen den Arten betrifft, so können auch hier anhand signifikanter Unterschiede unterschiedliche Tendenzen gezeigt und interpretiert werden. Diese werden in den nachfolgenden Kapiteln diskutiert. 7.1 Epidermis Der grundsätzliche Schichtaufbau der Epidermis ist bei Cavia aperea f. porcellus und Fukomys anselli gleich und entspricht dem bekannten Aufbau der Säugetierepidermis (Meyer 1998; Weyrauch & Smollich 1998). Die gemessenen Epidermisdicken beim Meerschweinchen (Anhang Tab. 1) decken sich mit Angaben in der Literatur, wo die Epidermis der allgemeinen Körperdecke des Meerschweinchens mit 14,9-32 µm angegeben wird (Spearman 1970; Militzer 1982). Die absolute Gesamtdicke der vitalen Epidermis ist beim Meerschweinchen im Vergleich zum Ansells Kleingraumull bei männlichen und weiblichen Tieren in allen Regionen signifikant höher (Abb. 13 und 14, Tab. 4). Diese Werte können darin begründet werden, dass die Körpermasse beim Meerschweinchen im Vergleich zum Ansells Kleingraumull etwa um das Zehnfache größer ist (Kapitel 2.3 und 3.3). Um also eine definitive Aussage treffen zu können, ob das Meerschweinchen tatsächlich eine dickere Epidermis bezogen auf das Körpergewicht vorweist als der Graumull, müsste eine relative Epidermisdicke in Korrelation zur Körpermasse des Tieres bestimmt werden. Dies war jedoch aufgrund fehlender Körpermassenangaben der bereits fixierten Ansells Kleingraumulle nicht möglich. Würde man jedoch einen prozentualen Vergleich anhand in der Literatur angegebener Körpergewichte anstellen (Kapitel 3.3), so wäre die relative Epidermis der Ansells Kleingraumulle im Vergleich zum Meerschweinchen etwa um das drei bis vierfache dicker. Aufgrund der Tatsache, dass interspezifische Vergleiche in der Regel auf die absolute Epidermisdicke bezogen werden, können auch keine Angaben zur Epidermisdicke in 82 Korrelation zur Behaarung gemacht werden. Zwar wird von einigen Autoren angegeben, dass die Epidermisdicke mit abnehmender Behaarung zunimmt und umgekehrt (Bonnet 1887; Schumacher 1931; Meyer 1986), jedoch blieben in diesen Untersuchungen Parameter wie unterschiedliche Körpergrößen oder der Haarzyklus unberücksichtigt (Meyer 1986). Bezieht man dies auf die vorliegenden Ergebnisse, so scheint das Meerschweinchen im Vergleich zum Ansells Kleingraumull bei einer vergleichsweise geringeren Haardichte pro cm² eine dickere Epidermis aufzuweisen (Abb. 25 und 26, Tab. 4), jedoch werden auch hier unterschiedliche Körpergrößen, Haardurchmesser oder Haarzyklen nicht mit einbezogen, weshalb eine Aussage dieser Art nicht sinnvoll ist. Vergleicht man die Epidermisdicken von Meerschweinchen und Ansells Kleingraumull mit denen anderer Labornager unabhängig von Behaarung und Körpergröße, so können keine großen Unterschiede festgestellt werden. So beträgt die mittlere Epidermis der Labormaus 1015 µm, der Laborratte 10-25 µm (Bronaugh et al. 1982; Meyer 1986; Meyer 2009) und des Syrischen Goldhamsters 25 µm (Militzer 1982). Im Geschlechtervergleich können beim Meerschweinchen im Vergleich zum Ansells Kleingraumull keine signifikanten Unterschiede dokumentiert werden. Bei Fukomys anselli ist in zwei Regionen die Epidermis der Männchen signifikant dicker (Abb. 10 und 11, Tab. 3). Innerhalb der Regionen ergeben sich beim Meerschweinchen keine signifikanten Unterschiede im Vergleich zum Graumull, dessen Epidermis bei den Männchen in der Regio colli und der Regio vertebralis thoracis signifikant dicker ist als in der Regio abdominis lateralis und der Regio umbilicalis (Abb. 10 und 11, Tab. 5,6 und 7). Dies könnte in der Tatsache begründet sein, dass die dorsale Epidermis als oberste Hautschicht beim Mull durch das Bewohnen enger, unterirdischer Gänge (Kapitel 3.2) größeren mechanischen Beanspruchungen ausgesetzt ist (Sokolov 1982; Meyer 1986). Epidermis- und Dermisfalten Bei der Interpretation der Epidermis- und Dermisfalten, welche sich sowohl beim Meerschweinchen als auch beim Ansells Kleingraumull in manchen Bereichen zeigen (Abb. 83 9A, 12A, 12B) gibt die Funktion von echten Epidermispapillen Aufschluss. Die Epidermis wird durch haarnadelförmige Kapillarschlingen mittels Diffusion mit Nährstoffen versorgt, welche im Stratum papillare dermidis der Haut lokalisiert sind (Liebich 1999). Demnach besteht in Hautbereichen mit dicker Epidermis theoretisch die Gefahr der Unterversorgung. Diese liegt praktisch jedoch nicht vor, da der Papillarkörper des Coriums proportional zur Epidermisdicke ausgebildet ist (Strickland & Calhoun 1963; Neurand & Schwarz 1969; Kristensen 1975; Schwarz et al. 1979; Schwarz et al. 1981). Diese Papillenbildung führt zu einer Oberflächenvergrößerung, so dass die gefäßlose, aber dicke Oberhaut ausreichend ernährt werden kann (Adam 1964). Beispiele hierfür sind mechanisch besonders belastete Bereiche wie Nasenspiegel- und Rücken, Gelenkvorsprünge (Militzer 1982), Fußballen der Katze (Meyer et al. 1990) und des Hundes (Weyrauch & Smollich 1998), der Huf (Weyrauch & Smollich 1998), Krallen und Hörner (Adam 1964). Folglich ist in den dünnhäutigen und dichtbehaarten Epidermisbereichen beispielsweise von Hund und Katze ein Papillarkörper nicht deutlich ausgebildet (Schwarz et al. 1981) oder fehlt bei den kleinen Versuchstieren (Militzer 1982) völlig. Dies entspricht auch den Untersuchungen von Weirich, Rufli und Longauer (1976), welche in der Körperdecke des Meerschweinchens keine Papillenbildung entdecken konnten und von Daly und Buffenstein (1998), welche keine Dermispapillen und Epidermisleisten in der Haut von Cryptomys hottentotus, einer verwandten Art von Fukomys anselli, nachweisen konnten. Demnach ist anzunehmen, dass die in dieser Arbeit teilweise sichtbaren Epidermis- und Dermiswellen eher als präparationsbedingte Auffaltelungen denn als echter Papillarkörper interpretiert werden müssen. Stratum basale und Stratum spinosum Vergleicht man die einzelnen Schichten der Epidermis bei Cavia aperea f. porcellus und Fukomys anselli miteinander, so zeigt sich bei beiden Tierarten ein einschichtiges Stratum basale und ein beim Meerschweinchen ein- bis dreilagiges, beim Graumull ein ein- bis selten zweilagiges Stratum spinosum. Stratum granulosum Ein durchgehendes Stratum granulosum ist bei Fukomys anselli im Vergleich zu Cavia aperea f. porcellus nicht ausgebildet. Dies deckt sich mit Untersuchungen von Daly und 84 Buffenstein (1998), welche in der Haut von Cryptomys hottentotus ebenfalls kein durchgehendes Stratum granulosum nachweisen konnten. Eine Erklärung könnte sein, dass die Bildung eines Stratum granulosum offensichtlich an die Ausbildung eines wenigstens zwei- bis dreischichtigen Stratum spinosum gebunden ist und daher bei sehr dicht behaarten Säugern mit relativ dünner Epidermis nicht oder nur unvollständig auftritt (Meyer et al. 1978d; Militzer 1982; Uhr 1984; Meyer 1986). In dieser Arbeit konnte beim Meerschweinchen ein durchgehendes Stratum granulosum als eine ein- bis selten zweilagige Schicht in allen Regionen dokumentiert werden. Dies deckt sich mit Angaben in der Literatur, wo es als einschichtige, durchgehende Zelllage beschrieben wird (Spearman 1970). Stratum lucidum Ein Stratum lucidum konnte bei beiden untersuchten Tierarten nicht nachgewiesen werden. Dies entspricht den Beschreibungen von Weyrauch und Schmollich (1998), wonach diese Schicht nur in unbehaarten Hautarealen vorkommt und ein Stratum lucidum in der allgemeinen Körperdecke der Haussäugerarten fehlt (Meyer et al. 1978a; Meyer 1998). Demgegenüber steht jedoch die Aussage von Militzer (1982), dass diese Zone mit histochemischen Verfahren unter anderem beim Meerschweinchen an verschiedenen Körperstellen nachgewiesen werden konnte. Daly und Buffenstein (1998) konnten zwar an paraffineingebetteten Schnitten in der Haut von Cryptomys hottentotus kein Stratum lucidum ausmachen, konnten es jedoch an in Kunstharz eingebetteten Schnitten als prominente leuchtende Schicht dokumentieren. Dies erklärt, warum ein Stratum lucidum auch in dieser Arbeit mit Hilfe der Paraffinschnitte bei beiden Tierarten nicht nachgewiesen werden konnte. Stratum corneum Das Stratum corneum beider untersuchter Tierarten kann in ein Stratum corneum conjunctum und ein Stratum corneum disjunctum unterteilt werden. Diese Befunde beim Meerschweinchen bestätigen frühere Beschreibungen von Spearman (1970). Das Stratum corneum ist bei Cavia aperea f. porcellus mit einer bis zu dreifachen Höhe der restlichen Epidermis deutlich dicker als bei Fukomys anselli, wo es maximal Dicken bis zur 0,5-fachen Höhe der restlichen Epidermis erreicht. 85 Vergleicht man die Haarfollikeldichte pro cm² bei den beiden untersuchten Tierarten, so zeichnet sich der Ansells Kleingraumull durch eine deutlich höhere Haardichte aus als das Meerschweinchen (Kapitel 5.4). Da ein weniger dichtes Haarkleid eine deutlich geringere mechanische Schutzfunktion für die Haut hat, indem es einer höheren Belastung durch Abrieb und Verschmutzung ausgesetzt ist (Meyer 1986), könnte eine erhöhte Verhornungsrate diesen Nachteil ausgleichen. Wie schon einleitend beschrieben, sind Meerschweinchen Bewohner einer Vielzahl von Habitaten mit steinigem und gebirgigem Gelände bis hin zu Waldrändern, Sümpfen und offenem Weideland (Grzimek 1975; Sutherland & Festing 1987; Nowak 1991; Noonan 1994). Dort suchen sie in geschichtetem Unterholz und Erdklumpen Unterschlupf (Nowak 1991), so dass die Haut häufig mechanischer Beanspruchung ausgesetzt ist. Melanozyten Melanozyten konnten weder in der Haut von Cavia aperea f. porcellus noch in der Haut von Fukomys anselli nachgewiesen werden. Der Grund liegt darin, dass es sich bei den untersuchten Meerschweinchen (Stamm: DH) um Albino-Tiere handelt. Bei den Ansells Kleingraumullen deckt sich dieses Ergebnis mit denen von Daly und Buffenstein (1998), welche in der Haut von Cryptomys hottentotus ebenfalls keine Melanozyten nachweisen konnten. Als Grund hierfür könnte angesehen werden, dass die primäre Funktion der Melaninpigmentierung ein Schutz gegen übermäßige UV-Bestrahlung ist (Hadley 1972; Cripps 1981), welche bei den obligat unterirdischen Fukomys anselli keine Gefahrenquelle darstellt. Methodenkritik Abschließend werden bei der Beurteilung der gemessenen Epidermisdicken fehlerkritische Studien zur Messung der Epidermisbreite beim Meerschweinchen diskutiert. So widerlegen Heite und Ritter (1962) die Ansicht von Oberste-Lehn und Wiemann (1959), dass eine exakte Messung der Breite des Deckepithels nur dann möglich ist, wenn der histologische Schnitt rechtwinklig zu den Haarreihen der Meerschweinchenhaut geführt wird. An Messungen der Meerschweinchenepidermis konnten sie feststellen, dass keine signifikanten Dickenunterschiede zwischen sagittal oder transversal geführten histologischen Schnitten zu verzeichnen waren. Darüber hinaus überprüften Heite und Ritter (1962), ob die Dehnung der 86 auf Pappe fixierten Hautstücke Einfluß auf die gemessenen Epidermisbreiten hat und stellten fest, dass durch Dehnung beim Aufspannen der Probe auf Pappe eine Verringerung der Epidermisbreite um 84 % des Wertes festzustellen war, der bei Fixierung in ungedehntem Zustand gemessen wurde. Jedoch war die relative Streuung der Epidermisbreiten in gedehnter Fixierung einheitlich und im Durchschnitt niedriger als bei ungedehnter Fixierung, weshalb sie weiterhin eine physiologische Dehnung der exzidierten Hautproben empfehlen. Was die allgemeine Schrumpfung der histologischen Hautschnitte durch die Einbettung in Paraffin angeht, kann man im Vergleich zu Technovit- eingebetteten Schnitten von einer Schrumpfung von 8-10% ausgehen (Meyer 2009b). Bezieht man diese Ergebnisse auf die vorliegende Arbeit, so hat die sagittale Schnittführung keinen Einfluss auf die gemessene Epidermisdicke. Jedoch kann laut Heite und Ritter (1962) ein Vorteil in der rechtwinklig zur Haarreihung durchgeführten Schnittführung sein, dass geeignete, interfollikuläre Stellen im Präparat leichter gefunden werden können. Weiterhin scheint die Art der Fixierung der frischen Hautpräparate durch Aufspannen auf Pappe, wie sie bei den Meerschweinchen durchgeführt worden ist, zweckmäßig zu sein. Was die Schrumpfung der Paraffinschnitte betrifft, so kann man von einem relativ einheitlichen Schrumpfungswert ausgehen, welcher bei Cavia aperea f. porcellus und Fukomys anselli durch einheitliche Einbettung gleich ausfallen sollte. Demnach ist ein Vergleich zwischen den beiden Tierarten sinnvoll. 7.2 Dermis und Hypodermis Der grundsätzliche Aufbau der Dermis ist bei Cavia aperea f. porcellus und Fukomys anselli gleich und deckt sich mit allgemeinen Angaben zur Struktur der Säugetierdermis (Liebich 1999). Die Schichtdicke der Dermis ist beim Meerschweinchen im Vergleich zum Graumull signifikant höher (Abb. 19 und 20, Tab. 4). Als Begründung liegt auch hier der Unterschied in der Körpermasse beider Tierarten (Kapitel 6.1). Denn würde man auch hier anhand allgemeiner Körpermasseangaben aus der Literatur eine Korrelation zwischen Dermisdicke 87 und Körpergewicht anstellen, so wäre die Dermis der Ansells Kleingraumulle im Bezug zum Körpergewicht im Vergleich zum Meerschweinchen um das 2,2-2,7 fache höher. Eine Verknüpfung der Schichtdicke von Dermis und Subcutis mit der Wachstumsphase des Haarfollikels, wie sie in der Haut von Versuchstieren, beispielsweise Maus (Andreasen 1953) und Ratte (Durward & Rudall 1949), festgestellt worden ist, ist bei den Wildformen nicht möglich (Uhr 1984). Weiterhin ist beim Meerschweinchen im Vergleich zu anderen kleinen Labortieren ein mosaikartiges Haarwachstum festgestellt worden (Näheres siehe Kapitel 6.3), so dass sich nie definitive Hautareale in toto in einer bestimmten Haarzyklusphase befinden, sondern einzelne Haare werden asynchron über den ganzen Körper gewechselt. Im Geschlechtervergleich ist die Dermis der Regio colli und der Regio abdominis lateralis männlicher Meerschweinchen signifikant dicker im Vergleich zu den Ansells Kleingraumullen, bei denen in keiner Region signifikante Dickenunterschiede zwischen den Geschlechtern nachweisbar waren (Abb. 16 und 17, Tab. 3). Vergleicht man die Regionen miteinander, so ist auffällig, dass die Dermis bei Fukomys anselli innerhalb der Regionen keine signifikanten Unterschiede aufweist. Im Gegensatz dazu wird die Dermis von Cavia aperea f. porcellus von den dorsalen - speziell der Nackenregion über die seitlichen zu ventralen Bereichen hin signifikant dünner (Abb. 16 und 17, Tab. 5, 6 und 7). Diese Verhältnisse beim Meerschweinchen decken sich mit jenen verschiedener anderer Säugetiere, wie der Europäischen Wildkatze (Meyer et al. 1981b), der Hauskatze (Strickland & Calhoun 1963) und des Schweines (Meyer 1986), sowie des Menschen (Southwood 1955; Pinkus 1964; Meyer 1986). Umso mehr stellt sich die Frage, warum die Dermis beim Ansells Kleingraumull in allen Bereichen der allgemeinen Körperdecke gleich stark ausgebildet ist beziehungsweise in ventralen Körperabschnitten nicht dünner ist als bei anderen Spezies. Wie einleitend beschrieben, erfüllt die Dermis, und hier vor allem das Stratum papillare, unter anderem kreislauf- und thermoregulatorische Aufgaben. Das in ihm enthaltene Gefäßsystem, und hier vor allem der subepitheliale Venenplexus, dient der Abgabe von Wärme an die Epidermis (Liebich 1999). 88 Beziehen wir nun diese Funktion auf den Lebensraum des Kleingraumulls: Aufgrund der hohen Luftfeuchtigkeit herrscht im unterirdischen Tunnelsystem ein geringes Dampfdruckgefälle, was unter anderem den Wasserverlust über die Atmung herabsetzt. Durch den verminderten Wasserverlust sind die Tiere schnell der Gefahr der Überhitzung und des thermischen Stresses ausgesetzt (Burda 2003). Daly und Buffenstein (1998) beschreiben, dass Cryptomys hottentotus, eine verwandte Art von Fukomys anselli, gute Thermoregulatoren sein müssen, da sie eine konstante Körpertemperatur über eine weite Spanne von Umgebungstemperaturen aufrechterhalten können. Untersuchungen zeigen, dass in Phasen erhöhter Stoffwechselleistung, vor allem beim Graben, Wärme abgegeben wird. Hierfür wird von den Tieren die Leitfähigkeit ihrer Körper genutzt, indem sie beim Liegen in kühleren Bereichen Wärme an den Boden abgeben. So wurde in einer thermographischen Studie u.a. von Fukomys mechowii festgestellt, dass in erster Linie der ventrale Bereich durch seine moderaten Außentemperaturen, verbunden mit seiner großen Oberfläche und der vergleichsweise dünnen Behaarung der wichtigste Körperabschnitt ist, über den Wärme abgegeben werden kann (Sumbera et al. 2007). Demnach kann man schlussfolgern, dass eine vergleichsweise dicke Dermis mit einem ausgeprägten Gefäßsystem diese Abgabe von Wärme fördert (Näheres hierzu siehe Unterkapitel Versorgungsstrukturen). Kollagene und elastische Fasern Bei beiden Tierarten zeigt sich eine Unterteilung der Dermis in ein oberflächliches Stratum papillare und ein tiefer liegendes Stratum reticulare, wie es auch für andere Säuger gefunden werden kann (Liebich 1999). Die kollagenen Fasern sind bei beiden Tierarten im Stratum papillare dermidis vorwiegend horizontal ausgerichtet, wobei sie beim Ansells Kleingraumull im Vergleich zum Meerschweinchen sehr strukturiert und parallelfaseriger erscheinen. Im Stratum reticulare formen diese bei beiden Tierarten ein horizontales Maschennetz. Insgesamt sind sie bei Fukomys anselli länglicher, gewellter und schlanker als bei Cavia aperea f. porcellus und nehmen an Dicke in die Tiefe gehend nur geringfügig zu. Die elastischen Fasern formen im Stratum papillare dermidis bei beiden Tierarten ein scherengitterartiges, dichtes Netz, welches subepidermal mit feinen vertikalen Ausläufern an die Basalmembran heranzieht. Im Stratum reticulare dermidis sind sie beim Meerschweinchen deutlich weniger engmaschig angeordnet als beim Ansells Kleingraumull, wo sie in der tiefen, an die Subcutis 89 angrenzenden Dermis einen dichten Filz bilden (vgl. Kapitel 5.2). Die Verteilung und Anordnung der kollagenen und elastischen Fasern deckt sich mit Untersuchungen beim Meerschweinchen (Hieronymi 1958) und entspricht im Grundmuster den Befunden bei vielen anderen Säugetieren (Meyer et al. 1978a; Schwarz et al. 1979). Zwei Gründe können für die unterschiedliche Anordnung der elastischen Fasern bei den untersuchten Tierarten angenommen werden. Der dichte Filz elastischer Fasern in tiefen Dermisabschnitten bei Fukomys anselli scheint die Elastizität und Verformbarkeit der Haut zu bedingen (Liebich 1999; Meyer et al. 2000). Beim subterranen Leben ist es von Vorteil, wenn die Haut verschieblich ist und somit einen geringen Widerstand beim Vorwärts- und Rückwärtslaufen in den engen, unterirdischen Gängen bietet. Des Weiteren liefert die Arbeit von Meyer et al. (2000) wichtige Hinweise: In dieser Studie wurde ein dreidimensionales Bild der elastischen Fasern in der Haut einiger Nagetiere erstellt. Sie stellten fest, dass die elastischen Fasern bei kleinen, vollbehaarten Säugetieren sehr zahlreich und verzweigt in der oberen und mittleren Dermis vorkommen und dort ein dichtes Maschennetzwerk bilden. In den tieferen Dermisschichten ist das Netzwerk hingegen grobmaschiger und lockerer strukturiert. Zusätzlich zeigten die elastischen Fasern von sehr dicht behaarten Vertretern der Myomorpha (Maus, Ratte) im Vergleich zu den etwas weniger dicht behaarten Meerschweinchen das feinere elastische Fasersystem mit vergleichsweise strikter horizontaler Ausrichtung in der Dermis. Die elastischen Fasern waren zum einen zwischen den Primär- und Sekundärhaarfollikeln verankert und verbanden sie so durch die gesamte Länge der Dermis hindurch: Desweiteren wurden Haarfollikelgruppen komplett mit elastischen Fasern umhüllt. Diese Anordnung entspricht ziemlich genau den Befunden, die in dieser Arbeit erhoben werden konnten. Durch die elastische Verbindung der Sekundärhaare, welche keinen Muskulus arrector pili aufweisen, können diese simultan mit der Aufrichtung der Primärhaare mitaufgerichtet werden. Auf diese Weise kann ein effektiver Schutz dieser kleinen Tiere mit vergleichsweise größerer Körperoberfläche vor Kälte gewährleistet werden (Meyer et al. 2000). Dies würde auch erklären, weshalb die vergleichsweise dichter behaarten Fukomys anselli einen dichteren Filz elastischer Fasern zeigen als die größeren Meerschweinchen. 90 Dieser dichte Faserfilz wird oberhalb des Hautmuskels auch bei der Ratte ausgebildet (Hussein 1972). Versorgungsstrukturen Betrachtet man die Versorgungsstrukturen der Dermis bei beiden Tierarten, so findet sich grundsätzlich ein gemeinsamer Aufbau (Kapitel 5.2), welcher mit dem anderer Säugetiere übereinstimmt (Liebich 1999). Auffallend beim Ansells Kleingraumull im Vergleich zum Meerschweinchen sind jedoch die recht prominenten Gefäße, welche parallel und häufig entlang von Follikelgruppen epidermiswärts ziehen und die vergleichsweise sehr gut durchbluteten, ventralen Hautabschnitte. Die gute Durchblutung in ventralen Hautabschnitten bestätigt die Annahme, dass Fukomys anselli dort über die Dermis vermehrt Wärme abgegeben kann. Subkutis Die Subkutis beider untersuchter Tierarten entspricht in ihrem grundsätzlichen Aufbau dem anderer Säugetiere (Liebich 1999). Bereits Neurand und Schwarz (1969) und Meyer et al. (1978a) beschreiben bei ihren Untersuchungen der Haut der Haussäugetiere, dass das Stratum adiposum subcutis einen ausgeprägt wellenförmigen Charakter aufweist, in deren „Wellenberge“ die Haarfollikel hineinragen. Diese Ausprägung konnte hier auch in der Subcutis des Ansells Kleingraumulles nachgewiesen werden. Weiterhin enthalten die ventralen Hautabschnitte bei Fukomys anselli weniger Fettgewebe. Da Fetteinlagerungen neben Energiereserven dem Kälteschutz dienen (Liebich 1999), könnte ein Grund für ihre geringe Ausbildung sein, dass sie an diesen Hautarealen, an denen vermehrt Wärme abgegeben wird, diese Funktion eher behindern würde und deshalb reduziert wurde. Der Hautmuskel (Panniculus carnosus) ist bei beiden Tierarten in allen untersuchten Hautregionen ausgebildet. Er ist eingebettet in das Stratum fibrosum subkutis (Kapitel 5.2) und liegt damit in homologer Lage wie bei anderen Säugetieren (Adam 1964). Eine statistische Auswertung, ob die Subkutis der Bauchregionen signifikant weniger Fettwegebe enthält als die anderen, untersuchten Regionen, konnte leider nicht erfolgen, da 91 die Subkutis in einigen Hautschnitten präparationsbedingt nicht mehr vollständig vorhanden war. Die Beschreibung bezieht sich demnach in diesem Fall auf den deutlich sichtbaren Befund der vorhanden Schnittpräparate. 7.3 Haarfollikel Der grundsätzliche Aufbau des Haarfollikels ist bei beiden Tierarten gleich und unterscheidet sich nicht von demjenigen anderer Säugetierarten wie Maus und Ratte (Priestley 1967; Parakkal 1969; Parakkal 1970), Hund und Katze (Kristensen 1975) und dem Menschen (De Villez 1986; Paus et al. 1994). Ein im Vergleich zur Rinde dickerer Markanteil beim Meerschweinchenhaar deckt sich mit Angaben in der Literatur (Lochte 1938; Militzer 1982). Im Bereich des Haarbulbus finden sich bei Fukomys anselli vermehrt Melanozyten (Abb. 22D). Dies entspricht Ergebnissen von Daly und Buffenstein (1998) bei Cryptomys hottentotus und kann damit begründet werden, dass diese Zellen die Bulbusmatrix mit Melaningranula versorgen (Meyer 1986). Eine Aussage über die Melanozyten beim Meerschweinchen kann, da es sich um albinotische Tiere handelte, in dieser Arbeit nicht getroffen werden. Beim Meerschweinchen befand sich in den untersuchten Hautregionen jeder Haarfollikel in einer individuellen, von nachbarschaftlichen Haarfollikeln unabhängigen Haarzyklusphase (Abb. 15D, 21E), so dass von einem asynchronen oder mosaikartigen Haarwachstum gesprochen werden kann. Diese Beobachtung deckt sich mit Befunden früherer Autoren (Bosse & Burzynski 1964; Bosse & Kostanecki 1964; Bosse 1966). Es gibt deutliche Hinweise, dass sich beim Ansells Kleingraumull die Haare innerhalb einer Hautregion in der gleichen Haarzyklusphase befinden. Hier muss man somit von einem synchronisierten oder wellenförmigen Haarwechsel sprechen. Gestützt wird diese Deutung einerseits durch die histologischen Schnitte, in welchen nachbarschaftliche Haare im gleichen Funktionsstadium erscheinen (Abb. 12A) und zusätzlich durch die Beobachtung, dass beim Scheren der Haare von Fukomys anselli stark pigmentierte, größere Hautbereiche neben unpigmentierten Hautarealen zu liegen kommen (Begall 2009). Dies legt die Vermutung nahe, dass es sich bei diesen Hautarealen um sogenannte „Mauserflecke“ handelt. Dies sind dunkle, zur Zeit des 92 Haarwechsels auftretende Hautbereiche, welche besonders gut an der rasierten Haut dunkelhaariger Tiere, deren Haut nicht oder nur geringfügig pigmentiert ist, sichtbar sind. Sie haben ihre Erscheinung der intensiven Pigmentierung der neuen Haarkeime im Vergleich zu den unpigmentierten Kolbenhaarwurzeln der Telogenfollikel zu verdanken (Westendorf 1974; Militzer 1982) und sind bei den meisten kleinen Versuchstieren mit Ausnahme des Meerschweinchens zu finden (Militzer 1982). Im Rahmen dieser Arbeit wurden am lebenden Tier aus Tierschutzgründen keine weiteren Untersuchungen der Haut zur Bestimmung des Haarwurzelstatus, wie Färben der Haare oder Rasur der Haut durchgeführt, wie bei Richter (1963) oder Westendorf (1974) beschrieben, da zur Untersuchung dieser Wildtiere eine Sedierung notwendig gewesen wäre. Es stellt sich die Frage, warum die wildlebenden Fukomys anselli scheinbar keinen saisonalen Haarwechsel zeigen, wie viele andere wildlebende Säugetiere (Ryder 1973). Ein Grund hierfür kann sein, dass dieser entscheidend durch die Photoperiodizität anhand der jahreszeitlichen Entwicklung der Tageslängen und ergänzend durch Temperaturveränderungen beeinflusst wird (Meyer et al. 1980; Meyer 1998). Diesen sind die Ansells Kleingraumulle durch ihre obligat subterrane Lebensweise mit annähernd gleichbleibenden Lichtverhältnissen und moderaten saisonalen und tagesperiodisch bedingten Temperaturschwankungen nicht ausgesetzt. 7.4 Haarfollikeldichte Beim Meerschweinchen ist die Gesamthaardichte, gemessen an der Anzahl der Haarfollikel pro cm², in allen untersuchten Regionen signifikant geringer als beim Ansells Kleingraumull (Abb. 25 und 26, Tab. 4). Vergleicht man die Haardichte mit der anderer Nagetiere (Laborratte: 5000-8000, Labormaus: 7000-9000 Haarfollikel pro cm²), (Bronaugh et al. 1982; Meyer 1986; Meyer 2009), so ist der Ansells Kleingraumull eher dicht behaart im Vergleich zum spärlich behaarten Meerschweinchen. Im Geschlechtervergleich können bei beiden Tierarten keine signifikanten Unterschiede ausgemacht werden (Abb. 23 und 24, Tab. 3). 93 Interessant ist jedoch die unterschiedliche Haardichte in den verschiedenen Körperregionen beider Tierarten (Abb. 23 und 24, Tab. 5, 6 und 7). Bei Cavia aperea f. porcellus ist eine signifikante Abnahme der Haardichte in der Regio vertebralis thoracis und Regio lumbalis, also im mittleren und hinteren Rückenbereich im Vergleich zur Nackenregion und der vergleichsweise dicht behaarten Abdominalregion zu verzeichnen. Dies deckt sich mit Untersuchungen von Schwarz und Meyer (1994), die beschrieben, dass die Haardichte der Deutschen Hauskatze und bei ursprünglichen Hunderassen vom Rücken zum Bauch hin zunimmt. Untersuchungen der Wildkatze (Meyer et al. 1982a) und der Wanderratte (Uhr 1984) dokumentieren, dass die Anzahl der Wollhaare in dieser Region zunimmt. Im Vergleich hierzu nimmt die Haardichte bei Fukomys anselli vom dorsalen Rumpf über die Flankengegend zum Bauch hin signifikant ab. Dies deckt sich mit Untersuchungen der Behaarung zwei weiterer Vertreter der Bathyergidae, Fukomys mechowii und Heliophobus argenteocinereus von Sumbera et al. (2007), welcher bei beiden Spezies eine deutlich verminderte Haardichte im Bauchbereich im Vergleich zum dorsalen Rumpfbereich beschreibt. Als Grund nennt er, wie schon weiter oben beschrieben, dass unter anderem die dünne Behaarung im Bauchbereich die Abgabe von Wärme in diesem Körperabschnitt begünstigt. 7.5 Größe und Anordnung der Haargruppen Beim Meerschweinchen konnten in den untersuchten Bereichen ausschließlich einfache Haargruppen nachgewiesen werden. Laut Definition von Oberste-Lehn und Nobis (1963) sind dies Haargruppen, welche sich aus Einzelfollikeln zusammensetzen. Dieser Befund deckt sich mit Untersuchungen des Rückenfells des Meerschweinchens von Oberste-Lehn und Nobis (1963), welche an Rücken und Bauch ausschließlich einfache Haargruppen differenzieren konnten. Auch die in dieser Arbeit vorgenommene Unterteilung der Haare in zentrale und laterale Primärhaarfollikel und Sekundärhaarfollikel und die häufig dreieckige Anordnung der Deckhaare (Kapitel 5.5.1) deckt sich mit Untersuchungen bei anderen Säugetieren wie Pferd (Meyer 1998), Hund, Katze, Schaf, Ziege und dem Schwein (Meyer et al. 1978a; Meyer 1986). Diese Anordnung wird laut Meyer (1998) als phylogenetisch altes Merkmal der 94 Säugetierhaut gedeutet und ist darin begründet, dass embryonal zunächst die Primärhaarfollikel angelegt werden. In den Zwischenräumen entwickeln sich später neue Haaranlagen, die Sekundärhaarfollikel, die meist Kontakt zu den Primärhaarfollikeln halten und mit diesen Haarbündel bilden (Oberste-Lehn & Nobis 1963; Ryder 1973; Militzer 1982). Auch beim Graumull konnten prominentere Primärhaarfollikel von kleineren Sekundärhaarfollikeln unterschieden werden (Abb. 22A). Diese zeigen im Vergleich zum Meerschweinchen jedoch keine regelmäßige Anordnung zueinander. Vielmehr gruppieren sich, wie in Kapitel 5.3.2 und 5.4.2 beschrieben, Primär- und Sekundärhaare in Form von Haargruppen zueinander, die aus mehreren Compounds (Haarverbunden) bestehen. Diese Art der Anordnung bezeichnet Militzer (1982) als „gruppierte Verbundfollikel“. Sie kommen laut seiner Aussage bei Maus und Hund in reihiger, bei der Katze in ovaler Anordnung vor. Beim Menschen treten sie an der Mamma und am Hinterhaupt auf (Militzer 1982). Gestützt werden die hier dokumentierten Befunde von Ergebnissen von Klauer et al. (1997), welche die Kopfhaut der subterran lebenden Blindmaus, Spalax ehrenbergi, untersuchten. Auch sie stellten fest, dass die Haare bei dieser Spezies in Haarbüscheln organisiert sind, welche in einem gemeinsamen Epitheltrichter durch desquamierte Hornzellen und Sebum zusammengehalten werden, wobei sie in unterschiedliche Richtungen zeigen. Klauer et al. (1997) nehmen hierdurch und durch zusätzliche Untersuchungen an der Haut von Cryptomys sp. und Geomys sp. an, dass diese Haarbüschelanordnung sich als ein gemeinsames charakteristisches Merkmal subterraner Nagetiere entwickelt hat. Bestärkt wird diese Vermutung durch Haaruntersuchungen bei weiteren Mullspezies, Fukomys mechowii und Heterocephalus argenteocinereus, welche ergeben, dass auch hier die untersuchten Haare am dorsalen und ventralen Körper in Haarbüscheln angeordnet sind (Sumbera et al. 2007). Als möglichen Grund führen Klauer et al. (1997) an, dass diese Haarbüschel leicht in beide Richtungen gebogen werden können und diese Form somit eine Adaption an die unterirdischen Bauten sein könnte, in welchen die Tiere sich gleichermaßen vor und zurück bewegen können müssen. Zusätzlich zu den Deck- und Wollhaaren konnte bei Fukomys anselli in allen untersuchten Hautbereichen ein dritter Haartyp dokumentiert werden, welcher deutlich größer ist und 95 zirkulär von einzelnen Haarfollikeln und Haarverbunden umsäumt wird (Abb. 22C). Diese Ergebnisse decken sich mit Befunden von Leithaaren (Guardhairs) in verschiedenen Hautregionen bei Ratte, Maus, Kaninchen, Hund und Katze (Dry 1926; Straile 1960; Hussein 1971; Sato et al. 2006). Eine Erklärung, ob die Leithaare von Fukomys anselli die gleiche Struktur und Innvervation aufweisen wie die anderer Spezies, liefern die Untersuchungen von Park et al. (2003) und Crish et al. (2003). Sie stellten fest, dass es sich bei den großen Körperhaarfollikel, welche in einem bestimmten Muster über den Körper des Nacktmulles, Heterocephalus glaber, verteilt sind, um taktile, vibrissen-ähnliche Leithaare handelt (Crish et al. 2003), welche die gleiche Struktur wie die Leithaare anderer Spezies haben, wenngleich sie größer und dichter innerviert sind als die Leithaare behaarter Spezies, wie der Ratte und dem Gemeinen Graumull, Cryptomys hottentotus (Park et al. 2003). Weiterhin wurde festgestellt, dass die Beugung eines einzelnen Leithaares beim Nacktmull eine genaue Orientierung der Schnauze in Richtung der Stimulation auslöst (Crish et al. 2003). Auch die Leithaare weiterer Afrikanischer Graumulle (Cryptomys hottentotus und Fukomys mechowii) rufen bei Stimulation drehende Bewegungen des Körpers hervor. Diese Ergebnisse lassen die Schlussfolgerung zu, dass diese Haare den Tieren im unterirdischen Gangsystem für die nonvisuelle Orientierung wichtige taktile Sinne sind (Crish et al. 2003). Betrachtet man die Anordnung der Haargruppen zur Körperachse hin, so zeigen sich bei beiden untersuchten Tierarten Haargruppenlinien, welche transversal zur Körperachse hin orientiert sind (Abb. 27A, 36F). Im Vergleich zu Fukomys anselli sind diese bei Cavia aperea f. porcellus jedoch strenger linear angeordnet. Diese Anordnung der Haargruppen deckt sich mit Untersuchungen bei Ratte und Maus (Hussein 1971). Die Größe der Haargruppen, angegeben in Fläche (µm²), ist beim Meerschweinchen in allen untersuchten Regionen signifikant höher als beim Ansells Kleingraumull (Abb. 30 und 31, Tab. 4). 96 Im Geschlechtervergleich sind, abgesehen von größeren Haargruppen in der Flankenregion der Meerschweinchen-Männchen bei beiden Tierarten keine signifikanten Unterschiede nachgewiesen worden (Abb. 28 und 29, Tab. 3). Im Regionenvergleich fällt auf, dass beim Meerschweinchen die Fläche der Haargruppen in der Bauchregion signifikant kleiner ist, als an den anderen untersuchten Hautregionen und bei den Graumullmännchen die Haargruppengröße auch im Nabelbereich signifikant kleiner ist (Abb. 28 und 29, Tab. 5, 6 uns 7). Dies deckt sich mit Angaben zur Anzahl der Haarfollikel pro Haargruppe. Diese sind bei beiden Tierarten zwischen den Geschlechtern nicht signifikant verschieden und nehmen synchron zur Größe der Haargruppenfläche zu (Abb. 32 und 33, Tab. 3). Bestätigt wird dies durch Korrelationen von Haargruppenfläche und Anzahl der Haarfollikel pro Gruppe, wo eine signifikante Abhängigkeit bei beiden Tierarten festgestellt wird (Abb. 37, 38, 39 und 40). Vergleicht man die Anzahl der Haarfollikel pro Haargruppe bei den beiden untersuchten Tierarten, so ist bei den männlichen Meerschweinchen in der Regio colli und der Regio vertebralis thoracis, bei den weiblichen Meerschweinchen zusätzlich in der Regio lumbalis, die Anzahl der Haarfollikel pro Gruppe signifikant kleiner als beim Ansells Kleingraumull (Abb. 34, 35, Tab. 4). Die Angaben zur Anzahl der Haarfollikel pro Haargruppe beim Meerschweinchen decken sich mit Untersuchungen von Oberste-Lehn und Nobis (1963), welche bei Cavia aperea f. porcellus in der Bauchregion weniger Haare pro Haargruppe als in der Rückenregion festgestellt haben. Schlussfolgerung: Je größer die Anzahl der Haare pro Gruppe, desto größer auch die Fläche. Jedoch kann von kleinen Haargruppen mit wenigen Haaren noch nicht auf die Dichte der Behaarung geschlossen werden. Denn es stellen sich folgende Fragen: 1) Warum ist die Haardichte beim Meerschweinchen im Bauchbereich signifikant höher trotz vergleichsweise kleiner Haargruppen? 2) warum ist die Haardichte beim Mull im Bauchbereich signifikant kleiner bei ähnlich großen Haargruppen wie in den anderen Regionen? Der Grund dafür liegt darin, dass die Haardichte weniger von der Haargruppenfläche und der Anzahl der Haare pro Gruppe abhängt, sondern vielmehr davon, wie dicht die Haargruppen nebeneinander liegen. Deutlich sichtbar wird dieser Zusammenhang z.B. in den Abbildungen 36 D und 36E, wo die Haargruppen der Bauchregion im Vergleich zur Nackenregion vergleichsweise sehr spärlich 97 vorkommen. Abschließend lässt sich also feststellen, dass bei Fukomys anselli eine Verringerung der Haargruppendichte im Bauchbereich im Vergleich zu anderen Regionen stattgefunden hat. Dies ist, wie im Kapitel 6.4 beschrieben, als Adaption an die Thermoregulation subterraner Nagetiere zu werten. 7.6 Haarbalgmuskel Beim Hausmeerschweinchen inseriert an den Primärhaaren jeweils ein M. arrector pili. Er besteht aus glatter Muskulatur und entspringt unterhalb der Talgdrüse an der bindegewebigen Wurzelscheide des Haarfollikels. Subepidermal ist er elastisch im Statum papillare dermidis aufgehängt. Dieser Befund entspricht im grundsätzlichen Aufbau den Verhältnissen bei Ratte, Maus, Hund, Hauskatze, Wildkatze und Schwein (Neurand & Schwarz 1969; Meyer et al. 1978a; Schwarz et al. 1981; Meyer et al. 1982a; Uhr 1984; Meyer 1986). Im Vergleich hierzu konnte beim Kleingraumull nur jeweils ein kräftiger Haarbalgmuskel aus glatter Muskulatur pro Haarverbund gefunden werden. Dies führt zu einer optimalen, gleichzeitigen Aufrichtung aller Haare innerhalb des Compounds bei kalten Temperaturen. Ein vergleichbarer Befund eines einheitlich zusammengesetzten Haarbalgmuskels für einen Haarverbund wurde von Lovell und Getty (1958) auch für die behaarte Haut des Hundes beschrieben. 7.7 Hautdrüsen Bei beiden Tierarten konnten Talgdrüsen an den Haarfollikeln aller untersuchten Regionen festgestellt werden, welche in grundsätzlichem Aufbau dem anderer Säugetiere (Sokolov 1982; Uhr 1984) ähneln. Auch die Art der holokrinen Sekretion über einen Ausführungsgang in den Haarkanal gleicht, abgesehen von Ausnahmen, wo das Sekret direkt auf die Hautoberfläche abgegeben wird, den Talgdrüsen anderer Säugetiere (Neurand & Schwarz 1969; Schwarz et al. 1981; Meyer et al. 1981b; Sokolov 1982; Saglam et al. 1994). Bei beiden untersuchten Tierarten variieren die Drüsen jedoch deutlich hinsichtlich ihrer Größe. Auffallend sind besonders die prominenten Talgdrüsen der Wollhaare. Dies entspricht auch Beobachtungen bei Maus und Ratte, die zeigen, dass die größten Talgdrüsen bei sehr kleinen Haarfollikeln vorkommen (Sokolov 1982; Uhr 1984). Das Ergebnis der vorliegenden Arbeit, 98 dass beim Meerschweinchen ein bis maximal vier Talgdrüsen radiär um den Haarfollikel angeordnet sind, deckt sich mit frühen Beschreibungen von Hieronymi (1958). Im Gegensatz dazu sind die Talgdrüsen beim Ansells Kleingraumull zirkulär um die Haarverbunde herum angeordnet. Letztere Anordnung wurde auch für den Hund beschrieben (Creed 1958; Lovell & Getty 1958): Im Bereich von Haarverbunden schließen sich die Talgdrüsen zu einem Talgdrüsenkomplex zusammen und geben ihre Sekrete in den tubulären, gemeinsamen Haartrichter mehrerer Haare ab. In ihrer Form sind die Talgdrüsen bei beiden untersuchten Tierarten einlappig. Diese Form der einlappigen Drüsen wird auch für weitere Nagetiere beschrieben (Sokolov 1982). Beim Meerschweinchen sind diese Drüsen eher zapfenförmig, während sie beim Ansells Kleingraumull eher kugelig sind. Die Talgdrüsen der subterran lebenden Blindmaus, Spalax ehrenbergi, sind ebenfalls kugelig ausgebildet (Klauer et al. 1997). Apokrin sezernierende Schlauchdrüsen konnten in den untersuchten Regionen bei beiden untersuchten Tierarten nicht gefunden werden. Dies deckt sich mit Angaben von Sokolov (1982) und Uhr (1984), dass dieser Drüsentyp in der Haut von Nagetieren nicht ausgebildet ist. 7.8 Haarkleid Die makroskopische Beschreibung des Haarkleids von Cavia aperea f. porcellus deckt sich im Wesentlichen mit frühen Untersuchungen des Meerschweinchenfells von Schühnke (1924) und Hiernomyi (1958). Auch der auffällige Befund, dass Hausmeerschweinchen keine sichtbare Unterwolle ausgebildet haben, deckt sich mit den Aussagen früherer Autoren, die beschrieben, dass Flaumhaare beim Meerschweinchen im Vergleich zu anderen Nagetieren nicht ausgebildet sind (Schünke 1924; Dawson 1930; Toldt 1935; Schilling 1939). Die Tatsache, dass Fukomys anselli eine hellere Bauchbehaarung im Vergleich zur wildfarbenen, dorsalen Behaarung zeigt, deckt sich mit den Verhältnissen beim Meerschweinchen, da auch die Wildformen diese vergleichbare Färbung zeigen (Rood 1972; Wagner & Manning 1976). Eine Aussage über regionale Unterschiede in der Fellfarbe kann in dieser Arbeit bei Cavia 99 aperea f. porcellus nicht getroffen werden, da es sich bei den untersuchten Tieren um Albinos handelte. 7.9 Allgemeine Bezüge zum Lebensraum Die vergleichende Untersuchung der Haut und Haare von Fukomys anselli und Cavia aperea f. porcellus in dieser Arbeit zeigt, dass sich der Aufbau bei beiden Tierarten grundsätzlich gleicht und nicht vom dem anderer Säugetiere unterscheidet. Dennnoch können beim subterran lebenden Ansells Kleingraumull eine Vielzahl von Haut- und Haarunterschieden im Vergleich zum epigäisch lebenden Meerschweinchen festgestellt werden, welche als Adaption an die jeweiligen Lebensbedingungen gewertet werden können. Thermoregulation Aufgrund der Ergebnisse dieser Arbeit ist anzunehmen, dass bei Fukomys anselli die Bauchseite maßgeblich für die Thermoregulation verantwortlich ist, da sie deutlich weniger Haare aufweist als die anderen Körperabschnitte und die Dermis in diesem Bereich im Verhältnis zu anderen Hautregionen verglichen mit anderen Säugetieren stark ausgebildet ist. Die Tiere geben beim Liegen in kühleren Gängen vermutlich überschüssige Wärme ab, welche in Phasen erhöhter Stoffwechselleistung (Graben, Laufen) entstanden ist. Dieser Befund deckt sich mit Beobachtungen bei einer nahe verwandten Art, Cryptomys hottentotus. Vergleicht man nun die Haardichte mit der des epigäisch lebenden Meerschweinchen, so fällt auf, dass diese bei Fukomys anselli von den dorsalen und lateralen zu den ventralen Hautabschnitten hin im Gegensatz zur vergleichsweise dichten, abdominalen Behaarung bei Cavia aperea f. porcellus signifikant abnimmt. Desweiteren ist die Dermis beim Ansells Kleingraumull in allen Bereichen der allgemeinen Körperdecke gleich stark ausgebildet und nicht in ventralen Abschnitten dünner, wie es bei anderen Spezies und auch beim Meerschweinchen im Rahmen dieser Arbeit festgestellt werden konnte. Als ein Grund kann angesehen werden, dass die Dermis mit ihrem verzweigten Gefäßsystem thermoregulatorische Aufgaben übernimmt, indem sie Wärme an die Epidermis ableitet. Gestützt wird diese Hypothese durch die Beobachtung, dass bei 100 Ansells Kleingraumullen hauptsächlich der ventrale Körperabschnitt zur Abgabe von Körperwärme dient. Dieser enthält auch einen vergleichsweise geringen Anteil an Körperfett. Einflüsse durch Photoperiodizität: In dieser Arbeit konnte dokumentiert werden, dass Fukomys anselli keinen saisonalen Fellwechsel zeigt, wie er bei vielen anderen wildlebenden Säugetieren auftritt. Ein Grund hierfür könnte sein, dass dieser entscheidend durch die Photoperiodizität anhand der jahreszeitlichen Entwicklung der Tageslängen und ergänzend durch Temperaturveränderungen beeinflusst wird. In ihrem subterranen Lebensraum sind Ansells Kleingraumulle durch vergleichsweise konstante Umweltbedingungen überwiegend gleichbleibenden Lichtverhältnissen und moderaten saisonalen und tagesperiodisch bedingten Temperaturschwankungen ausgesetzt. Desweiteren können beim Ansells Graumull keine Melanozyten in der Haut nachgewiesen werden. Dieser Zelltyp dient in erster Linie dem Schutz der Haut vor übermäßiger UVBestrahlung durch direkte Sonneneinstrahlung. Diese ist bei den obligat unterirdisch lebenden Fukomys anselli nicht gegeben und daher wurden Melanozyten offentsichtlich sekundär reduziert. Orientierung und Motilität: Fukomys anselli zeigt im Vergleich zu Cavia aperea f. porcellus einen dichten Filz elastischer Fasern in tiefen Dermisabschnitten. Dieser ermöglicht unter anderem eine Erhöhung der Elastiziät und Verformbarkeit der Haut, was beim Vor - und Rückwärtslaufen in den engen, unterirdischen Gängen deutliche Vorteile liefert. Weiterhin scheint die Anordnung der Haarfollikel in Compounds, wie sie bei Fukomys anselli gefunden werden konnten, ein charakteristisches Merkmal subterraner Nagetiere zu sein, welches ermöglicht, dass die Haarbüschel beim Vorwärts- und Rückwärtslaufen leicht in beide Richtungen gebogen werden können. 101 Abschließend lässt der Nachweis von Leithaaren bei Fukomys anselli in allen untersuchten Körperregionen die Vermutung zu, dass sie, ähnlich wie die gut innervierten, vibrissenähnlichen Leithaare verwandter Mullspezies, der non-visuellen Orientierung im unterirdischen Gangsystem dienen. Diese Meerschweinchen nicht nachgewiesen werden. speziellen Sinneshaare konnten beim 102 Filiz Hesselmann „Vergleich der mikroskopischen Anatomie der Haut und Hautanhangsorgane des Hausmeerschweinchens (Cavia aperea f. porcellus) und des Ansells Kleingraumulls (Fukomys anselli) unter Berücksichtigung ihrer Anpassung an unterschiedliche Lebensräume“ 8. Zusammenfassung In dieser Arbeit wurde das Integumentum commune des Hausmeerschweinchens, Cavia aperea f. porcellus, und des Ansells Kleingraumulls, Fukomys anselli, untersucht. Die Ergebnisse beider Tierarten wurden miteinander, sowie mit den Befunden anderer Autoren verglichen. Es wurden jeweils bei fünf männlichen und fünf weiblichen Tieren beider Spezies Hautproben von sechs unterschiedlichen Hautstellen (Regio colli, Regio vertebralis thoracis, Regio lumbalis, Regio abdominalis lateralis, Regio umbilicalis, Regio pubica) entnommen und Sagittal (3-5 µm)- sowie Horizontalschnitte (10 µm) angefertigt. Die Schnittpräparate wurden mit verschiedenen Methoden angefärbt (H.E., Toluidinblau,Trichromatische Bindegewebsfärbung, Orcein), um die unterschiedlichen Strukturen sichtbar zu machen, und histologisch untersucht. Mit einem speziellen Computerprogramm (Analysis, Version 5.0, Münster, Deutschland) wurden Messungen an Haut und Hautanhangsorganen (Schichtdicke von Epidermis und Dermis, Haarfollikeldichte pro cm², Fläche der Haargruppen und Anzahl der Haare pro Haargruppe) durchgeführt. Das Integumentum commune beider Tierarten glich in seinem grundsätzlichen Aufbau dem anderer Säugetiere. Es konnten jedoch einige Unterschiede differenziert werden, welche als Adaption an den Lebensraum interpretiert werden können. Die Dermis des Kleingraumulls ist in allen Bereichen der allgemeinen Körperdecke gleich stark ausgebildet und nicht in ventralen Abschnitten (Regio umbilicalis, Regio pubica) dünner, wie es beim Meerschweinchen im Rahmen dieser Arbeit, aber auch bei anderen 103 Säugetierspezies festgestellt werden konnte. Auch die Subkutis ist in den ventralen Hautabschnitten bei Fukomys anselli vergleichsweise dünn. Desweiteren nimmt die Haardichte bei Fukomys anselli von den dorsalen und lateralen zu den ventralen Hautabschnitten hin signifikant ab. Dies ist ein deutlicher Gegensatz zur vergleichsweise dichten, abdominalen Behaarung bei Cavia aperea f. porcellus. Aufgrund dieser Ergebnisse kann gedeutet werden, dass die Bauchseite von Fukomys anselli ein maßgeblicher Ort der Thermoregulation ist, über die beim Liegen in kühlen Flächen Wärme an den Boden abgegeben wird, welche in Phasen erhöhter Stoffwechselleistung entstanden ist. Eine vergleichbare Lokalisation von wärmeabgebenden Hautarealen wurde auch bei einem nahen Verwandten, Cryptomys hottentotus, beobachtet. Es kann somit davon ausgegangen werden, dass dies ein allgemeiner Mechanismus ist, der bei den Vertretern der Bathyergidae vergleichbar entwickelt wurde. Weiterhin zeigt Fukomys anselli keinen saisonalen Fellwechsel, wie er bei vielen wildlebenden Säugetieren vorkommt, und es konnten in seiner Haut keine Melanozyten nachgewiesen werden. Beide Befunde können als Adaption an fehlende UV-Bestrahlung und Photoperiodizität verbunden mit moderaten Temperaturschwankungen im subterranen Habitat interpretiert werden. Der Ansells Kleingraumull zeigt im Vergleich zum Hausmeerschweinchen einen dichten Filz elastischer Fasern in tiefen Dermisabschnitten sowie eine Anordnung der Haarfollikel in gruppierte Verbundfollikel im Vergleich zu den einfachen Haargruppen des Hausmeerschweinchens. Dies führt zu einer erhöhten Verschieblichkeit der Haut und einer größeren Beweglichkeit der Haare in verschiedene Richtungen. Dies wird ebenfalls als Anpassung an die engen, unterirdischen Gänge und die Notwendigkeit des Vor- und Rückwärtslaufens der Tiere interpretiert. Abschließend lässt der Nachweis von Leithaaren bei Fukomys anselli in allen untersuchten Körperregionen die Vermutung zu, dass diese, ähnlich wie die gut innervierten, vibrissenähnlichen Leithaare verwandter Mullspezies, der nonvisuellen Orientierung im unterirdischen Gangsystem dienen. 104 Filiz Hesselmann „Comparison of the microscopic anatomy of the skin and the accessory skin organs of the domestic guinea pig (Cavia aperea f. porcellus) and of the Ansell´s mole-rat (Fukomys anselli) with regards to the adaptation to their natural habitats” 9. Summary In our study the integument commune of the domestic guinea pig, Cavia aperea f. porcellus, and of the Ansell´s mole-rat, Fukomys anselli, was examined. The results for both species were compared with each other, as well as with the results of previous studies by different authors. Skin samples from six different skin regions (Regio colli, Regio vertebralis thoracis, Regio lumbalis, Regio abdominalis lateralis, Regio umbilicalis, Regio pubica) were obtained from five male and five female animals of each species, and 3-5 µm sagittal as well as 10 µm horizontal sections were prepared. The sections were stained with different staining methods (H.E., Toluidinblue, Trichromatic connective tissue stain, Orcein) in order to visualize and evaluate histologically the different skin structures. The skin and accessory skin organs (thickness of the epidermis, dermis, hair follicles per cm2, area of hair groupings and number of hairs per hair group) were measured with a specific computer program (Analysis, Version 5.0, Münster, Germany). The integument commune of both species correlates in its general structure with that of numerous other mammals. However, a number of documented differences are found could be interpreted as an adaptation to the habitat and the mode of life of these species. The dermis of the Ansell´s mole-rat is evenly developed in all areas of the common integument and not thinner in ventral abdominal regions (Regio umbilicalis, Regio pubica) as it was established in the investigated guinea pig, as well as in other mammals. In the ventral areas of the body, the subcutis of Fukomys anselli is relatively thin. The hair density of F. anselli decreases from the dorsal and lateral areas to the ventral skin areas. This is in contrast 105 to the relatively dense abdominal hair growth in Cavia aperea f. porcellus. Due to these results one can conclude that the ventral abdominal skin of F. anselli is an area of thermoregulation that allows by lying on cool soil surfaces, emitting of heat during times of increased metabolism. A comparable heat emitting skin area could also be observed in the closely related Cryptomys hottentotus. Thus, one can assume that this is a common mechanism which has been developed by all species belonging to the family Bathyergidae. Further more, F. anselli does not show a seasonal change of coat as it is evident in many mammalian species, and no melanocytes could be detected in its skin. Both results can be interpreted as an adaptation to the lack of UV light and photo periodicity and in connection with moderate temperature changes in subterranean habitats. In comparison to the domestic guinea pig, the Ansell´s mole-rat exhibits a more dense felt of elastic fibers in the deep areas of the dermis. Further more the hair follicles are arranged in grouped networks of follicles, which stands in contrast to the simple grouping of hairs of the domestic guinea pig. This leads to an increased mobility of the skin and an increased flexibility of the hairs in different directions, resulting in an adaptation to the small underground tunnels in which they live and enabling them to move forwards and backwards with the same speed. In conclusion, the proof of the existence of guard hairs of Fukomys anselli in all examined body areas leads to the assumption that those hairs, similar to the well innervated, vibrissaelike guard hairs of related mole-rat species, serve the non-visual orientation within the dark tunnel systems. 106 10. Literaturverzeichnis Adam, H. (1964): Die Haut der Säugetiere. Bau und Funktion. Studium Generale 6: 350-362 Andreasen, E. (1953): Cyclic changes in the skin of the mouse. Acta Pathol Microbiol Scand 32(1): 157-164 Arieli, R. (1979): The atmospheric environment of fossorial mole rat (Spalax ehrenbergi): effect of season, soil texture, rain, temperature and activity. Comp Biochem Physiol A 63: 569-575 Asdell, S.A. (1964): Patterns of mammalian reproduction. Cornell Univ Press, Ithaca: 670 pp Asher, M., Lippmann, T., Epplen, J.T., Kraus, C., Trillmich, F. und Sachser, N. (2008): Large males dominate: ecology, social organisation, and mating system of wild cavies, the ancestors of the guinea pig. Behavioral Ecology Sociobiology 62: 1509-1521 Begall, S. (2009): Persönliche Mitteilung. Fachbereich Zoologie, Universität Duisburg-Essen Begall, S. und Burda, H. (1998): Reproductive characteristics and growth rate in the eusocial Zambian common mole-rat (Cryptomys sp., Bathyergidae). Z für Säugetierkunde 63(5): 297-306 Begall, S., Lange, S., Schleich, C.E. und Burda, H. (2007a): Acoustics, Audition and Auditory System. In: Begall, S., Burda, H., Schleich, C. E. (Hrsg.): Subterranean Rodents. News from underground. Verlag Springer, Berlin, Heidelberg. S. 97-111. Begall, S., Burda, H. und Schleich, C.E. (2007b): Subterranean Rodents. News from underground. Verlag Springer, Berlin, Heidelberg. Benecke, N. (1994): Der Mensch und seine Haustiere. Verlag Konrad Theiss GmbH & Co, Stuttgart. 107 Bielefeld, H. (1977): Meerschweinchen. Alles über Anschaffung, Pflege, Ernährung und Krankheiten. 2. Auflage. Verlag Gräfe und Unzer GmbH, München. Bonnet, R. (1887): Haut und Anhänge. In: Ellenberger, W. (Hrsg.): Handbuch der vergleichenden Histologie und Physiologie der Haussäugetiere. Verlag Parey, Berlin. Bd. 1, S. 381-450 Bosse, K. (1965): Prospects for comparative dermatology. In: Rook, A.J. u. Walton, G.S. (Hrsg): Comparative physiology and pathology of the skin. Verlag Blackwell, Oxford. S. 3-14. Bosse, K. (1966): Comparative studies of the physiology and pathology of hair shedding with special reference to its synchronization. I. Introduction and problem presentation. Hautarzt 17(12): 541-546 Bosse, K. und Burzynski, Z. (1964): The physiological hair growth in different Guinea Pig species. Arch Klin Exp Dermatol 218: 158-164 Bosse, K. und Kostanecki, W. (1964): Temporary physiological synchronization of the hair cycle in Guinea Pigs. Hautarzt 15: 305-308 Breazile, J.E. und Brown, E.M. (1976): Anatomy. In: Wagner, J.E. (Hrsg): The biology of the guinea-pig. Academic Press, New York. S. 53-62 Bronaugh, R.L., Stewart, R.F. und Congdon, E.R. (1982): Methods for in vitro percutaneous absorption studies: II. Animal models for human skin. Toxicol Appl Pharmacol 62: 481-488 Bullough, W.S. und Laurence, E.B. (1961): Stress and adrenaline in relation to the diurnal cycle of the epidermal mitotic activity in adult male mice. Proc R Soc Lond 154: 540-556 Burda, H. (1989): Reproductive biology (behaviour, breeding, and postnatal development) in subterranean mole-rats, Cryptomys hottentotus (Bathyergidae). Z für Säugetierkunde 54: 360-376 108 Burda, H. (1990c): Constraints of pregnancy and evolution of solitary in mole-rats. Z zool Syst Evolut-Forsch 28: 26-39 Burda, H. (2003): Adaptations for subterranean life Mammals I of Grzimek’s Animal Life Encyclopedia, edited by Devra G Kleinman, Valerius Geist, Michael Hutchins, and Melissa C McDase, Farmington Hills, Mich: Gale Group 12: 69-78 Burda, H., Honeycut, R.L., Begall, S., Locker-Grütjen, O. und Scharff, A. (2000): Are naked and common mole-rats eusocial and if so, why? Behav Ecol Sociobiol 47: 293-303 Burda, H. und Kawalika, M. (1993): Evolution of eusociality in the Bathyergidae. The case of the giant mole rats (Cryptomys mechowi). Naturwissenschaften 80(5): 235-237 Burda, H., Marhold, S., Westenberger, T., Wiltschko, R. und Wiltschko, W. (1990b): Magnetic compass orientation in the subterranean rodent Cryptomys hottentotus (Bathyergidae). Experientia 46(5): 528-530 Burda, H., Sumbera, R. und Begall, S. (2007): Microclimate in burrows of subterranean rodents - revisited. In: Begall, S., Burda, H., Schleich, C. E. (Hrsg.): Subterranean rodents. News from underground. Verlag Springer, Berlin, Heidelberg. S. 21-33. Burda, H., Zima, J., Scharff, A., Macholan, M. und Kawalinka, M. (1999): The karyotypes of Cryptomys anselli sp. Nova and Cryptomys kafuensis sp. Nova: New species of the common mole-rat from Zambia (Rodentia, Bathyergidae). Z für Säugetierkunde 64: 36-50 Cassini, M.H. (1991): Foraging under predation risk in the wild guinea pig Cavia aperea. Oikos 62: 20-24 Cassini, M.H. und Galante, M.L. (1992): Foraging under predation risk in the wild guinea pig: the effect of vegetation height on habitat utilization. Annales Zoologici Fennici 29: 285-290 Chase, H.B. (1954): Growth of the hair. Physiol Rev 34(1): 113-126 109 Clutton-Brock, J.A. (1989): Natural History of Domesticated Mammals. Cambridge University Press, Cambridge. Credner, S., Burda, H. und Ludescher, F. (1997): Acoustic communication underground: vocalization characteristics in subterranean social mole-rats (Cryptomys sp., Bathyergidae). J Comp Physiol [A] 180(3): 245-255 Creed, R.F.S. (1958): The histology of mammalian skin, with special reference to the dog and cat. Vet Rec 70: 171-175 Cripps, D.J. (1981): Natural and artificial photoprotection. J invest Dermatol 76: 154-157 Crish, S.D., Rice, F.L., Park, T.J. und Comer, C.M. (2003): Somatosensory organization and behavior in naked mole-rats I: vibrissa-like body hairs comprise a sensory array that mediates orientation to tactile stimuli. Brain Behav Evol 62(3): 141-151 Daly, T.J. und Buffenstein, R. (1998): Skin morphology and its role in thermoregulation in mole-rats, Heterocephalus glaber and Cryptomys hottentotus. J Anat 193 ( Pt 4): 495-502 Dammann, P. und Burda, H. (2006): Sexual activity and reproduction delay ageing in a mammal. Curr Biol 16(4): 117-118 Dawson, H.L. (1930): A study of hair growth in the guinea-pig (Cavia cobaya). Am J Anat 45: 461-484 De Villez, R.L. (1986): The Growth and Loss of Hair. Current Concepts Dry, F.W. (1926): The coat of the mouse (Mus musculus). J Genet 16: 287-340 Durward, A. und Rudall, K.M. (1949): Studies on hair growth in the rat. J Anat 83: 325-335 110 Ebling, F.J. (1957): The action of testosterone on the sebaceous glands and epidermis in castrated and hypophysectomized rats. J Endocrinol 15: 297-306 Faulkes, C.G., Bennett, N.C., Bruford, M.W., O'Brien, H.P., Aguilar, G.H. und Jarvis, J.U. (1997): Ecological constraints drive social evolution in the African mole-rats. Proc Biol Sci 264(1388): 1619-1627 Faulkes, C.G., Verheyen, E., Verheyen, W., Jarvis, J.U. und Bennett, N.C. (2004): Phylogeographical patterns of genetic divergence and speciation in African mole-rats (Family: Bathyergidae). Mol Ecol 13(3): 613-629 Gabrisch, K. und Zwart, P. (2008): Krankheiten der Heimtiere, 7. Auflage. Schlütersche Verlagsgesellschaft, Hannover. Gade, D.W. (1967): The guinea pig in andean folk culture. Geographical Review 57: 213-224 Geneser, F. (1990): Histologie. Deutscher Ärzte-Verlag GmbH, Köln. Grzimek, B. (1975): Grzimek´s animal life encyclopedia. Mammals, I-IV. Van Nostrand Reinhold, New York. Guichón, M.L. und Cassini, M.H. (1998): Role of diet selection in the use of habitat by pampas cavies Cavia aperea pamparum (Mammalia, Rodentia). Mammalia 62: 23-35 Hackländer, T. (1972): Die Vaskularisation der Haut der Haussäugetiere im Vergleich zum Menschen. Dissertation. Tierärztl. Hochschule Hannover. Hadley, M.E. (1972): Functional significance of vertebrate integumental pigmentation. Am Zool 12: 63-76 Hamel, I. (1990): Das Meerschweinchen. Heimtier und Patient. Verlag VEB Gustav Fischer, Jena. 111 Harkness, J.E. und Wagner, J.E. (1989): Biology and husbandry. In: Wagner, J.E. and Manning, P.J. (Hrsg.): The Biology of the Guinea Pig. Academic Press, New York. Harper, L.V. (1976): Behavior. In: Wagner, I.E., Manning, P.J. (Hrsg.): The Biology of the Guinea Pig. Academic Press, New York, San Francisco, London. Heite, H.J. und Ritter, K. (1962): Fehlerkritische Studie zur Messung der Epidermisbreite beim Akanthose-Test. Dermatologica (Basel) 124: 406-419 Herre, W. und Röhrs, M. (1990): Haustiere - zoologisch gesehen. Gustav Fischer Verlag Stuttgart, New York. Hieronymi, E. (1958): Haut. In: Chors, I., Jatté, P., Meesen, R. (Hrsg.): Pathologie der Laboratoriumstiere. Verlag Springer, Berlin. Hildebrand, M. (1988): Analysis of Vertebrate Structure, 3. Auflage. Verlag John Wiley & Sons, New York. Hohoff, C. (2002): Female choise in three species of wild guinea pigs. PhD thesis. University of Münster, Germany. Honeycutt, R.L., Nelson, K., Schlitter, D.A. und Sherman, P.W. (1991): Genetic variation within and among populations of the naked mole-rat: evidence from nuclear and mitochondrial genomes. In: Sherman, P.W., Jarvis, J.U.M., Alexander, R.D. (Hrsg.): The biology of the naked molerat. Princeton Univ. Press, Princeton, NJ. S. 195-208. Hückinghaus, F. (1961): Zur Nomenklatur und Abstammung des Hausmeerschweinchens. Z für Säugetierkunde 26: 108-111 Hussein, M.A. (1971): The overall pattern of hair follicle arrangement in the rat and mouse. J Anat 109 (Pt 2): 307-316 112 Hussein, M.A. (1972): The orientation of connective tissue fibres in rat skin. Acta Anat (Basel) 82(4): 549-564 Hyams, E. (1972): Animals in the service of man: 10 000 years of domestication. J.M. Dent and Sons Ltd., London. Ingram, C.M., Burda, H. und Honeycutt, R.L. (2004): Molecular phylogenetics and taxonomy of the African mole-rats, genus Cryptomys and the new genus Coetomys Gray, 1864. Mol Phylogenet Evol 31(3): 997-1014 Jäckel, M. und Trillmich, F. (2003): Olfactory individual recognition of mothers by young guinea-pigs (Cavia porcellus). Ethology 109: 197-208 Jacobs, G.H. und Deegan, J.F. (1994): Spectral sensitivity, photopigments, and color vision in the guinea pig (Cavia porcellus). Behav Neurosci 108: 993-1004 Jarvis, J.U.M. und Bennett, N.C. (1991): Ecology and Behavior of the Family Bathyergidae. In: Sherman, P.W., Jarvis, J.U.M., Alexander, R.D. (Hrsg): The Biology of the naked molerat. Princeton Univ. Press, Princeton, NJ. S. 66-96. Johnson, E. (1972): Moulting cycles. Mammal Rev 1: 198-208 Kennerly, T.J. (1964): Microenvironmental conditions of the pocket gopher burrow. Texas Journal of Science 16: 395-441 Kimchi, T., Reshef, M. und Terkel, J. (2005): Evidence for the use of reflected self-generated seismic waves for spatial orientation in a blind subterranean mammal. J Exp Biol 208(Pt 4): 647-659 Klauer, G., Burda, H. und Nevo, E. (1997): Adaptive differentiations of the skin of the head in a subterranean rodent, Spalax ehrenbergi. J Morphol 233(1): 53-66 Kock, D., Ingram, C.M., Frabotta, L.J., Honeycutt, R.L. und Burda, H. (2006): On the nomenclature of Bathyergidae and Fukomys n. gen. (Mammalia: Rodentia). Zootaxa 1142: 51-55 113 Komárek, V. (2000): Gross Anatomy. In: Krinke, G.J. (Hrsg.):The Handbook of Experimental Animals. The Laboratory Rat. Academic Press, San Diego, San Francisco, New York, Boston, London, Sydney, Tokyo. S. 254 f. Kristensen, S. (1975): A study of skin diseases in dogs and cats. I. Histology of the hairy skin of dogs and cats. Nord Vet Med 27(12): 593-603 Künzel, E. (1990): Haut (Integumentum commune). In: Mosimann, W. u. Kohler, T. (Hrsg): Zytologie, Histologie und mikroskopische Anatomie der Haussäugetiere. Verlag Parey, Berlin, Hamburg. S. 259-287 Künzl, C., Kaiser, S., Meier, E. und Sachser, N. (2003): Is a wild mammal kept and reared in captivity still a wild animal? Horm Behav 43: 187-196 Künzl, C. und Sachser, N. (1999): The behavioral endocrinology of domestication: A comparison between the domestic guinea pig (Cavia aperea f. porcellus) and its wild ancestor, the cavy (Cavia aperea). Horm Behav 35(1): 28-37 Lange, S., Burda, H., Wegner, R.E., Dammann, P., Begall, S. und Kawalika, M. (2007): Living in a "stethoscope": burrow-acoustics promote auditory specializations in subterranean rodents. Naturwissenschaften 94(2): 134-138 Lauer, I. (2003): Kleintiere. Unsere liebenswerten Freunde. Verlag Neuer Honos Köln. Liebich, H.-G. (1999): Funktionelle Histologie der Haussäugetiere. Lehrbuch und Farbatlas für Studium und Praxis, 3. Auflage. Verlag Schattauer, Stuttgart, New York, S. 303-324. Lochte, T. (1938): Atlas der menschlichen und tierischen Haare. Verlag Schops, Leipzig. Lovell, J.E. und Getty, R. (1958): The hair follicle, epidermis, dermis and skin glands of the dog. Amer J Vet Res 18: 873-885 114 Marhold, S. und Nagel, A. (1995): The energetics of the common mole rat Cryptomys, a subterranean eusocial rodent from Zambia. Journal of Comparative Physiology B 164: 636-645 Meyer, W. (1986): Die Haut des Schweines (Archiv für tierärztliche Fortbildung, Bd. 9). Verlag Schlütersche Verlagsanstalt, Hannover. Meyer, W. (1998): Haut und Hautorgane. In: Wissdorf, H., Gerhards, H. u. Huskamp, B. (Hrsg.): Praxisorientierte Anatomie des Pferdes. Verlag Schaper, Hannover. S.19-48. Meyer, W. (2009): Hair follicles in domesticated mammals with comparison to laboratory animals and humans. In: Mecklenburg, L., Linek, M., Tobin, D. J. (Hrsg): Hair Loss Disorders in Domestic Animals. Verlag Wiley Blackwell, Ames, Iowa. S. 43-62 Meyer, W. (2009b): Persönliche Mitteilung Ana Inst TiHo Hannover Meyer, W., Bartels, T. und Schwarz, R. (1990): Zur Struktur und Funktion der Fußballen der Katze. Kleintierpraxis 35(2): 67-76 Meyer, W., Neurand, K. und Schnapper, A. (2000): SEM demonstration of elastic fibres in the integument of small and densely-haired mammals. Folia Morphol (Warsz) 59(4): 279-283 Meyer, W., Neurand, K. und Schwarz, R. (1978b): Die Haut der Haussäugetiere (2). Tierärztl Prax 6: 289-298 Meyer, W., Neurand, K. und Schwarz, R. (1978c): Significance of the apocrine skin glands in the general body surface of various domestic mammals. Dtsch tierärztl Wochenschr 85(6): 194-197 Meyer, W., Neurand, K. und Schwarz, R. (1980): Der Haarwechsel der Haussäugetiere. II. Topographischer Ablauf, Vergleich Haustier Wildtier und Steuerungsmechanismen. Dtsch tierärztl Wochenschr 87: 77-116 115 Meyer, W., Neurand, K., Schwarz, R., Bartels, T. und Althoff, H. (1994): Arrangement of elastic fibres in the integument of domesticated mammals. Scanning Microsc 8(2): 375-390; discussion 391 Meyer, W., Schwarz, R. und Neurand, K. (1978a): Die Haut der Haussäugetiere (1). Tierärztl Prax 6: 153-162 Meyer, W., Schwarz, R. und Neurand, K. (1978d): The skin of domestic mammals as a model for the human skin, with special reference to the domestic pig. Curr Probl Dermatol 7: 39-52 Meyer, W., Uhr, G. und Schwarz, R. (1981b): Untersuchungen an der Haut der Europäischen Wildkatze (Felis silvestris Schreber). I. Hautschichten und Hautdrüsen. Zool Jb Anat 106: 163-185 Meyer, W., Uhr, G., Schwarz, R. und Radke, B. (1982a): Untersuchungen an der Haut der Europäischen Wildkatze (Felis silvestris Schreber). II: Haarkleid. Zool Jb Anat 107: 205-234 Militzer, K. (1982): Haut- und Hautanhangsorgane kleiner Laboratoriumstiere. Teil I: Vergleichende Morphologie der Haut und der Haare von Maus, Ratte, Hamster, Meerschweinchen und Kaninchen. Verlag Parey, Berlin, Hamburg. Müller-Haye, B. (1981): Guinea pig ore cuy. In: Clutton-Brock, J. (Hrsg.): Domesticated animals from early times. University of Texas Press, Austin, London. S. 252-257. Nachtsheim, H. und Stengel, H. (1977): Vom Wildtier zum Haustier. Verlag Paul Parey, Berlin, Hamburg. Nemec, P., Burda, H. und Peichl, L. (2004): Subcortical visual system of the African mole-rat Cryptomys anselli: to see or not to see? Eur J Neurosci 20(3): 757-768 Nemec, P., Cveková, P., Burda, H., Benada, O. und Peichl, L. (2007): Visual Systems and the Role of Vision in Subterranean Rodents: Diversity of Retinal Properties and Visual System Designs. In: Begall, S., Burda, H., Schleich, C.E. (Hrsg): Subterranean rodents. News from underground. Verlag Springer, Berlin, Heidelberg. S. 129-160 116 Neurand, K., Meyer, W. und Schwarz, R. (1980): Shedding in domestic mammals. I. General problem and time course. Dtsch tierärztl Wochenschr 87(1): 27-31 Neurand, K. und Schwarz, R. (1969): Microscopic studies of the skin in cats. Epidermis, corium, subcutis. Dtsch tierärztl Wochenschr 76(19): 521-527 Nevo, E. (1999): Mosaic evolution of subterranean mammals. Regression, progression and global convergence. Oxford University Press, Oxford. Nevo, E., Ben-Shlomo, R., Beiles, A., Jarvis J.U.M. und Hickman, G.C. (1987): Allozyme differentiation and systematics of the endemic subterranean mole-rats of South Afrika. Biochem Syst Ecol 15: 489-502 Niedoba, T. (1917): Untersuchungen über die Haarrichtung der Haussäugetiere 1. Vorläufige Mitteilung. Tierärztliche Hochschule in Wien, Anatomisches Institut, S. 178-192 Noback, C.R. (1951): Morphology and phylogeny of hair. Ann N Y Acad Sci 53(3): 476-492 Noonan, D. (1994): The Guinea Pig (Cavia porcellus). Anzccart News 7(3): 1-8 Nowak, R.M. (1991): Walker´s Mammals of the World. Johns Hopkins University Press, Baltimore and London. Oberste-Lehn, H. und Nobis, A. (1963): Die Haaranordnung beim Menschen und bei einigen Säugetieren. Zeitschrift für Anatomie und Entwicklungsgeschichte 123: 589-642 Oberste-Lehn, H. und Wiemann, F.-W. (1959): Die Meerschweinchenhaut als dermatologisches Testobjekt. Arch klin exp Derm 209: 539-550 Ohnacker, H. (1960): Über die mitotische Aktivität in Epidermis und äußerer Wurzelscheide während eines Haarzyklus bei Albinomäusen, Dissertation. Universität Mainz, Medizinische Fakultät. 117 Parakkal, P.F. (1969): The fine strucure of anagen hair follicle of the mouse. Adv Biol Skin 9: 441-669 Parakkal, P.F. (1970): Morphogenesis of the hair follicle during catagen. Z Zellforsch Mikrosk Anat 107(2): 174-186 Park, T.J., Comer, C., Carol, A., Lu, Y., Hong, H.S. und Rice, F.L. (2003): Somatosensory organization and behavior in naked mole-rats: II. Peripheral structures, innervation, and selective lack of neuropeptides associated with thermoregulation and pain. J Comp Neurol 465(1): 104-120 Paus, R., Handjiski, B., Czarnetzki, B.M. und Eichmuller, S. (1994): Biology of the hair follicle. Hautarzt 45(11): 808-825; quiz 824-805 Peichl, L., Nemec, P. und Burda, H. (2004): Unusual cone and rod properties in subterranean African mole-rats (Rodentia, Bathyergidae). Eur J Neurosci 19(6): 1545-1558 Pinkus, H. (1964): Die makroskopische Anatomie der Haut. In: Jadassohn, J. (Hrsg.): Handbuch der Haut - und Geschlechtskrankheiten. Verlag Springer, Berlin, Heidelberg, New York. Ergw. Bd. I/2, S. 1-138 Pinkus, H. (1971): Embryology and anatomy of skin. In: Helwig, E.B, Mostofi, F.K (Hrsg.): The skin. Williams & Wilkins, Baltimore, S. 1-27 Priestley, G.C. (1967): Histological studies of the skin follicle types of the rat with special reference to the structure of the Huxley layer. J Anat 101(Pt 3): 491-504 Raebiger, H. (1933): Das Meerschweinchen. Seine Zucht, Haltung und Krankheiten. 2.Auflage. Verlag M. und H. Schaper, Hannover. Richardson, K.C., Jarett, L. und Finke, E.H. (1960): Embedding in epoxy resins for ultrathin sectioning in electron microscopy. Stain Technol 35: 313-323 118 Richter, R. (1963): Die Haare. In: Handbuch der Haut - und Geschlechtskrankheiten, Ergänzungswerk I/3. Marchionini, A., Spier, H. W. (Hrsg.): Normale und pathologische Physiologie der Haut I. Verlag Springer, Berlin. Romeis, B. (1989): Mikroskopische Technik, 17. Auflage. Verlag Urban & Schwarzenberg. Rood, J.P. (1972): Ecological and behavioural comparisons of three genera of Argentine cavies. Animal Behaviour Monographs 5: 1-83 Roper, T.J., Bennett N.C., Conradt, L. und Molteno, A.J. (2001): Environmental conditions in burrows of two species of African mole-rat, Georhychus capensis and Cryptomys damarensis. Journal of Zoology, London 254: 101-107 Ryder, M. (1973): Skin. In: Studies in Biology. Verlag Arnold, London. Sachser, N. (1998): Of domestic and wild guinea pigs: studies in sociophysiology, domestication, and social evolution. Naturwissenschaften 85: 307-317 Sachser, N., Künzl, C. und Kaiser, S. (2004): The Wellfare of Laboratory Guinea Pigs. Kluwer Academic Publishers: 181-209 Sachser, N., Lick, C., Beer, R. und Weinandy, R. (1992): Tagesgang von Serum-Hormonkonzentrationen und ethologischen Hausmeeschweinchen. Verhandlungen der Deutschen Zoologischen Gesellschaft 85: 120 Parametern bei Sachser, N., Schwarz-Weig, E., Keil, A. und Epplen, J.T. (1999): Behavioural strategies, testis size, and reproductive success in two caviomorph rodents with different mating systems. Behaviour 136: 1203-1217 Saglam, M., Meyer, W., Schwarz, R. und Tanyolac, A. (1994): Microscopic studies of the skin of Turkish angora goats. III. Cyclic annual growth of the sebaceous glands and hypodermis. Dtsch tierärztl Wochenschr 101(9): 343-346 119 Sato, H., Matsuda, H., Kubota, S. und Kawano, K. (2006): Statistical comparison of dog and cat guard hairs using numerical morphology. Forensic Sci Int 158(2-3): 94-103 Scharff, A. (1998): Systematik und Verhaltensökologie sambischer Sandgräber (Bathyergidae, Rodentia). Universität GH Essen, FB9, Verlag Logos, Berlin. Schilling, L. (1939): Untersuchungen zur Variabilität der Meerschweinchenhaare und ihrer Pigmente. Z Indukt Abstamm Vererbungsl 76: 535-568 Schmidt, G. (1985): Hamster, Meerschweinchen, Mäuse und andere Nagetiere. 2. Auflage. Eugen Ulmer Verlag, Stuttgart. Schünke, P. (1924): Untersuchung über Haare von der Ratte, dem Meerschweinchen, der Hausmaus und der weissen Maus. Schumacher, S. (1931): Integument der Mammalier. In: Bolk, L.; Göppert, E.; Kallius, E. u. Lubosch, W. (Hrsg.): Handbuch der vergleichenden Anatomie der Wirbeltiere. Verlag Urban & Schwarzenberg, Berlin, Wien. Bd. 1, S. 449-504 Schwarz, R., Le Roux, J.M., Schaller, R. und Neurand, K. (1979): Micromorphology of the skin (epidermis, dermis, subcutis) of the dog. Onderstepoort J Vet Res 46(2): 105-109 Schwarz, R. und Meyer, W. (1994): Haut und Hautorgane. In: Frewein, J. u. Vollmerhaus, B. (Hrsg.): Anatomie von Hund und Katze. Verlag Blackwell, Berlin. S. 316-340 Schwarz, R., Meyer, W. und Neurand, K. (1981): Die gesunde Haut von Hund und Katze. Kleintierpraxis 26: 395-402 Schwarz, R., Saglam, M., Tanyolac, A., Asti, R., Ozcan, Z. und Meyer, W. (1991): Microscopic studies of the skin of the Turkish angora goat. II. Functional morphology of the hair follicle. Dtsch tierärztl Wochenschr 98(8): 297-303 120 Shams, I., Avivi, A. und Nevo, E. (2005): Oxygen and carbon dioxide fluctuations in burrows of subterranean blind mole rats indicate tolerance to hypoxic-hypercapnic stresses. Comp Biochem Physiol A Mol Integr Physiol 142(3): 376-382 Smallwood, J. (1992): Laboratory mammals. In: A guided tour of veterinary anatomy: domestic ungulates and laboratory mammals. W. B. Saunders Company, Philadelphia. Sokolov, V.E. (1982): Mammal skin. Verlag University of California Press, Berkeley, Los Angeles, London. Southwood, W.F.W. (1955): The thickness of the skin. Plast Reconstr Surg 15: 423-429 Spearman, R.I. (1970): Some light microscopical observations on the stratum corneum of the guinea-pig, man and common seal. Br J Dermatol 83(5): 582-590 Stahnke, A. (1987): Verhaltensunterschiede zwischen Wild- und Hausmeerschweinchen. Z für Säugetierkunde 52: 294-307 Stein, B.R. (2000): Morphology of subterranean rodents. In: Lacey, E.A., Patton, J.L., Cameron, G.N. (Hrsg.): Life Underground. The Biology of subterranean rodents. University of Chicago Press, Chicago, Illinois. S.19-61 Straile, W.E. (1960): Sensory hair follicles in mammalian skin: the tylotrich follicle. Am J Anat 106: 133-141 Strickland, J.H. und Calhoun, M.L. (1963): The integumentary system of the cat. Amer J Vet Res 24: 1018-1029 Sumbera, R., Chitaukali, W.N., Elichová, M, Kubová, J, Burda, H (2004): Microclimatic stability in burrows of an Afrotropical solitary bathyergid rodent, the silvery mole-rat (Heliophobius argenteocinereus). Journal of Zoology, London 263: 409-416 121 Sumbera, R., Zelova, J., Kunc, P., Knizkova, I. und Burda, H. (2007): Patterns of surface temperatures in two mole-rats (Bathyergidae) with different social systems as revealed by IR-thermography. Physiol Behav 92(3): 526-532 Sutherland, S. und Festing, M. (1987): The guinea-pig. In: Poole, T. (Hrsg): The UFAW Handbook of the Care and Management of Laboratory Animals. 6th ed. Longman Scientific and Technical Longman Group, London. Terril, L.A. und Clemons, D.J. (1998): The Laboratory Guinea Pig. CRC Press LLC. Toldt, K. (1935): Aufbau und natürliche Färbung des Haarkleides der Wildsäugetiere. Deutsche Gesellschaft f. Kleintier- u. Pelztierzucht, Leipzig. Uhr, G. (1984): Vergleichende Untersuchungen an Haut und Haarkleid von Mus musculus domesticus Rutty, 1772 und Rattus norvegicus Berkenhout, 1769, Dissertation. Universität Hannover, Fachbereich Biologie. Van Daele, P.A.A.G., Dammann, P., Meier, J.L., Kawalika, M., Van De Woestijne, C. und Burda, H. (2004): Chromosomal diversity in mole-rats of the genus Cryptomys (Rodentia: Bathyergidae) from the Zambezian region: with descriptions of new karyotypes. Journal of Zoology 264: 317-326 Wada, M. (1978): Changes of the thickness of epidermal tissue with ageing. Okajimas Fol Anat Jpn 54: 341-360 Wagner, J.E. und Manning, P.J. (1976): The Biology of the Guinea Pig. Academic Press, New York. Wegner, R.E., Begall, S. und Burda, H. (2006): Light perception in "blind" subterranean Zambian mole-rats. Anim Behav 72: 1021-1024 Weir, B.J. (1974a): Reproductive characteristics of hystricomorph rodents. Symposium of the Zoological Society of London 34: 265-301 122 Weir, B.J. (1974b): Notes on the origin of the domestic guinea-pig. Symposium of the Zoological Society of London 34: 437-446 Weirich, E.G., Rufli, T. und Longauer, J.K. (1976): Formationsmuster des Hautepithels bei Mensch und Meerschweinchen. Dermatologica (Basel) 152(5): 263-269 Westendorf, P. (1974): Der Haarwechsel der Haussäugetiere, Dissertation. Anatomisches Institut der Tierärztlichen Hochschule Hannover. Weyrauch, K.D. und Smollich, A. (1998): Histologie-Kurs für Veterinärmediziner. Verlag Enke, Stuttgart. Wilson, D.E. und Reeder, D.M.e. (2005): Mammal Species of the World: A Taxonomic and Geographic Reference, 3. Auflage. Johns Hopkins University Press, Baltimore. Wilson, K.J. und Kilgore, D.L., Jr. (1978): The effects of location and design on the diffusion of respiratory gases in mammal burrows. J Theor Biol 71(1): 73-101 Wing, E.S. (1977): Animal domestication in the Andes. In: Reed, C.A. (Hrsg.): Origin of Agriculture. Mouton Publishers, The Hague, Paris. S. 837-859 123 11. Anhang Tab.1: Dicke der vitalen Epidermis in µm, n=5 pro Geschlecht (Mittelwerte, Standardabweichungen in Klammern). Region 1 Region 2 Region 3 Region 4 Region 5 Region 6 C. a. porcellus ♀ C. a. porcellus ♂ F. anselli ♀ F. anselli ♂ 24,71 (±3,47) 21,25 (±2,60) 22,12 (±1,63) 20,35 (±1,33) 20,43 (±4,08) 21,56 (±0,81) 10,79 (±2,32) 10,53 (±1,71) 9,18 (±0,94) 8,30 (±0,92) 8,05 (±1,27) 9,82 (±1,10) 22,36 (±4,48) 24,41 (±2,78) 24,98 (±3,74) 22,46 (±1,56) 19,95 (±4,31) 20,81 (±2,80) Tab. 2: Dicke der Dermis in Standardabweichungen in Klammern). Region 1 Region 2 Region 3 Region 4 Region 5 Region 6 7,81 (±1,10) 6,38 (±0,67) 7,33 (±1,21) 7,00 (±1,00) 7,23 (±1,55) 7,83 (±1,57) µm, n=5 pro Geschlecht (Mittelwerte, C. a. porcellus ♀ C. a. porcellus ♂ F. anselli ♀ F. anselli ♂ 1814,21 (±252,90) 1477,46 (±176,27) 1621,56 (±221,55) 1375,07 (±73,32) 791,17 (±60,15) 651,48 (±102,60) 2253,07 (±302,72) 1627,58 (±127,22) 1908,93 (±263,52) 1623,5 (±94,92) 958,77 (±142,98) 772,94 (±124,58) 333,76 (±43,83) 272,53 (±68,75) 356,51 (±41,70) 269,43 (±67,45) 280,4 (±64,51) 405,54 (±156,01) 407,71 (±150,76) 341,82 (±97,17) 367,4 (±120,20) 297 (±76,97) 268,02 (±92,47) 394,88 (±107,02) Tab. 3: Haarfollikel- bzw. Haardichte pro cm², n=5 pro Geschlecht (Mittelwerte, Standardabweichungen in Klammern). Region 1 Region 2 Region 3 Region 4 Region 5 Region 6 C. a. porcellus ♀ C. a. porcellus ♂ F. anselli ♀ F. anselli ♂ 3058 (±374,05) 2275,6 (±640,67) 2520 (±254,04) 2715,6 (±271,38) 3140 (±515,35) 3166,8 (±359,55) 3075,4 (±348,60) 2211 (±319,42) 2557,8 (±498,12) 2242,4 (±407,50) 2815,6 (±211,10) 2640 (±399,90) 17857,8 (±2762,72) 16800,2 (±4777,26) 17297,8 (±6052,64) 13306,8 (±3834,10) 12200 (±3273,00) 9902,2 (±4722,43) 10862,2 (±1626,16) 8346,8 (±2930,01) 7306,8 (±1558,75) 5102,2 (±1899,46) 6053 (±1417,44) 4204,4 (±1316,41) 124 Tab. 4: Kürzester Durchmesser der Haargruppen in µm, n=5 pro Geschlecht (Mittelwerte, Standardabweichungen in Klammern). Region 1 Region 2 Region 3 Region 4 Region 5 Region 6 C. a. porcellus ♀ C. a. porcellus ♂ F. anselli ♀ F. anselli ♂ 304,98 (±65,21) 278,18 (±40,51) 267,88 (±34,34) 234,53 (±26,98) 187,63 (±37,31) 162,18 (±24,21) 156,99 (±26,37) 160,25 (±24,30) 154,72 (±28,10) 131,16 (±23,36) 101,49 (±10,30) 121,61 (±24,47) 303 (±22,26) 310,49 (±46,93) 269,63 (±42,93) 290,45 (±38,61) 197,57 (±30,19) 185,34 (±22,83) 134,02 (±28,21) 130,02 (±21,46) 137,63 (±19,36) 131,54 (±25,05) 103,79 (±11,54) 116,38 (±30,47) Tab. 5: Längster Durchmesser der Haargruppen in µm, n=5 pro Geschlecht (Mittelwerte, Standardabweichungen in Klammern). Region 1 Region 2 Region 3 Region 4 Region 5 Region 6 C. a. porcellus ♀ C. a. porcellus ♂ F. anselli ♀ F. anselli ♂ 743,14 (±93,65) 645,42 (±67,38) 480,87 (±34,84) 727,52 (±52,48) 537,32 (±62,41) 429,79 (±50,22) 225,83 (±28,82) 227,66 (±30,26) 212,96 (±29,52) 202,66 (±32,06) 178,77 (±44,58) 205,96 (±33,70) 767,65 (±44,61) 644,55 (±62,12) 552,73 (±79,27) 823,45 (±74,20) 544,17 (±61,10) 477,58 (±114,86) 197,03 (±25,68) 177,44 (±34,09) 188,72 (±22,95) 205,28 (±34,14) 164,61 (±15,04) 188,2 (±42,96) Tab. 6: Fläche der Haargruppen in µm², n=5 pro Geschlecht (Mittelwerte, Standardabweichungen in Klammern). C. a. porcellus ♀ C. a. porcellus ♂ F. anselli ♀ Region 1 231262,40 (±70944,27) Region 2 186022,3 (±42317,43) Region 3 131678,19 (±22184,52) Region 4 173521,89 (±22838,92) Region 5 102144,11 (±23527,22) Region 6 71848,83 (±15371,29) 237620,11 (±25720,80) 202986,62 (±43130,76) 154201,22 (±45974,66) 239792,67 (±43662,87) 110704,82 (±23842,99) 93079,96 (±34242,76) 27216,778 (±9197,13) 24032,13 (±8854,36) 26729,46 (±6203,40) 27946,02 (±9423,87) 17304,73 (±3041,73) 23514,38 (±11691,23) F. anselli ♂ 36081,34 (±8922,19) 37589,96 (±9595,88) 34233,83 (±9886,30) 27053,13 (±6919,49) 18760,94 (±5811,65) 26430,98 (±8679,95) 125 Tab. 7: Anzahl der Haarfollikel pro Haargruppe, n=5 pro Geschlecht (Mittelwerte, Standardabweichungen in Klammern). Region 1 Region 2 Region 3 Region 4 Region 5 Region 6 C. a. porcellus ♀ C. a. porcellus ♂ F. anselli ♀ F. anselli ♂ 9,52 (±0,82) 7,42 (±0,75) 6,98 (±0,33) 9,84 (±0,45) 7,68 (±0,54) 6,32 (±0,73) 15,64 (±2,55) 12,38 (±2,30) 9,86 (±2,58) 10,46 (±2,52) 6,42 (±0,98) 5,84 (±0,32) 10,2 (±0,22) 7,66 (±0,40) 6,4 (±1,1) 9,1 (±1,18) 7,84 (±0,92) 6,08 (±1,03) 14,48 (±1,43) 13,18 (±2,39) 9,94 (±1,62) 9,8 (±2,91) 7,14 (±1,80) 6,1 (±1,70) 126 12. Danksagung Mein besonderer Dank gilt Herrn PD Dr. G. Hilken, Zentrales Tierlaboratorium des Universitätsklinikums Duisburg-Essen, für das Überlassen des Themas, die geduldige Betreuung der Arbeit und für die ständigen, wertvollen Hilfestellungen bei der Durchführung. Ein herzliches Dankeschön gilt Herrn Prof. Dr. H. Hackbarth, Tierschutzzentrum der TiHo Hannover, für seine Unterstützung und die Übernahme der wissenschaftlichen Betreuung der Dissertation. Weiterhin möchte ich mich bei den Mitarbeitern des Zentralen Tierlabors des Universitätsklinikums Duisburg-Essen bedanken. Im Speziellen Frau J. Driever, dass sie mich in allen Fragen rund um die praktische Durchführung zu jeder Zeit betreut hat, Herrn Dr. P. Dammann für die geduldige und kompetente Hilfe bei der Erstellung der Statistik, Frau Dr. N. Wisbrun für ihre Hilfsbereitsschaft bei der Einführung in einzelne Computerprogramme und Frau C. Krüger für das Überlassen der Fotos. Mein Dank gilt dem Fachbereich der Allgemeinen Zoologie der Universität Duisburg-Essen. Herrn Prof. Dr. H. Burda danke ich für die Überlassung der fixierten Fukomys anselli und zweier Graumullfotos, Frau Dr. S. Begall für die Hilfsbereitschaft bei Fragen zur Biologie der Ansells Kleingraumulle und Herrn Dr. M. Schmitt für die geduldige Einführung in das Analysis-Computerprogramm. Mein spezieller Dank gilt Herrn Prof. Dr. Militzer, Veterinärmedizinische Universität Wien, für gemeinsames Mikroskopieren und Beantwortung histologischer Fragestellungen. Weiterhin gilt mein herzlicher Dank den Mitarbeitern des Fachbereichs Anatomie der J. W. Goethe-Universität für die Unterstützung bei der Erstellung der Fotos. Vor allem möchte ich mich bei Frau PD Dr. G. Klauer für ihre stetige Unterstützung durch ihre kompetenten Ratschläge und gemeinsames Mikroskopieren bedanken. 127 Herrn Prof Dr. W. Meyer und seinen Mitarbeitern, Anatomisches Institut der TiHo Hannover, möchte ich für das hilfsbereite Beantworten meiner Fragen zu den histologischen Schnitten und Färbungen danken. Meiner lieben Freundin Daniela Steckler, Pretoria, SA, danke ich für die Korrektur meiner Summary. Ich möchte meiner lieben Freundin und Mitdoktorandin Mirijam Krebiehl für die gemeinsame Zeit während der Erstellung unserer Dissertationen danken und dafür, dass sie mir unermüdlich bei allen Fragen zur Seite gestanden hat. Mein inniger Dank gilt meiner Mutter, die mich unablässig unterstützt und an mich geglaubt hat und ohne die mein Studium nicht möglich gewesen wäre. Meinem lieben Mann Chris danke ich dafür, dass er mich immer wie selbstverständlich unterstützt und mir den Rücken frei gehalten hat und stets an die Fertigstellung der Arbeit geglaubt hat.