2. Abbildung der Nervennetze
Werbung

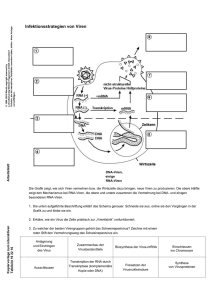
2. Abbildung der Nervennetze Abbildung der Nervennetze FOLIE 20-27 Gehirnforschung: Nervenbahn-Markierung mit Viren. Das Gehirn der Säugetiere ist eine ausserordentlich komplexe Struktur, deren Funktion wir nur dann verstehen können , wenn wir die Verbindungen zwischen den Neuronen kennen. Für diese Aufgabe sind die Herpes Viren (vor Allem das Pseudorabies Vírus) ausgesprochen gut geeignet, da diese die Nachbar-Neurone durch die Synapsen infezieren. Deshalb bekommen wir, wenn wir die mit dem Virus infezierten Zellen markieren, die miteinander in funktionalem (synaptischen) Kontakt stehenden Neurone (Neuronnetze). Die Anwesenheit der Viren können durch die Immun-Hystochemie gezeigt werden, wo die Antikörper die Oberflächen-Antigene des Virus erkennen;bzw. kann man auch in das Virus eingebaute Reporter Gene verwenden, welche mit homologer Rekombination eingetragen werden. Mit genetischer Modifizierung kann die Verbreitung des Herpes-Virus’, wenn man die Gene, die für die anterograde (mit dem Stimulus übereinstimmende) Richtung der Verbreitung zuständig sind ausser Gefecht setzt, in nur eine Richtung eingeschränkt werden; in diesem Fall wird sich der Virus nur in retrograder Richtung in dem Nervensystem verbreiten können. Dies ist deshalb notwendig, weil so die Ausbreitung des Virus’ der synaptischen Reihenfolge der Neurone entsprechend gemacht werden kann. Die Eintragung des Virus’ in die Zelle ist ein Rezeptor-vermittelter Prozess. Nach dem ankoppeln an den entsprechenden Rezeptor verschmilzt die Hülse des Herpes-Virus (eine vom Zellmembran abstammende Membran, mit doppelter Lipid-Schicht) mit dem Zytoplasma-Membran, in Folge dessen gerät das DNS beinhaltende Kapsid in das Zytoplasma, dann in den Zellkern, und die streng regulierte Expression der Gene beginnt. Der Virus bildet sogenannte Plaques auf der Zellen-Kultur. Ein Plaque besteht aus, von einem einzigem Virus-Teilchen infezierten Zellen. Unter natürlichen Umständen greift der Virus die periferen Zellen an, wo er sich dann vermehrt, dann in den primären Sensoneuron gerät, wo er sich wieder vermehrt, und die entstandenen Viren durch die Synapsen in die nächste Nervenzellen geraten. Das heisst, dass der Virus die miteinander in synaptischen Kontakt stehenden Neurone markiert, hierfür sind auf Folie 15–17 auch Beispiele zu sehen. Besonders auffällig werden die infizierten Zellen von den Membran-gekoppelten Fluoreszenz-Proteinen markiert (zB. Mem-GFP), welche einen genetisch kodierten, an Membran koppelndes Peptid am N-terminalem Ende des GFP beinhalten. Die feine Struktur des Gehirns kann erkundet werden indem unterschiedlich farbige Fluoreszenz-Gene enthaltende Viren in unterschiedliche Gehirn-Regionen injektiert werden. Untersuchung der Funktion von Nervennetzen FOLIE 28 Die traditionelle Untersuchung der Gehirnfunktion Um die Funktion des Gehirns zu verstehen, und um dessen Erkrankungen effektiv heilen zu können müssen wir den Mechanismus der Neurone kennen. Die Anomalien der Gehirnfunktion werden ursprünglich durch die EEG (Elektroenkephalogram) Technik untersucht.. Jedoch ist EEG eine Methode mit äusserst geringer Auflösungsfähigkeit, und nur zur Darstellung grober Anomalien anwendbar. Die moderne elektrophysiologischen Verfahren können auch die Funktion einer einzigen Zelle untersuchen. Diese Technik hat einen grossen Nachteil, nämlich, dass das Gehirn als System funktioniert, indem gleichzeitig unzählige Neurone aktiviert oder gehemmt werden. Verschiedene, durch Ca2+ oder Spannung induzierte fluoreszente Farben sind zur gleichzeitigen Untersuchung von vielen Zellen notwendig, allerdings werden diese Farben in jedem Neurontyp exprimiert, dadurch ist ihre Anwendung limitiert. FOLIEN 29, 30 Genetisch kodierte, fluoreszente Aktivitätsmarker Die genetisch kodierten (auf Protein basierende) fluoreszenten Aktivitätsmarker können wir - mit der Hilfe der entsprechenden Regelungselementen, oder durch Geneinfügung durch Viren – zellspezifisch exprimieren. Es gibt Ca2+-, Spannungs-, pH-Sensoren, usw.. Ca2+-, Sensore basieren auf der FRET (Fluorescent Energy Transfer) Technik. Das System besteht aus einem Chimera (Fusions) Protein, dessen Komponente: ein gelbes und dein blaues fluoereszens Protein, welche von einem Kalzium-koppelndem Peptid verbunden sind. Im Fall eines hohem Kalzium-Spiegels (aktive Zelle) geraten die beiden Fluoreszenz-Proteine nah aneinander, und deshalb übergibt das blaufarbige Protein bei anregung einen Teil seiner Energie an das gelbe Protein, welches dadurch anfängt zu leuchten. Das Verhältnis der blau/gelben Emission zeigt den Kalcium-Spiegel der Zelle, was ein wichtiger Indikator der Zellen-Aktivität ist. Die Spannungs-abhängigen fluoreszenten Sensore basieren auch auf FRET. In diesen Systemen werden an einen spannungsabhängigen Kaliumkanal genetisch blaue und gelbe FluoreszenzProteine gekoppelt, welche mit der Senkung der Spannung (EPSP, oder Aktionspotential), wegen der EXTRA ANFORDERUNG Frontlinien der Molekularbiologie Boldogkői Zsolt © 1 2. Abbildung der Nervennetze Veränderung der Raumstruktur des Ionkanals, nah aneinander geraten, und der FRET zustande kommt. Beide Arten der Aktivitätsmarker werden in transgenischen Tieren verwendet (Zellen-spezifische Promoter/Enhacer regulieren die Expression derer), und in auf Herpes Virus basierenden Systemen. Die virale Methode bietet die Möglichkeit die Kontakte und die Funktion der Neuron-Netze gleichzeitig zu untersuchen. FOLIE 31 Optogenetik – ferngesteuertes Verhalten Auf dem Gebiet der Erforschung des Verhaltens der Tiere kann eine solche Technik, die mit Anwendung eines Licht-Stimulus spezielle Neuron-Gruppen aktiviert, wichtig sein. Solch eine Technik kann im Fall des Menschen bei der Behandlung von unterschiedlichen neurologischen und psychiatrischen Erkrankungen eine Rolle spielen. Diese Technik basiert auf einem genetisch modifizierten, Licht-gesteuerten Ionkanal, dem Channelrhodopsin (ChR). Das ChR Gen wurde aus Chlamidomonas, einer grünen Algenart isoliert, wo die Funktion des Gens die Orientierung des einzelligen Lebewesens in die Richtung des Lichts (Fototaxis) ist. Der ChR besteht - ähnlich zu dem, im menschlichen Auge vorzufindenem Rhodopsin – aus einem Protein, dass aus 7 Transmembran Domainen besteht und aus Retinal. Aber, während das Rhodopsin ähnlich wie die anderen G-Protein gekoppelten Rezeptore auf indirektem Wege (durch die Aktivierung der Signalwege; metabotrope Rezeptore) die Öffnung der Ionenkanäle auslöst, ist das ChR selbst ein Ionenkanal. Die Molekularbiologen haben das ChR Protein modifiziert, indem sie mit genetischen Methoden ein Fluoreszenz-Protein (zB. RFP, rotes FP) an das C-terminale Ende des ChR Proteins fusioniert haben. Der Kanal ist mit blauem, das RFP mit grünem Licht aktivierbar. Das Fluoreszens Protein zeigt, ob das Fusions ChR auf das Licht reagiert. In transformanten Zellen oder den Zellen von transgenischen Tieren können wir mit Licht Nervenzellen aktivieren, und dann die Funktion der Zellen untersuchen. Diese Technik ermöglicht die Fernsteuerung des Verhaltens von unterschiedlichen Arten: Man kann die Entscheidungsmechanismen der Tiere durch Licht induzieren, zB. bei der Fruchtfliege Stress-Ausweichung, bei Zebrafischen den Fluchtreflex, bei der Maus den Entscheidungs-Mechanismus.Hauptsache ist, dass das in das Genom einzubauende ChR Gen mit Zellen-spezifischen regulierendenElementen versorgt wird, und so nur die gegebene Neuron-Population dieses Transgen ausdrücken wird.Zur Zeit wird die Parkinson-Krankheit recht erfolgreich durch die, auf Elektroden-basierende eingebauteDeep Brain Stimulation behandelt. Die Technik zeigt auch bei der Behandlung der Depression guteErgebnisse. Ein durch Licht stimulierbares genetisches (optogenetisches) System könnte das Einbauen vonElektroden in den Deep-Brain des Menschen vermeindbar machen. Dieses System kann dannfunktionieren, wenn die Neurone des betroffenen Teils des Gehirns das ChR ausdrücken. Dies kann durcheingebaute genetisch modifizierte Zellen erreicht werden. Die andere theoretische Möglichkeit ist der Hindernisse im Wege. EXTRA ANFORDERUNG Frontlinien der Molekularbiologie Boldogkői Zsolt © 2