Die Bedeutung der Herzfrequenz- variabilität für die kardiovaskuläre
Werbung

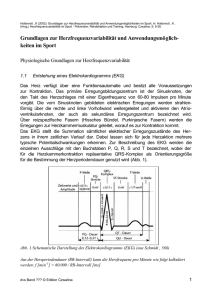
93. Jahrgang Die Naturheilkunde www.forum-medizin.de ISSN 1613-3943 Sonderdruck aus Ausgabe 05/2016 Die Bedeutung der Herzfrequenzvariabilität für die kardiovaskuläre Regulationsfähigkeit Dr. phil. habil. Olaf Hoos Helena Gabel Dr. med. Stephan Bortfeldt Forum Medizin Ein gesundes Herz schlägt variabel Die Bedeutung der Herzfrequenzvariabilität für die kardiovaskuläre Regulationsfähigkeit Dr. phil. habil. Olaf Hoos, Helena Gabel, Dr. med. Stephan Bortfeldt Kardiovaskuläre Erkrankungen sind weltweit Hauptursachen für die Mortalität in Industriestaaten und werden je nach Erkrankung mit unterschiedlichen Risikofaktoren in Verbindung gebracht. Eine autonome Dysbalance der sympathiko-vagalen Aktivität spielt in diesem Zusammenhang bei den meisten Erkrankungen eine nachweisbare Rolle und kann über die Analyse der Schwankungen der Herzfrequenz, der sogenannten Herzfrequenz­ variabilität (HRV), diagnostiziert werden. Die a ­ llgemeine und kardiovaskuläre Morbiditäts- und Mortalitätseinschätzung sowie die kardiovaskuläre Diagnostik in der präventiven und rehabilitativen Risikoprognose bei Gesunden und verschiedenen Erkrankungsbildern bilden deshalb zentrale klinische Anwendungsfelder der HRV-Analyse.1– 3 Nicht zuletzt ist in zahlreichen therapeutischen Bereichen die Wiederherstellung einer eingeschränkten HRV als Therapieziel zur Verbesserung der gesundheitlichen Prognose von Herz-Kreislauf-Patienten angezeigt, sodass die HRV-Analyse als wesentliches Evaluationstool in der pharmakologischen, funktionell-behavioralen und psychotherapeutischen Therapiekontrolle eingesetzt wird. Sichtbarmachen der vegetativen Regulationsfähigkeit Methodischer Zugang und HRV-Kenngrößen Die in der HRV sichtbar werdenden Schwankungen der Herzfrequenz bilden eine valide und gleichsam einfache Möglichkeit der vegetativen Diagnostik für klinische und praxisnahe Settings. Die HRV-Analyse beruht dabei auf einer mathematischen Analyse der Schlag-zu-Schlag-Veränderungen normaler Herzschläge bzw. genauer: der RR-Abstände im EKG (die R-Zacke entspricht dem maximalen positiven Ausschlag eines Herzschlags) über einen definierten Zeitraum. Denn die Unregelmäßigkeiten der Herzfrequenz kennzeichnen die Wechsel in der vegetativen kardialen Modulation, die den Eigenrhythmus des Sinusknotens im Vorhof des Herzens (etwa 100 S / min) permanent durch niederfrequente sympathische und hochfrequente parasympathische Impulse beeinflussen. Zur Erfassung und Quantifizierung der HRV sind neben dem Standard-EKG einfache mobile Messsysteme verfügbar, welche die R-Zacken-Abstände aufeinanderfolgender QRS-Komplexe (Kurve der Kammererregung aus negativer Q-Zacke, hoher R-Zacke und kleiner negativer S-Zacke) valide erfassen und daraus das RRTachogramm bzw. -Rhythmogramm (entspricht der zeitlichen oder herzschlagbezogenen Abfolge der RR-Intervalle) als Grundlage für die weitere Analyse ableiten können. Wichtig hierbei ist, dass zum einen die R-Zacken-Erfassung eine hohe Messgenauigkeit (mindestens 1 – 3 ms) besitzt, damit auch kleinere Schwankungen bei verschiedenen Patientengruppen und Anwendungssituationen valide erfasst werden können. Zum anderen gilt es, die RR-Intervalle bzw. deren Verteilungskurve sorgfältig auf mögliche Störgrößen (Artefakte) zu begutachten und zu korrigieren, um Fehlinterpretationen zu vermeiden. Neben zahlreichen weiteren Regelkreisen 4 liefern vor allem die Baroreflexaktivität (Veränderung der Herzfrequenz in Abhängigkeit vom Blutdruck) sowie die atemsynchrone Schwankung der Herzfrequenz, die sogenannte Respiratorische Sinusarrhythmie (RSA), die wesentlichen physiologischen Hintergründe der HRV und treten bei allen Menschen in Erscheinung. Die Barorezeptorenaktivität reguliert fortlaufend über einen negativen Feedback-Mechanismus im Hirnstamm den mittleren arteriellen Blutdruck, mit der Herzfrequenz als einer Stellgröße. Dabei wird über Aktivierung oder Inhibierung der medullären Vaguskerne eine schnelle, vagal übertragene Herzfrequenzänderung erreicht. Die RSA hingegen beschreibt die Herzfrequenzsteigerung bei Inspiration und Herzfrequenzsenkung bei Exspiration, die durch medulläre und hämodynamische Faktoren, aber auch eine mechanische Einflussnahme der Atembewegung über die efferente Vagusaktivität an das Herz vermittelt werden. Somit stellt die HRV letztlich die integrierte Endorganantwort des Herzens auf die komplexe, nicht-lineare Interaktion der sympathiko-vagalen Aktivität und anderer Faktoren dar und ist deshalb nicht nur von kardiovaskulärer, sondern auch von gesamtorganismischer Bedeutung.3 Bezogen auf die Messdauer können sowohl Kurzzeitmessungen von wenigen Minuten als auch Langzeitmessungen (meist 24 Stunden, mit Tag-Nacht-Vergleich) durchgeführt werden. Während Kurzzeitmessungen ein ideales Screening- und alltagstaugliches Therapiekontroll-Tool darstellen, das in verschiedensten Settings schnell und gut standardisiert eingesetzt werden kann, liefert die Langzeitanalyse ein globales Bild und bietet die Möglichkeit der Quantifizierung der Tages- und Nachtrhythmik bei allerdings starkem behavioralen Einfluss im Tagesverlauf. Bei geeigneter Standardisierung in Datenerfassung und -analyse sollten Kurzzeit- und Langzeitvariabilität für eine Risikobeurteilung ähnliche Ergebnisse liefern. Aus dem RR-Tacho- bzw. -Rhythmogramm der Kurzzeitanalyse werden in der Regel varianz- und mittelwertabhängige Zeit- und Frequenzparameter bestimmt. Zu den etablierten Indizes des Zeitbereichs im Kontext der Herzgesundheit zählen vor allem: • Standardabweichung aller RR-Intervalle (SDNN) als Ausdruck der Gesamtvariabilität • Mittelwert der Differenzen aufeinanderfolgender RR-Intervalle (RMSSD) als Marker für den Parasympathikus • Stressindex (SI) als Kenngröße der Häufigkeitsverteilung der RRIntervalle und Indikator der sympathischen Aktivität Die Kenngrößen des Frequenzbereichs umfassen unter ausreichend standardisierten Bedingungen unter anderem: • Gesamtvariabilität (TotP; vergleichbar zu SDNN) • HF: hochfrequent, parasympathische Sinusknotenmodulation (vergleichbar zu RMSSD) • LF: niederfrequent, gemischt sympathisch/parasympathische Modulation Grundsätzlich gilt bei Ruhemessungen, dass hohe Werte bei den Kenngrößen der Gesamtvariabilität und der parasympathischen Modulation (SDNN, TotP, RMSSD, HF) bei vergleichsweise niedrigen bis moderaten Werten der sympathischen bzw. gemischten Modulation (SI, LF) für eine gute Regulationsfähigkeit und günstige Herz-Kreislauf-Prognose sprechen.2,3 Als Orientierungsgrößen ­stehen für die meisten Parameter Normwertbezüge aus umfang­ reichen Meta-Analysen zur Verfügung.5,6 Letztlich sind die wesentlichen Zeit- und Frequenzparameter eng miteinander verbunden (insbesondere RMSSD und HF sowie TotP und SDNN), wobei für die tägliche Anwendung in der Praxis v. a. die Zeitbereichsparameter aufgrund ihrer einfacheren Berechnung, der höheren Robustheit gegenüber Artefakten (z. B. Husten oder Extrasystolen) und ihrer besseren Reproduzierbarkeit zu empfehlen sind. In jüngster Zeit werden diese Standardparameter durch weitere häufig nicht-lineare Kenngrößen ergänzt,5 wobei der Kurzzeitindex alpha1 die etablierteste dieser Kenngrößen darstellt. Alpha1 beschreibt dabei den Zusammenhangs- oder Ähnlichkeitsgrad der HRV-Daten, gibt also an, wie eng die Werte der RR-Intervalle miteinander in Verbindung stehen und kennzeichnet die systemische Interaktion an der HRV beteiligter Regelkreise. In Ruhe sprechen vor allem niedrige Werte (< 0,75) für eine schlechte Prognose. KHK zählen. Nicht zuletzt lässt sich wie bereits skizziert eine HRVReduktion auch als Zeichen eines grundsätzlichen Verlustes der inhibitorischen Vagusaktivität deuten, der wiederum eine entscheidende Rolle für den grundsätzlichen Integritätserhalt des Organismus zuzuschreiben ist.2 Aus empirischer Sicht lässt sich der Zusammenhang von Gesamtmortalität und HRV für die allgemeine Bevölkerung anhand großer epidemiologischer Studien nachweisen,8 wobei für Menschen mittleren Alters eine Kurzzeit-HRV-Messung mit reduzierter Gesamtvariabilität des SDNN auf unter 20 ms eine Erhöhung des Gesamtmortalitätsrisikos auf mehr als das Doppelte bedeutet. Darüber hinaus ist die HRV insbesondere bei Patienten mit Myokardinfarkt und Patienten mit chronischer Herzinsuffizienz als entscheidende prognostische Kenngröße bedeutsam. Zahlreiche Befunde belegen für verschiedene Gruppen von Herzpatienten, dass Reduktionen der Gesamtvariabilität, der efferenten Vagusaktivität und der nicht-linearen Dynamik mit einer deutlichen Erhöhung der (kardiovaskulären) Mortalität einhergehen. Beispielhaft deutlich wird dieser Zusammenhang für Myokardinfarktpatienten, deren Mortalitätsrate bei deutlichen Reduktionen der HRV-Parameter im Zeit- und Frequenzbereich sowie in der nicht-linearen Dynamik eine wesentlich schlechtere Prognose ausdrücken. Den nicht-linearen Kenngrößen (insbesondere alpha1) scheint in diesem Kontext eine eigenständige, besonders starke prognostische Sensitivität und Wertigkeit für die Mortalitätsprädiktion zuzukommen. 9,10 Abbildung 1 zeigt in diesem Kontext die Kasuistik eines asymptomatischen KHK-Patienten mit seit Jahren optimal eingestelltem Blutdruck und normalen Cholesterinwerten. Die HRV-Diagnostik oben offenbart eine ungünstige autonome Regulation (tachykard HF erhöht), alpha1 erhöht, (SDNN / RMSSD dagegen sehr niedrig, SI extrem hoch) und veranlasste eine weitergehende kardiale Diagnostik. Dadurch konnte im Anschluss eine lebensbedrohliche Dreigefäßerkrankung mit Verschluss der rechten Hauptstammarterie erkannt und behandelt werden. Unten ist die verbesserte vegetative Funktionalität im Rehabilitationsverlauf nach koronarer Reperfusion verdeutlicht (HF und alpha1 normalisiert, höhere RMSSD- / SDNNWerte, niedrigerer SI-Wert). 971.92 [50-150] 104.41 [55-80] Reduzierte HRV, Herzgesundheit und Mortalität Als mögliche physiologische Hintergründe der Assoziation zwischen HRV und Herzgesundheit bzw. allgemeiner und / oder kardiovaskulärer Mortalität lassen sich verschiedene Mechanismen anführen. Ein wesentlicher Punkt liegt sicher in der engen Verbindung von reduzierter Vagusaktivität und / oder akzentuierter Sympathikusaktivität einerseits und der Genese und Ausprägung von malignen ventrikulären Arrhythmien andererseits, wobei eine Herabsetzung der Flimmerschwelle und der beta-Adrenorezeptorsensitivität als beteiligte Mechanismen gelten.8 Auch dürfte eine Reduktion des myokardialen Sauerstoffbedarfs durch eine erhöhte kardiovagale Aktivität einen Kausalzusammenhang mit der Herzgesundheit begründen.6 Im Kontext der Genese und Fortschreitung der koronaren Herzerkrankung (KHK) liegt eine indirekte physiologische Erklärung des inversen (= umgekehrten) Zusammenhangs mit der HRV in der chronischen niedergradigen Entzündung (silent inflammation).7 Denn eine reduzierte HRV ist wie beschrieben mit einer vegetativen Dysfunktion in Form eines höheren Sympathikotonus und reduzierten Vagotonus assoziiert. Hierdurch kommt es häufig zu einer vermehrten Synthese proinflammatorischer Zytokine, die zu den Schlüsselkomponenten in der Pathogenese der prä 1.74 [0.90-1.65] 16.02 [37-125] Hf alpha1 SDNN 5.54 [24-92] SI RMSSD post 223.67 [50-150] 75.87 [55-80] 1.14 [0.90-1.65] 26.02 [37-125] Hf alpha1 SDNN 13.43 [24-92] SI RMSSD Abb. 1: Beispiel eines asymptomatischen KHK-Patienten (68 Jahre); prä- und postkoronarer Reperfusion (per Stent/PCI, Bypass)* Therapiekontrolle und HRV-Diagnostik Die Stimulation des Parasympathikus bildet für alle Herz-Kreislauf-Patienten eine wesentliche Therapieaufgabe, die mithilfe der HRV-Messung gut überprüft werden kann. Neben der pharmakologischen Einflussnahme dienen für Herz-Kreislauf-Patienten regelmäßiges moderates Ausdauertraining,11,12 aber auch Akupunktur und die indirekte Modulation des Herzens über ein gezieltes Atemtraining als probate Mittel zur Steigerung der Vagusaktivität.13 Dieses Atemtraining, das als HRV-Biofeedbacktraining bezeichnet wird, kann bei verschiedenen kardiovaskulären Patientengruppen eine Verschiebung der autonomen Regulation zugunsten der parasympathischen Aktivität herbeiführen. Vor allem für KHK-Patienten bildet das HRV-Biofeedbacktraining eine Art Trainingsform autonomer Reflexe, insbesondere des Baroreflexes. Ein erfolgreicher therapeutischer Effekt äußert sich hierbei in Form hoher Amplitudenschwankungen der RR-Zeitreihe und einem drastischen Anstieg der parasympathischen Zeitparameter (insb. RMSSD, vgl. Abb. 2). Zugehörige Biofeedback-Übungen, bei denen die Veränderung der Herzfrequenz unmittelbar für den Patienten sichtbar gemacht werden, zielen dabei vornehmlich auf eine ruhige, tiefe Atmung mit etwa 6 Atemzügen/min ab, die eine Frequenzsynchronisation der RSA mit dem arteriellen Baroreflex bewirken. Dies ergibt sich deshalb, weil die Eigenfrequenz der Blutdruckschwankungen bei 0,1 Hz (also alle 10 Sekunden) liegt. Wird die Atmung nun auf diese Eigenfrequenz synchronisiert, resultiert im Sinne eines Resonanzphänomens eine erhöhte Baroreflexsensitivität (also eine verbesserte Blutdruckregulation) und Zunahme der Vagusaktivität, was auch langfristig zu ­einer günstigeren Prognose für Herzpatienten führt.14 Fazit: Die HRV-Analyse als fester Bestandteil der kardio-vegetativen Diagnostik Die HRV-Analyse als Methode des vegetativen Screenings dient als etabliertes und validiertes, nicht-invasives diagnostisches Ver­fahren zur Stress- und Risikobewertung bei Gesunden und Herz-KreislaufErkrankungen und zur diagnostischen Begleitung im Therapieverlauf. Die vegetative Adaptationsfähigkeit ist eng verbunden mit der Entstehung und Progression diverser kardiovaskulärer und psychosomatischer Erkrankungsbilder. Die Messung der HRV in Ruhe sowie bei kontrollierter Atmung liefert eine zuverlässige Diagnostik zur kardiovaskulären Prognoseabschätzung. Die Stimulation des Parasympathikus stellt insbesondere für kardiovaskuläre ­Patienten eine wesentliche Therapieaufgabe dar, die sich mithilfe der HRVMessung gut kontrollieren lässt. Neben regelmäßiger ­körperlicher Aktivität eignet sich v. a. ein HRV-Biofeedbacktraining mit gezielter und kontrollierter Atmung als vielversprechende Intervention, die maßgeblich zur Prognoseverbesserung beitragen kann. Autoren: Privatdozent Dr. phil. habil. Olaf Hoos, wiss. Leiter Sportzentrum Helena Gabel, studentische Mitarbeiterin Julius-Maximilians-Universität Würzburg Fakultät für Humanwissenschaften Am Hubland / Sportzentrum 97074 Würzburg Tel.: 0931-31-80285 E-Mail: [email protected] Dr. med. Stephan Bortfeldt, Facharzt für Allgemeinmedizin, wissenschaftlicher Mitarbeiter der MH Hannover Hildesheimer Straße 356 30880 Laatzen Tel.: 05102-90 99 11 E-Mail: [email protected] Anmerkungen / Literatur * Diagnostik erstellt mit der VNS-Analyse© App, www.vnsanalyse.de 1Kleiger RE, Stein PK, Bigger JT: Jr. Heart rate variability: measurement and clinical utility. Ann Noninvasive Electrocardiol 2005;10:88-101 2Thayer JF, Lane RD: The role of vagal function in the risk for cardiovascular disease and mortality. Biol Psychol 2007;74:224-42 3Thayer JF, Yamamoto SS, Brosschot JF: The relationship of autonomic imbalance, heart rate variability and cardiovascular disease risk factors. Int J Cardiol 2010;141:122-31 4Persson PB: Modulation of cardiovascular control mechanisms and their interaction. Physiol Rev 1996;76:193-244 5Nicolini P, Ciulla MM, De Asmundis C, Magrini F, Brugada P: The prognostic value of heart rate variability in the elderly, changing the perspective: from sympathovagal balance to chaos theory. Pacing Clin Electrophysiol 2012;35:622-38 6Lewis ME, Al-Khalidi AH, Bonser RS, et al.: Vagus nerve stimulation decreases left ventricular contractility in vivo in the human and pig heart. J Physiol 2001;534:547-52 7Gidron Y, Kupper N, Kwaijtaal M, Winter J, Denollet J: Vagus-brain communication in atherosclerosis-related inflammation: a neuroimmunomodulation perspective of CAD. Atherosclerosis 2007;195:e1-9 8Dekker JM, Schouten EG, Klootwijk P, Pool J, Swenne CA, Kromhout D: Heart rate variability from short electrocardiographic recordings predicts mortality from all causes in middle-aged and elderly men. The Zutphen Study. Am J Epidemiol 1997;145:899-908 9Stein PK, Domitrovich PP, Huikuri HV, Kleiger RE: Traditional and nonlinear heart rate variability are each independently associated with mortality after myocardial infarction. J Cardiovasc Electrophysiol 2005;16:13-20 10Huikuri HV, Perkiomaki JS, Maestri R, Pinna GD: Clinical impact of evaluation of cardiovascular control by novel methods of heart rate dynamics. Philos Transact A Math Phys Eng Sci 2009;367:1223-38 11Rosenwinkel ET, Bloomfield DM, Arwady MA, Goldsmith RL: Exercise and autonomic function in health and cardiovascular disease. Cardiol Clin 2001;19:369-87 12Routledge FS, Campbell TS, McFetridge-Durdle JA, Bacon SL: Improvements in heart rate variability with exercise therapy. Can J Cardiol 2010;26:303-12 13Nolan RP, Jong P, Barry-Bianchi SM, Tanaka TH, Floras JS: Effects of drug, biobehavioral and exercise therapies on heart rate variability in coronary artery disease: a systematic review. Eur J Cardiovasc Prev Rehabil 2008;15:386-96 Abb. 2: RR-Tachogramm einer 73-jährigen Patientin mit schlechter vegetativer Ausgangslage (links: tachykard, sehr niedriger SDNN/RMSSD) und Vagusstimulation durch HRV-Biofeedbacktraining mit ruhiger tiefer Taktatmung bei 6 Atemzügen pro Minute (rechts) 14Nolan RP, Kamath MV, Floras JS, et al.: Heart rate variability biofeedback as a behavioral neurocardiac intervention to enhance vagal heart rate control. Am Heart J 2005;149:1137







![J`ql`emko][`k]d - enjoy](http://s1.studylibde.com/store/data/010254871_1-d376672deee8a6fd64d9514ed8de8bd2-300x300.png)