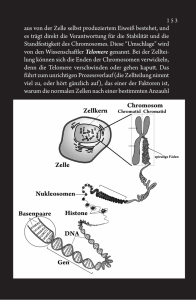
News Details - Biozentrum
Werbung

Contact New s News Details Communications Biozentrum, University of 16.09.2016 Basel Klingelbergstrasse 50/70 CH-4056 Basel / Switzerland Email: communicationsbiozentrum-at-unibas.ch Bakterieller Botenstoff schaltet Enzym in den «Rückwärtsgang» Bei der Vermehrung von Bakterien spielt das Signalmolekül c-diGMP eine entscheidende Rolle. Es schaltet ein Enzym, eine sogenannte Kinase, vom Vorwärts- in den Rückwärtsgang und kontrolliert so die Zellteilung. Das Team von Prof. Tilman Schirmer am Biozentrum der Universität Basel hat sich nun die Funktionsweise des Enzyms im Detail angeschaut. Die Ergebnisse sind im Fachblatt «Science Advances» veröffentlicht. Alle Zellen einschliesslich Bakterien durchlaufen den Zellzyklus. Dabei handelt es sich um eine streng kontrollierte Abfolge von Wachstumsphasen und Zellteilungen. In Bakterien wird der Zellzyklus von Enzymen, auch Kinasen genannt, gesteuert. Erst im vergangenen Jahr zeigten Forscher des Der Botenstoff c-di-GMP (Mitte) stabilisiert die offene Struktur der Histidinkinase und erlaubt so die Abspaltung des Phosphats eines Zielproteins. Biozentrums der Universität Basel im Bakterium Caulobacter crescentus, dass der Signalbotenstoff c-di-GMP die Aktivität einer solchen Kinase kontrolliert. In der nun veröffentlichten Folgestudie konnten die Teams um Prof. Tilman Schirmer und Prof. Urs Jenal nun aufklären, wie c-di-GMP die Enzymstruktur verändert und so zwei entgegengesetzte Aktivitäten steuert. Signalmolekül schaltet Enzym in «Rückwärtsgang» Der Zellzyklus ist ein ständiger Wechsel von Perioden mit und ohne Zellteilung. Nach einer Zellteilung gehen aus einer Mutterzelle je zwei gleiche Tochterzellen hervor. Jede diese Tochterzellen beginnt zunächst zu wachsen, verdoppelt dann ihre Erbinformation bevor sie sich schliesslich teilt und zwei neue Tochterzellen entstehen. In Bakterien bestimmt c-diGMP wann die Zelle in die Phase der DNA-Verdoppelung übertritt. Dabei schaltet das Signalmolekül eine sogenannte Histidinkinase vom Vorwärtsin den Rückwärtsgang und entscheidet damit letztlich, ob der Zellzyklus fortgesetzt wird. Normalerweise befindet sich die Histidinkinase im «Vorwärtsgang». In diesem Zustand überträgt sie Phosphatgruppen auf ihr nachgeschaltete Proteine und blockiert damit die Verdopplung des Erbguts und somit auch die Zellteilung. «Im Grundzustand liegt das Enzym in der geschlossenen Struktur vor. In Gegenwart von c-di-GMP wird jedoch eine offene Struktur stabilisiert», erklärt Badri Dubey, Erstautor der Studie. «Dies geschieht durch Verkupplung von zwei Bindungsstellen auf der Enzymoberfläche. In dieser offenen Form arbeitet die Histidinkinase nun quasi im ‹Rückwärtsgang›, das heisst, sie entfernt die Phosphatgruppen ihrer Zielproteine und hebt schliesslich die Blockade der Zellteilung auf. Mit Weitere Informationen Research group Tilman Schirmer Research group Urs Jenal unseren kristallographischen und biochemischen Analysen haben wir nun erstmals den molekularen Mechanismus entschlüsselt, wie c-di-GMP die beiden diametral entgegengesetzten Reaktionen eines bi-funktionalen Enzyms steuern kann», so Schirmer. Kontrollmechanismus etwa drei Milliarden Jahre alt Darüber hinaus konnten die Forscher mithilfe der Bioinformatik nachweisen, dass die c-di-GMP Bindungstaschen in einer grossen Gruppe von bakteriellen Histidinkinasen konserviert ist. So findet man solche cdi-GMP kontrollierten Histidinkinasen in den unterschiedlichsten Bakterienarten darunter auch urzeitliche Vertreter. Wie die Forscher anhand von Sequenzvergleichen herausfanden, muss dieser ausgeklügelte, feinjustierte Mechanismus bereits vor etwa drei Milliarden Jahren entstanden sein. Originalartikel: Badri N. Dubey, Christian Lori, Shogo Ozaki, Geoffrey Fucile, Ivan PlazaMenacho, Urs Jenal, Tilman Schirmer. Cyclic di-GMP mediates a histidine kinase/phosphatase switch by noncovalent domain cross-linking. Science Advances, published online 16 September 2016. Kontakt: Kommunikation, Katrin Bühler