Folien_Prot_DNS engl QX - Kantonsschule Kreuzlingen
Werbung
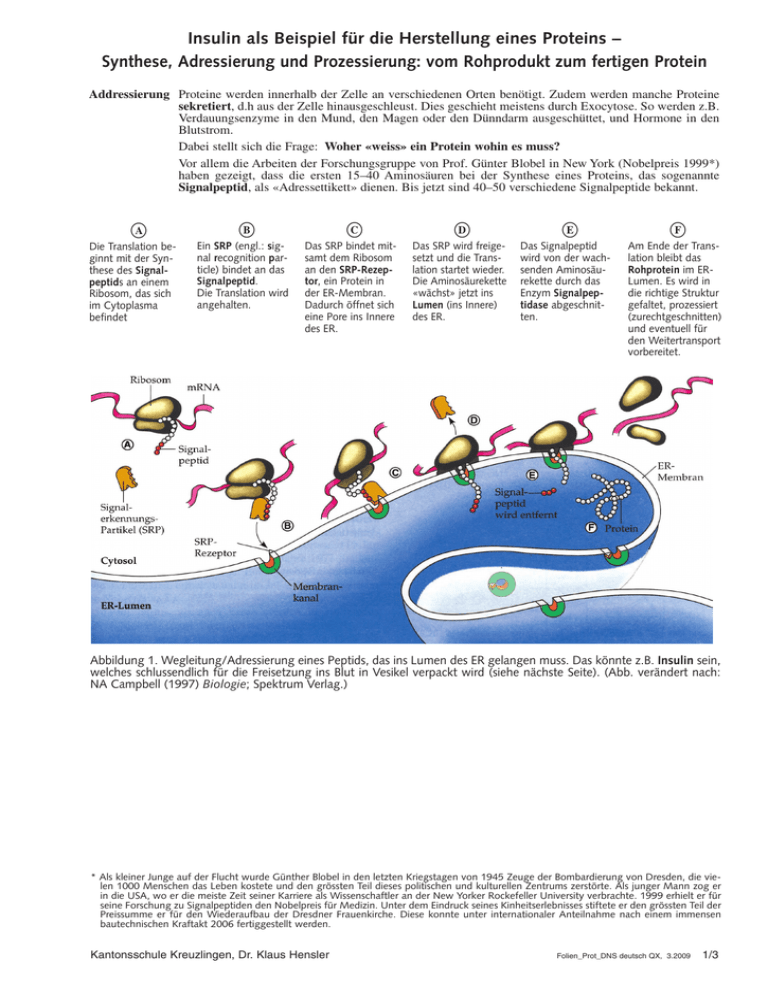
Insulin als Beispiel für die Herstellung eines Proteins – Synthese, Adressierung und Prozessierung: vom Rohprodukt zum fertigen Protein Addressierung Proteine werden innerhalb der Zelle an verschiedenen Orten benötigt. Zudem werden manche Proteine sekretiert, d.h aus der Zelle hinausgeschleust. Dies geschieht meistens durch Exocytose. So werden z.B. Verdauungsenzyme in den Mund, den Magen oder den Dünndarm ausgeschüttet, und Hormone in den Blutstrom. Dabei stellt sich die Frage: Woher «weiss» ein Protein wohin es muss? Vor allem die Arbeiten der Forschungsgruppe von Prof. Günter Blobel in New York (Nobelpreis 1999*) haben gezeigt, dass die ersten 15–40 Aminosäuren bei der Synthese eines Proteins, das sogenannte Signalpeptid, als «Adressettikett» dienen. Bis jetzt sind 40–50 verschiedene Signalpeptide bekannt. s A Die Translation beginnt mit der Synthese des Signalpeptids an einem Ribosom, das sich im Cytoplasma befindet s B Ein SRP (engl.: signal recognition particle) bindet an das Signalpeptid. Die Translation wird angehalten. s C Das SRP bindet mitsamt dem Ribosom an den SRP-Rezeptor, ein Protein in der ER-Membran. Dadurch öffnet sich eine Pore ins Innere des ER. s D Das SRP wird freigesetzt und die Translation startet wieder. Die Aminosäurekette «wächst» jetzt ins Lumen (ins Innere) des ER. s E Das Signalpeptid wird von der wachsenden Aminosäurekette durch das Enzym Signalpeptidase abgeschnitten. s F Am Ende der Translation bleibt das Rohprotein im ERLumen. Es wird in die richtige Struktur gefaltet, prozessiert (zurechtgeschnitten) und eventuell für den Weitertransport vorbereitet. Abbildung 1. Wegleitung/Adressierung eines Peptids, das ins Lumen des ER gelangen muss. Das könnte z.B. Insulin sein, welches schlussendlich für die Freisetzung ins Blut in Vesikel verpackt wird (siehe nächste Seite). (Abb. verändert nach: NA Campbell (1997) Biologie; Spektrum Verlag.) * Als kleiner Junge auf der Flucht wurde Günther Blobel in den letzten Kriegstagen von 1945 Zeuge der Bombardierung von Dresden, die vielen 1000 Menschen das Leben kostete und den grössten Teil dieses politischen und kulturellen Zentrums zerstörte. Als junger Mann zog er in die USA, wo er die meiste Zeit seiner Karriere als Wissenschaftler an der New Yorker Rockefeller University verbrachte. 1999 erhielt er für seine Forschung zu Signalpeptiden den Nobelpreis für Medizin. Unter dem Eindruck seines Kinheitserlebnisses stiftete er den grössten Teil der Preissumme er für den Wiederaufbau der Dresdner Frauenkirche. Diese konnte unter internationaler Anteilnahme nach einem immensen bautechnischen Kraftakt 2006 fertiggestellt werden. Kantonsschule Kreuzlingen, Dr. Klaus Hensler Folien_Prot_DNS deutsch QX, 3.2009 1/3 Synthese und Prozessierung von Insulin Die Translation stellt nicht direkt ein funktionelles Insulinmolekül her. Das Primärprodukt – Präpro-Insulin – besteht aus 104 Aminosäuren. Es wird auf verschiedene Art und Weise prozessiert, d.h. zurechtgeschnitten und in Form gebracht bevor es in Exocytose-Vesikel verpackt wird.. 1. Schon während der Synthese wird das Signalpeptid (die ersten 20 Aminosäuren) durch das Enyzm Signalpeptidase vom sich bildenden Präpro-Insulin abgeschnitten (siehe Vorderseite, Punkt E). 2. Mit Unterstützung spezifischer Proteine (Chaperone) wird das Pro-Insulin in seine charakteristische Tertiärstruktur gefaltet. Ein Teil des AS-Kette (in grau dargestellt, heisst auch C-Peptid, vergl Punkt 3) dient dabei als Gerüst bzw. Hilfsstruktur. Die Tertiärstruktur wird durch drei S–S-Brücken stabilisiert (Disulfidbrücken zwischen zwei schwefelhaltigen Cystein-Aminosäuren). 3. Vesikel mit Pro-Insulin werden vom rER abgeschnürt und fusionieren mit Dictyosomen (Teile des Golgi-Apparates). Dort wird das Pro-Insulin durch verschiedene Enzyme weiter prozessiert: Das C-Peptid wird entfernt (d.h. die 33, in grau dargestellten AS, die als Gerüst dienten). Das fertige Insulin besteht jetzt aus zwei Ketten mit insgesamt 51 Aminosäuren, die durch drei Disulfidbrücken verbunden sind.. β-Granula) schnüren sich von den Dictyosomen ab. Sie enthalten Insulin-Hexamere, die durch Zink4. Reife Vesikel (β Ionen stabilisiert werden. Das Insulin wird durch Exocytose ins Blut abgegeben, wenn die Glukosekonzentration im Blut einen kritischen Wert übersteigt. Übrigens: Viele Proteine/Peptide werden auf ähnliche Art und Weise prozessiert. Manche Proteine/Peptide werden zusätzlich chemisch verändert, indem sie z.B. mit Fettsäuren, Zucker(-ketten), Phosphatgruppen, Methylgruppen, Acetylgruppen Metallen oder etwas anderem verbunden werden. Abbildung 2. Prozessierung von Insulin, vom Primärprodukt der Translation zum funktionfähigen Hormon.. Kantonsschule Kreuzlingen, Dr. Klaus Hensler Folien_Prot_DNS deutsch QX, 3. 2009 3/3











