Ribosomale Translation Proteine
Werbung

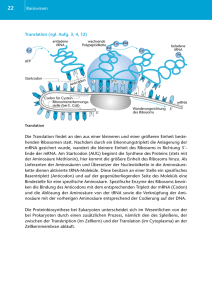
Ribosomale Translation Proteine 1 Fluss der genetischen Information 2 Der genetische Code • mRNA wird in „Wörtern“ á 3 „Buchstaben“ abgelesen. • der genetische Code ist degeneriert manche Aminosäuren werden durch mehr als ein Wort codiert. • der genetische Code wird (fast) unverändert in allen Organismen verwendet (Ausnahmen praktisch nur bei Mitochondrien). 3 Der genetische Code 4 Aus: Watson, Molekularbiologie, 6. Aufl., 2011 tRNA-Moleküle als Adapter Sekundärstruktur 5 Primärstruktur tRNA-Molekül als Adapter 6 Wobble-Basen Basenpaarung in der 3. Position des Codons ist nicht stringent! Trotz Degeneriertheit des genet. Codes muss es nicht für jedes Codon eine eigene tRNA-geben. In 1. und 2. Position des Codons ist die Basenpaarung absolut stringent! 7 Aktivierung des Aminosäure 8 tRNA-Editing 9 aa-tRNA-Synthetasen beladen die tRNAs! Wichtig: hohe Spezifität ansonsten: falsche Aminosäure im Protein! tRNA-Molekül als Adapter 10 Ribosomen 11 Ribosomen 12 Translationsinitiation (I) 13 Translationsinitiation (II) 14 Translationsinitiation (III) 15 Translationselongation (I) 16 Translationselongation (II) 17 Translationselongation (III) 18 Translationselongation (IV) 19 Schritte der Elongation 20 Fehlervermeidung 21 Termination der Translation (I) Stop-Codon in A-Stelle 22 Termination der Translation (II) Hydrolyse der Aminoacyl-Bindung. Freisetzung des Proteins 23 Termination der Translation (III) Ribosomenrecycling 24 Polyribosomen 25 Besonderheiten: Selenocystein Umprogrammierung eines Stop-Codons in ein Selenocystein-Codon. 26 Besonderheiten: Leserasterverschiebung mRNA von Retroviren hat frameshift-site Aus einer mRNA entstehen 2 verschiedene Proteine! 27 Kontrolle der Translation (I) Sequenzspezifischer Inhibitor 28 Kontrolle der Translation (II) „Thermosensor“ 29 Kontrolle der Translation (III) Riboswitch 30 Kontrolle der Translation (IV) 31 Reglung der Proteinmenge: Möglichkeiten 32 Aminosäuren 33 Stereoisomerie 34 Proteine = polymere Aminosäuren 35 Proteine = Backbone + Seitenketten 36 Proteinogene Aminosäuren 37 Faltung von Proteinen 38 Faltung von Proteinen 39 Denaturierung von Proteinen 40 Denaturierung auch durch: Hitze pH Salz etc. Funktioniert nicht mit allen Proteinen! Hitzedenaturierung meistens (!) irreversibel! Disulfidbindungen 41 Peptidbindung: Partieller Doppelbindungscharakter 42 Peptidbindung 43 Ramachandran-Plot 44 α-Helix 45 ß-Faltblatt 46 Faltblatt: Parallel und antiparallel 47 Tertiärstruktur 48 Tertiärstruktur 49 Quartärstruktur 50 Lambda-Repressor: α2 Quartärstruktur 51 Hämoglobin: α2β2 52 53 54 55 56