BIO-FLASH ® BIO-FLASH® Toxo IgG
Werbung

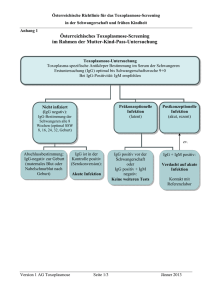
BIO-FLASH ® ® HERVORGEHOBENE ÄNDERUNGEN LESEN BIO-FLASH Toxo IgG 3000-8551 50 Tests BIO-FLASH Toxo IgG ist ein vollautomatisiertes, chemolumineszentes, zweistufiges Immunassay für die quantitative Bestimmung von IgG-Antikörpern gegen Toxoplasma gondii im humanen Serum und Plasma mit dem Instrument BIO-FLASH. Zusammenfassung Bei der Toxoplasmose handelt es sich um eine Infektionskrankheit, die sowohl Menschen als auch Tiere befällt und von dem Protozoon Toxoplasma gondii1 hervorgerufen wird. Die Toxoplasmose verläuft in der Regel symptomfrei und gutartig.2 Dennoch spielt diese Infektionskrankheit bei Schwangeren eine bedeutende Rolle, da der Parasit über die Plazenta in den Kreislauf des Fötus gelangen und eine konnatale Toxoplasmose hervorrufen kann. Zahlreiche Studien haben gezeigt, dass die Schwere und das Risiko der konnatalen Toxoplasmose höher sind, wenn die Infektion während der ersten drei Schwangerschaftsmonate stattfindet.3-6 Die Folgen der konnatalen Toxoplasmose reichen von spontanem Abort und Frühgeburt bis zu neurologischen und allgemeinen Symptomen, u.a. auch Augenprobleme. Neugeborene mit konnataler Toxoplasmose können auch während mehrerer Wochen nach der Geburt symptomfrei bleiben. In zahlreichen Studien wurde bewiesen, dass die Präsenz von mütterlichem IgG gegen Toxoplasma in bestimmter Konzentration vor der Schwangerschaft den Fötus vor der Infektion durch den Parasiten schützt. Serologische Untersuchungen können auch zur Identifikation von Risikoschwangerschaften dienen; Frauen, die zum Zeitpunkt der Diagnose seronegativ sind, können während der Schwangerschaft beobachtet werden. Die Analyse der Isotypen der spezifischen Antikörper gegen Toxoplasma gondii kann helfen, den Infektionszeitpunkt herauszufinden.7,8 So können eine frische Infektion erkannt, die notwendigen vorbeugenden Maßnahmen ergriffen und eine angemessene Behandlung eingeleitet werden. Das Erkennen von spezifischem IgM ermöglicht die Überwachung der Schwangeren, da Infektionen durch Toxoplasma in der Regel nicht durch klinische Anzeichen erkannt werden können. Serologische Kontrollen sollten ein frühzeitiges Entdecken einer Serokonversion und, abhängig von der Schwere der konnatalen Infektion des Fötus, ein sofortiges Ergreifen der notwendigen Maßnahmen ermöglichen. Die Toxoplasmose kann bei Patienten mit geschwächtem Immunsystem (AIDS, Organtransplantationen) tödlich verlaufen. Bei AIDS-Patienten tritt die akute Toxoplasmose gewöhnlich als Folge der Reaktivierung einer vorangegangenen latenten Infektion auf. Es wurden aber auch Primärinfektionen diagnostiziert.9 Prinzip Wenn die paramagnetischen Mikropartikel von BIO-FLASH Toxo IgG sich vermischen und mit der Probe inkubieren, verbinden sich diese mit den spezifischen Toxoplasma-Antigenen, die die paramagnetischen Mikropartikel umhüllen, sofern diese in der Probe enthalten sind. Nach magnetischer Trennung und einem Waschvorgang, um Reste der Probe zu beseitigen, wird ein Tracer zugegeben, der aus einem isoluminol-markierten Anti-Human-IgG-Antikörper besteht und sich an die Toxoplasma-IgG-Antikörper bindet, die von den Mikropartikeln eingefangen wurden. Nach einer zweiten Inkubation, magnetischer Trennung und einem weiteren Waschvorgang werden die Reagenzien zugegeben, die die chemolumineszente Reaktion auslösen. Das Luminometer von BIO-FLASH misst das abgegebene Licht als relative Lichteinheiten (RLU), die direkt proportional zur Konzentration des Anti-Toxoplasma-IgG der Probe sind. BIO-FLASH nutzt eine Methode zur Datenreduktion mit Anpassung an eine 4-Parameter-logistische Kurve (4PLC), um eine Masterkalibrationskurve zu erzeugen. Diese Kurve ist vordefiniert, hängt von der Charge ab und wird in dem Instrument durch den Strichcode der Kassette eingelesen. Mit der Messung der Kalibratoren (die in einem separaten Kit vertrieben werden) verwandelt sich die vordefinierte Masterkalibrationskurve in eine neue instrumentenspezifische Kalibrationskurve. Die Konzentrationen der Kalibratoren sind in den Strichcodes der Kalibratorenröhrchen enthalten. Reaktionsschema: Aktivatoren (Triggers) Activadores (Triggers) URL Magnetisches Partikel Probe Tracer RLU Lichtemission Emisión de luz BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-8551 R03 06.2015 ger 0843 BIO-FLASH ® Komponenten Reagenzkartusche Das Kit BIO-FLASH Toxo IgG enthält eine Reagenzkassette für 50 Auswertungen (REF 3000-8551). Hinweis: Das Design der Kassette ist patentgeschützt (US D565,741 / Design CE 000762992-0001) Aufbau der Reagenzkassette: Die Kassette besteht aus 4 Ampullen mit folgendem Inhalt: A. 1 zylindrische Ampulle mit einer Lösung mit Mikropartikeln, die mit dem Toxoplasma-Antigen bedeckt sind, in einem Phosphatpuffer. Enthält < 0,1% Natriumazid. B. 1 Ampulle Assay-Puffer. Natriumazid. C. 1 opake Ampulle mit Tracer, der aus Isoluminolmarkiertem monoklonalem Maus Anti-Human-IgG besteht. Enthält < 0,1% Natriumazid. D. 1 leere Ampulle. Enthält < 0,1% Vorbereitung Siehe Abbildung unten. Kassette: Die Mikropartikel sedimentieren während Transport und Lagerung, weshalb sie zur Verteilung erneut gemischt werden müssen. • Kippen Sie die Kassette vor dem ersten Gebrauch 30 Mal vorsichtig hin und her, ohne dass dabei Schaum entsteht (die Luftblasen können dazu führen, dass die Flüssigkeitssensoren des Instruments falsche Ergebnisse liefern). • Stellen Sie sicher, dass die Mikropartikel sich vollständig verteilt haben. Ist dies nicht der Fall, kippen Sie die Kassette weiter hin und her, bis sie sich vollständig verteilt haben. • Wenn die Mikropartikel nicht resuspendieren oder Sie feststellen, dass der Reagenzbehälter beschädigt ist, VERWENDEN SIE DIE KASSETTE NICHT. • Haben sich die Mikropartikel verteilt, dann stellen Sie die Kassette auf eine feste Oberfläche und entfernen Sie vorsichtig die rote Transportsicherung. • Lassen Sie die Kassette auf der festen Oberfläche stehen, drücken Sie die zwei Laschen, die sich seitlich an der Behälterkappe (graues Teil) befinden, zusammen und drücken Sie so lange auf den oberen Kassettenteil, bis er blockiert. Die Laschen sind nicht mehr sichtbar, wenn dies der Fall ist. Die geöffnete Kassette nicht umdrehen. • Lassen Sie die Kassette 5 Minuten stehen, bevor Sie sie in das Instrument einsetzen. • Wenn die Kassette eingesetzt ist, mischt das Instrument den Inhalt automatisch und in periodischen Intervallen. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-8551 R03 06.2015 ger 0843 BIO-FLASH ® Vorsichtsmaßnahmen Die Reagenzien BIO-FLASH sind für die IN VITRO-Diagnostik bestimmt. Für den ausschließlichen Gebrauch durch Fachpersonal. Das Natriumazid kann mit Rohren und Abflüssen aus Blei oder Kupfer reagieren und dadurch hochexplosive Metall-Azide bilden. Bei der Entsorgung von Resten der Reagenzien reichlich Wasser nachfließen lassen. WARNUNG: BIOGEFÄHRDUNG. Entsorgen Sie alle verwendeten Materialien in für biogefährliche Materialien geeigneten Behältern. Bitte kein Reagenz wiederverwenden oder wiederholt in die Kassetten oder Ampullen einfüllen. Gefahrenklasse Nicht eingestuft. Gefahrenhinweise Keine. Sicherheitshinweise P280: Schutzhandschuhe / Schutzkleidung / Augenschutz / Gesichtsschutz tragen. P305+351+338: BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang behutsam mit Wasser spülen. Vorhandene Kontaktlinsen nach Möglichkeit entfernen. Weiter spülen. Entnahme und Aufbewahren von Proben Verwenden Sie frisches Serum (es können auch Serumröhrchen mit Trenngel verwendet werden) oder Plasma (EDTA, Lithium-Heparin, Lithium-Heparin-Röhrchen mit Trenngel, Na-Heparin und Na-Citrat). Andere Antikoagulantia müssen vor Anwendung geprüft werden. Flüssige Antikoagulantia wie Na-Citrat haben eine verdünnende Wirkung und können die Konzentration der Patientenproben herabsetzen. Die Proben dürfen nicht durch Erhitzen inaktiviert worden sein. Die Partikel in der Suspension müssen durch Zentrifugieren beseitigt werden. In den Richtlinien CLSI H18-A3 und H21-A5 finden Sie weitere Informationen über die Handhabung, den Transport, das Verarbeiten und die Aufbewahrung der Proben. Serum Die Serumproben können 8 Tage lang bei 2-8°C gelagert werden. Werden sie länger gelagert, müssen sie bei -20°C oder darunter eingefroren werden. Die Proben können maximal 3 Mal eingefroren/aufgetaut werden. Nach dem Auftauen gut vermischen. Stellen Sie bei allen Proben sicher, dass sich keine Luftblasen darin befinden; sollte dies doch der Fall sein, entfernen Sie vor der Analyse alle Luftblasen. Plasma Plasmaproben können 8 Tage lang bei 2-8°C gelagert werden. Wenn sie länger gelagert werden, müssen sie bei -20°C oder darunter eingefroren werden. Das Plasma bei 37°C auftauen. Die Proben nur einmal auftauen. Nach dem Auftauen gut mischen. Stellen Sie bei allen Proben sicher, dass sich keine Luftblasen darin befinden; sollte dies doch der Fall sein, entfernen Sie vor der Analyse alle Luftblasen. Probenumfang Der Probenumfang, der notwendig ist, um einen einzelnen BIO-FLASH Toxo IgG Test durchführen zu können, variiert je nach Probenbehälter. Für eine Untersuchung sind mindestens 15 µL plus das tote Volumen, das bei 200 µL liegt, wenn die empfohlene Probenschale verwendet wird, notwendig (REF 3000-8209). Andere Materialien Die folgenden Materialien sind nicht in der Reagenzkassette enthalten und müssen separat erworben werden. REF 3000-8552 BIO-FLASH Toxo IgG Calibrators (Kalibratoren) REF 3000-8553 BIO-FLASH Toxo IgG Controls (Kontrollen) Für weitere Informationen, lesen Sie die jeweiligen Gebrauchsinformationen aufmerksam. Keine anderen Kalibratoren verwenden. Die Information, die das Instrument BIO-FLASH zur Kalibrierung des BIO-FLASH Toxo IgG-Assay benötigt, ist in den Strichcodes der Ampullen enthalten. Das Verwenden von Kontrollen anderer Hersteller kann zu unerwarteten Ergebnissen führen. Stellen Sie sicher, dass sich in dem Instrument BIO-FLASH ausreichende Mengen der folgenden Verbrauchsmaterialien befinden, bevor Proben, Kalibrierung oder Kontrollen durchgeführt werden: REF 3000-8206 BIO-FLASH Cuvettes (Küvetten) Hinweis: Das Design der Küvetten ist patentgeschützt (US D560,816 / Design CE 000762984-0001) REF 3000-8204 BIO-FLASH Triggers (Aktivatoren) REF 3000-8205 BIO-FLASH System Rinse (Systemlösung) REF 3000-8207 BIO-FLASH Sample Diluent (Verdünnungsmittel der Proben) BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-8551 R03 06.2015 ger 0843 BIO-FLASH ® Instrument / Testdurchführung Im Benutzerhandbuch von BIO-FLASH finden Sie die kompletten Anweisungen zur Durchführung eines Tests. Kalibrierung Der Strichcode der Kassette enthält eine für die Reagenziencharge gültige Masterkalibrationskurve. Dennoch wird für alle Reagenzien eine chargenspezifische Kalibrationskurve benötigt, die bis zum Verfallsdatum der Charge gilt. Eine neue Kalibrationskurve ist nötig, wenn die Kontrollergebnisse außerhalb des Akzeptanzbereiches liegen und wenn Anpassungen am Instrument vorgenommen wurden. Zur Konfigurierung einer Kalibrationskurve schlagen Sie im Benutzerhandbuch von BIO-FLASH nach. Qualitätskontrolle Zur Durchführung einer vollständigen Qualitätskontrolle werden drei Kontrollstufen empfohlen. Die Kontrollen BIO-FLASH Toxo IgG negativ, positiv und positiv hoch wurden für eine solche Qualitätskontrolle entwickelt. Es wird empfohlen, dass jedes Labor seinen eigenen Mittelwert, seine Standardabweichung und ein Qualitätskontrollprogramm zur Überwachung seiner Labortests festlegt. An jedem Anwendungstag sollen die Kontrollen mindestens alle 24 Stunden analysiert werden. Wenn die Kontrollen außerhalb des Bereichs liegen, kann eine Neukalibrierung notwendig sein. Weitere Informationen im Benutzerhandbuch des Instrumentes. Zur Identifizierung und Lösung von ungewöhnlichen Situationen bei der Qualitätskontrolle konsultieren Sie bitte Westgard et al.10 Aufbewahrung und Stabilität Die ungeöffneten Reagenzien bleiben bis zum auf dem Kassettenetikett angegebenen Haltbarkeitsdatum stabil, wenn sie bei 2-8°C und in vertikaler Lage aufbewahrt werden. Nach dem Öffnen bleibt die ins Instrument BIO-FLASH eingesetzte oder bei 2-8°C aufbewahrte Kassette 11 Wochen stabil. Wiederfindung von Kalibratoren und Kontrollen Die Werte sind in UI/mL angegeben und wurden durch zahlreiche Tests mit dem Instrument BIO-FLASH zugeordnet, bei denen spezielle Reagenzienchargen gemäß interner Standards, die dem internationalen WHO-Standard zu Anti-Toxoplasma-Serum-Ig (NIBSC Code: TOXM) entsprechen, verwendet wurden. Interpretation und Ergebnisse Die Menge des Analyts in jeder Probe wird durch die Lichtemission (RLU) mittels Interpolation in der eingelesenen Kalibrationskurve bestimmt. Die quantitative Bestimmung des Anti-Toxoplasma IgG mit dem BIO-FLASH Toxo IgG Test trägt zur Bestimmung des Immunzustandes des Patienten bei: • • • Proben mit einer Konzentration < 8,0 UI/mL werden als nicht reaktiv (negativ) betrachtet. Proben mit einer Konzentration ≥ 8,0 und < 10,0 UI/mL werden als unbestimmt (Grauzone) betrachtet. Proben, die als unbestimmt eingestuft werden, müssen erneut untersucht werden. Fällt das Ergebnis erneut unbestimmt aus, müssen sie als unbestimmt berichtet werden und eine andere Untersuchung mit Alternativmethode muss durchgeführt oder eine neue Probe entnommen werden. Proben mit einer Konzentration ≥ 10,0 UI/mL werden als reaktiv (positiv) bewertet. Bei Patienten, bei denen eine Serokonversion vermutet wird, muss zwischen 2 und 4 Wochen nach der ersten eine zweite Serumprobe entnommen werden und beide zusammen müssen auf Anti-Toxoplasma-IgG-Antikörper getestet werden. Ein bedeutender Anstieg in der Konzentration der Toxoplasma-IgG-Antikörper zwischen der ersten und der zweiten Serumprobe kann als Hinweis auf eine Serokonversion und Anzeichen einer frischen Infektion betrachtet werden. Bei Verdacht auf eine frische Infektion wird dringend empfohlen, die Probe auf Toxoplasma-IgM-Antikörper zu testen. Die IgM-Antikörper werden bei Patienten festgestellt, die erst vor kurzem infiziert wurden, die Antikörper können jedoch bis zu 18 Monate nach der Infektion persistieren.11 Ein negatives Ergebnis hinsichtlich Anti-Toxoplasma-IgGAntikörper schließt eine frische Infektion nicht aus. Da die Toxoplasma-IgG-Antikörper etwas später als die IgMAntikörper auftreten können, wird empfohlen, bei serologischen Untersuchungen von Schwangeren auch auf Toxoplasma-IgM-Antikörper zu testen. Der Test BIO-FLASH Toxo IgM REF 3000-8554 ist für diesen Zweck geeignet. Einschränkungen Das Ergebnis einer einzelnen Probe ist nicht ausreichend, um eine Primärinfektion durch Toxoplasmen zu diagnostizieren. Deshalb sollten neben den Ergebnissen des BIO-FLASH Toxo IgG andere Daten berücksichtigt werden, wie etwa klinische Anzeichen, Anamnese, Ergebnisse anderer Untersuchungen und weitere relevante Informationen. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-8551 R03 06.2015 ger 0843 BIO-FLASH ® Erwartete Ergebnisse Etwa ein Drittel der Weltbevölkerung hat Toxoplasmose-Antikörper, es bestehen jedoch große Unterschiede zwischen den jeweiligen Ländern sowie auch innerhalb derselben. In England und Wales steigt die Prävalenz der Toxoplasmose-Antikörper pro Lebensjahr um 0,5% - 1,0% und erreicht rund 30% bei den etwa 40-jährigen. In Frankreich dagegen fallen bei 80% - 90% der Bevölkerung in diesem Alter die Antikörper-Tests positiv aus.12 In einer multizentrischen Studie, die an über 16000 Serumproben von Schwangeren in Barcelona (Spanien) durchgeführt wurde, wiesen 28,6% Toxoplasmose-Antikörper auf. Bei 2,2% der Frauen mit Anti-ToxoplasmaAntikörpern wurden spezifische IgM-Antikörper festgestellt.13 In einer Studie, die zwischen 1992 und 1994 in Norwegen durchgeführt wurde und an der 35940 Schwangere teilnahmen, testeten 10,9% der Probanden vor Beginn der Schwangerschaft positiv auf Toxoplasma-Antikörper. 0,17% der Frauen, die zuvor nicht infiziert waren, wiesen während der Schwangerschaft eine Primärinfektion auf.14 Leistungsdaten HINWEIS: Die folgenden Daten sind repräsentativ; Ergebnisse von Einzelexperimenten können von diesen Daten abweichen. Methodenvergleich BIO-FLASH Toxo IgG wurde in Vergleichsstudien mit anderen handelsüblichen Tests bewertet. Interne Bewertung Es wurde mit BIO-FLASH Toxo IgG eine Anzahl von Proben unterschiedlicher Herkunft analysiert, wobei sowohl Serumproben verwendet wurden, die positiv als auch negativ hinsichtlich Toxoplasmose-IgG-Antikörper waren. Die Ergebnisse wurden mit denen einer handelsüblichen Toxo-EIA-IgG-Methode verglichen. Bei der Bewertung wurden unbestimmte Ergebnisse nicht mit einbezogen. Referenzmethode BIO-FLASH Toxo IgG UNB NEG POS Total UNB NEG POS Total 0 1 0 1 1 194 0 195 5 5 220 230 6 200 220 426 Es wurden folgende anfängliche Ergebnisse für relative Sensitivität und Spezifität sowie Gesamtübereinstimmung ermittelt: Relative Sensitivität Relative Spezifität Gesamtübereinstimmung N Wert 95% KI Wert 95% KI Wert 95% KI 419 97,8% 94,9% bis 99,3% 100,0% 98,1% bis100,0% 98,8% 97,2% bis 98,6% Die gleiche Probenauswahl wurde mit anderen handelsüblichen Toxo-IgG-Methoden getestet und die abweichenden Proben wurden ausgeschlossen. Unter den gesamten übereinstimmenden Ergebnissen, ausschließlich der 6 bei BIO-FLASH Toxo IgG unbestimmten Proben und der 4 Proben, bei denen keine Übereinstimmung erlangt werden konnte, sind folgende Ergebnisse erzielt worden: Übereinstimmung BIO-FLASH Toxo IgG NEG POS Total NEG POS Total 197 0 197 197 219 416 0 219 219 Hinsichtlich Sensitivität, Spezifität und Gesamtkongruenz gegenüber der Übereinstimmung wurden folgende Ergebnisse erzielt: N 416 Sensitivität vs. Übereinstimmung Wert 95% KI 100,0% 98,3% bis 100,0% Spezifität vs. Übereinstimmung Wert 95% KI 100,0% 98,1% bis100,0% Kongruenz vs. Übereinstimmung Wert 95% KI 100,0% 99,1% bis 100,0% BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-8551 R03 06.2015 ger 0843 BIO-FLASH ® Externe Bewertung Es wurde eine externe Bewertung im Servei de Microbiologia des Hospital de la Santa Creu i Sant Pau in Barcelona (Spanien) durchgeführt. Die Proben wurden mittels einer anderen auf dem Markt erhältlichen Methode, MEIA Toxo IgG, charakterisiert und mit BIO-FLASH Toxo IgG analysiert. Bei der Bewertung wurden die unbestimmten Ergebnisse nicht berücksichtigt. Referenzmethode BIO-FLASH Toxo IgG UNB NEG POS Total UNB NEG POS Total 1 1 0 2 1 350 0 351 2 1 301 304 4 352 301 657 Es wurden folgende anfängliche Ergebnisse für relative Sensitivität und Spezifität sowie Gesamtübereinstimmung ermittelt: N 652 Relative Sensitivität Wert 95% KI 99,7% 98,2% bis 100,0% Relative Spezifität Wert 95% KI 100,0% 99,0% bis 100,0% Gesamtübereinstimmung Wert 95% KI 99,8% 99,1% bis 100,0% Die abweichende Probe wurde mit einer handelsüblichen ELFA Toxo IgG-Methode analysiert und wurde als negativ zugunsten von BIO-FLASH Toxo IgG bewertet. Nach dem zusätzlichen Test wurden die folgenden endgültigen Ergebnisse hinsichtlich Sensitivität, Spezifität und Gesamtübereinstimmung ermittelt: N 652 Endgültige Sensitivität Wert 95% KI 100,0% 98,8% bis 100,0% Endgültige Spezifität Wert 95% KI 100,0% 99,0% bis 100,0% Endgültige Gesamtübereinstimmung Wert 95% KI 100,0% 99,4% bis 100,0% SeraCare-BBI Panel Es wurde das BBI „Anti-Toxo gemischte Titerpanel PTT201“ analysiert, das aus 25 charakterisierten Proben besteht. Die Ergebnisse des BIO-FLASH Toxo IgG Tests stimmen in allen Fällen mit dem Konsens der Mehrheit der Fabrikate überein. CDC Panel Das Panel humaner Seren, CDC Panel Toxoplasma 1998 Humanserum, das aus 70 positiven Serumproben und 30 negativen Serumproben besteht, wurde mit dem BIO-FLASH Toxo IgG Test geprüft und es wurden 100,0% Sensitivität und 100,0% Spezifität berichtet. Präzision In Übereinstimmung mit den Richtlinien CLSI EP05-A wurde die Präzision in den Tests und gesamt (Test zu Test und Tag zu Tag) in zahlreichen Untersuchungen geprüft. Die Ergebnisse sind in der folgenden Tabelle zusammengefasst: Negativkontrolle Positivkontrolle Positivkontrolle hoch Um den Cut-off-Wert Mittel (UI/mL) 2,8 50,4 279,4 9,1 CV% (im Test) 4,7 4,1 6,4 3,6 CV% (Gesamt) 6,3 5,7 10,5 5,3 Reproduzierbarkeit Es wurde die Reproduzierbarkeit unter Repliken, Auswahlen und Instrumenten bewertet. Die folgende Tabelle zeigt die Ergebnisse: Replikat 2 vs. Replikat 1 Charge 2 vs. Charge 1 Instrument 2 vs. Instrument 1 N 50 50 50 Wert 1,00 0,97 1,05 Gefälle 95% KI 0,98 bis 1,03 0,93 bis 1,02 1,03 bis 1,07 Schnittstelle Wert 95% KI -0,01 -0,47 bis 0,48 0,76 0,10 bis 1,89 0,09 -0,27 bis 0,64 BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN Wert 0,99 0,98 1,00 R 95% KI 0,99 bis 1,00 0,97 bis 0,99 1,00 bis 1,00 3000-8551 R03 06.2015 ger 0843 BIO-FLASH ® Interferenzen Studien in Übereinstimmung mit den Richtlinien CLSI EP7-A haben bewiesen, dass die folgenden potenziell störenden Substanzen die Ergebnisse des BIO-FLASH Toxo IgG nicht beeinflussen: Potenziell störende Substanz Hämoglobin Indirektes Bilirubin Direktes Bilirubin Triglyzeride Rheumafaktor Konzentration 500 mg/dL 18 mg/dL 18 mg/dL 1300 mg/dL 800 UI/mL % Interferenz ≤ 10 ≤ 10 ≤ 10 ≤ 10 ≤ 10 Kreuzreaktivität Bei der Analyse von 120 Proben, die eventuell eine Kreuzreaktion auslösen, mit dem BIO-FLASH Toxo IgG Test und dem Vergleich der Ergebnisse mit handelsüblichen Toxo-IgG-Tests, wurde die folgende Übereinstimmung festgestellt: Potenzielle Kreuzreaktion Übereinstimmung Anti-Röteln-IgG Anti-CMV IgG (Zytomegalievirus-Antikörper) Anti-HIV (Antikörper gegen Humanes-Immundefizienz-Virus) HAMA (Humane Anti-Maus-Antikörper) SLE (Systemischer Lupus erythematodes) ANA (Antinukleäre Antikörper) Anti-EBV (Epstein-Barr Virus-Antikörper) Anti-PV B19 (Parvovirus B19-Antikörper) Anti-HSV 1 (Herpes simplex Typ 1-Antikörper) Anti-VZV (Varizella Zoster-Antikörper) Paraproteine IgG und IgM IgG und IgM erhöht Heterophile Antikörper RF (Rheumafaktor) Schwangere (einschließlich multipare) 9/9 16/16 6/6 5/5 3/3 10/10 6/6 6/6 5/5 5/5 6/6 5/5 5/5 10/10 22/22 Nachweisgrenze In Übereinstimmung mit den Richtlinien CLSI EP17-A liegt die Nachweisgrenze (Lod=limit of detection) bei 0,9 UI/mL. Bestimmungsgrenze In Übereinstimmung mit den Richtlinien CLSI EP17-A liegt die Bestimmungsgrenze (Loq=limit of quantification) bei 0,9 UI/mL. Linearität In Übereinstimmung mit den Richtlinien CLSI EP6-A ist der BIO-FLASH Toxo IgG Test linear zwischen 0,9 und 500 UI/mL. Dennoch kann die Linearität mittels Verdünnung bis auf 7500 UI/mL ausgeweitet werden, wenn die Option eines automatischen Re-runs besteht. Um die Option automatischer Re-runs zu ermöglichen, siehe Benutzerhandbuch von BIO-FLASH. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-8551 R03 06.2015 ger 0843